ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(ヴィーリ:研究の最前線) |
乳酸菌によって生産されるエキソ多糖類: |
Graziano Caggianiello 1&Michiel Kleerebezem 2&Giuseppe Spano 1 |
|
抄録 |
広範囲の乳酸菌(LAB)は莢膜または細胞外多糖類を種々の化学組成と性質で生産することができる。LABによって産生された多糖類は、それらが分散しているマトリックスのレオロジー特性を変化させ、典型的には粘性のあるそしてロピー性の製品をもたらす。多糖類は、プレバイオシスおよびプロバイオシス、食品加工に伴うストレスへの耐性、および食品の技術的特性などのいくつかのメカニズムに関与しています。 本稿では、腸管上皮に付着するためのプロバイオティクス、それらの免疫調節活性、およびバイオフィルム形成におけるそれらの役割のような、プレバイオティック特性と胃腸管条件に対する細菌耐性、ESPの能力などのLAB-宿主相互作用メカニズムに対するエキソ多糖類の影響に特に注意してLABによって産生されるエキソ多糖類(EPS)の有益な性質を要約する。 これらの微生物バイオポリマーが食品の食感に好ましい影響を与えることが見出されたので、エキソ多糖類のプロ技術的側面について、食品産業におけるEPS、すなわちヨーグルトおよびグルテンフリーベーカリー製品の有利な用途に焦点を合わせて論じる。 最後に、ワインなどの発酵飲料で一般的に見られるストレス条件に対する耐性へのEPSの関与について説明します。 |
緒論 |
|
へキソ多糖類(EPS)という用語は、一般に、微生物細胞壁の外側に存在するあらゆる形態の多糖類に関連する。いくつかの乳酸菌(LAB)は、これは様々な化学部分で置換されていてもよい(Kleerebezem et al 1999)、糖または糖誘導体の(分岐)反復単位からなる、ホモまたはヘテロ多糖の長鎖を産生する(Ruas-Madiedo et al、2002年; Zannini et al、2016年)。 EPSは細菌細胞表面に弱くまたは強く結合することができ、そしてそれらは莢膜および分泌形態に区別される(Chapot-Chartier et al.2011)。 場合によっては、EPSが元の環境に粘性を付与して増加させます(図1)。
エキソ多糖類がLABの生態学において果たす生理学的役割は、まだ完全には理解されていない。EPSは、温度、光強度、pH、または浸透圧を含む生物的ストレスおよび/または非生物的ストレスなどの極端な条件から細菌細胞を保護すると考えられている(Donot et al. 2012年)。 EPSはまた、表面への接着およびバイオフィルム形成ならびに細胞接着/認識メカニズムにも関与し得る(Ruas-Madied et al. 2002年; Broadbent et al. 2003年; Rozen et al. 2004年)。 免疫刺激(Vinderolaet al. 2006年; Hidalgo-Cantabranaet al. 2012年; Matsuzakiら、2014年)および抗腫瘍効果(Kitazawaら、1998年;西村2014年)または血中コレステロールを低下させること(Nakajima et al。1992; Maeda et al.2004b; Ryan et al.2015)などのいくつかの健康上の利益は、微生物エキソ多糖に起因する。異なる多糖類の化学構造は、それらの潜在的なプレバイオティクス特性に影響を与えます。さらに、EPS化学構造は、細菌プロデューサー株に多様なプロバイオティック特性およびプロテクノロジー特性を付与することができる(Kleerebezem et al. 1999; van Kranenburg et al. 1999a; Tallon et al. 2003; Zannini et al. 2016) |
エキソ多糖類の生合成と化学的分類 |
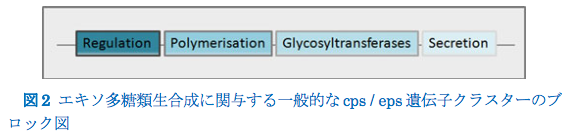
LABによるエキソ多糖の生産は、主に細菌の染色体上に、Streptococcus thermophilusまたはLactobacillus plantarumにおけるように位置する、epsまたはcpsとしてタグ付けされた特定の遺伝子クラスターと相関している(Stingele et al. 1996; De Vuyst and Degeest 1999; Siezenet al. 2010)、またはLactococcus lactisおよびPediococus damnsosusなどの種において主にプラスミド上にある(Van Kranenburg、1997、1999b)。 Remus et al(2012)は、L. plantarum WCFS1の染色体中に4つのcps遺伝子クラスターを同定し、それらは表面多糖生産に関連している。eps / cpsクラスターは、制御因子と、特徴的なEPS反復単位の組み立てに関与するグリコシルトランスフェラーゼを含む、EPS生合成、重合、および分泌に関与する酵素の両方をコードする遺伝子を含む(De Vuyst and Degeest 1999; Welman and Maddox 2003 ; Lebeer et al.2009; Kleerebezem et al。1999; Nierop Groot and Kleerebezem 2007)(図2)。
Wzx / Wzy依存性アセンブリ経路は、EPSを含むいくつかの表面ポリマーの生合成に関与している(Yother 2011)。糖単位の合成は細胞質内で起こる。 それらは、特異的グリコシルトランスフェラーゼによるヌクレオチド糖からの単糖転移を通して脂質担体分子ウンデカプレニルリン酸上に集合する。 続いて、Wzx(フリッパーゼ)が脂質結合反復単位を膜の細胞質面から外側面に移動させ、そこでWzyによって重合される(Islam and Lam. 2013)。L.lactis(Kleereberzem et al. 1999; Laws et al. 2001)、Streptococcus pneumoniae(Bentley etal. 2006)、およびLactobacillus ramnosus(Lebeer etal. 2009)について、いくつかのEPS構築モデルが提案されている。しかしながら、Blippase様経路に加えて、LABにおいて、ABCトランスポーターを含む別の経路が可能であり得るが、LABにおけるEPS産生のための輸出重合経路はまだ実証されていない。微生物エキソ多糖類は、ホモ多糖類(例えば、セルロース、デキストラン、ムタン、アルテルナン、プルラン、レバン、およびカードラン)およびヘテロ多糖類(例えば、ジェランおよびキサンタン)の2つのグループに分けられる(Welman and Maddox 2003; Zannini et al.2016)。 LAB中のホモ多糖類(HoPS)は、D-グルコースまたはD-フルクトースのような1種類の単糖類の繰り返し単位からなる。 それらは主にグルカンおよびフルクタンからなり、分子量は105〜106 Daの範囲である(Ruas-Madiedo et al。2002; Badel et al. 2011)。結合タイプおよび結合に関与する炭素の位置に応じて、HoPSはα-D-グルカン(デキストラン、ムタン、ロイテラン、およびアルテルナン)とβ-D-グルカンに分類できますが、フルクトースを含むものはフルクタンです( レバンとイヌリン型)(Ruas-Madiedo and de los Reyes-Gavilan 2005)。グルカンおよびフルクタンはホモ多糖類の中で最も頻繁に見いだされ、そしてそれらは両方とも食品産業における成分として適用されている(Anwarら、2008年; Zanniniら、2016年)。 逆に、ヘテロ多糖類(HePS)は、一般的にグルコース、ガラクトース、ラムノースからなり、場合によってはN-アセチル-D-グルコサミンとN-アセチル-D-ガラクトサミンからなる(Badel et al. 2011)。しかし、それらのポリマー構造中にリン酸または他の部分も含み得る(van Kranenburget al. 1999a; Kleerebezemet al. 1999)。 分子量は一般的に104〜106 Daである(Ryan et al. 2015)。 いくつかのLABによって産生されるエキソ多糖の収率および組成は、培養および発酵条件(すなわち、pH、温度、インキュベーション時間、および培地組成)によって大きく影響されるように思われる(Dueñaset al。2003; Torino et al. 2015; Zannini et al )。一方、いくつかの株では、さまざまな条件下でこれらのポリマーが比較的一定に生産されているように思われる(Boels et al. 2003)。現在までのところ、LABの中では、ヘテロ多糖類の収量はかなり変わりやすい(Tsuda 2013)。最大のEPS生産者の1つはL. ramnosus RW-9595M(2775 mg / L)(Macedoet al. 2002)およびLactobacillus kefiranofaciens WT-2B(2500 mg / L)(Maedaら2004a)である。 続いてL. lactis subsp cremoris(80〜600 mg / L)、S. thermophilus(50〜350 mg / L)、Lactobacillus delbrueckii subsp bulgaricus(60〜150 mg / L)、Lactobacillus casei(50〜60 mg / L) (Cerning 1995)およびL. plantarum(140 mg / L)(Tsuda and Miyamoto 2010)。図1 de Man、RogosaのLactobacillus plantarum EPS生産株のロピー表現型およびシャープ(MRS)プレート(a)およびMRSブロス(b、c)。ロピー表現型のないL.Plantanam EPS産生株のMRSブロス培養(d)。 |
エキソ多糖類のプレバイオティクス特性 |
プレバイオティクスの定義は長年にわたって変更されてきましたが、最近提案された定義は、“それは胃腸微生物叢の組成および/または活性に特異的な変化をもたらし、したがって宿主の健康に利益を与える選択的発酵成分です”(Gibson et al. 2010)。 LABによって産生されるエキソ多糖類は、それらがEPSを分解することができる酵素を持っているなら(Tsuda and Miyamoto 2010)。プロバイオティック菌株によって使用され得るので、プレバイオティック効果が観察されている(Dal Belloら、2001; O’Connorら、2005)。プロバイオティック細菌の増殖の増加は、腸内細菌科のような非プロバイオティクス細菌の成長が乏しいことによって裏付けられた(Das et al。2014)人工胃液による消化率が低く、in vitroでプレバイオティクス活性を示した。L plantarum株によって産生されたα-D-グルカンによって誘発された。 Lactobacilus sanfranciscensis由来のレバン型EPSのビフィズス形成効果もまた報告されている(Dal Bello et al. 2001)。Weissiella cibaria、Weissiella confusa、L. plantarum、およびPediococcus pentosaceusからのエキソ多糖類は、胃および腸の消化に対して高い耐性を示し、有益な腸内細菌、特にビフィズス菌の選択的増強を示し、それらのプレバイオティクスの可能性を示唆した(Hongpattarakere et al。2012)。「適切な量で投与されると宿主に健康上の利益を与える生菌」として定義されるプロバイオティック微生物の増殖(Hill et al。2014)は、Pediococcus parvulusによって産生されるβ-D-グルカンによって積極的に調節され得る(Hill Russo et al。2012)対照的に、P.parvulusから精製されたEPSはマウスモデルにおいてプレバイオティック効果を引き出すことができなかったが、微生物叢の恒常性を乱すことなく生EPS産生細菌拮抗腸内細菌科を摂取した(Lindstrom et al。2013)。 |
エキソ多糖類 - 宿主相互作用 |
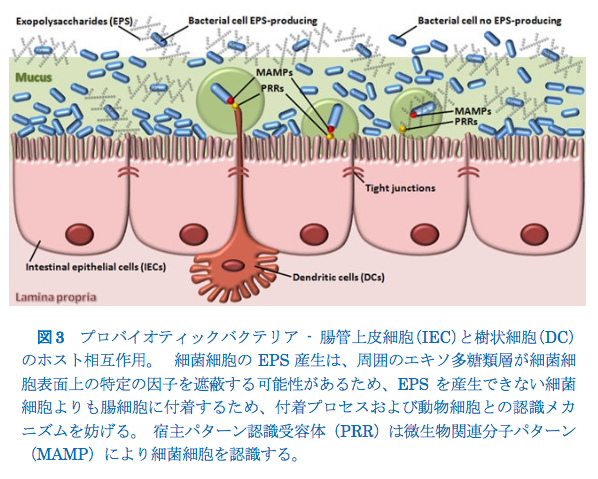
プロバイオティクス細菌の摂取は、人間の健康に有益であると提案されています。これらの細菌は、栄養素の消化、発生、および適切な粘膜免疫機能の維持に寄与することが示唆されています。さらに、いくつかの微生物は必須ビタミン(例えば、葉酸、ビオチン、ビタミンK)を提供し、結腸細胞によってエネルギー源として使用される短鎖脂肪酸を生産する(Gerritsenら、2011; Boveら、2013; Arenaら、2005。 2014))。 消化管ストレスに対する耐性、腸粘膜への付着、病原体を阻害する能力、および免疫系の調節は、プロバイオティクス細菌の選択のために採用されている基準のいくつかである(Dunne et al 1999)。 LABによって産生されるエキソ多糖類は、胃腸通過中のプロバイオティクス生存において重要であり得る。例えば、Stack et al(2010)は、P. parvulusによって産生されたβ-グルカンがLactobacillus paracaseiに消化管通過または技術的プロセス条件の間により高い生存を与えると報告した。さらに、微生物グルカンの添加は、乳酸桿菌の増殖、ストレス耐性、およびプロバイオティクスの可能性を高めることが証明されています(Russo et al.2012)。対照的に、P. parvulusおよびL. lactisでは、EPSの存在は、ヒトの消化管における細菌細胞の生存に利点を与えなかった(Fernandez de Palencia et al. 2009;Looijesteijn et al. 2001)。観察された違いは、LABによって産生されたEPSの多様な構造および組成、ならびに異なるEPSを使用するための株特異性能力に起因し得る。 LAB-EPSはまた、バイオフィルム形成および異なる環境のコロニー形成を可能にする表面接着において重要な役割を果たす(Dertli et al. 2015;Zannini et al. 2016)。Ruas-Madiedo et al.(2006a)は、スカンジナビアの伝統的な発酵乳から単離されたエキソ多糖類がプロバイオティクス接着およびヒト腸粘液モデルに対する腸内病原菌バクテリア接着のそれらの干渉に及ぼす影響を評価した。これらの著者は、病原体の癒着に違いはなく、EPSの非存在下でより大きなプロバイオティック癒着を観察した(Ruas-Madiedo et al。2006a)。さらに、プロバイオティクス細菌由来のエキソ多糖類は、用量依存的に腸管粘液に付着するようです。 プロバイオティックゲノム上のcps / eps遺伝子クラスターの遍在性は、腸内微生物叢からのそのような株が腸内でこれらのポリマーを産生する可能性があり、胃腸管内で局所的に高いEPS濃度に達する可能性があることを示唆する(Ruas-Madiedo et al。2006b; Salazar et al。 2015)。EPS層は細菌細胞表面上の特定の接着因子を遮蔽し、そして/または粘膜表面の受容体への結合を静電的に妨害し、それにより動物細胞への安定した接着に必要な接着プロセスおよび認識メカニズムを妨げるかもしれない(Lebeer et al. 2009 ; Denou et al. 2008; Remus et al. 2012; Dertli et al. 2015)(図3)。
例えば、Lactobacillus johnsoniiのEPS合成に関与する遺伝子の変化は、その表面特性を変化させ、腸の細菌定着のためのすべての重要な要素であるバイオフィルム形成、細胞接着、および自己凝集に影響を与える(Dertli et al. 2015)。それ故、EPS除去は細菌付着を増強し、かくして細菌付着プロセスを促進する付着因子および/または他の細胞表面因子を露出させる可能性がある。さらに、EPSは競合的阻害メカニズムによって腸細胞への接着を妨害する可能性がある(Ruas-Madiedo et al. 2006b)。Nikolic et al.(2012)は、非ロピー誘導体微生物は、親株に関してin vitro接着を改善したと報告した。 対照的に、P。parvulusによって分泌されたβ-グルカンは、EPSを産生する細菌(Fernándezde Palencia et al。2009; Garai-Ibabe et al。2010)、ならびにワインのP. parvulusによって産生されたエキソ多糖の付着を増加させた(García-Ruiz et al. 2014)。この点に関して、EPSの矛盾する効果はそれらの特定の化学的性質に依存するかもしれない(Fernándezde Palencia et al。2009)。しかしながら、腸管上皮への細菌のインビボ接着における細胞外多糖の寄与はまだ検証されていない(Ruas-Madiedo et al。2008)。最近、ゼブラフィッシュの幼虫を用いて、EPS生産株であるL.プランタラムLp90を含む外因性LABのインビボコロニー形成および持続性が報告されている(Russo et al。2015)。この場合でさえも、インビトロからインビボモデルに移行する細菌付着に対するEPSの役割に関して対照的なデータが存在する。例えば、Chen and Chen(2013)は、L.kefiranofaciensによって生産されたEPSのために、無菌マウスの腸に恒久的にコロニーを形成できないことを報告しました。対照的に、Lebeer et al(2011)は、以前のin vitroモデル(Lebeer et al。2009)から観察されたものとは対照的に、ネズミモデルにおいてそのEPS-変異株に関してL.ラムノサスGGのより高い持続性を見出した。 腸管上皮細胞(IEC)または樹状細胞(DC)は、それらのパターン認識受容体(PRR)を介してヒトの胃腸内微生物叢と通信することができ、それらは微生物関連分子パターン(MAMP)を検出します(図3)。MAMPとPRRとの間の相互作用は、検出された微生物に対する分子応答(すなわち、サイトカイン、ケモカイン、および抗菌剤の免疫調節)を決定するシグナル伝達カスケードの誘導をもたらす(Lebeer et al. 2010)。グラム陽性菌細胞壁は、プロバイオティクスと宿主受容体との間の相互作用メカニズムにおいて基本的であるエキソ多糖類を含むいくつかの構造成分を含む(Kleerebezem and Vaughan 2009)。 最近、いくつかのEPSが免疫調節特性を示し、ヒトの健康に潜在的な影響を与えることが観察されている(Fernándezde Palenciaet al. 2009; Liuet al. 2011; Hidalgo-Cantabranaet al. 2012、2014; Notararigoet al. 2014)。Remus et al.(2012)は、表面多糖類L.plumtrum細胞エンベロープの遮蔽的役割を示唆している。 同様に、L. rhamnosus GGによって産生されるエキソ多糖類は、抗菌ペプチドLL-37などの腸の先天的因子に対する遮蔽効果によって保護することができる(Lebeer et al. 2011)。Chapot-Chartier et al.(2010)は、L.lactisの表面上の新規な細胞壁多糖ペリクルが、マウスマクロファージによる宿主食作用に対して細胞壁に対する保護的なバリアを提供することを報告した。 免疫応答を引き出すEPSの能力は、LAB種または株の間で異なり、そしてそのような違いは、産生されるEPSの構造/サイズに関連するのは難しい(Hidalgo-Cantabrana et al. 2012)。例えば、それらの組成中にリン酸塩を有することを特徴とする酸性HePSは、乳製品業界でスターターとして使用されるLABにおいて以前に報告されたように免疫応答を誘導することができる(Kitazawa et al. 1996;Hidalgo-Cantabrana et al. 2012)。 対照的に、高分子量(HMW)HePSは免疫応答の抑制因子として作用するように思われる(Hidalgo-Cantabrana et al. 2012)。実際、Lactobacillus casei Shirotaにおいて、HMW HePSは、IL-6を含むマクロファージによる様々なサイトカインの産生を誘導した(Yasuda et al. 2008)。しかしながら、HMW多糖類の合成に関与する遺伝子のノックアウト変異体は、野生型細菌よりも高い程度でTNFα、IL-12、IL-10、およびIL-6の産生を誘導することができた(Yasuda et al。 2008; Hidalgo-Cantabrana et al. 2012)したがって、L. casei Shirotaの細胞壁多糖類は、宿主の免疫応答を調節する(弱める)ことができる内部「スイッチャー」と見なすことができる。LABがバイオフィルムを形成する能力、およびこの能力とそれらのプロバイオティック特性との関係が最近報告されている。株特異的ではあるが、バイオフィルム培養は、プロバイオティクス細菌を特徴付けるいくつかの有益な特性と関連している。 例えば、バイオフィルムは胃腸環境関連条件に耐性があり、免疫調節特性と病原体の増殖を阻害する能力の両方を有する細胞外因子を産生する(Rieu et al. 2014年; Aoudiaet al. 2016)。矛盾する結果はあるが、微生物のエキソ多糖類がバイオフィルムを形成する能力に関する研究が行われてきた。 確かに、バイオフィルム形成に対する負の効果がL. rhamnosus GG(Lebeerら、2009年)によって産生されたガラクトースリッチ細胞壁関連EPSから観察されたが、Dols-Lafargueら(2008年)はβ-グルカン含有カプセルは次のように報告した。 P. parvulus とOenococcus oeniの菌株は、非生物的表面に対するそれらの接着能力を増強した。したがって、バイオフィルム形成におけるEPSの役割は、化学構造、相対量と電荷、非生物的表面の特性、および周囲の環境によって影響を受ける可能性があります(Van Houdt and Michiels 2010)。 |
食品産業におけるエキソ多糖類の応用 |
微生物のエキソポリサッカライドの産業用途は、Zannini et al(2016)によってスマートにレビューされている関心が高まっているトピックです。このコンテストでは、産業コンテストでEPSを生成するLABの可能性と重要な側面のみを要約します。LABによって生成されるEPSは、食品のレオロジー特性、テクスチャ、および口当たりを変更できます。 したがって、彼らは食品産業で増粘剤、安定剤、乳化剤、またはゲル化剤としての用途を見出すだろう(De Vuyst and Degeest 1999; Looijesteijn et al. 1999; Patel et al. 2012; Zannini et al. 2016)。発酵中にエキソポリサッカライドをその場で(in situ)生産するLABスターターカルチャーの利用可能性は、多糖類を添加することが食品添加物としての仕様を必要とする製品の適切な代替品となり得ます。さらに、LABは、食品生産での安全な使用の長い歴史のために、一般的に安全^(GRAS)として認識されており、それらの多くはQPS(適格な安全性の推定)ステータスを持っています(Lahtinen et al. 2011)。より安価な基質の使用、最適な発酵条件、および高収量のEPS変異株の開発に関するさらなる研究は、基本的に重要です。 実際、微生物のエキソポリサッカライドの商業的価値と比較して、LABによって生産される生産コストとEPSの量が少ないことは、工業用途の制限要因です(Nwodo et al。2012; Zannini et al. 2016)。現在、微生物のエキソポリサッカライドの最高の生産はキサントモナス・カンペストリスに起因し、これは30〜50 g / Lのキサンタンガム、食品添加物およびレオロジー調整剤として使用される細胞外ヘテロポリサッカライドを生産します。 LABによって生成されるEPSの収量ははるかに低いですが、製造部門での現場での適用は持続可能です(Tsuda 2013)興味深い工業用途で生産される広範な細菌EPSがありますが、キサンタンとジェランのみが米国およびヨーロッパの食品の添加物としての使用が許可されています(Donot et al. 2012)。この点で、数人の著者がヨーグルト、 L delbrueckii ssp bulgaricusとS. thermophilusのスターターカルチャーが比率1:1であるミルクの発酵産物のレオロジー特性および感覚特性に対するLABエキソ多糖類の影響を研究しました(Hassan et al。2003; Doleyres et al。2005; Folkenberg et al 2006; Yang et al。2014)、両方の細菌は、Sthermophilusでは30から890 mg / L、L delbrueckii ssp bulgaricusでは60から150 mg / Lの細胞外多糖を産生します(Bouzar et al。1997; Marshall and Rawson 1999)。エキソポリサッカライドはヨーグルトの粘度とテクスチャーの改善に寄与し、最終製品の風味を変えないことがわかっています(Jolly et al。2002; Badel et al。2011)。 最近のレポートでは、乳酸菌からのEPSのin situ生産により、ヨーグルトのスターターカルチャーに影響を与えることなく、テクスチャーおよびレオロジー特性が改善されました(London et al. 2015)。 数十年以来、パンの発酵中にその場で生産される微生物のエキソポリサッカライドの影響に関するいくつかの研究が行われました。Arendt et al(2007)は、サワードウLABによって生産された細胞外多糖類が、より高価な植物性ハイドロコロイドに代わる有効で安価な代替品になる可能性があることを示唆しました。Weissella confusaによるデキストランの生産は、サワードウの粘度を大幅に増加させ、マイルドな酸性小麦パンに大きな塊とパンの柔らかさを与えました(Katina et al。2009)。W. cibariaとL. reuteriによって生産されたオリゴ糖は、生地のレオロジーとグルテンを含まないモロコシパンの品質におけるin situ EPS分泌の影響を評価するために使用されており、その結果、製パンの可能性が向上しています(Galle et al.2012 )。グルテンを含まないベーカリー製品の主な問題の1つは、従来の製品よりも満足のゆかないレオロジー特性に関連しているため、これは細菌EPSの有望な用途です。さらに、エキソポリサッカライドを生産するスターターカルチャーで発酵したサワードウを添加すると、グルテンフリーパンのプレバイオティクス量が増加する可能性があります(Schwab et al. 2008)。 |
Wine LABによるEPS生産:ロープ状および非ロープ状の表現型 |
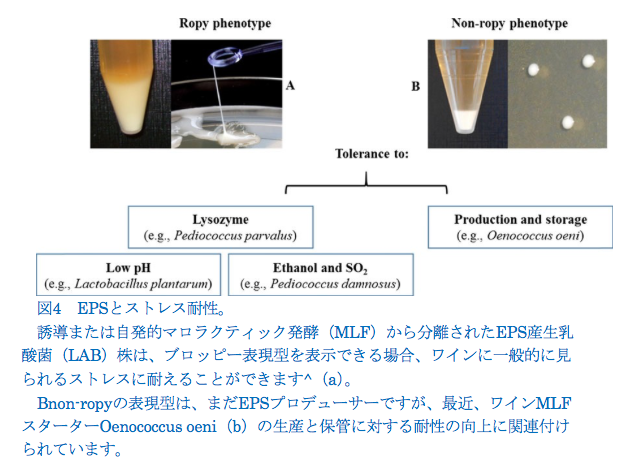
EPS産生LABは、産業用途にとって潜在的に重要な微生物ですが(Badel et al。2011; Zannini et al。2016)、ワインなどのアルコール飲料では、EPS産生LABがBropiness ^またはBoilinessとして知られる変化を引き起こすことがあります。粘り気のあるテクスチャーと油っぽい感触が特徴で、かなりの経済的損失の原因です(Gindreau et al. 2001)。ほとんどの場合、粘着性はゆっくりと発達し、瓶詰めから数週間または数か月後に明らかになりました。 ワインの外観は、P. parvulus(Dols-Lafargue and Lonvaud-Funel 2009)やPediococcus damnosus(Lonvaud-Funel 1999; Gindreau et al。2001)のような表現型を持つワインLABの存在が主な原因です。ワインLABにおけるropy表現型の生物学的役割は、おそらくワインで一般的に遭遇するストレスを許容または克服する能力に関連しています(Spano and Massa 2006)。たとえば、P. parvulusの一部の株は、エタノール、pH、SO2ストレスを含むワインの厳しい条件に対して強い抵抗性を示しました(Lonvaud-Funel and Joyeux 1988; Lonvaud- Funel 1999; Velasco et al。2006; Dols-Lafargue et 2008年; Coulon et al。2012)。Dols-Lafargue et al.(2008)は、機能的なgtf(グリコシルトランスフェラーゼ)遺伝子を含む野生または組換えの醸造細菌株が、アルコールだけでなくpH、SO2でもワインで発生するいくつかのストレスに対してより耐性があることを示しました。 対照的に、Walling et al. (2005)P. damnosusによって生成されたEPSはエタノールストレスにリンクされていないと報告しました。一部の国では、ネイティブのLAB人口を抑制し、マロラクティック発酵を遅らせるために、二酸化硫黄の添加に代わって、リゾチームのワイン製造プロセスでの使用が合法化されています(Lerm et al。2010)。興味深いことに、Coulon et al.(2012)は、細胞壁の周りのEPSの遮蔽効果によりリゾチームストレスに対する耐性を付与する、β-グルカンを合成できる、ローピーワインからP. parvulus株を発見しました。ワインの発酵プロセスを適切に管理することで、ワインの外観が非常にまれになる場合がありますが、非表現型のワインから分離された場合もあります。nonropyワインのワインLABによってEPSを合成する機能は一般的です。たとえば、O. oeniは、過酷なワイン条件に耐える最適なLABの1つであり、市販のマロラクティック発酵(MLF)スターターの準備に最も利用される種です(Capozzi et al。2010; Maitre et al. 2014; Betteridge et al. 2015)、誘発されたMLFの間だけでなく、自然発生時にもEPSをワインに放出できます(Dols-Lafargue et al. 2007; Dimopoulou et al. 2014)。EPSを生産できるいくつかのO. oeni株は、この製品を中期的に変更することなく、非ロープワインから分離されます(Ciezack et al. 2010)。O. oeniによって生成されるEPSは、使用する株と培地によって異なります。この変動は、おそらくO. oeniの一部の株と共存できる明確な生合成経路によるものです(Ciezack et al. 2010; Dimopoulou et al. 2016) 。いくつかのO. oeni株が多糖類カプセルを形成する自然な傾向は、生産および保存プロセス中の生存率の向上に関係しています(Dimopoulou et al. 2016)。 O. oeniに加えて、いくつかの研究は、ワインL. plantarum株がワインのMLFスターターとして適した優れた可能性と特性を保持していることを示しています(Berbegal et al. 2016)。この特徴は、食物ストレスを克服するL. plantarumの能力にも関連しています(Fiocco et al. 2007; Fiocco et al. 2009; Capozzi et al. 2011)。L. plantarum株は、自発的なMLF中に、非表現型のワインで最近同定されました。 予備的な結果は、Bnon-ropy ^株と比較して、L。plantarumのropy表現型は低pH耐性に関連していることを示唆しています。 観察されたストレス耐性の原因となるメカニズムを明らかにするためにさらに作業が必要ですが、膜および/または枝分かれしたEPSによって作られた外部バリアは、EPSを生成できるワインLABまたはリゾチーム、SO2、および/またはエタノールストレスによって細胞壁を物理的に保護する可能性があります 球状の表現型(図4)。
|
結論 EPSを生成するLABまたはLABからのEPSの産業用途は、食品発酵からプレバイオティクス/プロバイオティクスへの応用に及びます。たとえば、Bin situ発酵プロセスでEPSを生成するLABを使用すると、発酵食品のレオロジー特性と感覚特性が改善される場合があります。 この側面は、微生物由来のEPSが現在の植物起源のハイドロコロイドの代わりに使用できるため、食品産業にとって特に有利です。ただし、LABによって生成されるEPSの量が少ないこと、および食品での使用に関連する望ましい特性を備えた高収量を生成する菌株を特定することは、このようなアプリケーションの重要なステップと考えられます(Zannini et al。2016)。 プレバイオティクスおよび/またはプロバイオティクス特性は、LAB EPSまたはLAB産生EPSに起因することが多い。 一部のEPSはコレステロール値を低下させ、腸内微生物叢の発酵性(プレバイオティクス)基質として作用し、免疫応答を調節すると言われています。 しかし、プロバイオティクスの成長または腸上皮細胞の刺激に対する微生物EPSの影響、およびヒト消化管通過に対する耐性に関する対照的な知見が報告されています。 したがって、EPSの物理化学的特性は、生物学的および機能的特性を決定する重要なパラメーターでなければなりません。 異なるEPSを使用する系統依存の能力は、記載されている違いの原因となる場合もあります。 最後に、LABによって生成されたEPSは、LABによって開発されたストレス応答機構の追加部分と見なすことができます。この機能は、微生物のスターターの堅牢性を向上させるのに役立つ場合があります。これは、LABが腐った表現型を表示することが、発酵した飲料の腐敗に関連付けられることを考慮したものです。 |
|
この文献は、Appl Microbiol Biotechnol (2016) 100:3877–3886に掲載されたExopolysaccharides produced by lactic acid bacteria: from health-promoting benefits to stress tolerance mechanismsを日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |