ケフィアライフをお勧めする中垣技術士事務所

HOME>自社研究>スカンジナビアの発酵乳ヴィーリからの細胞外多糖は、 マウスの腸内の酪酸とMuribaculumのメンバーを増加させます
| 論文発表(アロニア果汁)ぶ |
アロニアジュースは5XFADマウスの作業記憶を改善し、 δ-セクレターゼ活性を抑制する |
Takuya Yamane , Momoko Imai, Satoshi Handa, Hideo Ihara, Tatsuji Sakamoto, Tetsuo Ishida, Takenori Nakagaki, Susumu Uchiyama |
要約 |
アスパラギン エンドペプチダーゼ (AEP) は、アミロイド前駆体タンパク質を切断して、脳内でのアミロイド β (Aβ) の生成を促進します。 アロニアベリー(アロニアメラノカルパ)は、ジペプチジルペプチダーゼIVなどの酵素の阻害を通じて、健康にさまざまな有益な効果をもたらします。 本研究では、アロニアジュース(AJ)の神経保護効果を調べるため、雄のアルツハイマー病モデルマウス(5XFAD)に、生後2週間から12週までアロニアジュースを飲料ボトルを介して投与しました。 アロニアジュースの摂取により、アルツハイマー病モデルマウスのY字迷路テストの成績が向上し、マウス脳のδ-セクレターゼ活性が抑制された。 アロニアジュースの摂取により、脳内のアミロイド β沈着が大幅に減少しました。 アロニアジュースはヒト神経芽腫細胞(SH-SY5Y)におけるδ-セクレターゼ活性を低下させました。 アロニアジュースから得られた 5 つの画分 (F1 ~ F5) のうち、F5 のみが神経芽腫細胞(SH-SY5Y)のδ-セクレターゼ活性を用量依存的に低下させました。液体クロマトグラフィー質量分析/質量分析 (LC-MS/MS)分析により、画分F5 には 3 つのケルセチン配糖体が含まれることが示唆されました。 アロニアジュースは、アスパラギン エンドペプチダーゼ(AEP)のδ-セクレターゼ活性の阻害を通じて神経保護機能を持っています。 |
1. はじめに |
アルツハイマー病 (AD) は、生活の質の破壊と非常に高い経済的コストを伴う、最も一般的な進行性の神経変性疾患です。 世界中で 5,500 万人がアルツハイマー病およびその他の認知症を抱えていると推定されており、アルツハイマー病は全認知症症例の 60 ~ 80% を占めています [1]。 したがって、アルツハイマー病の発症を予防し、病気の進行期への進行を阻止する手段を見つけることが非常に重要です。 最近総説されているように、アルツハイマー病における果物と野菜の神経保護の役割が集中的に研究されています[2、3]。 たとえば、ザクロジュースを毎日飲むと、トランスジェニックアルツハイマー病モデル マウスの行動が改善され [4]、ブルーベリー抽出物を栄養補給すると、トランスジェニックアルツハイマー病モデル マウスの行動障害が防止されます [5]。 |
アロニアベリー (Aronia melanocarpa) には、アントシアニンやフラボノイドなどの機能性成分が多く含まれています [6]。 たとえば、シアニジン 3,5-ジグルコシドとカフェオイルキニン酸は、ジペプチジル ペプチダーゼ IV (DPP IV) と α-グルコシダーゼを阻害します [[7]、[8]、[9]、[10]、[11]]。 デルフィニジン-アラビノシド-グルコシドは HMG-CoA レダクターゼを阻害し [12]、ビセニン-2 は arrdc3 遺伝子の発現を抑制します [13]。 さらに、最近、アロニアベリーから抽出されたシアニジン 3-O-ガラクトシドが、自然老化促進マウスの認知障害を軽減することが示されました [14,15]。 これらの研究では、加齢に伴う認知障害および突発性アルツハイマー病モデルとして SAMP8 マウスを使用しました [16、17]。 突発性アルツハイマー病モデル(SAMP)マウスは、アミロイド前駆体タンパク質 (APP) の過剰産生により、生後約 8 か月で学習と記憶の障害を発症します。 一方、アルツハイマー病モデルマウス(5XFAD)トランスジェニックマウスは5つの家族性アルツハイマー病変異を過剰発現し[18]、脳内のニューロン内β-アミロイド42(Aβ42)の蓄積は生後1.5か月で始まる[18,19]。 現時点では、この早期発症型 アルツハイマー病マウスに対するアロニアベリーの効果は調査されていません。 |
この研究では、アロニアジュースには、これまで知られていないメカニズムによってアルツハイマー病の初期段階に有益な効果をもたらす化合物が含まれているという仮説を立てました。 そこで、アルツハイマー病マウスモデルとして 5XFAD マウスを使用し、生後 2 週目から 12 週間、飲料ボトルに入れて自由飲用アロニアジュースを介してモデルマウスに アロニアジュースを与えました。 アスパラギン エンドペプチダーゼは アルツハイマー病マウスモデル(5XFAD)マウスの脳で強く活性化されているため、メカニズムを見つけるために脳内のアスパラギン エンドペプチダーゼ活性を測定しました [20]。 マウスの脳では、アスパラギン エンドペプチダーゼがアミロイド前駆体タンパク質(APP)を切断し、δ-セクレターゼ活性と呼ばれるこのアミロイド前駆体タンパク質の切断は、アミロイドβペプチドの生成を促進します。SH-SY5Y 細胞 (ヒト神経芽腫) に対する AJ および AJ から得られた 5 つの画分の効果も調べました。 |
|
2.材料と方法 |
2.1. 材料 |
アロニアジュースは、有限会社中垣技術士事務所(堺市、日本) から入手しました。 BF-188 および抗 アミロイドβ 抗体 (6E10 抗体) は和光純薬 (大阪、日本) から購入しました。 細胞計数キット-8 は Dojindo (熊本、日本) から購入しました。 Z-Ala-Ala-Asn-MCA および アミロイドβ25-35 ペプチドは、ペプチド研究所 (大阪、日本) から購入しました。 他のすべての化学物質は分析グレードであり、和光純薬 (大阪、日本) から購入しました。 |
|
2.2. 動物実験 |
アルツハイマー病モデル(5XFAD)トランスジェニック マウスは、The Jackson Laboratory (米国メイン州バーハーバー) から入手しました [18]。 アルツハイマー病モデル(5XFAD)マウスは、ヘミ接合トランスジェニック マウスと非トランスジェニック B6/SJL マウスを交配することによって維持されました。 実験の前に、すべてのマウスの尾端からゲノム DNA を個別に抽出し、ポリメラーゼ連鎖反応分析によって遺伝子型特定を行い、非トランスジェニック同腹子を対照として使用しました。 1 つのグループ (5XFAD) は 5 匹の雄の アルツハイマー病モデル(5XFAD)マウスで構成され、マウスは飲料ボトルを介して水を自由に摂取しました。 別のグループ (5XFAD-AJ) は 5 匹の雄のアルツハイマー病モデル(5XFAD)マウスで構成され、マウスは生後 2 週間から 12 週間まで飲料ボトルを介して アロニアジュースを自由に摂取しました。 対照群(WT)は5匹の非トランスジェニック雄同腹子から構成され、マウスは水を飲ませた。 通常の食餌(CE-2食)をすべてのマウスに自由に与えた。 マウスは、12:12 時間の明暗サイクル下で 23 ± 2 °C、相対湿度 55 ± 10% に維持されました。 マウスの体重は、対照群(WT)、アルツハイマー病モデル群(5XFAD)、およびアロニアジュースを飲ませたアルツハイマー病モデルマウス群(5XFAD-AJ)の間で実験全体を通して差異を示さなかった(図S1)。 |
|
2.3. Y字迷路テスト |
Y字迷路は灰色のアクリル板でできたアームが120度に3本あり、それぞれのサイズは40cm×10cm×15cmでした。 10 分間居住させた後、各マウスを Y 字迷路の中心に置き、8 分間で異なるアームを自由に探索させました。 アームエントリーの数とエントリーの順序はビデオカメラを使用して記録されました。 変更のパーセンテージは、次の式に従って計算されました: (変更の数) × 100/(合計アームエントリ数 -2) 3 つのグループの各マウスは、14 週齢の明期に Y 字迷路テストを受けました。 2.4. 免疫組織化学 生後 100 日で、各マウスをイソフルランで麻酔し、大脳を切除し、10% 中性緩衝ホルマリンで固定しました。 固定した組織を脱水し、パラフィンに包埋し、5 μm の切片にしました。 切片を脱パラフィンし、再水和し、3% 過酸化水素溶液 (メタノール中) で 25 分間インキュベートしました。 各切片をリン酸緩衝生理食塩水(PBS)中の抗 アミロイドβ 抗体 (1:500) と 4 °C で一晩インキュベートしました。 リン酸緩衝生理食塩水で洗浄した後、切片を二次抗体中で室温で30分間インキュベートしました。 ジアミノベンジジンと反応させた後、切片を顕微鏡 (MZ-9300、Keyence、大阪、日本) で観察しました。 |
|
2.5. BF-188染色 |
ベンズイミダゾール誘導体である BF-188 は、アミロイドβ およびタウタンパク質沈着物の両方に強く結合する蛍光プローブです [21]。 脱パラフィン切片を、製造業者のプロトコールに従ってBF-188で染色した。 簡単に説明すると、切片を Milli-Q 水で 10 分間洗浄し、0.25% 過マンガン酸カリウム溶液で 20 分間漂白し、リン酸緩衝生理食塩水で 2 回洗浄しました。 洗浄切片を 100 μmol/L BF-188 (50% エタノール中) に 10 分間浸漬し、水に数秒浸漬する洗浄を 5 回行った後、蛍光顕微鏡 (MZ-9300、Keyence、大阪、日本) を用いて観察した。 |
|
2.6. 細胞培養と処理 |
ヒト神経芽腫細胞(SH-SY5Y)を、10%FBS、1%ペニシリン-ストレプトマイシンを含むD-MEM/F-12培地(ナカライテスク、京都、日本)中で5%CO2下、37℃で培養した。 神経芽腫細胞を 96 ウェル プレートに播種し、細胞を 18 ~ 24 時間 80% コンフルエントになるまで増殖させた後、アミロイドβ25 ~ 35 ペプチド、アロニアジュース、または アロニアジュースから得た画分で処理しました。 アミロイドβ25-35 ペプチドのストック溶液を再蒸留水で 1 mM で調製し、溶液を 37 °C で 3 日間インキュベートしてペプチドを凝集させました。 得られた凝集形態のペプチド (有毒な アミロイドβ25-35 ペプチド) を培地に添加しました [22、23]。 処理された細胞の細胞生存率は、Cell Counting Kit-8 (Dojindo、熊本、日本) を製造業者のプロトコールに従って使用して検査しました。 プレートリーダー(Bio-Rad、USA)を使用して450 nmでの吸光度を測定しました。 |
|
2.7. δ-セクレターゼ活性アッセイ |
本研究では、基質として Z-Ala-Ala-Asn-MCA を使用して、δ-セクレターゼ活性をアスパラギン エンドペプチダーゼ(AEP) 活性としてアッセイしました。 アッセイ混合物 (1.0 mL) には、50 mM クエン酸ナトリウム緩衝液 (pH 5.0)、100 μM Z-Ala-Ala-Asn-MCA、5 mM 2-メルカプトエタノール、および酵素溶液 (脳組織ホモジネートまたは細胞溶解物の上清) が含まれていました。 基質ストック溶液(ジメチルスルホキシド中の10 mM Z-Ala-Ala-Asn-MCA)を添加することによって反応を開始し、反応混合物を37℃で30分間インキュベートした。 次に、2 mL の 0.2 M 酢酸を加えて反応を停止し、酵素的に放出されたアミノ メチル クマリン (AMC) を蛍光分光計 (励起波長と発光波長、それぞれ 380 nm と発光波長 440 nm) を使用して蛍光測定しました。 検量線は、さまざまな濃度のアミノ メチル クマリンを含むアッセイ混合物 (酵素溶液なし) の蛍光を測定することによって得られました。 酵素溶液のタンパク質濃度は、ブラッドフォード アッセイおよび標準タンパク質としてウシ血清アルブミンを使用して測定されました (Bio-Rad Protein Assays)。 |
|
2.8. アロニアジュースのクロマトグラフィー分離 |
前述のように、Wakogel 50C18 カラム (200 mL ゲル) を使用して、アロニアジュースから 5 つの画分 (F1 ~ F5) を調製しました[8]. 簡単に説明すると、AJ (300 mL) を、0.1% ギ酸水溶液 (溶媒 A) であらかじめ平衡化したカラムに直接アプライしました。 。 カラムを溶媒 A で十分に洗浄した後、メタノール濃度を段階的に増加させて吸着化合物をカラムから溶離しました (メタノール: 溶媒 A = 10、20、30、40、および 50% (v/v))。 F1 ~ F5 の順に入力します。 各画分を蒸発乾固し、重量を量り、0.1% ギ酸を含む 12.5% または 25% メタノール水溶液に最終濃度 1 ~ 10 mg/mL まで溶解しました。 |
|
2.9. 液体クロマトグラフィー質量分析 (LC-MS) |
それぞれの画分の化合物を調べるために、各画分のアリコート (1 μL) を溶媒 A であらかじめ平衡化した InertSustain C18 カラム (2.1 mm × 150 mm、ジーエルサイエンス、東京、日本) に注入し、カラムを 以下の勾配で流量 0.25 mL/min、0% B で 0 ~ 5 分、0 ~ 70% B で 5 ~ 35 分、70 ~ 100% B で 35 ~ 35.1 分、溶媒 B はアセトニトリルを含む 0.1% ギ酸、カラム温度は 40 °C に制御しました。 溶出液をエレクトロスプレーイオン化(スプレー電圧4kV、キャピラリー温度320℃)に供した。 溶出液の質量スペクトルは、陽イオンモードで m/z 150 ~ 1000 の間で記録されました。 上位 5 位の強度を持つイオンをデータに応じて MS/MS 測定に供しました。 デュアル UHPLC ポンプ (Vanquish、Thermo Fisher Scientific、カリフォルニア州、米国) およびオービトラップ質量分析計 (Q-Exactive、Thermo Fisher Scientific、カリフォルニア州、米国) を使用しました。 データ分析は、Compound Discoverer 3.1 ソフトウェア (Thermo Fisher Scientific、カリフォルニア州、米国) を使用して実行されました。 |
|
2.10. 統計分析 |
データは平均値±標準誤差として表されます。 統計分析は、Statcel4 ソフトウェア (OMS、東京、日本) を使用して実行されました。 2 つのグループ間の差異は、分散分析 (一元配置 ANOVA) に続いて対応のないスチューデントの t 検定を使用して評価されました。 複数のサンプルの比較には、Tukey-Kramer 検定を使用しました。 2.11. 倫理 すべての動物実験は、国立衛生研究所の実験動物の管理と使用に関するガイドに従って実施され、すべてのプロトコールは大阪府立大学動物研究委員会によって承認されました(許可番号 19 ~ 112)。 実験期間中、動物には著しい体重減少、摂食障害、自傷行為、異常な姿勢、呼吸障害、泣き声、下痢、出血、外陰部の汚れなどの苦痛の症状は見られませんでした。 |
|
3. 結果 |
3.1. アロニアジュースは アルツハイマー病モデルマウス(5XFAD)の Y 迷路パフォーマンスを改善しました |
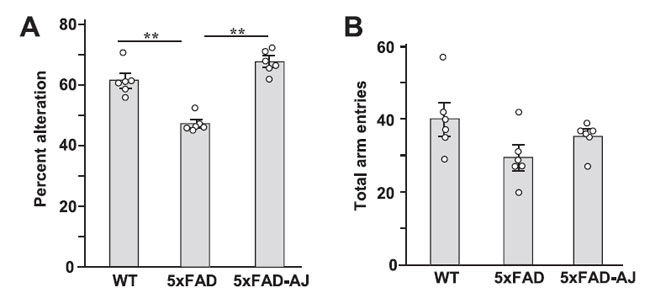
生後2週目にアロニアジュース摂取を開始してから84日後のアルツハイマー病モデルマウス(5XFAD)の作業記憶に対するアロニアジュース摂取の影響を調査するために、非トランスジェニックマウスすなわち野生マウス(WT群)、水を飲んだアルツハイマー病マウス(5XFAD群)、アロニアジュースを飲んだアルツハイマー病モデルマウス(5XFAD-AJ群)のY字迷路テストの成績を調べました(図1)。 アルツハイマー病モデルマウス(5XFAD)の変化率は野生マウスと比較して有意に減少したが、アロニアジュースを毎日摂取したアルツハイマー病モデルマウスマウスは野生マウスと同レベルの変化を示した(図1A)。 総アームエントリに関しては、アルツハイマー病マウス(5XFAD)は、 野生マウス(WT)および アロニアジュースを飲んだアルツハイマー病(5XFAD-AJ)マウスと比較して減少する傾向を示しました (図 1B)。 |
|
|
図 1.アルツハイマー病モデルマウス( 5xFAD)の Y 迷路行動に対するアロニアジュースの効果。 | 非トランスジェニックすなわち野生マウス(WT)とアルツハイマー病モデルマウス(5XFAD)は実験中ずっと水を飲み、アロニアジュース摂取アルツハイマー病マウス(5XFAD-AJ)は生後2週目から14週目まで水の代わりにアロニアジュースを飲みました。 (A) 変更率。 (B) アームエントリーの合計。 n = 6。 **p < 0.01。 |
3.2. アロニアジュースは大脳内のアミロイドβ蓄積を改善しました |
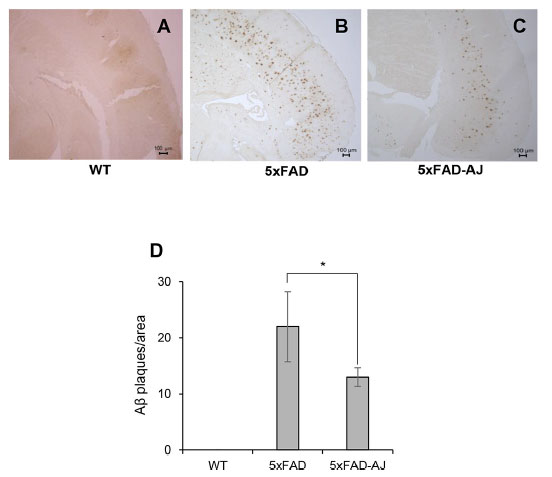
大脳におけるアミロイドβ 蓄積に対する アロニアジュース摂取の影響を調べるために、アミロイドβ に対する特異的抗体 (6E10) を用いた免疫組織化学によって アミロイドβ 沈着をアッセイしました。 図2に示すように、アルツハイマー病モデルマウス(5XFAD)と比較して、アロニアジュース摂取アルツハイマー病モデルマウス(5XFAD-AJ)の脳ではアミロイドβプラークの数が減少した。 アミロイドβとタウ沈着のレベルをさらに分析するために、脳切片をBF-188で染色しました(図S2)。 BF-188 染色スポットの数は、アルツハイマー病モデルマウス(5XFAD) と比較して アロニアジュース摂取アルツハイマー病モデルマウス(5XFAD-AJ )の脳では減少していました。 |
|
|
図 2. (A)14 週齢の 非トランスジェニック野生マウス:WT、(B)アルツハイマー病モデルマウス:5XFAD、および (C) アロニアジュース摂取アルツハイマー病モデルマウス:5XFAD-AJ マウスの大脳におけるアミロイド沈着。 |
| 代表的な アルツハイマー病モデルマウス(5XFAD) および アロニアジュース摂取アルツハイマー病モデルマウス(5XFAD-AJ )の脳の傍矢状切片を抗 アミロイドβ 抗体 (6E10) で染色しました。 (D)各遺伝子型のプラークの数を定量化しました。 *p < 0.05、n = 3。 |
3.3. アロニアジュースは5XFADマウス脳におけるδ-セクレターゼ活性の増加を改善する |
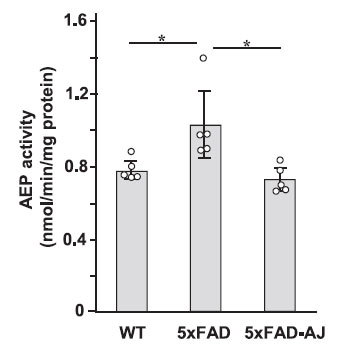
最近総説されたように[24]、哺乳動物の脳では、アスパラギン エンドペプチダーゼ(AEP)はアミロイド前駆体タンパク質(APP)の断片化とアミロイドβ(Aβ)の産生において重要な役割を果たしています。 アスパラギン エンドペプチダーゼ(AEP)は正常なマウスでは年齢に依存して活性化され、アルツハイマー病モデルマウス(5XFAD)の脳では強く活性化されることが知られています [20]。 そこで、マウス脳におけるアスパラギン エンドペプチダーゼ活性に対するアロニアジュースの影響を調べました(図 3)。 アルツハイマー病モデルマウス(5XFAD)脳におけるアスパラギン エンドペプチダーゼ活性は、非トランスジェニック マウスすなわち野生マウスと比較して有意に高かった。 重要なことに、アロニアジュース摂取アルツハイマー病モデルマウス(5XFAD-AJ )の脳は、非トランスジェニック マウスすなわち野生マウス(WT)の脳で見られるのと同じレベルの酵素活性を示しました。 |
|
|
図 3. 14 週齢の非トランスジェニックすなわち野生マウス (WT)、アルツハイマー病モデルマウス(5XFAD)、および アロニアジュース摂取アルツハイマー病モデルマウス(5XFAD-AJ )の脳における アスパラギン エンドペプチダーゼ(AEP) 活性に対するアロニア ジュースの効果。 アスパラギン エンドペプチダーゼ(AEP)活性は、基質としてZ-Ala-Ala-Asn-MCAを使用してアッセイした。 n = 5、⁎p < 0.05。 |
3.4. アロニアジュースと画分F5は神経芽腫細胞(SH-SY5Y)のδ-セクレターゼ活性を低下させた |
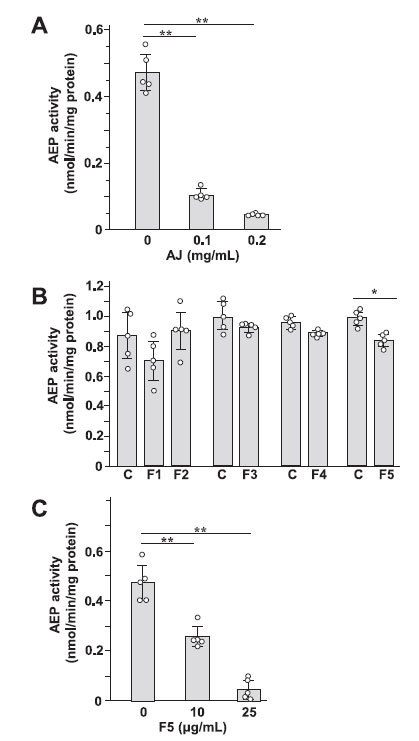
アロニアジュース摂取によるアルツハイマー病モデルマウス(5XFAD)の脳におけるアスパラギン エンドペプチダーゼ(AEP)活性の増加の改善メカニズムを見つけるために、神経芽腫細胞株であるSH-SY5Y細胞におけるアスパラギン エンドペプチダーゼ(AEP)活性に対するアロニアジュースおよびアロニアジュースからの5つの画分の影響を調べた(図4)。 細胞処理に使用した アロニアジュースおよび各画分の濃度は細胞に対して毒性はありませんでした (図 S3)。 アロニアジュースは用量依存的にアスパラギン エンドペプチダーゼ(AEP)活性を低下させた(図4A)。 5つの画分のうち、F5のみが神経芽腫細胞(SH-SY5Y)のアスパラギン エンドペプチダーゼ(AEP)活性を有意に低下させた(図4B)。 F5は、細胞内のアスパラギン エンドペプチダーゼ(AEP)活性を用量依存的に強く減少させた(図4C)。 |
|
|
図 4. 神経芽腫細胞(SH-SY5Y)の アスパラギン エンドペプチダーゼ(AEP) 活性に対するアロニア果汁 (A)、果汁から得られた画分 (B)、および画分 F5 (C) の影響。神経芽腫細胞(SH-SY5Y)をアロニアジュースの非存在下および存在下および各画分で2日間培養し、細胞溶解物のアスパラギン エンドペプチダーゼ(AEP)活性を測定した。 n = 5、⁎p < 0.05、⁎⁎p < 0.01。 |
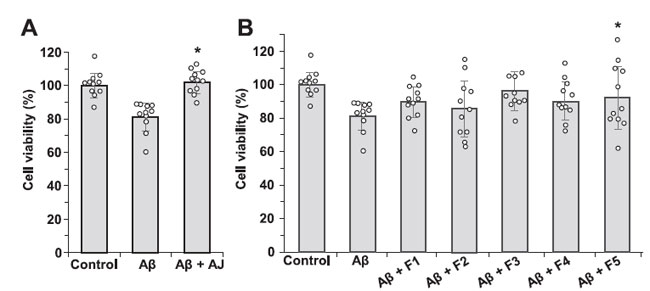
3.5. 画分F5は、アミロイドβ25-35ペプチドで処理した神経芽腫細胞(SH-SY5Y)を細胞死から保護した |
凝集した アミロイドβ25-35 ペプチドは神経細胞に対して有毒です。 アミロイドβ25-35で処理した神経芽腫細胞(SH-SY5Y)は、細胞生存率の低下を示しました(図5)。 F5 のみが アミロイドβ25-35 ペプチドの毒性作用から神経芽腫細胞(SH-SY5Y)を有意に保護しました。 |
|
|
図 5. アミロイドβ25-35 ペプチドによって誘導される神経芽腫細胞(SH-SY5Y)の 細胞死に対するアロニアジュース (A) およびその画分 (B) の効果。 n = 11。⁎p < 0.05。 (A) 細胞を、2.5 mg/mL アロニアジュース(AJ) の非存在下 (Aβ) および存在下 (Aβ + AJ) で アミロイドβ25-35 ペプチド (25 μM) とインキュベートしました。 (B) 細胞を各画分 (2.5 μg/mL) の存在下で アミロイドβ25-35 ペプチド (25 μM) とともにインキュベートしました。 |
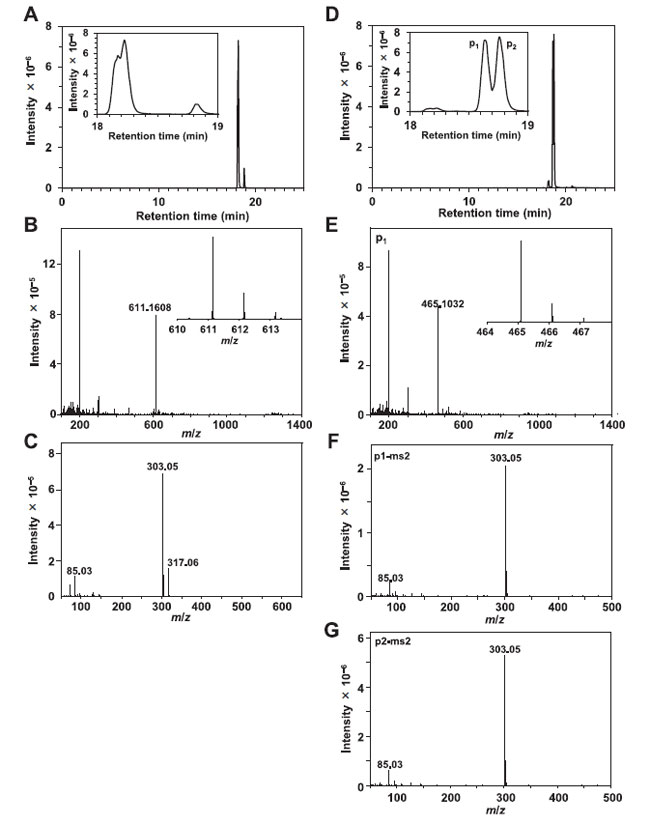
3.6. 画分F5の液体クロマトグラフィー質量分析/質量分析(LC-MS/MS) |
主要なイオンとして 3 つのイオンが検出されました (図 6)。 m/z 値 303.05 のイオンは、CID によって 3 つのイオンすべてから生成されました (図 6C、F、および G)。 プロトン化されたケルセチンの分子量は 303.05 Da であるため、これら 3 つのイオンはケルセチン誘導体であると考えられます。 ケルセチン 3-O-ルチノシド (ルチン)、ケルセチン 3-O-ガラクトシド (ヒペロシド)、およびケルセチン 3-O-グルコシド (イソケルセチン) の分子量は、それぞれ 611.16、465.465.10、および 465.10 です。 18.2分に溶出したイオンはルチンと思われる。 18.62 分に溶出したイオン (P1) と 18.78 分に溶出したイオン (P2) はヒペロシドとイソケルセチンであると考えられます。 |
|
|
図 6. F5 の 液体クロマトグラフィー質量分析/質量分析(LC-MS/MS)。 (A) 分子量 611.16 Da のイオンの抽出されたクロマトグラム。 (B) (A) で検出されたイオンの質量スペクトル。 (C) (B) に示したイオンから CID により生成されたイオンのマススペクトル。 (D) 465.10 Da の同じ分子量を持つ 2 つのイオンの抽出されたクロマトグラム。 (E) P1 イオンの質量スペクトル。 (F) CID によって P1 から生成されたイオンの質量スペクトル。 (G) CID によって P2 から生成されたイオンの質量スペクトル。 |
4.討議 |
疾患が特定の臨界レベルを超えて進行した後に、アルツハイマー病(AD) を逆転させる、または少なくともアルツハイマー病の進行を止める効果的な方法はありません。 したがって、病気を初期段階で維持する手段を見つけることが重要です。 アルツハイマー病モデルマウス(5XFAD)は、非常に迅速なアルツハイマー病アミロイド モデルを取得するために作成されました [18]。 アルツハイマー病モデルマウス(5XFAD)では、アミロイドの沈着は生後 2 か月で始まり、Y 字迷路での変更パフォーマンスによって判断される空間作業記憶は生後 4 か月で著しく損なわれます。 本研究では、生後 2 週から 12 週までの期間にわたる アルツハイマー病モデルマウス(5XFAD)の アルツハイマー病の極初期段階に対する毎日の アロニアジュース摂取の影響を調べました。 アルツハイマー病モデルマウス(5XFAD)の Y 字迷路変更能力は、野生型マウスと比較して生後 3 か月で著しく低下しており、アロニアジュース摂取によりその欠陥が改善されました。 アルツハイマー病モデルマウス(5XFAD)の脳における アミロイドβプラークの沈着は生後 3 か月で明らかであり、アロニアジュース摂取により沈着が軽減されました。 アスパラギン エンドペプチダーゼ(AEP)は脳内でδ-セクレターゼとして作用して アミロイドβ産生を増強することが明らかになっているので [20]、我々はマウス脳ホモジネートにおける アスパラギン エンドペプチダーゼ(AEP)活性を調べた。 重要なことに、アロニアジュースの摂取はアルツハイマー病モデルマウス(5XFAD)の脳におけるアスパラギン エンドペプチダーゼ(AEP)活性を低下させた。 アルツハイマー病モデルマウス(5XFAD)の疾患の進行に対するさまざまな天然化合物の影響が研究されています。 たとえば、アルツハイマー病モデルマウス(5XFAD)では、生後 4 か月から 6 か月の間、カルボキシ デヒドロエボジアミンを週 5 回腹腔内注射すると、アルツハイマー病関連の病状が軽減され、記憶障害が改善されます [25]。 生後4か月から6か月までの期間にわたってフロログルシノールを含む水を自由に飲むと、アルツハイマー病モデルマウス(5XFAD)の海馬におけるアミロイドβペプチド負荷と炎症誘発性サイトカインが減少します[26]。 ツボクサ抽出物を含む食餌を 4.5 週間投与すると、アルツハイマー病モデルマウス(5XFAD)の認知障害が回復しました [27]。 残念ながら、これらの研究ではアスパラギン エンドペプチダーゼ(AEP)の活性は調べられませんでした。 |
本研究では、アスパラギン エンドペプチダーゼ活性 (δ-セクレターゼ) に対する アロニアジュースの阻害効果に焦点を当てました。 図7は、アルツハイマー病モデルマウス(5XFAD)において過剰発現された3つの家族性アルツハイマー病変異を有するヒトアミロイド前駆体タンパク質(APP)の部分アミノ酸配列と、α-、β-、γ-、およびδ-セクレターゼの主要な切断部位を示す。 β-およびγ-セクレターゼの阻害またはα-セクレターゼの活性化はアミロイドβ42の形成の減少につながる可能性があるため、これらのセクレターゼを阻害または活性化するためにさまざまな天然化合物が試験されています[[28]、[29]、[30]、 [31]、[32]、[33]、[34]、[35]、[36]]。 興味深いことに、Descamps et al. [31]は、ルチン (ケルセチン 3-O-ルチノシド) が β-セクレターゼ活性を阻害し、神経芽腫細胞(SH-SY5Y)をルチン (1 μM) で処理すると、アミロイド前駆体タンパク質(APP)からの切断されたペプチドの放出が減少することを発見しました。 さらに、ケルセチンは in vitro で β-セクレターゼ活性を阻害します (IC50 25 μM) [32]。 これらの結果は、アロニアジュースおよび画分F5がδ-セクレターゼを阻害するだけでなく、β-セクレターゼも阻害する可能性を示唆している。 |
|
図 7. アルツハイマー病モデルマウス(5XFAD)で過剰発現された、K670N、M671L、I716V、および V717I の変異を伴うヒトアミロイド前駆体タンパク質(APP)の部分アミノ酸配列 (赤文字で表示)。 アミロイド前駆体タンパク質(APP)膜貫通配列はボックスで強調表示されます。 黒と青のバーは、それぞれ アミロイドβ42 と アミロイドβ25 ~ 35 を示します。 黒い矢印はδ-セクレターゼの切断部位を示します。 赤、青、黄色の矢印は、それぞれβ-セクレターゼ、α-セクレターゼ、γ-セクレターゼの切断部位を示します。 (この図の凡例における色の参照の解釈については、この記事の Web バージョンを参照してください。) |
γ-セクレターゼはアミロイド前駆体タンパク質(APP)の膜貫通ドメインを切断します(図7)。 これまで、γ-セクレターゼ活性を直接阻害するポリフェノールは知られていない。 最近、膜内のコレステロールの存在がγ-セクレターゼによる基質認識に重要であることが提案されている[33]。 ポリフェノールは細胞内のコレステロールレベルを低下させるので[34]、アロニアジュースは細胞膜内のコレステロール含有量の低下を通じて間接的にγ-セクレターゼ活性を阻害する可能性がある。 α-セクレターゼ (ADAM10) の活性化に関しては、Zhang et al. は、バイカレイン (5,6,7-トリヒドロキシフラボン) が、GABAA 受容体シグナル伝達の活性化を通じて、α-セクレターゼによる アミロイド前駆体タンパク質(APP) のα-プロセシングを強化することを発見しました [35]。 最近検討されたように[36]、緑茶ポリフェノールであるエピガロカテキン-3-ガレートがアミロイド前駆体タンパク質(APP)のα-セクレターゼプロセシングを促進することが示唆されています。 α-、β-、およびγ-セクレターゼに対するアロニアジュースの影響を調べるには、さらなる研究が必要です。 |
最近、炎症調節転写因子である C/EBPβ が、δ-セクレターゼの mRNA およびタンパク質のレベルを調節していることが判明しました [37]。 アルツハイマー病モデルマウス(5XFAD)から C/EBPβ を枯渇させると、δ-セクレターゼが減少し、アルツハイマー病の病態が軽減されます。 さらに、δ-セクレターゼは、アミロイドβ生成の律速アスパルチルプロテアーゼであるBACE1を切断してその酵素活性を高め、アルツハイマー病における老人斑の沈着を促進することがわかっている[38]。 重要なことに、腸の炎症は、C/EBPβ依存的にトランスジェニックアルツハイマー病マウス(3XTg AD)の結腸におけるアスパラギン エンドペプチダーゼ(AEP)活性を増加させ、アルツハイマー病におけるアミロイドβおよびタウ原線維の腸から脳への伝播を引き起こすことが実証されている[39]。 アミロイドβの沈着が炎症を誘発し、炎症が活性型C/EBPβを増加させ、C/EBPβが活性型δ-セクレターゼを増加させ、δ-セクレターゼがアミロイドβ産生を増加させ、δ-セクレターゼで切断されたアミロイド前駆体タンパク質(APP)フラグメント(C585~695)がC/EBPβを活性化するという悪循環が存在します[40]。 この悪循環において、δ-セクレターゼが重要な役割を果たします。 実際、δ-セクレターゼ阻害剤である阻害剤 11 [41] を 3 か月間強制経口投与すると、脳のアスパラギン エンドペプチダーゼ(AEP)活性が低下し、アミロイドβの生成が減少し、老化促進マウス (SAMP8) の記憶喪失が改善されます [42]。 アロニアジュースには強い抗酸化作用を持つ各種ポリフェノールが含まれているため、アロニアジュースの飲用による脳内アスパラギン エンドペプチダーゼ(AEP)活性の低下は、酸化ストレスによる炎症の抑制による活性型C/EBPβの減少によるものと考えられます。 しかし、5つのアロニアジュース画分のうち、F5のみが神経芽腫細胞(SH-SY5Y)のアスパラギン エンドペプチダーゼ(AEP)活性を抑制し(図4)、アロニアジュースによるアスパラギン エンドペプチダーゼ(AEP)の直接阻害の可能性が示唆された。 |
画分F5の液体クロマトグラフィー質量分析/質量分析(LC-MS/MS)により、F5にはルチン(ケルセチン-3-O-ルチノシド)、ヒペロシド(ケルセチン-3-O-ガラクトシド)およびイソケルセチン(ケルセチン-3-O-グルコシド)が含まれていることが示唆されました(図6)。 興味深いことに、ケルセチンおよびこれら 3 つのケルセチン配糖体の アルツハイマー病モデル動物に対する有益な効果が報告されています。 高齢のトランスジェニックアルツハイマー病モデルマウス (3XTg-AD) にケルセチンを 3 か月間腹腔内投与すると、β-アミロイドーシスが改善され、空間学習と記憶が改善されました [43]。 ルチンは、ヒ神経芽腫細胞(SH-SY5Y)におけるアミロイドβ42誘発性の細胞毒性を弱める[44]。 ケルセチンとルチンの抗アミロイド生成効果と原線維脱凝集効果は、アミロイド前駆体タンパク質(APP)695 でトランスフェクトされた 神経芽腫細胞(SH-SY5Y)でも実証されています [45]。 ヒペロシド混合食を9か月間摂取すると、APP/PS1トランスジェニックマウスの空間学習と記憶が改善された[46]。 イソケルセチンの脳室内投与は、コルヒチン誘発性アルツハイマー病モデルラットの学習および記憶障害を防止する[47]。 |
一般に、食事性フラボノール配糖体は最初に酵素的に加水分解されてアグリコンが遊離され、その後アグリコンが腸上皮細胞に入ることが提案されている[48]。 ケルセチン 3-O-グルコシドの場合、ケルセチンが吸着されます。 重要なことは、血漿中ではケルセチン 3-O-グルクロニドが検出されるが、ケルセチンは検出されず、これはケルセチンが体循環に入る前に肝臓でグルクロン酸と結合していることを示している[49]。 ケルセチン 3-O-グルクロニドは血液-脳関門 (BBB) を通過すると報告されています [50]が、極性ケルセチン 3-O-グルクロニドは血液-脳関門に対する透過性が低いと予想されます [51]。 神経芽腫細胞(SH-SY5Y)に対するケルセチン 3-O-グルクロニドの効果を調べる必要があります。 |
これらの以前の研究は、アルツハイマー病モデルマウス(5XFAD)に対するアロニアジュースの有益な効果は、少なくとも部分的に アロニアジュースのケルセチン配糖体によるものであることを示唆しています。 ケルセチン配糖体が in vivo および in vitro アルツハイマー病モデルでδ-セクレターゼ活性を阻害するかどうかを調べることが重要です。 |
|
5.結論 |
本研究では、アルツハイマー病の動物モデルにおいてアロニアジュースの予防効果が観察されました。 しかし、アロニアジュースには多くのポリフェノールが含まれているため、アロニアジュースの有益な効果は少なくとも部分的には アロニアジュースに含まれるケルセチン配糖体によるものです。 今後の研究では、ケルセチン配糖体が in vivo および in vitro アルツハイマー病モデルでδ-セクレターゼの活性を阻害するかどうかを調査する必要があります。 今回のようにモデル動物を用いた研究データやヒトを用いた臨床試験結果が蓄積されることで、アロニアジュースは機能性食品、栄養補助食品として広く認知されることが期待される。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この研究はNFS Journal 32 (2023) 100146 に掲載されたAronia juice improves working memory and suppresses δ-secretase activity in 5XFAD mice.を、日本語に訳したものです。タイトルをクリックして原論文の全文を英文で読むことが出来ます。 |