ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(ヨーグルト、ビフィズス菌:研究の最前線) |
ランダム化プラセボ対照試験における消化管におけるプロバイオティクスの生存率: 分子生物学と新しい培養技術の組み合わせ |
A. Sen, M. Kimura et al., |
|
|
| 要約 |
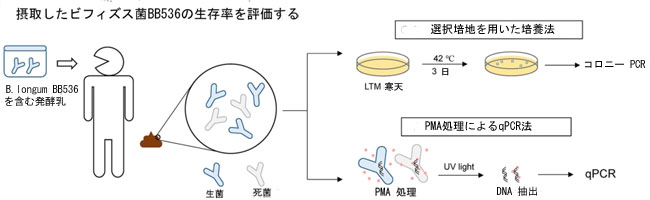
摂取したプロバイオティクスの胃腸管内での生存率を理解することは、その有効性を評価し、その作用機序を解明するために不可欠です。Bifidobacterium longum subspecies longum BB536の検出は、ヒトの腸内に自然に豊富に存在するB. longum種と区別がつかないため、特に困難です。私たちは、B. longum BB536 の選択培養培地を開発し、プロピジウムモノアジド定量ポリメラーゼ連鎖反応 (PMA-qPCR) 法を使用して、摂取後のプロバイオティクスの生存を検証することで、この課題に対処することを目指しました。これを実現するために、42 °C の嫌気条件下で B. longum BB536 の培養を容易にする新しいラクトース-ムピロシン-トリメトプリム (LMT) 培地を設計しました。52 人の健康な成人をスクリーニングし、適格基準を満たした 39 人を登録しました。参加者はランダムに 2 つのグループに分けられ、34 人がプロトコルを完了しました。17 人は B. longum BB536 (9.30 log10 cfu/日) を含む市販のヨーグルトを摂取し、17 人はプラセボを摂取しました。介入前は、すべての参加者で B. longum BB536 は検出されませんでした。しかし、補給後、LMT培養により生存可能なB. longum BB536が特定され、平均数は3日目に6.33 ± 0.69 log10 cfu/g、17日目に6.16 ± 0.74 log10 cfu/gでした。PMA-qPCRによりこれらの結果がさらに検証され、生存細胞数は3日目に6.09 ± 0.68 log10細胞/g湿潤便、17日目に6.44 ± 0.64 log10細胞/g湿潤便であることが示されました。各方法では、他方では検出されなかったB. longum BB536が一部の参加者で検出されたものの、どの時点でも両方の方法で陰性となった参加者はいませんでした。この LMT 培養と PMA-qPCR の相補性により、包括的な検出戦略が保証され、消化管における B. longum BB536 の存在と耐性が確認され、有益なプロバイオティクス株 (UMIN000052110) としての可能性が強調されます。 |
 |
| グラフィカル アブストラクト |
| 目次(クリックして記事にアクセスできます) |
| 1 はじめに |
| 2 材料と方法 |
| 2.1.細菌培養のための選択培地の開発 |
| 2.2.LMT 寒天培地を使用した生きたBifidobacterium longumBB536 の検出と PCR による同定 |
| 2.3.PMA-qPCR を用いた生きたBifidobacterium longum BB536 の検出 |
| 2.4.糞便懸濁液に混入したBifidobacterium longum BB536の生存率を評価するための LMT 培養と PMA-qPCR 技術の比較検証 |
| 2.5.臨床試験の設計 |
| 2.6.参加者 |
| 2.7.サプリメント |
| 2.8.サンプル採取 |
| 2.9.統計分析 |
| 3 結果 |
| 3.1.BB536 選択培地の開発 |
| 3.2.腸管におけるBifidobacterium longum BB536の生存率を測定する臨床試験 |
| 3.3.生菌Bifidobacterium longum BB536の定量 |
| 3.4.安全性評価 |
| 4. 考察と結論 |
本文 |
| 1.はじめに |
| プロバイオティクスは、健康上の利点のために摂取される生きた微生物です (Sanders et al., 2019)。腸上皮バリアを強化し、免疫系を調節する代謝産物を生成することで機能します (Abdulqadir et al., 2023)。ただし、摂取されたプロバイオティクスは、消化酵素や他の腸内細菌との栄養素の競合など、多くの環境ストレスに直面します。その結果、腸に到達するまで活性状態で生存することは保証されません。 Bifidobacterium longum subspecies longum BB536は、便秘の緩和、抗アレルギー効果、免疫機能の調整など、健康上の利点があることで知られる、世界的に研究されているプロバイオティクス株です (Wong et al., 2019)。この株は、腸の完全性を維持し、炎症を抑えるのに役立つ酢酸や乳酸などの代謝産物を生成します (Abdulqadir et al., 2023)。B. longum BB536 は、アリール炭化水素受容体を介して腸細胞に抗炎症効果を発揮するインドール乳酸も生成します (Sakurai et al., 2019)。さらに、B. longum BB536 は、他の腸内細菌叢との相互作用を通じて酪酸の生成をサポートします (Sugahara et al., 2015)。臨床試験では、定量的ポリメラーゼ連鎖反応 (qPCR) を使用して糞便中の B. longum BB536 が検出されました。しかし、この方法では生きている細菌と死んだ細菌を区別できません(Akatsu et al., 2013; Kondo et al., 2013; Rougé et al., 2010; Tremblay et al., 2021)。 |
| 摂取した生きたプロバイオティクスを正確に定量するために、細菌特異的プライマーと、細胞膜が損傷した細菌の DNA に結合して PCR 増幅を阻害する PMA 試薬を組み合わせたプロピジウムモノアジド (PMA)-qPCR 法が採用されています (Nocker and Camper, 2006)。この方法は、プロバイオティクスの生存力を評価するのに広く使用されています (Fujimoto et al., 2011, 2013; Palaria et al., 2012)。ただし、PMA-qPCR 法では、増殖能力を無視して細胞膜の完全性に基づいて生存力を判定します。生きたプロバイオティクスを検出する別の方法として、種固有の栄養素と抗生物質を添加した寒天培地で培養して効率を高める方法があります。種または株固有のプライマーを使用した PCR による同定を含むこの方法は、さまざまなプロバイオティクス株の生存力を評価するのにも使用されています。さらに、この方法は、複数のプロバイオティクス株の生存率を評価するために使用されています (Christensen et al., 2006; Dommels et al., 2009; Yuki et al., 1999)。しかし、B. longum BB536 はあらゆる年齢層の腸内に広く存在するため、同種の他の株と区別することは依然として困難です (Kato et al., 2017)。 |
| そこで、私たちはB. longum BB536の選択培養法を開発し、この菌株を含む発酵乳を摂取した健康な成人におけるその生存率を評価することを目的としました。私たちは、新たに開発した選択培地とPMA-qPCR法を使用して、プロバイオティクスの生存率を総合的に評価しました。 |
| 2 材料と方法 |
| 2.1.細菌培養のための選択培地の開発 |
| 本研究で使用した B. longum 株は、日本微生物コレクション (JCM)、アメリカタイプカルチャーコレクション (ATCC)、森永カルチャーコレクション (MCC) から入手しました。これらの株は、0.05% (w/v) L-システイン塩酸塩 (Kanto Chemical Co., Tokyo, Japan) を添加した de Man-Rogosa-Sharpe (MRS) 培地 (Becton Dickinson, Franklin Lakes, NJ, USA) で、AnaeroPack Kenki (Mitsubishi Gas Chemical Co., Tokyo, Japan) を使用して嫌気条件下で 37 °C で 16 時間培養しました。培養後、培養物を生理食塩水で 107 倍に希釈し、各希釈液 100 μl を、LMT 寒天培地と同量のトリメトプリムおよびムピロシンを添加したラクトース・ムピロシン・トリメトプリム (LMT) 寒天培地 (補足表 S1) および TOS プロピオン酸寒天培地 (Yakult Pharmaceutical, Tokyo, Japan) に塗布した。培地は 37 ~ 42 °C の温度で 3 日間嫌気的に培養した。 |
| 2.2.LMT 寒天培地を使用した生きたBifidobacterium longum BB536の検出と PCR による同定 |
| 糞便サンプルを 0.85% 生理食塩水で 20 倍 (w/v) に希釈し、AnaeroPack Kenki を使用して嫌気条件下で 42 °C で 3 日間 LMT 寒天培地上で培養しました。培養したプレートは分析まで 4 °C で保存しました。定量化のために、LMT 寒天培地のコロニーを選択し、20 μl の滅菌水に懸濁しました。懸濁した各コロニーを 40 μl の InstaGene Matrix (BioRad, Hercules, CA, USA) で処理し、99 °C で 30 分間加熱し、室温で 1000×g で 5 分間遠心分離しました。 PCR 分析は、TB Green® Premix Ex Taq™ (Tli RnaseH Plus, Takara, Kyoto, Japan) と B. longum BB536 の特異的プライマー (フォワード; GAACAGGGTGTGCTGAGTGA、リバース; CAAGCGAGAAGATCATCGAA、Gianotti et al., 2006) を使用して実施し、Applied Biosystems 7500/7500 Fast Real-Time PCR System (Thermo Fisher Scientific, Milford, MA, USA) を使用して分析しました。菌株特異的プライマーによって B. longum BB536 と識別されたコロニーのみを定量でカウントしました。検出限界は湿った糞便 1 g あたり 4.30 log10 cfu でした。 |
| 2.3.PMA-qPCR を用いた生きたBifidobacterium longum BB536 の検出 |
| 糞便懸濁液 1 ml サンプルを 20 mM PMAxx 試薬 (Biotium, Fremont, CA, USA) 5 μl と混合し、氷上で暗所で 10 分間インキュベートしました。その後、PMA 処理した懸濁液 800 μl を PhAST Blue 光活性化システム (GenIUL, Barcelona, Spain) を使用して青色 LED 光に 15 分間さらしました。光活性化後、懸濁液 400 μl を 4 °C で 5 分間 10,000 × g で遠心分離しました。ペレットは、以前説明したようにビーズビーティング法を使用して DNA 抽出を行うまで -80 °C で保存しました (Murakami et al.,2021)。定量PCRは、前述のように2回の技術的反復で実施され、検出限界は湿った糞便1gあたり4.80 log10細胞でした。 |
| 2.4.糞便懸濁液に混入したBifidobacterium longum BB536の生存率を評価するための LMT 培養と PMA-qPCR 技術の比較検証 |
| 上記のように、B. longum BB536培養培地を室温で 4,000 × g で 5 分間遠心分離しました。得られた細菌ペレットを再懸濁し、生理食塩水で希釈しました。次に、細菌溶液を糞便懸濁液に組み込み、生理食塩水で糞便を 20 倍 (w/v) に希釈しました。次に、LMT 寒天培地と PMA-qPCR 技術の両方を使用して、糞便懸濁液に導入された B. longum BB536の数と生存率を測定しました。 |
| 2.5.臨床試験の設計 |
| B. longum BB536 が健康な成人の安全性と腸内環境に及ぼす影響を調査するための臨床試験が実施され、B. longum BB536 の生存率が有効性の結果として評価されました。このランダム化プラセボ対照二重盲検試験は、2023 年 9 月から 2023 年 12 月まで、長野県の松本衛生研究所で実施されました。この臨床試験は、日本臨床研究会議の倫理委員会から承認を得ました (登録番号: BYG2B-01、委員会日: 2023 年 8 月 17 日)。研究プロトコルは、大学病院医療情報ネットワーク (UMIN000052110) に登録されました。本研究は、ヘルシンキ宣言(Fortaleza、2013年改訂)および「人を対象とするライフサイエンス研究・医学系研究に関する倫理指針」(文部科学省、厚生労働省、経済産業省告示第1号、2021年)に基づいて実施されました。研究開始前に、参加者全員に手順を十分説明した上で、書面によるインフォームドコンセントを得ました。 |
| 試験は 1 週間の事前観察期間とそれに続く 17 日間の介入期間で構成されました。参加者は、プラセボ グループまたは B. longum BB536 グループの 2 つのグループのいずれかにランダムに割り当てられました。サンプル サイズは、施設で実施できる最大症例数を考慮して計算されました。 |
| 参加者は、独立した調査員による層別ランダム化により、1:1 で 2 つのグループにランダムに分けられました。割り当て順序は、調査終了まで参加者と調査員の両方に公開されず、データベースはロックされました。介入期間中、参加者は割り当てられた製品を 1 日 1 回食後に摂取しました。糞便サンプルは、サンプル収集手順書に記載されているプロトコルに従って、0、3、17 日目に収集されました。 |
| 2.6.参加者 |
| 18~64歳の健康な成人が募集されました。除外基準は、(1)腸内細菌叢に影響を与える薬剤の定期的な使用、(2)乳酸菌、ビフィズス菌、またはオリゴ糖を含む食品またはサプリメントの摂取を中止できないこと、(3)肝臓、腎臓、心臓、肺、胃腸、血液、内分泌、または代謝疾患の存在、またはそれらの重大な病歴、(4)重度の薬物または食物アレルギー、(5)乳糖不耐症または牛乳アレルギー、(6)妊娠、授乳中、または妊娠の可能性、(7)他の臨床試験への参加、および(8)治験責任医師が参加に不適切とみなした状態です。研究開始前に、参加者はスクリーニングを支援するために食事記録と健康管理質問票に記入しました。すべての基準を満たす参加者のみが登録されました。事前観察期間および介入期間を通じて、参加者は主観的な症状、排便、食事摂取を記録する日記をつけました。 |
| 2.7.サプリメント |
| 介入には、B. longum BB536 を 2,000 万 cfu/g 含む市販の発酵乳を使用しました。プラセボは、B. longum BB536 を含まないことを除いて、組成が同一でした。これらの試験食品は、森永乳業 (Tokyo, Japan) から提供されました。試験食品の味、匂い、外観は、独立した調査員によって区別がつかないことが確認されました。参加者は、冷蔵保存され、2 ~ 3 日ごとに交換された 400 g のパッケージから 1 日 100 g を摂取しました。遵守状況は、発酵乳の残量と日記の記入をチェックすることで監視されました。 |
| 2.8.サンプル採取 |
| 糞便サンプル採取は、若干の変更を加えて、前述のとおりに実施しました (Tamura et al., 2017)。簡単に説明すると、糞便サンプルは、尿やその他の便器内容物の汚染を防ぐために、楽流カップを使用して 0、3、17 日目に採取しました (図 1)。サンプルはすぐに糞便採取チューブ C 型 (Asiakizai, Tokyo, Japan) に移し、AneroPouch Kenki (Mitsubishi Gas Chemical Co.,) に封入しました。サンプルは冷蔵容器 (4~8 °C) に保存し、24 時間以内に研究室に輸送しました。 |
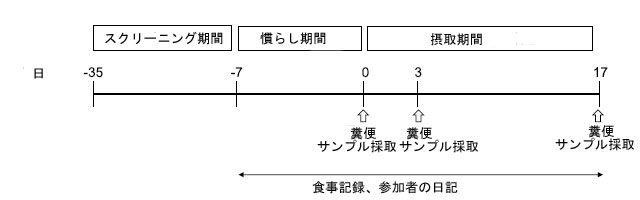 |
| 図 1 臨床試験スケジュール |
| 2.9.統計分析 |
| 試験食品を摂取した無作為に割り当てられたすべての参加者として定義された安全性分析セット (SAF) は、ベースライン特性を比較し、試験食品の安全性を評価するために使用されました。試験期間の 80% 以上にわたって試験食品を摂取した無作為に割り当てられたすべての参加者として定義されたプロトコル セット (PPS) 分析も、摂取した B. longum BB536 の生存率を評価するために実行されました。ベースライン特性は、平均 ± 平均の標準誤差として示されています。スクリーニング時のベースライン特性は、グループ間の年齢と BMI については Student の t 検定、性別についてはカイ 2 乗検定を使用して分析されました。安全性評価に関しては、各グループの発生率 (頻度、確認された有害事象のある参加者の数 / 参加者の総数) を計算しました。グループ間の発生率の差は、Fisher の正確検定によってテストされました。サンプル提出時間の許容範囲は ± 1 日に設定されました。データが欠落している場合は、欠落値として扱われました。統計解析にはIBM SPSS Statistics(ver. 24.0; Armonk, NY, USA)を使用し、フィッシャーの正確検定にはR(ver. 4.3.2)を使用した。P値<0.05を統計的に有意と判定した。 |
| 3 結果 |
| 3.1.BB536 選択培地の開発 |
| 当初、私たちの目的は、プロバイオティクスとして摂取した後の腸管における B. longum BB536 の生存率を評価することでした。しかし、ビフィズス菌の一般的な選択培地である TOS プロピオン酸培地を使用して、37 ~ 42 °C のどの温度で培養しても、B. longum BB536 の選択培養は得られませんでした (表 1)。これに対処するため、既存の TOS プロピオン酸培地を改変して、B. longum BB536 専用の培養培地を開発しました。2 種類の抗生物質を添加したこの改変培地を改変 TOS (mTOS) と名付けました。改変には、ビフィズス菌には影響しない、広範囲のグラム陽性菌に有効な抗生物質であるムピロシンの添加が含まれていました。したがって、乳酸菌の増殖を抑制するために添加されました(Bunesova et al., 2015; Serafini et al., 2011)。さらに、以前の研究では、B. longum BB536 は他のビフィズス菌株と比較してトリメトプリムに対して比較的高い耐性があることが示されました(Xiao et al., 2010)。これらの知見に基づいて、mTOS 培地での B. longum BB536 の選択的増殖を高めるためのこれらの抗生物質の有効性を評価しました。しかし、B. longum BB536 だけでなく、他の B. longum 株も mTOS 培地で繁殖することができました(図 1)。そのため、mTOS 培地のガラクトオリゴ糖をラクトースに置き換えたところ、42 °C でのみ B. longum BB536 が排他的に増殖するようになりました(表 1、図 2)。さらに、LMT培地では、未改変のTOSプロピオン酸培地と比較して、B. longum BB536の増殖は損なわれませんでした。その後、LMT培地の使用により、糞便中に混入した生菌B. longum BB536の効率的な検出が容易になりました(補足表S2)。また、この結果はPMA-qPCR法で得られた結果と同等であることが確認されました。これらの結果は、LMT培地が生菌B. longum BB536の検出に効果的なツールであることを示しています。 |
| 表1 TOS培地およびLMT培地におけるBifidobacterium longum subsp. longum BB536およびJCM1217Tのコロニー形成能※1 |
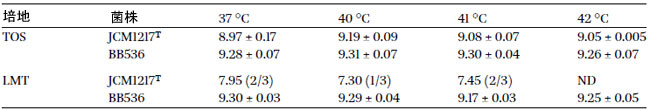 |
| ※1 Log10 cfu/ml値(n = 3)の平均±標準偏差を示します。ND = 3回の繰り返しサンプルすべてで検出されませんでした。検出されなかったサンプルがあった場合は、42 °C()で検出されたサンプルの数での平均値を示しました。 |
 |
図2 mTOSおよびLMT培地におけるBifidobacterium longumのコロニー形成能。 mTOS寒天プレート(左パネル)およびLMT寒天培地(右パネル)上で増殖した17株のB. longumの細菌コロニー。各細菌は42℃で3日間嫌気培養された。 |
| 3.2.腸管におけるBifidobacterium longum BB536の生存率を測定する臨床試験 |
| B. longum BB536 の増殖を促進するために特別に設計された選択 LMT 培地の開発に続いて、摂取後の腸管におけるこの菌株の生存率を測定する臨床試験を実施しました。募集期間 (2023 年 9 月) 中に、スクリーニングされた 52 人のうち 39 人が包含基準を満たし、研究に登録されました (図 3)。ランダム化と割り当ての後、介入前に病気のため 1 人の参加者が脱落しました。そのため、38 人の参加者を SAF に含めました。介入開始後に脱落した参加者はいませんでした。糞便サンプル中の生存 B. longum BB536 を評価する PPS 分析では、試験期間中の試験食品の摂取量が 80% 未満であったことからコンプライアンスが低いことが証明された 4 人の参加者を除外しました。その結果、摂取したプロバイオティクスの生存率について、34 人の参加者が PPS で分析されました。参加者のベースライン特性は表 2 に詳しく示されています。2 つのグループ間でベースライン特性に有意差はありませんでした。 |
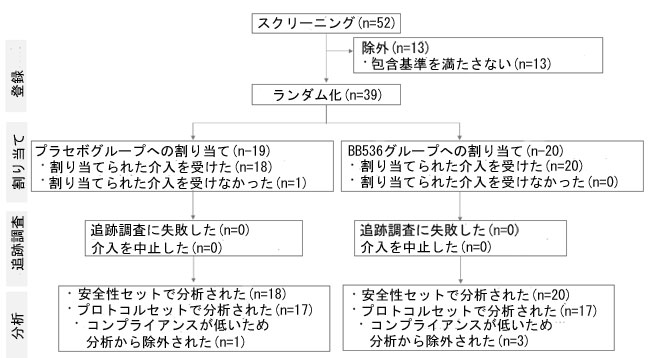 |
| 図3 臨床試験のフロー図 |
表2 安全セットの参加者のベースライン特性※1 |
| ※1 ns = 有意ではない。結果は平均±標準誤差として示されています。年齢とBMIはt検定を使用して実施され、性別はカイ2乗検定を使用して実施されました。 |
| 3.3.生菌Bifidobacterium longum BB536の定量 |
|
介入の有効性を判断するために、参加者のサンプル中の生菌Bifidobacterium longum BB536 を定量しました。補給開始前は、参加者のいずれも検出可能なレベルのBifidobacterium longum BB536 を示しませんでした。プラセボグループ では、3 日目または 17 日目に検出可能なレベルのBifidobacterium longum BB536 を示した参加者はいませんでした。BB536 グループでは、3 日目にBifidobacterium longum BB536 の生菌数は 6.33 ± 0.69 log10 cfu/g 湿便 (分析した参加者 15 人中 14 人)、17 日目に 6.16 ± 0.74 log10 cfu/g 湿便 (分析した参加者 16 人中 13 人) でした (図 4)。さらに、PMA-qPCR 法を使用して、生存 B. longum BB536 細胞のレベルが同程度であることを確認しました。3 日目には 6.09 ± 0.68 log10 細胞/g 湿潤便 (分析した参加者 15 人中 12 人)、17 日目には 6.44 ± 0.64 log10 細胞/g 湿潤便 (分析した参加者 16 人中 15 人) であり、PMA-qPCR が生きた細菌の正確な測定値を提供できることを示しています。対照的に、死細胞と生細胞の両方を定量化する PMA 処理なしの qPCR 法を使用した場合、細菌数に有意な差が見られました。3 日目には 7.38 ± 0.86 log10 細胞/g 湿潤便 (分析した参加者 15 人中 12 人)、17 日目には 7.56 ± 0.45 log10 細胞/g 湿潤便 (分析した参加者 16 人中 14 人) でした。 |
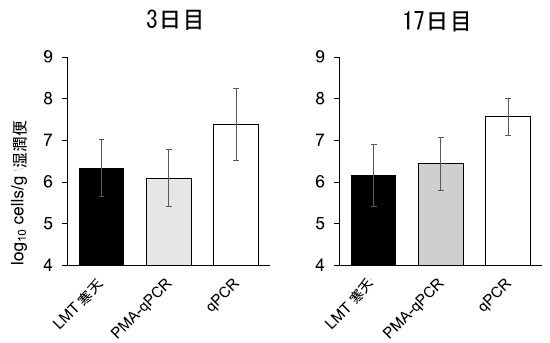 |
| 図 4 糞便サンプル中の B. longum BB536 の定量。培養法、PMA-qPCR 法、q-PCR 法で測定した 3 日目と 17 日目の Bifidobacterium longum BB536 の生細胞数。データは平均 ± 標準偏差として示されています。 |
| 驚くべきことに、培養法と PMA-qPCR 法の両方の結果を組み合わせることで、3 日目と 17 日目の両方ですべての参加者のプロバイオティクスの存在を検出することができました (図 5)。すべての参加者とすべての時点でのこの 100% の検出率は、BB536 株が胃腸環境全体で堅牢に生存し、検出プロトコルが徹底的であることを裏付けています。 |
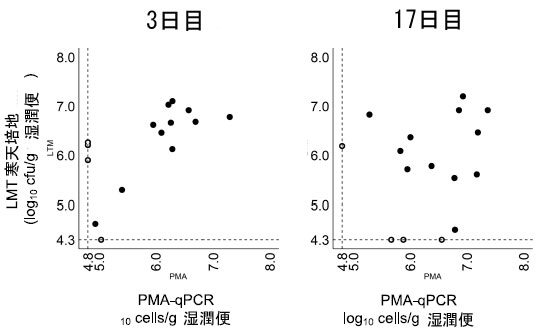 |
| 図 5 LMT 寒天培地または PMA-qPCR で検出された生細胞数の比較。3 日目と 17 日目に LMT 寒天培地で検出された Bifidobacterium longum BB536 の生細胞数と PMA-qPCR で検出された生細胞数の散布図。点線は PMA-qPCR と LMT 寒天培地の検出限界を示しています。白丸は、少なくとも 1 つの方法で検出限界を下回ったサンプルを示しています。 |
| 3.4.安全性評価 |
| 研究期間中、参加者による有害事象が 19 件記録されましたが、いずれも重篤なものではありません。2 つのグループ間で有害事象の発生率に差はなく (プラセボ: 0.28、BB536: 0.25、P 値 = 1.0)、試験食品の摂取に起因する有害事象はありませんでした。 |
| 4. 考察と結論 |
| B. longum BB536 の有効性は、有益な代謝産物の生成によるものと考えられる、多数のヒト臨床試験で十分に実証されています。私たちの研究は、発酵乳で摂取された B. longum BB536 が腸まで輸送されても生き残ることができることを確認しており、その作用機序のさらなる調査に貴重な洞察を提供しています。特に、糞便サンプルで生存状態の B. longum BB536 を検出できたことは、消化管全体で宿主と相互作用する可能性があることを示唆しています。この発見は、今後の研究でさまざまな消化器領域にわたる特定の機能を調査することの重要性を強調しています。 |
| 糞便サンプルから生きたB. longum BB536を定量化する取り組みでは、腸内に内因性のB. longum株が存在するため、大きな課題に直面しました(Derrien et al., 2022)。摂取したB. longum BB536を正確に定量するには、株固有の選択培地の開発が重要でした。炭水化物源の調整、抗生物質の添加、培養温度の調整により、Bifidobacteriumに使用される従来のTOSプロピオン酸培地の選択性を高めることに成功しました。トリメトプリムの補充により、Bifidobacterium breveなどの感受性のあるBifidobacterium種が効果的に抑制されました(Kim et al., 2018; Xiao et al., 2010)。さらに、培養温度を変更することで選択性が大幅に向上しました。ヒト由来のBifidobacteriumの最適温度は 36~38 °C ですが (Ruiz et al., 2011)、B. longum のいくつかの株は 42 °C では生育できませんでした。これらの変更により、B. longum BB536 の選択性が向上しましたが、この選択性の向上を促す正確なメカニズムはまだ解明されていません。1 つの仮説は、B. longum BB536 のストレス応答遺伝子が培養培地の組成の影響を受け、特に胃酸に対する強力なストレス耐性に寄与している可能性があるというものです (Liong et al., 2005)。ただし、詳細なメカニズムを明らかにするには、転写産物の分析を含むさらなる研究が必要です。 |
| 当社が新たに開発した選択培地は、被験者の B. longum BB536 を検出する上で、一般的に PMA-qPCR 法と同等の有効性を示しました。しかし、一部の被験者では、どちらか一方の方法でのみ B. longum BB536 が検出されるという矛盾が生じました。問題は、B. longum BB536 に干渉する可能性のある非選択細菌の増殖が、選択培地の使用時に制限をもたらしたことです。これらの障害を克服するには、選択培地をさらに改良して精度を向上させることが重要です。それでも、ほとんどの場合に観察された高い選択性は、LMT 寒天培地の有効性を裏付けています。 |
| さらに、一部のBifidobacteriumは、特定の条件下では生存可能だが培養不可能な(VBNC)状態になることが知られています。この状態では、細胞膜の完全性は維持されますが、培養できません(Sibanda et al.、2024)。この VBNC 状態は、死細胞の存在とともに、PMA 処理によって検出される細菌細胞数に寄与する可能性があります。逆に、B. longum BB536 が LMT 寒天法でのみ検出されたことは、これらの細胞が細胞膜に損傷を受けているものの、最適な増殖条件下では生存可能であることを示唆しています。宿主由来因子または他の腸内細菌によって引き起こされる可能性のある、またはサンプル処理の遅延による細胞膜の損傷により、PMA 染色が可能になり、好ましい条件での培養が依然として可能になる可能性があります。この中間の生存状態の細菌の検出は、PMA-qPCR と培養ベースの方法の間の矛盾を説明できる可能性があります。しかし、いずれの方法でも参加者のサンプルに B. longum BB536 が検出されなかったという事実は、B. longum BB536 の生存率が高いことを示しています。 |
| これらの臨床サンプルでは、2 つの分析方法は 3 日目に良好な相関を示しましたが、17 日目にわずかな相違が見られました (図 5)。この相違は、試験食品中の B. longum BB536 の生存条件の変動に起因する可能性があります。以前の研究では、特定のプロバイオティクス Bifidobacteriumが保存期間中に発酵食品中で生存可能だが VBNC 状態になる可能性があることが報告されています (Lahtinen ら、2008)。これは、試験食品の異なるバッチが B. longum BB536 の状態に影響を与え、培養法と PMA-qPCR 法から得られる結果にばらつきが生じる可能性があることを示しています。さらに、ストレス環境も細菌の VBNC 状態を引き起こす可能性があることが観察されています (Wendel、2022)。これは、試験期間中の腸内環境の変化が摂取した B. longum BB536 の状態にも影響を及ぼし、17 日目の結果に観察された相違にさらに寄与している可能性があることを示唆しています。これらの考慮事項を考慮すると、培養法と PMA-qPCR 法を組み合わせて使用することは、試験食品バッチの違いや腸内環境の変化などの要因による細菌状態の潜在的な変動を説明するのに役立つ可能性があるため、生存可能なプロバイオティクス株の包括的な検出に有益である可能性があります。 |
| 結論として、私たちの研究結果は、LMT 寒天培地が糞便サンプル中の B. longum BB536 の定量に有効であることを実証し、発酵乳を毎日摂取した後の胃腸管におけるプロバイオティクスの生存力と機能活性を裏付けています。さらに、LMT 培養と PMA-qPCR の相補的な役割により、包括的な検出戦略が保証されます。これらの研究結果は、消化器系を通過して生き残り、腸の健康にプラスの効果を発揮する可能性のある有益なプロバイオティクス株としての B. longum BB536 の可能性を強調しています。私たちの研究で観察されたこの株の堅牢性は、人間の健康を促進するためのさらなる研究と利用の可能性を強調しています。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Beneficial Microbes (2024) DOI:10.1163/18762891-bja00055に掲載されたProbiotic viability in the gastrointestinal tract in a randomised placebo controlled trial: combining molecular biology and novel cultivation techniques. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


