ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(ヨーグルト、ビフィズス菌:研究の最前線) |
Bifidobacterium longumの補給は加齢に伴う骨折治癒の遅れを改善する |
Joseph L. Roberts et al., |
|
|
| 要約 |
加齢に伴う骨修復の遅れは、痛みや苦しみを長引かせる可能性がある重要な臨床問題です。炎症は加齢とともに増加し、この悪化した炎症反応が骨格再生に影響を与える可能性があることは、現在では十分に確立されています。最近、有益なプロバイオティクス細菌の単純な食事補給が、若いマウスの骨折修復に影響を与えることが示されました。しかし、腸内細菌叢が加齢に伴う骨折治癒の障害にどのように寄与しているかは不明です。ここでは、有益なプロバイオティクスの単一種であるBifidobacterium longum (B. longum),の補給が、高齢(18 か月齢)の雌マウスの骨折修復を促進するかどうかを調べました。B. longumの補給により、骨の仮骨形成が促進され、骨折した四肢の機械的特性が改善されることがわかりました。B. longumのこれらの再生促進効果は、腸管バリアの維持、全身性炎症の緩和、および微生物叢コミュニティ構造の維持によるものと考えています。さらに、B. longum は骨折によって引き起こされる全身病の多くを軽減しました。私たちの研究は、シンプルな食事療法で腸内細菌叢をターゲットにすることで、骨折の治癒結果を改善し、加齢に伴う全身病を最小限に抑えることができるという証拠を示しています。 |
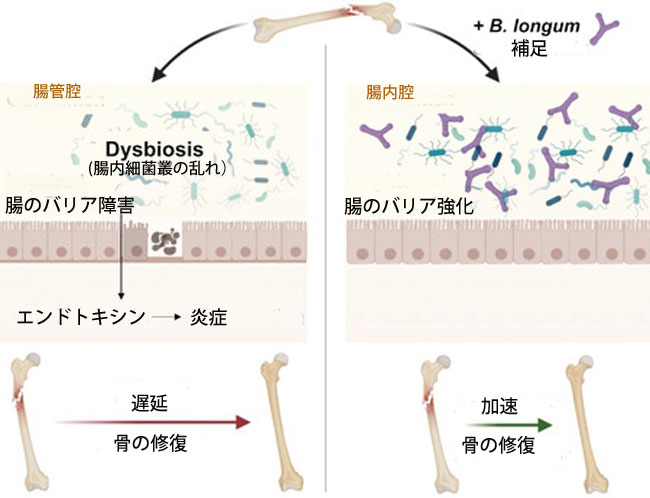 |
| プロバイオティクス種Bifidobacterium longum (B. longum),を食事に補給すると、高齢マウスの大腿骨骨折の修復が促進され、骨折による全身的影響の多くが軽減されました。Bifidobacterium longum の補給により、腸の漏れが防止され、炎症が抑えられ、骨の修復中ずっと腸内細菌叢のコミュニティ構造が維持されました。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.方法 |
| 2.1. 動物 |
| 2.2. 細菌培養 |
| 2.3. プロバイオティクス治療 |
| 2.4. 骨折モデル |
| 2.5. マイクロコンピュータ断層撮影 |
| 2.6. 組織学および静的組織形態計測 |
| 2.7. 二重エネルギーX線吸収測定法(DXA)分析 |
| 2.8. ねじり力学 |
| 2.9. レントゲン写真スコアリング |
| 2.10. 遺伝子発現 |
| 2.11. 血清分析 |
| 2.12. 腸管透過性アッセイ |
| 2.13. シーケンシング |
| 2.14. 統計およびバイオインフォマティクス分析 |
| 3.結果 |
| 3.1. Bifidobacterium longumは外傷後の体重減少と腰椎骨損失を軽減する |
| 3.2. Bifidobacterium longumの補給は二次骨修復を加速し、強化します |
| 3.3. Bifidobacterium longum は骨折治癒中に腸管バリアの完全性を維持する |
| 3.4. Bifidobacterium longum の補給は骨折に対する全身炎症反応を鈍らせる |
| 3.5. Bifidobacterium longum の補給は骨折後の腸内細菌叢コミュニティ構造を安定化させる |
| 4.考察 |
本文 |
| 1.はじめに |
| 正常な老化は、骨を含むほぼすべての組織に影響を及ぼすさまざまな生理学的変化と関連しています。加齢とともに骨吸収速度が加速し、骨が弱くなり骨折しやすくなります (Demontiero et al.,2012)。残念ながら、高齢者は自然に治癒力が低下し、骨の治癒が大幅に遅れて患者の苦痛が長引くことになります (Nieminen et al.,1981; Nikolaou et al.,2009)。高齢マウスでは骨折の治癒も遅れ(Clark et al., 2020; Clement et al., 2022; Liu et al., 2022; Naik et al., 2009)、これらの骨折は若いマウスと比較して、炎症の増加(Emami et al., 2019)、外傷後の骨量減少(Ely et al., 2020; Emami et al., 2019)、および疼痛(Majuta et al., 2018)を含む悪化した全身反応を引き起こします。骨折誘発性後遺症の多くを同時に軽減しながら骨の修復を加速できる新しい戦略を特定することは、高齢者集団にとって特に興味深いことです。 |
| 加齢はまた、腸内細菌叢のコミュニティ構造の大きな分類学的変化と関連しており、それが虚弱性と関連しています (Langille et al., 2014; Shin et al., 2021)。骨折を含む外傷も腸内細菌叢の組成を変える可能性があり、これが筋骨格系の健康と疾患の重要な要因として浮上しています (Li et al., 2021; Steves et al., 2016; Vitetta et al., 2013)。微生物叢のコミュニティ構造に一時的に影響を与える一般的な戦略は、プロバイオティクスと呼ばれる生きた細菌を食事から補給することであり、十分な量を摂取すると健康上の利点が得られます (Tyagi et al., 2018; Wieërs et al., 2019)。プロバイオティクス種のほとんどはLactobacillus 属とBifidobacterium属に属しており、そのうちのいくつかは急速な骨代謝において骨保護特性があると報告されています(Collins et al., 2017)。これらの有益な効果は、炎症と腸機能の調整に起因することが多い(Collins et al., 2017)。最近では、骨修復中のプロバイオティクスの有益な役割が調査されています。若いマウスにプロバイオティクス種Bifidobacterium adolescentis を補給すると、軟骨仮骨のリモデリングが加速され、腸の漏れや炎症など、大腿骨骨折に対する全身反応の多くを減弱させることが報告されました(Roberts et al., 2020)。同様に、その後の報告では、若いマウスにプロバイオティクス種のAkkermansia muciniphilaまたはLactobacillus gasseriを補給すると、腸管透過性と炎症を軽減する同様のメカニズムを通じて骨の治癒を促進できることが実証されました(Liu et al.,2020)。骨折からの回復中のプロバイオティクスの有益な効果は、Lactobacillus casei Shirotaを摂取した高齢患者で報告されており、橈骨遠位部、上腕骨、肋骨の骨折からの回復を通じて痛みと機能的転帰が大幅に改善しました(Lei et al.、2016、2018; Zhang et al.、2019)。 |
| Bifidobacterium longum(B. longum)はグラム陽性嫌気性先駆菌種であり、健康な乳児および成人の消化管内で最も多く存在するBifidobacterium 種です(Ouwehand et al., 2008; Turroni et al., 2012)。 B. longum には、腸機能の改善や腸管透過性の低下 (Chen et al., 2011; Pitkala et al., 2007)、炎症の軽減 (Chen et al., 2011; MacSharry et al., 2012; Ouwehand et al., 2008; Sapra et al., 2022)、卵巣摘出による骨量減少の予防 (Montazeri‐Najafabady et al., 2021; Parvaneh et al., 2015; Sapra et al., 2022)、マイクロバイオームの多様性への影響 (Ouwehand et al., 2008) など、多くの健康促進効果があるとされています。本研究では、一般的に摂取されているプロバイオティクス種であるB. longumの補給が、二次骨修復の自然な遅延を示す老齢マウスの骨折治癒を促進し、外傷後後遺症を軽減するかどうかを調査しました。単一のプロバイオティクス種であるB. longumの補給により、仮骨の増加と生体力学的特性の改善によって示されるように骨折治癒が促進され、外傷後の骨量減少から無傷の骨格が保護されることが実証されました。これらの有益な効果は、腸機能の維持、炎症の緩和、骨折誘発性の腸内細菌叢異常の抑制に起因すると考えられます。 |
| 2.方法 |
| 2.1. 動物 |
| 17 か月齢のメスの C57BL/6JN マウスを国立老化研究所から入手し、1 か月間飼育環境に順応させました。マウスは、滅菌 (放射線照射) された押し出し飼料 (Envigo #2918) と水 (0.1 ミクロンろ過) を自由に摂取できました。この飼料には、18% のタンパク質 (カロリーの 24%)、44% の有効炭水化物 (カロリーの 58%)、および 6% の脂肪 (カロリーの 18%) が含まれており、これは 3.1 kcal/g に相当します。すべてのマウスは、アトランタ退役軍人医療センター(VAMC)の飼育施設で、トウモロコシの芯の敷き藁と巣が入った特定の病原体を除去したケージに、管理された環境(温度:21〜24℃、湿度:40%〜70%、明暗サイクル:12時間/12時間)でグループ飼育されました(n = 3〜5匹/ケージ)。この順応期間中、ケージが微生物群集構造に与える影響を最小限に抑えるため、敷き藁はケージ間で繰り返し交換されました。経口投与開始の1週間前に、マウスはランダムにケージ間で入れ替えられました。すべての実験は、NIHの実験動物の飼育および使用に関するガイドラインに従って実施され、アトランタVAMCの動物実験委員会(承認番号V017‐19)の承認を受けています。 |
| 2.2. 細菌培養 |
| Bifidobacterium longum subsp. longum Reuter (B. longum ATCC #15707) を、9% オキシラーゼ (Sigma-Aldrich #SAE0013) を含む強化クロストリジウム培地で嫌気条件下で 37°C で約 24 時間培養しました。経口投与の前日には、細菌を 3000 × g で遠心分離し、培地を吸引し、滅菌PBS(訳者注:リン酸緩衝生理食塩水)で合計 2 回洗浄しました。ペレットを滅菌PBSに再懸濁し、経口投与に使用しました。 |
| 2.3. プロバイオティクス治療 |
| 1 か月の順応期間後、マウスは無作為に滅菌PBS(100 μl、Life Technologies) または 1 × 108 ~ 1 × 109 CFU の B. longum を 1 日 1 回経口投与されるよう割り当てられました。2 週間の補給後、1 つのコホートのマウスが骨折前に殺処分されるように無作為に選択され、0 日目 (またはベースライン) と呼ばれ、残りのマウスは以下に説明するように骨折させられました。すべてのマウスは、骨折後 3、7、14、21、または 35 日間、割り当てられた治療を受け続けました。マウスは、校正済み天秤を使用して毎日体重を測定されました (n = 10/グループ)。 |
| 2.4. 骨折モデル |
| 大腿骨骨折は、以前に説明したとおりに作成しました (Paglia et al., 2020; Roberts et al., 2021)。簡単に説明すると、マウスをイソフルランで麻酔し、鎮痛剤 (ブプレノルフィン SR) を投与し、左後肢を剃毛してクロロヘキシジンとイソプロパノールで洗浄しました。次に、大腿骨顆間切痕の関節面を 25 ゲージの針で皮膚に穿孔し、続いて滅菌したステンレス鋼 316LVM ワイヤー (直径 0.16 インチ) を髄管に挿入しました。次に、鈍角ギロチン装置による 3 点曲げを使用して、骨幹中央部の横断骨折を作成しました。骨折した四肢は、骨折位置とピンの位置を確認するために、骨折直後にデジタル X 線 (Bruker) で放射線検査されました。重度の粉砕骨折、遠位骨折、または近位骨折を患った動物は、組織学的研究およびマイクロコンピュータ断層撮影(μCT)研究から除外されましたが、骨折の全身的影響を評価するための他の結果には使用されました。マウスは麻酔から回復した後、完全に体重を支えることができました。 |
| 2.5. マイクロコンピュータ断層撮影 |
| マイクロコンピュータ断層撮影 (μCT) は、μCT40 スキャナ (Scanco Medical AG) を使用して、6 μm の等方性ボクセル サイズ (70 kVp および 114 mA、積分時間 200 ms) で骨折した大腿骨および L3 椎骨に対して実施されました。骨は 4°C で 10% 中性緩衝ホルマリンで 1 週間固定し、その後 PBS培地でスキャンしました。骨折仮骨の分析では、既存の皮質骨および骨片を除外するために仮骨全体を手動でセグメント化しました。14 日目 (n = 5~7/グループ) および 21 日目 (n = 6~9/グループ) に、各骨折仮骨について、仮骨構造および組成の以下の測定値を定量化しました: 総仮骨体積 (TV)、石灰化仮骨体積 (BV)、および骨体積率 (BV/TV)。自動輪郭機能を使用して、頭側から尾側にかけての L3 椎体内の海綿骨を ex vivo で測定しました。椎体の海綿骨構造と組成の以下の指標を、約 350 枚のスライス (n = 7~8/グループ) から定量化しました: 骨体積率 (BV/TV)、海綿骨厚 (Tb.Th)、海綿骨数 (Tb.N)、骨表面密度 (BS/BV)、および構造モデル指数 (SMI)。 |
| 2.6. 組織学および静的組織形態計測 |
| 骨折した大腿骨 (n = 4~5/群) を 10% 中性緩衝ホルマリンで 4°C で 1 週間固定し、その後、14% EDTA (pH 7.2) で 3~4 週間室温で穏やかに振とうして脱灰しました。脱灰した大腿骨はその後脱水し、パラフィンに包埋し、切片 (厚さ 7 μm) にしました。その後、組織切片を段階的な一連のアルコールで再水和し、サフラニン O/ファスト グリーンで染色して軟骨と骨を可視化しました。仮骨のサイズ、仮骨軟骨、および仮骨骨は、Osteomeasure (Osteometrics) を使用して定量化しました。骨折仮骨を含む軟骨と骨の割合は、組織を仮骨の合計サイズに対して正規化することによって決定しました。 |
| 2.7. 二重エネルギーX線吸収測定法(DXA)分析 |
| マウス(n = 10/群)はイソフルラン吸入麻酔で麻酔された。腰椎(L1~L5)の骨密度と骨ミネラル含有量は、骨折前、および骨折後7、14、21、35日目に、Kubtec 4パラメータキャビネットX線システム(40 KV、1000µA)とKubtec DIGIMUS BMD分析ソフトウェアを使用して縦断的に測定された。 |
| 2.8. ねじり力学 |
| 骨折後 35 日目に、骨折した大腿骨 (n = 8~9/群) からすべての軟部組織を取り除き、冷たい PBSに浸したガーゼで包み、試験時まで -20°C で保管しました。試験当日、大腿骨を室温まで解凍し、髄内ピンを取り外し、遠位端と近位端をポリメチルメタクリレート (Stoelting Co.) を充填した 1 cm2 のアルミニウム キューブに封入しました。各骨のゲージ長、前後径、内外径をノギスで測定しました。ねじり力学試験は、5 Nm ロードセルを備えた校正済み Instron 68-SC を使用して実施しました。ねじりは、破損するまで骨の近位端に 0.5 N-M/分で加えられました。データは、MATLAB (MathWorks r2021a) のカスタム コードを使用して分析されました。最大破壊トルク、剛性、剛性、強度、破壊時のエネルギーなどの生体力学的特性は、以前に説明したデータから計算されました(Díaz‐Hernández et al.、2022)。 |
| 2.9. レントゲン写真スコアリング |
| 骨折後35日目の骨折のレントゲン写真(n = 8~9/群)について、2名の独立した評価者が質的分析を行った。X線は、Bruker in-vivo Xtreme 4MPイメージングシステムを使用して、屠殺時に取得された。レントゲン写真はコード化され、観察者は治療群について盲検化された。検証済みの3カテゴリーのレントゲン写真スコアリングシステムを使用して、骨折治癒を(i)骨膜および骨内膜反応、(ii)仮骨不透明度、および(iii)皮質リモデリングおよびブリッジングによって評価した(Roberts et al., 2021)。骨膜および骨内膜反応は、骨折部位を横切るブリッジングを評価するために4点スコアリングシステム(スコア:0~3)を使用して決定した。仮骨不透明度は、仮骨の石灰化を評価するために4点スコアリングシステム(スコア:0~3)を使用して決定した。皮質のリモデリングとブリッジングは、目に見える皮質の数と髄質管が明確に区別されているかどうかを判断するために、5 段階のスコアリング システム (スコア: 0 ~ 4) を使用して決定されました。 |
| 2.10. 遺伝子発現 |
| 十二指腸と近位結腸に相当する小腸の約 1 cm の切片を採取し、急速冷凍し、分析まで -80°C で保存しました。組織をホモジェナイズし、TRIzol (Invitrogen) を使用して全 RNA を単離しました (n = 4~5/グループ/時点)。第一鎖 cDNA は、qScript cDNA SuperMix (Quantabio) を使用してオリゴ (dT) およびランダムプライマーで合成しました。すべての qRT-PCR は、PerfeCTa SYBR Green FastMix (Quantabio) を使用して Analytik Jena qTower3 G リアルタイム PCR 検出システムで実施しました。アンプリコンの真正性は、融解曲線分析によって確認しました。プライマー配列は表 S1 に示されており、β-アクチンは正規化コントロールとして使用されました。データは、各治療群内で遺伝子の発現レベルをベースライン (骨折前) 値と比較する ΔΔCT 法を使用して分析されました。 |
| 2.11. 血清分析 |
| マウスはイソフルランを使用して麻酔し、採取時に心臓穿刺により全血を採取し、室温で30分以上凝固させた後、10,000 gで10分間遠心分離した。全身性サイトカインは、エモリーマルチプレックス免疫アッセイコアで製造元の指示に従って、骨折後3日目(n = 5/グループ/時点)および7日目(n = 6/グループ/時点)に採取した血清を使用して、16種類のサイトカインとケモカインのMeso Scale Discovery U-Plex電気化学発光アッセイを使用して測定した。調査したマーカーは、EPO、GM-CSF、IFN-γ、IL-1β、IL-6、IL-10、IL-16、IL-17a、IL-21、IL-22、IL-23、IL-33、MCP-1、SDF-1α、TNF-α、VEGF-αでした。すべての因子の検出限界以下の濃度は、定量下限値の半分として記録されましたが、IL-23とIL-21はサンプルの半分以上で検出されなかったため、分析から除外されました。リポ多糖結合タンパク質(LBP、Abcam #ab269542)とリポカリン-2(LCN2、Abcam #ab199083)は、製造元の推奨に従って酵素結合免疫吸着測定キットを使用して測定しました(n = 4~5/グループ/時点)。血清エンドトキシン濃度を評価するために、血清サンプル(n = 4~6/グループ/時点)をパイロジェンフリー水で100倍希釈し、70℃で15分間加熱しました。エンドトキシン濃度は、製造元の指示に従って、Pierce Chromogenic Endotoxin Quant Kit(#A39552; Thermo Scientific)を使用して定量しました。 |
| 2.12. 腸管透過性アッセイ |
| マウス(n = 6~7/群)を4時間絶食させ、その後、滅菌PBS(Invitrogen)中の80 mg/mLフルオレセインイソチオシアネート-デキストラン4(FITC-デキストラン MW: 3~5 kDA、Sigma-Aldrich #FD4)を150 μl/マウスで経口投与した。さらに4時間絶食させ、食物や水を与えずに尾をイソプロピルアルコール綿棒で拭き取り、滅菌メスの刃で切り傷をつけた。ヘパリン処理した毛細管で血液を採取し、4°Cで3000 g、10分間遠心分離して血漿を分離した。血漿 FITC デキストラン濃度は、Spectramax M2 プレートリーダー (Molecular Devices) を使用して、励起波長 485 nm、蛍光波長 528 nm を測定することで決定しました。血漿 FITC デキストラン濃度の評価は、同じマウスで縦断的に評価しました。 |
| 2.13. シーケンシング |
| 糞便ペレット(約50 mg)をマウス(n = 4/群)から縦断的に採取し、分析まで-80°Cで保存しました。DNA抽出、シーケンシング、バイオインフォマティクスはMicrobiome Insightsによって完了しました。簡単に言うと、糞便DNAはQiagen MagAttract PowerSoil DNA KFキットを使用して抽出しました。ライブラリは、社内プロトコル(Illumina)を使用してIllumina Nexteraライブラリ調製キットを使用して調製しました。ペアエンドシーケンシング(150 bp × 2)は、中出力モードのNextSeq 500で完了し、シーケンスリードはSunbeamパイプラインで処理されました。初期品質評価はFastQC v0.11.5を使用して完了しました。処理は、アダプターの除去、リードトリミング、低複雑性リードの除去、およびホストシーケンスの除去の4つのステップで行われました。アダプターの除去はcutadapt v2.6を使用して行われました。トリミングは、カスタムパラメータ(LEADING:3 TRAILING:3 SLIDINGWINDOW:4:15 MINLEN:36)を使用してTrimmomatic v0.36で行われました。低複雑性の配列はKomplexity v0.3.6で検出されました。高品質のリードは、ヒトゲノム(Genome Reference Consortium Human Reference 37)とマウスMus musculus(ハツカネズミ)ゲノムアセンブリGRCm38.p6にマッピングされ、それにマッピングされ、リード長の60%にわたって少なくとも50%の類似性を持つリードは削除されました。残りのリードは、2021‐05‐17のPlusPFデータベースでKraken2を使用して分類学的に分類されました。 |
| 2.14. 統計およびバイオインフォマティクス分析 |
| 結果は平均±SDとして示されています。統計的有意性は、GraphPad Prismソフトウェア(バージョン9.4.1)を使用して、図の凡例に示されているように、対応のない両側スチューデントt検定、マン・ホイットニーU検定、またはシダックの事後検定を伴う2元配置分散分析によって決定されました。すべての統計検定は5%の有意水準で実施されました。外れ値はROUT法(Q = 1%)を使用して特定され、適切な場合はデータセットから削除されました。血清サイトカインのヒートマップを生成するために、値は最初に対数変換され、次にZスコアに変換されました。微生物のアルファ多様性は、生のOTU存在量に対するシャノン多様性指数を使用して推定されました。ベータ多様性は、OTUを使用してブレイ・カーティス指数を計算して推定されました。ベータ多様性は主座標分析 (PCoA) を使用して視覚化され、群集構造の変動は順列多変量分散分析 (PERMANOVA) を使用して評価されました。分類学的特徴の差異的存在量検定のための負の二項モデル (DESEq2 R パッケージ) は、時点間のグループ間の差異 (時点:グループの相互作用) について調べられました。p 値は尤度比検定で計算され、調整済み p 値 = 0.01 でした。サンプルの 10% 未満に存在する分類群は、偽陽性を減らすために除外されました。Sidak の多重比較検定による 2 元配置分散分析を使用して、すべての時点での変化を比較しました。すべての分析は、Microbiome Insights によって R 環境で実施されました。 |
| 3.結果 |
| 3.1. Bifidobacterium longumは外傷後の体重減少と腰椎骨損失を軽減する |
| 高齢の雌マウス(18か月齢)を、1か月の順応期間後、毎日経口投与により候補プロバイオティクス種であるB. longumまたは対照群に無作為に割り当てた。2週間の補給後、マウスは片側閉鎖式中大腿骨骨幹部骨折を受け、骨折後の指定された時点で治癒およびその他の結果を評価した(図1a)。マウスは殺されるまで毎日それぞれの治療を受け続けた。骨折前(補給前2週間)には、体重、肝臓重量、または脾臓重量にグループ間で有意差はなかった(図S1a~c)。骨折後、PBS(−12%)およびB. longum(−9.7%)を投与されたマウスの両方で、骨折後4日目までに早期かつ急速な体重減少が見られました(図1b)。しかし、B. longumは骨折後早期(2、3、4、6、8日目)のこの体重減少を有意に緩和しました。屠殺時のマウスの肉眼的剖検では、グループ間で組織病理学的差異は明らかにされませんでした。さらに、骨折後3日目に、B. longumを補給されたマウスで肝臓重量の有意な増加と脾臓重量の減少が見られました(図S1b、c)。 |
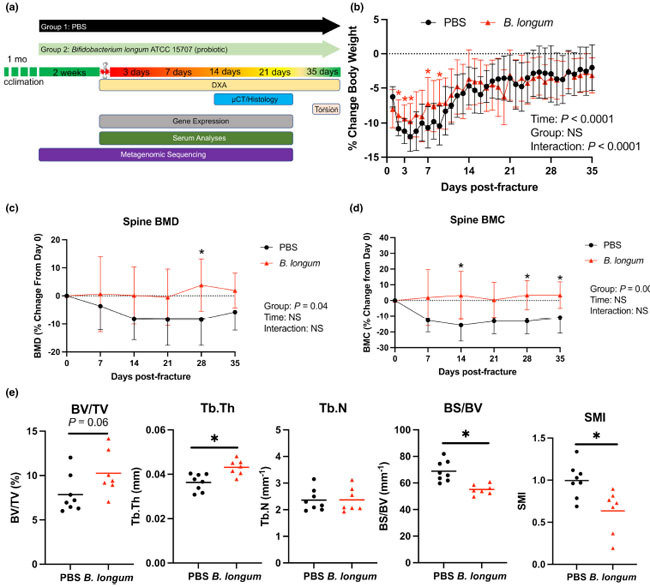 |
図 1 Bifidobacterium longum の補給は、外傷後の体重減少と腰椎内の骨量減少を軽減します。 PBS: リン酸緩衝生理食塩水 (a) 18 か月齢の雌マウスをランダムに割り当て、2 週間 PBS (溶媒対照) または B. longum (プロバイオティクス) を投与した後、大腿骨骨折を作製し、治癒と全身効果を評価する研究デザイン。 (b) Bifidobacterium longum の補給は、骨折後早期の体重減少を鈍化させました。データは、骨折前 (0 日目) の体重からのパーセンテージ変化として表されます。2 元配置分散分析に続いて Sidak の多重比較検定を実施、* PBS と比較して p < 0.05 (n = 10/グループ)。 B. longum 腰椎 (L1–L5) の変化 (c) 骨密度 (BMD)、および (d) 骨ミネラル含有量 (BMC)。データは骨折前(0日目)の値からの変化率として表されます。二元配置分散分析に続いてSidakの多重比較検定を実施、*PBSと比較してp < 0.05(n = 10/グループ)。 (e)Bifidobacterium longum の補給により、骨折後35日目のL3椎体内の海綿骨の骨梁厚さ(Tb.Th)、骨表面密度(BS/BV)が増加し、構造モデル指数(SMI)が減少しました。スチューデントt検定、*p < 0.05(n = 7-8/グループ)。各データポイントは独立した観察を表します。 |
| さらに、腰椎の縦断的 DXA 分析により、B. longum 補給により、PBS コントロール マウスで観察された外傷後の骨密度 (BMD) (図 1c) および骨ミネラル含有量 (BMC) (図 1d) の減少から腰椎が保護されることが実証されました。L3 椎体内の海綿骨のマイクロ CT 分析では、B. longum 補給マウスでは骨折後 35 日目に海綿骨の厚さ (Tb.Th) が有意に高く、骨表面密度 (BS/BV) が有意に低いことが実証されました (図 1e)。プロバイオティクスの B. longum を摂取したマウスでは構造モデル指数 (SMI) が有意に低く、海綿骨構造がより板状の形状になっていることを示しています (図 1e)。これらのデータを合わせると、B. longum は高齢マウスに病理学的影響を及ぼさず、大腿骨骨折によって引き起こされる全身病を軽減できる可能性があります。 |
| 3.2. Bifidobacterium longumの補給は二次骨修復を加速し、強化します |
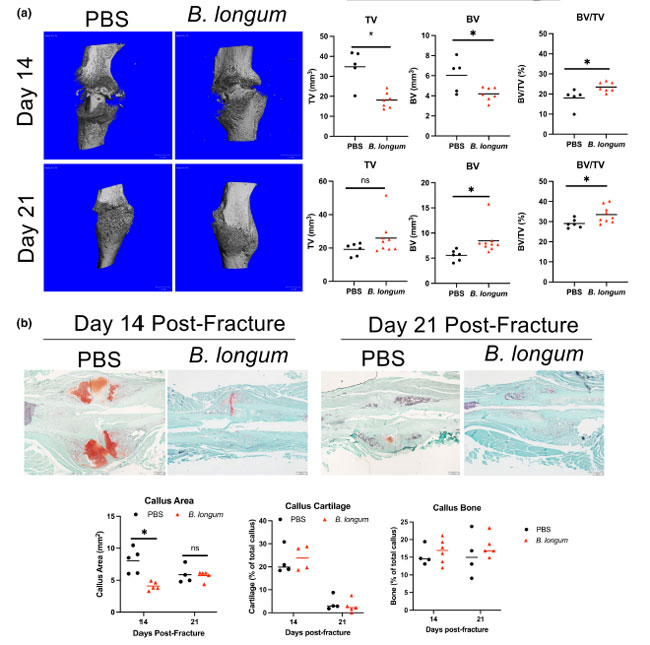
| マイクロCTによる仮骨骨含有量の評価により、B. longumを補給したマウスでは仮骨総量 (TV) (-48%) と骨量 (BV) (-31%) が大幅に減少し、骨折後14日目に仮骨骨量率 (BV/TV) が30% 増加しました (図 2a)。骨折後21日目には、グループ間で仮骨総量に差は見られませんでしたが、B. longumを補給したマウスでは仮骨骨量(+53%) と 仮骨骨量率(BV/TV) (+15%) が大幅に増加しました (図 2a)。組織形態計測分析による仮骨組成のさらなる評価により、骨折後14日目にB. longumを補給したマウスの仮骨サイズが小さい (-49%) ことが確認されました (図 2b)。しかし、組織形態計測では、骨折後14日目または21日目に、グループ間で仮骨軟骨または骨含有量に有意差は観察されませんでした(図2b)。 |
 |
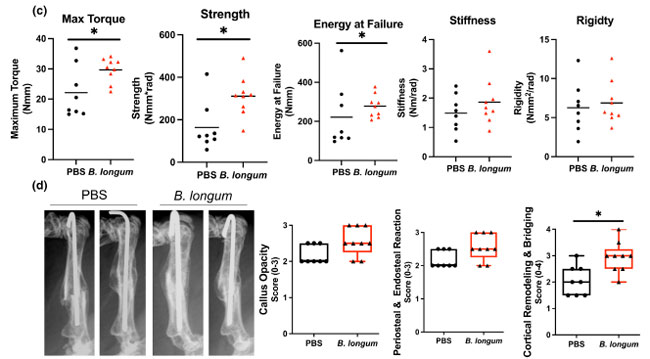 |
図 2 Bifidobacterium longum の補給は骨の修復を加速し、強化します。 PBS: リン酸緩衝生理食塩水 (a) 骨折後 14 日目に骨折仮骨をマイクロ CT 分析したところ、B. longumを補給したマウス (n = 5~7/群) では仮骨サイズ (TV) と骨量 (BV) が有意に減少し、仮骨骨量率 (BV/TV) が増加しました。骨折後 21 日目に、B. longumを補給したマウス (n = 6~9/群) では仮骨骨量 (BV)と仮骨骨量率 (BV/TV)が有意に増加しました。スチューデント t 検定、*p < 0.05。 (b) 組織形態計測分析では、骨折後 14 日目にB. longumを補給したマウスで仮骨サイズの減少が見られました。スチューデント t 検定、*p < 0.05 (n = 4~5/群)。 ROUT 法を使用して、仮骨軟骨で外れ値を特定しました (除外値 0.135%)。 (c) Bifidobacterium longum の補給により、骨折後 35 日目に骨折した骨の最大トルク、強度、および破壊時のエネルギーが増加しました。スチューデント t 検定、*p < 0.05 (n = 8~9/グループ)。 (d) 骨折後 35 日目に各グループから 2 つの代表的な大腿骨のレントゲン写真とレントゲンスコアリングにより、B. longum補給マウスで皮質ブリッジングとリモデリングが増加していることがわかります。 マン ホイットニー U 検定、*PBS と比較して p < 0.05 (n = 7~9/グループ)。各データ ポイントは独立した観察を表します。 |
| 次に、B. longum を補給したマウスで観察された骨仮骨の増加が、骨折した骨の強度を評価するための推奨方法であるねじり試験を使用して、機械的特性の改善につながるかどうかを調べようとしました (Knox et al., 2021)。骨折後 35 日目に骨折した大腿骨をねじる生体力学的試験では、B. longum を毎日補給したマウスで最大トルク (+38%)、強度 (+81%)、破損時エネルギー (+25%) が増加することが明らかになりました (図 2c)。グループ間で剛性や固さに有意差は認められませんでした。骨折後 35 日目に骨折した仮骨のレントゲンスコアリングを行ったところ、B. longum を補給したマウスで皮質リモデリングとブリッジングが有意に増加していることが明らかになりました (図 2d)。これらのデータを合わせると、B. longum の補給により高齢マウスの骨折治癒の経過が加速されることが示されています。 |
| 3.3. Bifidobacterium longum は骨折治癒中に腸管バリアの完全性を維持する |
| プロバイオティクスは腸管バリアを引き締めることで宿主の生理機能に部分的に影響を及ぼしますが、我々や他の研究者は、若いマウスの外傷性骨損傷後に腸管バリアが破壊されることを報告しています(Liu et al., 2020; Roberts et al., 2020)。しかし、老化の状況における骨折誘発性腸管透過性に対するプロバイオティクスの影響は不明のままです。骨折前は、グループ間で腸管透過性に差はありませんでした。しかし、大腿骨閉鎖骨折は、血漿 FITC デキストラン濃度で評価したところ、骨折後 3 日目に PBS 投与マウスで腸管透過性の有意な増加(+277%、p < 0.05)を引き起こしました(図 3a)。対照的に、B. longum 補給は、この初期の骨折誘発性の腸管透過性の増加を無効にし (+18%、p = 0.3)、骨折後 21 日目まで PBS 補給マウスよりも有意に低いレベルを維持しました (図 3a)。骨折後早期 (0~14 日目) には、グループ間または骨折に対する反応として血清エンドトキシン レベルに有意差は検出されませんでしたが、骨折後 21 日目に、PBS コントロール マウスで血清エンドトキシンの有意な増加が見られました (図 3b)。B. longum 補給は、PBS 投与マウスと比較して、骨折後 3 日目に血清リポ多糖結合タンパク質 (LBP) の有意な増加 (+113%) を引き起こしました (図 3c)。B. longum 投与マウスでは、骨折後 7 日目までに血清血清リポ多糖結合タンパク質 がベースライン (骨折前) に戻りました (図 3c)。対照的に、PBS対照マウスでは、血清血清リポ多糖結合タンパク質は骨折直後には変化しなかったが、骨折後14日目と21日目には有意に減少した(図3c)。 |
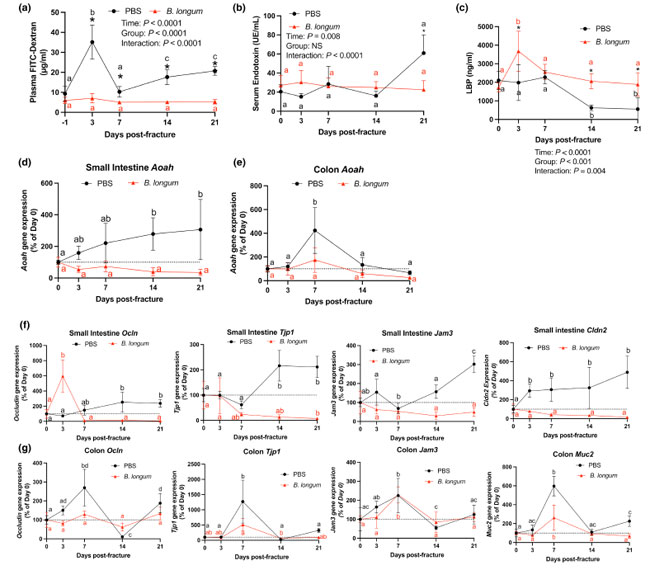 |
図3 Bifidobacterium longum 補給は腸管バリアの完全性を維持する。 PBS: リン酸緩衝生理食塩水 (a) Bifidobacterium longum 補給は骨折後の血漿FITCデキストラン濃度の上昇を予防した。*PBSと比較してp < 0.05(n = 6~7/グループ/時点)。同じ色の値が共通の文字を共有していない場合は、有意に異なる、p < 0.05。 (b) 骨折後21日目に、B. longum補給マウスの血清エンドトキシン値が有意に低かった。*PBSと比較してp < 0.05(n = 4~6/グループ/時点)。同じ色の値が共通の文字を共有していない場合は、有意に異なる、p < 0.05。 (c) 骨折後3、14、21日目に、B. longum補給マウスの血清リポ多糖結合タンパク質(LBP)値が有意に高かった。 * PBSと比較してp < 0.05。同じ色の値で共通の文字を共有していないものは有意に異なる、p < 0.05(n = 4~5/グループ/時点)。 ( d)小腸のアシルオキシアシルヒドロラーゼ(Aoah)遺伝子発現は、B. longum補給マウスでは変化しなかったが、PBS投与マウスでは骨折後14日目と21日目に増加した。 ( e)結腸のアシルオキシアシルヒドロラーゼ遺伝子発現は、B. longum補給マウスでは変化しなかったが、PBS投与マウスでは骨折後7日目に増加した。ベースラインの骨折なし(0日目)と比較した 。 (f)小腸と(g)結腸タイトジャンクションの遺伝子発現の変化は、B. longumおよびPBS補給マウスの骨折に対する異なる反応を示している。 データは、骨折前(0日目)の値からのパーセント変化として表される。二元配置分散分析に続いてシダックの多重比較検定を行った結果、共通の文字を共有しない同じ色の値は有意に異なり、p < 0.05(n = 4~5/グループ/時点)。 |
| 次に、エンドトキシン/血清リポ多糖結合タンパク質の解毒を担うアシルオキシアシルヒドロラーゼの小腸および結腸内遺伝子発現を測定した(Munford & Hunter、1992)。小腸では、大腿骨骨折により、骨折前のベースラインレベルと比較して、骨折後14日目と21日目にアシルオキシアシルヒドロラーゼ遺伝子発現が有意に増加した(図3d)。骨折後期間中、B. longum補給マウスの小腸ではアシルオキシアシルヒドロラーゼ伝子発現の有意な変化は観察されなかった(図3d)。結腸では、大腿骨骨折により、骨折後7日目にPBS対照マウスでアシルオキシアシルヒドロラーゼ遺伝子発現が有意に誘導されたが、B. longum補給マウスでは観察されなかった(図3e)。 |
| B. longum 補給が骨折後の腸管透過性と血清エンドトキシン濃度に及ぼすメカニズムをさらに解明するために、小腸と結腸内のタイトジャンクション関連タンパク質の遺伝子発現を評価しました。PBS コントロール マウスでは、Ocln(訳者注: オクルディンは、細胞間結合の様式の1種であるタイトジャンクションを構成するタンパク質の一つです)の発現が骨折後 14 日目に有意に増加し、骨折後 21 日目にも高いままでした。しかし、B. longum 補給マウスでは、骨折後 3 日目に Ocln 遺伝子発現が大幅に誘導されました (図 3f)。骨折は、小腸内の ZO-1 (Tjp1) 遺伝子発現にも異なる影響を及ぼし、PBS コントロール マウスでは骨折後 14 日目と 21 日目にベースライン発現と比較して発現が有意に増加したのに対し、B. longum 補給マウスでは 21 日目に発現が有意に減少しました (図 3f)。同様の効果が Jam3 の遺伝子発現にも見られ、PBS 投与マウスではベースライン発現と比較して骨折後 21 日目に有意に誘導されました (図 3f)。二次骨修復中に B. longum を投与されたマウスでは、ベースラインと比較して Jam3 遺伝子発現は小腸内で変化しませんでした (図 3f)。Claudin 2 (Cldn2) 遺伝子発現も骨折後 3 日目に PBS コントロール マウスの小腸内で強くアップレギュレーションされ、ベースライン (骨折前) レベルと比較して 21 日目まで有意に高いままでした (図 3f)。逆に、B. longum を補給したマウスでは、骨折治癒の間ずっと小腸の Cldn2 遺伝子発現は変化しませんでした (図 3f)。結腸内では、PBS コントロール マウスで Ocln 遺伝子発現が動的な発現パターンを示しました。骨折前のベースライン発現と比較すると、Ocln 遺伝子発現は骨折後 7 日目に有意に増加し、14 日目に減少し、21 日目に有意に増加しました (図 3g)。B. longum 補給マウスでは、結腸 Ocln 遺伝子発現に差は認められませんでした (図 3g)。同様に、結腸 Tjp1 遺伝子発現は、PBS コントロール マウスで骨折後 7 日目に有意に誘導され、骨折後 14 日目までにベースラインのレベルに戻りました (図 3g)。B. longum 補給マウスでは、骨折後 14 日目に Tjp1 の発現が有意に低下しました (図 3g)。骨折は、骨折後 7 日目に両グループで Jam3 および Muc2 の遺伝子発現の同様の増加を誘導し、骨折後 14 日目までにベースラインのレベルに戻りました (図 3g)。これらのデータは、高齢マウスでは骨折により早期に腸機能の障害が生じ、骨折が治癒するまでその障害が持続し、それが B. longum によって軽減されることを示しています。 |
| 3.4. Bifidobacterium longum の補給は骨折に対する全身炎症反応を鈍らせる |
| 骨折は二次骨修復の初期反応期に強力な局所炎症反応を引き起こし、損傷組織を超えて広がり、高齢動物では悪化する(Emami et al., 2019; Levy et al., 2006)。初期の炎症反応に対応する骨折後3日目と7日目にマウスから分離された血清をマルチプレックス免疫測定にかけ、16種のサイトカインとケモカインの全身レベルを測定した(図4aと図S2)。PBS対照マウスでは3日目から7日目にかけてIL-10とSDF-1αの血清レベルが有意に増加したが、B. longumを補給したマウスでは観察されなかった(図4a)。Bifidobacterium longumは、骨折後 3 日目と比較して 7 日目に VEGFa レベルの上昇も誘導しました (図 4a)。骨折後 7 日目に、B. longumを補給したマウスでは、PBS コントロール マウスと比較して IL-10 レベルが有意に低下しました (図 4a)。骨折は、ベースラインのレベルと比較して、PBS コントロール マウスの骨折後 3 日目に炎症性タンパク質リポカリン 2 の血清レベルの有意な急性期上昇 (+2141%) を誘導し、これは B. longumを補給したマウスのリポカリン 2 濃度よりも有意に高かった (図 4b)。小腸内では、骨折は、ベースラインの発現と比較して、骨折後 3 日目と 21 日目にコントロール マウスのリポカリン 2 (Lcn2) 遺伝子発現の有意な増加を誘導しました (図 4c)。 B. longum を補給したマウスでは、小腸でのリポカリン 2 (Lcn2)遺伝子発現は骨折治癒中も変化しませんでした (図 4c)。これらのデータを総合すると、B. longum が骨折誘発性の全身性炎症反応を弱めることが示唆されます。 |
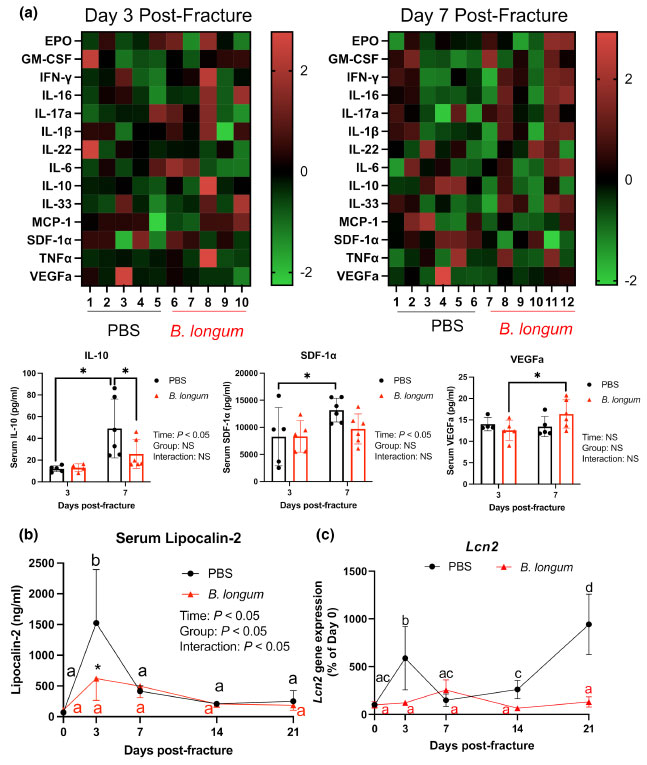 |
図 4 Bifidobacterium longumの補給は骨折誘発性全身炎症反応に影響を及ぼした。 PBS: リン酸緩衝生理食塩水 (a) 骨折後 3 日目 (n = 4~5/群) および 7 日目 (n = 5~6/群) の血清サイトカインのヒートマップ。骨折後 3 日目と比較して、7 日目に PBS 対照マウスでは血清 IL-10 および SDF1-α が増加し、B. longum補給マウスでは VEGFa が増加した。*p < 0.05。各データ ポイントは独立した観察値を表します。外れ値は、ROUT 法を使用して IL-10 (除外値 126 pg/ml) および VEGFa (除外値 40.3 および 74.7 pg/ml) で特定されました。 (b) 骨折は PBS 対照マウスの血清リポカリン 2 レベルの上昇を引き起こしましたが、B. longum補給マウスでは有意に低かった。 * PBSと比較してp < 0.05(n = 4–5/グループ/時点)。 ( c)骨折は、PBS対照マウスの小腸リポカリン-2(Lcn2)遺伝子発現の有意な増加を引き起こしたが、B. longumを補給したマウスでは増加は引き起こさなかった。 データは、2元配置分散分析とそれに続くSidakの多重比較検定を使用して評価した。共通の文字を共有しない同じ色の値は有意に異なる、p < 0.05(n = 4–5/グループ/時点)。 |
| 3.5. Bifidobacterium longum の補給は骨折後の腸内細菌叢コミュニティ構造を安定化させる |
| 腸内細菌叢の構成は非常に柔軟で、骨折などの外傷の影響を受けます (Howard et al., 2017; Li et al., 2022, p.^2022pp; Roberts et al., 2020)。プロバイオティクスは、細菌叢構成の調整を通じて宿主の生理機能に部分的に影響を及ぼします (Tyagi et al., 2018)。そのため、ケージ効果を最小限に抑えるために、順応期間中に床敷を繰り返し交換してまず細菌叢を正常化することで、骨折からの回復期にBifidobacterium longumが細菌叢コミュニティ構造に影響を与えるかどうかを調べました。糞便サンプルのメタゲノム配列決定により、経口投与開始前(14日目)のPBSおよびB. longumコホートのマウスで、ベータ多様性(図5a)、アルファ多様性(図5b)、および微生物叢コミュニティ構造が類似していることが明らかになりました(図5c)。これは、ケージ間でマイクロバイオームが正常化されたことを示唆しています。補給2週間後(骨折前0日目)、PBSコントロールマウスとB. longum補給マウスの微生物群集構成に明確な分離があり(図5a)、グループ間で属レベルの分類学的構成が異なっていました(図5c)。 PERMANOVA による骨折治癒中の全体的な微生物群集構成の変化の分析では、Aitchison 距離のペアワイズに基づいて、治療 (p = 0.01、R 2 = 0.03)、時点 (p = 0.001、R 2 = 0.15)、およびグループ:時点の相互作用 (p = 0.001、R 2 = 0.15) の有意な影響が明らかになりました (図 5a)。 PCoA プロットを視覚的に検査すると、PBS を補給したマウスは骨折後早期にクラスターを形成していましたが、骨折後 14 日目と 21 日目にはベータ多様性が変化し、B. longum を補給したマウスとクラスターを形成しました。微生物アルファ多様性も骨折後 14 日目に PBS コントロール マウスで有意に増加しましたが、B. longum を補給したマウスでは骨折が治癒する間ずっと変化しませんでした (図 5b)。属レベルの分類学的構成は、PBS を補給したマウスの骨折治癒の過程を通じて顕著な変化を示し、骨折後 3 日目と 14 日目に最も顕著でした (図 5c)。これは、PBS を補給したマウスで骨折後 3 日目に Ligilactobacillus の相対的存在量が減少し、Muribaculum と Parabacteroides の相対的存在量が 0 日目のベースラインと比較して増加することで特徴付けられました (図 5d)。 PBS対照マウスでは、骨折後14日目にLachnoclostridiumおよびBlautiaの相対存在量が有意に増加し、骨折後21日目にDuncaniellaが増加しました(図5d)。PBS対照マウスと同様に、B. longumを補給したマウスでも、骨折後3日目に分類構成に大きな変化が見られました(図5c)。これは主に、Ligilactobacillusの相対存在量の減少によるものでした(図5d)。しかし、分類構成は骨折後7日目までにベースラインに戻り、残りの時点を通してほとんどの属で変化しませんでした(図5c、d)。ただし、B. longum補給マウスでは、骨折前(0日目)と比較して骨折後21日目にMuribaculumが有意に増加しました(図5d)。種レベルでは、B. longum の 2 週間の補給 (骨折前 0 日目) により、Ralstonia mannitolilytica、Halobacterium hubeiense、Butyricimonas などのいくつかの細菌の存在量が増加しましたが、その後の時点では変化がありませんでした (図 5e)。PBS 対照マウスでは、Ralstonia mannitolilytica、Halobacterium hubeiense、Butyricimonas の存在量は骨折後 14 日目まで増加せず、Faecalibaculum rodentium は骨折後 21 日目に増加しました (図 5e)。これらのデータは、骨折により高齢マウスで急速に腸内細菌叢異常が引き起こされ、B. longum の補給により安定化できることを示しています。 |
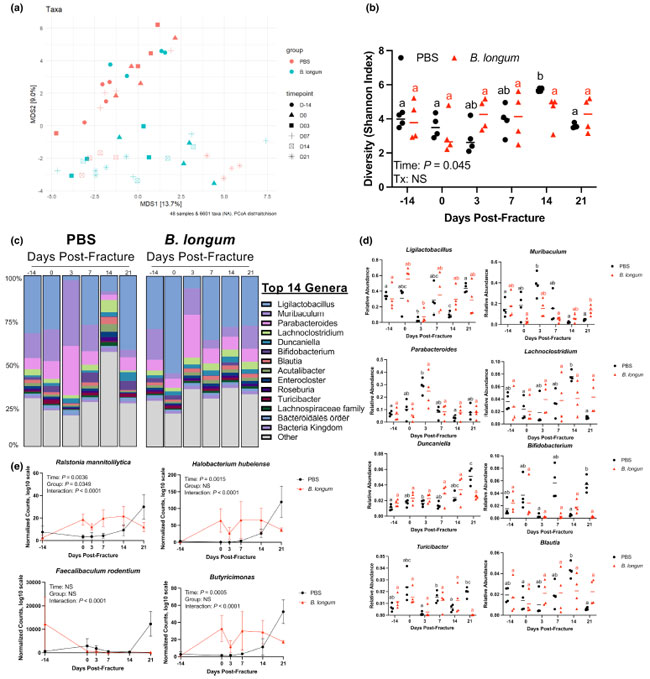 |
図5 Bifidobacterium longumの補給は骨折誘発性腸内細菌叢異常を抑制する。 PBS: リン酸緩衝生理食塩水 (a) 糞便β多様性の主座標配置解析(PCoA)。 (b) B. longum補給マウスでは、糞便α多様性は骨折の影響を受けなかった。 (c) 経口投与前(-14日目)、骨折前(0日目)、骨折後3、7、14、21日目の糞便サンプルにおける属レベルでの細菌分類群の詳細な相対存在量。 (d) 骨折治癒中の特定属の相対存在量の変化。 (e) Bifidobacterium longumの補給により、骨折治癒中、Ralstonia mannitolilytica、Halobacterium hubeiense、Faecalibaculum rodentium、Butyricimonasの存在量が増加および維持された。 同じ色の値で共通の文字を共有していないものは有意に異なる(p < 0.05)。 データは二元配置分散分析とそれに続くシダックの多重比較検定を使用して評価されました。各データポイントは独立した観察を表します(n = 4/グループ/時点)。 |
| 4.考察 |
| 加齢は、ほぼすべての臓器系が徐々に劣化する特徴があります。筋骨格系は特に加齢による変化の影響を受けやすく、加齢は長い間、治癒の悪化につながる患者固有の要因であると考えられてきました (Drissi et al., 2014)。加齢はまた、腸内細菌叢の構成の劇的な変化とも関連しており (Castro‐Mejía et al., 2020; Wilmanski et al., 2021)、これが骨の成長、恒常性、修復に影響を及ぼすことが報告されています (Cooney et al., 2020; Roberts et al., 2020)。しかし、腸内細菌叢のこれらの加齢に伴う変化と骨折治癒の結果との関係は不明です。ここでは、食事性プロバイオティクスサプリメントであるB. longumを使用して老化した腸内細菌叢を調整することで、高齢マウスの治癒結果を改善し、骨折によって引き起こされる全身病を軽減できることを示します。 |
| 加齢とともに骨格の再生能力は自然に低下しますが、これは幹細胞の利用可能性と分化能力の低下、炎症の亢進、免疫老化、血管新生障害に起因すると考えられています (Clark et al., 2017)。18 か月齢のマウスを使用した以前の研究では、若いマウスと比較して骨折後 14 日目にレントゲン写真上のブリッジングが遅れ、仮骨密度が低下したこと (McKenzie et al., 2019; Slade Shantz et al., 2014)、および骨が少なく小さい仮骨が形成されること (Clark et al., 2020) によって示されるように、これは治癒が困難な有効なモデルであることが実証されています。私たちの研究では、B. longum を補給したマウスは、骨折後 14 日目に骨が多く含まれるより小さな仮骨を示しました。これらの結果は、B. longum の補給が仮骨内の早期のミネラル形成を加速できることを示しています。組織学的分析では、仮骨内の軟骨組織に違いは見られなかったため、この早期の石灰化組織の増加は、軟骨仮骨形成の加速によるものではないと考えられます。むしろ、B. longum の補給は、仮骨周辺の膜内骨化を介して、より速い骨様骨形成を促進する可能性があります。この仮骨形成の加速と、B. longum を補給したマウスの皮質架橋の増加は、骨折骨の機械的適応能力の向上を促進したと考えられます。私たちのレントゲンスコアリングとねじり試験の結果は、B. longum の補給が骨折部位の皮質の架橋を介して生体力学的特性の再構築を加速することを示唆しています。骨の安定性が皮質を架橋する新しい骨の形成によって回復すると、骨折は治癒したとみなされます (Knox et al., 2021)。メカニズム的には、B. longum は、主に卵巣摘出誘発性骨量減少の文脈において、骨の健康を促進することが報告されています (Parvaneh et al., 2015; Sapra et al., 2022)。これらの研究では、B. longum またはその溶解物の補給により、破骨細胞形成の減少、骨形成の増加、および免疫調節に起因するメカニズムを通じて、卵巣摘出誘発性骨量減少を予防できることが実証されています (Montazeri‐Najafabady et al., 2021; Parvaneh et al., 2015; Sapra et al., 2022)。さらに、B. longum は、卵巣摘出ラットの大腿骨内で骨形成遺伝子 Bmp‐2 および Sparc の遺伝子発現を誘導することができます (Parvaneh et al., 2015)。高齢のマウスやラットの骨折では、骨折治癒の初期段階で強力な骨誘導成長因子である BMP-2 の発現が減少しています (Meyer Jr. et al., 2003; Naik et al., 2009)。B. longum が仮骨内で骨形成を刺激する BMP-2 の発現をアップレギュレーションした可能性がありますが、これは今後の研究で明らかにされる必要があります。これらの研究は、B. longum を補給したマウスで観察された仮骨の石灰化反応の加速に関する洞察を提供します。 |
| 我々と他の研究者らは、加齢と単純な骨折により腸管バリアの完全性が弱まり、透過性が高まり、細菌由来の毒性因子の転座を許して炎症を引き起こす可能性があることを報告している(Ahmadi et al., 2020; Roberts et al., 2020)。プロバイオティクスを使用して腸管バリアを強化することは、腸の漏れによって引き起こされる全身病理を軽減するための有望なアプローチである(Li et al., 2016; Ohland & Macnaughton, 2010; Rao & Samak, 2013)。我々は当初、プロバイオティクス種であるBifidobacterium adolescentisが、骨折を介した腸管細胞間タイトジャンクション遺伝子の機能不全を防ぐことができると報告した(Roberts et al., 2020)。同様に、若いマウスにプロバイオティクス種であるAkkermansia muciniphilaを補給すると、骨折によって引き起こされる腸のバリア機能障害も回復しました(Liu et al., 2020)。私たちのデータは、B. longumも高齢マウスの骨折によって引き起こされる腸のバリア機能障害を防ぐという同様のメカニズムで機能することを示しています。これは、B. longumを補給したマウスの骨折治癒中、小腸と結腸内でOclnの遺伝子発現の初期上方制御とバリアを形成する腸のタイトジャンクションタンパク質の遺伝子発現が安定していることによって証明されました。対照マウスでは、タイトジャンクション関連遺伝子の発現は骨修復の後期段階でのみ増加しました。これは、骨折によって引き起こされる腸の機能障害に対する代償反応があることを示唆しており、これは以前に若いマウスで観察されました(Roberts et al., 2021)。興味深いことに、この代償反応は高齢マウスでは遅れているようで、若いマウスでは骨折前と比較して骨折後10日目にタイトジャンクション関連遺伝子の発現レベルが有意に増加しています(Roberts et al., 2020)。また、PBS対照マウスの小腸内では、Claudin-2(Clnd2)の発現が早期かつ持続的に有意に誘導されていました。Claudin-2は孔を形成するクローディンであり、上皮透過抵抗を低下させ、それによって透過性を高めることができます(Van Itallie et al., 2008)。炎症性サイトカイン(Al‐Sadi et al., 2014; Mankertz et al., 2009; Weber et al., 2010)およびエンドトキシン(Liu et al., 2013; Xie et al., 2019)を含む特定の微生物産物は、Cldn2の発現をアップレギュレーションする可能性があります。Cldn2遺伝子発現の持続的な増加は、PBSコントロールマウスで観察された血清エンドトキシンの増加に寄与した可能性があります。これらのデータを合わせると、骨折は老化した腸内のバリア機能障害につながり、B. longumの摂取によって予防できることが示されています。 |
| 興味深い発見の 1 つは、血清リポ多糖結合タンパク質 (LBP) レベルの反応がグループ間で異なることです。B. longum を補給したマウスでは、骨折後に血清リポ多糖結合タンパク質レベルが著しく上昇し、骨折後 7 日目までにベースラインに戻りました。しかし、コントロール マウスでは、この初期の急性期反応は観察されず、ベースラインと比較して骨折後 14 日目 (-55%) と 21 日目 (-87%) に血清レベルが低下しました。血清リポ多糖結合タンパク質は急性期タンパク質であり、低濃度で免疫系をエンドトキシンに対して感受性にするという逆説的な役割を担っています (Schumann et al.,1990)。一方、高レベルの 血清リポ多糖結合タンパク質は、炎症を誘発することなくエンドトキシンの中和を促進します (Lamping ら、1998; Wurfel ら、1995)。血清リポ多糖結合タンパク質の恒常レベルは 血清リポ多糖結合タンパク質またはグラム陰性菌感染の認識を促進して免疫反応を引き起こすと考えられていますが、急性期には血清リポ多糖結合タンパク質機能が上昇して LPS (訳者注:LPSとは、大腸菌やサルモネラ菌などのグラム陰性菌の 細胞壁を構成する成分です。 日本語では"リポ多糖"と言 い、糖脂質になります)を中和し、炎症を軽減します (Heumann & Roger, 2002)。興味深いことに、血清エンドトキシン レベルは、骨折後 21 日目までグループ間または時点間で差がなく、この日にはリポ多糖コントロール マウスで有意な増加が見られました。このエンドトキシンの増加は、PBS コントロール マウスの血清リポ多糖結合タンパク質レベルの最低値と相関していました。血清リポ多糖結合タンパク質レベルの低下は、エンドトキシンの発生源であるグラム陰性菌への曝露の増加と関連しています (Gutsmann ら、2001)。 リポ多糖/エンドトキシンも、リポ多糖の脂質A領域にあるアシルオキシアシル結合を加水分解することでエンドトキシンの不活性化を担う主要酵素をコードするアシルオキシアシルヒドロラーゼ(Aoah)の発現を強く誘導します(Munford & Hunter、1992年;Zouら、2017年)。アシルオキシアシルヒドロラーゼの遺伝子発現も、対照群の小腸と結腸内で骨折に反応して強く上方制御されましたが、B. longumを摂取したマウスでは変化がありませんでした。総合的にこれらのデータは、骨折がエンドトキシン代謝の調節不全につながることを示唆していますが、これはB. longumの摂取では観察されません。 |
| 外傷は腸内細菌叢の構成と多様性に影響を及ぼす可能性がある (Howard et al., 2017; Li et al., 2022, p.^2022pp; Roberts et al., 2020)。私たちは最近、プロバイオティクス種である Bifidobacterium adolescentis の摂取が、若いマウスの骨折治癒中に腸内細菌叢を安定させることができると報告しました (Roberts et al., 2020)。この研究では、B. longum 補給に対する同様の効果が高齢マウスで観察され、骨折治癒中にベータ多様性とアルファ多様性の両方が変化しませんでした。しかし、対照マウスでは、骨折後 14 日目にアルファ多様性が増加するなど、微生物群集構造に大きな変化がありました。これらのデータは、大腿骨骨折により急速に腸内細菌叢の乱れが起こり、それが治癒中も持続し、B. longum によって安定化されることを示唆しています。リポカリン 2 発現の増加もこの考えを裏付けています。リポカリン2は急性期タンパク質であり、シデロフォアをキレートして鉄を隔離し、細菌の増殖を抑制します(Asimakopoulou et al., 2016)。リポカリン2の発現はリポ多糖によってアップレギュレーションされ、腸の炎症や腸内細菌叢の異常の敏感なバイオマーカーとして特定されています(Chassaing et al., 2012; Hsieh et al., 2016; Klüber et al., 2021; Marques et al., 2008)。私たちの研究で観察された血清リポカリン2レベルの上昇は、骨損傷に対する初期の急性期反応とマイクロバイオームコミュニティ構造の変化の両方を反映している可能性があります。一方、PBS対照マウスの小腸内の遺伝子発現の変化は、最初は外傷後の腸の機能不全と炎症を反映している可能性がありますが、その後の誘導は腸内細菌叢の異常の発症を反映しています。重要なのは、B. longumを投与されたマウスでは骨折治癒を通じてリポカリン 2遺伝子発現が変化しなかったことです。私たちの観察は、B. longum補給が糞便リポカリン-2を減少させるだけでなく、腸損傷の非常に炎症性の高いデキストラン硫酸ナトリウムモデルの微生物叢の構成を変えることを実証した以前の研究によって裏付けられています(Singh et al., 2020)。これらのデータを合わせると、B. longum補給が腸内微生物叢のコミュニティ構造を安定させ、骨折誘発性の腸内細菌叢異常を軽減できることがわかります。しかし、B. longum補給が腸内微生物叢に影響を与えたメカニズムは不明のままです。B. longumを含むBifidobacterium種は、属レベルで消化管内の病原性細菌の豊富さを阻害することができます(Singh et al., 2020; Yun et al., 2017)。この効果は、日和見微生物の増殖を阻害できる短鎖脂肪酸などのポストバイオティクスの生成に起因している可能性があります。たとえば、B. longum は、内腔内の pH を下げる代謝物を生成して、病原体である Clostridium difficile の増殖を防ぐことができます (Yun et al., 2017)。Bifidobacterium longum は、酢酸などのポストバイオティクスの生成を伴うクロスフィーディングを通じて、他の細菌の増殖もサポートします (Falony et al., 2006; Riviere et al., 2015)。さらに、これは、乳児腸に最初に定着した菌類の 1 つである Bifidobacterium 種の進化的適応 (Ruiz et al., 2013) を反映している可能性もあります。これにより、開いたニッチをめぐって他の細菌と競合することができます (Xiao et al., 2021)。 |
| また、2 つのグループ間および治癒過程において、いくつかの細菌属および種に有意な違いが見られました。腸内細菌叢のこれらの変化が B. longum の骨折治癒に対する有益な効果に寄与したのか、腸内細菌の代謝活動の変化に起因するのかは不明です。プロバイオティクスの健康への有益な効果は、集合的な代謝活動に影響を及ぼす可能性のある腸内常在細菌叢との相互作用に大きく起因することが示唆されています (Eloe‐Fadrosh et al., 2015; Scott et al., 2015)。短鎖脂肪酸、胆汁酸、トリプトファンおよびポリアミン代謝物など、多くの細菌由来の生理活性代謝物は、腸と骨の健康の改善と関連しています (Bellissimo et al., 2021; Lucas et al., 2018; Tyagi et al., 2018; Zhao et al., 2020)。特に、B. longum を補給したマウスでいくつかの短鎖脂肪酸産生細菌属および種 (Ligilactobacillus、Butyricimonas) が増加していることを考慮すると、これらの代謝物が観察された効果に寄与していると考えられます。観察された微生物の変化が加齢による骨折治癒にどのように寄与しているか、またメタゲノミクス、メタトランスクリプトミクス、メタボロミクスによって測定された微生物の活動が治癒と関連しているかどうかを解明するには、さらなる研究が必要です。 |
| 重要なのは、高齢マウスにB. longumを補給しても目立った有害な影響はなく、むしろB. longumは骨折によって引き起こされる全身病理の多くを減弱させたことです。骨折は両グループで急激な体重減少を引き起こしましたが、これはラットとマウスで同様の反応を報告しているいくつかの研究によって裏付けられています(Magnusdottir et al., 2021; Roberts & Drissi, 2020; Seifter et al., 1975)。特に、B. longumの補給により、この早期の体重減少が減弱しました。外傷後代謝に対するこの有益な効果は肝臓でも観察され、B. longumを補給したマウスでは肝臓の重量が有意に増加しました。この肝臓重量の増加は、急速な体重減少によりPBS対照マウスで枯渇した可能性のあるグリコーゲン貯蔵量の増加を反映していると考えられます(Ma et al., 2021)。体重の違いは、食物摂取量の違いによって部分的に生じている可能性があるが、本研究ではこれを測定していない。これは、代謝コストの高いプロセスである二次骨修復に対するB. longumの有益な効果にも部分的に寄与している可能性がある(Roberts & Drissi, 2020)。PBS対照マウスにおける血清リポカリン2の初期増加も、マウスおよび非ヒト霊長類に食欲抑制効果があるため、体重に対するこれらの異なる効果に寄与している可能性がある(Mosialou et al., 2017; Petropoulou et al., 2020)。もう1つの興味深い発見は、B. longumを補給したマウスでは、PBS対照マウスと比較して、骨折後3日目の脾臓重量が減少していたことである。脾臓の肥大は、骨折からの回復中によく見られる リポ多糖などのアドレナリンおよび炎症シグナルによる刺激の増加によって引き起こされます (Ajmo Jr et al., 2009; Liverani et al., 2014; Seemann et al., 2017)。 |
| 偶発的な骨折は椎体の海綿骨の損失も加速させ、高齢マウスでは損失が大きく、回復に時間がかかる(Emami et al., 2019)。高齢マウスを対象とした私たちの研究では、対照マウスで腰椎の骨密度(BMD)と骨ミネラル含有量 (BMC) 、椎体の微細構造指標の減少を特徴とする骨折に対する同様の反応を観察しました。Bifidobacterium longumは、腰椎内で骨折によって引き起こされる全身の骨量減少反応を予防しました。骨折後35日目の椎体内の骨表面密度 (BS/BV)の減少は、B. longumが外傷後骨量減少の主な原因である骨吸収を減少させたことを示唆しています(Emami et al., 2019)。我々は以前、Bifidobacterium adolescentiを投与された若いマウスで同様の効果がみられたことを報告しており(Roberts et al., 2020)、これはBifidobacterium属に属するいくつかの種が骨折からの回復中に無傷の骨格を保護できることを示唆している。 |
| 本研究にはいくつかの限界がある。遺伝的変異性を減らすために近交系 C57BL/6JN 株を使用し、ケージ間の微生物叢を正規化してケージコホート効果を最小限に抑えたが、最終的には横断的データに依存して、加齢と B. longum 補給が骨折治癒と全身病理に及ぼす縦断的影響を推測している。2 つ目は、分析にはメスのマウスのみを使用したことである。高齢女性の骨折発生率は男性よりも高いため、メスのマウスを研究することにした (Bergh et al., 2020)。オスのマウスが B. longum 補給に対して同様の反応を示すか、異なる反応を示すかを判断するには、最終的には将来の研究が必要である。最後に、分類群と種の変化を調べたマイクロバイオームデータは観察に基づくものであり、観察された微生物の変化から因果関係を判断することはできない。観察された効果は興味深いが、今後の研究では、加齢との関連でこれらの微生物の変化が骨折治癒に及ぼす影響を実験的に判断する必要がある。 |
| 結論として、本研究は、B. longum を用いたプロバイオティクスによる腸内細菌叢の調整が、高齢マウスの骨折治癒結果を改善し、骨折後の全身病理を軽減できることを実証しています。これらの有益な効果は、腸機能の維持、炎症の緩和、骨折誘発性腸内細菌叢異常の抑制から生じたものと考えられます。本研究は、加齢に伴う外傷性骨損傷と腸内細菌叢の関係を強調しており、プロバイオティクス サプリメントなどの単純な食事療法を用いて高齢者の骨修復を促進するための新たな治療ターゲットとなる可能性があります。 |
| 補足表1.プライマー一覧 |
 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Aging Cell. 2023 Apr; 22(4): e13786.に掲載されたBifidobacterium longum supplementation improves age-related delays in fracture repair. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


