ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
腸内のビタミン D 受容体は腸外の乳がんの腫瘍形成を防ぎます |
Yong-Guo Zhang et al., |
|
|
| 要約 |
微生物叢は、腸および腸外臓器の機能と健康を調節する上で重要な役割を果たします。 基本的な疑問は、乳がんの発生中に腸内細菌層と乳房の軸が存在するかどうかです。 もしそうなら、宿主因子の役割は何でしょうか? ビタミン D 受容体 (VDR) は、宿主因子とヒトの細菌叢に関与します。 Vdr 遺伝子の変異はヒトの細菌叢を形成し、ビタミン D 受容体欠損は腸内毒素症(dysbiosis:腸内細菌叢の異常)を引き起こします。 我々は、腸内ビタミン D 受容体が乳房における腫瘍形成から宿主を保護しているという仮説を立てました。 我々は、腸内毒素症のある腸上皮ビタミン D 受容体ノックアウト (VDRΔIEC) マウスにおける(7,12-)ジメチルベンズアントラセン (DMBA) 誘発乳がんモデルを検討しました。 我々は、腸内毒素症を有するビタミン D 受容体ノックアウトマウスは、ジメチルベンズアントラセンによって誘発される乳がんに対してより感受性が高いことを報告しました。 腸および乳房の細菌叢の分析により、ビタミン D 受容体欠損により細菌プロファイルが正常から発がんしやすい状態に変化することが示されました。 乳房腫瘍内で細菌染色が強化されていることがわかりました。 私たちは、腸上皮ビタミン D 受容体欠損が腸管透過性の増加、密着結合の破壊、微生物の転座、炎症の亢進を引き起こし、その結果、乳房内の腫瘍のサイズと数が増加するメカニズムを分子および細胞レベルで特定しました。 さらに、有益な細菌代謝物である酪酸塩またはプロバイオティクスであるLactobacillus plantarumによる処理は、ビタミン D 受容体ノックアウトマウスにおいて乳房腫瘍を減少させ、密着結合を強化し、炎症を抑制し、ブチリル-CoAトランスフェラーゼを増加させ、乳房Streptococcus bacteria(連鎖球菌)レベルを低下させた。 腸内細菌叢は、腸だけでなく乳房の疾患の発症にも関与しています。 私たちの研究は、腸のビタミン D 受容体機能不全と腸内毒素症が腸外腫瘍形成の高いリスクを引き起こすメカニズムについての洞察を提供します。 腸-腫瘍-細菌叢の相互作用は、乳がんの予防と治療における新たな標的となっています。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.結果 |
| 2.1.腸内ビタミン D 受容体欠損マウスにおける細菌の多様性とがんのリスクの変化 |
| 2.2. ビタミン D 受容体ノックアウトマウスは、対照群の ビタミン D 受容体マウスよりも多く、より大きな乳房腫瘍を発症しました |
| 2.3.腸上皮のビタミン D 受容体欠失は、乳房腫瘍組織における ビタミン D 受容体発現の減少、増殖の増加、およびアポトーシスの減少を引き起こしました |
| 2.4.腸のビタミン D 受容体の欠失は、腸の透過性の増加、密着結合の破壊、微生物の移動、および炎症の増強を引き起こしました |
| 2.5. ビタミン D 受容体ノックアウトマウスでは、酪酸処理により乳房腫瘍数が減少し、乳房ビタミン D 受容体発現が増加し、増殖が減少し、アポトーシスが増加しました |
| 2.6.酪酸塩処理は腸の上皮細胞の密着結合(TJ)を強化し、腸内毒素症を修正し、炎症を抑制しました |
| 2.7.プロバイオティクスは、ビタミン D 受容体ノックアウトマウスにおいて乳房腫瘍を減少させ、乳房 ビタミン D 受容体発現を増加させ、増殖を減少させ、アポトーシスを増加させました |
| 2.8.プロバイオティクスはビタミン D 受容体ノックアウトマウスの腸管上皮細胞の密着結合(TJ) を強化し、炎症を軽減しました |
| 3.討論 |
| 4.材料と方法 |
| 4.1.動物 |
| 4.2.マウスにおけるジメチルベンズアントラセン (DMBA)による乳がんの誘導 |
| 4.3.マウスにおける酪酸塩処理 |
| 4.4マウスにおけるプロバイオティクス治療 |
| 4.5.腸管透過性 |
| 4.6.ヘマトキシリンおよびエオシン染色 |
| 4.7.ウェスタンブロット分析と抗体 |
| 4.8.免疫蛍光 |
| 4.9.免疫組織化学 (IHC) |
| 4.10.ターミナルデオキシヌクレオチジルトランスフェラーゼ dUTP ニックエンドラベリング (TUNEL) 染色 |
| 4.11細菌DNAのリアルタイムPCR測定 |
| 4.12.マルチプレックスELISA |
| 4.13.血清リポ多糖(LPS)検出 |
| 4.14.ショットガンメタゲノムシーケンスおよびバイオインフォマティクス解析 |
| 4.14.1.研究デザインとサンプリング |
| 4.14.2.糞便サンプルの収集とショットガンメタゲノムシーケンス |
| 4.15.統計分析 |
本文 |
| 1.はじめに |
| ビタミン D は、複数の生物学的効果を担う脂溶性ステロイドのグループです。 活性型ビタミン D は、それ自体の受容体ビタミン D 受容体と連携して、粘膜免疫と上皮細胞の正常な増殖の両方を調節する上で重要な役割を果たします(1、2)。 ビタミン D/ビタミン D 受容体の調節不全は、乳がん (6-9) を含む人間のさまざまな疾患のリスクを高めることが知られています(3-5)。 がん生物学におけるビタミン D 受容体の役割に対する並行した評価は約 30 年前に始まり、その後、正常および悪性システムにおけるビタミン D 受容体の作用についての理解が深まりました (10)。 |
| ヒトおよび動物の研究における腸内細菌叢のビタミン D 受容体依存性調節は、ビタミン D 受容体の非常に重要な役割が新たに特定されたことを示しています (11,12)。 我々は、ヒト Vdr 遺伝子の変異が腸内細菌叢を形成し、ビタミン D 受容体の欠失が腸内毒素症を引き起こすことを実証しました( 12)。 私たちの研究は、腸および微生物の恒常性維持におけるビタミン D 受容体の重要な役割を裏付けています( 13-15)。 我々は、腸上皮ビタミン D 受容体マウスモデルの最初の条件付き欠失モデルを確立し、腸内細菌の存在量と機能がビタミン D 受容体ノックアウトマウスで大幅に変化することを実証しました( 11,16)。 ビタミン D 受容体ノックアウトマウスは炎症誘発因子 (11 )および結腸腫瘍形成( 15) にも影響を受けやすいことから、腸ビタミン D 受容体が損傷や炎症に対する宿主の保護に寄与していることが示されています。 腸内毒素症と慢性炎症は、がんの発生に重要な影響を及ぼします。 |
| ビタミン D 受容体細菌叢に関する研究の進歩により、微生物によって引き起こされる腸内の上皮細胞の恒常性と修復のプログラムが確立されました (17)。 細菌と宿主の相互作用の調節不全は、がんの発生において慢性炎症性および過剰な修復反応を引き起こす可能性があります(18-23)。 vdr 遺伝子の多型 (Bsm1、Apa1、Fok1、および Poly(A)) は、乳がんに対する感受性を高めることが報告されています (24,25)。 乳房腫瘍組織マイクロアレイにおけるビタミン D 受容体発現レベルは、乳がんの進行性と逆相関しているが、がん生存転帰とは逆相関していることが示されています (26)。 ビタミン D/ビタミン D 受容体 はがん研究において活発な話題となっていますが (14、15、26-29)、腫瘍形成における宿主と細菌叢の相互作用の根底にあるメカニズムは完全には理解されていません。 腸上皮ビタミン D 受容体と腸内細菌叢が腸内毒素症や乳がんの発症に影響を与える影響やメカニズムについてはほとんどわかっていません。 |
| この研究では、腸内ビタミン D 受容体 が乳房における腫瘍形成から宿主を保護しているという仮説を立てました。 私たちは、腸内毒素症のあるビタミン D 受容体ノックアウトマウスは、ジメチルベンズアントラセンによって誘発される乳がんにかかりやすいことを発見しました。 腸内および乳房の微生物叢の分析により、ビタミン D 受容体欠損により細菌プロファイルが正常から発がんしやすいものに変化することが示されました。 我々は、腸上皮ビタミン D 受容体欠損が腸管透過性の増加、密着結合の破壊、微生物の転座、炎症の亢進を引き起こし、その結果、乳房内の腫瘍のサイズと数が増加するメカニズムを細胞レベルで特定した。 さらに、有益な細菌代謝産物である酪酸塩またはプロバイオティクスのLactobacillus plantarum 株による治療により、ビタミン D 受容体ノックアウトマウスの乳房腫瘍が減少しました。 私たちの研究は、腸の ビタミン D 受容体機能不全が乳房における腸外腫瘍形成の高いリスクを引き起こすメカニズムについての新たな洞察を提供します。 |
| 2.結果 |
| 2.1.腸内ビタミン D 受容体欠損マウスにおける細菌の多様性とがんのリスクの変化 |
| まず、腸上皮ビタミン D 受容体の欠失が腸内細菌叢と乳がんのリスクに影響を与えるかどうかを確認しました。 腸上皮細胞のビタミン D 受容体を条件付きで欠失させた ビタミン D 受容体ノックアウトマウス群 (雄 5 匹、雌 5 匹) と対照群の ビタミン D 受容体マウス(雄 3 匹、雌 7 匹) の 2 群からの 20 個の糞便サンプルのメタゲノム シーケンスを実行しました。 99%以上の同一性で反復配列を除去した後、サンプルあたり平均2,644,633リードを含む52,892,651の分類学的アライメントと、サンプルあたり平均1,394,700リードを含む27,893,990の機能アライメントが生成されました。 |
| 図1aに示すように、細菌群集プロファイルは、対照群のビタミン D 受容体マウスとビタミン D 受容体ノックアウトマウスの間で研究対象動物の多様性と組成の違いを示しました。 個別に存在した各動物で最も蔓延している細菌種の上位 10 種は、Ralstonia solanacearum、Escherichia coli、Muribaculum intestinale、Bifidobacterium pseudolongum、Bacteroides caecimuris、Faecalibaculum robentium、Lactobacillus johnsonii、Lactobacillus reuteri、Alistipes shahii、および Lachnoclostridium sp YL32 でした (図 1a)。 Haemophilus ducreyi はグラム陰性細菌であり、性器潰瘍疾患下疳 30 の原因物質であり、ビタミン D 受容体ノックアウトマウス群では有意に下方制御されることが判明しました (図 1b)。 Mesorhizobium huakuii は、その宿主植物 Astragalus sinicus 上で窒素固定根粒の形成を誘導し、新しい生物変異体に割り当てられています(31)。 M. huakuii 分離株は、リポ多糖類に対するエンドトキシン活性を持つことも判明し(32)、ビタミン D 受容体ノックアウトマウス群では大幅に下方制御されました。 さらに、2 つの有益な細菌種、Lactobacillus johnsonii と Bifidobacterium pseudolongum は、ビタミン D 受容体ノックアウトマウス群で顕著に下方制御されました (図 1b)。 |
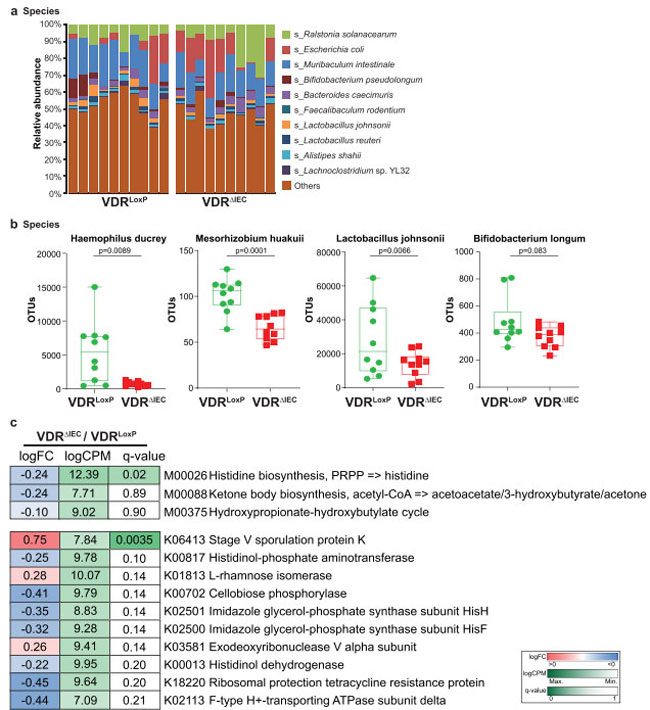 |
図1。 対照群の ビタミン D 受容体(VDRloxp )マウスと比較した ビタミン D 受容体を条件付きで欠失させた ビタミン D 受容体ノックアウト(VDRΔIEC)マウスにおける腸内細菌の分類学的コミュニティの変化。 (a) 種レベルでの細菌の相対存在量が上位 10 種について示されており、存在量の少ない種は「その他」としてグループ化されました。 各バーは個々のマウスを表し、グループあたり n = 10。 (b) 腸内ビタミン D 受容体条件付き欠失後に顕著に変化した現存細菌種。 Y 軸の値は、シーケンスリードを表す操作分類単位 (OTU) カウントに基づいています。 データは、各グループの平均 ± SD、ウェルチの t 検定、n = 10 として表されます。 (c) 条件付きビタミン D 受容体ノックアウトマウスの糞便中の機能遺伝子の鑑別分析。 KEGG MODULE データベースは、手動で定義された遺伝子セットの機能単位である M 番号で識別される KEGG モジュールで構成されます。 KEGG モジュール オーソログ テーブルは、ゲノム アノテーションの完全性と一貫性をチェックするのに便利なツールです。 特定の K 番号セットについて、個々のゲノム内の現在アノテーションが付けられている遺伝子を示します。 ペアワイズ比較で q 値が 0.05 以下の項目または酪酸関連項目が選択されました。 倍率変化 (log2FC)、100 万あたりのカウント (log2CPM)、および q 値は、図の右側に示されているキーを使用して色付けされました (各グループ n = 10)。 すべての p 値が図に示されています。 |
| ショットガンメタゲノムシーケンスでは、細菌の多様性と存在量に加えて、機能分析を通じて微生物の機能変化を明らかにすることができます。 我々は、主に関連する生合成、個々の経路、および機能遺伝子のセットにそれぞれ基づいて、分類学的機能モジュール、経路、およびテーブル分析を実行しました。 次に、機能プロファイリングに対して差分分析を実行し、モジュール、経路、およびテーブル内のこれらの特定された機能に対する ビタミン D 受容体条件付き削除の影響を示しました。 興味深いことに、ヒドロキシプロピオン酸-ヒドロキシ酪酸サイクルやケトン体生合成(アセチル-CoA => アセト酢酸/3-ヒドロキシ酪酸/アセトン)などの一部の酪酸関連モジュールは、ビタミン D 受容体ノックアウトマウスで下方制御されていました。 そして、胞子形成に必須でありステージ V の胞子形成に特異的であるステージ V の胞子形成タンパク質 K をコードする遺伝子 (33 )は、ビタミン D 受容体ノックアウトマウスで有意に(q < 0.01)上方制御されました(図 1c)。 ヒスチジン生合成経路は、細菌、古細菌、下等真核生物、植物に存在する古代の代謝経路であり、細菌における基本的な調節プロセス(プロトン緩衝作用や金属イオンキレート化など)を持っています (34,35) が、有意に(q < 0.05) ビタミン D 受容体ノックアウトマウスでは下方制御されましたが、他のペア比較では有意差なく上方制御されました (図 1c)。 |
| 2.2. ビタミン D 受容体ノックアウトマウスは、対照群の ビタミン D 受容体マウスよりも多く、より大きな乳房腫瘍を発症しました |
| 腸内毒素症は乳がんの発症と関連しています(36-40)。 我々のメタゲノム配列決定の結果は、腸上皮ビタミン D 受容体ノックアウトが腸内毒素症を誘発することを示しました。 次に、ジメチルベンズアントラセン マウスモデルを使用して、乳がんの発症における腸内ビタミン D 受容体の役割を調査しました(図2a)。 化学的に誘発されたげっ歯類の乳がんモデルは、ヒト乳がんの発生と進行を反映するために広く使用されてきました(41-44)。 我々は、ジメチルベンズアントラセン処理した対照群の ビタミン D 受容体マウスとビタミン D 受容体ノックアウトマウスの間で乳房腫瘍の発生率に顕著な差があることを発見した。 代表的な乳房腫瘍を図 2b に示します。 乳房腫瘍の数は、対照群の ビタミン D 受容体マウスと比較して ビタミン D 受容体ノックアウトマウスで有意に増加しました (図 2c)。 腫瘍の体積は、対照群の ビタミン D 受容体マウスよりも ビタミン D 受容体ノックアウトマウスの方が有意に大きかった (図 2d)。 さらに、乳房サンプルの病理学的分析により、対照群の ビタミン D 受容体マウスジメチルベンズアントラセン実験グループとビタミン D 受容体ノックアウトマウスジメチルベンズアントラセン実験グループの間の腫瘍サイズの違いが示されました(図2e)。 ただし、H&Eによると、ジメチルベンズアントラセンで処理した対照群の ビタミン D 受容体およびビタミン D 受容体ノックアウトマウスでは結腸と回腸に腫瘍は見られませんでした(図2 f–g)。 |
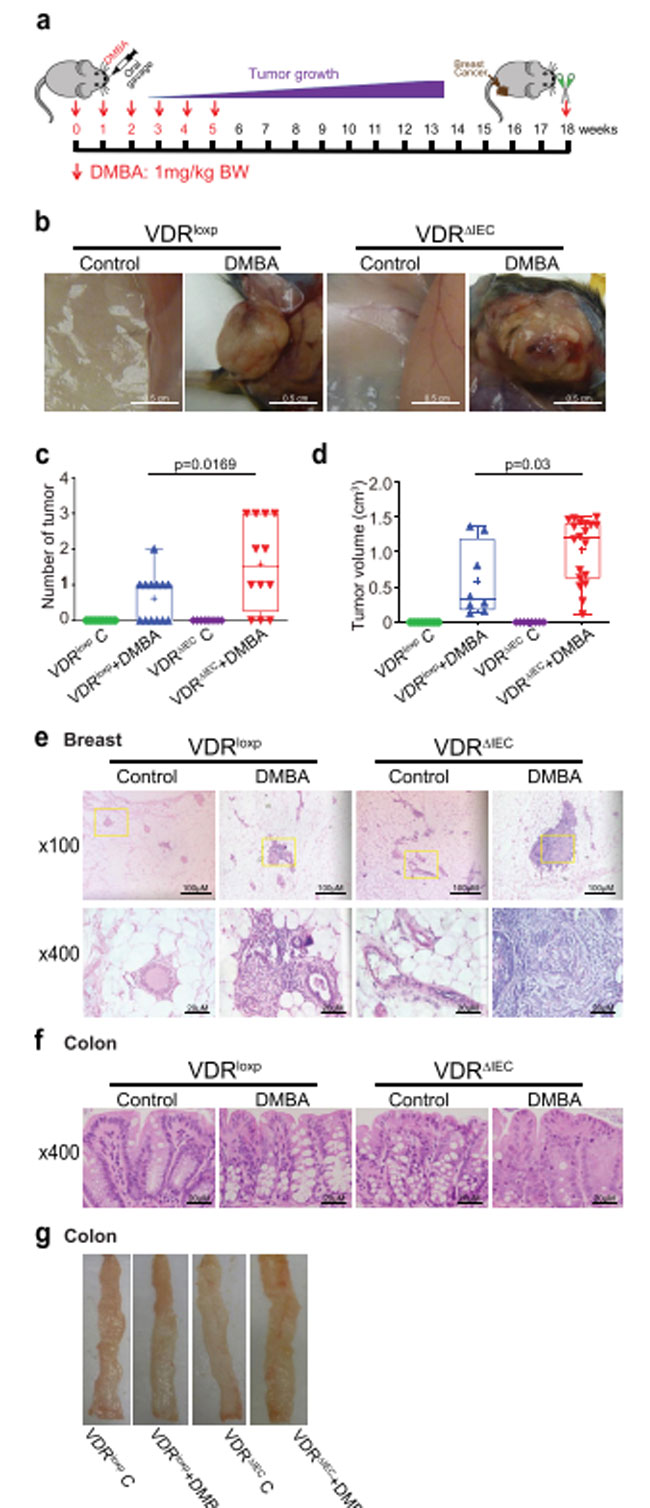 |
図2。 ビタミン D 受容体ノックアウト(VDRΔIEC)マウスでは、より大きく、より多くの乳房腫瘍が発生しました。 (a) ジメチルベンズアントラセン (DMBA)誘発乳がんモデルの概略図。 マウスには、0.2 mlのコーン油に溶かした1.0 mgのジメチルベンズアントラセンを週に1回、6 週間経口強制投与しました。 サンプルは 18 週目に採取されました。 (b) 上皮内乳房腫瘍。 さまざまなグループの代表的な乳腺。 (c) 対照群の ビタミン D 受容体(VDRloxp )マウスと比較して、ビタミン D 受容体ノックアウト(VDRΔIEC) マウスでは乳房腫瘍の数が有意に増加しました。 データは平均 ± SD として表されます。 N = 8–13、一元配置分散分析。 (d) 乳房腫瘍体積は、対照群の ビタミン D 受容体(VDRloxp )マウスよりも ビタミン D 受容体ノックアウト(VDRΔIEC) マウスの方が有意に大きかった。 データは平均 ± SD として表されます。 n = 8–13、一元配置分散分析。 (e) 示されたグループからの乳腺の代表的な H&E 染色。 画像は 1 回の実験からのもので、1 グループあたり 8 ~ 13 匹のマウスを表しています。 (f) 示されたグループからの腸の代表的な H&E 染色。 画像は 1 回の実験からのもので、1 グループあたり 8 ~ 13 匹のマウスを表しています。 すべての p 値が図に示されています。 (g) 示されたグループからの結腸の代表的な写真。 |
| 2.3.腸上皮のビタミン D 受容体欠失は、乳房腫瘍組織における ビタミン D 受容体発現の減少、増殖の増加、およびアポトーシスの減少を引き起こしました |
| ビタミン D 受容体ノックアウトマウスでは、乳房腫瘍組織のタンパク質レベルで ビタミン D 受容体の有意な下方制御が観察されました (図 3a)。 ビタミン D 受容体発現の低下は、対照マウスおよびジメチルベンズアントラセン処理対照群の ビタミン D 受容体マウスおよびビタミン D 受容体ノックアウトマウスの乳房組織のIHC染色によって確認されました(図3b)。 増殖マーカー p-β-カテニン (ser 552) の WB および IHC データ 45-47 は、乳房腫瘍組織内の p-β-カテニン (Ser552) が 対照群の ビタミン D 受容体マウスと比較して ビタミン D 受容体ノックアウトマウスで有意に増加していることを示しました (図 3a-c )。 TUNEL 染色により、対照群の ビタミン D 受容体マウスと比較して、ビタミン D 受容体ノックアウトマウスの乳房腫瘍組織ではアポトーシス陽性細胞が減少しました (図 3d)。 ビタミン D 受容体ノックアウトマウスの乳房における細胞増殖とアポトーシスの変化は、最終的に発がんに対する感受性を高めました。 |
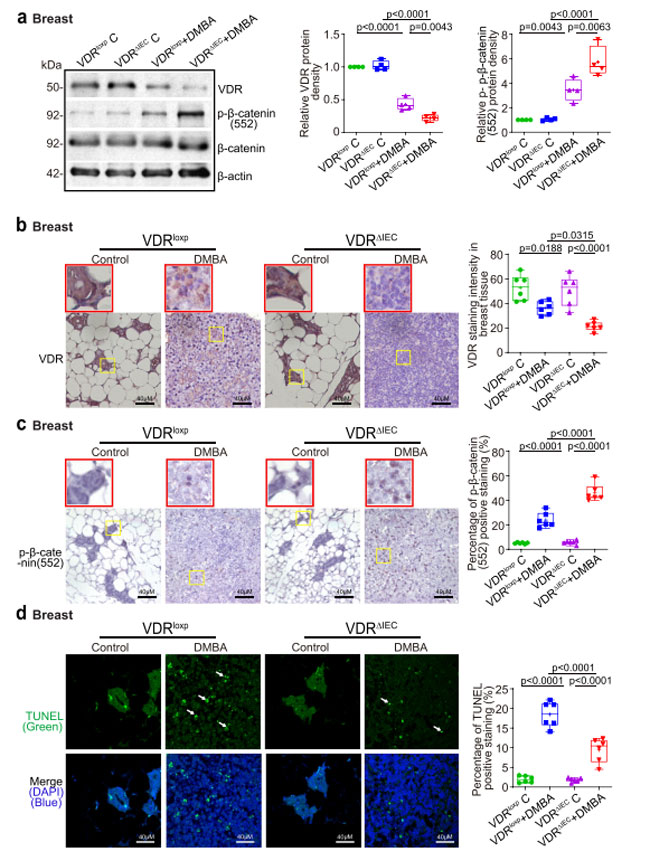 |
図3. 腸上皮ビタミン D 受容体欠失は、乳房腫瘍組織におけるビタミン D 受容体発現の減少、増殖の増加、およびアポトーシスの減少を引き起こしました。 (a) 対照群の ビタミン D 受容体(VDRloxp )マウスと比較して、ビタミン D 受容体ノックアウト(VDRΔIEC)マウスの乳腺腫瘍におけるビタミン D 受容体タンパク質発現の減少と p-β-カテニン (Ser552) 発現の増加。 データは平均 ± SD として表されます。 N = 4、一元配置分散分析。 (b) IHC 染色により、ビタミン D 受容体は、対照群の ビタミン D 受容体(VDRloxp )マウスと比較して、ビタミン D 受容体ノックアウト(VDRΔIEC)マウスの乳房腫瘍で減少しました。 画像は 1 回の実験からのもので、1 グループあたり 6 匹のマウスを表しています。 赤いボックスは、選択された領域を高倍率で示します。 (c) IHC 染色により、対照群の ビタミン D 受容体(VDRloxp )マウスと比較してビタミン D 受容体ノックアウト(VDRΔIEC)マウスの乳房組織で p-β-カテニン (Ser552) 発現が増加しました。 画像は 1 回の実験からのもので、1 グループあたり 6 匹のマウスを表しています。 赤いボックスは、選択された領域を高倍率で示します。 ( d )TUNEL染色により、対照群の ビタミン D 受容体(VDRloxp )マウスと比較して、ビタミン D 受容体ノックアウト(VDRΔIEC)マウスの乳房組織ではアポトーシス陽性細胞が減少しました。 画像は 1 回の実験からのもので、1 グループあたり 6 匹のマウスを表しています。 すべての p 値が図に示されています。 |
| 2.4.腸のビタミン D 受容体の欠失は、腸の透過性の増加、密着結合の破壊、微生物の移動、および炎症の増強を引き起こしました |
| 腸内毒素症は通常、有害な腸内細菌を増加させ、リポ多糖類などのエンテロトキシンをより多く放出し、上皮細胞の密着結合を損傷し、それによって腸の透過性を高め、がんのリスクを高める可能性があります(36,48)。 腸の透過性をテストするために、最初のジメチルベンズアントラセン処理から 18 週間後にマウスにフルオレセイン デキストランを強制経口投与しました。 4時間後、蛍光強度測定のために血液サンプルを採取しました。 蛍光強度が高いほど、腸の透過性が増加していることが示されました。 図4aに示すように、ジメチルベンズアントラセン処理は対照群の ビタミン D 受容体マウスとビタミン D 受容体ノックアウトマウスの両方で腸の透過性を増加させましたが、ビタミン D 受容体ノックアウトマウスは処理後に有意に高い透過性を示しました。 in vivo の腸透過性データに基づいて、ジメチルベンズアントラセン処理マウスでは上皮細胞の密着結合タンパク質が変化する可能性があるという仮説を立てました。 ビタミン D 受容体ノックアウトマウスでは、結腸内のタンパク質レベルで ZO-1 の有意な下方制御が観察され、一方、p-β-カテニン (552) は結腸内のタンパク質レベルで増加しました (図 4b)。 減少し、組織化されていない ZO-1 は、ジメチルベンズアントラセン処理マウスの結腸の免疫染色によって確認されました (図 4c)。 嫌気性細菌による酪酸合成は、ブチリル補酵素 A (CoA):酢酸 CoA トランスフェラーゼを介して起こります (49)。 私たちは、腸内ビタミン D 受容体の欠乏が腸内細菌叢の異常と細菌プロファイルの変化を引き起こすことを発見しました。 対照群の ビタミン D 受容体マウスと比較して、ビタミン D 受容体ノックアウトマウスの糞便中でのブチリル CoA トランスフェラーゼの発現は減少しました。 対照群の ビタミン D 受容体マウスと比較して、ビタミン D 受容体ノックアウトマウスでは大腸菌が増強されました (図 4d)。 慢性炎症は乳がんの一因となる重要な要因です。 血清LPSとサイトカインIL-1β、IL-6、IL-5およびTNF-αは、ジメチルベンズアントラセン処理ビタミン D 受容体ノックアウトマウスの方が対照群の ビタミン D 受容体マウスよりも有意に高いことがわかりました(図4e)。 FISH 染色により、ビタミン D 受容体ノックアウトマウスの乳房腫瘍でより普遍的な細菌が見つかりました (図 4f)。これは、乳房内の局所細菌の増強を示唆しています。 がん患者の乳房組織では、Streptococcus pyogenes, Streptococcus mitis, Lactobacillus, Methylobacterium, および Atopobium, などのさまざまな細菌が、対応する正常組織よりもがん組織のほうが豊富に見つかっています(50,51)。 次に、FISH プローブ Strc 493 (Streptococcus spp用) を使用しました。 また、ビタミン D 受容体ノックアウトマウスの乳がんでは、対照群の ビタミン D 受容体マウスよりも多くの連鎖球菌属細菌が検出され、ビタミン D 受容体ノックアウト乳がん組織内でStreptococcus spp. の菌数が増加していることが示唆されました。 |
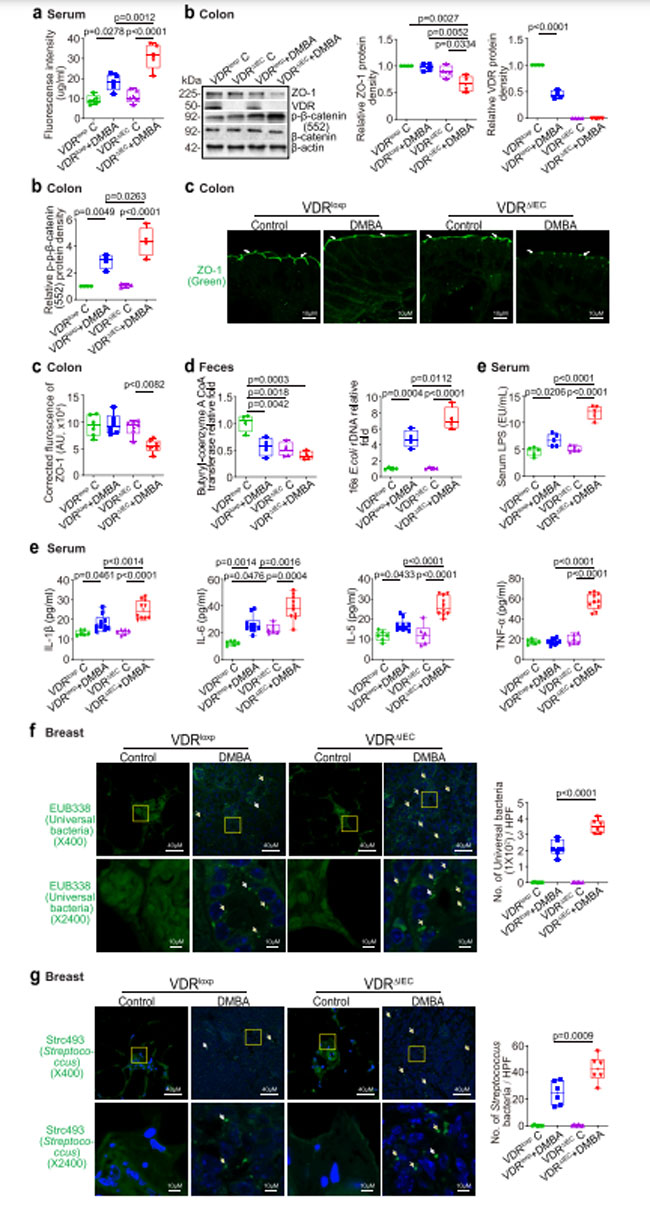 |
図4. 対照群の ビタミン D 受容体(VDRloxp )マウスと比較して、ビタミン D 受容体ノックアウト(VDRΔIEC)マウスの乳房腫瘍における腸管透過性の増加、ZO-1 (訳者注:ZO-1(別名:TJP1)は、細胞質側に位置する周辺膜リンタンパク質であり、上皮細胞および内皮細胞の両方のタイトジャンクションで発現されます)発現の減少、慢性炎症、および普遍的細菌の増加。 (a) ジメチルベンズアントラセン (DMBA)誘発ビタミン D 受容体ノックアウト(VDRΔIEC)乳がんモデルでは腸管透過性が増加しました。 フルオレセイン デキストラン (分子量 4 kDa、HBSS で希釈) を強制経口投与しました (50 mg/kg マウス)。 4時間後、蛍光強度測定のためにマウスの血液サンプルを収集しました。 データは平均 ± SD として表されます。 N = 5、一元配置分散分析。 (b) 対照群の ビタミン D 受容体(VDRloxp )マウスと比較して、ジメチルベンズアントラセン (DMBA)処理後の ビタミン D 受容体ノックアウト(VDRΔIEC)マウスの腸における ZO-1 発現は減少しました。 対照群の ビタミン D 受容体(VDRloxp )マウスと比較して、ジメチルベンズアントラセン (DMBA)処理後の ビタミン D 受容体ノックアウト(VDRΔIEC)マウスの結腸における p-β-カテニン (552) の発現が増加しました。 データは平均 ± SD として表されます。 n = 4、一元配置分散分析。 ( c )IF染色によると、ジメチルベンズアントラセン (DMBA)処理後の腸ビタミン D 受容体ノックアウト(VDRΔIEC)マウスでは対照群の ビタミン D 受容体(VDRloxp )マウスと比較してZO-1発現が減少しました。 画像は 1 回の実験からのもので、1 グループあたり 6 匹のマウスを表しています。 データは平均 ± SD として表されます。 N = 6、一元配置分散分析。 (d) 腸内ビタミン D 受容体の欠如は腸内細菌叢の異常と細菌プロファイルの変化を引き起こしました。 ブチリル補酵素 a CoA トランスフェラーゼの発現は、対照群の ビタミン D 受容体(VDRloxp )マウスと比較して、ビタミン D 受容体ノックアウト(VDRΔIEC)の対照組織および腫瘍で減少しました。 対照群の ビタミン D 受容体(VDRloxp )マウスと比較して、ビタミン D 受容体ノックアウト(VDRΔIEC)マウスの腫瘍では大腸菌が増加していました。 データは平均 ± SD として表されます。 N = 4、一元配置分散分析。 ( e )血清LPS、IL-1β、IL-6、IL-5、およびTNF-αは、対照群の ビタミン D 受容体(VDRloxp )マウスよりもビタミン D 受容体ノックアウト(VDRΔIEC)マウスの腫瘍で有意に高かった。 腫瘍の有無にかかわらず、対照群の ビタミン D 受容体(VDRloxp )および ビタミン D 受容体ノックアウト(VDRΔIEC)マウスから血清サンプルを収集し、Luminex 検出システムによってサイトカインを検出しました。 データは平均 ± SD として表されます。 N = 6–10、一元配置分散分析。 (f) ビタミン D 受容体ノックアウト(VDRΔIEC)マウスの乳房腫瘍組織内のより普遍的な細菌が、蛍光 in situ ハイブリダイゼーションによって発見されました。 画像は 1 回の実験からのもので、1 グループあたり 6 匹のマウスを表しています。 データは平均 ± SD として表されます。 N = 6、一元配置分散分析。 すべての p 値が図に示されています。 (g) ビタミン D 受容体ノックアウト(VDRΔIEC)マウスの乳房腫瘍組織中のより多くの連鎖球菌細菌が、蛍光 in situ ハイブリダイゼーションによって発見されました。 画像は 1 回の実験からのもので、1 グループあたり 6 匹のマウスを表しています。 データは平均 ± SD として表されます。 N = 6、一元配置分散分析。 すべての p 値が図に示されています。 |
| 2.5. ビタミン D 受容体ノックアウトマウスでは、酪酸処理により乳房腫瘍数が減少し、乳房ビタミン D 受容体発現が増加し、増殖が減少し、アポトーシスが増加しました |
| 対照群の ビタミン D 受容体マウスと比較して ビタミン D 受容体ノックアウトマウスの糞便では酪酸合成関連トランスフェラーゼが減少しているため、マウスにおける酪酸処理により乳房腫瘍の形成が減少する可能性があるという仮説を立てました。 また、酪酸塩は腸内のビタミン D 受容体発現を増加させることが知られているため、酪酸塩の役割もテストしました (11)。 雌の対照群の ビタミン D 受容体および ビタミン D 受容体ノックアウトマウスを、生後 6 ~ 7 週齢で開始し、最初のジメチルベンズアントラセン 処理後 18 週目に終了するまで、飲料水中の 2.5% 酪酸塩で治療しました。 酪酸塩で治療した ビタミン D 受容体ノックアウトマウスでは、乳房腫瘍の数が大幅に減少しました (図 5a)。 乳房腫瘍体積は、酪酸で治療した ビタミン D 受容体ノックアウトマウスの方が、酪酸で治療しなかったマウスよりも有意に小さかった (図 5b)。 病理学的分析により、酪酸で処理された ビタミン D 受容体ノックアウトマウスでは乳腺のサイズが小さいことが示されました (図 5c)。 酪酸で処理したビタミン D 受容体ノックアウトマウスの乳房腫瘍では、ビタミン D 受容体のタンパク質発現の増加と p-β-カテニン (552) の減少が観察されました (図 5d)。 ビタミン D 受容体発現の増加は、酪酸で処理したビタミン D 受容体ノックアウトマウスの乳房腫瘍組織のIHC染色によって確認されました(図5e)。 酪酸で治療した ビタミン D 受容体ノックアウトマウスでは、乳房腫瘍の p-β-カテニン (Ser552) が大幅に減少していることがわかりました (図 5f)。 TUNEL染色で示されるように、酪酸で処理したビタミン D 受容体ノックアウトマウスの乳房腫瘍でもアポトーシス陽性細胞が有意に増加しました(図5g)。 |
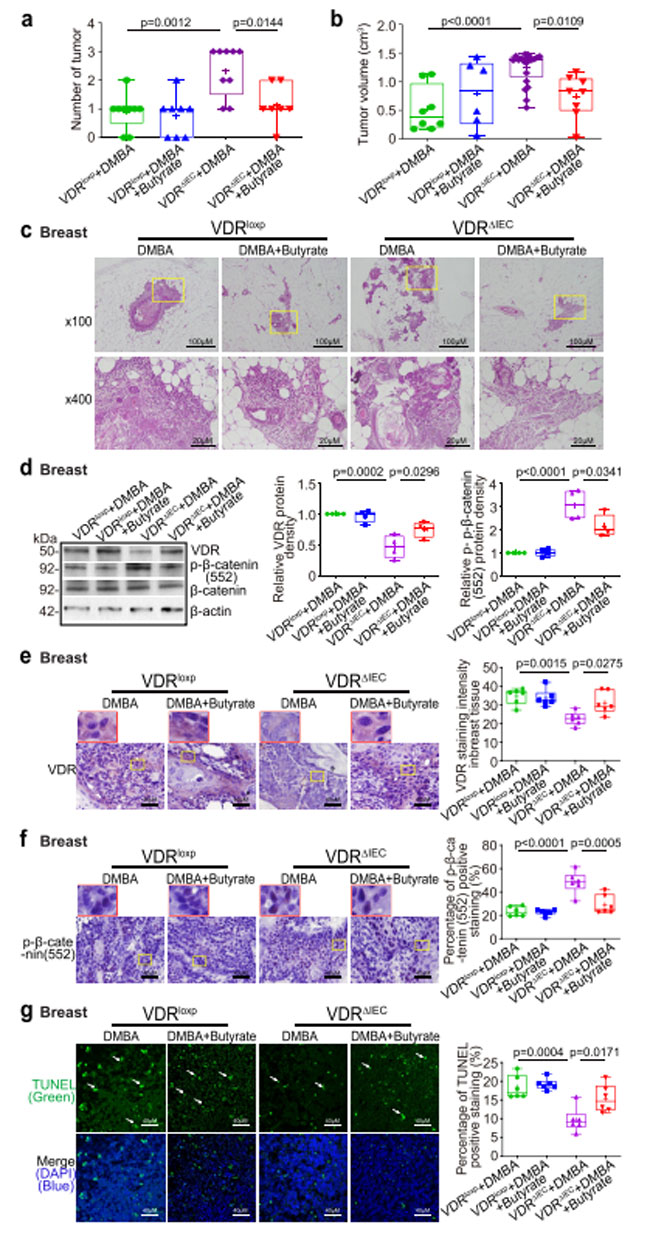 |
図5. 酪酸処理したビタミン D 受容体ノックアウト(VDRΔIEC)マウスでは、腫瘍が少なく、小さくなり、胸部ビタミン D 受容体発現が増加し、胸部 p-β-カテニン (552) 発現が減少し、細胞アポトーシスが増加しました。 (a) 酪酸で処理されたビタミン D 受容体ノックアウト(VDRΔIEC)マウスでは乳房腫瘍の数が大幅に減少しました。 データは平均 ± SD として表されます。 N = 7–9、一元配置分散分析。 (b) 酪酸で処理したビタミン D 受容体ノックアウト(VDRΔIEC)マウスでは乳房腫瘍体積が有意に小さくなりました。 データは平均 ± SD として表されます。 N = 7–9、一元配置分散分析。 (c) 示されたグループの乳腺の代表的な H&E 染色。 画像は 1 回の実験からのもので、1 グループあたり 7 ~ 9 匹のマウスを表しています。 ( d )酪酸で処理されたビタミン D 受容体ノックアウト(VDRΔIEC)マウスの乳房腫瘍組織では、ビタミン D 受容体(VDR) 発現が増加しましたが、p-β-カテニン(Ser552)発現は減少しました。 データは平均 ± SD として表されます。 N = 4、一元配置分散分析。 ( e )IHC染色によって示されるように、酪酸で処理されたビタミン D 受容体ノックアウト(VDRΔIEC)マウスの乳房腫瘍組織ではビタミン D 受容体(VDR) が増加しました。 画像は 1 回の実験からのもので、1 グループあたり 6 匹のマウスを表しています。 赤いボックスは、選択された領域を高倍率で示します。 データは平均 ± SD として表されます。 N = 6、一元配置分散分析。 ( f )IHC染色によって示されるように、酪酸で処理されたビタミン D 受容体ノックアウト(VDRΔIEC)マウスの乳房腫瘍組織ではP-β-カテニン(Ser552)発現が減少しました。 画像は 1 回の実験からのもので、1 グループあたり 6 匹のマウスを表しています。 赤いボックスは、選択された領域を高倍率で示します。 データは平均 ± SD として表されます。 N = 6、一元配置分散分析。 ( g )TUNEL染色で示されるように、酪酸で処理したビタミン D 受容体ノックアウト(VDRΔIEC)マウスの乳房腫瘍組織ではアポトーシス陽性細胞が減少しました。 画像は 1 回の実験からのもので、1 グループあたり 6 匹のマウスを表しています。 データは平均 ± SD として表されます。 N = 6、一元配置分散分析。 すべての p 値が図に示されています。
|
| 2.6.酪酸塩処理は腸の上皮細胞の密着結合(TJ)を強化し、腸内細菌叢の異常を修正し、炎症を抑制しました |
| 我々は、酪酸で処理されたビタミン D 受容体ノックアウトマウスでは腸の透過性が低下していることを発見しました(図6a)。 ZO-1発現は酪酸処理ビタミン D 受容体ノックアウトマウスの結腸で増加しましたが、p-β-カテニン (552) 発現は酪酸処理ビタミン D 受容体ノックアウトマウスの結腸で減少しました (図 6b)。 ZO-1発現の増加は、酪酸で処理したビタミン D 受容体ノックアウトマウスの結腸組織の免疫染色によって確認されました(図6c)。 酪酸で処理したビタミン D 受容体ノックアウトマウスの糞便では、ブチリル CoA トランスフェラーゼ遺伝子のレベルが増加し、大腸菌が減少しました (図 6d)。 血清エンテロトキシン リポ多糖 および炎症誘発性サイトカイン (つまり、IL-1β、IL-5、IL-6、および TNF-α) は、酪酸塩で処理したビタミン D 受容体ノックアウトマウスで有意に低下しており (図 6e)、酪酸塩が炎症の増加からマウスを保護したことを示唆しています。 FISH 染色では、酪酸で処理したビタミン D 受容体ノックアウトマウスの乳房腫瘍組織では普遍的な細菌と連鎖球菌が少ないことが示されました (図 6f–g)。 総合すると、これらのデータは、酪酸治療がビタミン D 受容体ノックアウトマウスの乳房腫瘍の大幅な減少、密着結合の強化、マイクロバイオームの回復、および炎症の抑制につながったことを示しています。 |
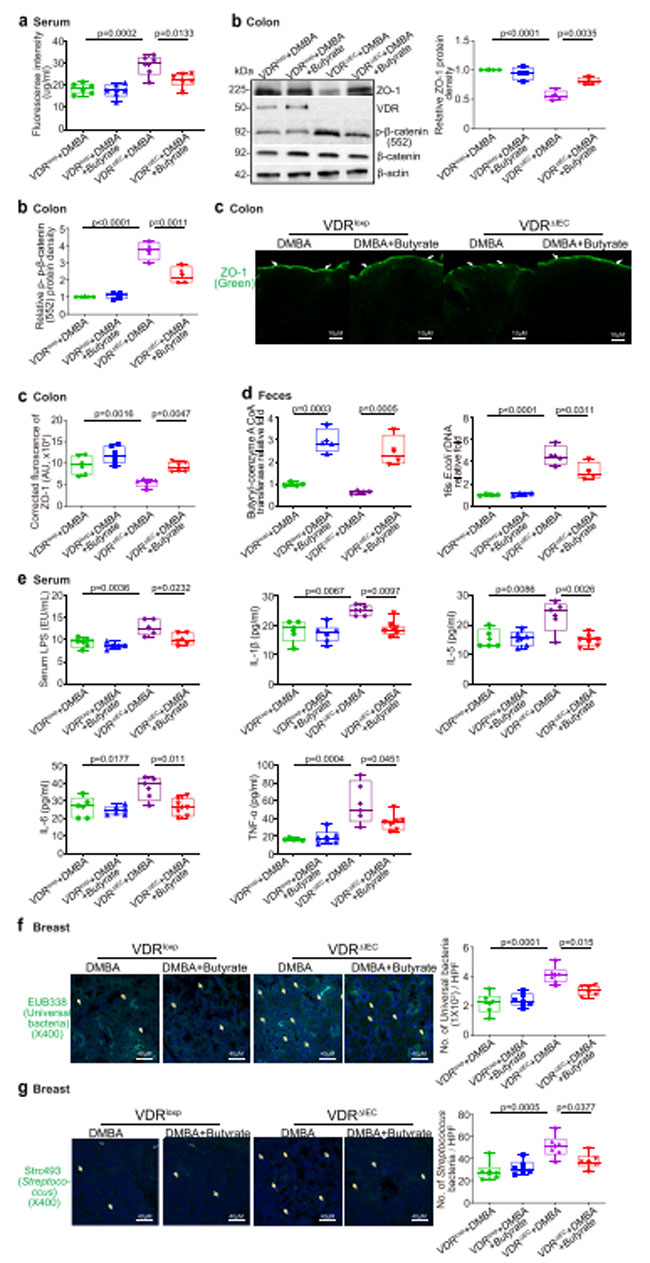 |
図6. ビタミン D 受容体ノックアウト(VDRΔIEC)マウスでは、酪酸処理により腸の透過性が低下し、腸の ZO-1 発現が増加し、炎症が減少しました。 (a) 酪酸で処理したビタミン D 受容体ノックアウト(VDRΔIEC)マウスでは腸管透過性が減少しました。 データは平均 ± SD として表されます。 N = 6、一元配置分散分析。 (b) 酪酸で処理したビタミン D 受容体ノックアウト(VDRΔIEC)マウスの腸では、ZO-1 発現が増加し、p-β-カテニン (552) 発現が減少しました。 データは平均 ± SD として表されます。 N = 4、一元配置分散分析。 ( c )IF染色によって決定されたように、酪酸で処理されたビタミン D 受容体ノックアウト(VDRΔIEC)マウスではZO-1発現が増加しました。 画像は 1 回の実験からのもので、1 グループあたり 6 匹のマウスを表しています。 データは平均 ± SD として表されます。 N = 6、一元配置分散分析。 ( d )酪酸処理により、酪酸処理されたビタミン D 受容体ノックアウト(VDRΔIEC)マウスにおいてブチリル補酵素 a CoA トランスフェラーゼ遺伝子が増加し、大腸菌が減少しました。 データは平均 ± SD として表されます。 N = 4、一元配置分散分析。 (e) 酪酸処理は、ビタミン D 受容体ノックアウト(VDRΔIEC)マウスの炎症の増加から保護しました。 血清 LPS、IL-1β、IL-5、IL-6、および TNF-α は、酪酸で処理されたビタミン D 受容体ノックアウト(VDRΔIEC)マウスで有意に低かった。 データは平均 ± SD として表されます。 N = 5–7、一元配置分散分析。 すべての p 値が図に示されています。 (f) 酪酸処理されたビタミン D 受容体ノックアウト(VDRΔIEC)マウスの乳房腫瘍組織におけるあまり普遍的ではない細菌が、蛍光 in situ ハイブリダイゼーションによって発見されました。 画像は 1 回の実験からのもので、1 グループあたり 6 匹のマウスを表しています。 データは平均 ± SD として表されます。 N = 6、一元配置分散分析。 すべての p 値が図に示されています。 (g) 酪酸処理したビタミン D 受容体ノックアウト(VDRΔIEC)マウスの乳房腫瘍組織中の連鎖球菌の減少が、蛍光 in situ ハイブリダイゼーションによって検出されました。 画像は 1 回の実験からのもので、1 グループあたり 6 匹のマウスを表しています。 データは平均 ± SD として表されます。 N = 6、一元配置分散分析。 すべての p 値が図に示されています。 |
| 2.7.プロバイオティクスは、ビタミン D 受容体ノックアウトマウスにおいて乳房腫瘍を減少させ、乳房 ビタミン D 受容体発現を増加させ、増殖を減少させ、アポトーシスを増加させました |
| プロバイオティクスのLactobacillus plantarum (LP) は、腸内ビタミン D 受容体 タンパク質の発現を増加させることが知られています( 52)。 Lactobacillus plantarum は酪酸または他の短鎖脂肪酸 の生成を促進する可能性があります(53,54)。 乳がんにおけるプロバイオティクス処理の役割を試験するために、ジメチルベンズアントラセンプロバイオティクス処理群の雌の対照群の ビタミン D 受容体マウスとビタミン D 受容体ノックアウトマウスに、生後6~7 週齢で開始し、最初のジメチルベンズアントラセン処理後18 週まで毎日Lactobacillus plantarum を強制経口投与しました。 プロバイオティクスで処理したビタミン D 受容体ノックアウトマウスでは、乳房腫瘍の数が大幅に減少しました (図 7a)。 乳房腫瘍の体積は、プロバイオティクス処理を受けたビタミン D 受容体ノックアウトマウスで大幅に小さくなりました (図 7b)。 病理学的分析により、プロバイオティクス処理を受けたビタミン D 受容体ノックアウトマウスでは乳腺のサイズが小さいことが示されました (図 7c)。 プロバイオティクス処理された ビタミン D 受容体ノックアウト(VDRΔIEC)マウスでは、プロバイオティクス処理により ビタミン D 受容体 のタンパク質発現が大幅に回復し、乳房腫瘍における p-β-カテニン (Ser552) が減少したことがわかりました (図 7d)。 ビタミン D 受容体発現の増加は、プロバイオティクス処理を受けたビタミン D 受容体ノックアウトマウスの乳房腫瘍組織のIHC染色によって確認されました(図7e)。 p-β-カテニン(552)発現の減少は、酪酸で処理したビタミン D 受容体ノックアウトマウスからの乳房腫瘍組織のIHC染色によって確認されました(図7f)。 TUNEL染色により、酪酸で処理したビタミン D 受容体ノックアウトマウスでアポトーシス細胞の増加が見られました(図7g)。 |
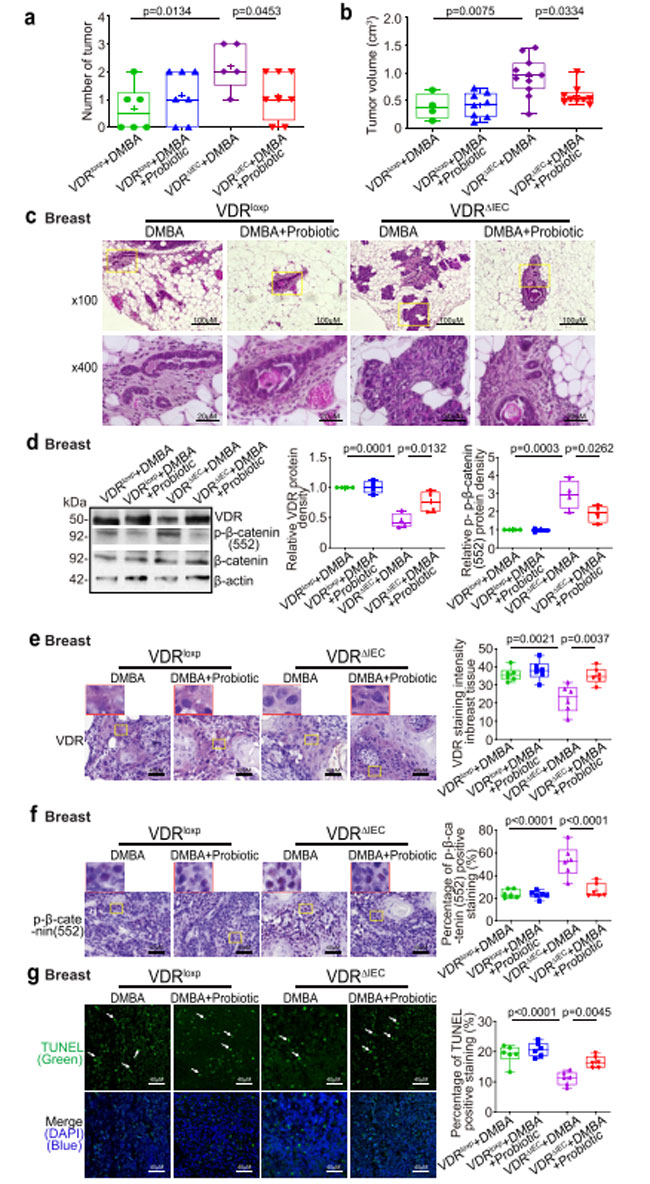 |
図7。 プロバイオティクスで処理したビタミン D 受容体ノックアウト(VDRΔIEC)マウスでは、腫瘍が少なく、小さくなり、乳房ビタミン D 受容体 (VDR)発現が増加し、p-β-カテニン (552) の発現が減少し、細胞アポトーシスが増加しました。 (a) プロバイオティクスで処理したビタミン D 受容体ノックアウト(VDRΔIEC)マウスでは乳房腫瘍の数が大幅に減少しました。 データは平均 ± SD として表されます。 N = 5–8、対応のない t 検定。 (b) プロバイオティクスで処理したビタミン D 受容体ノックアウト(VDRΔIEC)マウスでは、乳房腫瘍の体積が著しく小さかった。 データは平均 ± SD として表されます。 N = 5–8、一元配置分散分析。 (c) 示されたグループの乳腺の代表的な H&E 染色。 画像は 1 回の実験からのもので、1 グループあたり 6 ~ 8 匹のマウスを表しています。 ( d )プロバイオティクスで処理した ビタミン D 受容体ノックアウト(VDRΔIEC)マウスの乳房腫瘍組織では、ビタミン D 受容体 (VDR)発現が増加しましたが、p-β-カテニン(552)発現は減少しました。 データは平均 ± SD として表されます。 N = 4、一元配置分散分析。 ( e )IHC染色によって示されるように、プロバイオティクスで処理されたビタミン D 受容体ノックアウト(VDRΔIEC)マウスの乳房腫瘍組織ではビタミン D 受容体 (VDR)が増加しました。 画像は 1 回の実験からのもので、1 グループあたり 6 匹のマウスを表しています。 赤いボックスは、選択された領域を高倍率で示します。 データは平均 ± SD として表されます。 N = 6、一元配置分散分析。 (f) IHC 染色で示されるように、プロバイオティクス処理を受けた ビタミン D 受容体ノックアウト(VDRΔIEC)マウスの乳房腫瘍組織における P-β-カテニン (552) 発現が減少しました。 画像は 1 回の実験からのもので、1 グループあたり 6 匹のマウスを表しています。 赤いボックスは、選択された領域を高倍率で示します。 データは平均 ± SD として表されます。 N = 6、一元配置分散分析。 ( g )TUNEL染色によるプロバイオティクス処理を受けたビタミン D 受容体ノックアウト(VDRΔIEC)マウスの乳房腫瘍では、アポトーシス陽性細胞が減少しました。 画像は 1 回の実験からのもので、1 グループあたり 6 匹のマウスを表しています。 データは平均 ± SD として表されます。 N = 6、一元配置分散分析。 すべての p 値が図に示されています。 |
| 2.8.プロバイオティクスはビタミン D 受容体ノックアウトマウスの腸管上皮細胞の密着結合を強化し、炎症を軽減しました |
| 我々は、プロバイオティックLactobacillus plantarum で処理したビタミン D 受容体ノックアウトマウスでは腸管透過性が低下することを発見した(図8a)。 ZO-1 発現はプロバイオティクス処理された ビタミン D 受容体ノックアウトマウスの結腸で増加しましたが、p-β-カテニン (552) 発現はプロバイオティクス処理されたビタミン D 受容体ノックアウトマウスの結腸で減少しました (図 8b)。 結腸ZO-1発現レベルの増加は、プロバイオティクス処理を受けたビタミン D 受容体ノックアウトマウスにおける免疫染色によって確認された(図8c)。 プロバイオティックLactobacillus plantarum 処理したビタミン D 受容体ノックアウトマウスでは、ブチリル-CoAトランスフェラーゼ遺伝子レベルの増加と大腸菌の減少も観察されました(図8d)。 さらに、血清リポ多糖、IL-1β、IL-5、IL-6、およびTNF-αは、プロバイオティクスで処理したビタミン D 受容体ノックアウトマウスでは有意に低かった(図8e)。 FISHによるプロバイオティクス処理を受けたビタミン D 受容体ノックアウトマウスの乳房腫瘍組織では、細菌と連鎖球菌が少ないことがわかりました(図8f-g)。 これらのデータは、プロバイオティクス処理がいくつかの有益な役割を果たしている可能性を示唆しており、例えば、乳房腫瘍の減少、上皮細胞の密着結合(TJ)の増強、炎症の抑制、マイクロバイオームの回復により、ビタミン D 受容体ノックアウトマウスの腫瘍形成を抑制することが挙げられる。 |
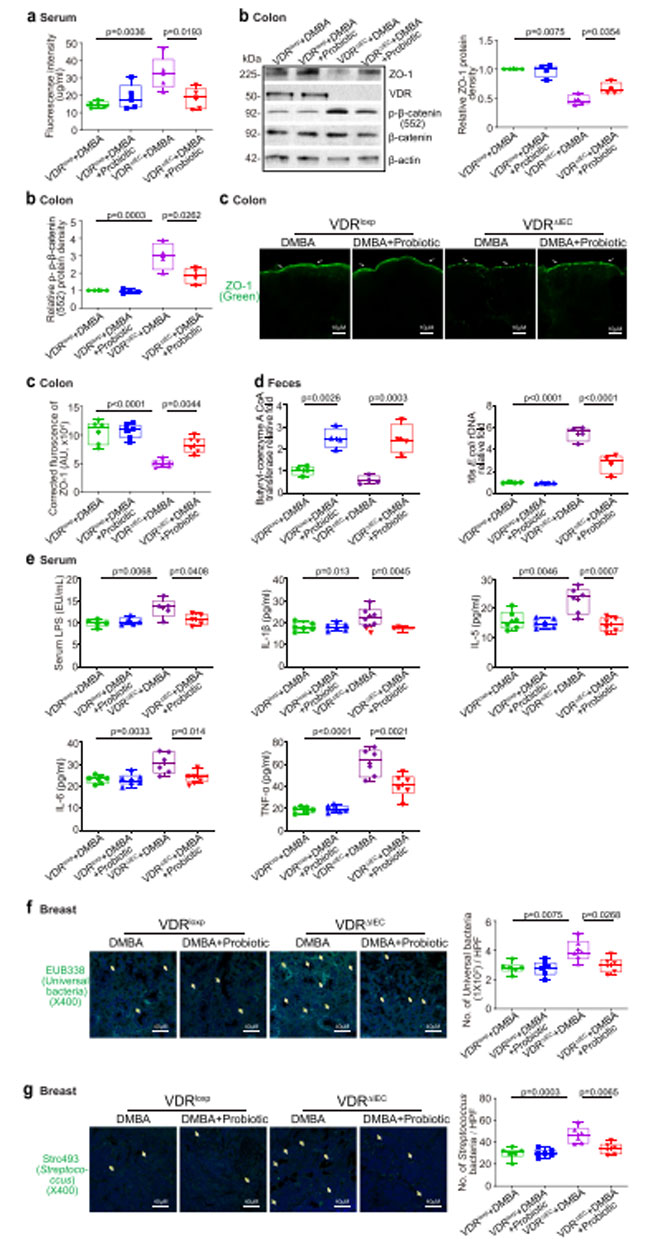 |
図8。 プロバイオティクスで処理した ビタミン D 受容体ノックアウト(VDRΔIEC)マウスは、腸透過性が低下し、腸内 ZO-1 発現が増加し、腸内毒素症が修正され、炎症の増加から保護されました。 (a) プロバイオティクスで処理した ビタミン D 受容体ノックアウト(VDRΔIEC) マウスでは腸管透過性が減少しました。 データは平均 ± SD として表されます。 N = 5、一元配置分散分析。 (b) プロバイオティクス処理を受けた ビタミン D 受容体ノックアウト(VDRΔIEC) マウスの腸における ZO-1 発現は増加しました。 プロバイオティクス処理を受けた ビタミン D 受容体ノックアウト(VDRΔIEC) マウスでは結腸の p-β-カテニン (552) 発現が減少しました。 データは平均 ± SD として表されます。 N = 4、一元配置分散分析。 ( c )免疫蛍光染色によって示されるように、プロバイオティクスで処理されたビタミン D 受容体ノックアウト(VDRΔIEC)マウスではZO-1発現が増加しました。 画像は 1 回の実験からのもので、1 グループあたり 6 匹のマウスを表しています。 データは平均 ± SD として表されます。 N = 6、一元配置分散分析。 (d) プロバイオティクス処理により、ビタミン D 受容体ノックアウト(VDRΔIEC)マウスにおいてブチリル-CoA トランスフェラーゼ遺伝子が増加し、大腸菌が減少しました。 データは平均 ± SD として表されます。 N = 4、一元配置分散分析。 (e) プロバイオティクス処理は、ビタミン D 受容体ノックアウト(VDRΔIEC)マウスの炎症の増加から保護しました。 血清リポ多糖(LPS)、IL-1β、IL-5、IL-6、および TNF-α は、プロバイオティクスで治療した ビタミン D 受容体ノックアウト(VDRΔIEC)マウスで有意に低かった。 データは平均 ± SD として表されます。 N = 5–6、一元配置分散分析。 すべての p 値が図に示されています。 ( f )プロバイオティクス処理を受けたビタミン D 受容体ノックアウト(VDRΔIEC)マウスの乳房腫瘍組織中のあまり普遍的ではない細菌が、蛍光in situハイブリダイゼーションによって発見されました。 画像は 1 回の実験からのもので、1 グループあたり 6 匹のマウスを表しています。 データは平均 ± SD として表されます。 N = 6、一元配置分散分析。 すべての p 値が図に示されています。 (g) プロバイオティクス処理を受けた ビタミン D 受容体ノックアウト(VDRΔIEC) マウスの乳房腫瘍組織における連鎖球菌の減少が、蛍光 in situ ハイブリダイゼーションによって検出されました。 画像は 1 回の実験からのもので、1 グループあたり 6 匹のマウスを表しています。 データは平均 ± SD として表されます。 N = 6、一元配置分散分析。 すべての p 値が図に示されています。 |
| 3.討論 |
| 私たちの現在の研究は、腸上皮ビタミン D 受容体が正常な宿主の恒常性にとって重要であり、乳がんを防ぐというこれまで知られていなかったメカニズムを明らかにすることで、知識のギャップを埋めています。 ビタミン D 受容体ノックアウトマウスは胸部で正常なビタミン D 受容体発現を示しましたが、炎症と細菌の負荷/転座の増加により、腸を超えた臓器での腫瘍形成のリスクが依然として増加しました。 私たちは、腸の透過性の増加、慢性炎症、および乳房腫瘍内の細菌の増加を特定しました。 さらに、有益な微生物代謝産物またはプロバイオティクス細菌を使用して腸内細菌叢を操作することにより、ビタミン D 受容体ノックアウトマウスの腫瘍負荷を軽減することができました。 統合された証拠により、腸内細菌が乳がんの発病に重要な役割を果たしていることが示されています (36,55)。 私たちの研究はさらに、乳がんの予防において腸内ビタミン D 受容体 および腸内細菌叢の機能を回復するための新しい治療標的を示唆しています (グラフの要約を参照)。 明らかに、腸内ビタミン D 受容体に関する研究は、腸の機能不全がどのようにして遠隔がんの発生を意図せず促進するかを理解するための枠組みを提供します。 これは、防御と修復におけるビタミン D 受容体の通常の役割の拡張です。 これらの洞察は、健康だけでなく病気を理解するためにも重要です。 ビタミン D 受容体 ががんに影響を与える複数のメカニズムが発見されています (6-9,56)。 1,25D3/ビタミン D 受容体 複合体は、正常な乳腺において増殖を抑制し分化を維持する遺伝子を誘導する可能性があり、ビタミン D 受容体シグナル伝達の調節不全により乳房上皮細胞が形質転換しやすくなる可能性がある(57,58)。 しかし、乳房腫瘍形成における腸内ビタミン D 受容体の機能と腸内細菌叢の間の具体的な関係は理解されていません。 人間と微生物、特に腸内微生物叢との間には複雑な共生関係が進化しており、ほぼすべてのレベルおよびすべての器官系で宿主に影響を与えているようです (36,55)。 腸内微生物や乳房部位の微生物叢を含む腸内細菌叢(59)は、乳房の健康と疾患において重要な役割を果たしています(60)。 しかし、腸と乳房の細菌叢群集の腸内ビタミン D 受容体制御についてはほとんど知られていません。 我々の以前の研究では、ビタミン D 受容体ノックアウトマウスは細菌の侵入に敏感であり、腸に重度の損傷を示すことが実証されました (11、16、17)。 ビタミン D 受容体 と細菌の相互作用は、微生物によって誘導される宿主恒常性プログラムの一例を表します。 細菌と宿主の相互作用の調節不全は、慢性炎症や過剰な修復反応を引き起こす可能性があり、腸だけでなく他の臓器(乳房など)でもがんの発生に関連しています(18-23)。 したがって、私たちの研究は、腸上皮ビタミン D 受容体 が乳がんの発症を制御するメカニズムを調査することにより、これらの知識のギャップを埋めています。 |
| 私たちは、細菌の代謝産物である酪酸塩とプロバイオティクス処理が、生体内で乳房の腫瘍を縮小できることを示しました。 乳房内の腸内毒素症は微環境を変化させ、乳房炎を引き起こし、乳がんの潜在的なリスクを引き起こす可能性があります。 最近の研究では、乳房腫瘍の常在微生物叢が、バイオマスが低いにもかかわらず、転移の促進に重要な役割を果たしていることがさらに示されました (59)。 私たちの研究は、乳房腫瘍形成における乳酸菌の保護的役割を示しました。 乳酸菌は、抗発がん性などの健康に有益な効果があることで知られています。 健康な女性と乳がん患者との間には、乳房組織内の異なる細菌プロファイルが存在します(61)。 乳がん患者では、Bacillus, Enterobacteriaceae, および Staphylococcusが相対的に多く存在しました。 ビタミン D 受容体ノックアウトマウスでは、Butyrivibrio fibrisolvens,などの酪酸生成細菌の量が減少しています (11)。 ここで我々はさらに、2つの有益な細菌種、Lactobacillus johnsoniiaとBifidobacterium pseudolongum,の存在量が糞便中で著しく下方制御されていることを報告した。 bifidobacteria と酪酸生成菌の間には交差摂食の相互作用が知られています(62)。 これらの相互作用は、結腸内でのbifidobacterial株と他のbifidobacteriaおよび酪酸生成菌との共存に有利に働く可能性があります(62)。 プロバイオティクス処理は、健康な腸内細菌叢とその機能を回復し、有益な代謝物を生成するのに役立ちました。 Lactobacillus plantarum は酪酸塩または他の短鎖脂肪酸の生成を促進し( 53,54)、腸内でのビタミン D 受容体 (VDR)タンパク質発現を増加させました( 52)。 我々は、Lactobacillus plantarum処理により細菌の酪酸- CoA CoA トランスフェラーゼの発現も増加することを示しました。 |
| 腸内細菌叢の腸内毒素症は、腸からの細菌代謝産物(SBA、短鎖脂肪酸、PAMP、ビタミン)や免疫および炎症調節因子(TLR、サイトカイン)を介して、乳がんの発生または進行に間接的に関与している可能性があります。 これらは消化管からの腸内細菌叢と密接に結びついています(36)。 ビタミン D 受容体の発現は上皮の完全性を高め、炎症を軽減します (63)。 興味深いことに、我々は、いくつかの酪酸関連モジュールもビタミン D 受容体ノックアウトマウスで下方制御されていることを発見しました。 酪酸塩は乳がん細胞株の増殖停止、アポトーシス、または分化を誘導する可能性があることが報告されています(64)。 われわれは、ビタミン D 受容体ノックアウトマウスにおける酪酸処理が、宿主の腸内毒素症を是正するだけでなく、炎症性サイトカインを阻害し、それによって乳房腫瘍を減少させるのに役立つことを発見した。 低用量の炎症誘発性サイトカインは上皮細胞による細菌エンドサイトーシスを誘導するのに十分であるため、無症状または低悪性度の変化は、その後の細胞内微生物感知および傍細胞透過性損傷により、本格的な炎症に向けて耐性のバランスを傾ける可能性があります。 さまざまながんの発症における腸内細菌叢に関する現在の知識を利用して、上皮、腸内細菌叢、代謝産物間の相互作用を理解することは、がんを含む疾患における慢性炎症を管理する戦略の開発に役立つ可能性があります。 |
| 私たちの現在の研究にはいくつかの制限があります。 マウスがカルシウムを多く含む「レスキュー」食で飼育および維持されない限り、腸の ビタミン D 受容体ノックアウトは低カルシウム血症と体重減少を引き起こす可能性があります。 現在の研究では、すべてのマウスにカルシウムを多く含む餌ではなく、通常の餌を使用しました。 我々は腫瘍形成におけるプロバイオティクスまたは微生物の代謝産物の役割に焦点を当てていたため、実験群の腸上皮ビタミン D 受容体ノックアウトマウスに同じ通常の餌を与えました(例えば、プロバイオティクス処理の有無、酪酸の有無)。 プロバイオティクス処理または酪酸処理の全体的な結果は、ノックアウトマウスの潜在的な低カルシウム血症に関係なく、乳がんの腫瘍形成を大幅に減少させました。 乳がんの発症における「レスキュー」食事の役割は、将来テストされるでしょう。 乳がんではビタミン D 受容体発現の低下とビタミン D/ビタミン D 受容体シグナル伝達の減少が観察され( 26,57)、ビタミン D 受容体はエストロゲン受容体 (ER) 陽性および エストロゲン受容体 (ER)陰性乳がん細胞の負の増殖制御因子として機能する可能性があります (57,58)。 ただし、乳がんではビタミン D 受容体の状態が全般的に低下するわけではありません。 腸および乳房の ビタミン D 受容体 タンパク質レベルに関する関連するヒトのデータはありませんでした。 現在の研究では、ジメチルベンズアントラセン 誘発がんモデルのみがテストされました。 他の乳がんモデルや人体試験における酪酸塩とプロバイオティクスの役割をテストするには研究が必要です。 微生物叢の移植が、以前は無菌であった腸内ビタミン D 受容体欠損マウスの乳房腫瘍に影響を与えることができるかどうかを示すには、さらなる研究が必要です。 |
| 疫学研究および実験研究では、ビタミン D のがんに対する保護作用が示されています( 65-71)。 ビタミン D3 は、ビタミン D 受容体 (VDR)依存的に腫瘍上皮細胞と腫瘍微小環境の間のクロストークを遮断することによって化学予防活性を発揮します( 67)。 さらに、病気の予防と治療にビタミン D 化合物を使用することへの関心が高まっています (72,73)。 腸のビタミン D 受容体 機能と健康な腸内細菌叢を維持することで、乳房の健康が促進されます。 私たちの現在の研究は、細菌産物である酪酸塩とプロバイオティクスを用いてビタミン D 受容体 を強化し、乳房腫瘍のリスクを軽減する代替方法についての洞察を提供します。 |
| 結論として、私たちの研究は、腸上皮ビタミン D 受容体 欠損が腸のバリア機能、腸内細菌叢のプロファイル/位置、および乳房の腫瘍形成に大きな影響を与えることを実証しました。 腸、乳房、腸内細菌叢の相互作用は、乳がんの予防と治療の新たな標的を示しています。 それは、乳房疾患における微生物と ビタミン D 受容体の相互作用を理解し、腸管外疾患のリスク評価と予防のための新しいプロトコルを開発する上で方向性を開く可能性があります。 |
| 4.材料と方法 |
| 4.1.動物 |
| 腸特異的ビタミン D 受容体ノックアウトマウスは、以前に報告したように、VDRloxpマウスと絨毛 cre マウス (Jackson Laboratory、004586) を交配することによって得られました (11,74,75)。 私たちは動物施設に到着した後、さらにこの系統と C57BL/6 マウスを 10 世代以上戻し交配しました。 実験は生後6〜7週目の雌マウスで行われました。 マウスには水を自由に与え、12時間の暗/明サイクルを維持した。 マウスは Teklad Irradiated Diet 7912 (Envigo、米国ウィスコンシン州マディソン) に無制限にアクセスできました。 動物実験は、UIC 動物管理局によって承認されました。 この研究で使用された動物プロトコル番号は、ACC 16 ~ 180、ACC 19 ~ 139、および ACC 20-058 です。 |
| 4.2.マウスにおけるジメチルベンズアントラセン による乳がんの誘導 |
| 雌の VDRloxp および VDRΔIEC マウス (生後 6 ~ 7 週齢) をランダムに対照群または ジメチルベンズアントラセン (DMBA)群に割り当てました。 マウスに、0.2 mlのコーン油に溶かした1.0 mgのジメチルベンズアントラセン(Sigma‒Aldrich、ミルウォーキー、ウィスコンシン州、米国)を毎週、または等量のコーン油単独(ビヒクル)を強制経口投与しました。 ジメチルベンズアントラセン処理は6 週間続きました。 次に、マウスを継続的に交配させて振動するホルモン環境を提供し、腫瘍が発生するまでモニタリングした。 12 週齢からマウスの乳腺腫瘍を週に2回検査しました。 腫瘍体積 (V) は、式 V= (W2 × L)/2 を使用してキャリパー測定により計算されました。ここで、V は腫瘍体積です。W は腫瘍の幅、L は腫瘍の長さです(76)。 最初のジメチルベンズアントラセン処理から18 週間後、または触知できる乳腺腫瘍の体積が2 cm3に達した時点で、マウスを麻酔下で屠殺しました。 腫瘍の数と測定は、実体解剖顕微鏡(Nikon SMZ1000、Melville、NY、USA)の下で盲検法で実行されました。 |
| 4.3マウスにおける酪酸塩処理 |
| 雌の VDRloxp および VDRΔIEC マウス(生後 6 ~ 7 週齢)を、ジメチルベンズアントラセン単独群または ジメチルベンズアントラセン -酪酸群のいずれかにランダムに割り当てました。 ジメチルベンズアントラセン対照群には、酪酸ナトリウムを含まない濾過した飲料水を与えました。 ジメチルベンズアントラセン酪酸処理群には、ろ過した飲料水に溶かした2.5%酪酸ナトリウム(Sigma-Aldrich、ミルウォーキー、ウィスコンシン州、米国)を投与しました。 12 週齢からマウスの乳腺腫瘍を週に2回検査しました。 マウスは、酪酸処理後 18 週目、または触知できる乳腺腫瘍の体積が 2 cm3 に達した時点で、麻酔下で屠殺されました。 |
| 4.4マウスにおけるプロバイオティクス処理 |
| 雌の VDRloxp および VDRΔIEC マウス(生後 6 ~ 7 週齢)を、ジメチルベンズアントラセン単独群または ジメチルベンズアントラセンプロバイオティクス群にランダムに割り当てました。 マウスには、0.1 mlのHBSSまたは等量のHBSS中のLactobacillus plantarum(1 × 107 CFU)を毎日強制経口摂取させた。 12 週齢からマウスの乳腺腫瘍を週に2回検査しました。 最初の メチルベンズアントラセン処理後 18 週目、または触知できる乳腺腫瘍の体積が 2 cm3 に達した時点で、マウスを麻酔下で屠殺しました。 |
| 4.5腸管透過性 |
| 最初のメチルベンズアントラセン処理から18 週間後に、フルオレセインデキストラン(分子量4 kDa、HBSSで希釈)を強制経口投与しました(50 mg/kgマウス)。 4 時間後、以前に報告されているように、蛍光強度測定のためにマウスの血液サンプルが収集されました (77)。 |
| 4.6.ヘマトキシリンおよびエオシン染色 |
| マウス結腸 (近位結腸または遠位結腸) 切片 (5 μm) を含むスライドをキシレン中で脱パラフィンし、段階的アルコールに通しました。 次に、以前に記載された方法に従ってヘマトキシリンおよびエオシンで染色しました(74)。 |
| 4.7.ウェスタンブロット分析と抗体 |
| 経産婦の年齢を一致させた対照マウスから乳腫瘍および全体的に正常な乳腺を切除し、組織の一部をウェスタンブロッティング用に調製した。 マウス結腸上皮細胞は、近位領域と遠位領域を含むマウスの結腸から組織を掻き取ることによって収集されました。 細胞を、0.2 mM オルトバナジン酸ナトリウムおよびプロテアーゼ阻害剤カクテルを含む溶解バッファー (10 mM Tris、pH 7.4、150 mM NaCl、1 mM EDTA、1 mM EGTA、pH 8.0、および 1% Triton X-100) 中で超音波処理しました。 タンパク質濃度は、Bio-Rad 試薬 (Bio-Rad、米国カリフォルニア州ハーキュリーズ) を使用して測定し、超音波処理しました。 等量のタンパク質を SDS ポリアクリルアミドゲル電気泳動で分離し、ニトロセルロース膜に転写し、一次抗体で免疫ブロットしました。 以下の抗体を使用しました:抗 ZO-1 (Invitrogen、33–9100、Carlsbad、CA、USA)、抗 p-β-catenin (552) (Cell Signaling、9566、Danvers、MA、USA)、抗 β-カテニン (BD Biosciences、フランクリン レイクス、ニュージャージー州、米国)、抗 VDR (Santa Cruz Biotechnology、SC-13133、ダラス、テキサス州、米国)、および抗 β-アクチン (Sigma-Aldrich、A5316、セント ルイス) 、ミズーリ州、米国)抗体を使用し、ECL(Thermo Fisher Scientific、32106、ウォルサム、マサチューセッツ州、米国)によって視覚化しました。 複数の抗体でプローブされたメンブレンは、再プローブする前に剥がされました。 ウェスタンブロットバンドの定量化には、Quantity One ソフトウェアを使用しました。 簡単に説明すると、最初に「長方形ツール」を選択して、バックグラウンドとウェスタンブロットのバンドを 1 つずつ測定しました。 測定後の「密度」と「体積」の値をExcelファイルに転送しました。 バックグラウンド測定値を差し引いて、ウェスタンブロット上の各バンドの「密度」値が計算されました。 |
| 4.8.免疫蛍光 |
| 結腸組織または乳房組織を新たに単離し、10% 中性緩衝ホルマリンで固定した後、パラフィンワックスに包埋しました。 前述のようにスライドを調製した後、パラフィン包埋切片(4 μm)で免疫蛍光を行い78、続いて非特異的なバックグラウンド染色を減らすためにブロッキング溶液(HBSS中2%ウシ血清アルブミン、1%ヤギ血清)中で1時間インキュベートしました。 組織サンプルを一次抗ZO-1抗体とともに4℃で一晩インキュベートしました。 スライドを洗浄緩衝液中で室温で各5 分間、3回洗浄しました。 次に、サンプルを二次抗体 (ヤギ抗ウサギ Alexa Fluor 488、Molecular Probes、カリフォルニア州; 1:200) とともに室温で 1 時間インキュベートしました。 組織を SlowFade Antifade Kit (Life Technologies, s2828, Grand Island, NY, USA) でマウントし、続いてカバースリップをかぶせ、乾燥を防ぐために端をシールしました。 標本は、Zeiss レーザー走査型顕微鏡 LSM 710 (Carl Zeiss Inc.、オーバーコッヘン、ドイツ) で検査されました。 |
| 4.9.免疫組織化学(IHC) |
| スライドの調製後、予熱したクエン酸ナトリウム(pH 6.0)緩衝液中でスライドを 15 分間インキュベートし、その後室温で 30 分間冷却することにより、抗原賦活化を達成しました。 内因性ペルオキシダーゼは、スライドを 3% 過酸化水素中で 10 分間インキュベートすることによってクエンチされ、その後 HBSS で 3 回洗浄され、非特異的バックグラウンドを低減するために HBSS 中の 3% BSA + 1% ヤギ血清中で 1 時間インキュベートされました。 VDR または p-β-カテニン (552) に対する一次抗体を低温室で一晩適用しました。 HBSS で 3 回洗浄した後、スライドを二次抗体 (1:100、Jackson ImmunoResearch Laboratories、カタログ番号 115-065-174、米国ペンシルベニア州ウェストグローブ) 中で室温で 1 時間インキュベートしました。 HBSSで10 分間洗浄した後、スライドをvectastain ABC試薬(Vector Laboratories、カタログPK-6100、Burlingame、CA 94,010、USA)とともに1時間インキュベートしました。 HBSS で 5 分間洗浄した後、一次抗体に応じて、ペルオキシダーゼ基質キット (Vector Laboratories、カタログ番号 SK-4800、Burlingame、CA 94,010) を 2 ~ 5 分間適用することによって発色させました。 ペルオキシダーゼ基質のインキュベーション時間はパイロット実験を通じて決定され、すべてのスライドで一定に保たれました。 蒸留水で洗浄した後、切片をヘマトキシリン (Leica、カタログ番号 3801570、Wetzlar、ドイツ) で対比染色しました。 エタノールとキシレンで脱水し、Permount (Fisher Scientific、カタログ番号 SP15–100、Waltham、MA、USA) を使用してカバースリップをかけました。 |
| 4.10.ターミナルデオキシヌクレオチジルトランスフェラーゼ dUTP ニックエンドラベリング (TUNEL) 染色 |
| アポトーシス細胞の数は、パラフィン包埋組織切片で In Situ Cell Death Detection Kit (Sigma-Aldrich、11684795910、セントルイス、ミズーリ州、米国) を使用して測定しました。 簡単に説明すると、抗原の賦活化は、脱パラフィンと再水和の後、スライドを予熱したクエン酸ナトリウム (pH 6.0) 緩衝液中で 15 分間インキュベートすることによって達成されました。 次に、スライドを PBS で 10 分間洗浄しました。 ブロッキング後、スライドを TUNEL 反応混合物とともに 37℃で 1 時間インキュベートしました。 組織を、PBSで10分間洗浄した後、SlowFade Antifadeキット(Life Technologies、s2828、グランドアイランド、ニューヨーク州、米国)を用いてマウントした。 染色は、Zeiss レーザー走査型顕微鏡 LSM 710 (Carl Zeiss Inc.、オーバーコッヘン、ドイツ) で検査されました。 |
| 4.11細菌DNAのリアルタイムPCR測定 |
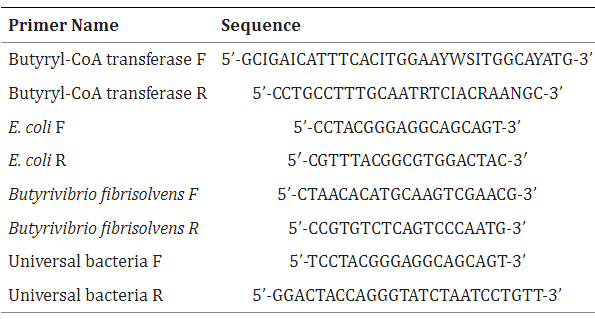
| EZNA Stool DNA キット (Omega Biotek, Inc. D4015-01, Norcross, GA 30,071) を使用して、マウスの糞便から DNA を抽出しました。 定量的リアルタイム PCR は、CFX96 リアルタイム PCR 検出システム (Bio-Rad Laboratories、米国カリフォルニア州ハーキュリーズ) および iTaqTM Universal SYBR グリーン スーパーミックス (Bio-Rad Laboratories、1725121、米国カリフォルニア州ハーキュリーズ) を使用してメーカーの指示通り実施しました。 すべての発現レベルは、同じサンプルの普遍的な細菌レベルに正規化されました。 発現パーセントは、対応する未処理の対照細胞の正規化値に対する各サンプルの正規化値の比として計算されました。 すべてのリアルタイム PCR は 3 回実行されました。 プライマー配列は、Primer-BLAST を使用して設計されたか、表 1 にリストされている Primer Bank プライマー ペアから取得されました。 |
| 表1。 リアルタイム PCR プライマー |
 |
| 4.12.マルチプレックスELISA |
| マウスの血液サンプルを心臓穿刺によって採取し、EDTA (10 mg/mL) を含むチューブに入れました。 マウスのサイトカインは、Cytokine & Chemokine コンビニエンス 26-Plex Mouse ProcartaPlex™ パネル 1 (Invitrogen、EPXR260 -26,088-90、カリフォルニア州カールズバッド) を使用して、製造元の指示に従って測定しました。 簡単に説明すると、定義されたスペクトル特性のビーズをタンパク質特異的捕捉抗体に結合させ、サンプル (既知のタンパク質濃度の標準物質、対照サンプル、および試験サンプルを含む) とともにフィルター底部マイクロプレートのウェルに添加しました。 2 時間のインキュベーション中に抗体を捕捉します。 ビーズを洗浄した後、タンパク質特異的ビオチン化検出抗体を添加し、ビーズとともに 1 時間インキュベートしました。 過剰なビオチン化検出抗体を除去した後、ストレプトアビジン結合蛍光タンパク質 R-フィコエリトリンを添加し、30 分間インキュベートしました。 洗浄して未結合のストレプトアビジン – R-フィコエリトリンを除去した後、ビーズを Luminex 検出システム (Bio-Rad、Bio-Plex 200 Systems、カリフォルニア州ハーキュリーズ) で分析しました。 |
| 4.13.血清リポ多糖検出 |
| 血清サンプル中の LPS は、メーカーの指示に従って、リムルス変形細胞溶解物発色エンドポイントアッセイ (Hycult Biotech、HIT302、ペンシルバニア州プリマス) を使用して測定しました。 サンプルをエンドトキシンを含まない水で 1:4 に希釈し、反応前に温かいプレート上で 75°C で 5 分間加熱してタンパク質を変性させました。 標準曲線を作成し、血清サンプル中の濃度 (EU/mL として表される) を計算するために使用しました。 |
| 4.14.ショットガンメタゲノムシーケンスおよびバイオインフォマティクス解析 |
| 4.14.1.研究デザインとサンプリング |
| この研究では、VDRΔIEC マウス系統とコントロール VDRLoxP マウス系統を使用しました (雄と雌、生後 6 ~ 8 週齢)。 ブリーダーは、サンプル収集に十分な量の同じ年齢のノックアウト マウスとコントロール マウスを入手するために、同じ時期に設立されました。 この研究で使用されたマウスは同腹子であり、離乳後に別のケージに移されました。 この研究で使用されたすべての動物は、UIC 動物管理委員会の動物管理方針に従って、イリノイ大学シカゴ校の生物資源研究所 (BRL) の同じ部屋で飼育されました。 VDRLoxP (雄 n = 3 および雌 n = 7) および VDRΔIEC (雄 n = 5 および雌 n = 5) のすべてのマウスを各グループにランダムに割り当てました。 |
| UIC 動物施設内のバイオセキュリティを維持するために、多くの方法が使用されています。 まず、マウスの健康監視プログラムでは、センチネル動物を利用して、UIC コロニーの病原体の状態を評価します。 センチネルマウスは、血清学、PCR、寄生虫学によって四半期ごとに検査されます。 センチネルマウスの包括的な血清学的検査は毎年行われます。 第二に、感染病原体の蔓延を制御するために動物の飼育措置が講じられます。 マウスは、微生物の侵入と拡散に対する効果的な障壁となる、滅菌済みの静的マイクロアイソレーターケージに収容されます。 病原体の暴露と拡散を減らすもう 1 つの手段は、すべての共用設備とスペースを使用前に消毒することです。 そうすることで動物の健康を確保し、研究モデルに対する交絡変数を最小限に抑え、動物コロニーの特定の病原体フリー状態を維持することができます。 |
| 4.14.2.糞便サンプルの収集とショットガンメタゲノムシーケンス |
| 新鮮な糞便サンプルが収集され、ドライアイスの入った滅菌チューブに入れられ、ゲノム配列決定のためにイリノイ大学シカゴ研究資源センターに送られました。 サンプルからの DNA は、DNeasy Power Fecal Kit (Qiagen、ヒルデン、ドイツ) を使用して、メーカーの指示に従い、前述のようにわずかに変更を加えて抽出されました 13。 ショットガンメタゲノムシーケンスは、以前の出版物16、79で説明されているように、Illumina HiSeqシステムを使用して実行されました。 品質をチェックし、リードをフィルタリングし、ノイズ配列を除去し、メタゲノムアセンブリを実行した後 80、結果として得られたアセンブリをフィルタリングしました。 1,000 ヌクレオチドより短い DNA リードは除外され、Centrifuge81 で分類されました。 最後に、包括的な NCBI GenBank 非重複ヌクレオチド データベースを検索することにより、各遺伝子に分類学的注釈が付けられました。 |
| 4.15.統計分析 |
| すべてのデータは平均 ± SD として表されます。 すべての統計検定は両側性でした。 0.05 未満のすべての p 値は統計的に有意であるとみなされました。 データ分布に基づいて、2 つのグループについてはウェルチの t 検定または対応のない t 検定を、必要に応じて 3 つ以上のグループについては一元配置分散分析を使用して、サンプル間の差異を分析しました。 統計分析は、GraphPad Prism 8 (GraphPad, Inc.、サンディエゴ、カリフォルニア州、米国) を使用して実行されました。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Gut Microbes. 2023; 15(1): 2202593.に掲載されたIntestinal vitamin D receptor protects against extraintestinal breast cancer tumorigenesis.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


