ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(植物性ヨーグルト) |
Lactobacillus plantarum HAC01の補給により、 前糖尿病患者の血糖コントロールが改善:ランダム化二重盲検プラセボ対照試験 |
Mi-Ra Oh et al., |
|
|
| 要約 |
最近の動物研究では、韓国キムチから分離されたLactobacillus plantarum HAC01 の投与により、2 型糖尿病マウスの血糖コントロールが改善されることが実証されました。 本研究では、前糖尿病のヒト被験者の代謝パラメーターに対するLactobacillus plantarum HAC01 の効果を評価しました。 耐糖能障害が単独で認められた被験者 40 名を、8 週間にわたって毎日プラセボ (n = 20) または Lactobacillus plantarum HAC01 の投与 (n = 20) を受ける群に無作為に割り当てました。 主要評価項目は食後 2 時間の血糖値 (2h-PPG) レベルの変化で、副次評価項目は HbA1c(ヘモグロビンA1c)、腸内微生物叢組成、糞便短鎖脂肪酸 (SCFA) などの他の糖代謝パラメーターの評価でした。 Lactobacillus plantarum HAC01 を添加した食事を与えたグループでは、プラセボ グループと比較して 食後 2 時間の血糖値(2h-PPG) および HbA1c レベルの大幅な低下が見られました。 しかし、空腹時血漿グルコース、インスリン、HOMA-IR、QUICKI、微生物叢組成、および糞便短鎖脂肪酸は大幅に変化しませんでした。 重篤な副作用は報告されていません。 これは、前糖尿病患者のHbA1cレベルに対して、8週間にわたって投与された単一株のプロバイオティクスサプリメントの有益な効果を示した最初の臨床試験である。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2.材料と方法 |
| 2.1. 倫理 |
| 2.2. 科目 |
| 2.3. 研究デザイン |
| 2.4. 生化学測定 |
| 2.5. 糞便微生物叢の解析 |
| 2.6. 糞便中の短鎖脂肪酸の分析 |
| 2.7. サンプルサイズと統計分析 |
| 3. 結果 |
| 3.1. 科目の特徴 |
| 3.2. グルコース代謝のパラメータ |
| 3.3. 脂質プロファイル、アディポネクチン、レプチン |
| 3.4. 糞便微生物叢の構成と短鎖脂肪酸 |
| 3.5. 安全性 |
| 4.討議 |
| 5.結論 |
本文 |
| 1.はじめに |
| 2 型糖尿病 (T2D) は、過去 20 年間で特に若者の間でさらに蔓延しています [1]。 国際糖尿病連盟によると、2019 年には 4 億 6,300 万人が糖尿病であり、この数は 2030 年までに 5 億 7,800 万人に増加すると予想されています [2]。 適切に管理すれば、患者は冠状動脈性心疾患、脳卒中、腎不全、網膜症などの心血管系後遺症を防ぐことができます[3]。 2 型糖尿病の治療は現在、ライフスタイルの変更と投薬によるインスリン抵抗性の軽減に重点を置いています。 しかし、現世代の治療法で適切な代謝制御を達成することは困難であり、多くの患者は最終的に満足のいく反応を示せません[4]。 血糖値を正常化し、治療の成功率を高める代替戦略が緊急に必要とされています。 |
| 最近のメタ分析により、腸内微生物叢の組成の変化がヒトのインスリン抵抗性の発症に寄与していることが確認されました[5]。 2 型糖尿病患者では、健康な人と比較して、Firmicutes 属の存在が減少し、比較的高レベルのBacteroidetes 属が見られます [6]。 プロバイオティクスによる腸内微生物叢の構成の変化は、インスリン抵抗性を制御する新しい手段を模索している研究者の間で大きな注目を集めています。Bifidobacterium と Lactobacillus は、プロバイオティクスに最も一般的に見られる腸内細菌叢であり、グルコース恒常性を改善するそれらの能力がいくつかの臨床試験で報告されています[7、8、9、10]。 Parkら[11]は最近、韓国キムチからLactobacillus plantarum HAC01を単離し、高脂肪食を与えたマウスでその体重減少効果を観察した。 また、L. plantarum HAC01の投与は、ストレプトゾトシン投与による膵臓機能不全の発症後に高脂肪食によって2 型糖尿病が誘発された糖尿病マウスの腸内微生物叢組成を回復することにより血糖コントロールを改善した[12]。 これらの報告は、この株がヒトの2 型糖尿病を治療する可能性があることを示しています。 この仮説を検証するために、前糖尿病患者を対象とした無作為化二重盲検プラセボ対照試験を実施しました。 我々の主な目的は、食後 2 時間の血糖値 (2h-PPG) レベルに対する L. plantarum HAC01 の影響を調査することでした。 私たちの第二の目的は、他のグルコース代謝関連パラメーター、腸内微生物叢の組成、および糞便短鎖脂肪酸(SCFA)に対するその影響を調査することでした。 |
| 2.材料と方法 |
| 2.1. 倫理 |
| この研究は試験報告統合基準(CONSORT)ガイドラインに準拠し、世界医師会ヘルシンキ宣言(2013年版)に従って実施されました。 すべての被験者は、研究に参加する前に書面によるインフォームドコンセントを提出しました。 この研究プロトコールは、全北国立大学病院の治験審査委員会(CUH 2019-03-037)によって承認され、臨床研究情報サービス(CRIS)にNo. KCT0005652として登録されました。 |
| 2.2. 科目 |
| 合計 96 人の参加者がサイトを訪問し、そのうち 40 人が次のように定義される参加基準を満たしました。
(1) 19歳から70歳まで。 (2) 孤立した耐糖能異常 (I-IGT)、 これは、75 g の経口ブドウ糖負荷試験 (OGTT) 後の 2 時間の 血糖値(2h-PPG )レベルが 140 ~ 199 mg であることによって定義されます。 (3) 臨床試験に参加するための自発的な同意とインフォームドコンセントの提供。 主な除外基準は次のとおりです。 (1) 基礎となる糖尿病の病歴; (2) 空腹時血漿グルコース (FPG) レベル ≥ 140 mg/dL または HbA1c ≥ 7.0%。 (3) スクリーニング来院前の 2 週間以内に抗生物質を投与するか、またはスクリーニング来院前の 4 週間にコルチコステロイドを投与する。 (4) スクリーニング来院前3ヶ月以内に血糖降下薬、抗肥満薬、脂質低下薬などを投与している。 (5) 心筋梗塞、心不全または脳卒中を含む急性心血管疾患、肝不全、急性または慢性腎不全、アルコールまたは薬物乱用の病歴、妊娠、授乳歴。 |
| 2.3. 研究デザイン |
| このランダム化二重盲検プラセボ対照臨床試験は、全北国立大学病院の機能性食品臨床試験センター(CTCF2)で2019年7月から2020年11月まで実施された。 被験者 (n = 40) は、コンピューターで生成されたランダム シーケンスによって L. plantarum HAC01 グループまたはプラセボ グループにランダムに割り当てられました。 介入は8週間にわたって実施され、その間、被験者は4週間間隔でL. plantarum HAC01カプセルまたはプラセボカプセルを受け取り、すべての被験者は主な食事(朝食、昼食、または夕食)後に1日1カプセルを摂取するように指示されました。 すべての被験者はプロバイオティクスまたは発酵乳製品の毎日の摂取量を記録し、他のプロバイオティクスまたは発酵乳製品を週に4回以上摂取した場合は被験者の摂取を中止した。 被験者には、8週間の介入期間中、身体活動や食事パターンなどの日常的なライフスタイルを維持することが推奨されました。 |
| 各試験カプセルには、L. plantarum HAC01 の 4 × 109 コロニー形成単位 (CFU) が含まれていました。 投与量は、血糖コントロールの改善を示し、目立った副作用なしにヒトが許容できる乳酸菌の一日摂取量を説明した以前の動物研究の結果に基づいています[12]。 プラセボカプセルは主に微結晶セルロースで構成されていました。 2 種類のカプセルの風味、色、外観、および投与量は同一でした。 |
| この研究は、1 回のスクリーニング訪問と 3 回の追加の訪問 (V1 ~ V3、各訪問の間隔は 42 日) で構成されていました。 人口統計データ、病歴、および併用薬はスクリーニング訪問時に記録されました。 適格基準が満たされていることを確認するために、経口ブドウ糖負荷試験 (OGTT)も実行されました。 訪問 1 (0 日目) および訪問 3 (84 日目) で、糞便および血液サンプルを収集しました。 バイタルサイン(訳者注:「脈拍」「血圧」「呼吸」「体温」の4つの指標)、人体計測データ、身体活動、食事摂取量、アルコール摂取量、および有害事象が来院のたびに評価されました。 糞便サンプルは訪問の前日または訪問当日の朝に採取されました。 前者の場合、被験者は糞便サンプルを翌朝まで従来の冷凍庫に保管しました。 すべての被験者は、アイスパックを含む専用の便採取キットに入れて約 5 g の便サンプルを提出しました。 糞便サンプルは -70 °C で保存され、1 mL の氷冷 100% メタノールを加えて抽出されました。 各サンプルを Retsch MM400 ミキサーミル (Retsch GmbH、ハーン、ドイツ) で 10 分間均質化し (周波数 = 30 Hz)、その後、各サンプルを 4 °C、17,000 rpm で 10 分間遠心分離しました。 上清を0.2μmのPTFEフィルターに通し、エッペンドルフチューブに移し、その後、スピードバキュームマシンで完全に乾燥させた。 |
| 2.4. 生化学測定 |
| 経口ブドウ糖負荷試験 (OGTT)は、スクリーニング訪問時および訪問 3 (84 日目) に標準化されたプロトコールを使用して投与されました。 簡単に説明すると、一晩絶食した後、被験者は 75 g のグルコース溶液を摂取し、グルコース負荷後 0、30、60、90、120 分の時点で肘正中静脈から血液サンプルを採取し、フッ化ナトリウムチューブに入れた。 0 分の血液サンプルを使用して、FPG、インスリンレベル、HbA1c、トリグリセリド (TG)、総コレステロール (TC)、HDL コレステロール (HDL-C)、LDL コレステロール (LDL-C)、アディポネクチン、およびレプチンを測定しました。 グルコース代謝関連パラメーターは、血漿グルコース絶対最大濃度 (Cmax) および曲線下面積の増分 (iAUC) を使用して評価されました。 曲線下面積の増分 (iAUC)は、各被験者の血漿グルコースの台形則を使用して計算されました [13]。 血漿グルコースレベルは、グルコースオキシダーゼ法を使用して測定した。 インスリン濃度は、Cobas e601 モジュール (日立ハイテクノロジーズ、東京、日本) を使用して測定しました。 HbA1c レベルは、自動糖化ヘモグロビン分析装置 (アークレイ工場、滋賀県、日本) を使用して測定しました。 インスリン抵抗性は、恒常性モデル評価 [14]: HOMA-IR = [FPG (mg/dL) × 空腹時インスリン (μU/mL)/405] を通じて推定されました。 インスリン感受性は、定量的インスリン感受性チェックインデックス (QUICKI) [15]: QUICKI = 1/[log(空腹時インスリン (μU/mL)) + log(FPG (mg/dL))] によって推定されました。 脂質プロファイルは、Hitachi 7600-110® アナライザー (Hitachi High-Technologies) で測定しました。 アディポネクチンは酵素免疫吸着法(Molecular Devices、サンノゼ、カリフォルニア州、米国)によって測定し、レプチンレベルは二重抗体ラジオイムノアッセイ法(Molecular Devices)によって定量しました。 |
| 2.5. 糞便微生物叢の解析 |
| 介入の前後に、40 人の被験者全員から糞便サンプルを採取しました。 総糞便 DNA は、QIAamp PowerFecal Pro DNA キット (Qiagen、ヒルデン、ドイツ) を使用して抽出されました。 細菌の 16S rRNA の V4 超可変領域は、独自の 8 bp バーコードで増幅され、Illumina MiSeq PE300 プラットフォームで配列決定されました [16]。 生の読み取りは、QIIME パイプライン [17] を使用して分析されました。 配列はフィルタリングされ、SILVA 132 データベース [18] に従って 97% の配列同一性で操作可能な分類単位にクラスター化されました。 実用的な分類単位は、門から属のレベルで特定されました。 重み付けされた UniFrac 距離は PCoA に使用されました [19]。 |
| 2.6. 糞便中の短鎖脂肪酸の分析 |
| 糞便サンプル(1.4mg)を、25μLの3-ニトロフェニルヒドラジンおよび25μLのN-3-ジメチルアミノプロピル-N'-エチルカルボジイミドを添加することによって抽出した。 各混合物サンプルを、Retsch MM400ミキサーミル(Retsch Gmbh)を用いて30分間均質化した。 14,000 rpm で 5 分間遠心分離した後、Waters BEH C18 UPLC カラム (1.7 μm、2.1 mm × 100 mm、Waters、Milford、MA、 USA)、勾配溶出の移動相として水/ギ酸 (100:0.01、v/v; 溶媒 A) およびアセトニトリル/ギ酸 (100:0.01、v/v; 溶媒 B) を使用します。 |
| 2.7. サンプルサイズと統計分析 |
| 我々は、以前の同様の研究で開発された方法に従って、必要なサンプルサイズを決定しました[20、21]。 望ましい検出力 80%、アルファ誤差確率 0.05、推定効果量 d = 1.3 に基づいて、32 人の被験者が必要であると判断しました。 潜在的な中退率が 20% であると予想し、この研究には 40 人の被験者を登録しました。 |
| すべての分析は、SAS 統計ソフトウェア バージョン 9.4 (SAS Institute、米国ノースカロライナ州ケアリー) を使用した、プロトコルごと (PP) セットのアプローチに基づいて実行されました。 カテゴリ変数は頻度と割合によって要約され、連続変数は平均値と標準偏差 (SD) または中央値と四分位範囲 (IQR) によって要約されました。 グループ間の比較では、カテゴリ変数には χ2 またはフィッシャーの直接確率検定が使用され、連続変数間の差異には独立サンプルの t 検定が必要に応じて使用されました。 p < 0.05 の値は有意であるとみなされました。 |
| 3. 結果 |
| 3.1. 科目の特徴 |
| 40人の被験者が、L. plantarum HAC01 (n = 20) またはプラセボ (n = 20) のいずれかを投与される 2 つのグループに無作為に割り当てられました。 無作為化後、同意の撤回(n = 2)および禁止薬物の投与(n = 1)により、3 人の被験者が分析セットから除外されました。 したがって、プロトコルごとのセットには、最終的に合計 37 人の被験者が含まれることになりました (図 1)。 ベースライン特性は 2 つのグループ間で類似していました (表 1 に示すように)。 |
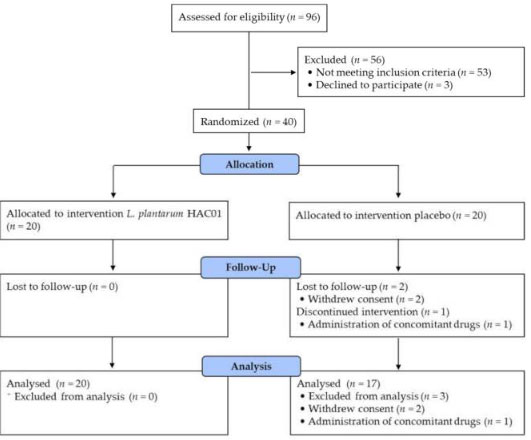 |
| 図 1 被験者の登録、割り当て、追跡、分析のフロー図 |
| 表 1 ベースライン参加者の臨床的特徴と人口統計 |
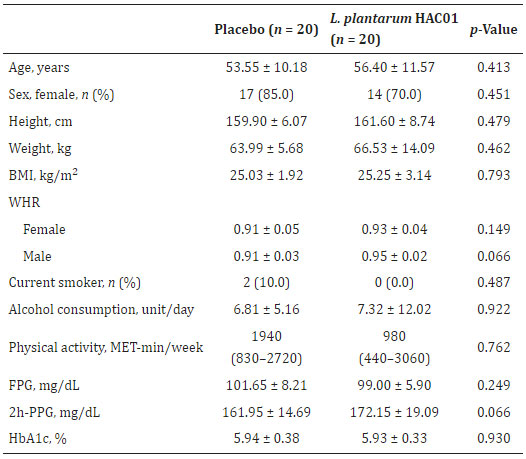 |
| BMI、肥満指数。 WHR、ウエストヒップ周囲比。 MET、タスクの代謝等価物。 FPG、空腹時血漿グルコース。 PPG、食後血漿グルコース。 MET は中央値 (四分位範囲) として表示されます。 |
| 3.2. グルコース代謝のパラメータ |
| 表 2、表 3、図 2 は、空腹時血漿グルコース(FPG)、食後2時間の血漿グルコース(2h-PPG)、iAUC0-2h、HbA1c、空腹時インスリン、HOMA-IR、QUICKI などのグルコース代謝に関連するパラメーターの変化を示しています。 プラセボ群と比較して、L. plantarum HAC01を投与した群では8週間後に2h-PPGおよびHbA1cレベルの有意な低下が観察された(表1および図2)。 FPG、空腹時インスリン、HOMA-IR、およびQUICKIにおいて、L. plantarum HAC01群とプラセボ群との間に有意差はなかった(表2および表3)。 |
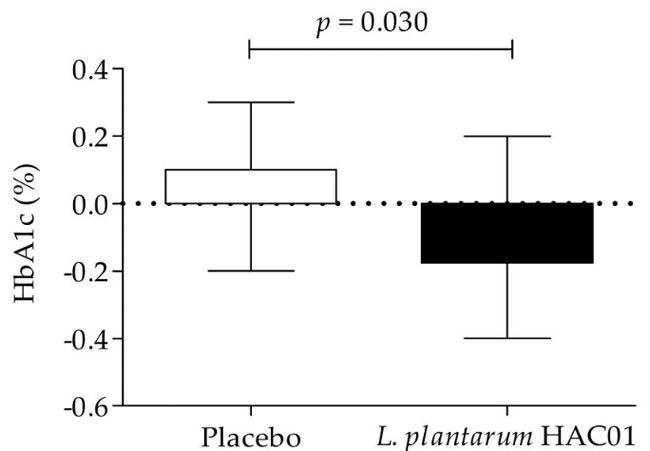 |
| 図 2 ベースライン値 (ゼロに調整) から 8 週目までの HbA1c レベルの変化 (%) に対する L. plantarum HAC01 補給の効果 |
| 表2 介入期間中の血糖値の変化 |
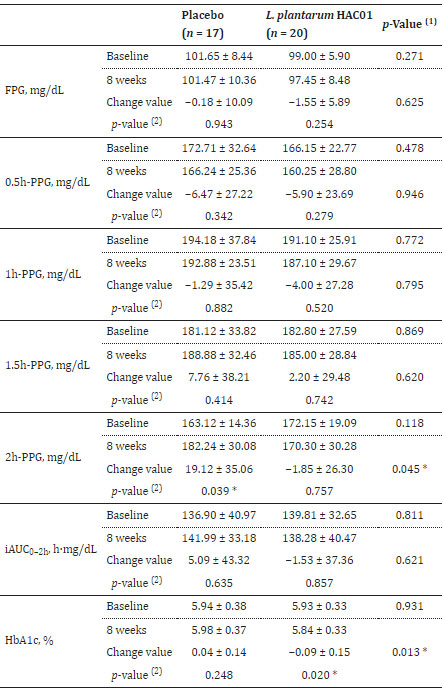 |
| FPG、空腹時血漿グルコース。 PPG、食後血漿グルコース。 iAUC、曲線下の増分面積。 p 値 < 0.05 はアスタリスク (*) で示されます。 (1) グループ間で比較する。 独立した t 検定による p 値。 (2) グループ内で比較する。 対応のある t 検定による p 値。 |
| 表 3 介入期間中のインスリン、HOMA-IR、および QUICKI の変化 |
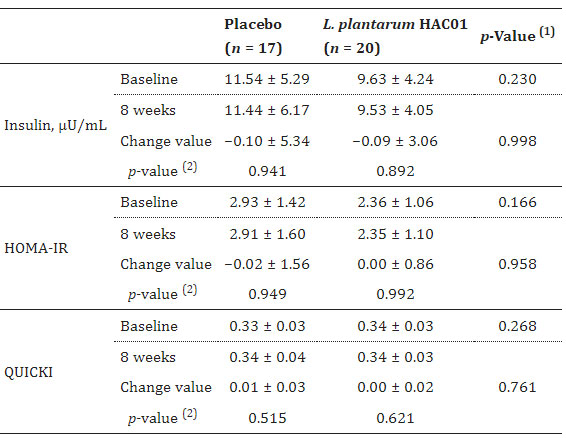 |
| HOMA-IR、インスリン抵抗性の恒常性モデル評価。 QUICKI、定量的なインスリン感受性チェック指標。 (1) グループ間で比較する。 独立した t 検定による p 値。 (2) グループ内で比較する。 対応のある t 検定による p 値。 |
| 3.3. 脂質プロファイル、アディポネクチン、レプチン |
| 8 週間の介入後、L. plantarum HAC01 群とプラセボ群の間で、TC、HDL-C、LDL-C、TG、アディポネクチン、およびレプチンに有意差はありませんでした(データは示さず)。 |
| 3.4. 糞便微生物叢の構成と短鎖脂肪酸 |
| 糞便微生物群集に対する L. plantarum HAC01 補給の効果を調べるために、糞便中の細菌組成を分析しました。 重み付けされた UniFrac 距離行列を使用して、PCoA を通じてベータ多様性を検査したところ、結果は研究グループ間に有意差がないことを示しました (データは示されていません)。 これらの結果と一致して、総短鎖脂肪酸、酢酸塩、プロピオン酸塩、イソ酪酸塩、酪酸塩、イソ吉草酸塩、吉草酸塩の糞便中濃度は、研究グループ間で有意な差はありませんでした(データは示さず)。 |
| 3.5. 安全性 |
| 介入中に 7 件の有害事象が発生しましたが、いずれも重篤なものではありませんでした。 有害事象を報告した被験者の割合は、各研究グループで同様でした(L. plantarum HAC01、n = 3; プラセボ、n = 4)。 L. plantarum HAC01 グループにおける他の安全性パラメーター (バイタルサイン、ECG、および検査データ) は、研究期間を通じて大幅に変化しませんでした (データは示されていません)。 |
| 4.討議 |
| 米国糖尿病協会 (ADA) は、空腹時血糖値の低下 (IFG、空腹時血漿グルコース(FPG)レベル 100 ~ 125 mg/dL)、IGT (経口ブドウ糖負荷試験(OGTT)中、食後2時間の血漿グルコー(2h-PPG)レベル 140 ~ 199 mg/dL) またはHbA1c(5.7〜6.4%)の 3 つの異なる条件のいずれかが満たされた場合に前糖尿病が存在すると定義しています [22]。 IFG と IGT は、単独で (I-IFG または I-IGT)、または組み合わせて (IFG + IGT) 存在します。 |
| 米国糖尿病協会の専門家委員会は、前糖尿病患者の最大 70% が最終的に 2型糖尿病と診断されると推定しています [23]。 したがって、2型糖尿病との発症を予防または遅らせるために、前糖尿病患者に健康的なライフスタイルを維持するよう奨励することが重要です。 糖尿病の発症前にライフスタイル介入と薬理学的介入の両方を実施すれば、この状況を改善できる可能性がある[24、25、26]。 この研究では、I-IGT 患者を特に対象としました。これは、このカテゴリーの前糖尿病は主に不健康な食習慣と身体的不活動に関連しており、I-IFG は男性の性別やその他の遺伝的要因とより密接に関連しているためです [27] ,28]。 I-IGT患者へのL. plantarum HAC01の8週間にわたる毎日の投与は、プラセボ群と比較して2h-PPG(主要評価項目)およびHbA1c(副次評価項目)レベルを有意に改善した。 しかし、研究グループ間で空腹時血漿グルコース(FPG)レベルに有意差はなかったことから、L. plantarum HAC01はI-IGTの前糖尿病患者には効果があるが、I-IFG患者には効果がない可能性があることが示唆された。 |
| 12週間にわたる多菌株プロバイオティクスのさまざまな製剤の使用を検討した最近の臨床試験では、2型糖尿病患者のHbA1cレベルが大幅に低下した[10、29、30]。 対照的に、単一株のプロバイオティクス(Lactobacillus casei または Lactobacillus reuteri)を使用した以前の2つの臨床試験では、HbA1cレベルを低下させることができませんでした[9、31]。 全体的に見ると、複数株のプロバイオティクスが単一株のプロバイオティクスよりも HbA1c 低下に効果的であることが報告によって示唆されています。 L. plantarum HAC01 をわずか 8 週間摂取した後、HbA1c レベルの明らかな改善が観察されました。 プロバイオティクスが腸内微生物叢の組成の調節を通じて代謝上の利点を達成することを認識していたので[32]、この発見は驚くべきものであります。 私たちは腸内微生物叢の構成を分析しました。 L. plantarum HAC01 がマウスの糞便中のAkkermansiaceae 科の存在を増加させ、Desulovibrionaceae 科の存在を減少させた我々の動物研究の結果とは対照的に [12]、ヒト糞便マイクロバイオームの存在量や分類学的組成に変化は観察されませんでした。 これらの結果は、ヒトの血糖コントロールにおいて調節的な役割を果たすのは、微生物叢組成の違いではなく、微生物産物であることを示唆しています。 ただし、糞便の微生物組成に関連する結果の解釈は慎重に進める必要があります。 糞便微生物叢は腸粘膜関連微生物叢を正確に反映していない可能性があり、-70 °C であっても糞便検体の長期保存によりサンプルの組成の変化が生じた可能性がある [33,34]。 |
| 最近の研究では、短鎖脂肪酸(酢酸塩、プロピオン酸塩、酪酸塩を含む) が腸内微生物叢とその健康増進効果を結び付ける微生物由来の一次代謝産物であることが示唆されています [35]。 短鎖脂肪酸は、GPR41やGPR43などの遊離脂肪酸の受容体に結合し、インスリン感受性と膵臓β細胞の増殖を増加させます[36]。 ベースライン値と8週目の値を比較すると、L. plantarum HAC01を投与された被験者におけるさまざまな短鎖脂肪酸の血漿中濃度に変化がないことが確認され、腸内微生物叢に由来する循環短鎖脂肪酸はHbA1cレベルの観察された改善に関与していない可能性が高いことが示唆されました。 しかし、短鎖脂肪酸はプロバイオティクスが健康状態を促進する最も可能性の高いメカニズムとして他の場所で提案されているため、この結論にはさらなる調査が必要である[35]。 そして、短鎖脂肪酸の糞便レベルは、微生物叢の組成、結腸通過時間、管腔pH、宿主の健康状態、および結腸クリアランスなどの多様な要因によって影響を受ける[37、38、39]。 さらに、サンプリングした各グループの被験者の数は少数でした。 したがって、私たちの結果は暫定的なものとして扱う必要があります。 大規模な研究では、これらの問題を検証し、L. plantarum HAC01 がグルコースパラメーターに影響を与える正確なメカニズムを評価する予定です。 |
| この研究では、主要評価項目は 食後2時間の血漿グルコース(2h-PPG) レベルの変化であり、グループ間比較では L. plantarum HAC01 補給による有意な改善が示されました (p = 0.045)。 しかし、グループ内比較では、8週間のL. plantarum HAC01補給後の食後2時間の血漿グルコース(2h-PPG)レベルに有意な改善が見られなかった。 プラセボ群の被験者は、L. plantarum HAC01を補給した群と比較して、食後2時間の血漿グルコース(2h-PPG)のベースラインレベルが比較的低かった。 これらの結果は、観察された 食後2時間の血漿グルコース(2h-PPG) レベルの改善が L. plantarum HAC01 のインスリン感作効果の結果ではないことを示しています。 これを裏付けるかのように、血漿インスリンレベル、HOMA-IR、およびQUICKIもL. plantarum HAC01の投与によって変化しないことが観察されました。 |
| この研究では、主要評価項目は 食後2時間の血漿グルコース(2h-PPG) レベルの変化であり、グループ間比較では L. plantarum HAC01 補給による有意な改善が示されました (p = 0.045)。 しかし、グループ内比較では、8週間のL. plantarum HAC01補給後の食後2時間の血漿グルコース(2h-PPG)レベルに有意な改善が見られなかった。 プラセボ群の被験者は、L. plantarum HAC01を補給した群と比較して、食後2時間の血漿グルコース(2h-PPG)のベースラインレベルが比較的低かった。 これらの結果は、観察された 食後2時間の血漿グルコース(2h-PPG) レベルの改善が L. plantarum HAC01 のインスリン感作効果の結果ではないことを示しています。 これを裏付けるかのように、血漿インスリンレベル、HOMA-IR、およびQUICKIもL. plantarum HAC01の投与によって変化しないことが観察されました。 |
| 5結論 |
| この臨床研究は最近の動物研究の結果を確認し、8週間のL. plantarum HAC01補給コースが前糖尿病患者のプラセボと比較してHbA1cおよび食後2時間の血漿グルコース(2h-PPG)レベルを有意に改善したことを実証した。 重篤な副作用は観察されず、L. plantarum HAC01には2型糖尿病の発症を予防または予防するための効果的なライフスタイル介入としての可能性があることが示唆されました。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Nutrients. 2021 Jul; 13(7): 2337.に掲載されたLactobacillus plantarum HAC01 Supplementation Improves Glycemic Control in Prediabetic Subjects: A Randomized, Double-Blind, Placebo-Controlled Trial. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


