ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(植物性ヨーグルト、プランタルム菌:研究の最前線) |
Lactiplantibacillus plantarum GOLDGUT-HNU082 は、 腸内細菌叢と神経伝達物質のレベルを調整することで、 マウスの CUMS 誘発性うつ病様行動を軽減します |
Wanggao Li et al., |
|
|
| 要約 |
新たな証拠により、うつ病は腸脳軸を介して腸内細菌叢と関連していることが明らかになっています。腸内細菌叢を調整する微生物であるプロバイオティクスは、うつ病の緩和に有望な結果を示しており、健康上の利点がある機能性食品成分としてますます認識されています。本研究では、機能性食品への応用が期待されるプロバイオティクス株である Lactiplantibacillus plantarum GOLDGUT-HNU082 (L.plantarumu 082) が、マウスの慢性予測不可能な軽度ストレス (CUMS) 誘発性うつ病に及ぼす影響を調べます。行動テスト、血清および結腸組織中の神経伝達物質および炎症性サイトカインの測定、腸内細菌叢のメタゲノム配列決定を使用して、潜在的なメカニズムを調査しました。結果は、L.plantarumu 082が 慢性予測不能軽度ストレス (CUMS)マウスのうつ病様行動を大幅に緩和し、セロトニン (5-HT) などの主要な神経伝達物質のバランスを回復し、TNF-α などの炎症性サイトカインのレベルを低下させ、海馬神経新生を促進することで脳神経可塑性を高めることを実証しました。さらに、L.plantarumu 082 は 慢性予測不能軽度ストレス (CUMS)マウスの腸内細菌叢の構成を変え、Bifidobacteriumの増殖を促進し、神経伝達物質合成に関連する代謝経路を改善しました。これらの知見は、潜在的な機能性食品成分としてのL.plantarumu 082が腸内細菌叢を再形成することでマウスのうつ病様行動を緩和することを示しており、メンタルヘルス管理のための機能性食品におけるプロバイオティクスの使用に関する新たな知見を提供しています。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 材料と方法 |
| 2.1. 材料と動物 |
| 2.2. 実験設計 |
| 2.3. 動物行動試験 |
| 2.3.1. オープンフィールド試験 (OFT) |
| 2.3.2. 高架式プラス迷路テスト (EPM) |
| 2.3.3. ショ糖嗜好試験 (SPT) |
| 2.3.4. 尾懸垂試験(TST) |
| 2.3.5. 強制水泳テスト (FST) |
| 2.4. 動物サンプルの収集 |
| 2.5. 生理学的および生化学的評価 |
| 2.6. 組織病理学的分析 |
| 2.7. 糞便メタゲノムシーケンシングと微生物種のアノテーション |
| 2.8. 血清メタボロミクス |
| 2.9. 統計分析 |
| 3. 結果 |
| 3.1. L. plantarum 082 はうつ病様行動を軽減する |
| 3.2. L. plantarum 082 は血清と結腸の神経伝達物質と炎症性サイトカインのレベルを調節する |
| 3.3. L. plantarum 082は脳内の神経伝達物質レベル、炎症性サイトカイン、海馬神経細胞マーカーに影響を及ぼす |
| 3.4. L. plantarum 082は腸内細菌叢の構成と機能を再形成します |
| 3.5. L. plantarum 082 は 慢性予測不能軽度ストレス (CUMS)モデルマウスの血清代謝物レベルを調節します |
| 3.6. L. plantarum 082の抗うつ効果の根底にある潜在的メカニズム |
| 4. 考察 |
| 5. 結論 |
本文 |
| 1.はじめに |
| 近年、うつ病は世界中でますます一般的になり、2億8千万人以上が罹患しています[1]。軽症の場合、日常生活や仕事に支障をきたします。重症の場合、自傷行為や自殺に至ることもあります。うつ病患者の自傷行為は、障害の主な原因となりつつあり、細心の注意が必要です[2]。心理療法や薬物療法などの既存の治療法は、ある程度症状を緩和してきましたが、依然として、有効性が限られており、副作用が顕著であるなど、大きな限界があります。アゴメラチン、エスシタロプラム、ボルチオキセチン、フルオキセチンなどの比較的有効性の高い抗うつ薬は、依然として治療失敗率が高く、吐き気、発疹、肝臓や腎臓の障害などの副作用が伴います[3]。そのため、うつ病の治療に効果的な戦略を模索することが極めて重要です。 |
| 腸-脳軸(GBA)が気分や行動の調節に重要な役割を果たしていることを実証する研究が増えています。腸-脳軸とは、腸と中枢神経系(CNS)の相互作用を指します[4]。腸内細菌叢は、神経系、免疫系、内分泌系、代謝系に影響を及ぼすことで、気分の調節に重要な役割を果たします。腸内細菌叢は、腸管神経系を通じて気分や行動に影響を与えるセロトニン(5-HT)(訳者注:セロトニンは、脳内の神経伝達物質で、精神を安定させ、脳を活発に働かせる効果があります。別名「幸せホルモン」とも呼ばれ、不足すると不安やイライラ、うつなどの症状が現れることがあります)などの神経伝達物質や代謝物を生成または調節することができます[5]。そのため、腸-脳軸を介した気分の調節は、抗うつ療法の開発のための潜在的な戦略として浮上しています。 |
| 腸内細菌叢を調整するプロバイオティクスには、有望な抗うつ効果が示されている。 Lactobacillus helveticus, Lactobacillus rhamnosus, および Bifidobacterium longum, などのプロバイオティクスが、患者のうつ病様行動を改善できることを示した研究が増えている [6,7,8]。臨床試験では、B. longum CCFM1025 の補給により、トリプトファン代謝経路が変化し、うつ病が大幅に緩和された [9]。別の臨床研究では、プロバイオティクスのLactobacillus plantarum 299v の補給により、大うつ病患者の代謝障害が改善し、酸化グリセロホスホコリン (oxPC) のレベルが上昇した [10]。慢性予測不能軽度ストレス (CUMS) プロトコルは、日常生活で遭遇する一連のランダムな軽度ストレス要因にマウスをさらすことでうつ病を誘発するために一般的に使用される動物モデルである。 Chevalier らの研究によると、慢性予測不能軽度ストレス (CUMS)誘発性うつ病マウスの腸内細菌叢における乳酸菌の量が著しく減少した。糞便細菌叢移植後、マウスのうつ病様行動は著しく改善し、乳酸菌の量が著しく増加した。これは、腸内細菌叢がエンドカンナビノイド系の調節を通じてうつ病表現型に影響を及ぼしていることを示唆している [1]。さらに、Zhao らの研究によると、Lactiplantibacillus plantarum R6-3 の補給により、腸内細菌叢が調整され、免疫および酸化ストレス反応が改善され、モノアミン神経伝達物質の産生が促進され、マウスのうつ病様行動が緩和されることが示された [11]。 |
| 中国海南省の発酵玉茶から分離されたL. plantarum GOLDGUT-HNU082(Lp082)は、酸および胆汁酸塩に耐性があります[12]。全ゲノム配列決定により、L. plantarum 082は有望な生理学的機能を備えたプロバイオティクスとして大きな可能性を秘めていることが示唆されています[13]。Huangらによる結果では、L. plantarum 082は腸内細菌叢の生態学的および遺伝学的安定性を高め[14]、Fusobacterium's の増殖を抑制し、炎症を軽減し[15]、腸内細菌叢の調節を介して潰瘍性大腸炎を緩和する[16]ことが示されました。さらに、L. plantarum 082は代謝経路を調節して高脂血症を予防することが示されています[17]。L. plantarum 082はゼブラフィッシュの腸内細菌叢を調節し、セロトニン(5-HT)の合成を促進することもできるため、抗うつ作用がある可能性があります[18]。 |
| 本研究では、腸脳系のシグナル伝達と神経炎症経路を調節することでうつ病関連の病態生理を緩和する機能性食品成分としてのL. plantarum 082 の可能性を調査します。食事介入の可能性を評価するために、慢性予測不能軽度ストレス (CUMS)モデルマウスで行動試験を実施し、血清/脳神経伝達物質 (セロトニン(5-HT)、ガンマアミノ酪酸(GABA)) と炎症マーカー (TNF-α、IL-6) の定量分析を補完しました。統合腸内微生物叢プロファイリング (ショットガンメタゲノミクス) とメタボロミクス分析を使用して、L. plantarum 082 が宿主生理機能と食事-微生物-宿主相互作用に及ぼす影響を体系的に評価しました。これらの知見は、精神衛生管理のための微生物叢をターゲットとした機能性食品の開発を前進させる可能性があります。 |
| 2. 材料と方法 |
| 2.1. 材料と動物 |
| 以前の研究では、L. plantarum 082は中国海南省の発酵玉茶から分離され、-80 °Cで保存されていました。玉茶を生理食塩水で1:9で均質化して懸濁液を作り、その後勾配希釈を行いました。その後、異なる勾配濃度の各懸濁液100 μLをMRS(Guangdong Huankai Microbial Technology Co., Ltd.、Guangzhou, China)寒天培地に塗布し、37 °Cで2日間培養して乳酸菌を分離しました[12]。 |
| 生後 5 週の雄 C57BL/6J マウス 24 匹は、北京維河実験動物科技有限公司 (Beijing, China) から入手しました。タンパク質 22.9%、脂肪 11.1%、炭水化物 66% を含む標準食は、江蘇省曉通医薬生物科技有限公司 (Beijing, China) から提供されました。 |
| 2.2. 実験設計 |
| 動物実験は、海南大学倫理委員会の承認を得ました (承認番号 HNUAUCC-2023-00183、2023 年 9 月 5 日)。マウスは、23 ± 2 °C、湿度 55 ± 5% の 12 時間明暗サイクルの特定病原体フリー (SPF) グレードの動物施設で飼育されました。1 週間の順応後、マウスは Con グループ (n = 8)、Mod グループ (n = 8)、L. plantarum 82 グループ (n = 8) の 3 つのグループにランダムに分けられました。Con グループを除き、マウスは 8 週間毎日予測不可能なストレス要因にさらされました。ストレス要因には、濡れた寝具、寝具なし、拘束、ケージの傾斜、明暗サイクルの変更、点滅する光、4 °C の冷水浴などがありました。平均して、1 日に 2 つのストレス要因が適用されました。詳細なスケジュールは表S1に示されています。この期間中、ConグループとModグループには毎日午前10時に200μLの生理食塩水が経口投与され、L. plantarum 082グループには同じ方法で毎日午前10時に200μLのL. plantarum 082懸濁液(1×109 CFU)が投与されました。8週間後、行動テストが行われました。 |
| 2.3. 動物行動試験 |
| 2.3.1. オープンフィールド試験 (OFT) |
| オープンフィールド試験 (OFT)は、温度、湿度、光強度が管理された、十分に断熱された実験室で実施されました。1 時間の順応後、マウスをオープンフィールド ボックスの底にそっと置きました。その後 8 分間、マウスの活動がビデオ カメラで記録されました [19]。動物行動実験の記録ビデオの分析には、ソフトウェア VisuTrack v.3 (Shanghai Xinruan Information Technology Co., Ltd.、Shanghai, China) を使用しました。各オープンフィールド試験の前に、臭いを除去するためにボックスを 75% エタノールで消毒しました。 |
| 2.3.2. 高架式プラス迷路テスト (EPM) |
| マウスを迷路内に配置し、実験中は各マウスが同じ場所にいることを確認し、その後 5 分間、マウスの活動をビデオ カメラで記録しました。アーム開放時間は VisuTrack ソフトウェアを使用して分析しました。実験中、実験者は迷路から 1 m の距離を維持しました。 |
| 2.3.3. ショ糖嗜好試験 (SPT) |
| ショ糖嗜好試験 (SPT)は、適応訓練部分と試験部分の 2 つの部分から構成されています。48 時間の適応訓練期間中、各ケージに蒸留水 1 本と 1% (w/v) ショ糖溶液 1 本が置かれ、その間に水ボトルの位置が入れ替わりました。適応訓練後、マウスは 24 時間絶食し、水分を摂取しませんでした。その後、12 時間の試験のために蒸留水とショ糖水溶液をマウスに与え、12 時間後にショ糖溶液と蒸留水の消費量を記録しました。 |
| 2.3.4. 尾懸垂試験(TST) |
| 尾懸垂試験中、動物は6分間の試験プロトコルを受け、最初の2分間は慣れ期間とされ、その後の不動期間は最後の4分間の観察間隔で定量化されました[20]。不動時間が長いほど、マウスが試験の後半で逃走を試みる頻度が低くなるため、抑うつレベルが高いことを示しています。 |
| 2.3.5. 強制水泳テスト (FST) |
| マウスは、水深 18 cm、温度 23~25 °C の水が入ったプラスチック製のシリンダーに 5 分間入れられました。マウスの活動はカメラで記録され、ソフトウェアを使用して不動時間が自動的に評価されました。不動時間が長いほど、うつ病のレベルが高いことを示します。 |
| 2.4. 動物サンプルの収集 |
| 行動試験後、ショットガンメタゲノムシーケンシングのために新鮮な糞便サンプルを無菌的に収集しました。12 時間の絶食期間の後、麻酔下で眼窩後出血により血液サンプルを採取し、続いて頸椎脱臼により安楽死させました。全血を室温で 2 時間凝固させた後、遠心分離 (3000 rpm、20 分、4 °C) して血清を分離し、分注して生化学分析まで -80 °C で保管しました。脳と結腸組織は直ちに切除し、2 つのアリコートに分けました。1 つは組織病理学的検査用に 4% パラホルムアルデヒドで固定し、もう 1 つは分子研究用に液体窒素で瞬間凍結しました。 |
| 2.5. 生理学的および生化学的評価 |
| 血清、結腸、脳組織中のセロトニン(5-HT)、腫瘍壊死因子アルファ (TNF-α)、ドーパミン (DA)(訳者注:ドーパミンは、脳内で生成される神経伝達物質で、やる気や集中力、モチベーション、快感、幸福感、運動調節などに関与しています)、インターロイキン (IL)-6、アセチルコリン (Ach)、ガンマアミノ酪酸 (GABA)、グルタミン酸 (Glu)、ノルエピネフリン(NE)、インターロイキン-1β (IL-1β)、およびリポ多糖 (LPS) のレベルを、上海新宇生物技術有限公司 (Shanghai, China) の ELISA キットを使用して測定した。 |
| 2.6. 組織病理学的分析 |
| 海馬組織を 4% パラホルムアルデヒドで固定し、脱水し、パラフィンに包埋し、切片を作製しました。神経細胞構造を観察するために、ニッスル染色を行いました。脱パラフィン、抗原賦活、非特異的結合のブロッキングの後、切片を、赤または緑の蛍光標識を結合させた、脳由来神経栄養因子 (BDNF)、ダブルコルチン (DCX)、シナプトフィジン、シナプス後密度タンパク質 95 (PSD-95)、グリア線維性酸性タンパク質 (GFAP) に対する一次抗体とともに一晩インキュベートしました。次に、切片を蛍光標識二次抗体とともにインキュベートし、核を可視化するために DAPI で染色し、蛍光顕微鏡用に退色防止試薬を塗布しました。組織病理学的分析に使用した抗体と試薬は、Servicebio Technology Co., Ltd. (Wuhan, China) から提供されました。 |
| 2.7. 糞便メタゲノムシーケンシングと微生物種のアノテーション |
| QIAamp DNA Stool Mini Kit (Qiagen、Hilden, Germany) を使用して、製造元の指示に従ってマウスの糞便サンプルから全 DNA を抽出しました。DNA の純度と完全性を評価しました。シーケンシングライブラリは、Illumina NEBNext® Ultra DNA Library Prep Kit (NEB、Ipswich, MA, USA) を使用して準備し、超音波処理により約 350 bp の DNA フラグメントを取得しました。ショットガンメタゲノムシーケンシングは、Novogene Co., Ltd. (Beijing, China) の Illumina NovaSeq 2500 プラットフォームで実施しました。メタゲノムデータは、HUMAnN3 v.3 ソフトウェアを使用して分析し、微生物種を特定しました。代謝経路と存在量情報は、MetaCyc データベースに基づいて予測されました。 |
| 2.8. 血清メタボロミクス |
| 実験サンプルはまず 4 °C で解凍し、その後 1 分間ボルテックスして完全に混合しました。サンプルの適切な量を 2 mL 遠心管に移し、400 µL のメタノール溶液を加えました。さらに 1 分間ボルテックスした後、サンプルを 4 °C で 10 分間 12,000 rpm で遠心分離しました。上清を新しい 2 mL 遠心管に慎重に移し、濃縮乾固しました。次に、残渣を 4 ppm の 2-クロロ-L-フェニルアラニンを含む 80% メタノール溶液 150 µL に再溶解し、0.22 µm の膜で濾過しました。濾過した溶液を LC-MS/MS 分析用のバイアルに移しました。 |
| 2.9. 統計分析 |
| データの分析は、GraphPad Prism v.8 および R ソフトウェア (v.4.3.1) を使用して実行されました。実験値は、平均 ± 平均の標準誤差 (SEM) として表されました。グループ間の差異の比較には、一元配置分散分析を使用しました。統計的有意性、強い有意性、非常に強い有意性は、それぞれ p < 0.05、p < 0.01、p < 0.001 とみなされました。 |
| 3. 結果 |
| 3.1. L. plantarum 082 はうつ病様行動を軽減する |
| この研究では、マウスの慢性予測不能軽度ストレス (CUMS)モデルを使用して、一連の行動テストを通じて L. plantarum 082 の抗うつ効果を評価し、これを Con および Mod グループと比較しました (図 1A)。結果は、Mod グループが以前の研究結果と一致して、有意にうつ病様行動を示しました [21]。具体的には、Con グループと比較して、Mod グループのマウスはオープンフィールド試験 (OFT)中に中心領域の活動時間が有意に減少し (p < 0.05) (図 1B、C)、ショ糖嗜好が減少し (p < 0.05) (図 1D)、尾懸垂試験(TST)と 強制水泳テスト (FST) の両方で不動性が増加し (p < 0.05) (図 1F、G)、探索行動、無快感症、絶望が減少したことを示しています。これらの結果により、慢性予測不能軽度ストレス (CUMS)モデルの成功が確認されました。 Mod グループと比較して、L. plantarum 082 を投与されたマウスは、中心領域の活動時間の増加、ショ糖嗜好の上昇、不動時間の減少など、4 つのテストすべてで有意な改善を示し (p < 0.05)、強力な抗うつ効果が示唆されました。さらに、オープンアームでのマウスの活動時間は、ある程度不安を反映する可能性があります。本研究では、Con、Mod、および L. plantarum 082 グループ間でオープンアーム活動時間に有意差はありませんでした (図 1E)。総合的に、これらの結果は、L. plantarum 082 がマウスのうつ病を大幅に改善したことを示しています。 |
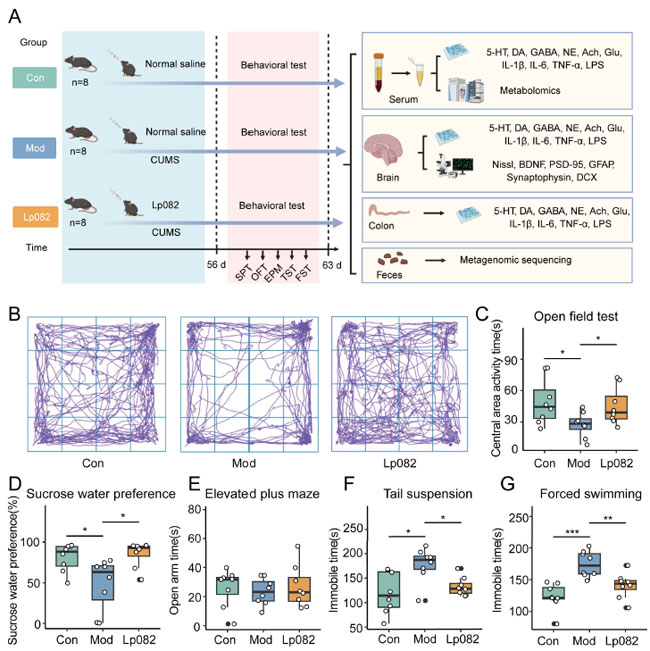 |
| 図1 L. plantarum 082 (Lp82)は慢性予測不能軽度ストレス (CUMS)誘発性の抑うつ様行動を軽減します。(A) 実験のフローチャート。(B) オープンフィールド試験 (OFT)におけるマウスの活動の軌跡図。(C) オープンフィールド試験 (OFT)の中央領域におけるマウスの活動時間。(D) ショ糖嗜好試験 (SPT)におけるマウスのショ糖嗜好率。(E) 高架式プラス迷路テスト (EPM)のオープンアームにおけるマウスの活動時間。(F) 尾懸垂試験(TST)におけるマウスの不動時間。(G) 強制水泳テスト (FST)におけるマウスの不動時間。データは平均 ± 平均の標準誤差 (SEM) として表されます。* p < 0.05、** p < 0.01、*** p < 0.001。 |
| 3.2. L. plantarum 082 は血清と結腸の神経伝達物質と炎症性サイトカインのレベルを調節する |
| うつ病の発症は神経伝達物質の不均衡 [22] と炎症反応 [23] に密接に関連しています。慢性予測不能軽度ストレス (CUMS)モデルマウスにおける神経伝達物質と炎症性サイトカインのレベルに対する L. plantarum 082 の効果を調べるために、3 つのグループの血清と結腸のサンプルを分析しました。Mod グループは、Con グループとL. plantarum 082 グループと比較して、血清中のセロトニン (5-HT)、ドーパミン (DA)、ガンマアミノ酪酸 (GABA)、およびノルエピネフリン (NE)のレベルが有意に低く (p < 0.05) (図 2A、C、D、F)、うつ病に関連する神経伝達物質の不均衡が確認されました [24]。さらに、Mod グループと Con グループの間で血清リポ多糖類(LPS) レベルに差はありませんでした (図 2J)。対照的に、L. plantarum 082を投与されたマウスでは、ガンマアミノ酪酸 (GABA)、セロトニン (5-HT)、ノルエピネフリン (NE)のレベルが有意に回復し(p < 0.05)(図2A、D、F)、リポ多糖類(LPS)レベルは有意に減少しました(p < 0.05)(図2J)。 |
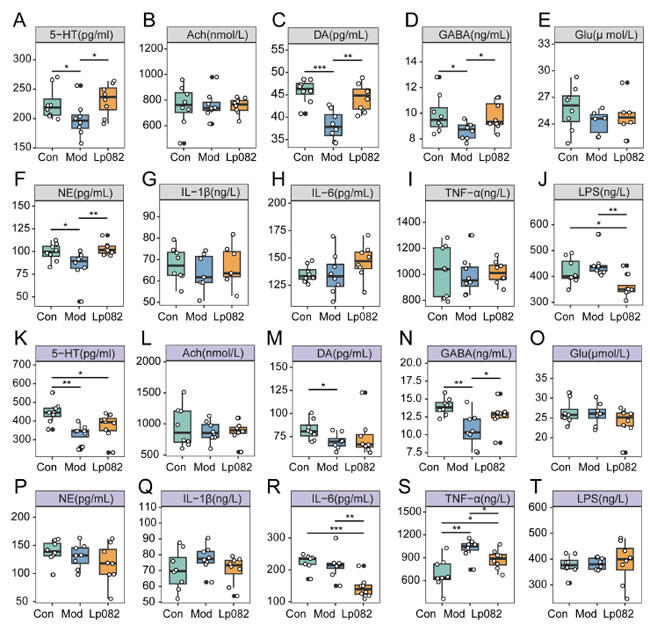 |
| 図2 L. plantarum 082(Lp082)は、血清と結腸の神経伝達物質と炎症性サイトカインのレベルを調節します。(A–J) 血清中の神経伝達物質と炎症性サイトカインのレベル。(A) セロトニン (5-HT) レベル、(B) アセチルコリン (Ach) レベル、(C) ドーパミン (DA) レベル、(D) ガンマアミノ酪酸 (GABA) レベル、(E) グルタミン酸 (Glu) レベル、(F) ノルエピネフリン (NE) レベル、(G) インターロイキン-1β (IL-1β) レベル、(H) インターロイキン(IL-6) レベル、(I) 腫瘍壊死因子アルファ (TNF-α) レベル、(J) リポ多糖 (LPS) レベル。(K–T) 結腸の神経伝達物質と炎症性サイトカインのレベル。 (K) セロトニン (5-HT)レベル、(L) アセチルコリン(Ach) レベル、(M) ドーパミン (DA)レベル、(N) ガンマアミノ酪酸 (GABA)レベル、(O) グルタミン酸(Glu )レベル、(P) ノルエピネフリン (NE)レベル、(Q) インターロイキン-1β (IL-1β) レベル、(R) インターロイキン(IL-6)レベル、(S) 腫瘍壊死因子アルファ (TNF-α)レベル、(T) リポ多糖 (LPS)レベル。データは平均 ± SEM として表されます。* p < 0.05、** p < 0.01、*** p < 0.001。 |
| 結腸では、Con グループと比較して、Mod グループは全グループの中で セロトニン (5-HT) 、ドーパミン (DA)、ガンマアミノ酪酸 (GABA)のレベルが有意に低く (p < 0.05) (図 2K、M、N)、腫瘍壊死因子アルファ (TNF-α)のレベルが有意に高く (p < 0.05) (図 2S)、神経伝達物質レベルの不均衡と腸の炎症反応を示しています。対照的に、L. plantarum 082治療はこれらのパラメータを大幅に改善し、セロトニン (5-HT)の顕著な増加 (p < 0.05) (図 2K)、ガンマアミノ酪酸 (GABA)レベルの回復 (p < 0.01) (図 2N)、インターロイキン(IL-6)および 腫瘍壊死因子アルファ (TNF-α)レベルの大幅な減少 (p < 0.05) (図 2R、S) が見られました。しかし、ドーパミン (DA)レベルには有意な変化は見られませんでした (図 2M)。これらの結果は、L. plantarum 082が神経伝達物質と炎症性サイトカインのレベルを調節することで抗うつ効果を発揮する可能性があることを示唆しています。 |
| 3.3. L. plantarum 082は脳内の神経伝達物質レベル、炎症性サイトカイン、海馬神経細胞マーカーに影響を及ぼす |
| L. plantarum 082の脳への影響をさらに調査するため、脳組織内の神経伝達物質と炎症性サイトカインのレベルを測定し、ニッスル染色と免疫蛍光染色を使用して海馬神経細胞マーカーを評価しました。Con グループと比較して、Mod グループのマウスの脳では神経伝達物質に有意な変化が見られ、セロトニン (5-HT)、ドーパミン (DA)、ノルエピネフリン (NE)レベルの有意なダウンレギュレーション (p < 0.05) が見られました (図 3A、C、F)。これはうつ病で観察されたセロトニン (5-HT)レベルの低下と一致しています [25]。さらに、統計的有意性はないものの、Mod グループではガンマアミノ酪酸 (GABA)レベルも低下しました。L. plantarum 082による治療により、ガンマアミノ酪酸 (GABA)レベルが上昇する傾向が見られました (図 3D)。さらに、L. plantarum 082は脳内のリポ多糖 (LPS)レベルを大幅に低下させ (図 3I)、潜在的な抗炎症作用があることを示唆しています。 |
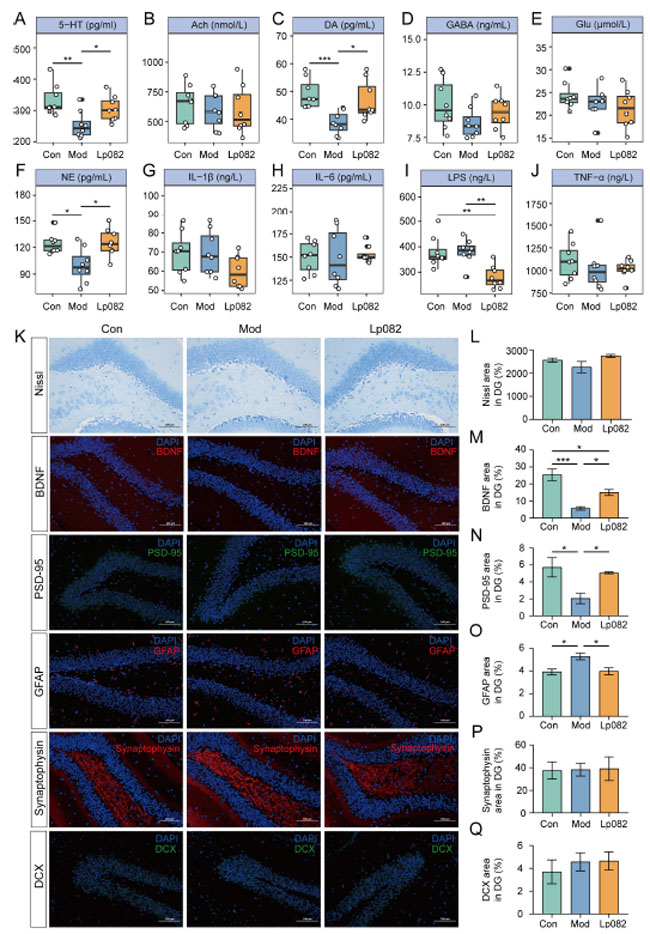 |
| 図3 慢性予測不能軽度ストレス (CUMS)モデルマウスの脳組織における神経伝達物質と炎症性サイトカインのレベルおよび海馬DG領域(訳者注:海馬の歯状回(DG)領域は、海馬における記憶の形成と想起に重要な神経回路の一部です)のニューロン関連マーカーに対するL. plantarum 082の効果。(A~J) 脳組織における神経伝達物質と炎症性サイトカインのレベル:セロトニン (5-HT)(A)アセチルコリン (Ach)(B)、ドーパミン (DA)(C)、ガンマアミノ酪酸 (GABA)(D)、グルタミン酸(Glu )(E)、ノルエピネフリン (NE)(F)、インターロイキン-1β (IL-1β)(G)、インターロイキン(IL-6)(H)、リポ多糖 (LPS)(I)、および腫瘍壊死因子アルファ (TNF-α)(J)。(K) ニッスル染色を使用して海馬DG領域のニューロンの状態を観察し、免疫蛍光染色により脳由来神経栄養因子(BDNF)、シナプス後密度タンパク質95(PSD-95)、グリア線維性酸性タンパク質(GFAP)、シナプトフィジン、およびダブルコルチン(DCX)の発現が示されました。 (L–Q) 海馬の DG 領域における上記マーカーの陽性発現の割合: ニッスル染色 (L)、脳由来神経栄養因子(BDNF)(M)、シナプス後密度タンパク質95(PSD-95)(N)、グリア線維性酸性タンパク質(GFAP) (O)、シナプトフィジン (P)、および ダブルコルチン(DCX)(Q)。データは平均 ± SEM として表されます。* p < 0.05、** p < 0.01、*** p < 0.001。 |
| 海馬領域(CA1、CA3、およびDG)の免疫蛍光分析により、慢性予測不能軽度ストレス (CUMS)によるニューロンマーカーとシナプスマーカーの有意な変化が明らかになりました。Conグループと比較して、Modグループでは、CA1、CA3、およびDG領域で脳由来神経栄養因子(BDNF)レベルが有意に低下し(p < 0.05)(図S1CおよびS2C)、CA3およびDG領域でシナプス後密度タンパク質95(PSD-95)レベルが有意に低下し(p < 0.05)(図S1DおよびS2D)、神経可塑性とシナプス機能の障害を示しています。対照的に、L. plantarum 082治療によりこれらのマーカーの発現が回復し、神経保護効果が示唆されました。さらに、ModグループではDG領域でグリア線維性酸性タンパク質(GFAP)発現が有意に上昇しており、神経炎症反応を示しています。 L. plantarum 082投与により、慢性予測不能軽度ストレス (CUMS) によって上昇した グリア線維性酸性タンパク質(GFAP)レベルが大幅に低下しました (p < 0.05) (図 3O)。これは、その抗炎症効果をさらに裏付けるものです。全体的に、L. plantarum 082は神経伝達物質のバランスを調整し、炎症を軽減し、海馬神経機能を回復させることで、マウスのうつ病様行動を軽減しました。 |
| 3.4. L. plantarum 082は腸内細菌叢の構成と機能を再形成します |
| 慢性予測不能軽度ストレス (CUMS)への曝露により、腸内細菌叢の構成が大幅に変化しました (図 4A)。Con グループと比較すると、Mod グループでは、Alistipes 属、Lachnospiraceae 細菌、Bacteroides 属 L10_4、Muribaculum intestinale、Duncaniella freteri など、いくつかの種が大幅に増加しました。逆に、Mod グループでは、B. pseudolongum、Faecalibaculum rodentium、Bacteroidales 細菌が大幅に減少しており、慢性予測不能軽度ストレス (CUMS)によって腸内細菌叢の異常が誘発されたことを示しています。これらの変化は、L. plantarum 082投与後に大幅に回復しました。 Mod グループで減少した B. pseudolongum、F. rodentium、B. bacterium などの菌種はL. plantarum 082グループで有意に増加し、Mod グループで増加した D. freteri や B. sp. L10_4 などの菌種は L. plantarum 082投与後に有意に減少しました。本研究で使用したプロバイオティクス菌株 (L. plantarum 082) は L. plantarum 082グループで特定され、定着が成功したことが確認されました。さらに、有益な細菌である Akkermansia muciniphila の量は Mod グループと比較してL. plantarum 082グループで有意に増加しており、L. plantarum 082が腸内細菌叢の構成に有益な効果をもたらすことをさらに裏付けています。 |
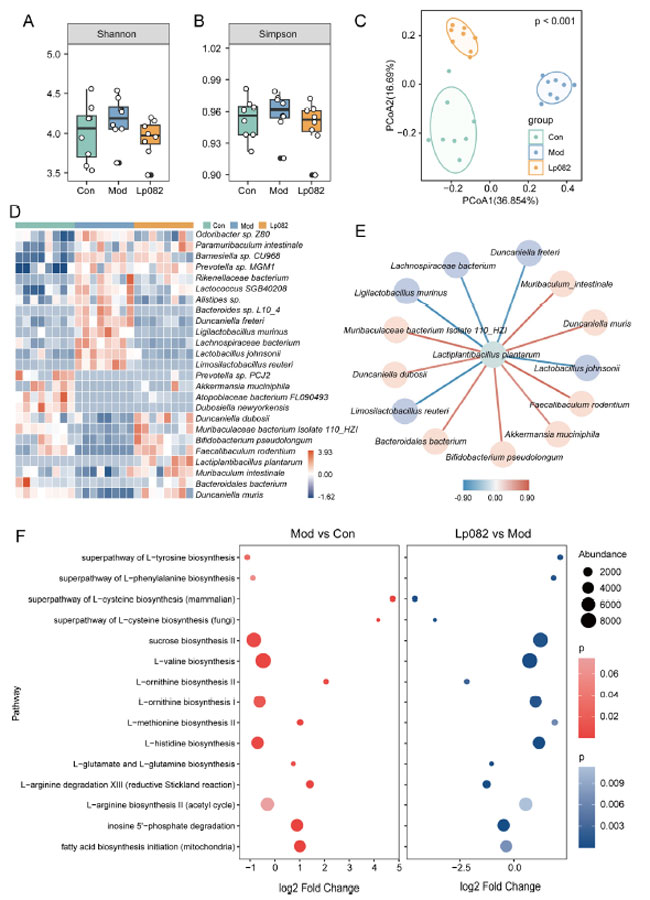 |
| 図4 L. plantarum 082は腸内細菌叢の不均衡を改善しました。(A) シャノン指数。(B) シンプソン指数。(C) 微生物群集の主座標分析 (PCoA)。(D) 種レベルでの微生物存在量の差異のヒートマップ。(E) L. plantarum 082と異なる種との相関ネットワーク。(F) 微生物代謝経路。 |
| 次に、L. plantarum と他の差別化細菌種との相関分析を実施しました (図 4E)。L. plantarum 082は、B. pseudolongum、A. muciniphila、F. rodentium、および M. intestinale (赤) と正の相関を示しましたが、D. freteri および B. sp. L10_4 (青) とは負の相関を示しました。 |
| 最後に、L. plantarum 082が微生物代謝経路に及ぼす影響を調べました (図 4F)。 Mod グループは Con グループと比較して、神経伝達物質合成、炎症、エネルギー代謝に関連する代謝経路に有意な変化を示しました。特に、L-ヒスチジンおよび L-フェニルアラニン生合成に関連する経路はダウンレギュレーションされ、L-グルタミンおよび L-グルタミン生合成に関連する経路はアップレギュレーションされました (p < 0.05)。アミノ酸代謝は神経系にとって重要です。たとえば、フェニルアラニンはドーパミン (DA)およびノルエピネフリン (NE)合成の前駆体です [26]。うつ病患者では、アミノ酸レベルの調節不全がうつ病行動に寄与している可能性があります [27]。この研究では、Mod グループのマウスはうつ病のような行動を示しました。これらの行動は、腸内微生物アミノ酸代謝経路の変化に関連している可能性があります。 L. plantarum 082介入により、L-フェニルアラニン生合成を含むいくつかの腸内微生物代謝経路の豊富さが大幅に回復しました。この介入により、マウスのうつ病様行動も著しく緩和されました。したがって、L. plantarum 082は腸内微生物叢の構造と機能を回復し、代謝バランスを再構築し、アミノ酸代謝を調節することでうつ病を緩和する可能性があります。 |
| 3.5. L. plantarum 082 は 慢性予測不能軽度ストレス (CUMS)モデルマウスの血清代謝物レベルを調節します |
| L. plantarum 082がどの代謝物を調節してうつ病を軽減するかを調べるために、血清メタボロミクス分析を実施しました。ボルカノ プロットには、有意にアップレギュレーションおよびダウンレギュレーションされた代謝物の数が表示され (図 5A、B)、ヒートマップには Con、Mod、および L. plantarum 082グループ間の差異的代謝物の分布が示されました (図 5C)。Con グループと比較して、Mod グループの 5-ヒドロキシインドール酢酸 (5-HIAA) および L-フェニルアラニンのレベルは有意に増加しました (p < 0.05)。L. plantarum 082 治療後、5-ヒドロキシインドール酢酸 (5-HIAA)および L-フェニルアラニンのレベルは有意に減少しました。これは、L. plantarum 082が セロトニン (5-HT)およびフェニルアラニン代謝を調節してうつ病の緩和に寄与している可能性を示唆しています。 |
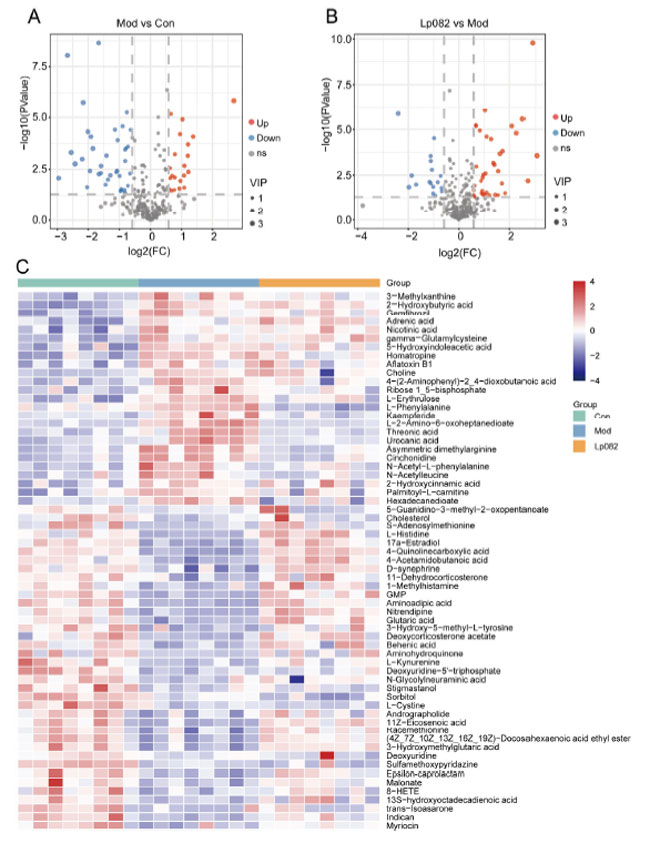 |
| 図5 L. plantarum 082は 慢性予測不能軽度ストレス (CUMS)モモデルマウスの血清代謝物レベルを調節します。(A、B) 代謝物火山プロット。(C) 差分代謝物のヒートマップ。 |
| 血清代謝産物濃縮分析により、Mod グループの代謝経路、特にトリプトファン代謝、ヒスチジン代謝、および不飽和脂肪酸の生合成に有意な変化が認められました (図 6A)。これらの所見は、うつ病には脂肪酸およびアミノ酸代謝を含む広範な代謝障害が関与している可能性があることを示しています。Mod グループと比較して、L. plantarum 082治療は脂肪酸代謝を有意に調節し、アミノ酸代謝、硫黄代謝、およびリン脂質代謝を含む他のいくつかの代謝経路にプラスの影響を及ぼしました (図 6B)。これらの所見は、L. plantarum 082が脂質およびアミノ酸代謝経路を調節することにより、うつ病に関連する代謝障害を改善する可能性があることを示唆しています。 |
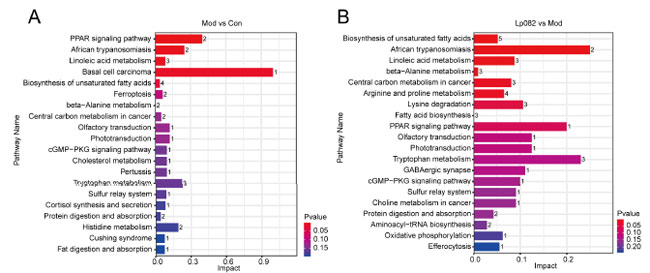 |
| 図6 差異代謝産物の濃縮マップ。(A、B) 差異代謝産物濃縮棒グラフ |
| 3.6. L. plantarum 082の抗うつ効果の根底にある潜在的メカニズム |
| 観察された効果の根底にある潜在的メカニズムを特定するために、包括的な分析が行われました。スピアマン相関分析により、腸内細菌種、代謝経路、生化学マーカーの間に有意な関係があることが明らかになりました (図 7)。B. pseudolongum、F. rodentium、および M. intestinale は L. plantarum と正の相関関係にあり、それらの存在量は L. plantarum 082グループで有意に増加しました (p < 0.05) (図 3D、E)。対照的に、Ligilactobacillus murinus および Lachnospiraceae 細菌は負の相関関係を示しました。L-フェニルアラニン、L-チロシン、および L-ヒスチジン生合成に関連する代謝経路の存在量の増加は、血清中の ドーパミン (DA)および脳内の ノルエピネフリン (NE)、セロトニン (5-HT)、および ドーパミン (DA)と正の相関関係がありました。これらのアミノ酸の生成増加は、ノルエピネフリン (NE)と ドーパミン (DA)の合成を促進し、L. plantarum 082 の抗うつ効果に寄与していると考えられます。これらの結果は、L. plantarum 082 が腸内細菌叢と代謝経路を調整することでうつ病を軽減することを示唆しています (図 8)。 |
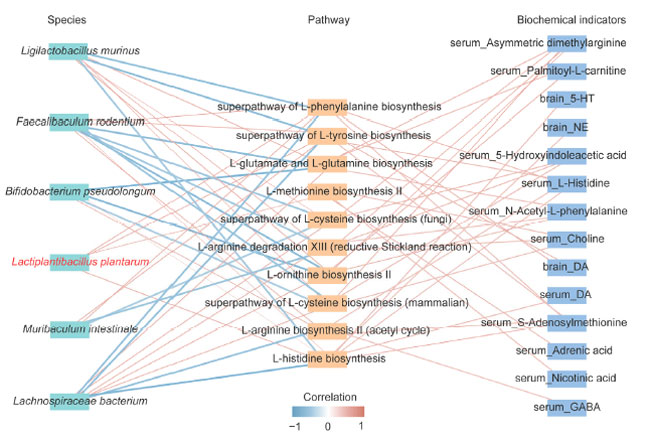 |
| 図7 相関分析。腸内細菌叢、代謝経路、生化学的指標の相関ネットワーク マップ。赤い線は正の相関を表し、青い線は負の相関を表します。 |
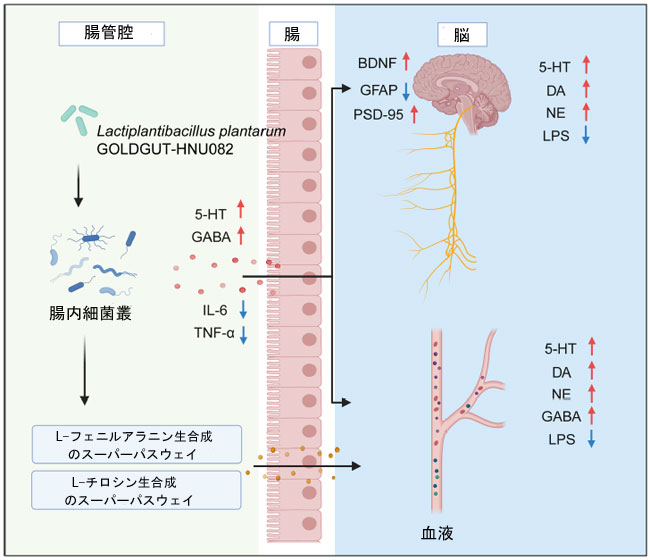 |
| 図8 L. plantarum 082 が慢性予測不能軽度ストレス (CUMS)モデルマウスのうつ病および神経学的損傷を改善する潜在的なメカニズム。 |
| 4. 考察 |
| プロバイオティクスは、機能性食品の必須成分として、その固有の特性と発酵由来の代謝産物を通じて、人間の健康を促進する上で不可欠な役割を果たしています。近年、腸-脳軸研究の進歩により、プロバイオティクスはうつ病を緩和するための有望な食事介入戦略として浮上しています。たとえば、Lactobacillus rhamnosus KY16の投与は、5-ヒドロキシトリプトファン(5-HTP)の腸内分泌を促進することでうつ病の症状を改善することが示されています[28]。さらに、Lactiplantibacillus plantarum によって発酵された小麦胚芽は、げっ歯類モデルでうつ病様行動を緩和する顕著な有効性を実証しています[29]。本研究では、潜在的な機能性食品成分としてのプロバイオティクスL. plantarum 082は、神経伝達物質のバランスを回復し、炎症を軽減し、腸内細菌叢を調整することで、慢性予測不能軽度ストレス (CUMS)マウスのうつ病様行動を大幅に改善しました。これらの結果は、L. plantarum 082の食事補給が 腸-脳軸(GBA)の調節を通じて抗うつ効果を発揮する可能性があることを示唆しており、気分調節のための微生物叢を標的とした栄養介入としての可能性を強調しています。 |
| 神経伝達物質レベルの乱れはうつ病の重要な病態生理学的特徴であり、特にセロトニン (5-HT)、ノルエピネフリン(NE)、ガンマアミノ酪酸(GABA)、ドーパミン(DA)などの必須神経伝達物質の欠乏が重要です[30,31,32]。モノアミン仮説では、セロトニン (5-HT)とノルエピネフリン(NE)のレベル低下が、不安や気分の落ち込みといったうつ病症状の重要な原因であるとされています[24]。蓄積された証拠は、ガンマアミノ酪酸(GABA)やドーパミン(DA)を含む他の神経伝達物質の不均衡がうつ病の発症に関与していることを強調しています。具体的には、神経内分泌系の重要な構成要素である視床下部-下垂体-副腎(HPA)系がストレス反応と気分を制御します[33]。ガンマアミノ酪酸(GABA)レベルの低下は抑制性神経伝達を阻害し、視床下部-下垂体-副腎(HPA)系が過剰に活性化してストレス反応を悪化させます[34]。さらに、ドーパミン(DA)レベルの低下は報酬系を障害し、うつ病症状の悪化に寄与する[35]。 |
| 本研究では、慢性予測不能軽度ストレス (CUMS)モデルを使用してこれらの病態生理学的特徴を検討しました。結果によると、Con グループと比較して、Mod グループの 慢性予測不能軽度ストレス (CUMS) マウスの血清、結腸、または脳内のセロトニン (5-HT)およびドーパミン(DA)のレベルが有意に低下し、不安および抑うつ行動を示しました (図 2A、C、K、M、図 3A、C)。L. plantarum 082治療後、これらの神経伝達物質は複数のシステム (血清および脳) で有意に回復したことから、L. plantarum 082は神経伝達物質のバランスを調整することで抑うつ症状を緩和する可能性があることが示唆されました。特に、セロトニン (5-HT)はトリプトファンから合成され、トリプトファン水酸化酵素がトリプトファンを 5-HTP に変換します。その後、5-HTP はトリプトファン脱炭酸酵素によって セロトニン (5-HT) に変換されます [36]。内因性セロトニン (5-HT) の 90% 以上は腸で生成されます [37,38]。さらに、セロトニン (5-HT)は迷走神経を介して中枢神経系や行動に影響を与える可能性がある[39]。さらに、腸由来の5-HTPは脳のセロトニン (5-HT)合成を促進し、抗うつ効果に寄与することが示されている[40]。興味深いことに、結腸では有意に高いレベルのセロトニン (5-HT)が観察された。これは、L. plantarum 082が腸内細菌叢を調節することでトリプトファン代謝を調節し、腸-脳軸(GBA)を介して中枢神経系のセロトニン (5-HT)合成の前駆体5-HTPを提供している可能性を示唆している。 |
| さらに、血清メタボロミクス分析によりこれらの結果が裏付けられ、Mod グループでは L-キヌレニンや 3-メチルインドールなどのトリプトファン代謝に障害があることが明らかになりました。L. plantarum 082 投与により、慢性予測不能軽度ストレス (CUMS)マウスのトリプトファン代謝が正常化しました。さらに、L. plantarum 082は腸内の L-フェニルアラニン生合成スーパーパスウェイの存在量を大幅に増加させました。これはフェニルアラニンの生成を促進し、NE および DA 合成の追加の前駆体を提供する可能性があります。ガンマアミノ酪酸(GABA )レベルの回復は視床下部-下垂体-副腎(HPA)軸の過剰な活性化を阻害することでストレスを軽減する可能性があり、ドーパミン(DA)レベルの増加は報酬系機能を回復し、うつ病に関連する否定的な感情状態を改善するのに役立ちます。 |
| 腸内細菌叢は腸-脳軸(GBA)の重要な構成要素であり、腸管神経系、末梢系、迷走神経、炎症性サイトカイン、視床下部-下垂体-副腎(HPA)軸を介して中枢神経系に影響を及ぼすことができます。腸内細菌叢は、うつ病の悪化または緩和に重要な役割を果たしています。一方では、アミノ酸代謝と神経伝達物質の合成を介して中枢神経系を制御します。他方では、腸由来の炎症性サイトカインは、感情の調節と認知に大きな影響を与えます。神経炎症はうつ病の根底にある重要なメカニズムであると考えられており[41]、末梢の炎症性サイトカインはミクログリア細胞を活性化し、神経炎症と気分障害を引き起こします[42]。腸内細菌叢のディスバイオーシスは腸管透過性を高め、炎症を引き起こします[43]。腸内細菌叢によるリポ多糖類(LPS)の過剰産生は、インターロイキン(IL-6)、インターロイキン-1β (IL-1β)、、腫瘍壊死因子アルファ (TNF-α)などの炎症性サイトカインの産生を誘発し[44,45]、視床下部-下垂体-副腎(HPA)軸をさらに破壊し、脳の炎症を増加させ、神経変性を促進し、海馬の神経新生を阻害します[46]。海馬ニューロンが損傷すると、脳由来神経栄養因子(BDNF)、シナプス後密度タンパク質95(PSD-95)、グリア線維性酸性タンパク質(GFAP)などのタンパク質が破壊されます。脳由来神経栄養因子(BDNF)はシナプス可塑性の重要なメディエーターであり、ニューロンの成長とシナプス形成を促進します[47]。シナプス後密度タンパク質95(PSD-95)はシナプス可塑性の中心となる足場タンパク質であり[48]、グリア線維性酸性タンパク質(GFAP)はアストロサイトの活性化のマーカーです[49]。 |
| この研究では、Mod グループにおける慢性予測不能軽度ストレス (CUMS)誘発性の腸内細菌叢異常により、腸内腫瘍壊死因子アルファ(TNF-α)が有意に増加しました。これらの炎症性サイトカインは、迷走神経または視床下部-下垂体-副腎(HPA)軸を介して神経炎症を誘発し、神経可塑性の低下と海馬神経新生の障害をもたらしたと考えられます。L. plantarum 082介入により、慢性予測不能軽度ストレス (CUMS)マウスの腸内細菌叢が再形成され、B. pseudolongum、F. rodentium、A. muciniphila などの有益な微生物の存在量が大幅に増加しました [50,51,52]。また、腸、血液、脳の炎症性サイトカインのレベルも低下しました。さらに、L. plantarum 082は慢性予測不能軽度ストレス (CUMS)マウスの海馬の脳由来神経栄養因子(BDNF)と シナプス後密度タンパク質95(PSD-95)のレベルを大幅に増加させ、上昇していた グリア線維性酸性タンパク質(GFAP)レベルを低下させました。これらの結果は、L. plantarum 082が腸内細菌叢のバランスを調整し、腸および神経炎症反応を緩和し、神経損傷を軽減することで抗うつ効果を発揮する可能性があることを示唆しています。 |
| 5. 結論 |
| 結論として、この研究は、機能性食品への応用が期待されるプロバイオティクスである L. plantarum 082 が、腸内細菌叢の構成と機能を調整することで、マウスの慢性予測不能軽度ストレス (CUMS)誘発性うつ病を軽減する可能性があることを示唆しています。L. plantarum 082は、L-フェニルアラニンおよび L-チロシン生合成に関連するものを含む、腸内のアミノ酸代謝経路に影響を与えるようです。これらの経路は、ノルエピネフリン(NE)、セレトニン(5-HT)、ドーパミン(DA) などの主要な神経伝達物質の合成を促進し、その後、腸管神経系または視床下部-下垂体-副腎(HPA)軸を介して脳機能に影響を与え、うつ病の症状を軽減する可能性があります。さらに、L. plantarum 082 は、B. pseudolongum や A. muciniphila などの有益な腸内細菌の量を増やし、腸の炎症、ひいては神経炎症を軽減する可能性があります。この炎症の軽減は、神経可塑性を高め、海馬の神経新生を促進する可能性があります。これらの発見は、腸-脳軸(GBA)の調節を通じて精神的健康を改善する機能性食品成分としてのL. plantarum 082の可能性を浮き彫りにしています。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Foods. 2025 Feb 26;14(5):813.に掲載されたLactiplantibacillus plantarum GOLDGUT-HNU082 Alleviates CUMS-Induced Depressive-like Behaviors in Mice by Modulating the Gut Microbiota and Neurotransmitter Levels.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


