ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(植物性ヨーグルト、プランタルム菌:研究の最前線) |
Lactiplantibacillus plantarum Lp05 による胃腸微小環境の調節を介した ヘリコバクターピロリ感染に対する宿主防御の強化 |
Yao Dong et al., |
|
|
| 要約 |
目的 |
| この研究の目的は、Lactiplantibacillus plantarum Lp05 (L.plantarum Lp05) が Helicobacter pylori (H. pylori) に感染したマウスの消化管マイクロバイオームと病態生理学的状態に及ぼす影響を評価し、H. pylori 感染に対するプロバイオティクス治療としての可能性を探ることです。 |
| 方法 |
| in vitro では、レーザー共焦点顕微鏡と走査型電子顕微鏡を使用して、L.plantarum Lp05と H. pylori の相互作用を分析しました。in vivo では、H. pylori に感染した C57BL/6 マウスをL.plantarum Lp05で治療し、コントロール、モデル、4 剤併用療法、および 3 種類のL.plantarum Lp05投与量レベル (2×107、2×108、2×109 CFU/マウス/日) の 6 つのグループに分けました。6 週間にわたって、L.plantarum Lp05が消化管マイクロバイオームと生理学的マーカーに及ぼす影響を評価しました。測定項目には、消化酵素(α-アミラーゼ、ペプシン、セルラーゼ)、炎症マーカー(インターロイキン-17A、インターロイキン-23、インターロイキン-10、インターフェロン-β、インターフェロン-γ、FoxP3、エンドセリン、IP-10、TGF-β1)、酸化ストレスマーカー(カタラーゼ、マロンジアルデヒド、スーパーオキシドジスムターゼ、ミエロペルオキシダーゼ)、および組織病理(改良Warthin-Starry銀染色およびH&E染色による)が含まれます。胃と腸内の微生物群集構造は、16S rRNA遺伝子配列決定によって評価されました。 |
| 結果 |
| in vitro研究では、L.plantarum Lp05とH. pyloriが共凝集体を形成し、L.plantarum Lp05がH. pyloriの細胞構造を破壊して胃でのコロニー形成を減少させる可能性があることが示されました。生体内では、L.plantarum Lp05は感染マウスの胃粘膜ウレアーゼ活性と血清 H. pylori-IgG 抗体レベルを著しく低下させました (p < 0.01)。また、胃と十二指腸の病理学的変化を緩和し、炎症反応 (エンドトキシン(ET)、IL-17A、IL-23、TGF-beta1、IP-10、すべて p < 0.01) を減少させ、抗酸化酵素活性 (カタラーゼ(CAT)および スーパーオキシドジスムターゼ(SOD)、p < 0.01) を高め、マロンジアルデヒド(MDA)および ミエロペルオキシダーゼ(MPO) レベルを低下させ (p < 0.01)、H. pylori 感染による酸化ストレスと闘いました。L.plantarum Lp05治療は腸内および胃内微生物叢を大幅に変化させ、LactobacillusやLigilactobacillusなどの有益な細菌を増やし、病理学的状態に関連するOlsenellaなどの有害な細菌を減らしました。 |
| 結論 |
| L.plantarum Lp05は、胃腸内微生物叢を効果的に調整し、炎症と酸化ストレスを軽減し、H. pylori を抑制するため、プロバイオティクス療法への応用が期待されますが、臨床使用を改善するにはさらなる研究が必要です。 |
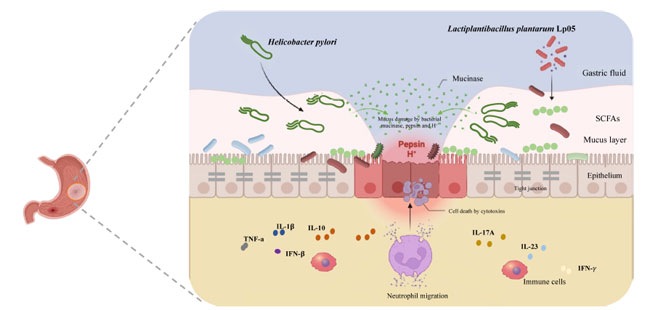 |
| グラフィカル アブストラクト |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.方法と材料 |
| 2.1.菌株の調製 |
| 2.2.共焦点レーザー走査顕微鏡 |
| 2.3.走査型電子顕微鏡 |
| 2.4.マウスにおけるH. pylori感染モデルの確立 |
| 2.5.マウスの血液および組織サンプルの処理 |
| 2.6.マウスの胃と十二指腸組織の染色 |
| 2.7.マウスの胃組織における H. pylori のコロニー形成の検出 |
| 2.8.マウスの血清学的検査 |
| 2.9.DNA 抽出、16S rRNA 遺伝子アンプリコンシーケンシング、および胃と盲腸のマイクロバイオームのバイオインフォマティクス分析 |
| 2.10.統計分析 |
| 3.結果 |
| 3.1.in vitro テスト: L.plantarum Lp05 と H. pylori SS1の共凝集の共焦点レーザー走査顕微鏡検証 |
| 3.2. in vitroテスト:L.plantarum Lp05と H. pylori SS1の共凝集の走査型電子顕微鏡特性評価 |
| 3.3.H.pylori 感染マウスモデルにおける L.plantarum Lp05のウレアーゼ活性および H. pylori-IgG 抗体レベルへの影響 |
| 3.4.H.pylori 感染マウスモデルにおけるL.plantarum Lp05介入の胃組織構造への影響 |
| 3.5.H.pylori 感染マウスモデルにおけるL.plantarum Lp05の胃および十二指腸組織への影響 |
| 3.6.H.pylori 感染マウスモデルにおける胃組織の消化酵素に対するL.plantarum Lp05の影響 |
| 3.7.H.pylori 感染マウスモデルにおける血清炎症性サイトカインに対するL.plantarum Lp05の影響 |
| 3.8.H.pylori 感染マウスモデルにおけるL.plantarum Lp05の酸化ストレス反応への影響 |
| 3.9.H.pylori 感染マウスモデルにおける L.plantarum Lp05の胃微生物叢構造と機能への影響 |
| 3.10.H.pylori 感染マウスモデルにおけるL.plantarum Lp05の腸内微生物叢構造と機能への影響 |
| 3.11.H.pylori 感染マウスモデルにおける胃腸内微生物叢の相関分析 |
| 4.考察 |
| 5.結論 |
本文 |
| 1.はじめに |
| 医学的には、Helicobacter pylori (H.pylori)は、微好気性でらせん状のグラム陰性細菌であり、一般的にヒトの胃に生息しています (1)。1982 年に発見されたこの細菌は、持続的でしばしば生涯にわたる感染症を形成し、酸性の胃の状態に適応することで、胃腸病や感染症に多大な影響を及ぼしています (2)。H.pylori は胃粘膜に付着してバイオフィルムを形成し、運動性、接着性、ウレアーゼ活性、細胞毒素産生などの戦略を採用して生存と病原性を発揮します (3、4)。尿素をアンモニアに分解することで、胃酸を中和し、自身にとって好ましい環境と安定した窒素源を維持します (5)。さらに、H.pylori は免疫活性化によって慢性炎症を引き起こし、これが自身の生存を助け、胃の損傷やがんを引き起こす可能性があります (6)。H.pylori は保護粘膜層を改変して定着を促進し、免疫反応を回避します。多くの場合無症状ですが、H.pylori 感染は、消化性潰瘍、非潰瘍性消化不良、胃がんなどの重大な胃腸疾患と相関関係があります (6、7)。胃がんは、国際がん研究機関 (IARC) によるグループ 1 発がん物質としての分類と強く関連しています (8)。H.pylori 感染への対処は、特に胃がんの発生率が高い地域では不可欠であり、その発症メカニズムをより深く理解し、診断を改善し、健康への影響を軽減するためのより効果的な治療法を開発するための継続的な研究を促進しています。 |
| マーストリヒト IV/フィレンツェ合意で承認されている H.pylori 感染症の標準的な 3 剤併用療法は、2 種類の抗生物質 (通常はアモキシシリンおよびクラリスロマイシン) とプロトンポンプ阻害剤 (PPI) で構成されています (9)。このレジメンは、抗生物質耐性、副作用、高コストなどの障害に直面しています (10)。クラリスロマイシン耐性が発生した場合、多くの場合、ビスマス含有 4 剤併用療法 (BQT) に置き換えられます (11)。プロトンポンプ阻害剤は治療効果を高め、細菌の増殖を抑制するために不可欠ですが、腸管感染症や急性腎障害のリスクを高める可能性があります (10)。特にクラリスロマイシンとレボフロキサシンに対する世界的な抗生物質耐性の増加により、治療の成功率は低下しています。最新のマーストリヒト VI/フィレンツェ合意では、耐性が低い地域では 3 剤併用療法またはビスマス 4 剤併用療法を使用することが推奨されています (12)。それにもかかわらず、抗生物質の広範な使用により、代替治療法の探究が促進されました (13)。このような状況を考えると、プロバイオティクスは、その安全性、免疫調節効果、抗菌特性により大きな関心を集めています (14)。これらの生きた微生物は、特定の部位の微生物組成を変更することで宿主に利益をもたらします (15)。胃の酸性条件 (pH 4〜6) で繁殖する乳酸菌は、H. pylori 感染症の治療に特に適しています (4、16、17)。研究によると、特定のプロバイオティクスは、宿主の免疫応答を強化することで H.pylori の増殖を直接阻害したり、そのライフサイクルを変更したりできるため、抗生物質を使わずにこれらの感染症を管理できる戦略を提供しています (4、16、17)。たとえば、Lactobacillus johnsonii No. 1088 は、H.pylori に感染したマウスで顕著な抗菌効果を示しています (18)。さらに、プロバイオティクスを従来のビスマス含有 4 剤併用療法 (BQT)と組み合わせると、除菌率が大幅に向上し、プロバイオティクスなしの場合の 86.8% と比較して 92% の治癒率を達成します (19)。これらの知見は、腸内細菌叢が病気の進行に重要な役割を果たしていることを強調し、革新的な治療法の開発をサポートします。 |
| Lactiplantibacillus plantarum はプロバイオティクスとして十分に研究されていますが、その特異的な抗 H.pylori メカニズムと宿主微生物群集への影響、特にそれが微生物群集と免疫応答を調整して H.pylori の胃でのコロニー形成を減らす方法については十分に理解されていません。in vitro では、L. plantarum Lp05 は H.pylori の増殖を阻害する能力を示しており、その抗菌性の可能性が強調されています。この研究では L.plantarum Lp05に焦点を当て、H.pylori に感染したマウスモデルにおける胃粘膜ウレアーゼ活性、免疫応答、および胃腸内微生物叢への影響を分析します。目標は、H.pylori に対する阻害効果のメカニズムを探り、新しい治療法としての可能性を評価し、将来の治療戦略の基礎を提供することです。 |
| 2.方法と材料 |
| 2.1.菌株の調製 |
| L.plantarum Lp05菌株は Wecare Probiotics Co., Ltd. (Suzhou, China) から提供されました。菌株は De Man、Rogosa、Sharpe (MRS) 培地で 37°C で 18 時間培養されました (20)。細菌細胞は 6000 × g で 8 分間遠心分離して回収し、滅菌水に再懸濁して最終濃度 1×109 CFU/mL を達成しました。 |
| BeNa Culture Collection から入手した H.pylori SS1 は、-80°C で保存されていたコロンビア寒天培地に 5% 滅菌脱繊維羊血液を添加して復活しました。2 世代復活後、コロンビア血液寒天培地で 48 時間培養し、BHI ブロスで洗浄し、細菌懸濁液を 1×1010 CFU/mL に調整しました (21)。 |
| 2.2.共焦点レーザー走査顕微鏡 |
| 培養した H.pylori SS1 を遠心分離し、人工胃液で 2 回洗浄し (22)、再懸濁して OD600 を約 0.50 に調整しました。CFDA SE 染料で染色し、37°C で 30 分間インキュベートした後、細菌を PBS で遠心分離して余分な染料を除去しました。次に、染色済みの H.pylori SS1 をL.plantarum Lp05と等量混合し、少なくとも 10 秒間ボルテックスし、37°C で 2 時間インキュベートしました。この混合物のサンプルをスライド上に置いて、共焦点レーザー走査顕微鏡 (Ex = 494 nm、Em = 521 nm) で検査しました (23)。 |
| 2.3.走査型電子顕微鏡 |
| L.plantarum Lp05株を遠心分離し、PBSで2回洗浄し、滅菌PBSに再懸濁した。同様に、H.pylori SS1を人工胃液で洗浄し、再懸濁した。両方の懸濁液をOD600が約0.50になるように調整し、等量混合して共凝集を誘発した。25°Cで2時間後、凝集体を4°Cで2.5%グルタルアルデヒドで一晩固定し、段階的エタノールシリーズで脱水し、金スパッタコーティングした。その後、サンプルを走査型電子顕微鏡でスキャンした(24)。 |
2.4.マウスにおけるH.pylori感染モデルの確立 |
| マウスに関わるすべての手順は、鄭州大学実験動物倫理委員会(ライセンス番号:SYXK(Yu)2021-0011)の承認を受け、ARRIVEガイドライン2.0(25)に準拠しました。H. pylori感染モデルを確立するために、8週齢の雌SPFグレードC57BL/6マウス60匹(SPF Biotechnology Co., Ltd、Beijing, China)を1週間順応させ、その後、6週間の実験のために10匹ずつ6つのグループに分けました(26)(図1)。コントロール(CTL)グループには、実験中毎日0.2 mLの生理食塩水を経口投与しました。 2週目から、5つの治療グループは、1×1010 CFU/mLのH.pyloriを含む0.9% NaCl懸濁液0.2mLを2日1回、合計5回経口投与して、H.pylori SS1感染のモデル化を開始しました。H. pylori 感染(MC)グループは、同じ生理食塩水療法に従い、H.pyloriのみを使用しました。4剤併用療法グループ(PG)は、感染後1週目は通常食を摂取し、2週目と3週目はアモキシシリン(410 mg/kg)、ビスマスペクチン(123 mg/kg)、フラゾリドン(41 mg/kg)、およびパントプラゾール(16.4 mg/kg)を含む混合物を毎日経口投与し、その後6週目まで0.2 mL 0.9% NaClを投与しました。 L.plantarum Lp05低用量、中用量、高用量グループ (L.plantarum Lp05_L、L.plantarum Lp05_M、L.plantarum Lp05_H) は、1 週目から毎日 0.2 mL の L.plantarum Lp05 をそれぞれ 1×108、1×109、1×1010 CFU/mL で経口投与され、2 週目から H. pylori 感染(MC)グループと同様に H. pylori 感染が開始されました。すべてのマウスは 25 ± 2°C で飼育され、床敷は週 2 ~ 3 回交換され、定期的に体重が測定されました。 |
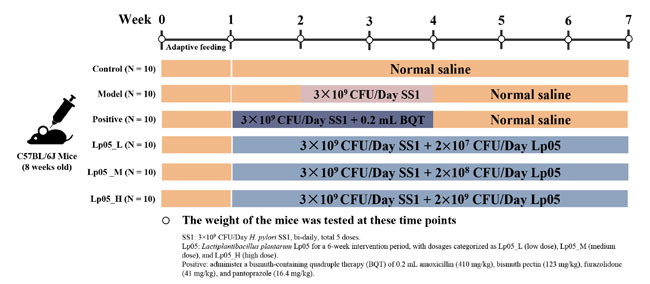 |
| 図1.マウスにおけるHelicobacter pylori SS1 感染モデルの実験設計図 |
| 2.5マウスの血液および組織サンプルの処理 |
| 最終経口投与後、12時間絶食したマウスを腹腔内投与で4%クロラール水和物溶液を使用して麻酔し、眼窩抽出法で血液を採取しました。血液サンプルは4°Cで20分間3500 rpmで遠心分離し、血清は分析のために-80°Cで保存しました。実験後、マウスは安楽死させ、胃、十二指腸、盲腸の組織を摘出して固定し、組織学的検査を行いました。 |
| 2.6.マウスの胃と十二指腸組織の染色 |
| 胃組織中のH. pyloriの存在は、修正Warthin-Starry(W-S)銀染色法を用いて検出され、組織中のH. pyloriを黒色の沈着物として検出するのに効果的でした(27)。構造的および病理学的評価のために、組織は固定、脱水、パラフィン包埋後にH&E染色を受けました。組織の構造的および病理学的状態を詳細に調べるために、4μmの組織切片をDongら(2022)の方法を用いて染色しました(28)。 |
| 2.7.マウスの胃組織における H. pylori のコロニー形成の検出 |
| 胃粘膜サンプルを 1 g/mL 尿素と 850 µg/mL フェノールレッドを含む溶液中で 37°C で 30 分間インキュベートし、色の変化を観察しました (29)。さらに、PBS で均質化したサンプルを希釈し、選択培地に塗布し、37°C で 2 ~ 5 日間微好気条件下で培養し、典型的なコロニー特性に基づいて H. pylori を同定しました。 |
| 2.8.マウスの血清学的検査 |
| 実験後、マウス血清中の抗H. pylori IgG抗体をELISA(Yuanju Biotechnology Center、Shanghai, China)を使用して検出しました。1:50に希釈した血清サンプルをH. pylori抗原でコーティングしたウェルに加え、37°Cで30分間インキュベートし、3回洗浄し、HRP標識ウサギ抗マウスIgGでさらに30分間処理しました。テトラメチルベンジジン(TMB)で発生した反応を硫酸で停止し、450 nmで読み取りました。血清を分析して、胃酵素(α-アミラーゼ、ペプシン、セルラーゼ)、炎症マーカー(インターロイキン-17A(IL-17A)、インターロイキン-23(IL-23)、インターロイキン-10(IL-10)、インターフェロンベータ(IFN-β)、インターフェロンガンマ(IFN-γ)、フォークヘッドボックスP3(FoxP3)、エンドトキシン(ET)、インターフェロン-γ誘導性タンパク質10(IP-10)、形質転換成長因子ベータ-1(TGF-β1))、カタラーゼ(CAT)、マロンジアルデヒド(MDA)、スーパーオキシドジスムターゼ(SOD)、ミエロペルオキシダーゼ(MPO)の活性を調べました。すべてのアッセイは、各キットに付属のメーカーの説明書(BIOSCO Biotechnology Co., Ltd、江蘇省、中国)に従って実施しました。 |
| 2.9.DNA 抽出、16S rRNA 遺伝子アンプリコンシーケンシング、および胃と盲腸のマイクロバイオームのバイオインフォマティクス分析 |
| 16S rRNA 遺伝子シーケンシングにより、胃と盲腸の組織内の微生物群を分析しました。DNA を抽出し、341F プライマーと 805R プライマーを使用して 16S rRNA 遺伝子の V3-V4 領域を増幅しました。PCR プロセスでは、95°C での最初の変性、続いて 94°C での変性、58°C でのアニーリング、72°C での伸長のサイクルを行い、最後に 72°C での最終伸長で終了しました。増幅された産物は、ペアエンド 2x300 bp 形式で Illumina MiSeq プラットフォームでインデックス付け、プールし、シーケンシングしました。生データは、USEARCH を使用して精製し、低品質のリードとキメラを除去しました。アンプリコン配列変異体(ASV)は、UPARSE(バージョン7.1)を使用して97%の類似性でクラスター化され、RDP分類器(30)によって分類されました。アルファおよびベータ多様性はQIIMEを使用して分析され、コミュニティ間の有意差は線形判別分析効果サイズ(LEfSe)、PICRUSt、およびメタゲノムプロファイルの統計的分析(STAMP)分析によって決定されました(31)。 |
| 2.10.統計分析 |
| すべてのデータは平均±標準偏差(SD)として提示されました。統計分析はR Studioソフトウェアを使用して実施しました。データは最初にKolmogorov-Smirnov検定を使用して正規分布についてテストされました。複数のグループの比較はノンパラメトリックKruskal-Wallis検定を使用して行われ、2つのグループ間の差はMann-Whitney U検定を使用して評価され、有意水準はp < 0.05に設定されました。微生物群集分析はQIIMEソフトウェアと重み付けされていないUniFrac距離に基づく主座標分析(PCoA)を使用して実施されました(32)。PICRUStおよびLEfSe分析を使用して群集系統学を調査し、胃と盲腸組織における細菌属間の相関関係を調べるためにSpearmanの順位相関検定を使用しました。すべての統計分析はR環境バージョン4.3.2(33)で実施されました。 |
| 3.結果 |
| 3.1.in vitro テスト: L.plantarum Lp05 と H. pylori SS1の共凝集の共焦点レーザー走査顕微鏡検証 |
| この研究では、共焦点レーザー走査顕微鏡を使用して L.plantarum Lp05と H. pylori SS1の共凝集現象を確認しました。CFDA SE 蛍光染色を使用して H. pylori SS1 を標識し、共凝集体内のH. pylori SS1の存在を容易に特定できるようにしました。顕微鏡下での観察は図 2A (a-c) に示されており、明視野、暗視野、オーバーレイ条件下で単独で培養されたH. pylori SS1の分布を示しています。細菌は均一に分散しており、凝集体が形成されていません。対照的に、図 2A (d-f) はL.plantarum Lp05とH. pylori SS1を 2 時間共培養した後の状況を示しており、3 つの視野すべてで大きな共凝集体 (矢印で示す) が確認できます。これらの凝集体は、H. pylori SS1が L.plantarum Lp05に包み込まれて密集していることを明確に示しており、これによりH. pylori SS1が胃から排出されやすくなり、胃での H. pylori の定着が減少する可能性があります。 |
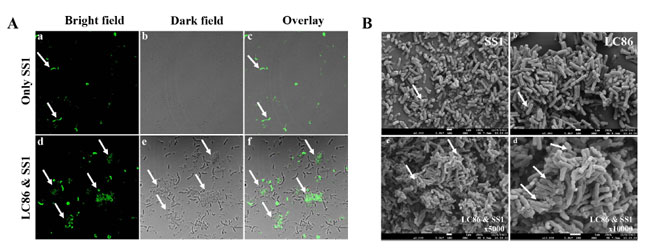 |
| 図2. Lactiplantibacillus plantarum Lp05 の Helicobacter pylori SS1 に対する阻害効果の in vitro 評価。(A) L.plantarum Lp05と H.pylori SS1 の共凝集 2 時間後の共焦点レーザー走査顕微鏡画像。(a–c): H pylori SS1 のみ培養。(d–f) L.plantarum Lp05と H pylori SS1 の共培養。(a、d) - 明視野。(b、e) - 暗視野。(c、f) - オーバーレイ。(B) >L.plantarum Lp05と H pylori SS1 の共凝集体の走査型電子顕微鏡画像。(a) H pylori SS1 を示す。(b) L.plantarum Lp05を示す。(c、d) 共凝集体を示す。(c) x5000、(d) x10000。 |
| 3.2. in vitro テスト:L.plantarum Lp05と H. pylori SS1の共凝集の走査型電子顕微鏡特性評価 |
| L.plantarum Lp05 と H. pylori SS1の共凝集体の形成も走査型電子顕微鏡を使用して観察されました。真空下で凍結乾燥した後、凝集体を冷電界放出走査型電子顕微鏡で検査し、共凝集を確認しました。図 2B (a、b) は、別々に培養された H. pylori SS1と L.plantarum Lp05を 5000 倍に拡大して示しています。H. pylori SS1は湾曲した棒状で、L.plantarum Lp05は短い棒状で示されており、両者の間には大きな形態的違いがあります。図 2B (c、d) は、それぞれ 5000 倍と 10000 倍に拡大した共凝集体を示しており、矢印は L.plantarum Lp05と結合して大きな凝集体を形成している複数のH. pylori SS1体を指しています。注目すべきことに、 L.plantarum Lp05と H. pylori が共凝集体を効果的に形成し、胃でのコロニー形成を減少させていることを裏付けています。 |
| 3.3.H.pylori 感染マウスモデルにおける L.plantarum Lp05のウレアーゼ活性および H. pylori-IgG 抗体レベルへの影響 |
| 胃粘膜サンプルのウレアーゼ活性は、図 3A に示すように評価されました。特に、H. pylori 感染(MC)グループグループはウレアーゼ活性が著しく増加し、pH の上昇につながり、フェノールレッド指示薬が黄色からピンクまたは赤に変化しました。定量的には、H. pylori 感染(MC)グループグループのウレアーゼ活性は著しく高く、562 nm での光学密度 (OD) 測定値は 2.0 に達しました。これに対して、さまざまな用量のL.plantarum Lp05を投与したグループと 4剤併用療法グループではウレアーゼ活性が低下し、フェノールレッド指示薬の色の変化は最小限か、黄色が維持されました。特に、L.plantarum Lp05_H グループのウレアーゼ活性は4剤併用療法グループ (OD562nm = 0.5) と同等で、H. pylori 感染(MC)グループグループよりも大幅に低いことが示されました。これは、L.plantarum Lp05が H. pylori の胃のコロニー形成を減少させ、それによって H. pylori 感染によって誘発されるウレアーゼ活性を低下させ、H. pylori のコロニー形成と感染によって引き起こされる組織の炎症を軽減できることを示唆しています。これらの知見は OD 測定によって実証されており、L.plantarum Lp05_H 処理によってウレアーゼが効果的に抑制されることを示しています。さらに、H. pylori-IgG 抗体の血清レベル (図 3B に示す) は、H. pylori 感染(MC)グループと比較してL.plantarum Lp05で処理したマウスで有意に低く (p < 0.01)、コントロール(CTL)グループで見られるレベルに近づき、4剤併用療法グループのレベルと同等でした。これは、L.plantarum Lp05が H. pylori に対する全身免疫応答を効果的に減少させることができることを示しています。 |
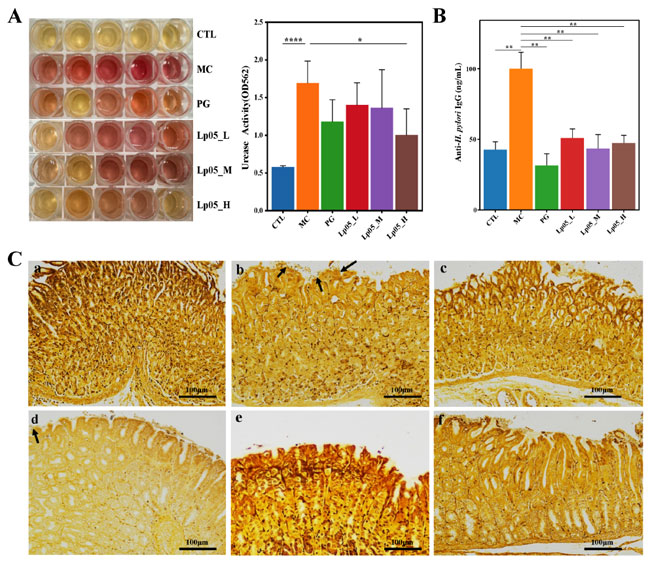 |
| 図3. Lactiplantibacillus plantarum Lp05 が H. pylori に感染したマウスに与える影響。(A) 胃粘膜ウレアーゼ活性への影響。(B) マウス血清中の抗 H. pylori IgG 抗体のレベル。(C) Warthin-Starry 銀染色で染色した胃組織切片。サブパネル a-f はそれぞれCTL (コントロール)、MC(H. pylori 感染モデル)、PG (4 剤併用療法グループ)、L.plantarum Lp05_L (低用量、2×107 CFU)、L.plantarum Lp05_M (中用量、2×108 CFU)、L.plantarum Lp05_H (高用量、2×109 CFU) に対応します。*: p < 0.05、**: p < 0.01、****: p < 0.0001。 |
| 3.4.H.pylori 感染マウスモデルにおけるL.plantarum Lp05介入の胃組織構造への影響 |
| 図 3C は、マウス胃組織の W-S 銀染色切片を示しています。コントロール(CTL)グループと比較すると、H. pylori 感染(MC)グループでは粘膜層、上皮表面、細胞間隙に暗褐色から黒色の桿状またはわずかにらせん状の細菌 (矢印で表示) が見られました。H.pylori は主に胃体部と幽門の接合部にある胃小窩と腺腔に定着し、一般的には弧状、S 字型、時には短い桿状を呈します。胃組織をホモジェナイズし、ブルセラ寒天培地で 3 日間培養した後、コロニーのグラム染色 ( 補足図 S1 ) により、H. pylori の典型的な赤色の S 字型、わずかにらせん状、または湾曲した桿菌形状が明らかになりました。これにより、グラム陰性であることが確認され、胃粘膜のコロニー形成が観察され、H. pylori 感染(MC)グループグループで H. pylori 感染モデルが確立されました。対照的に、L.plantarum Lp05_L グループでは、時折 H. pylori のコロニー形成が依然として観察されました。しかし、L.plantarum Lp05_M グループとL.plantarum Lp05_H グループでは、H. pylori のコロニー形成はコントロール(CTL)グループと 4剤併用療法グループと同等であり、中用量と高用量の L.plantarum Lp05が胃粘膜上の H. pylori のコロニー形成を著しく阻害することを示しています。 |
| 3.5.H. pylori 感染マウスモデルにおけるL.plantarum Lp05の胃および十二指腸組織への影響 |
| HE 染色により、H. pylori 感染マウスにおける L.plantarum Lp05 の胃および十二指腸組織への影響が明らかになりました。図 4A ~ L は、コントロール(CTL)グループでは胃の構造が損なわれておらず、胃小窩が明瞭で、上皮細胞が整然としており、炎症がないことを示しています。一方、H. pylori 感染(MC)グループでは、上皮壊死、腺の乱れ、炎症などの H. pylori 誘発性の病変が見られ、壁細胞が少なくなっています。4剤併用療法グループでは、軽度の炎症と軽度の潰瘍が見られました。L.plantarum Lp05_L グループでは軽度から中程度の炎症が見られましたが、L.plantarum Lp05_M グループと L.plantarum Lp05_H グループでは顕著な組織改善が見られ、特に L.plantarum Lp05_H グループでは、胃粘膜が透明で損なわれておらず、コントロール(CTL)グループと同様に炎症が最小限に抑えられていました。十二指腸については、図 4M~R はコントロール(CTL)グループの粘膜構造が正常であることを示していますが、H. pylori 感染(MC)グループでは広範囲にわたる細胞壊死と炎症が見られ、構造が著しく破壊されていました。治療にもかかわらず、4剤併用療法グループでは上皮細胞が乱れていました。L.plantarum Lp05治療後、特に L.plantarum Lp05_M グループと L.plantarum Lp05_H グループでは、十二指腸絨毛は正常な上皮細胞の配列で無傷であり、中用量および高用量のL.plantarum Lp05が H. pylori 誘発性十二指腸損傷を効果的に軽減することを示唆しています。 |
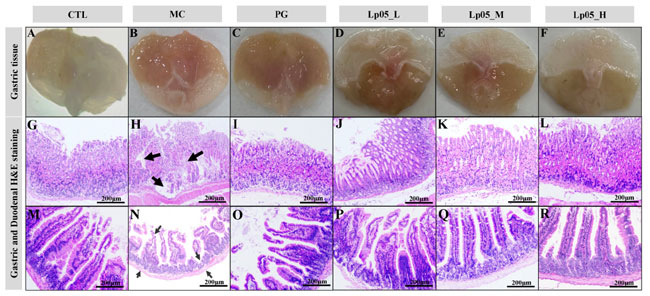 |
| 図3. Lactiplantibacillus plantarum Lp05 が H. pylori に感染したマウスに与える影響。(A) 胃粘膜ウレアーゼ活性への影響。(B) マウス血清中の抗 H. pylori IgG 抗体のレベル。(C) Warthin-Starry 銀染色で染色した胃組織切片。サブパネル a-f はそれぞれCTL (コントロール)、MC(H. pylori 感染モデル)、PG (4 剤併用療法グループ)、L.plantarum Lp05_L (低用量、2×107 CFU)、L.plantarum Lp05_M (中用量、2×108 CFU)、L.plantarum Lp05_H (高用量、2×109 CFU) に対応します。*: p < 0.05、**: p < 0.01、****: p < 0.0001。 |
| 3.6.H. pylori 感染マウスモデルにおける胃組織の消化酵素に対するL.plantarum Lp05の影響 |
| この試験では、α-アミラーゼ、セルラーゼ、ペプシンに焦点を当て、H. pylori に感染したマウスの胃組織の消化酵素に対するL.plantarum Lp05の影響を評価しました。具体的には、コントロール(CTL)グループでは、平均 α-アミラーゼ活性は 27.5 mg/分/g でした。H. pylori 感染(MC)グループでは、感染後、活性は 17.2 mg/分/g に大幅に低下しました (p < 0.01)。これは、H. pylori 感染の有害な影響を示しています。L.plantarum Lp05による治療後、L.plantarum Lp05_H グループの α-アミラーゼ活性は 28 mg/分/g にほぼ完全に回復し、コントロール(CTL)グループをわずかに上回りました。コントロール(CTL)グループのベースライン ペプシン活性は 1501 nmol/分/g でした。 H. pylori 感染後 (H. pylori 感染(MC)グループ)、活性は 1260 nmol/分/g に低下しました (p < 0.01)。注目すべきことに、ペプシン活性はL.plantarum Lp05_H グループで 1614.9 nmol/分/g に増加し、コントロール(CTL)グループよりも有意に高くなりました。これは、L.plantarum Lp05が感染の影響を逆転させるだけでなく、酵素活性を高めるという有効性を強調しています。セルラーゼについては、コントロール(CTL)グループの活性は 454.9 μg/分/g でしたが、H. pylori 感染により H. pylori 感染(MC)グループでは 329.5 μg/分/g に低下しました (p < 0.01)。L.plantarum Lp05処理後、L.plantarum Lp05_H グループの活性は 481.6 μg/分/g に達し、再びコントロール(CTL)グループを超え、機能の大幅な回復と強化を示しています。これらの結果 ( 図 5A ~ C ) は、L.plantarum Lp05介入、特に高用量介入が、H. pylori 感染によって低下した消化酵素活性を正常化し強化することで、全体的な胃機能の回復をサポートすることを示唆しています。 |
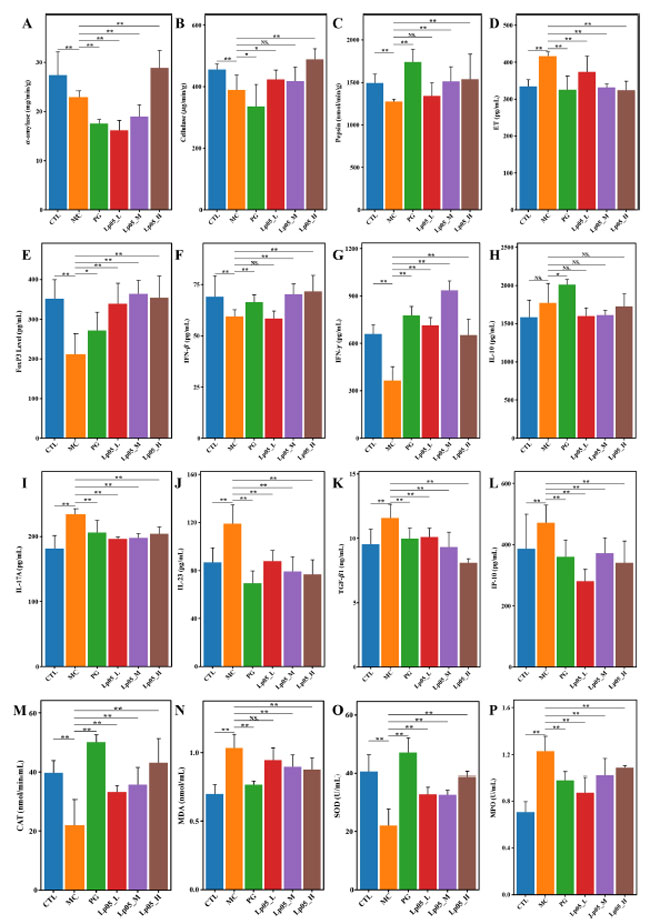 |
| 図5. Helicobacter pyloriに感染したマウスにおけるペプシン活性、免疫応答、酸化ストレスレベルに対するLactiplantibacillus plantarum Lp05の効果。(A–C) 胃プロテアーゼの活性:α-アミラーゼ、セルラーゼ、ペプシン。(D–L) エンドトキシン(ET)、FoxP3、IFN-β、IFN-γ、IL-10、IL-17A、IL-23、TGF-β1、IP-10のレベル。(M–P) カタラーゼ(CAT)、マロンジアルデヒド(MDA)、スーパーオキシドジスムターゼ(SOD)、ミエロペルオキシダーゼ(MPO)のレベル。** はp < 0.01、* はp < 0.05、NS はp > 0.05を示します。 |
| 3.7.H.pylori 感染マウスモデルにおける血清炎症性サイトカインに対するL.plantarum Lp05の影響 |
| 図 5D~L に示すように、H. pylori 感染(MC)グループでは エンドトキシン(ET)レベルが 420.1 pg/mL と測定され、コントロール(CTL)グループの 331 pg/mL と比較して高くなっています。L.plantarum Lp05_H グループは エンドトキシン(ET) を 332.24 pg/mL に効果的に低下させ (p < 0.05)、コントロール(CTL)グループとほぼ一致しています。IL-17A は H. pylori 感染(MC)グループでは 236.15 pg/mL と高く、コントロール(CTL)グループでは 186.3 pg/mL でしたが、L.plantarum Lp05_H では 204 pg/mL に低下しました (p < 0.05)。 IL-23 レベルはコントロール(CTL)グループの 83.9 pg/mL からH. pylori 感染(MC)グループで 117.5 pg/mL に上昇しましたが、L.plantarum Lp05処理により 75.70 pg/mL に緩和されました (p < 0.05)。IP-10 レベルはコントロール(CTL)グループの 387.1 pg/mL からコントロールで 495.5 pg/mL に上昇しましたが、L.plantarum Lp05_H では 348.7 pg/mL に減少しました (p < 0.05)。TGF-β1 も コントロール(CTL)グループの 9.4 pg/mL からH. pylori 感染(MC)グループで 11.5 pg/mL に増加し (p < 0.05)、L.plantarum Lp05_H では 8.7 pg/mL に減少しました (p < 0.05)。これは大幅な減少を示しています。逆に、IFN-βとIFN-γは、コントロール(CTL)グループ67.7 pg/mLと646.5 pg/mLからH. pylori 感染(MC)グループでそれぞれ58.9 pg/mLと391 pg/mLに減少しましたが、L.plantarum Lp05_Hではそれぞれ67.8 pg/mLと672.2 pg/mLに回復しました(両方ともp < 0.05)。さらに、FoxP3レベルは、コントロール(CTL)グループの343 pg/mLからH. pylori 感染(MC)グループで206.76 pg/mLに減少しましたが、L.plantarum Lp05_Hでは341.0 pg/mLに回復しました(p < 0.05)。L.plantarum Lp05の効果は4剤併用療法グループの効果と同様であり、特にL.plantarum Lp05_Hグループでは炎症性サイトカインの調節が顕著であり、L.plantarum Lp05がH. pylori感染によって引き起こされる全身性炎症反応を効果的に抑制することを示しています。 |
| 3.8.H. pylori 感染マウスモデルにおけるL.plantarum Lp05の酸化ストレス反応への影響 |
| 図 5M~P に示すように、H. pylori 感染とその後の治療の影響を評価するために、酸化ストレスマーカーを定量的に分析しましたコントロール(CTL)グループでは、カタラーゼ(CAT)活性は 38.1 nmol/min/mL、スーパーオキシドジスムターゼ(SOD)活性は 40.4 U/mL と測定されました。H. pylori 感染後、H. pylori 感染(MC)グループではこれらの抗酸化酵素が大幅に減少し、カタラーゼ(CAT)は 21.3 nmol/min/mL、スーパーオキシドジスムターゼ(SOD) は 23.3 U/mL に減少しました (すべて p < 0.05)。この減少は、マロンジアルデヒド(MDA)レベルと ミエロペルオキシダーゼ(MPO)レベルのそれぞれ 0.72 nmol/mL から 1.03 nmol/mL と 0.75 U/mL から 1.24 U/mL への増加と一致しており、酸化ストレスが著しく増加していることを示しています。治療後の分析では、すべての介入グループでこれらの酸化ストレスマーカーの有意な逆転が示されました (すべて p < 0.05)。さまざまな用量のL.plantarum Lp05 で治療した後、L.plantarum Lp05_H グループでは カタラーゼ(CAT)レベルが 42.2 nmol/分/mL に増加し、コントロール(CTL)グループレベルを超えました。同様に、スーパーオキシドジスムターゼ(SOD)レベルは L.plantarum Lp05_H で 38.2 U/mL に改善し、コントロール(CTL)値にほぼ達しました。L.plantarum Lp05_H グループでは、マロンジアルデヒド(MDA)および ミエロペルオキシダーゼ(MPO)レベルがそれぞれ 0.86 nmol/mL および 1.09 U/mL に有意に減少しました。これらの結果は、高用量の L.plantarum Lp05 が強力な抗酸化能力を持ち、H. pylori 感染によって引き起こされる酸化損傷を効果的に軽減することを示唆しています。 |
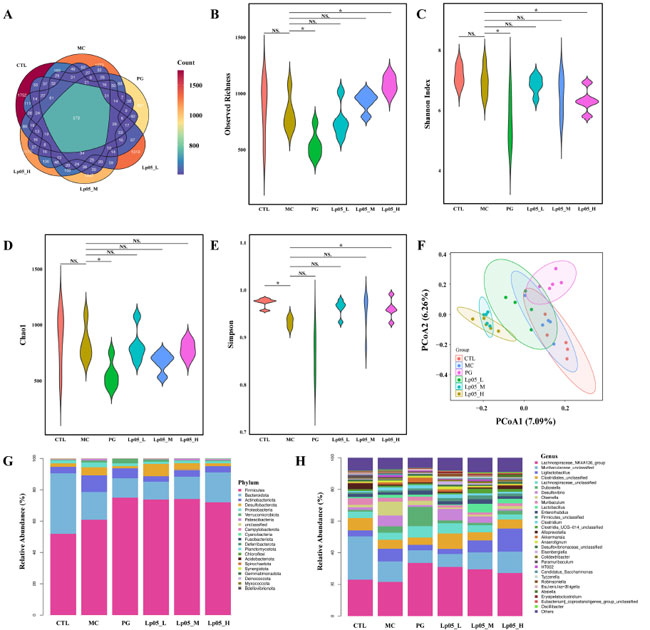
| 3.9.H.pylori 感染マウスモデルにおける L.plantarum Lp05の胃微生物叢構造と機能への影響 |
| 16S rRNA 遺伝子配列解析により、H.pylori 感染マウスの胃微生物叢に対するL.plantarum Lp05の効果を評価しました。図 6A は 13,888 個の アンプリコン配列変異体(ASV)を示しており、そのうち 420 個はグループ間で共通です。固有のアンプリコン配列変異体(ASV)は、コントロール(CTL)グループで 2366 個、H. pylori 感染(MC)グループで 1815 個、4剤併用療法グループ で 3046 個、低用量、中用量、高用量 L.plantarum Lp05グループでそれぞれ 2041 個、2002 個、2198 個であり、治療による微生物多様性の大幅な変化を示しています。観察された豊富さ、Chao1、Shannon、および Simpson 指数 (図 6B ~ E) は、微生物の豊富さ、多様性、および均一性を評価し、コントロール(CTL)グループと比較してH. pylori 感染(MC)グループで α 多様性が減少していることを示しています。 ビスマス含有 4 剤併用療法 (BQT)およびL.plantarum Lp05介入後、H. pylori 感染(MC)グループと比較して有意ではないものの、豊富さとChao1指数が増加しました。β多様性解析(図6F)では、コントロール(CTL)グループと比較してL.plantarum Lp05、H. pylori 感染(MC)グループ、4剤併用療法グループで有意な構成シフトを伴う明確な微生物構造が示されました。優勢な種とその存在量は、図6G、Hに詳述されています。FirmicutesおよびBacteroidotaが優勢で、相対存在量に有意な変動があり、たとえばMGでは71.18%であるのに対し、コントロール(CTL)グループでは26.67%でした。L.plantarum Lp05は、特に低用量グループでこれらの割合を大幅に調整し、コントロール(CTL)グループとより密接に一致しました。優勢な属には、Muribaculaceae_unclassified、Lactobacillus、およびMuribaculumが含まれ、Muribaculaceae_unclassifiedはH. pylori 感染(MC)グループと比較して4剤併用療法グループおよびL.plantarum Lp05グループで存在量が増加しており、効果的な微生物調節を示唆しています。 LEfSe 分析 ( 図 7A ) では、グループ間で有意差のあるマーカー種が強調表示され、Rikenella などの有益な属がL.plantarum Lp05によって増加したことが示され、胃の微生物叢の最適化におけるその役割が示唆されました。STAMP 分析 ( 図 7B ) では、特に低用量で、H. pylori 感染(MC)グループと比較してL.plantarum Lp05処理グループで Muribaculaceae_unclassified の大幅な回復が見られました。PICRUSt2 分析 ( 図 7C ) では、L.plantarum Lp05グループでアミノ酸代謝や多糖類生合成などの代謝経路の上方制御が予測され、これは微生物群集の安定性に不可欠であり、コントロール(CTL)グループのレベルに近づいています。 |
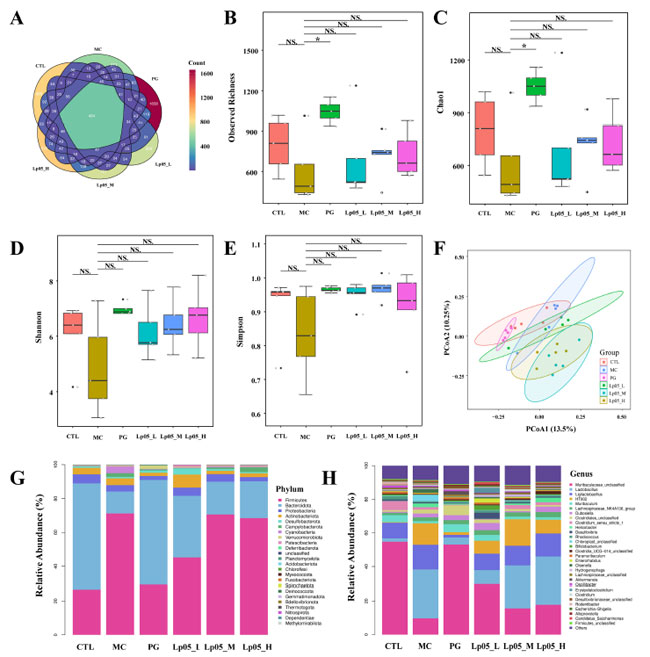 |
| 図6.Lactiplantibacillus plantarum Lp05 の投与量が胃の微生物組成と構造に与える影響。(A) 胃マイクロバイオーム配列のベン図分析、(B~E) 胃マイクロバイオームのアルファ多様性分析、(F) PCoA による胃マイクロバイオームのベータ多様性分析、(G、H) 胃マイクロバイオームの門および属レベルでの種の相対的存在量、コントロール(CTL)グループ、H. pylori 感染(MC)グループ、H pylori 感染モデルグループ、L.plantarum Lp05_L、低用量グループ(2×107 CFU)、L.plantarum Lp05_M、中用量グループ (2×108 CFU)、L.plantarum Lp05_H、高用量グループ(2×109 CFU)。NS は p > 0.05、* は p < 0.05 を示します。 |
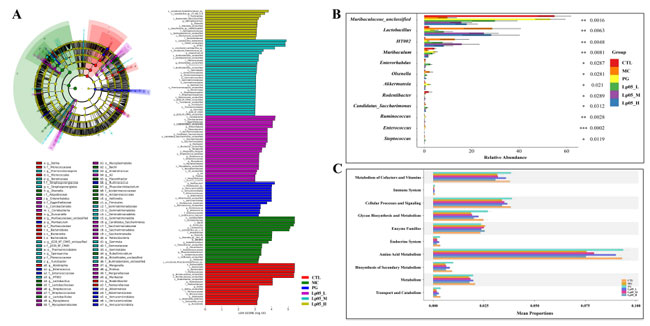 |
| 図7.Lactiplantibacillus plantarum Lp05 の投与量が胃の微生物種の豊富さに与える影響。(A) メタゲノム データから生成された系統分類図と LefSe 分析 LDA スコア ヒストグラム。円のサイズは分類単位の豊富さに比例します。(B) 胃の微生物叢における属レベルでの違いの STAMP 分析。(C) PICRUSt 分析は、KEGG レベル 2 で胃の微生物叢分類群の機能を予測します。 |
| 3.10.H. pylori 感染マウスモデルにおけるL.plantarum Lp05の腸内微生物叢構造と機能への影響 |
| ベン図解析 (図 8A) では 14,342 個の アンプリコン配列変異体(ASV)が示され、そのうち 340 個は 6 つのグループすべてで共通していました。固有の アンプリコン配列変異体(ASV)は、CTL で 2760、H. pylori 感染(MC)グループで 2518、4剤併用療法グループ(PG)で 1627、L.plantarum Lp05低用量グループ、中用量グループ、高用量グループでそれぞれ 2595、1894、2268 個であり、腸内微生物叢構造に重大な影響があることを示しています。観察された豊富さ、Chao1、Shannon、Simpson 指数 (図 8B~E) などのアルファ多様性指標は、コントロール(CTL)グループと比較して H. pylori 感染(MC)グループで微生物の豊富さと多様性が低下していることを示しました。 L.plantarum Lp05投与後、特に高用量では、これらの指標が有意に向上し(p < 0.05)、H. pylori感染によって失われた多様性の回復におけるL.plantarum Lp05の有効性を示唆しています。PCoA分析(図8F)では、CTLと比較してL.plantarum Lp05、H. pylori 感染(MC)グループ、および4剤併用療法グループで微生物組成の大幅な変化が明らかになり、マイクロバイオームの再バランス調整が効果的であることが示されました。図8G、Hは、さまざまな分類レベルで優勢な種の詳細を示しており、FirmicutesおよびBacteroidotaが優勢です。たとえば、FirmicutesはH. pylori 感染(MC)グループで60.85%を占めたのに対し、コントロール(CTL)グループでは51.91%を占めました。属レベルの分析では、Lachnospiraceae_NK4A136_groupとMuribaculaceae_unclassifiedが顕著であり、L.plantarum Lp05はLachnospiraceae_NK4A136_groupを著しく向上させ、腸の健康をサポートする可能性を強調しました。 LEfSe 解析 ( 図 9A ) では重要なバイオマーカーが特定され、コントロール(CTL)グループ では Muribaculum や Paramuribaculum などが優勢な種でした。H. pylori 感染(MC)グループでは Atopobiaceae と Olsenella が豊富に存在し、4剤併用療法グループのバイオマーカーは主に Firmicutes と Bifidobacterium でした。L.plantarum Lp05の介入により、Bacilli や Ligilactobacillus などの有益なバイオマーカーが強調表示され、潜在的な病原体の減少が示唆されました。属レベルの STAMP 解析 ( 図 9B ) では、Ligilactobacillus、Bifidobacterium、および Olsenella の有意な存在量の変化が確認され、H. pylori 関連の病理におけるそれらの役割が示されました。PICRUSt2 解析 ( 図 9C ) では、細胞の成長と修復に不可欠な代謝経路、特に炭水化物とヌクレオチドの代謝が大幅に増加していることが明らかになりました。これは、L.plantarum Lp05介入が胃の微生物叢における代謝活動を調節し、H. pylori 感染に関連する代謝障害や長期的な健康問題を軽減する可能性があることを示唆しています。 |
 |
| 図8.Lactiplantibacillus plantarum Lp05 の投与量が盲腸の微生物組成と構造に与える影響。(A) 腸内微生物叢配列のベン図分析、(B~E) 腸内微生物叢のアルファ多様性指標、(F) PCoA 分析で評価した腸内微生物叢のベータ多様性、(G、H) 腸内微生物叢内の門および属レベルでの種の相対的存在量。グループ、CTL (コントロール)、MC(H. pylori 感染モデル)、L.plantarum Lp05_L (低用量、2×107 CFU)、L.plantarum Lp05_M (中用量、2×108 CFU)、L.plantarum Lp05_H (高用量、2×109 CFU)。NS は p > 0.05、* は p < 0.05 を示します。 |
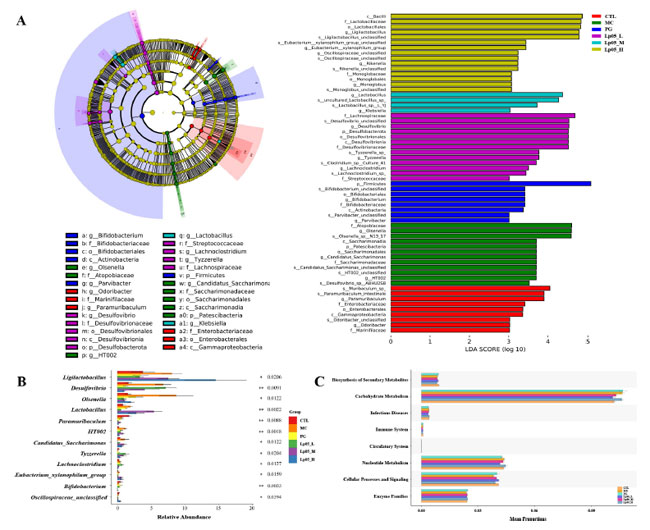 |
| 図9. Lactiplantibacillus plantarum Lp05 の投与量が盲腸マイクロバイオームの多様性に与える影響。(A) メタゲノム データと LEfSe 分析から得られた系統樹。有意差のある分類群を示し、円の大きさは分類群の豊富さを反映しています。(B) STAMP 分析により、腸内マイクロバイオーム内の属レベルの違いが特定されています。(C) PICRUSt は、腸内マイクロバイオームにおける KEGG レベル 2 分類群の機能を予測します。グループ、CTL (コントロール)、MC(H. pylori 感染モデル)、L.plantarum Lp05_L (低用量、2×107 CFU)、L.plantarum Lp05_M (中用量、2×108 CFU)、L.plantarum Lp05_H (高用量、2×109 CFU)。 |
| 3.11.H.pylori 感染マウスモデルにおける胃腸内微生物叢の相関分析 |
| 図 10 に示すように、スピアマンの相関を使用して、胃腸内微生物叢における微生物属の相対的存在量の関係を分析しました。胃腸内微生物叢では、Raoultella、Streptomyces、Pseudoxanthomonas、Gemmata、Sporosarcina、Steroidobacter などの属が、Actinobacillus、Ureaplasma、Anaerococcus、Oceanivirga、Fusobacterium、Atopostipes、Succinivibrio、Rikenella、Campylobacter、Anaerovibrio などの腸内微生物属と有意な正の相関 (p < 0.05) があることがわかりました。逆に、これらの胃の属は、Christensenellaceae_R-7_group、Eubacterium_nodatum_group、Bifidobacterium、Mitochondria、Brevundimonas、Subdoligranulum と負の相関を示しました。さらに、Ruminococcus_gnavus_group、Rothia、UBA1819、Subdoligranulum、Blautia、Phascolarctobacterium などの胃の属は、Christensenellaceae_R-7_group、Eubacterium_nodatum_group、Bifidobacterium、Mitochondria、Brevundimonas、Subdoligranulum と正の相関を示しました。しかし、これらは、Actinobacillus、Ureaplasma、Anaerococcus、Oceanivirga、Fusobacterium、Atopostipes、Succinivibrio、Rikenella、Campylobacter、Anaerovibrio などの腸内属と有意に負の相関関係 (p < 0.05) を示しました。胃と腸のマイクロバイオーム間の相関関係のこの複雑な相互作用は、L.plantarum Lp05介入が特定の属に影響を及ぼすだけでなく、宿主内のより広範な微生物生態系の関係にも影響を及ぼすことを示しています。 |
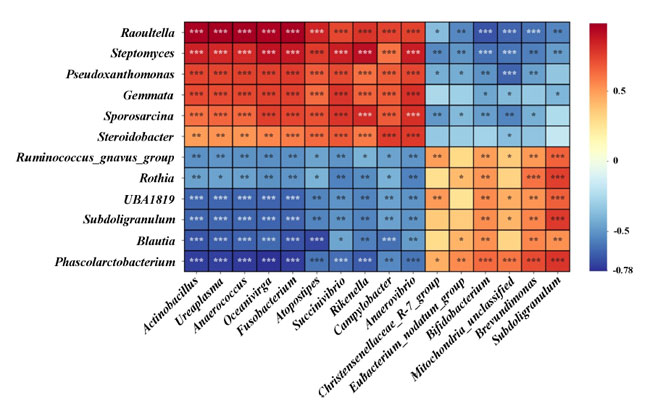 |
| 図10. 胃と腸のマイクロバイオーム間の異なる微生物属の相関分析を示します。スピアマンの順位相関検定を使用して、ヒートマップは有意水準を示します。*** は p < 0.001、** は p < 0.01、* は p < 0.05 です。 |
| この研究では、スピアマンの相関係数を使用して、H. pylori に感染したマウスの胃と腸の微生物属の関係を評価しました (図 10 参照)。Raoultella、Streptomyces、Pseudoxanthomonas などの胃の属は、Actinobacillus や Ureaplasma などのいくつかの腸の属と有意な正の相関 (p < 0.05) を示しており、胃腸のプロセスで潜在的な共通の役割を示唆しています。逆に、これらの胃の属は Christensenellaceae_R-7_group および Bifidobacterium と負の相関を示しており、異なる生理学的役割または環境条件への適応を示唆しています。さらに、Ruminococcus_gnavus_group などの属は、さまざまな腸の属と正と負の両方の相関を示しており、胃腸管内での複雑な相互作用を反映しています。これらの発見は、L.plantarum Lp05介入が特定の微生物属だけでなく、より広範な属間の関係にも影響を与え、宿主内の微生物生態系の全体的なダイナミクスに影響を及ぼすことを強調しています。 |
| 4.考察 |
| この研究は、マウスの H. pylori 感染に対する治療薬としてL.plantarum Lp05の可能性を示し、その抗菌および免疫調節特性を示しています。L.plantarum Lp05は、胃粘膜のウレアーゼ活性を大幅に低下させ、炎症性サイトカイン レベルを調整し、消化酵素機能を回復し、胃と腸の微生物叢を変化させて H. pylori と戦います。これらの結果は、H. pylori 感染の管理におけるプロバイオティクスの有効性を強調するだけでなく、胃腸の健康を高める能力も強調しています。L.plantarum Lp05は、4 剤併用療法などの従来の治療法よりも優れた利点を提供し、抗生物質関連の胃の損傷を軽減する可能性があります (34)。これは、長期管理に不可欠です。 |
| 我々の研究結果は、L. reuteri や L. johnsonii などのプロバイオティクスに関するこれまでの研究と一致しており、これらのプロバイオティクスは H. pylori の増殖を阻害し、胃の炎症を軽減することが示されています (18、35)。具体的には、L.plantarum Lp05の有効性は in vitro 研究で実証されており、L.plantarum Lp05は H. pylori と共凝集し、細胞構造を直接損傷したり、局所 pH レベルを変更したりすることで、その定着を阻害する可能性があります (16、36)。in vivo では、L.plantarum Lp05は感染マウスのウレアーゼ活性と H. pylori-IgG レベルを大幅に低下させ、定着の減少と胃の炎症の軽減を示唆しています (17、26、37)。組織病理学的分析では、L.plantarum Lp05は特に高用量で、胃と十二指腸の組織の完全性を著しく改善し、炎症性浸潤を減らし、上皮構造を維持することが示されています。 L.plantarum Lp05は、L. reuteri や L. johnsonii とは異なり、ウレアーゼ活性と H. pylori の定着を減らすだけでなく、胃の環境と免疫反応も強化するため、総合的な治療オプションとなります。L.plantarum Lp05のこれらの多面的な効果は、H. pylori 感染を管理し、胃腸の健康を促進する総合的なアプローチとしての可能性を強調しています。 |
| 本研究では、抗酸化酵素、消化酵素の回復、免疫調節に焦点を当て、L.plantarum Lp05の胃の微小環境に対する効果をさらに調べました。L.plantarum Lp05は、H.pylori 感染マウスの胃組織における必須消化酵素 (α-アミラーゼ、セルラーゼ、ペプシン) の活性を著しく回復させました。通常、H. pylori 感染は、酵素の分泌と活性を阻害する粘膜損傷と炎症、および複雑なシグナル伝達を介して酵素機能に影響を与える炎症性メディエーターの放出によって胃の機能を損ないます (38–40)。私たちの研究結果は、L.plantarum Lp05がこれらの酵素の活性を著しく高め、ベースライン レベルを超える場合があることを示しています。これは、L.plantarum Lp05が直接的な抗菌効果によって H. pylori の定着に対抗するだけでなく、H. pylori 誘発性機能障害と戦うために不可欠な胃の機能回復を促進することを示唆しています (6)。特に高用量では、L.plantarum Lp05の酵素活性の回復は、粘膜バリア修復、胃液分泌調節、正常な胃機能の回復を含む、その多メカニズムアプローチを強調しています。 |
| さらに、L.plantarum Lp05治療は、局所的な胃の炎症と全身反応の両方を引き起こし、症状を悪化させる H. pylori 感染によって引き起こされる全身炎症反応を大幅に軽減しました (41、42)。L.plantarum Lp05介入後、エンドトキシン(ET)、IL-17A、IL-23、TGF-β1、IP-10 などの炎症マーカーは顕著に減少し、FoxP3、IFN-β、IFN-γ などの調節マーカーは増加しました。これは、L.plantarum Lp05が H. pylori のコロニー形成を減少させ、宿主の免疫反応を調節する役割を果たしていることを示しています。高用量群では、炎症マーカーが特に大幅に改善し、免疫調節におけるL.plantarum Lp05の有効性が強調されました。さらに、H. pylori によって誘発される主要な病理学的反応である酸化ストレスには、カタラーゼ(CAT) や スーパーオキシドジスムターゼ(SOD)などの抗酸化酵素の活性低下 (43、44)、および マロンジアルデヒド(MDA)や ミエロペルオキシダーゼ(MPO)などの酸化マーカーの増加 (45、46) が伴います。酸化ストレスは胃組織にさらなる損傷を引き起こすだけでなく、細胞のアポトーシスや突然変異を含むさまざまな下流の病理学的反応を引き起こす可能性があります (44、47)。L.plantarum Lp05介入は、特に高用量で抗酸化酵素活性を大幅に高め、酸化ストレスマーカーを減少させ、酸化ストレスを軽減し、H. pylori 誘発性損傷から胃組織を保護する可能性があることを示しました。これは、プロバイオティクスが感染症に関連する酸化ストレスの管理に役割を果たす可能性があることを示唆しています。 |
| 我々は、L.plantarum Lp05が H. pylori 感染を緩和する方法を探るために、胃と盲腸の微生物叢のさらなる分析を行った。H. pylori 感染(MC)グループではアルファ多様性が著しく減少し、病原体が宿主の微生物叢に影響を与えていることが示された。L.plantarum Lp05介入により、胃の微生物叢の観察された豊富さと Chao1 指数が大幅に増加したことから、健康な胃環境を維持し、H.pylori の再発を減らすために重要な微生物多様性を回復するのに役立つことが示唆された (48)。L.plantarum Lp05は特に、抗炎症および保護機能で知られる Firmicutes の存在量を増加させた (49)。これが、炎症を軽減する効果を説明できる可能性がある。Bacteroidota の回復は、腸管バリア機能へのプラス効果と関連している可能性があり、腸管構造の改善と一致している (48、50)。L.plantarum Lp05は、酸性条件での H. pylori の生存に重要な要因であるウレアーゼ活性も大幅に低下させた (48)。これは、L.plantarum Lp05による Firmicutesおよび Bacteroidota レベルの修正が胃の pH および微生物相互作用を変化させ、間接的にウレアーゼ活性を阻害する可能性があることを示唆しています (51、52)。LEfSe 分析では、L.plantarum Lp05が Rikenella などの抗炎症および免疫調節機能を持つ細菌分類群を強化することが示されました (53、54)。これは、IL-10 および TGF-β1 などの炎症性サイトカインの減少と相関しており、免疫調節の強化を示しています。PICRUSt2 分析では、L.plantarum Lp05が抗酸化防御に重要なアミノ酸代謝および多糖類生合成に関連する経路を強化することが明らかになりました (55、56)。これは、カタラーゼ(CAT)およびスーパーオキシドジスムターゼ(SOD)などの抗酸化酵素活性のブーストに対応しており、L.plantarum Lp05が微生物群集および代謝経路を調節することで宿主の抗酸化能力を促進し、H. pylori 感染による酸化ダメージを軽減することを示唆しています。 |
| H. pylori 感染は胃と腸の微生物バランスを乱し、バイオマーカーと微生物群集の大きな変化から明らかです。L.plantarum Lp05介入は腸内微生物叢の多様性と豊かさを顕著に回復させ、H.pylori の悪影響を打ち消すために微生物生態系のバランスを取り戻す役割を示唆しています。L.plantarum Lp05治療下で観察された α-アミラーゼ、セルラーゼ、ペプシンなどの消化酵素活性の増強は、特定の腸内微生物が宿主酵素の発現と活性に影響を及ぼし、代謝経路と栄養素の吸収を高めるため、微生物の健康状態の改善に直接関係している可能性があります (57、58)。 LEfSe 解析により、L.plantarum Lp05は健康に関連する微生物の存在量を大幅に変化させ、特に Lachnospiraceae_NK4A136_group と Muribaculaceae_unclassified の割合を増加させることが明らかになりました。これは、IL-17A、IL-23、TGF-β1 などの炎症性因子のレベルの低下と直接相関している可能性があります (59)。この有益な微生物の増加は、酪酸などの抗炎症代謝物を生成して炎症を軽減することにより、宿主の免疫調節に直接影響を与える可能性があります (60)。さらに、L.plantarum Lp05介入により Olsenella の存在量が減少し、その潜在的な抗炎症および腸の健康促進能力が反映されています (61、62)。予測される機能的変化の PICRUSt2 解析では、L.plantarum Lp05が微生物の代謝経路に影響を及ぼし、特に細胞の成長と修復に不可欠な炭水化物とヌクレオチドの代謝を促進することが示されています (63–65)。これは、L.plantarum Lp05が微生物群集の構成に影響を与えるだけでなく、代謝の健康を改善する可能性もあることを示唆しており、H.pylori 感染によって引き起こされる代謝障害を軽減し、胃がんなどの長期的な健康問題のリスクを軽減するのに役立ちます。L.plantarum Lp05の介入は、H.pylori によって引き起こされる炎症を軽減し、炎症関連微生物の量を調整し、抗炎症微生物群を増やすことに大きな効果を示しており、宿主の免疫反応を調整して炎症を軽減するのに役立つ可能性があります。 |
| 胃と腸のマイクロバイオームの相互作用をさらに分析すると、胃の Raoultella と Streptomyces などの特定の属と、腸の Actinobacillus と Fusobacterium などの特定の属の間に有意な相関関係があることがわかります。これらの正の相関関係は、胃腸プロセスへの共同参加を示唆し、全体的な健康とストレス反応における微生物群集の相乗的な役割を強調しています。逆に、胃の Ruminococcus_gnavus_group と腸の Actinobacillus の間のような負の相関関係は、それらの異なる生理学的役割または独自の環境適応を強調しています。たとえば、Ruminococcus_gnavus_group は、胃の粘膜バリアの完全性と抗炎症機能をサポートする可能性がありますが、腸の炎症や病原体防御に関連している可能性があります (66)。この分析は、栄養素の吸収、免疫調節、病原体防御に影響を与える、全身の健康管理における微生物群集の重要性を強調しています。特に、Bifidobacteriumの負の相関は、胃の酸性環境により、腸の健康に対するBifidobacteriumの補助的役割が胃では低下する可能性があることを示唆しています (67)。これらの知見は、胃と腸の微生物叢の複雑な相互作用を明らかにし、胃腸疾患の管理において微生物群集の全身的影響を考慮することの重要性を強調し、総合的なアプローチが微生物の健康と宿主疾患管理戦略の改善につながる可能性があることを示唆しています。 |
| 全体として、この研究は、H. pylori に対する戦略におけるL.plantarum Lp05の可能性を明らかにし、その介入が胃腸内の微生物群集に影響を与えるだけでなく、消化酵素の活性や免疫反応などの宿主の生理機能にも良い影響を与えることを実証しました。ただし、この研究の限界には、人間の複雑な生理学的および微生物学的環境を完全に反映していない可能性のある特定の動物モデルの使用、および微生物群集の変化と宿主の病理との因果関係を完全に調査できないことが含まれます。これらの要因は、多様な宿主モデルとより広範な環境条件下でこれらの発見をさらに検証するための将来の研究の必要性を強調しています。 |
| 5.結論 |
| この研究により、H. pylori に感染したマウスの治療におけるL.plantarum Lp05の有効性が確認され、胃腸内微生物叢の調整、炎症および酸化ストレスの緩和、宿主の健康の最適化の能力が示されました。これらの結果は、プロバイオティクスとしての L.plantarum Lp05の可能性を強調し、臨床応用に関するさらなる研究の科学的根拠を提供します。今後の研究では、胃腸疾患の予防と治療における使用を拡大するために、その特定の作用メカニズムをさらに深く調査する必要があります。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Front Immunol. 2025 Jan 17;15:1469885. に掲載されたEnhancement of host defense against Helicobacter pylori infection through modulation of the gastrointestinal microenvironment by Lactiplantibacillus plantarum Lp05.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


