ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(植物性ヨーグルト、プランタルム菌の科学:研究の最前線) |
FXRシグナル伝達による胆汁酸代謝は 乳酸菌株によるコレステロール胆石の緩和に重要である |
Xin Ye et al., |
|
|
| 要約 |
コレステロール胆石疾患は、胆汁酸代謝の不均衡を特徴とし、腸内細菌叢障害と密接に関連しています。しかし、腸内細菌叢を標的とするプロバイオティクスがコレステロール胆石を軽減する役割とメカニズムはまだ不明です。この研究では、Limosilactobacillus reuteri 株 CGMCC 17942 と Lactiplantibacillus plantarum 株 CGMCC 14407 を、8 週間、結石誘発食を与えられたマウスに個別に投与しました。両方の Lactobacillus 株は、結石誘発食誘発性胆石、肝脂肪変性症、および高脂血症を大幅に軽減しました。これらの株は、血清と肝臓の胆汁酸プロファイルを調節し、これがファルネソイド X 受容体(FXR)(訳者注:ファルネソイドX受容体は、核内ホルモン受容体の一種で、胆汁酸などのリガンドによって活性化されます。胆汁酸の生合成や腸管循環の制御、脂質代謝や糖代謝の調節など、さまざまな生理機能に関与しています)の活性化に関与している可能性があります。分子レベルでは、L. reuteri と L. plantarum は回腸線維芽細胞増殖因子 15 (FGF15) と肝臓線維芽細胞増殖因子受容体4 (FGFR4) および小ヘテロ二量体パートナー (SHP) を増加させました。その後、肝臓コレステロール 7α-ヒドロキシラーゼ (CYP7A1) とオキシステロール 7α-ヒドロキシラーゼ (CYP7B1) が阻害されました。さらに、2 つの株は肝臓多剤耐性関連タンパク質ホモログ3 および4 (Mrp3/4)、肝臓多剤耐性タンパク質 2 (Mdr2)、および胆汁酸塩輸出ポンプ (BSEP) のレベルを上昇させることで胆汁酸輸送を強化しました。さらに、L. reuteri と L. plantarum はどちらも 結石誘発食関連腸内細菌叢の不均衡を軽減しました。L. reuteri は Muribaculaceae の相対的存在量を増加させ、L. plantarum は Akkermansia の存在量を増加させました。腸内細菌叢の変化は、コレステロール胆石の発生率、肝臓と血清中のファルネソイド X 受容体(FXR)拮抗性胆汁酸、および ファルネソイド X 受容体(FXR)シグナル伝達経路と有意に負の相関関係にあった。さらに、2 つの菌株の保護効果は、全身および腸管特異的ファルネソイド X 受容体(FXR)拮抗薬の両方によって無効化された。これらの知見は、Lactobacillusが ファルネソイド X 受容体(FXR)シグナル伝達経路を通じてコレステロール胆石を軽減する可能性があることを示唆している。 |
重要性 コレステロール胆石疾患は世界中で蔓延しています。コレステロール胆石疾患の予防と治療のための医学的選択肢はいずれも推奨されておらず、外科的治療は再発率が高い。メタボリックシンドロームに関与する因子はコレステロール胆石形成と密接に関連していることが報告されています。メタボリックシンドロームの改善中の腸内細菌叢のディスバイオーシス(腸内細菌叢の乱れ)のリモデリングは十分に研究されていますが、腸内細菌叢の調整後のコレステロール胆石形成の予防についてはあまり知られていません。私たちは、Limosilactobacillus reuteri株CGMCC 17942とLactiplantibacillus plantarum株CGMCC 14407によるコレステロール胆石形成の予防を調べるために、結石誘発食を使用してC57BL/6Jマウスで実験的コレステロール胆石モデルを誘導しました。私たちは、これらのL. reuteri株とL. plantarum株がマウスの胆汁酸組成を変え、腸内細菌叢のディスバイオーシスを改善することを発見しました。これら 2 つの乳酸菌株は、肝臓および回腸の ファルネソイド X 受容体(FXR)シグナル伝達経路を完全に活性化することでコレステロール胆石の形成を予防しました。これらは、コレステロール胆石の治療や再発の予防に有望な治療戦略となる可能性があります。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.結果 |
| 2.1.L. reuteri および L. plantarum の投与により、マウスの結石誘発食誘発性胆石および代謝障害が減少しました |
| 2.2.L. reuteri および L. plantarum の投与により、結石誘発食給餌マウスの肝臓および血清中の胆汁酸組成が変化した |
| 2.3.L. reuteri および L. plantarum 処理により、ファルネソイド X 受容体(FXR)-線維芽細胞増殖因子 15 (FGF15) /小ヘテロ二量体パートナー (SHP)シグナル伝達経路が活性化されました |
| 2.4.L. reuteri および L. plantarum の投与により、結石誘発食給餌マウスの コレステロール胆石関連腸内細菌叢の構成が変化しました |
| 2.5.腸内細菌叢と宿主のコレステロール胆石関連パラメータとの相関 |
| 2.6.ファルネソイド X 受容体(FXR)活性化の阻害は、結石誘発食給餌マウスにおける L. reuteri および L. plantarum の保護効果を減弱させた |
| 3.考察 |
| 4.材料と方法 |
| 4.1.マウスの系統と処理 |
| 4.2.プロバイオティクス製剤 |
| 4.3.サンプル採取 |
| 4.4.組織学 |
| 4.5.胆汁酸分析 |
| 4.6.胆汁分析およびコレステロール飽和指数 (CSI)計算 |
| 4.7.免疫蛍光法 |
| 4.8.ウェスタンブロッティング |
| 4.9.RNA抽出および定量的リアルタイムPCR |
| 4.10.DNA 抽出および細菌配列決定 |
| 4.11.バイオインフォマティクス |
| 4.12.統計分析 |
| 4.13.試薬 |
本文 |
| 1.はじめに |
| コレステロール胆石の形成率は、西洋料理の人気とともに増加しています(1、2)。コレステロール胆石は、胆嚢または胆道におけるコレステロールの沈殿によって引き起こされ、胆嚢炎、胆管炎、膵炎、胆嚢がん、結腸がんなどのより深刻な病気につながる可能性があります(3、4)。ウルソデオキシコール酸(UDCA)は、特定の患者のコレステロール胆石を溶解するために使用されてきましたが、コレステロール胆石の再発率が高いため、好まれなくなりました(5)。現在、コレステロール胆石の予防と治療のための医学的選択肢はどれも推奨されておらず、外科的管理は再発率が高い(2)。したがって、コレステロール胆石の予防と治療の両方に効果的な治療法を見つける必要があります。 |
| 大規模研究において、腸内細菌叢のディスバイオーシスと細菌群集の形成がコレステロール胆石と関連していることが示された (6–8)。新たな研究では、胆石患者の腸内細菌叢を胆石耐性マウス株に糞便移植すると、胆石形成が誘発される可能性があることが明らかになった (9)。コレステロール胆石マウスモデルではLactobacillusの割合が大幅に減少することが報告されている (10)。しかし、Lactobacillus サプリメントが胆石を減少させるかどうかは研究されていない。さらに、武田らは、実験的コレステロール胆石においてClostridium butyricum サプリメントが胆石形成を軽減できることを示した (11) が、研究対象株が胆石を軽減するメカニズムについては述べていない。さらに、Limosilactobacillus reuteri 株 CBG-C15 と Lactiplantibacillus plantarum 株 CBG-C21 がラットの高コレステロール血症に有益な効果を示したことが報告されている (12)。最近の研究で、Limosilactobacillus reuteri Fn041株はマウスのコレステロールと胆汁酸の排泄を促進し、高コレステロール血症を予防することが示されています(13)。Liangと同僚は、Lactiplantibacillus plantarum H-87株が胆汁酸代謝の調節の役割によりコレステロールを低下させる可能性があることを示しました(14)。これらの結果は、これら2つのLactobacillus種に属する細菌株がコレステロール関連の代謝を調節する可能性を示唆しています。私たちは以前、正常血清コレステロール値の健康な成人の糞便からLimosilactobacillus reuteri株CGMCC 17942とLactiplantibacillus plantarum株CGMCC 14407(以下、L. reuteriとL. plantarum)を分離しており、この研究は、これら2つの株の補給が胆石形成を減らすことができるかどうかを調べ、そのメカニズムを明らかにするために実施しました。 |
| 胆汁酸は肝細胞で生合成され、抱合され、胆嚢から小腸に分泌され、そこで腸内細菌叢によって加水分解および脱水酸化され、一部は腸の門脈系から肝臓に再吸収されます (15)。胆汁酸の含有量や組成の変化は胆汁中のコレステロールの沈殿につながり、これが胆石の重要な原因であると考えられています (16)。腸内細菌叢を介した胆汁酸プールの変化は、核受容体ファルネソイド X 受容体 (FXR) 経路シグナル伝達の活性化を制御します (15、17、18)。ファルネソイド X 受容体(FXR)は、ステロイド/甲状腺ホルモン受容体ファミリーのリガンド活性化転写因子のメンバーとして、胆汁酸、グルコース、脂質代謝を制御する重要な胆汁酸受容体です (15、19)。現在の研究では、ファルネソイド X 受容体(FXR)は胆汁酸の疎水性を調節してコレステロールの排泄を促進し (20、21)、胆汁酸とコレステロールの生合成を阻害し、コレステロール結晶の沈殿を減らすことで コレステロール胆石 の形成を防ぐことが示されています (15、19)。Moschetta と同僚は、ファルネソイド X 受容体(FXR)の活性化により、小ヘテロ二量体パートナー (SHP) 遺伝子の発現が増加して胆汁酸同化が調節され、胆汁リン脂質と胆汁酸塩の輸送が増加して胆汁中のコレステロールの可溶化が促進されることを示しました (20)。 |
| 他の疾患モデル(コレステロール胆石以外)で蓄積された証拠は、Lactobacillus rhamnosus GG, Lactobacillus casei YRL577とプロバイオティクス混合物 VSL#3 などのプロバイオティクスの経口補給が、マウスのファルネソイド X 受容体(FXR)-線維芽細胞増殖因子 15 (FGF15) シグナル伝達経路を介して肝臓での胆汁酸合成を抑制し、胆汁酸の脱抱合または排泄を促進できることを示唆しています (17、22、23)。しかし、コレステロール胆石に対するプロバイオティクスの効果がファルネソイド X 受容体(FXR)-線維芽細胞増殖因子 15 (FGF15) 軸に依存するかどうかは不明です。そのため、L. reuteri または L. plantarum の補給がファルネソイド X 受容体(FXR)シグナル伝達経路を活性化することでコレステロール胆石形成を減少させるかどうかを調べるために本研究を実施しました。 |
| この研究で、私たちのデータは、L. reuteri と L. plantarum の補給が コレステロール胆石の形成を効果的に予防することを示しました。これらの菌株は、Muribaculaceae または Akkermansia の相対的存在量を増やすことで腸内細菌叢の異常を改善しました。L. reuteri と L. plantarum による治療は、主にタウロ-α-ムリコール酸 (T-α-MCA) とタウロ-β-MCA (T-β-MCA) を減らして ファルネソイド X 受容体(FXR)活性を高め、肝臓での 胆汁酸とコレステロールの合成を減らすことで、胆汁酸代謝の恒常性を維持しました。全身的および腸管特異的ファルネソイド X 受容体(FXR)拮抗薬はどちらも、コレステロール胆石に対する 2 つの菌株の保護効果を無効にしました。 |
| 2.結果 |
| 2.1.L. reuteri および L. plantarum の投与により、マウスの結石誘発食誘発性胆石および代謝障害が減少しました |
| L. reuteri および L. plantarum がコレステロール胆石の形成を予防できるかどうかを調べるため、マウスで結石誘発食誘発性コレステロール胆石モデルを使用しました。マウスには 8 週間結石誘発食を与え、実験開始から L. reuteri および L. plantarum を 1 日 1 回補給しました。通常食を与えられたマウスの胆嚢は透明な胆汁で満たされ、コレステロール結晶はありませんでした。結石誘発食を与えられたマウスの胆嚢には、丸い胆石または層状の結晶と少量の粘着性胆汁が詰まっていました。胆石の発生率は 100% に達しました。 L. reuteri および L. plantarum を投与したマウスの胆嚢では、肉眼では見えない小葉結晶またはコレステロール粒子と粘性の胆汁がわずかに観察されただけで、胆石の発生率は著しく減少しました (図 1A および B)。 胆石の評価には、Akiyoshi らが開発したグレーディング基準を使用しました (24)。 結石誘発食を与えられたマウスの実験的胆石のグレードは、通常食を与えられたマウスのグレードよりも有意に高く、L. reuteri および L. plantarum を投与すると著しく減少することが分かりました (図 1C)。 次に、L. reuteri および L. plantarum による コレステロール胆石形成の減少に関与するメカニズムを理解するために、胆嚢胆汁中の脂質プロファイルを評価し、コレステロール飽和指数 (CSI) を計算しました。 通常食群と比較して、結石誘発食を与えられたマウスの胆汁総コレステロール(TC)レベルは有意に上昇したが、L. reuteriおよびL. plantarum投与により総コレステロール(TC)レベルは有意に低下した。通常食群と比較して、結石誘発食マウスの胆汁中のリン脂質(PL)レベルは有意に低下したが、L. reuteriおよびL. plantarum投与によりリン脂質(PL)レベルは有意に上昇した。しかし、胆汁中の総胆汁酸レベルは有意に上昇し、L. reuteriまたはL. plantarum投与により有意に変化しなかった(図1D)。結石誘発食群のコレステロール飽和指数 (CSI)は通常食群よりも高く、L. reuteriおよびL. plantarum投与はともにそれを低下させた(図1E)。これは、L. reuteriおよびL. plantarum投与が結石誘発食誘発性胆汁中コレステロール過飽和を改善できることを示唆している。 |
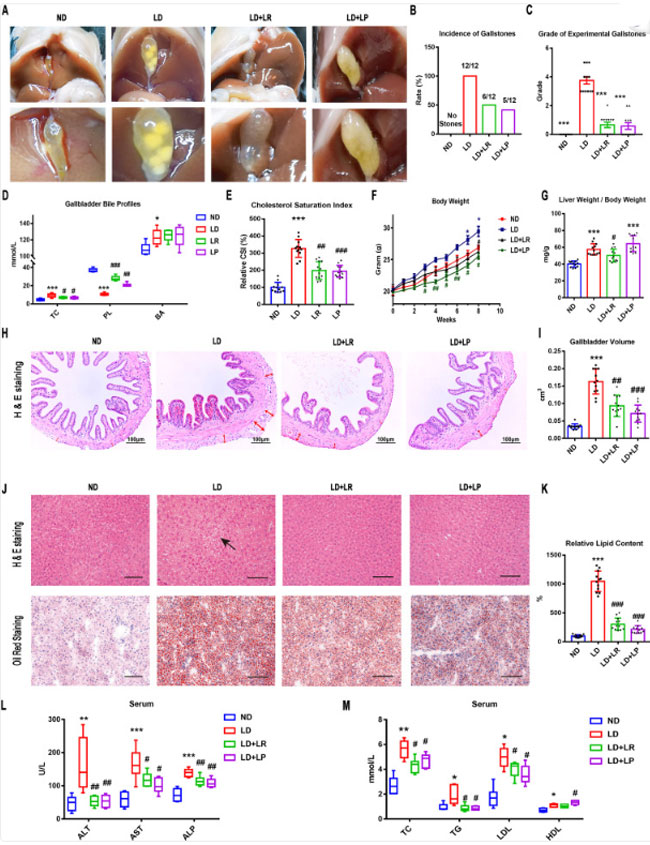 |
| 図1.L. reuteri (LR) および L. plantarum (LP) 投与により、マウスにおける結石誘発食誘発性胆石および代謝障害が減少しました。12 匹のマウスを各グループに無作為に割り当て、8 週間、L. reuteri または L. plantarum 投与 (109 CFU/日) の有無にかかわらず、通常食 (ND) または結石誘発食 (LD) を与えました。(A) 異なる投与を受けたマウスの胆嚢および胆石の肉眼的外観。(B) 各マウス グループにおける胆石発生率。(C) マウスにおける実験的コレステロール胆石の等級は、観察された胆石症に基づいています。(D) 胆嚢中の総コレステロール (TC)、胆汁酸 (BA)、およびリン脂質 (PL)。(E) 各マウス グループのコレステロール飽和指数 (CSI)。(F) マウスの体重は週 1 回記録しました。(G) 肝臓重量と体重の比。 (H) H&E 染色した胆嚢切片の代表画像 (×200)。胆嚢外膜は赤い矢印で示されています。(I) 胆嚢の容積は、胆嚢の長さ、直径、円周から推定されました。(J) H&E染色およびオイルレッドO染色した肝臓切片の代表画像 (×200)。(K) オイルレッドO陽性領域の割合。(L および M) 血清アラニンアミノトランスフェラーゼ (ALT)、アスパラギン酸アミノトランスフェラーゼ (AST)、アルカリホスファターゼ (ALP)、総コレステロール (TC)、トリグリセリド (TG)、高密度リポタンパク質 (HDL)、および低密度リポタンパク質 (LDL) は、シーメンス高速自動生化学分析装置 (Advia 2400) を使用して測定しました。データはANOVAと事後Tukey検定で分析され、平均値±SEM(n = 12)として提示されています。*、0.01 < P ≤ 0.05、**、0.001 < P ≤ 0.01、***、通常食群と比較してP ≤ 0.001、#、0.01 < P ≤ 0.05、##、0.001 < P ≤ 0.01、###、結石誘発食群と比較してP ≤ 0.001。 |
| いくつかの証拠から、メタボリックシンドローム(MS)は胆石の罹患率と関連していることが示唆されている(25、26)。マウスの体重を週1回測定したところ、結石誘発食給餌マウスの体重は通常食給餌マウスに比べて有意に増加していることが判明した。L. reuteriおよびL. plantarum投与を受けたマウスでは体重増加が抑制された(図1F)。次に、マウスの肝臓重量と体重の比を計算した。通常食給餌マウスと比較すると、結石誘発食給餌マウスの肝臓重量と体重の比は有意に高く、L. reuteri投与によりこの変化を有意に逆転させることができた。L. plantarum投与マウスの比は、結石誘発食給餌マウスの比と比較して減少せず、通常食群の比とは有意に異なっていた(図1G)。L. plantarum投与群の比の有意な増加は、L. plantarum投与後の体重減少によるものと考えられる(図1G)。インスリン抵抗性は胆石の発症に密接に関連していることが報告されている (26, 27)。そこで、経口ブドウ糖負荷試験 (OGTT) によりマウスの血清グルコースとインスリン機能をさらに調べた。その結果、結石誘発食給餌マウスの高血糖は L. reuteri および L. plantarum 投与により大幅に改善されることがわかった。さらに、結石誘発食給餌マウスの耐糖能は通常食給餌マウスに比べて著しく低下していたが、L. reuteri および L. plantarum 投与により効果的に改善された (補足資料の図 S1A および B)。これらの結果は、脂質代謝とインスリン抵抗性の改善が、L. reuteri および L. plantarum 投与によるコレステロール胆石形成の減少を伴うことを示唆している。 |
| 結石誘発食投与はマウスに有意な組織病理学的および生化学的変化をもたらした。結石誘発食摂取マウスの胆嚢外膜の結合組織は通常食群よりも厚く緩んでおり、これらの変化は L. reuteri および L. plantarum 投与によって軽減された (図 1H)。通常食群と比較して、結石誘発食摂取マウスの胆嚢容積は有意に増加し、この変化は L. reuteri および L. plantarum 投与によって顕著に回復した (図 1I)。これらの胆嚢の変化は、L. reuteri および L. plantarum 投与が胆嚢壁の肥大および胆嚢の生理機能を改善することでコレステロール胆石予防に関与することを示唆している。次に、L. reuteri および L. plantarum 補給による脂肪肝および代謝異常の改善を評価した。 通常食群の肝実質と比較して、結石誘発食給餌マウスの肝実質には脂肪滴の蓄積による空胞が多く見られました。L. reuteriおよびL. plantarum投与により、肝臓の組織学的損傷が著しく減少しました(図1J)。オイルレッドO染色により、肝実質の脂質の変化をさらに確認しました。通常食群と比較して、結石誘発食給餌マウスの肝実質には、オイルレッドで染色された脂肪滴が多く見られました。脂肪滴の量は、L. reuteriおよびL. plantarum投与により大幅に減少しました(図1JおよびK)。さらに、血清中のアラニンアミノトランスフェラーゼ(ALT)、アスパラギン酸アミノトランスフェラーゼ(AST)、アルカリホスファターゼ(ALP)、総コレステロール(TC)、トリグリセリド(TG)の値は、通常食群と比較して結石誘発食群で増加したのに対し、L. reuteriおよびL. plantarum投与により有意に減少した(図1LおよびM)。高密度リポタンパク質(HDL)および低密度リポタンパク質(LDL)の値は、通常食群と比較して結石誘発食群群で増加した。低密度リポタンパク質(LDL)の値は、L. reuteriおよびL. plantarum投与により減少した。高密度リポタンパク質(HDL)の値は、L. plantarum投与マウスでさらに増加した(図1M)。これらのデータは、L. reuteri と L. plantarum の経口投与が胆嚢と肝臓の組織学的損傷を改善し、肝臓脂肪変性と肝臓脂質代謝を改善し、コレステロール胆石形成の減少に関連する可能性があることを示唆しています (28、29)。 |
| 2.2.L. reuteri および L. plantarum の投与により、結石誘発食給餌マウスの肝臓および血清中の胆汁酸組成が変化した |
| 胆汁酸は重要なシグナル分子として、胆汁酸とコレステロール代謝の調節に関与している(30)。ほとんどの 胆汁酸は、腸内細菌によって処理された後、腸上皮から再吸収され、腸肝循環に入る (31、32)。本研究では、L. reuteri および L. plantarum の投与によるコレステロール胆石形成の減少に関与するメカニズムを理解するために、マウスの肝臓および血清中の総胆汁酸および胆汁酸組成を測定した。結石誘発食給餌マウスでは、通常食給餌マウスと比較して肝臓の総胆汁酸レベルが有意に増加し、L. reuteri および L. plantarum の投与では変化がなかったことがわかった (図 2A)。 結石誘発食給餌マウスでは血清中の胆汁酸総量が通常食給餌マウスに比べて著しく増加し、経口L. reuteri投与により有意に減少した(図2B)。胆汁酸標的メタボロミクス解析を用いて、マウスの肝臓と血清中の個々の胆汁酸の変化を調べた。結石誘発食給餌マウスの肝臓と血清中の胆汁酸の組成は、通常食給餌マウスのものと有意に異なっていた(図2CおよびD)。血清と肝臓の上位12の胆汁酸をそれぞれ解析したところ、肝臓中のコール酸(CA)とタウロコール酸(TCA)の量が結石誘発食群では通常食群に比べて有意に増加しており、L. reuteriおよびL. plantarum投与ではコール酸(CA)とタウロコール酸(TCA)の増加がより顕著であった(図2C)。しかし、結石誘発食給餌マウスやL. reuteriまたはL. plantarum投与マウスの血清ではコール酸(CA)とタウロコール酸(TCA)のレベルは上昇しなかった(図2D)。さらに、最も強力な内因性ファルネソイド X 受容体(FXR)アゴニストであるタウロケノデオキシコール酸(TCDCA)は、50%有効濃度(EC50)が17μM(33)で、結石誘発食給餌マウスの肝臓と血清で増加し、L. reuteriおよびL. plantarum投与は、結石誘発食給餌によって誘発されたタウロケノデオキシコール酸(TCDCA)レベルの増加をさらに上方制御することを発見した。マウスの主な胆汁酸であるβ-ムリコール酸(β-MCA)は、ファルネソイド X 受容体(FXR)の拮抗薬として機能することを実証した研究があった(34)。 結石誘発食処理により肝臓と血清中のβ-ムリコール酸(β-MCA)レベルが有意に減少し、L. reuteriとL. plantarum処理によりβ-ムリコール酸(β-MCA)の減少がより顕著であったことがわかった(図2CとD)。さらに、タウロ-α-ムリコール酸(T-α-MCA)(50%阻害濃度[IC50] = 28μM)とタウロ-β-ムリコール酸(T-β-MCA)(IC50 = 40μM)は、どちらもファルネソイド X 受容体(FXR)の効率的な天然拮抗薬として知られている(34)。結石食群では通常食群と比較してタウロ-α-ムリコール酸(T-α-MCA)とタウロ-β-ムリコール酸(T-β-MCA)のレベルが有意に増加し、L. reuteriとL. plantarum処理によりそれらのレベルが著しく減少することがわかった(図2CとD)。 タウロ-α-ムリコール酸(T-α-MCA)とタウロ-β-ムリコール酸(T-β-MCA)のダウンレギュレーションはファルネソイド X 受容体(FXR)の阻害を逆転させ、ファルネソイド X 受容体(FXR)を活性化できることが報告されている (33, 35)。L. reuteri および L. plantarum 投与によってファルネソイド X 受容体(FXR)が活性化されたことをさらに実証するために、ファルネソイド X 受容体(FXR)作動性 胆汁酸として摂取された総コール酸 (CA)、デオキシコール酸 (DCA)、およびケノデオキシコール酸 (CDCA) (タウリン結合胆汁酸を含む) と、ファルネソイド X 受容体(FXR)拮抗性 胆汁酸として摂取された総ムリコール酸(MCA)の比率を計算した。通常食給餌マウスと比較して、結石誘発食給餌マウスでは上記の比率が有意に高く、L. reuteri および L. plantarum 投与により肝臓胆汁酸の比率がさらに上昇した (図 2E)。また、結石誘発食 群では 通常食群と比較して血清胆汁酸の比率は増加しなかった。しかし、L. reuteri および L. plantarum 投与により、この比率は顕著に増加しました (図 2G)。これらの結果は、結石誘発食給餌マウスで ファルネソイド X 受容体(FXR)が活性化され、L. reuteri および L. plantarum 投与により ファルネソイド X 受容体(FXR)の活性がさらに増強された可能性があることを示唆しています。タウリン結合胆汁酸 は親水性が高く、ファルネソイド X 受容体(FXR)に対する親和性が高く、コレステロール胆石の形成を防ぐのに有益であることが報告されています (33)。 タウロコール酸(TCA)、タウロケノデオキシコール酸(TCDCA)、タウロウルソデオキシコール酸(TUDCA)、タウロヒオデオキシコール酸(THDCA)、タウロ-α-ムリコール酸(T-α-MCA)、およびタウロ-β-ムリコール酸(T-β-MCA)を含む総タウリン結合胆汁酸は、通常食給餌マウスと比較して結石誘発食給餌マウスの肝臓と血清で有意にアップレギュレーションされ、L. reuteriおよびL. plantarum投与により肝臓タウリン結合胆汁酸のより顕著な増加が認められた(図2FおよびH)。これらの結果は、L. reuteriおよびL. plantarum投与により、ファルネソイド X 受容体(FXR)作動性胆汁酸が増加し、ファルネソイド X 受容体(FXR)拮抗性胆汁酸が減少し、胆汁酸の親水性がアップレギュレーションされることによって、コレステロール胆石の形成が減少する可能性があることを示唆している。 |
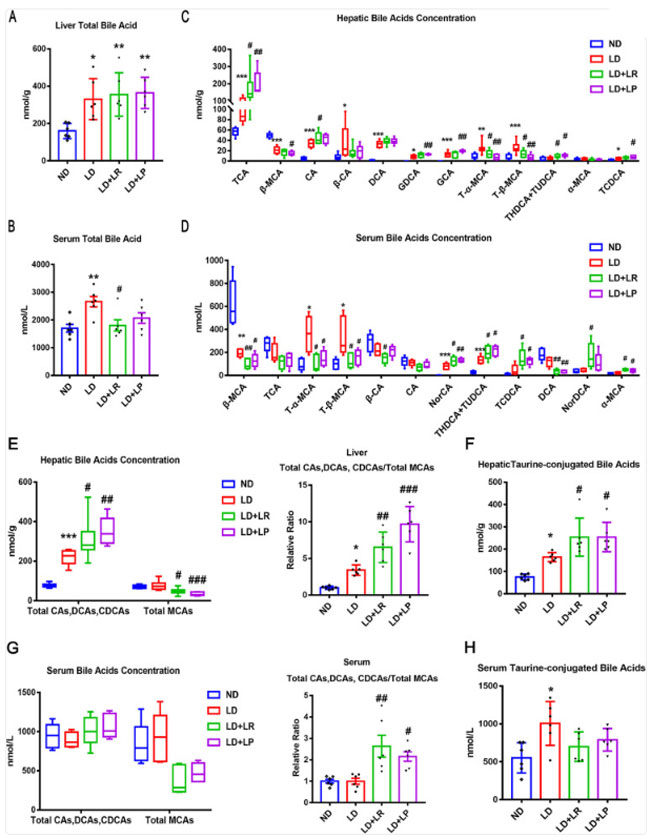 |
| 図2.L. reuteri (LR) および L. plantarum (LP) 処理により、肝臓および血清中の胆汁酸種が変化しました。各グループのマウスは 8 週目の終わりに屠殺され、血清と肝臓が採取されました。(A) マウスの肝臓中の総胆汁酸 (TBA)。(B) マウスの血清中の総胆汁酸 (TBA)。(C) 肝臓中の最も豊富な上位 12 の胆汁酸種を分析しました。(D) 血清中の最も豊富な上位 12 の 胆汁酸種を示します。NorCA、ノルコール酸、NorDCA、23-ノルデオキシコール酸。(E) 肝臓中の総コール酸 (CA)、デオキシコール酸 (DCA)、ケノデオキシコール酸 (CDCA)、総ムリコール酸(MCA)、および総コール酸 (CA)、デオキシコール酸 (DCA)、ケノデオキシコール酸 (CDCA)と総ムリコール酸(MCA)の比率。(F) 肝臓中の総タウリン結合胆汁酸(BA)。 (G) 血清中の総コール酸 (CA)、デオキシコール酸 (DCA)、ケノデオキシコール酸 (CDCA)、総ムリコール酸(MCA)、および総コール酸 (CA)、デオキシコール酸 (DCA)、ケノデオキシコール酸 (CDCA)と総ムリコール酸(MCA)の比率。 (H) 血清中の総タウリン結合胆汁酸(BA)。データは ANOVA および事後 Tukey 検定で分析され、平均値 ± SEM (n = 6) として示されています。*、0.01 < P ≤ 0.05、**、0.001 < P ≤ 0.01、***、通常食 (ND) グループと比較した P ≤ 0.001、#、0.01 < P ≤ 0.05、##、0.001 < P ≤ 0.01、###、結石食 (LD) グループと比較した P ≤ 0.001。 |
| 2.3.L. reuteri および L. plantarum 処理により、ファルネソイド X 受容体(FXR)- 線維芽細胞増殖因子 15 (FGF15) /小ヘテロ二量体パートナー (SHP)シグナル伝達経路が活性化されました |
| 回腸および肝臓でファルネソイド X 受容体(FXR)シグナル伝達が活性化されているかどうかをさらに調べるため、ファルネソイドX 受容体(FXR)および関連するシグナル伝達分子が検出されました。回腸における 線維芽細胞増殖因子 15 (FGF15)の mRNA およびタンパク質レベルを調べたところ、結石誘発食給餌マウスでは回腸における線維芽細胞増殖因子 15 (FGF15)発現が 通常食給餌マウスのレベルと比較して有意に増加していることがわかりました。さらに、L. reuteri および L. plantarum 処理では線維芽細胞増殖因子 15 (FGF15)の mRNA およびタンパク質レベルがより顕著に増加し、免疫蛍光法で検出された回腸における線維芽細胞増殖因子15 (FGF15)の発現は mRNA およびタンパク質レベルと一致していました (図 3A ~ C)。 通常食群と結石誘発食群の間で回腸と肝臓のファルネソイド X 受容体(FXR)のmRNAとタンパク質レベルに有意差はなく、L. reuteriとL. plantarumの投与後も有意な変化は見られませんでした(図S2A~D)。 |
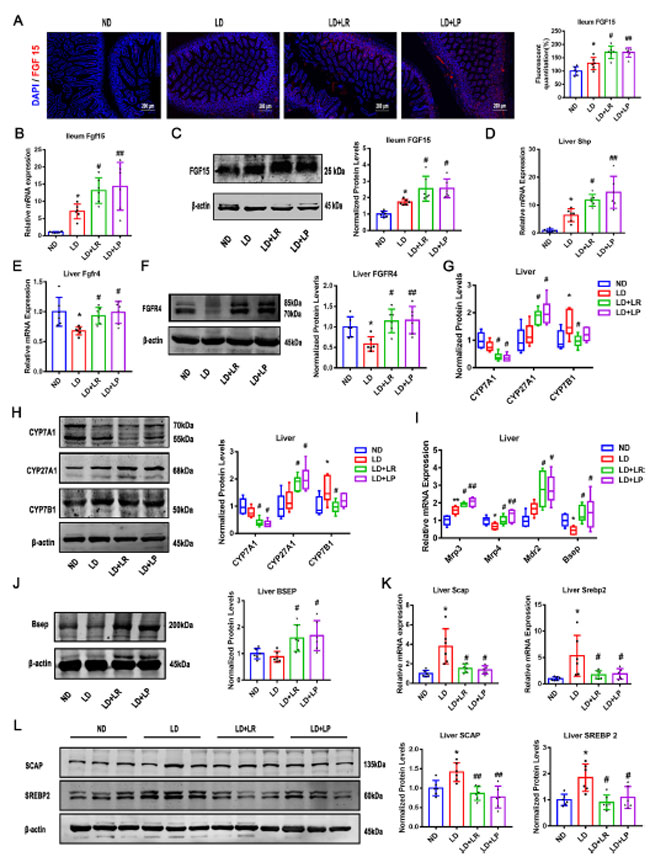 |
| 図3.L. reuteri (LR) および L. plantarum (LP) 処理により、ファルネソイドX 受容体(FXR)シグナル伝達経路が活性化されました。各グループのマウスは 8 週目に屠殺され、血清および回腸サンプルが採取されました。(A) 回腸線維芽細胞増殖因子15 (FGF15)の免疫蛍光分析 (×400)。(B) 回腸のFgf15 mRNA 発現。(C) 回腸線維芽細胞増殖因子15 (FGF15)のタンパク質発現および定量。(D および E) Shp および Fgfr4 の肝臓 mRNA レベル。(F) 肝臓線維芽細胞増殖因子受容体4 (FGFR4)のタンパク質発現および定量。(G および H) CYP7A1、CYP27A1、および CYP7B1 の肝臓 mRNA およびタンパク質発現とタンパク質の定量。(I) Mrp3、Mrp4、Mdr2、および Bsep の肝臓 mRNA レベル。(J) 肝臓胆汁酸塩輸出ポンプ(BSEP)のタンパク質発現および定量。 (K および L) 肝臓における SCAP および SREBP2 の mRNA およびタンパク質発現とタンパク質の定量。データは ANOVA および事後 Tukey 検定で分析され、平均値 ± SEM (n = 6) として示されています。*、0.01 < P ≤ 0.05、**、0.001 < P ≤ 0.01、***、通常食 (ND) グループと比較した P ≤ 0.001、#、0.01 < P ≤ 0.05、##、0.001 < P ≤ 0.01、###、結石食 (LD) グループと比較した P ≤ 0.001。 |
| さらに、結石誘発食給餌マウスでは肝臓ShpのmRNAレベルが有意に増加し、L. reuteriおよびL. plantarum投与によりさらに増加しました(図3D)。ファルネソイド X 受容体(FXR)シグナル伝達経路の重要な受容体である肝臓線維芽細胞増殖因子受容体4(FGFR4)のmRNAおよびタンパク質レベルは、通常食給餌マウスと比較して結石誘発食給餌マウスで著しく減少し、L. reuteriおよびL. plantarum投与によりそのレベルが回復したことは注目に値します(図3EおよびF)。これらの結果は、ファルネソイド X 受容体(FXR)-線維芽細胞増殖因子 15 (FGF15) -線維芽細胞増殖因子受容体4 (FGFR4)シグナル伝達経路が結石誘発食投与により損なわれる可能性があり、L. reuteriおよびL. plantarum投与によりそれが修復されることを示しています。 ファルネソイド X 受容体(FXR)の下流シグナル伝達経路を研究するために、コレステロールから胆汁酸を合成する重要な触媒酵素であるコレステロール7α-ヒドロキシラーゼ (CYP7A1)、ステロール 12α-ヒドロキシラーゼ (CYP8B1)、ステロール 27-ヒドロキシラーゼ (CYP27A1)、およびオキシステロール 7α-ヒドロキシラーゼ (CYP7B1) の発現を評価しました (36, 37)。次に、胆汁酸合成の古典的経路の律速酵素であるコレステロール7α-ヒドロキシラーゼ (CYP7A1) (38) は、結石誘発食給餌マウスでは 通常食給餌マウスと比較してわずかにダウンレギュレーションされており、コレステロール7α-ヒドロキシラーゼ (CYP7A1)のレベルは L. reuteri および L. plantarum 投与により著しく減少したことを発見しました。これは、L. reuteri および L. plantarum 投与が古典的経路を介した 胆汁酸合成を阻害できることを示唆しています (図 3G および H)。古典的経路におけるもう一つの重要な酵素であるステロール 12α-ヒドロキシラーゼ (CYP8B1) の mRNA およびタンパク質レベルは、結石誘発食、L. reuteri、および L. plantarum 介入による有意な変化は見られませんでした (図 S2E および F)。さらに、代替経路の律速酵素であるステロール 27-ヒドロキシラーゼ (CYP27A1)の mRNA およびタンパク質レベルは、通常食投与マウスと比較して 結石誘発食投与マウスでは低下せず、ステロール 27-ヒドロキシラーゼ (CYP27A1)のタンパク質レベルは L. reuteri および L. plantarum 投与により著しく増加しました。これは、L. reuteri および L. plantarum 投与マウスで代替経路が活性化されたことを示しています (図 3G および H)。最後に、オキシステロール 7α-ヒドロキシラーゼ (CYP7B1)タンパク質の発現は 結石誘発食グループで増加し、L. reuteri 投与により逆転しました (図 3G および H)。 |
| 胆嚢への胆汁酸の輸送が阻害されると、胆石形成のさらなるリスクとなる(39)。肝細胞の基底外側膜にある多剤耐性関連タンパク質ホモログ(MRP)は、胆汁酸の排泄を担っている(40)。私たちは、抱合型胆汁酸の共排出を媒介するトランスポーターであるMRP4のmRNA発現(41)が結石誘発食によって大幅に減少し、L. reuteriおよびL. plantarum投与によってそれが著しく上方制御されることを発見した(図3I)。結石誘発食を摂取したマウスでは肝臓MRP3のmRNAレベルが著しく増加し、L. reuteriまたはL. plantarum投与によってさらに顕著な増加が認められた(図3I)。また、肝臓多剤耐性タンパク質2(MDR2)のmRNAレベルは、結石誘発食給餌マウスでは通常食群と比較して統計的に有意に上昇しませんでしたが、L. reuteriまたはL. plantarum投与により有意に増加しました(図3I)。 L. reuteriおよびL. plantarum介入により胆汁リン脂質分泌が改善したことが示唆されました(39)。 しかし、MRP2の発現は、L. reuteriまたはL. plantarum投与にかかわらず、結石誘発食給餌マウスで有意に変化しませんでした(図S2G)。 さらに、胆汁酸塩輸出ポンプ(BSEP)のmRNAおよびタンパク質発現レベルが検出され、結石誘発食給餌マウスでは通常食給餌マウスと比較して低下していることがわかりましたが、この低下はL. reuteriおよびL. plantarum投与により回復することができました(図3IおよびJ)。 |
| 肝臓でのコレステロール排泄をさらに研究するために、ATP結合カセットサブファミリーGメンバー5および8(ABCG5/8)をコードする肝臓コレステロール排泄遺伝子の発現を評価しました(42)。まず、結石誘発食給餌マウスでは通常食給餌マウスと比較してATP結合カセットサブファミリーGメンバー5および8(ABCG5/8)遺伝子のmRNAレベルが増加し、L. reuteri投与によって回復しましたが、L. plantarum投与では回復しませんでした(図S2H)。これは、L. reuteriとL. plantarum投与がコレステロール輸送に異なる影響を及ぼしたことを示唆しています。次に結石誘発食給餌マウスではステロール調節エレメント結合タンパク質 2 (SREBP2) と SREBP 切断活性化タンパク質 (SCAP) の mRNA とタンパク質レベルが 通常食給餌マウスと比較して著しく上昇し、L. reuteri と L. plantarum の投与によりこれらの効果が著しく逆転することを発見しました (図 2K と L)。 |
| 総合的に、これらのデータは、結石誘発食給餌マウスにおいて胆汁酸合成がファルネソイド X 受容体(FXR)-線維芽細胞増殖因子 15 (FGF15) -線維芽細胞増殖因子受容体4 (FGFR4)およびファルネソイド X 受容体(FXR)-小ヘテロ二量体パートナー (SHP)シグナル伝達経路を介して阻害され、L. reuteriおよびL. plantarum投与によってさらに顕著に阻害されたことを示しています。さらに、L. reuteriおよびL. plantarumサプリメントでは、代替経路が古典的経路よりも有利でした。胆汁酸の胆嚢への排泄は、L. reuteriおよびL. plantarumによって促進されました。一貫して、コレステロール合成はSREBP 切断活性化タンパク質 (SCAP)およびステロール調節エレメント結合タンパク質 2 (SREBP2)の発現を下方制御することによって阻害され(43)、L. reuteri投与群ではコレステロール流出が抑制されました。 |
| 2.4.L. reuteri および L. plantarum の投与により、結石誘発食給餌マウスの コレステロール胆石関連腸内細菌叢の構成が変化しました |
| L. reuteri および L. plantarum が腸内細菌叢を再構築することでコレステロール胆石を軽減するという仮説をさらに検証するため、マウスの糞便を採取し、Illumina プラットフォームを使用して 16S rRNA 遺伝子の V3-V4 領域を分析しました。2 つのプロバイオティクス株が分離に寄与することを回避するため、距離計算のデータ セットから L. reuteri および L. plantarum をマスクし、類似性分析 (ANOSIM) を使用して、Bray-Curtis 分析に基づく操作分類単位 (OTU) レベルでサンプル間の細菌群集の類似性を比較しました。細菌群集間の差異を研究するために使用される視覚的方法である主座標分析(PCoA)は、結石誘発食グループのOTUが通常食グループのものと有意に異なり、L. reuteriとL. plantarumの経口投与により、結石誘発食を与えられたマウスの微生物組成がOTUレベルで通常食グループのものに近づくことを示した(Bray-Curtis ANOSIM、R = 0.6668、P = 0.001)(図4A)。グループ間の距離はグループ内のすべての距離よりも大きく、グループ間の差異がグループ内の差異よりも有意に大きいことを示した(図4B)。門レベルでは、結石誘発食を8週間摂取した後、ほとんどの人々(44)で最も一般的な門であるFirmicutesの平均読み取り数が5,198から14,172に増加した。 Firmicutes の割合も結石誘発食グループでは通常食グループと比較して有意に増加し、結石誘発食給餌マウスのFirmicutes のリード数は、経口 L. reuteri および L. plantarum 投与によりそれぞれ 14,172 から 10,706 および 10,307 に減少しましたが、L. reuteri および L. plantarum で治療したマウスの割合は 結石誘発食グループと比較して減少しませんでした (図 4C および D)。結石誘発食 グループの平均リード数および Bacteroidetes の割合は 通常食グループと比較して有意に減少し、L. plantarum 治療によりそれらが有意に減少しました (図 4C および D)。さらに、結石誘発食群での Verrucomicrobia のリード数は 通常食グループと比較して 2,128 から 249 に減少しましたが、L. plantarum 治療したマウスでは 6,720 に著しく増加しました (図 4C)。 Firmicutes/Bacteroidetes 比を詳しく調べたところ、結石誘発食給餌マウスでは 通常食給餌マウスと比較してこの比が著しく増加しており、この増加は L. reuteri 投与によって逆転していることが分かりました。L. reuteri 投与とは対照的に、L. plantarum 投与では Firmicutes/Bacteroidetes 比の減少は引き起こされませんでした (図 4D)。 |
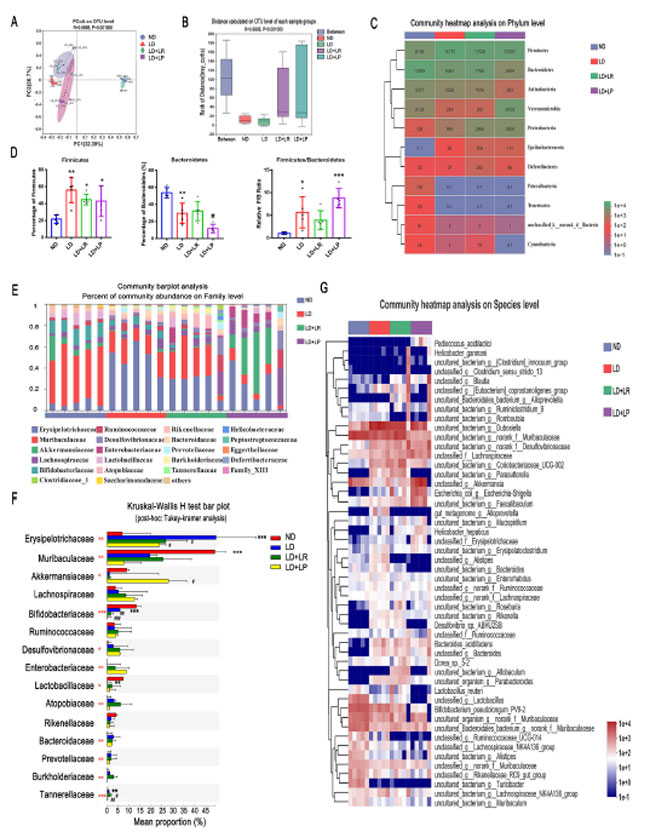 |
| 図4.L. reuteri (LR) および L. plantarum (LP) 投与により、結石誘発食給餌マウスのコレステロール胆石関連腸内細菌叢の構成が変化した。通常食給餌マウスまたは結石誘発食給餌マウス(乳酸菌投与の有無にかかわらず)の糞便サンプルを 8 週目に採取し、定量化した。(A)異なるグループの OTU 存在量に基づく、加重なし UniFrac 分析の主座標分析(PCoA)(Bray-Curtis ANOSIM、R = 0.6683、P = 0.001)。(B)グループの OTU 存在量に基づく距離ボックス プロット(Bray-Curtis ANOSIM、R = 0.6668、P = 0.001)。(C)L. reuteri または L. plantarum 投与の有無にかかわらず、通常食給餌マウスと 結石誘発食給餌マウスの腸内細菌叢における門の相対的存在量。 (D) Firmicutes および Bacteroidetes の割合と Firmicutes/Bacteroidetes の比率 (F/B)。(E) ファミリー レベルでの各マウス グループの糞便細菌の相対的な存在量をコミュニティ バー プロット分析で分析しました。(F) 事後 (Tukey-Kramer) 分析による Kruskal-Wallis H 検定による、ND、LD、LD + L. reuteri、および LD + L. plantarum グループにおける上位 15 の最も豊富なファミリーの比較。(G) さまざまなグループの腸内細菌叢における上位 50 の最も豊富な種をヒートマップで示します。データは平均値 ± SEM (n = 5) として示します。*、0.01 < P ≤ 0.05、**、0.001 < P ≤ 0.01、***、通常食 (ND) グループと比較した P ≤ 0.001。 #、0.01 < P ≤ 0.05; ##、0.001 < P ≤ 0.01; ###、P ≤ 0.001(石形成食(LD)群との比較)。パネルFの赤いアスタリスクは、Kruskal-Wallis H検定によるグループ間の統計的に有意な差を示しています。 |
| 属レベルでは、ベン図から、腸内細菌全体の約 48.61% の割合が 4 つのグループ間で同一であることが示され (図 S3A)、コア微生物叢が安定していることが分かりました。また、Roseomonas 属と Catabacter 属の 2 種が結石誘発食給餌マウスに特有であることも分かりました (図 S3A)。科レベルでは、コミュニティ バー プロット解析における Muribaculaceae と Akkermansiaceae のコミュニティ存在率のパーセンテージから、結石誘発食給餌マウスでは 通常食給餌マウスよりも両属の相対存在量が低いことが分かりました (図 4E および F)。Muribaculaceae の存在量は L. reuteri 投与によりわずかに回復し、Akkermansiaceae の存在量は L. plantarum 投与により大幅に増加しました (図 4E および F)。 Muribaculaceae は健康なマウスの糞便中のコミュニティの大部分を占め、代謝障害の改善に重要な役割を果たしています (45, 46)。近年、多くの研究で Akkermansiaceae がメタボリックシンドロームの改善と腸の炎症の軽減に重要な機能を持っていることが明らかになっており (47, 48)、私たちの結果では、結石誘発食を与えられたマウスでの Akkermansiaceae の減少が L. plantarum の投与によって回復したことが示されました。さらに、結石誘発食グループでは 通常食グループと比較して Erysipelotrichaceae の量が有意に増加しているのが観察されましたが、これは L. reuteri と L. plantarum の投与によって回復しました (図 4E と F)。Erysipelotrichaceae の減少は脂質代謝に有益です (49)。図 3F の Kruskal-Wallis H 検定バープロットが示すように、結石誘発食給餌マウスで有意に減少した Lactobacillaceae は、L. reuteri および L. plantarum 介入によって増加しました。さらに、種レベルでの Lactobacillus の存在量の違いを特定しました。Lactobacillus の Kruskal-Wallis H 検定バープロットでは、L. reuteri は L. reuteri 処理で有意に増加し、L. plantarum subsp. plantarum は L. plantarum 処理で有意に増加したことが示されました (図 S3B)。さらに、マウスの糞便中の腸内細菌の種 (存在量上位 50) を調べたところ、いくつかの種の存在量が L. reuteri および L. plantarum 処理で同様に変化したことが分かりました。ただし、L. reuteri および L. plantarum はいくつかの種に対して異なる変化を示しました。例えば、Pediococcus acidilactici、Akkermansia、Erysipelotrichaceae、およびErysipelatoclostridiumはL. plantarum処理群で増加しましたが、L. reuteri処理群では増加しませんでした。一方、Parasutterella、Desulfurovibrio sp. ABHU2SB、およびAllobaculumはL. plantarum処理群で減少しましたが、L. reuteri処理群では減少しませんでした(図4G)。 |
| これらの結果は、L. reuteri および L. plantarum の投与により、結石誘発食を与えられたマウスの門、属、科、種のレベルで腸内細菌叢の構成が操作され、代謝を促進する細菌叢の数が増加し、さまざまな方法で 結石誘発食誘発性代謝障害から健康状態への細菌叢の豊富さのパターンの変化が誘発されたことを示しています。 |
| 2.5.腸内細菌叢と宿主のコレステロール胆石関連パラメータとの相関 |
| 異なる腸内細菌叢の存在量とコレステロール胆石の発生に関連する要因との相関をさらに調査するために、2つの株によって変化した上位50の最も豊富な種と科と、コレステロール胆石の発生率とグレード(図5A、図S4A)、血液生化学指標(図5B、図S4B)、ファルネソイド X 受容体(FXR)経路関連遺伝子の発現レベル(図5C、図S4C)、およびすべてのマウス群の血清(図5D、図S4D)と肝臓(図5E、図S4E)の胆汁酸を含むいくつかのコレステロール胆石関連パラメータとの間でスピアマンの相関分析を実施しました。種レベルでは、4種と6種がそれぞれコレステロール胆石の発生率とグレードと有意に正の相関を示し、4種と2種が負の相関を示しました(図5A)。これまでの研究で代謝障害との関連が判明している日和見病原細菌の中には、コレステロール胆石の発生率や重度と正の相関関係にあるものもあり、例えば Desulfurovibrionaceae や Ruminococcaceae などが挙げられます (図 5A) (9, 50)。Akkermansia、Muribaculaceae、Muribaculum は コレステロール胆石の発生率と重度の両方と負の相関関係にあることがわかりました (図 5A)。科レベルでは、Akkermansiaceae は コレステロール胆石の発生率と重度の両方と負の相関関係にあり、Lactobacillaceae と Muribaculaceae は コレステロール胆石の発生率と負の相関関係にあり>、Desulfurovibrionaceae は コレステロール胆石の発生率と正の相関関係にあった (図 S4A)。次に、Spearman の相関分析を用いて、いくつかの血清生化学的指標と腸内細菌叢の関係を調査しました。その結果、種レベルでは、50種中10種が血清アラニンアミノトランスフェラーゼ(ALT)、アスパラギン酸アミノトランスフェラーゼ(AST)、アルカリホスファターゼ(ALP)と有意に負の相関を示し、その中にはAkkermansia、Muribaculaceae、Lactobacillaceae、およびMuribaculumに属する細菌が含まれていました(図5B)。また、科レベルでは、50種中10種が血清アラニンアミノトランスフェラーゼ(ALT)、アスパラギン酸アミノトランスフェラーゼ(AST)、アルカリホスファターゼ(ALP)と負の相関を示し、すなわちMuribaculaceae、Akkermansiaceae、Lactobacillaceaeなどでした(図S4B)。これは、これらの細菌がコレステロール胆石形成過程での肝障害の修復に関与している可能性を示唆しています。腸内細菌の中には、種レベルでは Desulfurovibrio、Dubosiella、Roseburia、Parasutterella などが血清トリグリセリド(TG)、総コレステロール(TC)、高密度リポタンパク質(HDL)、低密度リポタンパク質(LDL)、グルコース(Glu)と有意に正の相関関係にあるものがあり (図 5B)、科レベルでは Erysipelotrichaceae、Defluviitaleaceae、Atopobiaceae などが血清 トリグリセリド(TG)、総コレステロール(TC)、高密度リポタンパク質(HDL)、低密度リポタンパク質(LDL)、グルコース(Glu)と有意に正の相関関係にあるものがあり (図 S4B)、これらの細菌が代謝障害に影響を及ぼす可能性があることが示唆されました。さらに、腸内細菌叢と肝臓の Cyp7a1、Cyp7b1、Cyp8b1、Cyp27a1、Fxr、Fgfr4、Shp、Mrp3、Mrp4、Mdr2、Bsep および回腸の Fxr および Fgf15 の mRNA レベルとの相関関係を解析したところ、Akkermansia および Lactobacillus は種レベルで肝臓の Fgfr4 と有意に正の相関関係にあることがわかりました (図 5C)。Enterobacteriaceae の豊富さは、種および科レベルで回腸 ファルネソイド X 受容体(FXR)シグナル伝達関連遺伝子 ileum Fgf15 および Bsep、Mdr2、Mrp3 を含む胆汁への 胆汁酸 輸出関連遺伝子と有意に正の相関関係にあります (図 5C、図 S4C)。しかし、Muribaculaceae は肝臓の Shp と負の相関関係にあります (図 5C、図 S4C)。これらの結果は、腸内細菌叢がファルネソイド X 受容体(FXR)シグナル伝達経路および 胆汁酸合成と輸出に関与する遺伝子の発現プロファイルに影響を与えることを示唆しています。最後に、いくつかの腸内細菌が血清と肝臓の胆汁酸の組成と有意に相関していることがわかり、腸内細菌叢が胆汁酸 代謝に重要な役割を果たしていることが示唆されました (図 5D と E、図 S4D と E)。これらのデータは、コレステロール胆石表現型、血清バイオマーカー、ファルネソイド X 受容体(FXR)シグナル伝達経路関連遺伝子、および胆汁酸の組成が腸内細菌叢と有意に相関しており、L. reuteri および L. plantarum 処理による コレステロール胆石形成への保護効果は、腸内細菌叢の調節によるものである可能性があることを実証しました。 |
 |
| 図5.腸内細菌叢と宿主のコレステロール胆石関連パラメータとの相関。 (A) 最も豊富な上位50種のレベルとコレステロール胆石の発症率および重症度との間でスピアマンの相関分析を実施しました。(B) 最も豊富な上位50種のレベルと血清アラニンアミノトランスフェラーゼ(ALT)、アスパラギン酸アミノトランスフェラーゼ(AST)、アルカリホスファターゼ(ALP)、トリグリセリド(TG)、総コレステロール(TC)、高密度リポタンパク質(HDL)、低密度リポタンパク質(LDL)、およびグルコース(Glu)レベルとの間でスピアマンの相関分析を実施しました。(C) 最も豊富な上位50種のレベルと肝臓Cyp7a1、Cyp8b1、Cyp7b1、Cyp27a1、Mdr2、Mrp3、Mrp4、Bsep、Shp、肝臓Fxr、およびFgfr4、回腸FxrおよびFgf15のmRNAレベルとの間でスピアマンの相関分析を実施しました。(D) 最も豊富な上位50種のレベルとマウス血清中の35種類の胆汁酸との間でスピアマンの相関分析を実施しました。 (E) マウスの肝臓における上位50種の最も豊富なレベルと26種類の胆汁酸との間でスピアマンの相関分析を行った。赤と青はそれぞれ正の関連と負の関連を示す。n = 5。*、0.01 < P ≤ 0.05、**、0.001 < P ≤ 0.01、***、P ≤ 0.001。 |
| 2.6.ファルネソイド X 受容体(FXR)活性化の阻害は、結石誘発食給餌マウスにおける L. reuteri および L. plantarum の保護効果を減弱させた |
| 上記のデータは、結石誘発食給餌マウスにおける L. reuteri および L. plantarum を介した胆石予防におけるファルネソイド X 受容体(FXR)の重要な関与を示している。我々は、L. reuteri および L. plantarum 治療の有益な効果はファルネソイド X 受容体(FXR)活性化の阻害によって打ち消される可能性があると仮説を立てた。この仮説を検証するために、通常食または 結石誘発食を給餌し、L. reuteri または L. plantarum 治療を 8 週間投与したマウスに、全般的なファルネソイド X 受容体(FXR)阻害剤である Z/E-ググルステロン (Z-Gu) または腸管特異的 ファルネソイド X 受容体(FXR) 阻害剤であるグリシン-β-ムリコール酸 (Gly-MCA) を経口投与した (17)。 結石誘発食給餌マウスの胆嚢で観察された丸い胆石と粘着性のある胆汁と比較して、L. reuteri および L. plantarum を投与したマウスの胆嚢では少数の葉状結晶またはいくらかのコレステロール粒子しか見られず、胆石の発生率とグレードは L. reuteri および L. plantarum 投与によって減少することができました。しかし、Z/E-ググルステロン (Z-Gu)はこれらの保護効果をほぼ完全に逆転させ、顆粒状の石が胆嚢を満たしました。グリシン-β-ムリコール酸 (Gly-MCA)も胆石形成を減少させる保護効果を弱め、いくつかの葉状結晶が胆汁中に浮遊しました。Z/E-ググルステロン (Z-Gu)介入下では、胆石の量と質が高く、胆石の発生率はグリシン-β-ムリコール酸 (Gly-MCA)介入の場合よりも高くなりました (図 6A および B)。これは、コレステロール胆石形成を減少させたのは腸管ファルネソイド X 受容体(FXR)だけではなく、全身ファルネソイド X 受容体(FXR)であったことを示唆しています。次に、マウスの肝臓重量と体重の比を計算し、Z/E-ググルステロン (Z-Gu)およびグリシン-β-ムリコール酸 (Gly-MCA)処理によりファルネソイド X 受容体(FXR)を阻害すると、L. reuteri誘発性の肝臓重量と体重の比の減少を有意に逆転させることができるが、L. plantarum処理マウスでは有意な変化は見られなかったことを発見した(図6C)。ヘマトキシリンおよびエオシン(H&E)染色およびオイルレッドO(ORO)染色を実施して、肝臓脂肪変性症を調べた。一貫して、Z/E-ググルステロン (Z-Gu)はL. reuteriおよびL. plantarum処理の保護効果を無効にし、グリシン-β-ムリコール酸 (Gly-MCA)はこれらの効果をわずかに鈍化させることがわかった(図S5A)。肝オイルレッドO染色で示された相対脂質含量の変化は、組織切片染色の結果と一致しており(図S5B)、これは、L. reuteriまたはL. plantarumが肝臓の脂肪代謝を改善するために全体的なファルネソイド X 受容体(FXR)が必要であり、腸管特異的ファルネソイド X 受容体(FXR)は相乗的な役割のみを果たしていることを示唆している。さらに、L. reuteri および L. plantarum によって誘発された胆嚢容量の減少と胆嚢外膜の厚さの減少は、Z/E-ググルステロン (Z-Gu)およびグリシン-β-ムリコール酸 (Gly-MCA)介入によって顕著に改善され、腸管特異的ファルネソイド X 受容体(FXR)ではなく、全身ファルネソイド X 受容体(FXR)を阻害すると、結石誘発食給餌のみよりも胆嚢壁が厚くなる可能性があることが示されました (図 6D および E)。腸管特異的ファルネソイド X 受容体(FXR)ではなく全身ファルネソイド X 受容体(FXR)を阻害すると、胆嚢壁が厚くなる可能性があるためであると考えられます。 |
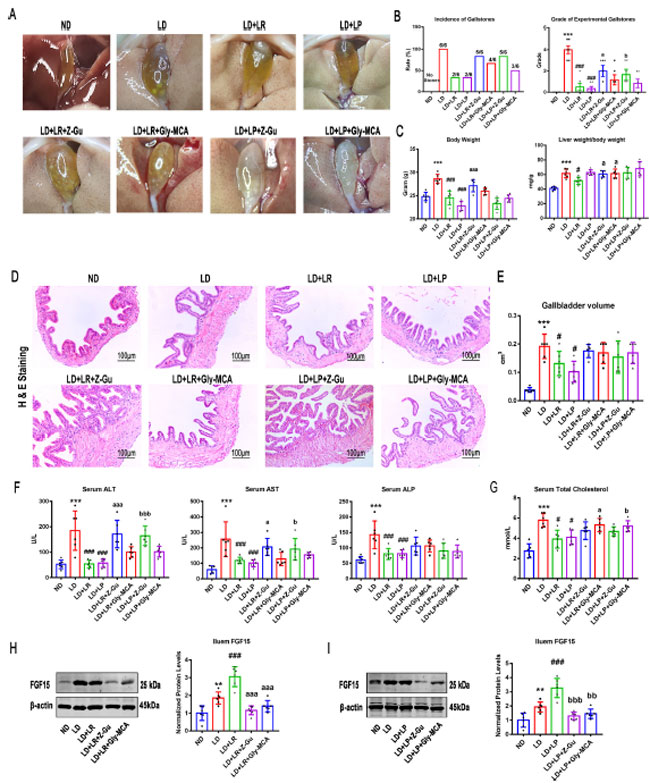 |
| 図6. ファルネソイド X 受容体(FXR)活性化の阻害は、結石誘発食給餌マウスにおける L. reuteri (LR) および L. plantarum (LP) の保護効果を減弱させた。48 匹のマウスを、L. reuteri または L. plantarum 投与 (109 CFU/日) の有無にかかわらず、通常食または 結石誘発食を給餌した 8 つのグループに無作為に割り当てた。L. reuteri または L. plantarum 投与の開始時に、マウスに、全般的なファルネソイド X 受容体(FXR)阻害剤である (Z/E)-ググルステロン (Z-Gu)、または腸管特異的ファルネソイド X 受容体(FXR)阻害剤であるグリシン-β-ムリコール酸 (Gly-MCA) を経口投与した。(A) 異なる投与を受けたマウスの胆嚢および胆石の肉眼的外観。(B) 各マウス グループにおける胆石発生率および可視化された胆石症に基づく実験的コレステロール胆石のグレード。 (C) 最終日のマウスの体重と体重に対する肝臓重量の比。(D) H&E 染色した胆嚢切片の代表画像 (×200)。(E) 胆嚢の長さ、直径、円周から推定した胆嚢容積。(F および G) 血清 アラニンアミノトランスフェラーゼ(ALT)、アスパラギン酸アミノトランスフェラーゼ(AST)、アルカリホスファターゼ(ALP)、、および総コレステロール(TC)は、シーメンス高速自動生化学分析装置 (Advia 2400) を使用して測定した。(H および I) L. reuteri (H) または L. plantarum (I) 処理の有無による回腸線維芽細胞増殖因子 15 (FGF15)のタンパク質発現および定量。データは ANOVA および事後 Tukey 検定で分析し、平均値 ± SEM (n = 6) として示した。*、0.01 < P ≤ 0.05、**、0.001 < P ≤ 0.01。 ***、通常食(ND)群と比較してP ≤ 0.001。#、0.01 < P ≤ 0.05。##、0.001 < P ≤ 0.01。###、結石食(LD)群と比較してP ≤ 0.001。a、0.01 < P ≤ 0.05。aa、0.001 < P ≤ 0.01。aaa、LD + L. reuteriと比較してP ≤ 0.001。b、0.01 < P ≤ 0.05。bb、0.001 < P ≤ 0.01。bbb、LD + L. plantarumと比較してP ≤ 0.001。 |
| 血清アラニンアミノトランスフェラーゼ(ALT)、アスパラギン酸アミノトランスフェラーゼ(AST)、アルカリホスファターゼ(ALP)を分析したところ、(Z/E)-ググルステロン (Z-Gu)とグリシン-β-ムリコール酸 (Gly-MCA)の両方の介入がL. reuteriまたはL. plantarum投与によるアラニンアミノトランスフェラーゼ(ALT)、アスパラギン酸アミノトランスフェラーゼ(AST)、アルカリホスファターゼ(ALP)の減少を逆転させ、(Z/E)-ググルステロン (Z-Gu)の方がより効果的であることがわかりました(図6F)。これは、グローバルファルネソイド X 受容体(FXR)を阻害すると、結石誘発食給餌マウスにおけるL. reuteriおよびL. plantarum投与による肝障害に対する保護効果がほぼ完全になくなる可能性があることを示しています。さらに、L. reuteriおよびL. plantarum投与は血清総コレステロール(TC)を効果的に減少させ、その減少は腸管特異的ファルネソイド X 受容体(FXR)阻害剤グリシン-β-ムリコール酸 (Gly-MCA)によって有意に逆転することがわかりました(図6G)。しかし、結果は、L. reuteriおよびL. plantarumによる血清総コレステロール(TC)およびトリグリセリド(TG)の減少がグローバルファルネソイド X 受容体(FXR)阻害剤によって有意に影響されないことを示しこれまでの研究結果(51)と一致して、(Z/E)-ググルステロン (Z-Gu)とグリシン-β-ムリコール酸 (Gly-MCA)介入は、血清グルコースに対するL. reuteriおよびL. plantarum投与の保護効果を消失させました(図S5D)。さらに、線維芽細胞増殖因子 15 (FGF15)のタンパク質発現レベルが検出され、(Z/E)-ググルステロン (Z-Gu)とグリシン-β-ムリコール酸 (Gly-MCA)投与により、L. reuteriおよびL. plantarum投与の有無にかかわらず結石誘発食給餌マウスのレベルと比較して著しく減少しました。 |
| これらのデータを総合すると、L. reuteri と L. plantarum による治療は、少なくとも部分的にはファルネソイド X 受容体(FXR) 依存的に実験的胆石を改善することが証明されます。 |
| 3.考察 |
| コレステロール胆石患者とマウスにはLactobacillus 属の菌数が少ない (10、52) が、Lactobacillus 属の菌株がコレステロール胆石を軽減できるかどうか、またそのメカニズムは不明である。この研究では、(i) L. reuteri 株 1 株と L. plantarum 株 1 株が コレステロール胆石とそれに関連する肝臓および血清の脂肪沈着およびインスリン抵抗性を有意に軽減し、その効果には全身ファルネソイド X 受容体(FXR)と腸管特異的ファルネソイド X 受容体(FXR)、特に全身ファルネソイド X 受容体(FXR)が重要な役割を果たしていること、(ii) 2 つの Lactobacillus 株が血清および肝臓の胆汁酸プールを変化させ、特にファルネソイド X 受容体(FXR) 拮抗薬タウロ-α-ムリコール酸(T-α-MCA)、およびタウロ-β-ムリコール酸(T-β-MCA)を下方制御し、回腸および肝臓ファルネソイド X 受容体(FXR)シグナル伝達経路を活性化することで肝臓での 胆汁酸合成を減少させ 胆汁酸輸送を促進すること、(iii) 2 つの株が結石誘発食誘発性のコレステロール胆石 関連腸内細菌叢のディスバイオーシスを有意に改善し、これには L. reuteri による Muribaculaceae の増加と L. plantarum による Akkermansia の増加が含まれることがわかった。これらの結果はすべて、Lactobacillus がファルネソイド X 受容体(FXR)シグナル伝達経路を介して コレステロール胆石を予防する可能性を示唆している。 |
| 我々の研究は、L. reuteri および L. plantarum 投与が胆石の発生率を低下させた最も重要なメカニズムの1 つは、回腸ファルネソイド X 受容体(FXR)-線維芽細胞増殖因子15 (FGF15) -線維芽細胞増殖因子受容体4 (FGFR4) および肝臓ファルネソイド X 受容体(FXR)-小ヘテロ二量体パートナー (SHP)シグナル伝達経路の活性化であることを示した。結石誘発食 摂取によりタウロ-α-ムリコール酸(T-α-MCA)、およびタウロ-β-ムリコール酸(T-β-MCA)のレベルが著しく増加し、ファルネソイド X 受容体(FXR)シグナル伝達経路が阻害されることがわかった。Cai らは、胆石症患者のファルネソイド X 受容体(FXR)mRNA レベルが対照群よりも低いことを示した (21)。これは、ファルネソイド X 受容体(FXR)シグナル伝達の阻害がコレステロール胆石の発症を促進する可能性が非常に高いことを示唆している。さらに、線維芽細胞増殖因子受容体4 (FGFR4)の発現が著しく減少したことは、回腸ファルネソイド X 受容体(FXR)-線維芽細胞増殖因子 15 (FGF15) -線維芽細胞増殖因子受容体4 (FGFR4)シグナル伝達経路が部分的に遮断されたことを示唆している。これらのデータは、結石誘発食中の高濃度のコール酸 (CA) によって活性化された腸の ファルネソイド X 受容体(FXR)は、線維芽細胞増殖因子 15 (FGF15) を介して肝臓の線維芽細胞増殖因子受容体4 (FGFR4)シグナルを活性化するのに十分ではなかったことを示しています。コール酸 (CA)の過剰摂取は、マウスの 胆汁酸プールの重大な障害をもたらしました。ファルネソイド X 受容体(FXR) シグナル伝達の欠如は、胆汁酸合成および輸送のファルネソイド X 受容体(FXR)駆動型負のフィードバック制御を弱め、結石形成性胆汁酸プールにつながるため、コレステロール胆石形成の主なリスク要因の 1 つです (20)。私たちの結果は、L. reuteri および L. plantarum 処理により、タウロ-α-ムリコール酸(T-α-MCA)、およびタウロ-β-ムリコール酸(T-β-MCA)のレベルが低下し、タウロコール酸(TCA)、タウロケノデオキシコール酸(TCDCA)のレベルが上昇してファルネソイド X 受容体(FXR)シグナル伝達が活性化され、コレステロール胆石形成のリスクを軽減できるいくつかの代謝効果が改善されることを示しました。 L. reuteri および L. plantarum を投与したマウスにおける回腸線維芽細胞増殖因子 15 (FGF15)および肝臓小ヘテロ二量体パートナー (SHP)の発現の上方制御は、ファルネソイド X 受容体(FXR)の活性化によって引き起こされ、これはコレステロール7α-ヒドロキシラーゼ (CYP7A1)のレベルを下方制御して 胆汁酸合成の古典的経路を阻害し、ステロール調節エレメント結合タンパク質 2 (SREBP2) および SREBP切断活性化タンパク質 (SCAP)の発現を阻害してコレステロール合成を減少させた。さらに、小ヘテロ二量体パートナー (SHP) および線維芽細胞増殖因子 15 (FGF15)の増加は腸のコレステロール吸収を阻害できることが報告されている (53)。さらに、L. reuteri および L. plantarum を投与したグループでは、肝臓のタウリン結合胆汁酸が増加し、胆汁酸の親水性が上方制御された。さらに、肝臓の 肝臓多剤耐性関連タンパク質ホモログ3 (MRP3)、肝臓多剤耐性関連タンパク質ホモログ4 (MRP4)、肝臓多剤耐性タンパク質 2 (MDR2)、および 胆汁酸塩輸出ポンプ(BSEP)のレベルが L. reuteri および L. plantarum 投与によって有意に上方制御されることが観察され、胆嚢への 胆汁酸排出が増加して胆汁からのコレステロールの沈殿を防ぐことが示された。これらの結果は、L. reuteri と L. plantarum の投与によりファルネソイド X 受容体(FXR)シグナル伝達が効果的に活性化され、胆汁酸とコレステロールの代謝が調節され、胆汁酸とコレステロールのバランスが改善される可能性があることを示唆しています。 |
| 我々のデータによると、コレステロール胆石に対する 2 つの菌株の保護効果は、全身ファルネソイド X 受容体(FXR) 阻害剤および腸管特異的ファルネソイド X 受容体(FXR)阻害剤単独ではほぼ完全に阻害されました。さらに、全身ファルネソイド X 受容体(FXR)は肝臓脂肪変性症および胆嚢壁肥厚の軽減に優れた効果を示しました。この現象は、2 つのLactobacillus 株の投与後、肝臓および回腸のファルネソイド X 受容体(FXR)シグナル伝達がともに宿主を コレステロール胆石から保護する上で主要な役割を果たしたことを示唆しています。ファルネソイド X 受容体(FXR)-線維芽細胞増殖因子 15 (FGF15) -線維芽細胞増殖因子受容体4 (FGFR4)および ファルネソイド X 受容体(FXR)-小ヘテロ二量体パートナー (SHP)シグナル伝達経路は、血清および肝臓中のタウロ-α-ムリコール酸(T-α-MCA)、およびタウロ-β-ムリコール酸(T-β-MCA)のダウンレギュレーションとタウロケノデオキシコール酸(TCDCA) のアップレギュレーションを介してLactobacillus によって活性化されました。 Zhang らは、Lactobacillus casei YRL577 株が腸管 ファルネソイド X 受容体(FXR)-線維芽細胞増殖因子15 (FGF15)経路を増加させることでマウスの非アルコール性脂肪性肝疾患を軽減することを示し (54)、Liu らは、Lactobacillus rhamnosus GG によって活性化された肝臓と腸管のファルネソイド X 受容体(FXR)が胆汁うっ滞(訳者注:胆汁の分泌が少ないかあるいは全くない状態、あるいは消化器への胆汁の流入が遮断されていること)を軽減する相乗効果を持つことを発見しました (17)。これらの結論は、肝臓ファルネソイド X 受容体(FXR)シグナル伝達だけでなく腸管ファルネソイド X 受容体(FXR)シグナル伝達もコレステロール胆石予防に極めて重要な役割を果たしている可能性があることを示す私たちの結果を裏付けています。さらに、Kim らは、肝臓と腸管のファルネソイド X 受容体(FXR)による胆汁酸恒常性の異なる制御を示し、組織特異的ファルネソイド X 受容体(FXR)ヌルマウスを使用して、肝臓ファルネソイド X 受容体(FXR)による胆汁酸代謝関連酵素のより効果的な制御を示唆しました (55)。この結論は、L. reuteri と L. plantarum によって活性化された肝臓ファルネソイド X 受容体(FXR)シグナル伝達経路のみが、コレステロール胆石形成過程の一部である肝臓脂肪変性症と胆嚢壁肥大を予防できることを示す私たちの研究結果を裏付けています。 |
| これまでの研究では、腸内細菌叢と胆汁酸代謝は相互に調節されていることが証明されています(31、56)。私たちの研究では、結石誘発食を与えられたマウスで腸内細菌叢が乱れ、いくつかの代謝障害が存在することがわかりました。L. reuteriとL. plantarumは、時には異なる方法でこれらの障害を改善しました。L. reuteri治療は主に、腸内細菌叢の多様性を高め、Muribaculaceaeの割合を回復する役割を果たしました。L. plantarum治療は腸内細菌叢の多様性に影響を与えませんでしたが、Akkermansiaの割合を大幅に増加させて代謝障害を改善したことは注目に値します。この現象は、私たちの以前の研究結果と一致しています(57)。さらに、Akkermansia は ファルネソイド X 受容体(FXR)シグナル伝達経路関連遺伝子 (Shp および Fgf15)、胆汁酸代謝の代替経路の律速酵素をコードする遺伝子 (Cyp27a1)、および 胆汁酸輸出に関与する遺伝子 (Bsep) と有意に正の相関関係にあることがわかった。これは、L. plantarum を投与されたマウスの Akkermansia が 胆汁酸代謝および輸送の改善に関与していることを示す。結果は、L. plantarum を投与されたマウスにおける Akkermansia の増加が L. reuteri の数倍であることを示した。この現象の理由は、L. plantarum が Akkermansia の成長を促進する代謝産物を生成するためである可能性がある。Dao らは、Akkermansia の豊富さがより健康な代謝状態と関連していることを示した (48)。Depommier らは、Akkermansia の補給が腸内微生物叢構造のバランスを維持しながら肥満関連疾患および肝障害を改善できることを実証した (58)。この現象は、一部のプロバイオティクスが宿主の腸内細菌叢を調節することで効果を発揮する可能性があることを示しています。L. reuteri と L. plantarum はLactobacillus 株であり、どちらもコレステロール胆石形成に対する保護効果がありますが、2 つのLactobacillus 株が腸内細菌叢に与える影響はまったく異なり、腸内細菌叢の機能的冗長性を示唆しています。 |
| Hu らは、コレステロール胆石患者の糞便および胆石感受性マウス (9) で Desulfurovibrionaceae の増加を確認しましたが、これは結石誘発食給餌マウスの腸内細菌叢で確認されたものと一致しています。さらに、Desulfurovibrionaceae のレベルはコレステロール胆石の発生率およびグレードと有意に正の相関関係にあり、血清スパラギン酸アミノトランスフェラーゼ(AST)、アルカリホスファターゼ(ALP)およびグルコースと正の相関関係にあることがわかりました。L. reuteri または L. plantarum のどちらの処理でも、科レベルで Desulfurovibrionaceae の量を減少させることはできませんでした。したがって、Desulfurovibrionaceae のレベルは、L. reuteri およびL. plantarum 処理による コレステロール胆石形成の減少とは関係がない可能性があります。さらに、Roseomonas および Catabacter は 結石誘発食給餌マウスに特異的であり、この 2 つの属は常に感染に関与していることがわかりました (59、60)。私たちの知る限り、この 2 つの属と コレステロール胆石の間に潜在的な関係があることを発見した研究はこれが初めてです。 |
| 要約すると、腸内細菌叢を標的としたL. reuteriおよびL. plantarumの投与により、タウロ-α-ムリコール酸(T-α-MCA)、およびタウロ-β-ムリコール酸(T-β-MCA)の濃度が低下し、ファルネソイド X 受容体(FXR)の活性化が促進されてコレステロール胆石形成が減少することが実証されました。タウロ-α-ムリコール酸(T-α-MCA)、およびタウロ-β-ムリコール酸(T-β-MCA)の減少により、ファルネソイド X 受容体(FXR)の競合的阻害が緩和され、回腸線維芽細胞増殖因子 15 (FGF15)および肝臓小ヘテロ二量体パートナー (SHP)のレベルが上昇して胆汁酸およびコレステロール合成が阻害され、胆嚢への胆汁酸の排泄が促進されました。さらに、肝臓線維芽細胞増殖因子受容体4 (FGFR4)の増加により、回腸ファルネソイド X 受容体(FXR)-線維芽細胞増殖因子 15 (FGF15)シグナル伝達が促進され、胆汁酸合成の古典的経路が阻害されました(図7)。患者への適用前にさらなる研究が必要ですが、L. reuteriまたはL. plantarumの補給は、コレステロール胆石の治療またはコレステロール胆石の再発予防のための有望な治療戦略となる可能性があります。 |
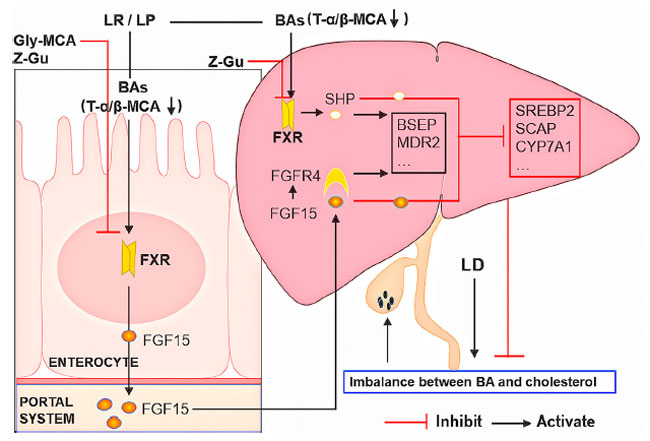 |
| 図7. L. reuteri と L. plantarum が コレステロール胆石形成を阻害するメカニズムをまとめた模式図 |
| 4.材料と方法 |
| 4.1.マウスの系統と処理 |
| 体重20~22gの雄C57BL/6Jマウス(約8週齢、兄弟ではない)を上海SLAC実験動物有限公司(Shanghai, China)から購入しました。すべてのマウスは、22°Cで12時間の明暗サイクルで飼育され、標準的なげっ歯類の食事と水を無制限に摂取でき、特定病原体フリー(SPF)の環境で飼育されました。マウスは実験前に少なくとも1週間順応させました。すべての動物実験は、中国上海の上海交通大学医学部の動物倫理委員会によって承認され(SYXK 2013-0050)、3R原則(削減、代替、改善)に基づいて実施されました。この研究では、結石誘発性食事誘発性コレステロール胆石マウスモデルを使用しました。マウスに標準飼料(通常飼料[ND]、コレステロール0.02%含有)または結石誘発性飼料(結石誘発食、バター脂肪15%、カゼイン28%、コレステロール1.5%、コール酸0.5%含有)を8週間与えた(61)。Limosilactobacillus reuteri株CGMCC 17942(以下、L. reuteri)およびLactiplantibacillus plantarum株CGMCC 14407(以下、L. plantarum)の投与の効果を確認するために、48匹のマウスを4つのグループに無作為に分け、各グループ12匹のマウスを4つのプラスチックケージに無作為に分けた(グループあたりn = 12、ケージあたりn = 3)。通常食を与えられた通常食群のマウスには対照として生理食塩水200μLを投与し、結石誘発食を与えられた結石誘発食群のマウスには生理食塩水200μLを8週間投与した。結石誘発食を与えられたL. reuteri群とL. plantarum群のマウスには、L. plantarumまたはL. reuteriの細菌懸濁液200μLを109 CFU/日の用量で8週間投与した。各群から5匹のマウスを無作為に選択し、血清と糞便サンプルを採取して胆汁酸分析と腸内細菌叢の配列決定を行った。次に、ファルネソイド X 受容体(FXR)の役割をさらに検証するために、48匹のマウスを8群に無作為に分けた。各群6匹のマウスを2つのプラスチックケージに無作為に分け(群あたりn = 6、ケージあたりn = 3)、4群のマウスを上記のように治療した。他の2群のマウスには、結石誘発食を与え、L. reuteriまたはL. plantarum懸濁液200μLを腸管特異的ファルネソイド X 受容体(FXR)阻害剤Gly-β-MCA(10 mg/kg体重)とともに経口投与し、最後の2群のマウスには、結石誘発食を与え、L. reuteriまたはL. plantarum懸濁液200μLを全身ファルネソイド X 受容体(FXR)拮抗薬Z/E-ググルステロン(10 mg/kg)とともに8週間経口投与した(17)。 |
| 4.2.プロバイオティクス製剤 |
| L. plantarum および L. reuteri を、嫌気条件下で 37°C で 24 時間、de Man-Rogosa-Sharpe 液体培地 (MRS ブロス、BD、米国) とともに培養し、初期定常期に到達させました。培養物を 4°C で 5,000 × g で 5 分間遠心分離し、細菌細胞を滅菌生理食塩水 (109 細胞/200 μL) に再懸濁し、ストック溶液として -80°C で保存しました。各アリコートを室温まで 1 時間解凍した後、マウスに経口投与しました。細菌細胞数を測定するために、細菌懸濁液の連続希釈液を嫌気条件下で新鮮な MRS 寒天培地に接種しました。 |
| 4.3.サンプル採取 |
| マウスは1週間の順応期間の後、8週間治療を受けた。マウスの体重と食物摂取量は週に1回チェックした(57)。8週目の初めに、マウスから糞便サンプルを採取し、RNA抽出とその後の腸内細菌叢の定量化のために液体窒素に保存した(62)。8週目の終わりに、マウスは5時間絶食したが、水は自由に摂取できた。マウスの血液サンプルは心臓穿刺によって採取し、4℃で20分間400×gで遠心分離し、その後の生化学分析に使用した。動物はペントバルビタールで麻酔した後、放血により屠殺した。肝臓、胆嚢、回腸を採取し、2つに分けた。1つはすぐに液体窒素で急速凍結し、もう1つは室温で24時間4%中性パラホルムアルデヒドで固定した。 |
| 4.4.組織学 |
| パラホルムアルデヒドで固定した肝臓および胆嚢標本をパラフィン包埋に使用した。パラフィン包埋切片(4μm)をヘマトキシリンおよびエオシン(H&E)で染色し、治療群を知らされていない肝臓病理専門医2名が20倍対物レンズを使用して5つの別々の視野で脂肪肝の影響を受けた肝細胞の割合を特定した。肝臓脂質蓄積は、前述のようにオイルレッドO(ORO)染色で測定した(63)。凍結肝臓切片(6μm)をORO脂質染色(Abcam、USA)で染色し、脂肪肝に関与する肝細胞の割合を相対脂質含有量で評価し、ImageJで定量化した。 |
| 4.5.胆汁酸分析 |
| 胆汁酸濃度は、ネガティブエレクトロスプレー液体クロマトグラフィー-タンデム質量分析(LC-MS/MS)を使用して測定しました。クロマトグラフィー分離は、Acquity超高性能液体クロマトグラフィー(UPLC)BEH C18カラム(内径100 mm、1.7 μm、Waters Corp.)で行いました。血清と肝臓組織を正確に測定し、沈殿のためにエタノール(-20°C)を加え、混合物を60秒間ボルテックスで混合してから遠心分離しました。肝臓組織については、100 mgのガラスビーズを加えて遠心分離する前に振動させました。上清は、LC-MS/MSの前に0.22 μmの膜でろ過しました。移動相は、水中の0.1%ギ酸(A)とアセトニトリル中の0.1%ギ酸(B)の混合物でした。グラジエント溶出は次の相に適用されました:0~4分、25% B。4~9分、25~30% B。9~14分、30~36% B。14~18分、36~38% B。18~24分、38~50% B。24~32分、50~75% B。32~35分、75~100% B。35~38分、100~25% B。流量は0.25 mL/分でした。 |
| 40種類の胆汁酸標準(Yuanye Bio-Technology、Shanghai, China)をメタノールで調製し、均等に混合して作業用標準溶液(沈殿物のない透明)を生成しました。作業用標準溶液はネガティブエレクトロスプレー液体クロマトグラフィー-タンデム質量分析(LC-MS/MS)で測定し、作業用標準溶液の全イオンクロマトグラフィー(TIC)分析を図S6に示します。信号対雑音比10(S / N = 10)を使用して胆汁酸標準の定量限界(LOQ)を決定し、表S2に示すように、適切な標準曲線濃度を選択して濃度曲線を作成しました。標準分析物のサプライヤー番号、CAS番号、および国際化学識別子(InChI)キー、それらの保持時間、および質量遷移イオンペア(m / z)(前駆体イオンと生成物イオン)を表S3に示します。作業用標準溶液は、ネガティブエレクトロスプレー液体クロマトグラフィー-タンデム質量分析(LC-MS/MS)を使用する前に新しく調製しました。標準溶液の濃度を横軸に、ピーク面積を縦軸にとり、直線範囲を調べて標準曲線を描きました。各 胆汁酸について直線回帰式が得られ (相関係数 r > 0.99)、すべてのサンプルの定量分析に使用しました。 |
| 4.6.胆汁分析およびコレステロール飽和指数 (CSI)計算 |
| 胆汁中の代謝物のレベルは、マイクロプレートリーダー (BioTek、Winooski、VT、USA) を使用した酵素アッセイによって測定されました。胆汁中の総コレステロール (TC) および胆汁酸のレベルは、キット (Jiancheng Bioengineering Institute、Nanjing, China) の指示に従って測定されました。胆汁中のリン脂質のレベルは、キット (Wako Pure Chemicals、Osaka, Japan) の指示に従って測定されました。胆嚢胆汁のコレステロール飽和指数 (CSI) の計算は、以前に説明したように実行されました (64)。 |
| 4.7.免疫蛍光法 |
| 免疫蛍光法を用いて、パラフィン包埋回腸組織切片中の回腸線維芽細胞増殖因子 15 (FGF15)を検出した。脱蝋、水和、抗原回収、透過処理、非特異的結合のブロック、抗体とのインキュベーションのプロセスは、以前説明したように実行した(62)。切片は、ライカTCS SP8共焦点顕微鏡(×400)で撮影した。 |
| 4.8.ウェスタンブロッティング |
| 肝臓および回腸組織からの全タンパク質は、前述のように抽出されました(62)。全タンパク質(レーンあたり40μg)は10%SDS-PAGEで分離され、その後ニトロセルロース膜に電気転写されました。膜を、ファルネソイド X 受容体(FXR)(NR1H4、1:1,000、Abcam、米国)、SREBP2 (1:1,000、Abcam、USA)、コレステロール7α-ヒドロキシラーゼ (CYP7A1) (1:1,000、Abcam、米国)、ステロール 12α-ヒドロキシラーゼ (CYP8B1) (1:1,000、Abcam、米国)、CYP7B1 (1:1,000、Proteintech Group、USA)、ステロール 27-ヒドロキシラーゼ (CYP27A1) (1:1,000、Proteintech Group、USA)、胆汁酸塩輸出ポンプ(BSEP) (1:200、Santa Cruz Biotechnology、USA)、およびβ-アクチン (1:1,000、Cell Signaling Technology、米国) に対する一次抗体とともに 4°C で一晩インキュベートしました。 0.1% Tween 20-リン酸緩衝液(PBST)で3回洗浄した後、膜をヤギ抗マウスまたはヤギ抗ウサギIRDye 700または800カルコフロールホワイト(CW)標識二次抗体とともに37°Cで1時間インキュベートし、Odyssey赤外線スキャナー(LI-COR、リンカーン、ネブラスカ州、米国)で画像化しました。定量化は、LI-CORソフトウェアImage Studioを使用して行いました。 |
| 4.9.RNA抽出および定量的リアルタイムPCR |
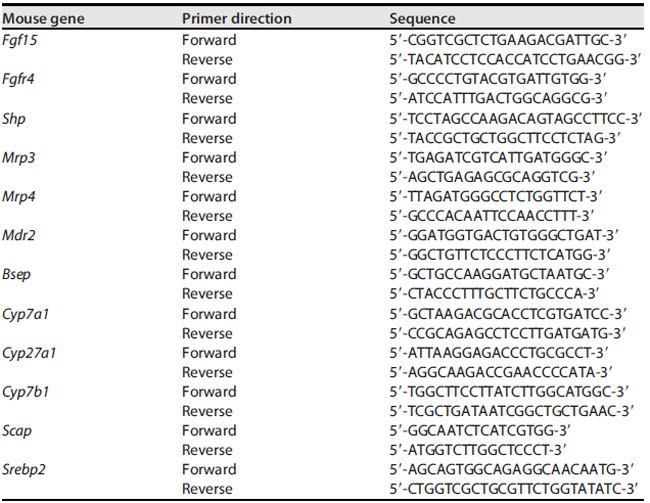
| 肝臓および回腸組織からの全RNAは、前述のようにTRIzol(Invitrogen、CA, USA)ホモジナイズ法で抽出し、続いてイソプロパノールでインキュベートし、RNA産物の純度は260/280比に従って1.8~2.0と判定されました。1,000ナノグラムのRNAを逆転写(RT)し、市販のPrimeScript RT試薬キット(TaKaRa、Japan)を使用してcDNAを生成しました。合成されたcDNAは定量PCR(qPCR)に使用され、遺伝子特異的なイントロンスパンプライマーを使用して標的遺伝子の相対的発現を判定しました(表1)。Hieff qPCR SYBRグリーンマスターミックス(Yeasen Biotech、Shanghai, China)を使用してqPCRを実行し、mRNA転写産物を解析しました。すべての反応はABI Prism 7900HT配列検出システム(Applied Biosystems、CA, USA)を使用して実施しました。各標的遺伝子の発現の倍数変化は、サイクル閾値(2−ΔΔCT)法を使用してハウスキーピング遺伝子β-アクチンの量と比較され、対照群の値に対する倍数変化として表されます。組織で分析された各標的遺伝子は、3回繰り返された実験で3重に分析されました。 |
| 表1.PCRに使用したプライマー |
 |
| 4.10.DNA 抽出および細菌配列決定 |
| 実験終了時に、各グループの 12 匹のマウスから 5 匹のマウスをランダムに選択し、腸内細菌叢検出用の糞便サンプルを採取しました。その他のマウスの糞便サンプルは液体窒素で凍結しました。マウスの糞便サンプルは排便後 15 分以内に採取し、1 時間以内に液体窒素で保存しました。細菌 DNA は、QIAamp DNA 糞便キット (Qiagen、米国カリフォルニア州) を使用して抽出しました。16S rRNA 遺伝子は、V3-V4 領域に結合するプライマーを使用して PCR 増幅しました。得られたアンプリコンは 2% アガロースゲルから抽出し、ゲル抽出 (AxyPrep DNA ゲル抽出キット、Axygen Biosciences、米国カリフォルニア州ユニオンシティ) を使用して精製し、その後、ペアエンド 300 ヌクレオチド リードを使用して Illumina MiSeq プラットフォーム (Illumina、米国サンディエゴ) で定量化および配列決定しました。 16S rRNA シーケンス データは、Quantitative Insights Into Microbial Ecology (QIME) プラットフォーム (バージョン 1.9.1) を使用して分析されました。 |
| 4.11.バイオインフォマティクス |
| 生の 16S rRNA 遺伝子配列リードは、次の基準でデマルチプレックス化され、fastp バージョン 0.20.0 を使用して品質フィルタリングされ、FLASH バージョン 1.2.7 (65, 66) を使用してマージされました。(i) 汚染配列は許可されませんでした。(ii) 50 bp のスライディング ウィンドウにわたって平均品質スコアが 20 未満のサイトでは 300 bp のリードが切り捨てられ、切り捨てられたリードの 50 bp 未満の部分とあいまいな文字を含むリードの部分は両方とも破棄されました。(iii) 10 bp を超える重複配列のみが、重複配列に従ってアセンブルされ、重複領域の最大ミスマッチ比は 0.2 であり、アセンブルできなかったリードは破棄されました。 (iv)サンプルはバーコードとプライマーによって区別され、配列方向が調整され、正確なバーコードマッチングが実行され、プライマーマッチングにおける2ヌクレオチドの不一致が許容された。97%の類似性カットオフ(67)を持つ操作的分類単位(OTU)は、UPARSEバージョン7.1を使用してクラスター化され、キメラ配列が識別され、除去された。 |
| 4.12.統計分析 |
| 得られた非マイクロバイオームデータは、一元配置分散分析(ANOVA)と事後Tukey検定を用いて統計的に分析され、有意水準が決定されました。P値が0.05未満で、有意な分散不均一性がないデータに対して、Tukeyの事後検定が行われました。統計分析は、SPSS 24(SPSS, Inc.、Chicago, IL, USA)を使用して実施されました。実験データの整形にはGraphPad Prism 7.0(GraphPad Software, Inc.、La Jolla, CA, USA)が使用され、データは平均値±平均の標準誤差(SEM)(n = 5~12)として提示されています。P値が0.05未満の場合、統計的に有意であるとみなされました。腸内細菌叢データ分析では、分析前にさまざまな分類群の存在量を均等にサブサンプリングし、各代表的な OTU 配列の分類を、信頼閾値 0.7 (68) を使用して 16S rRNA データベースに対して RDP Classifier バージョン 2.2 で分析しました。Bray-Curtis の類似度に基づく主座標分析 (PCoA) を実行して、結石誘発食および L. reuteri または L. plantarum 処理に対する腸内微生物動態の概要を示しました。サンプル間の腸内細菌叢の類似性は、門レベルで Bray-Curtis に基づき ANOSIM と Adonis によって比較されました。異なるグループの相対的な存在量の統計的比較は、Kruskal-Wallis H 検定と Tukey-Kramer 検定を使用して分析しました (95% 信頼区間および P 値 <0.05、多重検定 P 値は偽発見率 [FDR] で調整しました)。種レベルで最も豊富な上位50種の生物とコレステロール胆石の発生率と程度、血清胆汁酸、肝臓胆汁酸、血清生化学指標、コレステロール胆石関連mRNA発現レベルとの関係をスピアマンの相関分析で分析し、さまざまな分類群の存在量のリードカウントをスピアマン相関分析の中心対数比に変換しました(69)。スピアマンの相関係数はでした。P値は、0.01 < P ≤ 0.05、0.001 < P ≤ 0.01、およびP ≤ 0.001です。 |
| 4.13.試薬 |
| Z/E-ググルステロンおよびグリシン-β-ムリコール酸は MedChemExpress (MCE、USA) から購入しました。コレステロール7α-ヒドロキシラーゼ (CYP7A1)、ステロール12α-ヒドロキシラーゼ (CYP8B1)、ファルネソイド X 受容体(FXR)に対する一次抗体は Abcam (USA) から購入しました。β-アクチンは Cell Signaling Technology (CST、USA) から購入しました。ステロール12α-ヒドロキシラーゼ (CYP8B1)、ステロール 27-ヒドロキシラーゼ (CYP27A1)、線維芽細胞増殖因子受容体4 (FGFR4)に対する一次抗体は Proteintech Group (USA) から購入しました。線維芽細胞増殖因子 15 (FGF15)および胆汁酸塩輸出ポンプ(BSEP) に対する一次抗体は Santa Cruz Biotechnology (USA) から、その他の試薬はすべて Sigma-Aldrich Chemical (St. Louis, MO, USA) から購入しました。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Microbiol Spectr. 2023 Feb 1;11(2):e05072-22に掲載されたFXR Signaling-Mediated Bile Acid Metabolism Is Critical for Alleviation of Cholesterol Gallstones by Lactobacillus Strains. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


