ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
Lactiplantibacillus plantarumは、試験管内での 早期アポトーシスと老化を誘導することで、原発性肝がんの増殖を抑制した |
Oladimeji Paul Duduyemi et al., |
|
|
| 要約 |
原発性肝がんは肝細胞がんと胆管がんから成り、死亡率と罹患率が高く、世界中で発生率が増加している重篤ながんです。現在の治療法は限られており、化学療法は強い副作用を示します。新しい治療法が強く求められています。乳酸菌は最も多様な乳酸産生細菌群であり、プロバイオティクスの代表的な例です。いくつかの研究で、特にLactiplantibacillus plantarumのプロバイオティクスの抗がん効果が強調されています。しかし、肝細胞がんと胆管がんの2つの原発性肝がんタイプに対するその活性に関する研究は限られています。本研究では、ウクライナとフランスのブドウから分離されたL. plantarum ONU 12(Lp 12)とL. plantarum ONU 355(Lp 355)のマウス原発性肝がん細胞株に対する阻害メカニズムと特性をin vitroで評価しました。最も研究されているプロバイオティクス株であるLacticaseibacillus casei ATCC 393(Lc 393)株を直接比較するために採用しました。3種のLactobacillus種は、生菌および加熱殺菌懸濁液、および超音波処理抽出物の3つの形態で使用され、単独療法として、または標準的な化学療法薬(肝細胞がんにはソラフェニブ、胆管がんにはゲムシタビン)との併用療法として試験されました。細胞増殖と生存率は、クリスタルバイオレット染色アッセイと細胞計数キット8アッセイで評価しました。老化の誘導は、老化関連β-ガラクトシダーゼアッセイで調査しました。蛍光活性化細胞選別分析を使用して、乳酸菌の阻害特性の背後にあるアポトーシス機構を決定しました。結果は、L. plantarum ONU 12、L. plantarum ONU 355、およびLacticaseibacillus casei ATCC 393の生菌懸濁液と超音波処理抽出物が、48時間の培養後に胆管がんおよび肝細胞がん細胞で阻害特性を示しまし た。標準的な化学療法との併用において、乳酸菌治療は強力な相乗効果を示しました。併用療法により、ゲムシタビンの化学療法用量を50μMから0.1および0.05μMに、ソラフェニブを13.8μMから6.9および3.45μMに減らすことができました。成功した治療レジメンは、阻害のメカニズムとして、原発性肝がんで早期アポトーシスと細胞老化を誘発しました。加熱殺菌懸濁液は、どの細胞株でも阻害効果を示さなかった。 L. plantarum ONU 12とL. plantarum ONU 355の両方の株は成功した結果を示しており、自家肝細胞がんおよび 胆管がんモデルを使用した生体内でのさらなるテストが必要です。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 材料と方法 |
| 2.1. 細菌株の培養 |
| 2.2. 細菌の生懸濁液の調製 |
| 2.3. 加熱殺菌した細菌懸濁液の調製 |
| 2.4. 細菌の超音波抽出物の調製 |
| 2.5. 細胞株とその維持 |
| 2.6. 乳酸菌による肝細胞がん、胆管がん細胞および線維芽細胞の治療 |
| 2.7. 明視野顕微鏡検査 |
| 2.8. クリスタルバイオレット染色アッセイ |
| 2.9. 細胞増殖アッセイ/細胞カウントキット-8 |
| 2.10. 老化関連β-ガラクトシダーゼアッセイ |
| 2.11. フローサイトメトリー分析による初期、後期アポトーシスおよびネクロプトーシスの検出 |
| 3. 結果 |
| 3.1. 胆管がん細胞における抗がん活性スクリーニング |
| 3.1.1. L. plantarum ONU 12およびL. plantarum ONU 355の生菌懸濁液および超音波処理抽出物を単独療法またはゲムシタビンとの併用で胆管がんの増殖を阻害した |
| 3.1.2. L. plantarum ONU 12、L. plantarum ONU 355、および Lacticaseibacillus casei ATCC 393 の加熱殺菌懸濁液は胆管がんに対して阻害効果を示さなかった |
| 3.1.3. L. plantarum ONU 12、L. plantarum ONU 355、Lacticaseibacillus casei ATCC 393の超音波抽出物または生菌懸濁液とゲムシタビンの併用は胆管がんの増殖を阻害した |
| 3.1.4. 乳酸菌の生菌懸濁液または超音波処理抽出物の単独療法とゲムシタビンとの併用は、胆管がん細胞株で細胞老化を誘発した |
| 3.1.5. 乳酸菌は胆管がん細胞株を阻害しながら早期アポトーシスを誘導した |
| 3.2. 肝細胞がん細胞における抗がん活性スクリーニング |
| 3.2.1. L. plantarum ONU 12、L. plantarum ONU 355、Lacticaseibacillus casei ATCC 393の単独療法の生菌懸濁液および超音波処理抽出物は 肝細胞がんの増殖を阻害した |
| 3.2.2. L. plantarum ONU 12、L. plantarum ONU 355、Lacticaseibacillus casei ATCC 393 の生菌懸濁液または超音波処理抽出物とソラフェニブの組み合わせは 肝細胞がんの増殖を阻害しました |
| 3.2.3. L. plantarum ONU 12 の生菌懸濁液を単独療法およびソラフェニブと併用すると、肝細胞がん細胞株で細胞老化が誘発される |
| 4. 考察 |
| 5. 結論 |
本文 |
| 1.はじめに |
| 原発性肝がん(PLC)は、世界中で死亡率と罹患率が高い重篤ながんの一種です。2020年には、全世界で推定830,180人が死亡し、905,677人が新たに発症し、がん関連死の第3位となりました。多くの国で発症率が上昇しており、今後も増加し続けると予測されています(Liu et al., 2022)。肝細胞がん(HCC)と胆管がん(CCA)は、原発性肝がんの最も一般的な主要タイプであり、肝がん症例全体のそれぞれ肝細胞がんの70~85%と胆管がんの10~20%を占めています(Banales et al., 2020; El-Serag and Rudolph, 2007)。 肝細胞がんは肝細胞(成熟肝細胞)に由来し、胆管がんは胆管の胆管細胞に由来します(Gromowski et al., 2023)。肝臓がんのリスクを高める主な要因は、B 型および C 型肝炎の持続ウイルス感染、アルコール性肝疾患、アフラトキシンへの曝露、代謝機能障害関連脂肪肝疾患、および肥満や糖尿病などの代謝障害です(Chan et al., 2023; Forner et al., 2018; Rawla et al., 2018)。これらの状態は肝臓の炎症、線維化、および肝硬変につながり、最終的にはがん細胞への進行を開始します。肝臓がんの有病率は、上記のリスクに基づいて地理的地域によって異なり、アジアとサハラ以南のアフリカで最も高い率が観察されています(Sung et al., 2021)。利用可能な治療オプションには、外科的切除、肝移植、化学療法、放射線療法、標的療法、免疫療法などがあります (Jiang et al., 2023; Suresh et al., 2023)。ただし、肝臓がんの治療法の選択は、腫瘍の大きさ、ステージ、場所、患者の全般的な健康状態などのさまざまな要因によって異なります。たとえば、腫瘍が局所化していて転移しておらず、切除できる早期段階の患者の場合、手術が最も好ましい治療オプションです (Liu et al., 2015; Naqi et al., 2014)。ただし、多数の治療オプションが利用可能であるにもかかわらず、臨床結果は肝臓がんの除去に費やされた努力に直接対応していません。これらの治療オプション、特に化学療法は、重篤な副作用があり、再発率も高い(Llovet et al., 2005)。その結果、予後を改善し、既存の治療法の重篤な副作用を軽減し、原発性肝がんの世界的な負担を軽減するための新しい代替および補完的な治療戦略を開発するための研究を強化することが必須となっています。 |
| 有望なアプローチは、腸内微生物叢を有益な微生物で修正するか、その代謝産物で治療することです (Temraz et al., 2021)。プロバイオティクスは、適切な濃度で投与すると健康上の利点をもたらすことが知られています (Swanson et al., 2020)。研究では、プロバイオティクスのさまざまな役割と、下痢、がん、高血圧、自閉症、片頭痛などのさまざまな症状を予防および治療する可能性が検討されています (Liu et al., 2018; Tegegne and Kebede, 2022)。これらの有益な効果は大きな注目を集めています。そのようなプロバイオティクスの重要な例は、免疫調節、抗酸化、抗炎症、血糖値および代謝経路の調節など、多くの特性を持つことが示されている Lactiplantibacillus plantarum です (Liu et al., 2018)。 L. plantarumは、最も多様な乳酸菌グループである Lactobacillus 属に属します (Seddik et al., 2017)。L. plantarum は、グラム陽性、短桿菌、非胞子形成、非病原性、プロバイオティクス細菌であり、ヒトのマイクロバイオームに自然に存在する (Kazmierczak-Siedlecka et al., 2020)。また、乳製品 (Agaliya and Jeevaratnam, 2012)、肉 (Schillinger and Lucke, 1989)、ワイン (Berbegal et al., 2016) にも含まれています。L. plantarum の遍在性は、胃の酸性環境や小腸の胆汁酸塩の中でも、極端な環境条件で生存し適応する能力があることを証明しています (Fiocco et al., 2010)。 乳酸菌は、Staphylococcus aureus(黄色ブドウ球菌), Listeria monocytogenes(リステリア菌), Salmonella enteriditis (サルモネラ腸炎菌)およびEscherichia coli(大腸菌)などの病原菌の増殖を抑制します (Oldak ら、2020 年、Oldak et al.,2017 年)。これらの菌は、バクテリオシンや有機酸を生成し、栄養素や接着部位を直接競合して病原菌の定着や増殖を防ぐことで、抗菌効果を発揮します (Mokoena、2017 年) L. acidophilus, L. casei, L. rhamnosus, およびL. plantarumなどのさまざまな乳酸菌種は、ヒトの血清コレステロールやフィブリノーゲンを低下させ、心血管疾患を予防することに関係していることが証明されています (Anderson および Gilliland、1999 年)。 |
| 上記を踏まえ、本研究ではL. plantarumに焦点を当てました。ウクライナとフランスのブドウの果汁から分離されたL. plantarumの2つの株(ONU 12とONU 355)を選択しました。これらは、強力な細菌拮抗活性とバイオフィルム形成能力があることが実証されています(Limanska et al.、2019)。選択したL. plantarum株について、標準的な化学療法の補完療法または代替療法として、肝細胞がんおよび胆管がんに対する抗がん作用を試験しました。2つのL. plantarum株の有効性を、抗がん効果で知られる最も研究されている乳酸菌株であるLacticaseibacillus casei ATCC 393と直接比較しました(Lau et al.、2024; Spyridopoulou et al.、2021)。 |
| 2. 材料と方法 |
| 2.1. 細菌株の培養 |
| L. plantarum ONU 12 および L. plantarumONU 355 は、ウクライナとフランスで採取されたブドウの果汁から最初に分離されました (Limanska et al., 2019)。文献で抗がん作用があることが知られ (Lau et al., 2024; Spyridopoulou et al., 2021)、ドイツ、ブラウンシュヴァイクのライプニッツ研究所の DSMZ から購入した L. casei ATCC 393 (DSMZ 番号: 20011) を対照として使用しました。L. plantarum と L. casei は、37°C で好気的に de Man Rogosa and Sharpe (MRS) 培地 (Haghshenas et al., 2023) で培養されました。 |
| 2.2. 細菌の生菌懸濁液の調製 |
| 乳酸菌株をMRSブロスで37°Cで20~24時間培養し、濃度を少なくとも109 CFU/mLにしました。細菌細胞をPBS緩衝液で2回洗浄し、4°Cで3,500 gで15分間遠心分離して回収しました(S. Choi et al., 2006)。抗生物質を含まないダルベッコ改変イーグル培地(DMEM、Gibco、UK)を使用して、得られた細菌ペレットを109 CFU/mLの開始濃度に調整しました。 |
| 2.3. 加熱殺菌した細菌懸濁液の調製 |
| 乳酸菌をMRSブロスで37°Cで培養し、少なくとも109 CFU/mLの濃度に達するようにした。その後、細菌懸濁液を採取し、前のセクションで説明したようにPBS緩衝液で2回洗浄した。細菌ペレットをPBS緩衝液に再懸濁し、2 mLマイクロチューブに分配した。サーモブロック(Eppendorf、USA)を使用して、95°Cで1時間加熱不活化を行い(Choi et al.、2006)、不活化が完全に行われるように断続的にボルテックスした。その後、乳酸菌を再び3,500 gで4°Cで15分間遠心分離し、抗生物質を含まないDMEM(訳者注:DMEM(ダルベッコ改変イーグル培地)は、細胞や組織の培養に用いられる合成培地です)に再懸濁した。 |
| 2.4. 細菌の超音波抽出物の調製 |
| 超音波処理は、音エネルギーを使用して細菌の細胞壁と膜を破壊または破壊し、細菌タンパク質を放出するために実施されました (Wang et al., 2021)。乳酸菌は、MRSブロスで37°Cで20~24時間培養され、少なくとも109 CFU/mLの濃度に達しました。細菌懸濁液を採取し、前のセクションで説明したのと同じ条件を使用してPBS緩衝液で2回洗浄しました。その後、1 mLの細菌懸濁液をいくつかの1.5 mLマイクロチューブに分配し、Han et al(2013)の方法に従って超音波ディスメンブレーターで破壊した(修正:70 Wで1分間ずつ10ラウンド)。 その後、超音波処理した抽出物をファルコンに集め、抗生物質を含まない DMEM で 2 倍希釈したものを実験用に調製し、製造元の指示に従って Pierce™ BCA タンパク質アッセイキット (Thermo Scientific™、米国) でタンパク質定量を行いました。 |
| 2.5. 細胞株とその維持 |
| 本研究では、最近報告されたようにマウス原発性肝がんから分離された、NRASG12Vオンコジーン(訳者注:オンコージンとは正常な遺伝子が修飾を受けて発現や構造、機能に異常をきたし、正常細胞のがん化を引き起こす遺伝子のこと)を発現する肝細胞がんおよびKRASG12VおよびAkt2オンコジーンを発現する胆管がんのがん細胞株を使用しました(Pylypchuk et al., 2022; Suo et al., 2022)。市販のマウス線維芽細胞CBA-310(Zhang et al., 2023)を対照の非がん細胞として使用しました。すべての細胞株は、10%ウシ胎児血清、5%ペニシリン/ストレプトマイシン、および5%最小必須培地非必須アミノ酸(Thermo Fisher、USA)を添加した完全DMEMで培養しました。細胞は、37°C、5%CO2、95%湿度のインキュベーターで培養しました。 |
| 2.6. 乳酸菌による肝細胞がん、胆管がん細胞および線維芽細胞の治療 |
| まず、抗生物質を含まない完全 DMEM 培地に 100 μL の容量で 1 × 105/mL の濃度で細胞を播種しました。16 時間の培養後、2 倍濃縮の生菌懸濁液または超音波処理抽出物または加熱殺菌懸濁液 100 μL を、96 ウェル プレートの各ウェルにそれぞれ加えました。また、標準的な抗がん治療薬であるソラフェニブ (肝細胞がんの場合) およびゲムシタビン (胆管がんの場合) を単独療法として、または L. plantarum 懸濁液または抽出物と組み合わせて投与しました。最近報告されているように(Pylypchuk et al., 2022; Suo et al., 2022)、ソラフェニブの臨床血漿濃度(13.8 μM)の半分の用量(6.9 μM)と4分の1の用量(3.5 μM)を使用しました。ゲムシタビンについては、最近報告されているように(Pylypchuk et al., 2022; Suo et al., 2022)、ゲムシタビンの臨床血漿濃度(50 μM)から導出された血漿濃度のごく一部、具体的には0.05 μMと0.1 μMを使用しました。超音波処理したPBS、PBS、およびDMEMを陰性対照として使用しました。その後、プレートを24時間および48時間インキュベートし、さらなる実験と分析を行いました。 |
| 2.7. 明視野顕微鏡検査 |
| 細胞単層は、40 倍対物レンズを備えた Nikon Eclipse Ti2 顕微鏡を使用して観察および撮影されました。 |
| 2.8. クリスタルバイオレット染色アッセイ(CVSA) |
| がん細胞の増殖の評価は、Śliwka et al. (2016)、Pylypchuk et al. (2022)、およびSuo et al. (2022) の研究で説明されているように、確立された標準技術を採用したクリスタルバイオレット染色アッセイ(CVSA)を使用して実施しました。簡単に説明すると、24 時間および 48 時間の培養期間の後、細胞を温かい 100 μL PBS で穏やかに洗浄して、残留 DMEM またはデブリを除去しました。その後、細胞が適切に固定されていることを確認するために、4% パラホルムアルデヒド溶液を使用して 7 分間細胞を固定しました。固定後、細胞を 30% エタノール中の 0.5% クリスタルバイオレットで室温で 30 分間染色しました。染色色素は生細胞の細胞成分に結合するため、細胞密度の最適な視覚化と定量化が可能になります。その後、プレートを一晩乾燥させました。最後に、ImmunoSpot® S6 ULTI-MATE Analyzer (Cellular Technology Limited、USA) を使用して各プレートのウェルの高解像度写真を撮影し、ImageJ ソフトウェアを使用して分析しました。 |
| 2.9. 細胞増殖アッセイ/細胞カウントキット-8 (CCK-8) |
| 細胞増殖アッセイ/細胞カウントキット-8 (CCK-8)法は、確立された正確かつ客観的な方法で細胞生存率と増殖を定量的に評価するために採用されました (Pylypchuk et al., 2022; Suo et al., 2022)。実験手順は、標準化と精度を確保するために製造元のプロトコルに従って実行されました。24時間および48時間のインキュベーション期間後、10μLの細胞増殖アッセイ/細胞カウントキット-8溶液をプレートの各ウェルに慎重に添加し、さらに2~4時間インキュベートしました。この間、細胞増殖アッセイ/細胞カウントキット-8試薬に含まれる水溶性テトラゾリウム塩は生細胞内で酵素還元を受け、色のついたフォルマザン生成物が生成されました (Yang et al., 2021)。この細胞反応を定量化するために、Infinite 200 PRO Nano Quant Tecanマイクロプレートリーダー(TECAN、スイス)を使用して、2時間後と4時間後に各ウェルの吸光度を波長450 nmで測定しました。細胞増殖アッセイ/細胞カウントキット-8アッセイでは、フォルマザン生成物の強度と光学密度の測定値は、ウェル内に存在する生細胞の存在量と直接相関しています(Yang et al.、2021)。得られた吸光度値は、その後、i-control™ソフトウェア(TECAN、Switzerland)を使用して分析されました。 |
| 2.10. 老化関連β-ガラクトシダーゼアッセイ(SA-β-gal) |
| 細胞老化は、試験した乳酸菌とその抽出物を細胞に24時間および48時間インキュベートした後、確立された老化関連β-ガラクトシダーゼアッセイ(SA-β-gal)(Pylypchuk et al., 2022; Suo et al., 2022)によって評価されました。最初に、細胞単層をpH範囲7.2~7.4のPBSで穏やかに洗浄し、残留培地や破片を除去しました。その後、細胞は、前述のpH範囲のPBSに2%ホルムアルデヒドと0.2%グルタルアルデヒドを含む固定液で固定されました。固定液を除去した後、細胞は、1 mM MgCl2を添加したpH 6.0のPBS緩衝液で追加の洗浄ステップを受けました。各ウェルにX-gal染色液100 μLを加えました。 Cahu および Sola (2013) のプロトコルに従って調製した染色溶液は、pH 6.0 で 1 mM MgCl2 を添加した PBS 中のフェロシアン化カリウム、フェリシアン化カリウム、および X-ガラクトースで構成されていました (Cahu and Sola、2013)。次に、プレートを CO2 供給なしで 37°C でインキュベートし、老化細胞の存在を示す明確な青い染色が現れるまで待ちました。分析の代表的な画像を取得するために、Nikon 顕微鏡 Eclipse Ti2 (Nikon、Japan) を使用して、対物レンズ 40 倍で各ウェルから 10 枚の高倍率フィールド写真を撮影しました。その後、画像を分析して、乳酸菌とその抽出物によって誘発された細胞老化の程度を評価しました。 |
| 2.11. フローサイトメトリー分析(FACS)による初期、後期アポトーシスおよびネクロプトーシスの検出 |
| 24 時間および 48 時間の培養後の細胞を慎重に採取し、pH 7.2~7.4 の範囲の PBS で洗浄しました。付着細胞を剥離するために、トリプシンを添加し、得られた細胞懸濁液をそれぞれ最初のマイクロチューブに移しました。アポトーシスの評価には、アネキシン V-フィコエリスリン (PE) と 7-アミノ-アクチノマイシン D (7-AAD) (Biolegend®、USA) を使用した二重染色法を実装しました (Bushnell、2015)。アネキシン V-PE は、初期アポトーシス中に細胞膜の内側から外側のリーフレットに転座するホスファチジルセリンに特異的に結合します (Vermes ら、1995)。 DNA結合色素である7-AADは、無傷の細胞膜には浸透しませんが、膜の完全性が損なわれた後期アポトーシス細胞および壊死細胞のDNAを染色します(Zembruski et al.、2012)。Annexin V-PEおよび7-AAD染色剤をそれぞれ5μL、細胞懸濁液に加えました。10mM HEPES [pH7.4]、140mM NaCl、および2.5mM CaCl2からなる結合バッファー400μLを各チューブに加えました。次に、サンプルをフローサイトメーター(Cytek® Aurora、USA)を使用してフローサイトメトリー分析 (FACS)にかけました。補正を実行し、取得したデータをFlowJo 9.9.6(BD™、USA)ソフトウェアを使用して分析しました。 |
| 3. 結果 |
| 本研究では、3つの異なる乳酸菌株を使用しました。ブドウの果汁から分離されたL. plantarum ONU 12(Lp 12)とL. plantarum ONU 355(Lp 355)(Limanska et al., 2019)、そして最後にドイツのDSMZから購入したL. casei ATCC 393(Lc 393)です。すべての細菌は、MRSブロスで37°Cで20~24時間培養され、本研究で使用するために生菌懸濁液、超音波処理抽出物、または加熱殺菌懸濁液として調製されました。肝細胞がんおよび胆管がん細胞株は以前に樹立されており(Pylypchuk et al., 2022; Suo et al., 2022)、96ウェルプレートに播種されました(図1A)。 16時間後、L. plantarum ONU 12、L. plantarum ONU 355、Lacticaseibacillus casei ATCC 393の生菌懸濁液、超音波処理抽出物、加熱殺菌懸濁液を、それぞれの標準的な化学療法薬(肝細胞がんにはソラフェニブ、胆管がんにはゲムシタビン)と組み合わせて添加し、すでに播種した細胞と共インキュベートした(図1B)。重要なことは、標準的な治療薬が異なる濃度で添加されたことである。陽性対照は、以前に確立されたソラフェニブの臨床血漿濃度(13.8μM)とゲムシタビンの臨床血漿濃度(50μM)で構成されていた(Pylypchuk et al.、2022; Suo et al.、2022)。陰性対照は、希釈液/緩衝液とDMEMで構成されていた。インキュベーション後24時間および48時間に、クリスタルバイオレット染色アッセイ(CVSA)、細胞増殖アッセイ/細胞カウントキット-8 (CCK-8)、老化関連β-ガラクトシダーゼアッセイ(SA-β-gal)、フローサイトメトリー分析 (FACS)、明視野顕微鏡などのアッセイを実施し、添加した処理の阻害特性と作用機序を評価した(図1C)。 |
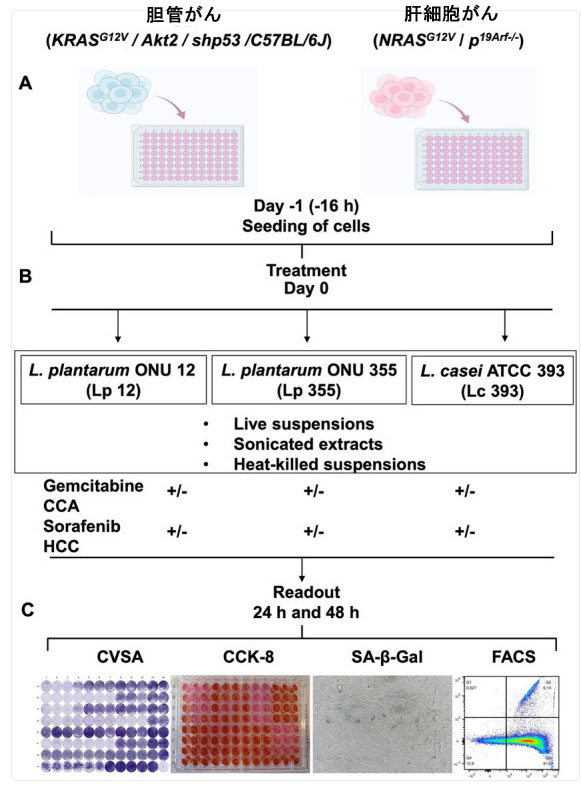 |
| 図1 胆管がん、肝細胞がん細胞株、線維芽細胞を用いて、L. plantarum ONU 12、L. plantarum ONU 355、Lacticaseibacillus casei ATCC 393の有効性とin vitroでの作用機序を研究するための実験レイアウト。(A) 細胞は-1日目に播種されました。(B) 0日目に、L. plantarum ONU 12、L. plantarum ONU 355、Lacticaseibacillus casei ATCC 393のいずれかの生細胞、加熱殺菌した懸濁液、超音波処理した抽出物を、単独療法として、または胆管がんにはゲムシタビン、肝細胞がんにはソラフェニブという標準的な化学療法薬との併用療法として、さまざまな濃度で細胞に加えました。(C) 24時間および48時間の培養後、クリスタルバイオレット染色アッセイ(CVSA)、細胞増殖アッセイ/細胞カウントキット-8 (CCK-8)、老化関連β-ガラクトシダーゼアッセイ(SA-β-gal)、フローサイトメトリー分析 (FACS)、、明視野顕微鏡検査など、さまざまな読み取りを実行しました。市販のマウス線維芽細胞CBA-310を対照細胞株(正常細胞)として使用しました。 |
| 3.1. 胆管がん細胞における抗がん活性スクリーニング |
| 3.1.1. L. plantarum ONU 12およびL. plantarum ONU 355の生菌懸濁液および超音波処理抽出物を単独療法またはゲムシタビンとの併用で胆管がんの増殖を阻害した |
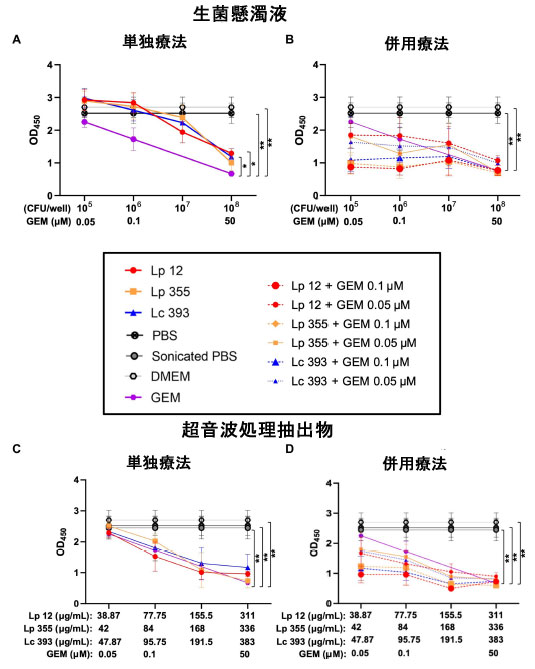
| L. plantarum ONU 12、L. plantarum ONU 355、および Lacticaseibacillus casei ATCC 393の生菌懸濁液の阻害能力は、最初に胆管がん細胞株で クリスタルバイオレット染色アッセイ(CVSA)を使用して評価されました。使用したすべての株の中で最も濃度の高い生菌懸濁液 (108 CFU/ウェル) は、24 時間後に 胆管がんに対して軽度の阻害効果を示し (図 2A)、未処理のコントロール (DMEM) と比較した場合、48 時間後にはより顕著になりました (図 2B)。陽性コントロールとしてゲムシタビン (50 μM) を使用したところ、予想どおり、用量依存的に胆管がん細胞を阻害しました。L. plantarum ONU 12、L. plantarum ONU 355、および Lacticaseibacillus casei ATCC 393の生菌懸濁液の阻害効果も濃度依存的であることが判明し、最高濃度 (108 CFU/ウェル) が最も強い効果を示し、ゲムシタビンのヒト血漿濃度 (50 μM) に匹敵しました。 L. plantarum ONU 12とL. plantarum ONU 355の最高濃度(108 CFU/ウェル)による単独療法は、Lacticaseibacillus casei ATCC 393群よりも強い阻害効果を示した(図2B)。対照株Lacticaseibacillus casei ATCC 393(108 CFU/ウェル)は、24時間後(補足図S1A、B)と特に48時間後(補足図S1C、D)の両方で線維芽細胞に対する毒性効果を示した。重要なことは、L. plantarum ONU 12とL. plantarum ONU 355の最高濃度(108 CFU/ウェル)は胆管がんの増殖を阻害したが、線維芽細胞の増殖は阻害しなかったことである(図2および補足図S1)。胆管がんと線維芽細胞における併用療法で観察された阻害効果は、ゲムシタビン(0.1および0.05 μM)で治療した対照群で観察された効果と同様であった(図2および補足図S1)。 |
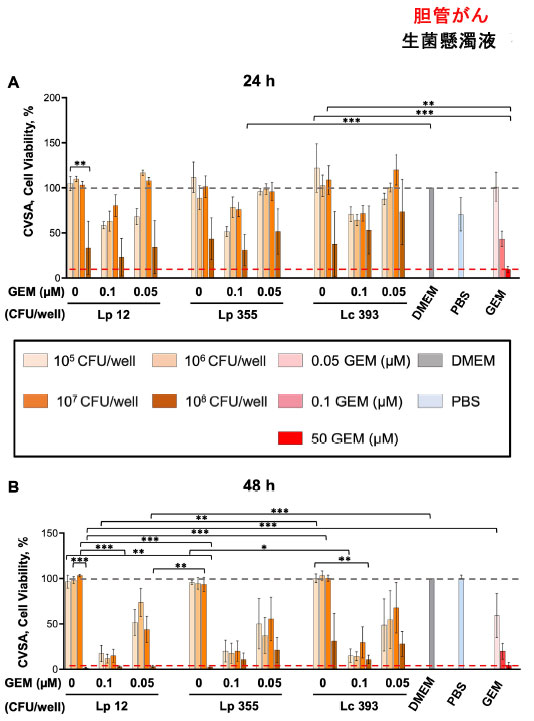 |
| 図2 108 CFU/ウェルの濃度のL. plantarum ONU 12およびL. plantarum ONU 355の生菌懸濁液は、胆管がんの増殖を阻害しました。クリスタルバイオレット染色CVSA)分析は、異なる濃度(生菌懸濁液:108、107、106、105 CFU/ウェル)で単独で投与された乳酸菌、または異なる濃度(0.05および0.1μM)でゲムシタビンと組み合わせて投与された乳酸菌による処理後の胆管がん細胞で実施されました。クリスタルバイオレット染色アッセイ(CVSA)の読み取りを実行しました:(A)インキュベーション後24時間後の生菌懸濁液、および(B)インキュベーション後48時間後の生菌懸濁液。GEM、ゲムシタビン。赤い破線は、標準治療(ゲムシタビン50μM)で治療した対照群で得られたデータを示しています。*p < 0.05、**p < 0.01、***p < 0.001。 |
| さらに、胆管がん設定で生きた細菌から得られた超音波処理抽出物をテストしました。生きた懸濁液と同様に、L. plantarum ONU 12 (311 μg/mL) と L. plantarum ONU 355 (336 μg/mL) の超音波処理抽出物は、陽性対照 (ゲムシタビン 50 μM) と比較して、48 時間インキュベーション後に胆管がん細胞の増殖を特異的に阻害しました (図 3A、B)。Lacticaseibacillus casei ATCC 393 (383 μg/mL) は、2 つの L. plantarum対照よりも阻害効果が低かった (図 3B)。併用療法で観察された阻害効果は、特に 48 時間インキュベーション後に、ゲムシタビン (0.1 μM および 0.05 μM) で治療した対照群で見られたものよりも顕著でした (図 3B)。特に、L. plantarum ONU 12(311 および 155.5 μg/mL)、L. plantarum ONU 355(336 および 168 μg/mL)、および Lacticaseibacillus casei ATCC 393(383 および 191.5 μg/mL)をゲムシタビン 0.1 μM と併用した場合、単独療法として投与されたゲムシタビン 0.1 μM 単独または超音波処理抽出物よりも有効性が高くなりました(図 3B)。さらに、試験したすべての超音波処理抽出物をゲムシタビン 0.5 μM と併用した場合、単独療法として投与されたゲムシタビン 0.5 μM 単独または超音波処理抽出物よりも有効性が高くなりました(図 3B)。陰性対照(超音波処理 PBS、PBS、および DMEM)は胆管がん の増殖を阻害できませんでした(図 3)。 |
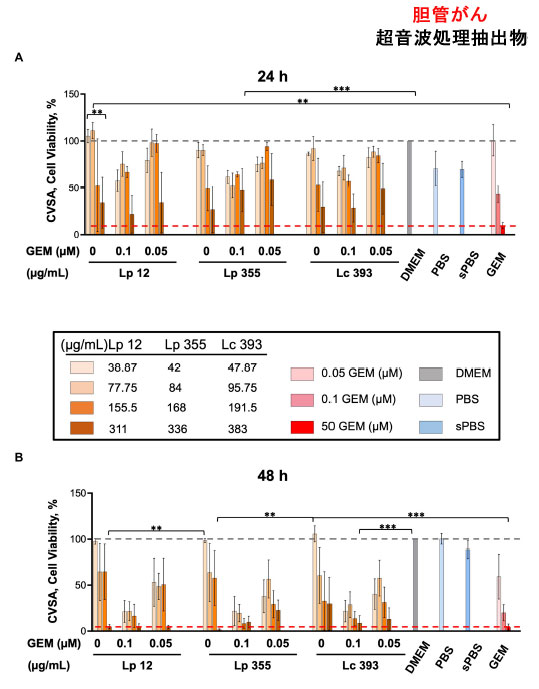 |
| 図3 L. plantarum ONU 12および L. plantarum ONU 355の超音波処理抽出物は、それぞれ 311 μg/mL および 336 μg/mL の濃度で 胆管がん の増殖を阻害しました。クリスタルバイオレット染色アッセイ(CVSA)分析は、異なる濃度で乳酸菌を単独で投与した後 (超音波処理抽出物: 35~390 μg/mL の範囲)、または異なる濃度 (0.05 および 0.1 μM) でゲムシタビンと組み合わせて投与した後の 胆管がん細胞で実施しました。クリスタルバイオレット染色アッセイ(CVSA)の読み取りを実行しました: (A) 24 時間後の超音波処理抽出物、および (B) インキュベーション後 48 時間後の超音波処理抽出物。GEM、ゲムシタビン、sPBS、超音波処理 PBS。赤い破線は、標準治療 (ゲムシタビン 50 μM) で治療した対照群で得られたデータを示しています。 **p < 0.01、***p < 0.001。 |
| 正常細胞線維芽細胞と比較すると、Lacticaseibacillus casei ATCC 393の超音波抽出物(383および191.5μg/mL)は毒性があることが判明しましたが、L. plantarum ONU 12およびL. plantarum ONU 355は線維芽細胞に対して高い毒性を示さなかった(補足図S2A~D)。 |
| 3.1.2. L. plantarum ONU 12、L. plantarum ONU 355、および Lacticaseibacillus casei ATCC 393 の加熱殺菌懸濁液は胆管がんに対して阻害効果を示さなかった |
| さらに、細胞増殖アッセイ/細胞カウントキット-8 (CCK-8)アッセイを使用して、胆管がんにおけるL. plantarum ONU 12、L. plantarum ONU 355、および Lacticaseibacillus casei ATCC 393 の加熱殺菌懸濁液の有効性を評価しました。興味深いことに、加熱殺菌懸濁液の影響は観察されず、乳酸菌の最高濃度である 108 CFU/mL でも 24 時間および 48 時間の両方で 胆管がん細胞の増殖を阻害できませんでした (図 4A、B)。 |
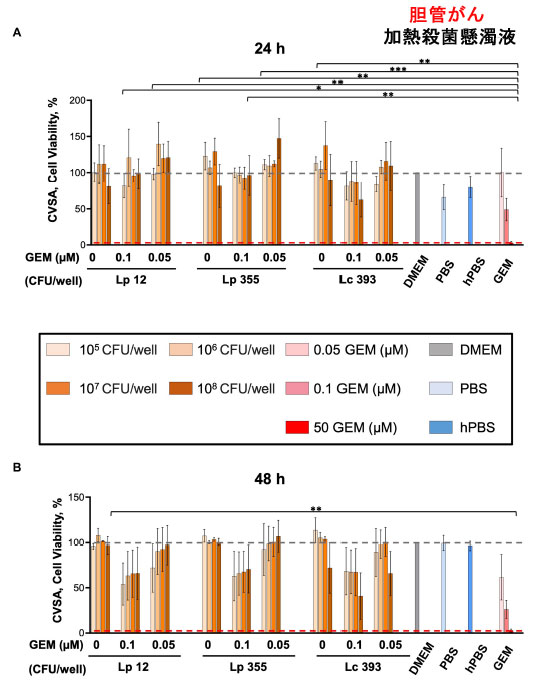 |
| 図4 L. plantarum ONU 12、L. plantarum ONU 355、および Lacticaseibacillus casei ATCC 393の加熱殺菌懸濁液は 胆管がん細胞の増殖を阻害しませんでした。クリスタルバイオレット染色アッセイ(CVSA)分析は、異なる濃度の乳酸菌を単独で、または異なる濃度 (0.05 および 0.1 μM) のゲムシタビンと組み合わせて投与した後の 胆管がん 細胞で実施しました。クリスタルバイオレット染色アッセイ(CVSA)の読み取りは、インキュベーション後 (A) 24 時間および (B) 48 時間で実施しました。GEM、ゲムシタビン、hPBS、加熱 PBS。赤い破線は、標準治療 (ゲムシタビン 50 μM) で治療した対照群で得られたデータを示しています。*p < 0.05、**p < 0.01、***p < 0.001。 |
| 3.1.3. L. plantarum ONU 12、L. plantarum ONU 355、Lacticaseibacillus casei ATCC 393の超音波抽出物または生菌懸濁液とゲムシタビンの併用は胆管がんの増殖を阻害した |
| 次のステップでは、細胞増殖アッセイ/細胞カウントキット-8 (CCK-8)アッセイを実施し、胆管がん 細胞を L. plantarum ONU 12、L. plantarum ONU 355、Lacticaseibacillus casei ATCC 393の生菌懸濁液および超音波抽出物で処理した後に残存する生細胞を定量化した。培養後 48 時間で、生菌懸濁液単独療法では濃度に応じて生細胞数が比例して減少したが、ヒト血漿濃度 50 μM のゲムシタビンはそれを上回った (図 5A)。しかし、3つの菌株(108 CFU/ウェル)とゲムシタビン0.1μMの併用療法では、それぞれの単独療法よりもさらに生存細胞数が減少し、この減少はヒト血漿濃度のゲムシタビン50μMで治療した群と同様であった(図5B)。 |
 |
| 図5 L. plantarum ONU 12、L. plantarum ONU 355、Lacticaseibacillus casei ATCC 393の生菌懸濁液または超音波処理抽出物、およびゲムシタビンとの併用は、細胞増殖アッセイ/細胞カウントキット-8で 胆管がん細胞株に対する阻害効果を示しました。胆管がん細胞を乳酸菌および乳酸菌とゲムシタビンの併用で処理しました: (A) 48 時間生乳酸菌懸濁液単独療法、(B) 48 時間生乳酸菌懸濁液単独療法および併用療法、(C) 48 時間超音波処理乳酸菌抽出物単独療法、(D) 48 時間超音波処理乳酸菌抽出物単独療法および併用療法。インキュベーション後、胆管がん細胞を OD450 で細胞増殖アッセイ/細胞カウントキット-8分析にかけました。GEM、ゲムシタビン。*p < 0.05、**p < 0.01。 |
| 超音波処理抽出物については、48時間でL. plantarum ONU 355(336 μg/mL)の単独療法のみがゲムシタビン50 μMと同様の有効性を示したのに対し、L. plantarum ONU 12(311 μg/mL)およびLacticaseibacillus casei ATCC 393383 μg/mL)の単独療法はゲムシタビン50 μMおよびL. plantarum ONU 355(336 μg/mL)よりも有効性が低かった(図5C)。重要なことに、L. plantarum ONU 355(336 μg/mL)の超音波処理抽出物とゲムシタビン0.1 μMの併用は、ゲムシタビン50 μM単独療法よりも胆管がんの増殖をより効率的に阻害した(図5D)。 L. plantarum ONU 12 (311 μg/mL) および Lacticaseibacillus casei ATCC 393 (383 μg/mL) をゲムシタビン 0.1 μM と併用した場合、ゲムシタビン 50 μM 単独療法よりもわずかに効果が低かった (図 5D)。興味深いことに、L. plantarum ONU 12 (155.5 μg/mL) および L. plantarum ONU 355 (168 μg/mL) をゲムシタビン 0.1 μM と併用した場合、ゲムシタビン 50 μM 単独療法よりも胆管がんの増殖をより効率的に阻害した (図 5D)。3 つの菌株すべての超音波処理抽出物をゲムシタビン 0.5 μM と併用した場合、ゲムシタビン 50 μM 単独療法よりも効果が低かった (図 5D)。また、併用療法はすべての菌株において単独療法よりも効果的であったことも特筆すべき点である (図 5D)。 |
| 3.1.4. 乳酸菌の生菌懸濁液または超音波処理抽出物の単独療法とゲムシタビンとの併用は、胆管がん細胞株で細胞老化を誘発した |
| 私たちはさらに実験を進め、乳酸菌の阻害特性が胆管がん細胞での細胞老化の誘発と関連しているかどうかを確認した。私たちは 老化関連β-ガラクトシダーゼアッセイ(SA-β-gal)を実施し、治療後 48 時間で老化細胞を検出した。106 CFU/ウェルで試験した 3 株すべての生菌懸濁液は老化を誘発することができた (図 6)。同様に、L. plantarum ONU 12、L. plantarum ONU 355、Lacticaseibacillus casei ATCC 393の超音波処理抽出物は、それぞれ 84、57.5、127.75 μg/mL の濃度で老化を誘発した (図 7)。検出された老化反応は、さまざまな濃度のゲムシタビンで検出されたものと同等であった (図 6、7)。同様に、乳酸菌とゲムシタビン0.1μMおよび0.05μMの併用療法でも老化が誘導された(図6、7)。 |
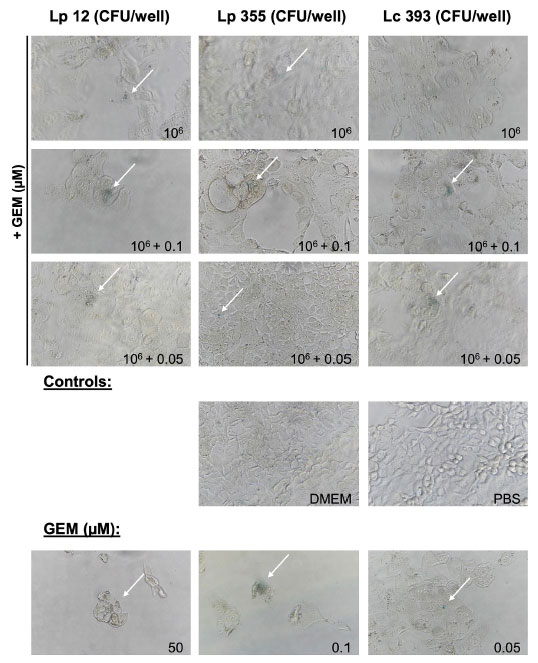 |
| 図6 生きた懸濁液 L. plantarum ONU 12、L. plantarum ONU 355、Lacticaseibacillus casei ATCC 393とゲムシタビンの組み合わせは細胞老化を誘発しました。老化関連β-ガラクトシダーゼアッセイ(SA-β-gal)はインキュベーション後 48 時間で実施しました。代表的な明視野顕微鏡写真 (対物レンズ 40 倍) を示します。老化細胞 (青) は白い矢印で示されています。GEM、ゲムシタビン、 |
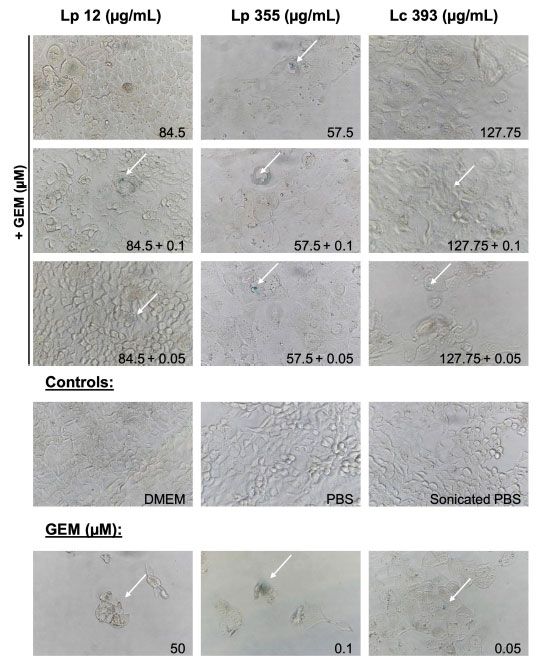 |
| 図7 超音波処理した抽出物 L. plantarum ONU 12、L. plantarum ONU 355、Lacticaseibacillus casei ATCC 393とゲムシタビンの組み合わせは細胞老化を誘発しました。老化関連β-ガラクトシダーゼアッセイ(SA-β-gal)は、インキュベーション後 48 時間で実施しました。代表的な明視野顕微鏡写真 (対物レンズ 40 倍) を示します。老化細胞 (青) は白い矢印で示されています。GEM、ゲムシタビン、 |
| 3.1.5. 乳酸菌は胆管がん細胞株を阻害しながら早期アポトーシスを誘導した |
| 次のステップでは、胆管がん細胞の阻害の背後にあるメカニズムをさらに調査するために フローサイトメトリー分析 (FACS)を実行しました。補足図 S3 に示すゲーティング戦略を採用しました。ゲーティング戦略に基づいて、次の 4 つの集団を検出しました。(1) 7AAD− アネキシン V PE 中程度として特徴付けられる早期アポトーシス中程度、(2) 7AAD− アネキシン V PE 高として特徴付けられる早期アポトーシス高程度、(3) 7AAD+ アネキシン V PE+ として特徴付けられる後期アポトーシス、および (4) 7AAD+ アネキシン V PE− として特徴付けられるネクロプトーシス (補足図 S3)。予想どおり、標準治療 (ゲムシタビン単独療法 50 μM) は 胆管がんで主に早期 (中程度および高程度) アポトーシスを誘導しました (図 8A~D)。超音波処理抽出物 L. plantarum ONU 12、L. plantarum ONU 355、および Lacticaseibacillus caseiATCC 393の単独療法は、用量依存的に初期アポトーシス中期を誘導しました (図 8D)。しかし、生菌懸濁液 L. plantarum ONU 12、L. plantarum ONU 355、および Lacticaseibacillus casei ATCC 393の単独療法は、50 μM でのゲムシタビン単独療法よりもさらに強力な初期アポトーシス中期を誘導しました (図 8D)。細菌生菌懸濁液または超音波処理抽出物で処理した細胞では、後期アポトーシス、ネクロプトーシス期、および初期アポトーシス高期 (それぞれ図 8A~D) の細胞はほとんどまたはまったく見られませんでした。生細胞懸濁液L. plantarum ONU 355およびLacticaseibacillus casei ATCC 393と0.1μMゲムシタビンの併用療法は最も強力な早期アポトーシスを誘導し(図8C)、生細胞懸濁液Lacticaseibacillus casei ATCC 393と0.1μMゲムシタビンの併用療法は最も強力な後期アポトーシスを誘導した(図8A)。 |
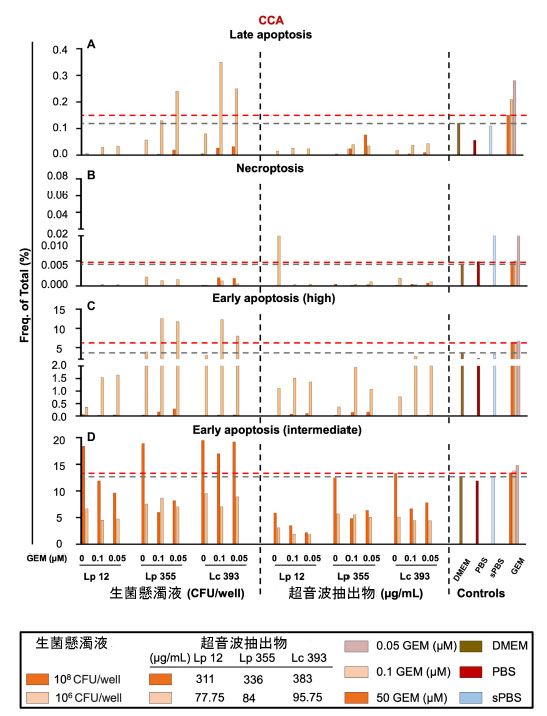 |
| 図8 生菌懸濁液 L. plantarum ONU 355 は、胆管がん細胞で主に早期アポトーシスを誘導しました。補足図 S3 に示すゲーティング戦略を使用して、ネクロプトーシス、後期アポトーシス、早期アポトーシス (中程度)、早期アポトーシス (高程度) を分析しました。細胞は、重複を避けながら、前方散乱特性と側方散乱特性を使用してゲーティングされました。フローサイトメトリー分析 (FACS)の結果は、(A) 後期アポトーシス、(B) ネクロプトーシス、(C) 早期アポトーシス (高程度)、(D) 早期アポトーシス (中程度) 集団の総細胞頻度をパーセントで示しています。GEM、ゲムシタビン。赤い破線は、標準治療 (ゲムシタビン 50 μM) で治療した対照群で得られたデータを示しています。 |
| 3.2. 肝細胞がん細胞における抗がん活性スクリーニング |
| 3.2.1. L. plantarum ONU 12、L. plantarum ONU 355、Lacticaseibacillus casei ATCC 393の単独療法の生菌懸濁液および超音波処理抽出物は 肝細胞がんの増殖を阻害した |
| 同じ実験レイアウトを使用して、肝細胞がん細胞株における乳酸菌の有効性をさらにテストしました (図 1)。肝細胞がん設定では、L. plantarum L. plantarum ONU 355、Lacticaseibacillus casei ATCC 393の 3 つの株すべてで最高濃度の 108 CFU/ウェルの生菌懸濁液が、ヒト血漿濃度 (13.8 μM) で 肝細胞がんの標準化学療法であるソラフェニブよりも効果的であることが判明しました (補足図 S4A~D)。超音波処理抽出物では、L. plantarum ONU 12509、254.5μg/mL)、L. plantarum ONU 355(714、357、178.5μg/mL)、およびLacticaseibacillus casei ATCC 393(712、356、および178μg/mL)は、ヒト血漿濃度(13.8μM)でのソラフェニブ単独療法よりもさらに単独療法として使用した場合に肝細胞がん細胞株の増殖を完全に阻害しました(補足図S5A〜D)。さらに、濃度6.9μMおよび3.45μMのソラフェニブとの併用は、特に48時間のインキュベーション後に、単独療法と同等の阻害効果を示しました(補足図S4C、D)。 |
| すべての菌株の加熱殺菌懸濁液は、肝細胞がん細胞に対する阻害効果を示さなかった (補足図 S6A~D)。肝細胞がんの増殖は、陰性対照群で検出された増殖とほぼ同様であった。 |
| 3.2.2. L. plantarum ONU 12、L. plantarum ONU 355、Lacticaseibacillus casei ATCC 393 の生菌懸濁液または超音波処理抽出物とソラフェニブの組み合わせは 肝細胞がんの増殖を阻害しました |
| さらに、細胞増殖アッセイ/細胞カウントキット-8 (CCK-8)アッセイを使用して、乳酸菌処理後の 肝細胞がんにおける細胞生存率をテストしました。L. plantarum ONU 12、L. plantarum ONU 355は、107 CFU/ウェルと 108 CFU/ウェルの 2 つの最高濃度で 肝細胞がん細胞の増殖を阻害し、これはヒト血漿濃度 (13.8 μM) でのソラフェニブによる効果よりもさらに強かった (補足図 S7A)。一方、Lacticaseibacillus casei ATCC 393は、108 CFU/ウェルの濃度でソラフェニブ 13.8 μM と同様の効果を示しました (補足図 S7A)。併用療法の場合、ソラフェニブ6.9または3.45μMを投与した3つの株はすべて、ソラフェニブ13.8μMよりも効率的に肝細胞がんの増殖を阻害した(補足図S7B)。 |
| L. plantarum ONU 12、L. plantarum ONU 355、およびLacticaseibacillus casei ATCC 393の超音波抽出物を48時間で単独療法または併用療法として投与したところ、ヒト血漿濃度13.8μMで生菌懸濁液やソラフェニブよりも優れた効果を示した(補足図S7C、D)。 |
| 3.2.3. L. plantarum ONU 12 の生菌懸濁液を単独療法およびソラフェニブと併用すると、肝細胞がん細胞株で細胞老化が誘発される |
| さらに、乳酸菌単独またはソラフェニブとの併用で細胞老化が誘発されるかどうかをテストすることを目的とし、処理後の 肝細胞がん細胞株で老化関連β-ガラクトシダーゼアッセイ(SA-β-gal)染色を実施しました。L. plantarum ONU 12の生菌懸濁液は、108、107、106 CFU/ウェルの濃度で 肝細胞がん細胞に老化を誘発し、また 6.9 μM のソラフェニブとの併用でも老化を誘発しました (補足図 S8)。検出された老化反応は、さまざまな濃度のソラフェニブで検出されたものと同等でした。同様に、ソラフェニブとの併用療法でも老化が誘発されました (補足図 S8)。老化細胞は、すべてのネガティブ コントロール (PBS、超音波処理 PBS、DMEM) には存在しませんでした。 |
| 4. 考察 |
| 本研究では、L. plantarum の 2 種類の菌株L. plantarum ONU 12とL. plantarum ONU 355の 2 つの主要なタイプの 原発性肝がん、肝細胞がん、胆管がんに対する抗がん効果を in vitro で調査しました。菌株は、生菌懸濁液、超音波処理抽出物、または加熱殺菌懸濁液として投与されました。治療は、それぞれ標準治療薬であるソラフェニブとゲムシタビンとの単独療法または併用療法として使用され、両化学療法薬の血漿濃度が対照として使用されました。得られた結果は、古典的なプロバイオティクス菌株 L. casei (Lc 393) と比較されました。 |
| この研究の結果は、肝細胞がんおよび胆管がん細胞株に対する L. plantarum ONU 12、L. plantarum ONU 355、およびLacticaseibacillus casei ATCC 393の超音波処理抽出物と生菌懸濁液の顕著な阻害効果を明らかにし、代替療法または補完療法としての潜在的な治療応用について貴重な洞察を提供します。私たちの調査の クリスタルバイオレット染色アッセイ(CVSA)結果では、108 CFU/mL の濃度の L. plantarum ONU 12、L. plantarum ONU 355、およびLacticaseibacillus casei ATCC 393の生菌懸濁液は、それぞれのヒト血漿濃度のゲムシタビンとソラフェニブよりも、48 時間の処理後に胆管がんと肝細胞がんの両方の増殖を阻害できることが示されました。また、311 μg/mL の L. plantarum ONU 12、336 μg/mL の L. plantarum ONU 355、および 383 μg/mL と 191.5 μg/mL のLacticaseibacillus casei ATCC 393の超音波処理抽出物は、胆管がんの増殖を阻害することができました。 肝細胞がんの場合、3 つの菌株すべての超音波処理抽出物は、線維芽細胞に同様の効果を及ぼしながらも、肝細胞がんの増殖を阻害することができました。 |
| 重要なのは、私たちの結果で証明されているように、L. plantarum の超音波処理抽出物の方が生きた懸濁液よりも効果的だったことです。L. plantarum の超音波処理抽出物の 肝細胞がんおよび 胆管がんに対する影響は濃度に依存し、高濃度では細胞増殖が阻害され、早期アポトーシスにつながる可能性があります。ただし、低濃度では有効性が制限されます。これらの結果は、がん細胞の増殖を阻害するために不可欠な L. plantarum 超音波処理抽出物の最適濃度を示唆しています。超音波処理抽出物には、細胞壁、ペプチドグリカン、およびその他のいくつかのタンパク質を含むさまざまな成分の複雑な混合物が含まれています (Han et al.、2013)。超音波処理抽出物のさまざまな成分がさまざまな疾患に及ぼす潜在的な影響に関するさまざまな研究が報告されていますが、がん細胞への影響については大規模な研究は行われていません。 L. reuteri の超音波処理抽出物は、PI3K/AKT/β-カテニン/TGFβ1 経路を調節することで創傷治癒プロセスを促進することが報告されています (Han et al., 2019)。同様に、超音波処理した Lactococcus lactis subsp. lactis の細胞質抽出物およびその細胞壁に存在するタンパク質であるナイシンは、SW480 結腸がん細胞株でサイクリン D1 を減少させることで抗増殖および抗腫瘍効果を発揮します (Hosseini et al., 2020)。肝細胞がんおよび胆管がんに対する乳酸菌の超音波処理抽出物の阻害効力は、上記で強調した他の過去の研究と相関し、一致しているため、大げさなものではありません。今後は、液体クロマトグラフィーとタンデム質量分析法を使用して超音波処理抽出物の組成を分画し、胆管がんおよび 肝細胞がん細胞株に対する個々の成分の効果をテストして、最も強力な代謝物を特定する予定です。 |
| 加熱殺菌した懸濁液が肝細胞がんおよび胆管がん細胞株の増殖を阻害する能力をまったく持たないことは、まったく予想外のことでした。加熱殺菌した懸濁液には、がん細胞の増殖を許したり、促進したりする可能性のある成長因子が含まれている可能性があります。加熱殺菌した懸濁液の成分には、細胞壁成分、リポテイコ酸、ペプチドグリカン、表面タンパク質、多糖類などが含まれます (Aiba et al., 2017)。私たちの結果とは対照的に、L. paracasei から抽出したペプチドグリカン全体は、プロアポトーシス遺伝子をアップレギュレーションし、抗アポトーシス遺伝子をダウンレギュレーションすることで、大腸がん HT-29 細胞に対する細胞毒性活性を持つことが報告されています (Wang et al., 2018)。加熱殺菌したL. reuteriとL. caseiの抗腫瘍効果をヒト大腸がんで調べた別の研究では、抽出物はRKO細胞を持つ異種移植モデルに経口投与した場合と比較して、in vitroで中程度の細胞傷害性およびアポトーシス効果があることが証明されました(Kim et al., 2022)。また、細菌細胞は95°Cで1時間という私たちの治療法とは異なり、100°Cで30分間加熱殺菌されました。これが得られた結果の差異に影響を与えた可能性があります。私たちのin vitroデータは、Si et al.のin vivoデータによってさらに裏付けられており、加熱殺菌したL. rhamnosusの単独療法の経口投与では、MC38腫瘍を持つマウスの腫瘍体積を減少させることができず、抗PD-1抗体治療の併用による有効性の改善さえも見られなかったことが示されています(Si et al., 2022)。これらはすべて、加熱殺菌懸濁液の抗がん特性が、乳酸菌の種、投与経路、加熱不活性化の条件、および細胞株の違いによって異なることを示唆しています。 |
| さらに、我々の結果では、細胞増殖アッセイ/細胞カウントキット-8 (CCK-8)アッセイにより、生菌懸濁液および超音波処理したL. plantarum ONU 12、L. plantarum ONU 355、およびLacticaseibacillus casei ATCC 393と0.1μMゲムシタビンの併用療法は、それらの個別療法およびゲムシタビン単独療法よりも胆管がんに対する明らかな阻害効果を示すことが明確に示されました。同様に、L. plantarum ONU 12、L. plantarum ONU 355、およびLacticaseibacillus casei ATCC 393超音波処理抽出物は、主にソラフェニブ単独療法よりも阻害効果を発揮することができました。この結果は、併用療法はより有益であり、低濃度での使用を可能にするため、標準的な化学療法の副作用を軽減するという我々の仮説を証明しています。L. plantarum ONU 12、L. plantarum ONU 355、およびLacticaseibacillus casei ATCC 393の超音波処理抽出物または生菌懸濁液は、ソラフェニブの副作用を軽減するための補完療法として使用できます。標準的な化学療法の投与量を減らして最適な効果を確保する併用療法は、がん治療における有望なアプローチとなるでしょう。肝細胞がんの標準的な化学療法薬であるソラフェニブには、手足皮膚反応、発疹、高血圧、下痢、疲労、食欲不振、血小板減少症、脱毛症、ビリルビン上昇など、多くの副作用があります (Cheng et al.,2009 年、Llovet et al.,2008 年)。一方、胆管がん の標準的な化学療法薬であるゲムシタビンも、骨髄抑制、肺毒性、毛細血管漏出症候群などの副作用を伴います (Mertz ら、2019 年、Turco et al.,2015 年)。これまでの研究では、腸内細菌叢ががん化学療法の有効性と毒性プロファイルを調整する能力を持っているという報告があります。L. rhamnosus GGサプリメントで治療した後の腸内細菌叢は、乳酸菌関連の毒性なしに、大腸がん関連下痢と腹部不快感の化学療法を軽減することができました(Alexander et al.,2017)。また、Rodriguez-Arrastia et al.による別の研究では、主にLactobacillus属のプロバイオティクスサプリメントが、腫瘍学患者のさまざまな治療によって引き起こされる関連副作用に対処する上で重要であることを強調しました(Rodriguez-Arrastia et al.、2021)。また、Rodriguez-Arrastia et al.研究ではこの仮説が実証されており、併用療法は標準的な化学療法と乳酸菌の両方の治療効果を組み合わせているため、単独療法よりも効果が高いことが示唆されています(Rodriguez-Arrastia et al.、2021)。 |
| さらに、私たちの研究結果に基づき、L. plantarum の生菌懸濁液と超音波処理抽出物が細胞老化を誘発できることも確認できました。細胞老化は、さまざまな内因性および外因性要因によって引き起こされる細胞周期からの安定した離脱ですが (Campisi および d'Adda di Fagagna、2007)、私たちの研究では L. plantarum の治療効果によって引き起こされました。プロバイオティクス、特にLactobacillus属の細菌による細胞老化の調整は、その抗炎症性、抗酸化性、抗免疫老化特性により、老化と長寿の観点から広く研究されてきました (Sharma and Padwad、2020)。しかし、プロバイオティクスとその代謝物ががん細胞で細胞老化を誘発するという証拠を示した科学文献はありません。私たちの研究は、それを初めて示しています。老化細胞は代謝的に生存可能で、無期限に存続する可能性があり、通常は細胞周期の G1 期または G2/M 期で停止します (Campisi および d'Adda di Fagagna、2007)。興味深いことに、L. plantarum ONU 12の生菌懸濁液と超音波処理抽出物はすべての濃度で 胆管がん細胞に老化を誘導でき、L. plantarum ONU 12の生菌懸濁液は 肝細胞がん細胞に老化を誘導できました。しかし、細胞老化誘導は、胆管がんおよび 肝細胞がん細胞の両方で 107 CFU/ウェルの L. plantarum ONU 12生菌懸濁液単独療法、胆管がん細胞で 77.75 μg/mL の L. plantarum ONU 12超音波処理抽出物単独療法、および 胆管がん細胞で 106 CFU/mL のL. plantarum ONU 12生菌懸濁液と 0.05 μM ゲムシタビンの併用療法でより明白でした。低濃度のL. plantarum ONU 12が老化を誘発するという観察結果は、治療誘導性老化の潜在的な利点を示唆しています。研究では、老化細胞が周囲の腫瘍細胞の増殖を阻害する可能性のあるサイトカインや因子の発現を促進する可能性があることが示唆されています (Di et al., 2008; Kang et al., 2011; Xue et al., 2007)。最近の研究データでは、老化細胞は生体内で長期にわたって持続するため免疫原性が強く、老化関連分泌表現型として知られる炎症誘発性セクレトームの形成を通じて、インターフェロンシグナル伝達、抗原提示細胞、CD8 T 細胞、および MHC クラス I 分子を活性化することも実証されています (Eggert et al., 2016; Marin et al., 2023; Yevsa et al., 2012)。 |
| Lactobacillus属菌は免疫系を著しく調節し、制御します (Parada Venegas et al., 2019; Wiese-Szadkowska et al., 2019)。T リンパ球の増殖を促進し、ナチュラル キラー細胞の殺傷能力を強化し (Meng et al., 2018)、マクロファージの貪食能力を高め (Jung et al., 2015)、B 細胞の成熟を促進します (Garcia-Castillo et al., 2019)。免疫系の調節は、過度の炎症を防ぎ、感染症と闘う上で不可欠です (Iddir et al., 2020)。さらに、乳酸菌は、上皮透過電気抵抗の増加、IL-8 の透過性の下方制御、細胞外シグナル制御キナーゼおよび c-jun N 末端キナーゼの調節によって病原細菌によって引き起こされる損傷から保護し、腸上皮バリアの完全性を維持するのにも役立ちます (Yu et al.、2015)。 前述の乳酸菌の健康上の利点に関しては、原発性肝がんにおけるその抗がん効果を研究することが不可欠です。 |
| 乳酸菌の抗がん作用は過去にも研究されてきました。L. plantarum は酸化ストレスを軽減し、がんの発生と進行を防ぐことが報告されています (Kullisaar et al., 2002; Wu et al., 2021) が、原発性肝がんにおけるその有効性については包括的な理解が必要です。最も重要なことは、私たちの研究により、原発性肝がん細胞の増殖を阻害する乳酸菌の作用機序がさらに解明されたことです。胆管がん細胞における乳酸菌の生菌懸濁液と超音波処理抽出物の阻害能力の背後にある主な機序は、早期アポトーシスの誘導であることを証明できました。私たちの研究結果と一致して、乳がん、大腸がん、肝臓がん、白血病がん細胞株に対する L. plantarum 処理の細胞毒性効果は、アポトーシスの誘導によって媒介されていました (Chuah et al., 2019)。最近、L. paracasei X12の生菌懸濁液が体重減少を防ぎ、腫瘍容積を減少させることで大腸がんに対する腫瘍抑制効果があることが実証されました。DMH誘導ラットモデルにおいて、増殖誘導因子および抗アポトーシス遺伝子であるBcl-3、Jak-1、Akt-1遺伝子を下方制御し、Bax、Cas-3などのプロアポトーシス遺伝子を上方制御しました(Jam et al.、2020)。別の研究では、大腸がん細胞と共培養したL. caseiの生菌懸濁液が、生存率の低下とアポトーシスの誘導をもたらすことが報告されました(Tiptiri-Kourpeti et al.、2016)。これは、13日間毎日経口投与した後、生体内でさらに確認されました(Tiptiri-Kourpeti et al.、2016)。私たちのデータと一致して、研究ではL. plantarumがアポトーシスを誘導し、がん細胞の転移と浸潤を防ぐことが実証されています(Belury、2002年、Choi et al.、2006年)。さらに、マイクロバイオームの質と腫瘍の進行の間には確立された相関関係があります(Dzutsev et al.、2017年)。腸内細菌叢の組成の不均衡またはディスバイオーシスは、代謝障害や病原菌の増加による炎症を引き起こし、続いて慢性肝疾患や肝細胞がんや胆管がんを含む原発性肝がんへの進行につながるため、肝臓の健康に直接的な悪影響を及ぼします(Chen et al.、2020年)。L. plantarumは腸内マイクロバイオームを改善し、潜在的に病原性のある細菌の増殖を抑制することが示されています(Hong et al.、2021年)。健康な腸内細菌叢の構成を回復させることで、L. plantarum は腸内細菌叢の乱れによる肝臓がんの進行リスクを軽減できる可能性があります (Yu and Schwabe, 2017)。また、L. acidophilus 606 から分離された可溶性多糖類が、アポトーシス誘導と抗酸化活性に起因する HT-29 がん細胞の死をもたらすことも実証されています (Choi et al., 2006)。さらに、L. acidophilus は吉草酸を生成することで、代謝機能障害に関連する脂肪肝悪性疾患を抑制することが示されています (Lau et al., 2024)。同様に、L. plantarum 懸濁液を投与すると、ミトコンドリアのアポトーシス経路が活性化され、大腸 C26 がん細胞の死につながりました (Sharifi et al., 2022)。マウスモデルにおける高転移性および低転移性のヒト悪性黒色腫細胞で試験されたL. plantarumの無細胞抽出物は、Bax/Bcl-2比を調節することによって内因性アポトーシスを誘導した(Park et al., 2020)。また、Sun et al.は、L. plantarumの粗エキソ多糖がプロアポトーシスタンパク質レベルを上昇させることによってヒト大腸がん株に対する阻害効果を有することを証明した(Sun et al., 2021)。最後に、乳酸菌は、炎症性サイトカインであるIL-17およびその他の血管新生因子を減少させ、マウスの肝細胞がん増殖を40%阻害することによって強力な抗腫瘍効果を引き起こすことも実証された(Li et al., 2016)。また、乳酸菌摂取がmiRNAの刺激および発現を介してマウスに誘発される大腸がんおよび肝細胞がんの阻害においてプラスの役割を果たすことが説明された(Heydari et al., 2019)。 |
| 要約すると、L. plantarum ONU 12と L. plantarum ONU 355の生菌懸濁液と超音波処理抽出物は、用量依存的に胆管がんと 肝細胞がんの両方で強力な阻害特性を示し、この研究で対照として使用された古典的なプロバイオティクス株 Lacticaseibacillus casei ATCC 393と同等か、それ以上の有効性を示しました。同時に、L. plantarum ONU 12とL. plantarum ONU 355は、Lacticaseibacillus casei ATCC 393よりも線維芽細胞に対する毒性効果が低いことが示されました。驚くべきことに、L. plantarum ONU 12、L. plantarum ONU 355、およびLacticaseibacillus casei ATCC 393の加熱殺菌懸濁液は、肝細胞がんと胆管がんに阻害効果を示さなかった。さらに、L. plantarum ONU 12、L. plantarum ONU 355、Lacticaseibacillus casei ATCC 393の生菌懸濁液または超音波処理抽出物と標準化学療法剤 (肝細胞がんにはソラフェニブ、胆管がんにはゲムシタビン) の併用は、ソラフェニブとゲムシタビンの単独療法およびヒト血漿濃度と比較して、相乗的な阻害効果を示しました。併用療法により、標準化学療法剤の濃度を低下させることができ、その結果、副作用が軽減されます。また、L. plantarum ONU 12は両方のがん細胞株で細胞老化を誘発し、免疫細胞の活性化につながる可能性があることも示しました。乳酸菌の作用機序は、胆管がんにおける早期アポトーシスの誘発に関連していることが示されました。 胆管がんの最も有望な治療候補は、108 CFU/mL の濃度のL. plantarum ONU 12および L. plantarum ONU 355の生菌懸濁液、0.1 μM の L. plantarum ONU 12生菌懸濁液とゲムシタビンの併用療法、およびそれぞれ 311 μg/mL と 336 μg/mL のL. plantarum ONU 12および L. plantarum ONU 355の超音波処理抽出物です。肝細胞がんの最も有望な治療法は、178 μg/mL の L. plantarum ONU 355および Lacticaseibacillus casei ATCC 393の超音波処理抽出物と、6.9 μM のソラフェニブとの併用です。この治療法開発研究を進め、前臨床モデルを使用して 肝細胞がんおよび 胆管がんに対する L. plantarumの単独療法または併用療法レジメンを適用した場合の安全性、有効性、および免疫応答を生体内でさらに調査するには、より集中的な研究が必要です。 |
| 5. 結論 |
| 試験したLactobacillus菌株、L. plantarum ONU 12と L. plantarum ONU 355 は、どちらも胆管がん 肝細胞がん細胞株に対して in vitro で強力な抗がん作用を示すことがわかりました。これらの菌株を従来の化学療法薬と併用することで、ゲムシタビンとソラフェニブの濃度を大幅に低下させることができました。この結果は、この阻害効果の背後にあるメカニズムには、早期アポトーシスと細胞老化の誘導が関与していることを示唆しています。ただし、L. plantarum 菌株の有効性と、自家肝細胞がんおよび胆管がんモデルにおけるその作用メカニズムを評価するには、in vivo 研究が必要です。相乗効果を示し、毒性のある化学療法薬の投与量を減らす併用療法は、肝細胞がんおよび胆管がん患者にとって大きな期待が寄せられています。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Front Microbiol. 2024 Nov 11;15:1451170.に掲載されたLactiplantibacillus plantarum inhibited the growth of primary liver cancer by inducing early apoptosis and senescence, in vitro. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


