ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(植物性ヨーグルト、プランタルム菌の科学:研究の最前線) |
正常から軽度の高コレステロール血症の成人における Lactobacillus plantarum ECGC 13110402のコレステロール低下効果の生体内評価 |
Adele Costabile et al., PLOS ONE | https://doi.org/10.1371/journal.pone.0187964 December 11, 2017. |
|
|
| 要約 |
冠状動脈性心疾患(CHD)は先進国における死亡および障害の主な原因の1つであり、高血中コレステロールは確立された危険因子です。原発性高コレステロール血症の患者における総血漿コレステロールの低下は、冠状動脈性心疾患の発症率を低下させる可能性があります。本研究では、高胆汁酸塩加水分解酵素活性を持つ株であるLactobacillus plantarum ECGC 13110402のコレステロール低下能力を、正常から軽度の高コレステロール血症の成人49名で調査しました。主な有効な結果には、介入の安全性と忍容性を確立するための血中脂質(総コレステロール(TC)、低密度リポタンパク質(LDL-C)、高密度リポタンパク質(HDL-C)、トリアシルグリセリド(TAG)、炎症性バイオマーカー、胃腸の副作用の発生/重症度への影響が含まれました。副次的結果には、血圧、免疫バイオマーカー、腸内細菌叢の特性、メタボノームの変化が含まれます。この研究は、並行、二重盲検、プラセボ対照、ランダム化設計で実施され、アクティブグループは、2x109 CFU のカプセル化された Lactobacillus plantarum ECGC 13110402 を 1 日 2 回摂取しました。アクティブ治療を毎日摂取すると、0±12 週間の期間中に、ベースライン総コレステロール<5mM のボランティアで LDL-コレステロール が統計的に有意に減少しました(13.9%、P = 0.030)。 0±6週の期間にベースライン総コレステロール6mMのボランティアで総コレステロールが増加し(37.6%、P = 0.045)、6±12週の期間に60歳以上の人口でトリアシルグリセリドが大幅に減少し(53.9%、P = 0.030)、HDL-コレステロールが増加しました(14.7%、P = 0.007)。また、6~12週の期間にアクティブグループ全体で収縮期血圧が統計的に有意に低下したことも観察されました(6.6%、P = 0.003)。研究期間中、胃腸機能や副作用への影響は観察されませんでした。血液や尿のメタボノミクス分析と同様に、糞便のメタゲノミクスでもアクティブまたはプラセボの摂取による有意な変化は見られませんでした。この研究の結果は、Lactobacillus plantarum ECGC 13110402 が、心血管疾患リスクを軽減するための既存の治療法の代替または補助として使用できる、忍容性の高い天然プロバイオティクスであることを示唆しています。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.材料と方法 |
| 2.1.研究対象集団の選択と特徴 |
| 2.2.研究期間中の食事と投薬に関する要件 |
| 2.2.1. Lactobacillus plantarum ECGC 13110402 の選択 |
| 2.2.2.研究デザイン |
| 2.2.3.人体計測値と血圧 |
| 2.2.4.血液、尿、便のサンプル採取 |
| 2.2.5.血漿トリアシルグリセリド、総コレステロール、HDL-コレステロール濃度の測定 |
| 2.2.6.炎症/免疫バイオマーカー |
| 2.2.7.尿および血清サンプルの 1H 核磁気共鳴分光法 |
| 2.2.8.糞便からの微生物DNA抽出 |
| 2.2.9.次世代シーケンシング (NGS) とバイオインフォマティクス解析による 16S rRNA 遺伝子の増幅 |
| 2.3.統計分析 |
| 3.結果 |
| 3.1. Lactobacillus plantarum ECGC 13110402 の選択 |
| 3.2. ベースライン人口統計変数とボランティアの層別化 |
| 3.3. 人体計測データと血圧 |
| 3.4. 脂質パラメータ |
| 3.4.1総コレステロール (TC) |
| 3.4.2高密度リポタンパク質コレステロール (HDL-C) |
| 3.4.3.低密度リポタンパク質コレステロール (LDL-C) |
| 3.4.4トリアシルグリセリド(TAG) |
| 3.4.5炎症/免疫バイオマーカー |
| 3.4.6.16S rDNA 次世代シーケンシングの結果 |
| 3.4.7.尿および血清代謝物の全体的分析 |
| 3.4.8.胃腸症状 |
| 4.考察 |
| 5.結論 |
本文 |
| 1.はじめに |
| 冠動脈性心疾患は、先進国における死亡および障害の主な原因の1つです[1]。世界保健機関(WHO)は、2020年までに全死亡者の最大40%が心血管疾患に関連すると予測しています。冠動脈性心疾患の最も一般的な形態は冠動脈疾患(CAD)であり、WHOの報告によると、現在、世界で最大の死亡原因であり、年間725万人が死亡しています。疫学的研究と臨床研究の結果は、主に低密度リポタンパク質分画(LDL-C)を反映する血清総コレステロール値の上昇と冠動脈性心疾患発症リスクとの間に正の相関関係があることを示しています[2]。LDL-コレステロール濃度の上昇と冠動脈疾患の相対リスクの間には対数線形関係があることが証拠によって示されています。コレステロール低下アプローチに関する疫学的研究と臨床試験では、この関係が確認されており、ほぼ同一の関連パターンが示されています。そのため、心血管疾患のリスクを減らすために、血清コレステロールやその他の血中脂質[3]に対処することに関心が寄せられており、多くの国内外のガイドラインでは、脂質レベル管理の主な目標としてLDL-コレステロールが挙げられています。 |
| 冠状動脈性心疾患予防のための食事療法は第一選択の治療ですが、低コレステロール/低飽和脂肪食の遵守を基本としており、効果的である可能性はあるものの、長期的に維持するのは難しく、時間の経過とともに効力が低下します [4,5]。コレステロール管理のための薬理学的アプローチには、フィブリン酸誘導体 (フィブラート)、ニコチン酸、胆汁酸吸着剤 (BAS)、エストロゲン補充療法、スタチンなどがあります。スタチン療法は現在、コレステロール管理に最も一般的に使用されているアプローチであり、初回または再発性冠状動脈性心疾患の発生率を低下させることが示されていますが、多くの患者がスタチン単独療法を継続できず、治療開始 2 年後に一次性 (25.4%)、慢性 (36.1%)、急性冠動脈疾患 (40.1%) の非遵守率を示しています [6]。その結果、患者の要求と臨床実践の間にギャップが生じ、現在のアプローチの限界により、血中コレステロールプロファイルを改善するための非薬物療法への関心が高まっています。これには、副作用のリスクがほとんどないかまったくない、冠状動脈性心疾患患者の転帰を改善する可能性のある作用機序を持つプロバイオティクスが含まれます。 |
| いくつかの研究では、プロバイオティクスと発酵乳製品がコレステロール管理に有効であることが示されています。しかし、いくつかの研究では、ほとんど効果がないか、まったく効果がないと報告されています。これらの矛盾した結果は、主に研究デザインの不均一性と特定の微生物株の有効性のばらつきに起因しています [7]。これは、多くの研究で使用されているプロバイオティクスの選択に科学的根拠が欠けていることを反映していることがよくあります。プロバイオティクスの使用が一般的な福祉から実証可能な特定の健康上の利点に移行するにつれて、信頼できる微生物株とその作用機序を特定する必要性が高まっています。腸内細菌叢 (GM) が腸内での脂質吸収の調節に重要な役割を果たしていることはよく認識されているため、プロバイオティクスが微生物生態系の全体的な構造に与える影響を調査することが重要です。プロバイオティクスによるコレステロール除去のメカニズムはいくつか考えられます。コレステロールの細胞表面への吸着、コレステロールの細胞膜への同化、コレステロール還元酵素の活性、胆汁酸塩加水分解酵素 (BSH) による胆汁酸の脱抱合などです [8,9]。関心が高まっている分野の 1 つは、胆汁酸塩加水分解酵素プロバイオティクスがコレステロールを減らす可能性です。胆汁酸塩加水分解酵素活性プロバイオティクスは、腔内の胆汁酸塩脱抱合を促進し、循環する脱抱合胆汁酸のレベルを上昇させることが示されています。脱抱合されると、胆汁酸は溶解性が低下し、腸で吸収されず糞便中に排泄されます。その後、コレステロールは恒常性反応で胆汁酸の新規合成に使用され、血清コレステロールが低下します [10]。 1197件の文献を対象とした系統的レビュー[11]では、肥満手術後の肥満の代謝合併症を軽減する上での胆汁酸の役割を検討し、脂質とコレステロールの代謝における胆汁酸の役割を裏付ける十分な証拠があると結論付けました。これは、胆汁酸塩加水分解酵素産生プロバイオティクスを使用した胆汁酸の調節が、血中脂質レベルを修正し、心血管リスクを軽減するための安全で自然なアプローチとなる可能性があることを示唆しています。 |
| コレステロールを低下させる能力を持つ菌株を特定するために、系統学的に多様な微生物株の体系的なスクリーニングが行われました。Lactobacillus plantarum ECGC 13110402は、in vitro 胆汁酸塩加水分解酵素活性が高く、コレステロール除去能力、胃酸、膵酸、胆汁酸に対する耐性、凍結乾燥後の生存率が高いことから選択されました。このヒトボランティア研究の目的は、49 人の健康な正常から軽度の高コレステロール血症の成人 (30±65 歳) におけるLactobacillus plantarum ECGC 13110402 の耐性とコレステロール低下能力の程度を確立することでした。主な有効性の結果には、介入の安全性と忍容性を確立するための、血中脂質(総コレステロール:TC、低密度リポタンパク質:LDL-C、高密度リポタンパク質:HDL-C、トリアシルグリセリド:TAG)炎症性バイオマーカーおよび胃腸副作用の発生/重症度への影響が含まれました。副次的結果には、血圧、免疫バイオマーカー、腸内細菌叢の特性、およびメタボノームの変化が含まれます。12 週間の介入は、並行二重盲検プラセボ対照ランダム化設計で実施され、4 週間のウォッシュアウト期間で終了しました。 |
| 2.材料と方法 |
| 2.1.研究対象集団の選択と特徴 |
| この研究は臨床試験として登録され (clinical trials.gov ID: NCT03263104)、適正臨床試験基準 (GCP) に従ったヘルシンキ宣言に従って実施されました。 この研究はヘルシンキ宣言に従って実施され、リーディング大学研究倫理委員会 (UREC 15/06、2015 年 1 月 28 日) によって承認されました。 選択開始前に、すべての被験者から書面によるインフォームド コンセントを得ました。包含基準は次のとおりでした: 18 歳から 50 歳の男性と女性、BMI 18.5 ~ 29.9 kg/m2、総コレステロール (TC) 200 ~ 300 mg/dl (5.16 ~ 7.64 mmol/L)。 一般的な健康状態は、研究前の医療質問票を使用して評価され、以下のいずれかの条件を満たす被験者候補は除外されました。慢性的な胃腸障害(慢性便秘、下痢、過敏性腸症候群を含む)、糖尿病、貧血を患っていること、胃腸管に作用する長期の薬剤の服用、心血管疾患の治療、またはその他の長期の薬剤の服用が必要であること、高血中コレステロールまたはコレステロール低下薬/機能性食品の使用、薬物またはアルコールの乱用歴、女性で週14単位、男性で週21単位を超えるアルコール摂取、薬剤または食品に対するアレルギーがある人、喫煙者、減量ダイエット中の人。研究開始から6か月以内に妊娠を計画している、授乳中である、または過去6か月以内に出産した女性も除外されました。除外基準には、研究開始前の 6 か月以内に抗生物質を使用したこと、プロバイオティクス、プレバイオティクス、または下剤の研究に参加したこと、または研究開始の 4 週間前に実験薬を摂取したことが含まれていました。 2015 年 1 月から 2015 年 2 月の間に、ヒュー・シンクレア人間栄養ユニットのボランティア データベースと地元コミュニティ内の広告を通じて、リーディング大学とその周辺地域から 70 人の健康なボランティア候補 (年齢 18 歳から 50 歳) に連絡が取られました。 最初に回答した 68 人のうち 60 人がスクリーニングされ、49 人のボランティアが採用されました。46 人の参加者が研究を完了しましたが、3 人が個人的な事情で脱落しました (図 1)。 |
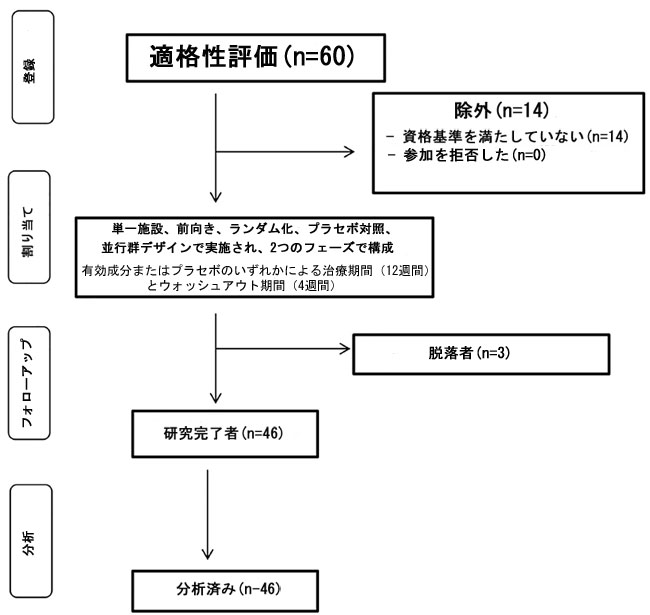 |
| 図 1. 介入を通じた研究参加者の流れ |
| 参加者(性別:女性 34 人、男性 15 人、平均年齢:51.5 歳(男性 50.31 歳、女性 52.70 歳)、範囲 30 ~ 65 歳、BMI(体格指数):男性 25.68、女性 27.19、総平均体重 26.43 kg/m2、範囲 19.6 ~ 40.2 kg/m2)は、プラセボグループとアクティブグループの 2 つの治療グループにランダムに割り当てられました。Excel ベースの共変量適応ランダム化プログラムを使用して、年齢、性別、BMI で層別化されたボランティアをランダムに 2 つの介入グループに分けました。両方の治療は製造業者によって盲検化され、同一のブリスター包装カプセルで提供されました。この研究は、血中脂質について実施された人間のボランティアに対する以前の介入研究のデータに基づき、総コレステロール (TC) の平均 (±SD) 対数変化 0.45 ± 0.4 に基づいて、80% の統計的検出力 (MGH Biostatistics Hedwig Software) を提供するようにパワーアップされました。 これらの計算を考慮すると、差異を検出するには 49 人の参加者 (15% の脱落を許容) が必要になります。 両側 0.05 有意水準での治療差異。 |
| 2.2.研究期間中の食事と投薬に関する要件 |
| 以下の食品または物質の摂取は許可されませんでした: プレバイオティクスサプリメント、プロバイオティクス、スタチン、胃腸運動に作用する薬剤、抗生物質治療、またはあらゆる種類の下剤。服用した薬剤はすべて日記に記録されました。 ボランティアは、試験期間中、通常の食事や水分摂取を変えないように指示されました。 |
| 2.2.1. Lactobacillus plantarum ECGC 13110402 の選択 |
| 系統学的に多様な 353 種のLactobacillus菌株の胆汁酸塩加水分解酵素活性と胆汁耐性を、96 ウェル プレート上で嫌気条件下で測定した。 胆汁酸塩溶液 (各 5μl、(w/v): グリコデオキシコール酸 0.5%、タウロデオキシコール酸 0.5%、オキソガリン 0.5%、オキソガリン 2.0% を含む) を各ウェルにスポットし、24 時間後と 72 時間後に各試験の増殖を評価した。 45 種の菌株で有望な結果が得られ、その胆汁酸塩加水分解酵素活性は従来のプレート アッセイを使用して定量化された。 最も高い活性を示した 24 種のLactobacillu菌株を選択して、コレステロール同化アッセイを行った。 20 mg/l コレステロールと 0.4% (w/v) のオキソガリンを含む MRS 培地を使用して、Lactobacillus菌株を 37℃ で 24 時間嫌気的に培養しました。その後、Lactobacillus細胞を遠心分離により培地から分離し、培地を次の処理まで -25℃ で凍結しました。 サンプルを解凍した後、コレステロールを室温で脂質抽出により培地から分離しました。 上清 (3 ml) を 3 ml のエーテルヘプタン (1:1、v/v) と 1 ml のエタノール (99.8%) で激しく振とうし、3000 g で 5 分間遠心分離しました。 エーテル/ヘプタンの上層をガラス管に集め、1.5 ml のエーテル/ヘプタンと 0.5 ml のエタノールで抽出を 2 回繰り返しました。 集めた脂質抽出チューブの内容物は、窒素下で約 40℃ で乾燥されました。 脂肪成分は、超音波浴で 5 分間ヘプタンに溶解されました。 少量の乾燥硫酸ナトリウムが溶液に加えられ、存在する水分が結合されました。 遠心分離後、1.0 μl が炎イオン化検出器を備えたキャピラリー GC カラム (Agilent: VF-5ht UltiMetal 30 m x 0.32mm ID DF = 0.10μm 2m x 0.53mm ID 保持ギャップを含む) に注入されました。コレステロール含有量の計算は、ヘプタン中のコレステロール標準溶液を使用して行われました。 |
| 2.2.2.研究デザイン |
| この研究は、単一施設、前向き、ランダム化、プラセボ対照、並行群デザインで実施され、2つのフェーズで構成されました。有効成分またはプラセボのいずれかによる治療期間(12週間)とウォッシュアウト期間(4週間)です。 包含基準の遵守を確認するためのスクリーニング訪問の後、研究にはベースライン、中間点、エンドポイント(それぞれ6週目と12週目)、ウォッシュアウト訪問(16週目)が含まれていました。 参加者は、朝食と夕食の前に1日2回製品を摂取するよう求められ、試験期間中、通常の食事や身体活動を変えないようにアドバイスされました。 各参加者は、Lactobacillus plantarum ECGC 13110402 を 2x109 CFU (0.1 g) の濃度でカプセル形式 (植物性) で 1 日 2 回摂取し、充填キャリア (0.12 g、30% w/v マルトデキストリンおよび 5% w/v スクロース) を加えたもの、またはプラセボ (0.12 g、30% w/v マルトデキストリンおよび 5% w/v スクロース) を摂取するよう求められました。 参加者全員に、研究期間全体を通じて製品の一貫性を確保するための製品保管条件についてアドバイスしました。 プロバイオティクスは、CSL (Centro Sperimentale del Latte, Lodi,Italy) によって製造されました。 有効成分とプラセボ成分は、Nutrilinea srl (Gallarate, Italy) によってブレンド、カプセル化され、ブリスターパックにブラインド包装されました。 |
| 2.2.3.人体計測値と血圧 |
| 研究参加者の人体計測値は、すべての訪問時に測定されました。これには、体重、BMI (Body Mass Index)、体脂肪率 (Tanita BC-418 セグメント体組成計、Scalesmart UK) が含まれます。さらに、身長とウエスト周囲径も測定されました。血圧値は、電気血圧計 (CONTEC08E、UK) を使用して、各訪問時に 3 回測定されました。 |
| 2.2.4.血液、尿、便のサンプル採取 |
| すべての訪問で、排泄されたばかりの糞便サンプルと初回通過尿が採取され、さらに分析するまで -80℃で保管されました。各ボランティアについて、血液サンプルは訓練を受けた採血技師によって、空腹時トリアシルグリセリド、総コレステロール、HDL-コレステロール分析用に10ml EDTAチューブ1本(BD Vacutainer EDTAチューブ、BD、Cowley, Oxon, UK)に、空腹時グルコース分析用に2mlフッ化物/シュウ酸チューブ1本(BD Vacutainer フッ化物/シュウ酸チューブ)に採取されました。採取後、すべてのサンプルは遠心分離まで氷上に保管されました。血漿サンプルは1700gで10分間遠心分離して回収し、1.5mlマイクロ遠心チューブに分注して採取後1時間以内に -20℃で凍結しました。血漿サンプルは分析前に解凍され、1500 g で 5 分間遠心分離されました。 |
| 2.2.5.血漿トリアシルグリセリド、総コレステロール、HDL-コレステロール濃度の測定 |
| 血漿 トリアシルグリセリド、総コレステロール、HDL-コレステロール濃度は、AU5800 臨床化学システム (Beckman Coulter、Buckinghamshire, UK) を使用して測定しました。 Beckman Coulter UK から提供されたテスト キット (IL テスト トリアシルグリセロール、IL テスト コレステロール、IL テスト HDL コレステロール) は、それぞれ血漿トリアシルグリセリド、総コレステロール、HDL-コレステロールの測定の指示に従って使用されました。 |
| 2.2.6.炎症/免疫バイオマーカー |
| 炎症バイオマーカー、インターロイキン 6 (IL-6)、腫瘍壊死因子アルファ (TNF-α)、C 反応性タンパク質 (CRP)、インターロイキン 10 (IL-10) は、適切な特異的試薬キット (Quantikine1 ELISA、R&D Systems Inc.、Barton, UK) を使用して酵素結合免疫吸着法 (ELISA) で測定されました。 |
| 血清サンプルはローラーミキサーで解凍した。キャリブレーターおよび試薬は製造元の指示に従って調製した。血清、キャリブレーターまたはコントロールの 25 μl アリコートを 96 ウェルプレートにピペットで移し、100 μl の抗サイトカイン抗体、ホースラディッシュペルオキシダーゼ、コンジュゲートを加えた。プレートを室温で 1 時間振とうした。インキュベーション後、プレートを洗浄バッファーで 3 回洗浄した。基質溶液の 100 ml アリコートを各ウェルに加え、プレートを室温で 10 分間振とうした。反応は停止液 100 μl を加えて停止し、自動 ELISA プレート分光光度計 (Tecan GENios、Process Analysis and Automation Ltd. Farnborough、Hants, UK) を使用して 450 nm で直ちにプレートを測定した。サンプルおよび品質管理のサイトカイン濃度は、Magellan (バージョン 5.01) コンピュータ ソフトウェアを使用して標準曲線から読み取ることによって自動的に決定されました。 |
| 2.2.7.尿および血清サンプルの 1H 核磁気共鳴 (NMR) 分光法 |
| 代謝産物および胆汁酸塩の定量化のため、ロンドンのインペリアル カレッジで核磁気共鳴 (NMR) 分光法によるメタボノミクス分析を実施しました (尿および血清サンプル)。 NMR 尿サンプルは、データ取得を最適化し、自然変動を最小限に抑えるために連続的に分析しました。 1 つの実験からのすべてのサンプルは、サンプルの完全性を保つために 1 つのバッチとして分析しました。 サンプルは、重水素化リン酸緩衝液 (28.86 g/L リン酸二ナトリウム、5.25 g/L リン酸一ナトリウム、0.172 g/L 3 (トリメチルシリル) プロピオン酸ナトリウム-d4 (TSP) (1 mM)、および 0.193 g/L アジ化ナトリウムを 900 ml の重水素酸化 (D2O) (v/v) および 100 ml H2O に溶解) して調製しました。 NMR で分析した尿サンプルは、-80℃ から解凍し、ボルテックスしてサンプルが均一になるようにしました。各尿サンプル (400 μl) をマイクロチューブに入れ、リン酸緩衝液 200 μl を加えてボルテックスし、8000 g で 10 分間遠心分離した後、上清 550 μl を 5 mm NMR チューブに移しました。TSP は NMR スペクトルの較正用内部標準として使用され、サンプルが NMR 分析を待っている間に微生物の増殖を防ぐためにアジ化ナトリウムが添加されました。すべてのサンプルは、1H 観察用に 700.13 MHz で動作する Bruker Ultrashield Plus NMR 分光計で 300 K で分析されました。標準の 1 次元 NMR スペクトルは、標準パルスシーケンス (リサイクル遅延 - 90° - t1 - 90° - tm - 90° - 取得) - Noesypr1D を使用して、水ピーク抑制で取得されました。リサイクル遅延は 2 秒に設定され、混合時間 (tm) は 100 ミリ秒に設定されました。 |
| 血漿サンプルについては、サンプル 30 μl を生理食塩水緩衝液 30 μl (TSP なし) と混合し、50 μl を毛細管 NMR チューブに移しました。血漿サンプルは、尿および肝臓サンプルと同じ標準の飽和前パルス シーケンスを使用して取得し、その後、Carr-Purcell Meiboom Gill (CPMG) スピン エコー パルス プログラムで 8 回のダミー スキャンを行い、続いて 128 回のスキャンを 64 K データ ポイントで収集しました。スペクトル幅は 20 ppm、スキャンあたりの取得時間は 1.36 秒でした。混合時間は 100 ミリ秒、リサイクル デラは 2 秒でした。すべての 1H NMR スペクトルは、位相補正、TSP を 0 ppm に設定して化学シフトを較正する、および多変量データ分析によるスペクトル データの比較を可能にするベースライン補正を行う TopSpin 3.1.5 (Bruker™) アルゴリズムで処理されました。 |
| 2.2.8糞便からの微生物DNA抽出 |
| QIAamp DNA Stool Mini Kit (QIAGEN、UK) の改良プロトコルを使用して、糞便サンプル250 mgから全細菌DNAを抽出しました [12]。DNAサンプルをTE緩衝液100 μlに再懸濁し、DNaseフリーRNase (10 mg/ml) 2 μlで37℃で15分間処理しました。タンパク質は、プロテイナーゼK 15 μlで70℃で10分間処理して除去しました。その後、製造元の指示に従って、QIAamp Mini Spinカラム (QIAGEN) を使用してDNAを精製しました。最終的なDNA濃度は、NanoDrop ND-1000 (NanoDrop Technologies、Wilmington, DE) を使用して定量しました。 |
| 2.2.9.次世代シーケンシングとバイオインフォマティクス解析による 16S rRNA 遺伝子の増幅 |
| 次世代シーケンシング(NGS)解析では、16S rRNA 遺伝子の V3-V4 領域を、25 ng の微生物 DNA、2X KAPA HiFi HotStart Ready-Mix (KAPA Biosystems、Resnova、Rome, Italy)、および Illumina オーバーハング アダプター シーケンスを持つ 200 nmol/L の S-D-Bact-0341-b-S-17/S-D-Bact-0785-a-A-21 プライマーを含む 50 μL 最終容量ミックスで PCR 増幅しました。 増幅サイクルは、95℃で3分間の初期変性、95℃で30秒間の変性、55℃で30秒間のアニーリング、72℃で30秒間の伸長を25サイクル繰り返し、最終伸長ステップとして72℃で5分間行い、Biometra Thermal Cycler T Gradient (Biometra) を使用して実行しました。460 bp 増幅産物の精製には磁気ビーズベースのクリーンアップ システム (Agencourt AMPure XP、Beckman Coulter、Brea, CA) を使用し、その後、Nextera Technology を使用した限定サイクル PCR を使用してインデックス ライブラリを準備しました。ライブラリは精製され、等モル濃度 (4nM) で順次プールされ、変性されて 6 pmol/L に希釈されました。サンプルは、メーカーの指示(Illumina、San Diego, CA)に従って、2×300 bpペアエンドプロトコルを使用してIllumina MiSeqプラットフォームでシーケンスされました。シーケンスによって得られたペアエンドリードは、QIIMEパイプライン[13]とPANDAseq [14]を使用して分析され、Greengenesデータベース[15]は分類学的割り当てに使用されました。キメラフィルタリングは、シグレットOTUを除去するUCLUSTを使用して実行されました[16]。 |
| 2.3.統計分析 |
| 最初の一連の分析では、ベースラインでの人口統計変数と結果変数を調べ、2 つのグループが適切に一致していることを確認しました。連続変数は、対応のない t 検定を使用して分析され、カテゴリ変数にはカイ 2 乗検定が使用されました。事前に決定された 4 つの研究期間にわたる結果の変化が調べられました。調査された期間は、ベースラインから 6 週間、6 週間から 12 週間、ベースラインから 12 週間、12 週間から 16 週間でした。分析は、Stata (バージョン 13.2) による共分散分析 (ANCOVA) を使用して実行されました。後者の時点は結果変数として使用され、前の時点は共変量と見なされました。各期間について、個別の共分散分析が実行されました。残差の正規性および予測値との関係をチェックすることにより、モデルの仮定が調べられました。ほとんどの患者とほとんどの結果について、データは完全でした。欠損値は分析から除外されました。 |
| 脂質プロファイル、血圧、炎症/免疫バイオマーカー、胃腸症状、人体計測値に対する治療の効果は、まず研究対象集団全体で検討されました。プラセボグループとアクティブグループは、ベースライン総コレステロールレベル(正常ベースライン総コレステロール(N-TC)<5mM、軽度上昇ベースライン総コレステロール(M-TC)5±5.9mM、高ベースライン総コレステロール(H-TC)6.0mM)、性別(男性、女性)、年齢(<50歳、50-59歳、60歳)に従って層別化された患者サブグループでさらに比較されました。 H1NMR については、Korrigan Toolbox (Korrigan Sciences Ltd、UK) の統計ツールとレディング大学 (UK) の社内スクリプトを使用して、Matlab で多変量統計データ分析 (PCA および OPLS-DA) を実行しました。 |
| メタゲノムデータの生物統計学的解析は、R (https://www.r-project.org/) と Microsoft Excel を使用して実施しました。主座標分析 (PCoA) は、重み付けおよび重み付けなしの UniFrac メトリック [17] を使用してサンプル間の類似性を調査および視覚化するために実施されました。 |
| 3.結果 |
| 3.1. Lactobacillus plantarum ECGC 13110402 の選択 |
| 系統発生学的に多様なLactobacillus菌株の系統的 in vitro スクリーニングの結果、Lactobacillus plantarum ECGC 13110402 は、高い胆汁酸塩加水分解酵素活性 (2.6 μmol/hr/e10cells)、in vitro コレステロールを77.9% 減少させる能力、胃酸、膵酸、胆汁酸に対する高い優先耐性、凍結乾燥時の高い生存率を兼ね備えた最も有望な菌として特定されました。Lactobacillus plantarum ECGC 13110402 は、このヒト介入研究で使用するために製造され、カプセル化され、ブリスター パックに包装されました。 |
| 3.2. ベースライン人口統計変数とボランティアの層別化 |
| ベースラインで、アクティブグループ(n = 23)とプラセボグループ(n = 23)の人口統計学的パラメータが調べられました(表 1)。ベースラインの脂質プロファイル、体重、BMI、ウエスト周囲径、収縮期血圧と拡張期血圧、年齢、性別に統計的に有意な差は見つかりませんでした。 表 2 は、ベースラインの 総コレステロールレベル、年齢、性別に基づいてボランティアをサブグループに分類したことを示しています。 |
| 表 1. アクティブ治療グループ (Lactobacillus plantarum ECGC 13110402) およびプラセボ治療グループにおけるヒト介入研究参加者の人口統計学的およびベースライン特性。 |
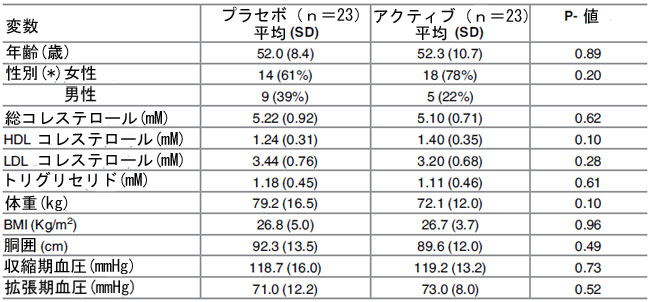 |
| (*) 報告された数 (%)、BMI: ボディマス指数 |
| 表 2. ヒト介入研究のボランティアを、ベースラインの総コレステロール、年齢、性別に基づいて、アクティブ治療グループ (Lactobacillus plantarum ECGC 13110402)とプラセボ治療グループに層別化した。 |
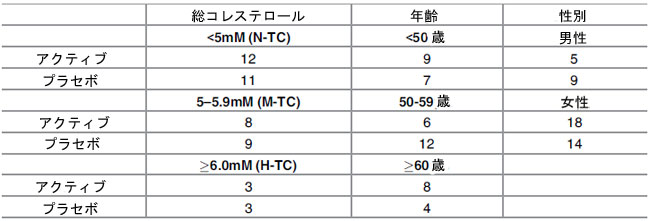 |
| TC: 総コレステロール; 正常ベースライン TC: N-TC:<5mM; 軽度上昇ベースライン TC: M-TC: 5±5.9mM、高ベースライン TC: H-TC: 6.0mM) |
| 3.3. 人体計測データと血圧 |
| Lactobacillus plantarum ECGC 13110402 による治療は、ベースラインから 12 週間の研究期間において、体重、BMI、またはウエスト周囲径に統計的に有意な影響を及ぼしませんでした (表 3)。研究グループは、6 週間から 12 週間の期間の収縮期血圧に有意な差があることがわかりました (P = 0.003、-1.8 変化平均 (SD) [範囲]、-0.7% 変化平均 (SD) [範囲]、-0.6 グループ差平均 (95% Cl)) (表 4)。プラセボ グループでは上昇が見られましたが、アクティブ グループではわずかに低下しました。12 週間の値は、アクティブグループの方がプラセボ グループよりも 6 mmHg (5.1%) 低いことがわかりました。 |
| 表 3. アクティブ治療グループ (Lactobacillus plantarum ECGC 13110402) およびプラセボ治療グループにおける、ベースラインから 12 週間までの全研究参加者の人体測定値および血圧の変化 |
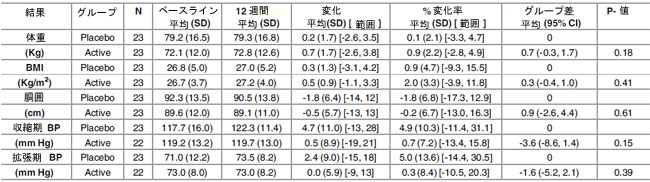 |
| BMI: ボディマス指数; BP: 血圧; N: 参加者数 |
| 表 4. アクティブ治療グループ (Lactobacillus plantarumECGC 13110402) およびプラセボ治療グループにおける 6 ~ 12 週間の全研究参加者の人体測定値および血圧の変化 |
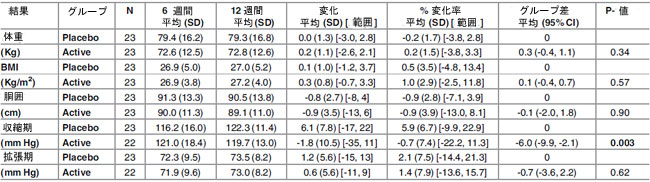 |
| BMI: ボディマス指数; BP: 血圧; N: 参加者数 |
| 3.4.脂質パラメータ |
| 3.4.1総コレステロール (TC) |
| プラセボグループと比較すると、ベースラインから 12 週間までの総コレステロールは、すべてのアクティブ治療グループで一貫した減少パターンを示しましたが、これは統計的に有意ではありませんでした (表 5±7)。ベースラインから中間試験時点(0±6週)まで、総コレステロールの2.44mmol/lの統計的に有意な減少が観察され、これはH-TCグループの36.7%減少(P = 0.045、-0.50変化平均(SD)[範囲]、-7.8%変化平均(SD)[範囲]、-2.44グループ間差平均(95% Cl)に相当)に相当します(表8)。ただし、このグループの人口規模は非常に小さく(n = 3プラセボ/3アクティブ)、統計的に有意であるにもかかわらず、少数の患者数は個々の変化に大きく影響される可能性があります。したがって、この効果にグループの関連性は帰せられません。総コレステロールに対する性別の有意な影響は確認されませんでした。 |
| 3.4.2高密度リポタンパク質コレステロール (HDL-C) |
| 高密度リポタンパク質コレステロールは、プラセボグループとアクティブグループの両方で、ベースラインから 12 週間の間にわずかに増加しました。変動ベースラインを調整すると、プラセボグループと比較して、全被験者グループと N-TC グループの HDL-コレステロール濃度はアクティブグループで 0.06mmol/l (4.5%) と 0.09mmol/l (7.4%) 高くなりました。この差のほとんどは、全被験者(P = 0.023、0.06 変化平均(SD) [範囲]、3.4% 変化平均 (SD) [範囲]、0.06 グループ差平均 (95% 信頼区間) (表 6) と N-TC グループ(P = 0.33、0.10 変化平均 (SD) [範囲]、6.2% 変化平均 (SD) [範囲]、0.09 グループ差平均 (95% 信頼区間))の両方で 6 ~ 12 週間の期間に発生しました。 年齢層別化(<50、50±59、および 60 歳以上)では、60 歳以上のグループ(n = 12)で統計的に有意なグループ差が明らかになり、プラセボグループと比較した場合の HDL-コレステロールの平均増加は 0.23mmol/l (14.7%) でした。 ベースライン総コレステロール濃度と性別による層別化では、HDL-コレステロールレベルに対する治療の有意な効果は明らかになりませんでした。 |
| 3.4.3.低密度リポタンパク質コレステロール (LDL-C) |
| 低密度リポタンパク質コレステロールは、すべてのアクティブ治療グループでベースラインから 12 週の間に減少しましたが、この効果はプラセボグループでは観察されませんでした。N-TCグループの LDL-コレステロール濃度は、アクティブグループではプラセボグループと比較して 0.39mmol/l (13.9%) 有意に低下しました (P = 0.03)。M-TCグループでは、LDL-コレステロールは平均 0.47mmol/l (13.1%) 減少しましたが、統計的に有意には達しませんでした。LDL-コレステロール低下効果は、0±6 週と 6±12 週の両方の期間で一貫して発生しているようでした。 |
| 性別による層別化では、女性ボランティアの方が男性よりも顕著な LDL-コレステロール低下効果が明らかになりましたが、これは統計的に有意ではありませんでした (P = 0.06)。 アクティブグループの濃度は、プラセボと比較して女性では 0.41mmol/l (12.4%) 低く、アクティブ男性グループではプラセボと比較して 0.06mmol/l (1.8%、P = 0.06) 高くなりました (P = 0.83)。 |
| ボランティアの年齢による層別化では、年齢が上がるにつれて LDL-コレステロール濃度の減少が大きくなる傾向が見られました。50 歳未満グループでは、ベースライン調整 LDL コレステロール濃度にわずかな変化が見られました (0.08mmol/l 増加)。LDL-コレステロールの減少は、50±59 歳グループ (0.49mmol/l) と 60 歳グループ (0.31mmol/l) でより顕著で、プラセボと比較してアクティブグループではそれぞれ 15% と 9.14% の減少に相当します。 |
| 3.4.4トリアシルグリセリド(TAG) |
| L-総コレステロール、M-総コレステロール、H-総コレステロールグループの被験者全員において、アクティブ治療またはプラセボ治療の摂取によるトリアシルグリセリド濃度への統計的に有意な影響は認められませんでした。年齢層別化では、50 歳未満(n = 16)、50±59 歳(n = 18)、60 歳以上(n = 12)で、ベースラインから 12 週間の試験期間中に、プラセボグループとアクティブグループの間で 60 歳以上グループで 0.48mmol/l(53.9%)の統計的に有意な(P = 0.002)トリグリセリド減少が見られました。トリグリセリドの減少は 6±12 週間の期間でより顕著で、0.26mmol/l(32.9%、P = 0.03)の統計的に有意な減少でした。ベースラインから 6 週間の期間で 0.38mmol/l (31.4%) の減少が観察されましたが、統計的に有意ではありませんでした (P = 0.47)。 |
| 表 5. 試験参加者全員における、ベースラインから 12 週間までのアクティブ治療グループ(Lactobacillus plantarumECGC 13110402) およびプラセボ治療グループの脂質パラメータ (mM 単位)。 |
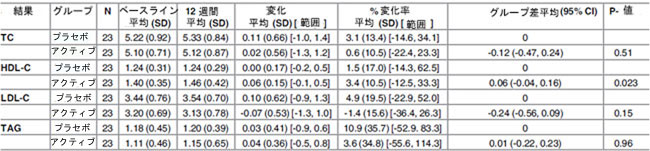 |
| TC: 総コレステロール; HDL-C: 高密度リポタンパク質コレステロール; LDL-C: 低密度リポタンパク質コレステロール; TAG: トリアシルグリセロール; N: 参加者数 |
| 表 6. アクティブ (Lactobacillus plantarumECGC 13110402) およびプラセボ治療グループにおけるベースラインと 12 週間の介入研究の間の正常総コレステロール群 (TC <5mM) における mM で表された脂質パラメータ。 |
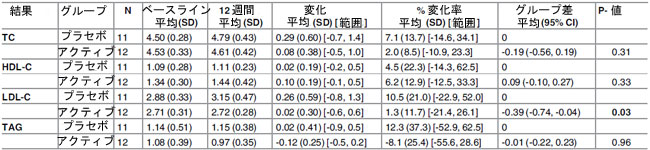 |
| TC: 総コレステロール; HDL: 高密度リポタンパク質コレステロール; LDL: 低密度リポタンパク質コレステロール; TAG: トリアシルグリセロール; N: 参加者数 |
| 表 7. 総コレステロールが軽度上昇したグループ (TC <5±5.9mmol mM) における、ベースラインと 12 週間の介入研究におけるアクティブ (Lactobacillus plantarum ECGC 13110402) およびプラセボ治療グループ間の脂質パラメータ (mM で表したもの)。 |
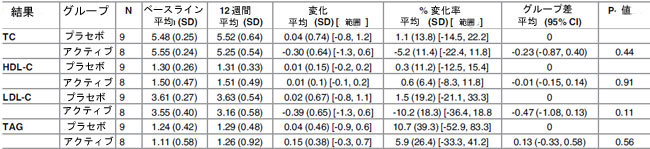 |
| TC: 総コレステロール; HDL: 高密度リポタンパク質コレステロール; LDL: 低密度リポタンパク質コレステロール; TAG: トリアシルグリセロール; N: 参加者数 |
| 表8. ベースラインから介入研究6週間までの高総コレステロールグループ(TC 6.0 mmol/L)のアクティブ(Lactobacillus plantarumECGC 13110402)およびプラセボ治療グループにおける脂質パラメータ(mMで表したもの)。 |
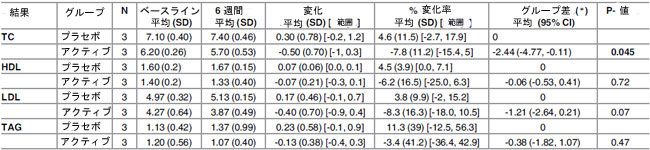 |
TC: 総コレステロール、HDL: 高密度リポタンパク質コレステロール、LDL: 低密度リポタンパク質コレステロール、TAG: トリアシルグリセロール、N: 参加者数、 (*) ANCOVA 分析から算出、ベースライン値を調整 |
| 3.4.5炎症/免疫バイオマーカー |
| IL-6、TNF-α、CRP、IL-10 については、ベースラインと 12 週間の間 (表 9)、または研究中期の分析時点のいずれにおいても、統計的に有意な変化は認められませんでした。ベースラインの総コレステロールレベル、性別、年齢によるグループ分けは、ここで分析したどのパラメータにも影響を与えませんでした。 |
| 表9. ベースラインから12週間までの全被験者の炎症バイオマーカーの変化 |
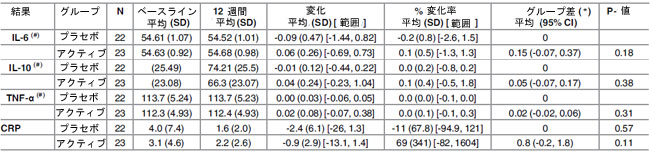 |
(*) ANCOVA 分析から計算し、ベースライン値を調整。 (#) 要約統計量は 1000 単位で報告。N: 参加者数 |
| 3.4.6.16S rDNA 次世代シーケンシングの結果 |
| 16S rDNA 遺伝子の V3-V4 領域の高品質リードが合計 3,225,782 件得られ (平均 17,921、SD 1581)、41,919 個の操作分類単位 (OTU) にクラスター化されました。治療が 腸内細菌叢構成に影響を与えたかどうかを評価する目的で、各時点のファミリー レベルでの相対的存在量が示されました (図 2A および 2B、それぞれアクティブおよびプラセボ)。 全体的な糞便微生物叢の構成は、経時的に Bacteroidaceae、Lachnospiraceae、および Ruminococcaceae の 3 つのファミリーによって支配され、それらの相対的存在量はアクティブ治療にもかかわらず有意に変化しませんでした (p >0.05)。全体的に、メタゲノミクスデータは、Lactobacillus plantarumECGC 13110402 (A) またはプラセボ (B)、あるいは時間 (ベースラインまたは 12 週間) に基づいて変化を示しませんでした。 Lactobacillus plantarumECGC 13110402 とプラセボを比較したLactobacillu集団の相対的存在量を具体的に分析したところ、有意差は認められませんでした (P>0.05)。 |
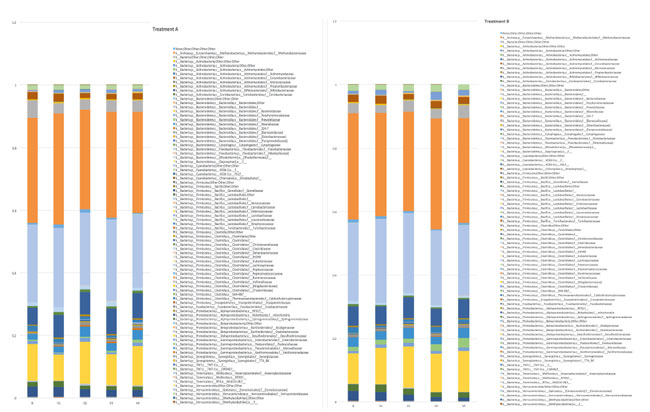 |
| 図 2. (A) 同じ処理 (A: Lactobacillus plantarum ECGC 13110402) を受けたすべてのサンプル間のファミリーレベルでの相対的存在量の平均を表すヒストグラム (B = 基礎、V1 = 訪問 1、V2 = 訪問 2、V3 = 訪問 3、V4 = 訪問 4)。 被験者の少なくとも 10% に見られるファミリーを存在量の 0.01% に保つために、相対的存在量はフィルタリングされました。 凡例は Greengenes 構文に従って家族名を報告します。(B) 異なる時点 (B = 基礎、V1 = 訪問 1、V2 = 訪問 2、V3 = 訪問 3、V4 = 訪問 4) で同じ治療を受けたすべてのサンプル間の平均の家族レベルでの相対存在度を表すヒストグラム。相対的存在量は、対象の 10% 以上で発見されたファミリーを 0.01% の存在量に保つためにフィルタリングされました。凡例は Greengenes 構文に従ってファミリー名を報告します。 |
| 3.4.7.尿および血清代謝物の全体的分析 |
| 血清および尿代謝物の主成分分析では、アクティブまたはプラセボの摂取または時間(ベースラインまたは 12 週間)に基づく変化は見られませんでした。12 週間で有効成分またはプラセボを比較した場合、尿(図 3A および 3B)または血清(図 4A および 4B)の代謝プロファイルに違いは見られませんでした。OPLS 分析では、アクティブまたはプラセボの使用による血液および尿の代謝プロファイルの変化は見られませんでした。個々の血清代謝プロファイルは、治療に関係なく、ベースラインと 12 週間で同様のままでした。 |
| 4.考察 |
| この研究の目的は、健康な正常から軽度の高コレステロール血症の成人におけるLactobacillus plantarum ECGC 13110402のコレステロール低下能力を調査することです。主な有効性の結果には、血中脂質、安全性、耐性への影響が含まれ、副次的な結果には、血圧、免疫バイオマーカー、腸内細菌叢分析、メタボノームの変化が含まれます。 |
| この研究では、コレステロール低下に影響することが知られており、高い腸管生存率をシミュレートした作用機序について 353 種の微生物株を in vitro スクリーニングした後に特定された株、Lactobacillus plantarum ECGC 13110402 を使用しました。in vitro スクリーニングにより、Lactobacillus plantarum ECGC 13110402 は、高い胆汁酸塩加水分解酵素活性、コレステロール低下能力、胃酸、膵酸、胆汁酸に対する高い優先耐性、および凍結乾燥に対する高い生存率を有することが確認されました。確立された疾患バイオマーカー (コレステロール) に関連する既知の作用機序 (胆汁酸塩加水分解) を持つ微生物株を選択するための体系的なアプローチを採用することで、プロバイオティクス株の選択にベースラインの理論的根拠が導入され、以前の研究 [7] で一般的に説明されている株の変動の影響が制御され、ヒト研究で信頼性の高い結果の可能性が高まります。 |
| 研究の結果は、正常から軽度の高コレステロール血症の被験者において、いくつかの冠状動脈性心疾患リスク要因、特にLDL、HDL、血圧にわたって、生物学的および/または統計的に有意な効果を示しています。 |
| 心血管リスクを減らすための主な目標の1つは、LDC-コレステロールです。研究結果では、0±6、6±12、0±12週の期間にわたって、プラセボと比較してアクティブグループで一貫した減少パターンが示唆されています。LDL-コレステロールの変化は、全被験者グループの0.24mmol/l(7.2%)からN-総コレステロールグループの0.39mmol/l(13.9%)までさまざまでした(P = 0.03)。個々のグループおよびサブグループの分析では統計的有意性のばらつきが示されましたが、すべてのアクティブグループでLDL値が低下する傾向が一貫して見られました。血清コレステロールの1%の減少は動脈疾患リスクの2±3%の軽減と関連しているため、これらの減少は潜在的な臨床的意義を持っています[18]。 |
| 2 つの時点間の総コレステロールレベルの変化を調べる相関分析では、アクティブグループではベースラインと 6 週間の間に総コレステロールが統計的に有意に (P = 0.04) 減少したことが示されました。この効果はプラセボグループでは見られませんでした。アクティブ治療グループの平均治療をプラセボグループと比較した場合、総コレステロールレベルも同様に一貫して減少しました。これは、全被験者での 0.12mmol/l (2.3%) から、H-総コレステロールグループでの統計的に有意な 2.44mmol/l 減少 (36.7%、P = 0.045) までの範囲でした。N-総コレステロールグループと M-総コレステロールグループでは、それぞれ 0.19mmol/l (4.2%) と 0.23mmol/l (4.17%) の 総コレステロール減少が見られました。LDL-コレステロールレベルへの影響が最も大きかったのは H-総コレステロールグループでしたが、このサブグループの人口が少ないことが、この観察の強さにマイナスの影響を与えています。 Cho & Kim [7]によるプロバイオティクス摂取と脂質濃度に関する30件のランダム化比較試験(参加者1624名)の最近のメタアナリシスでは、総コレステロールの開始ベースライン濃度が研究結果の重要な要因であることが判明しました。ベースライン総コレステロールが高いほど、総コレステロールとLDL-コレステロールレベルに観察される効果が大きくなります。これらの知見を考慮すると、ベースライン総コレステロールが高い人はLactobacillus plantarum ECGC 13110402治療によって最も恩恵を受けることができると考えられますが、これは適切な検出力を持つ関連集団の研究で確認される必要があります。 |
| 60人の高コレステロール血症患者を対象に実施された最近の研究では、Lactobacillus plantarumの菌株の組み合わせの影響が調査されました。しかし、この研究では、ベースラインのコレステロール値に応じて総コレステロールとLDL-コレステロールの減少量が異なり、コレステロールが6.5 mmol/l未満の患者ではLDL-コレステロールにわずかな影響しか見られませんでした[19]。 |
| アテローム性動脈硬化性プラーク形成に関する古典的な疫学調査および介入試験により、LDL-コレステロールが冠動脈疾患の原因物質であることが判明しています。そのため、LDL-コレステロールの低減は世界中で心血管リスク低減の基礎となります。Briel ら [20] は、LDL-コレステロールの変化と心血管疾患の罹患率および死亡率との関連性を調査したメタ分析で、LDL-コレステロールが 0.26mmol/l 低下すると、冠動脈性心疾患による死亡の相対リスクが 7.2% (P = 0.001)、冠動脈性心疾患イベントが 7.1% (P<0.001)、総死亡が 4.4% (P = 0.002) 低下することを示しました。現在、スタチンは LDL-コレステロールレベルを低下させる最も効果的な薬剤です。しかし、スタチン治療を受けている約2000万人の患者のうち、推定10%から20%は、主に筋肉関連の副作用のために、介入、または現在のLDL-コレステロール目標を達成するために必要な高用量に耐えることができません[21]。スタチンの限界に対する認識が高まるにつれて、特に薬物治療がコストの高騰、安全上の理由、または単に個人的な好みのために不適切であると考えられる場合に、血中コレステロールプロファイルを改善するための非薬物療法への関心が高まっています。植物スタノールとステロールはますます選択肢になっています。欧州食品基準機関(EFSA)は80以上の研究を検討し、1.5±2.4 g/日(小さじ3±4杯)の摂取で、LDL-コレステロールの平均7〜10.5%の低下が期待できると結論付けました。委員会は、このような低下は、冠状動脈性心疾患のリスク低下の点で生物学的に重要であると判断しました。Lactobacillus plantarum ECGC 13110402を使用したこの研究の結果は、スタノールとステロールの同様の削減が達成できる可能性があることを示唆している[22]。 |
| これまでにプロバイオティクス細菌にはコレステロールを減少させるメカニズムがいくつか提案されている。Lactobacillus 菌株はコレステロールを細胞膜に受動的に結合し、循環から除去することがわかっている [23,24]。コレステロールは成長中に細菌細胞膜に取り込まれることもあり、このメカニズムによって膜強度が高まり、溶解に対する抵抗力が増す [24,25]。コレステロールは腸内で細菌コレステロール還元酵素によってコプロスタノールに変換され、その後直接糞便中に排泄される。これにより吸収されるコレステロールの量が減少し、生理的コレステロールプールが減少する。Lye ら [25, 26] は、in vitro 発酵中にコレステロールをコプロスタノールに変換できるLactobacillus菌株の範囲における細胞内および細胞外コレステロール還元酵素の特徴を明らかにした。Lactobacillusによるコレステロール減少のもう1つの報告されたメカニズムは、腸肝循環における胆汁酸塩の脱抱合を担う胆汁酸塩加水分解酵素活性によるものです。胆汁酸塩加水分解酵素活性は、以前にL. plantarum株について報告されています[27]。胆汁酸塩加水分解酵素は、抱合胆汁酸のC24-アシルアミド結合の加水分解を触媒し、腸肝循環から胆汁酸を除去し、肝臓でのコレステロールの利用を必要とします。 |
| アクティブ治療薬を摂取すると、ベースラインと 12 週間の間に収縮期血圧に差が見られました。収縮期血圧の主な低下は 6±12 週間の研究期間に起こり、プラセボと比較して有効群では 6mmHg (5.1%) 低かった (P = 0.003)。高LDL-コレステロールと同様に、高血圧は確立された 冠状動脈性心疾患リスク要因であり、収縮期血圧が 10 mmHg 低下すると、冠動脈性心疾患、脳卒中、心不全による全死亡率が 13% 低下します [28]。ただし、この研究は正常血圧のボランティアで実施されたため、介入の影響は高血圧患者で確認する必要があります。他の研究では、血圧低下におけるプロバイオティクスの役割が示唆されています。 9件の試験のメタ分析[29]では、プロバイオティクスの摂取により対照群と比較して収縮期血圧が3.56mmHg低下し、拡張期血圧が2.38mmHg低下したことが示された。プロバイオティクスの抗高血圧作用のメカニズムとして考えられるのは、脂質プロファイルの改善、インスリン抵抗性、レニンの調節、生物活性イソフラボンの生体内変換、体重減少などである[26]。L. plantarum ECGC 13110402の摂取はここでは体重に影響を与えなかったが、収縮期血圧への影響は脂質プロファイルの改善に起因する可能性があり、この効果は収縮期高血圧の患者で以前に報告されている[27]。他のメカニズムも関与している可能性があるが、本研究の範囲外であった。 |
| 総コレステロール、LDL-コレステロール、血圧の低下を組み合わせることは、LDL-コレステロールと収縮期血圧の両方を低下させる能力が心血管リスクの低減に相乗効果をもたらす可能性があるため、既存のアプローチに比べて大きな利点があります[28±32]。 |
| 炎症誘発性バイオマーカーにおいて臨床的に重要な所見は確認されず、介入の安全性が実証されました。Lactobacillus plantarum ECGC 13110402 の摂取による有害な消化管副作用は認められず、鼓腸、腹痛、排便、便の硬さに関する自己申告パラメータは、アクティブグループとプラセボグループの間で有意差がなかったことから、介入はすべてのボランティアに十分耐えられたことが示されました。 |
| ベースラインと介入研究期間終了時(12 週間)に得られた腸内細菌叢組成のメタゲノム解析では、有意な変化は確認されませんでした。ただし、ここで使用した解析手法は、Lactobacillus属の密度を調べるものであり、グループ内の種間の変化を考慮することはできません。 |
| 血清および朝の尿サンプルのメタボノミクス分析では、ベースラインと介入終了時(12 週間)の間の代謝プロファイルに有意な変化は見られませんでした。 特に血液中の代謝物濃度は恒常性制御下にあるため、測定可能な変化をもたらすには、プレバイオティクスなどのより影響の大きい介入が必要になる場合があります。 この目的のために、私たちは Lactobacillus plantarum ECGC 13110402 の β-ガラクトシダーゼを使用して、標的プレバイオティクス ガラクトオリゴ糖を合成しました。これは、pH 制御糞便培養モデルで in vitro で Lactobacillus レベルを選択的に刺激し、Lactobacillus plantarum ECGC 13110402 のコレステロール除去と胆汁酸塩加水分解酵素活性を大幅に刺激することができます。これは現在、さらにテスト中です。 |
| 現在の研究では生物学的および統計的に有意な効果が見られましたが、特に H-総コレステロールグループでは、サンプル サイズがサブグループ分析の価値を制限した可能性があります。より大きな数でさらに研究を行うことで、有意な効果をより明確に表現できるようになると予想されます。同様に、研究期間を長くしたり、クロスオーバー デザインを採用したりすることで、現在の知見を強調できる可能性があります。 |
| この研究の結果は、正常から軽度の高コレステロール血症の被験者において、特に LDL-コレステロール、HDL-コレステロール、血圧など、多くの冠状動脈性心疾患リスク要因に統計的に有意な効果を及ぼすことを示しています。この結果は、Lactobacillus plantarum ECGC13110402 が、既存の治療法の代替または補足として、忍容性が高く、使いやすい天然コレステロール低下サプリメントとして潜在的可能性を秘めていることを示す初期の証拠となります。最適化されていない製品で健康な成人に投与したこれらの結果は、1 日あたり 1.5±2.4 g の植物ステロール/スタノールと同様の有効性を示唆しています。 |
| 5.結論 |
| この研究は、幅広い健康な集団に対する効果を調査するために設計されており、臨床的有効性を実証するために高コレステロール群をターゲットにしたものではありません。研究プロトコル、投与タイミングの最適化、高コレステロール集団および/または高血圧群のターゲット化、およびLactobacillus plantarumをターゲットとしたプレバイオティクスとの組み合わせにより、in vivoでのコレステロール低下作用がさらに強化され、実証されると考えられます。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、PLOS ONE | https://doi.org/10.1371/journal.pone.0187964 December 11, 2017に掲載されたAn in vivo assessment of the cholesterollowering efficacy of Lactobacillus plantarum ECGC 13110402 in normal to mildly hypercholesterolaemic adults. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


