ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(植物性ヨ-グルト、プランタルム菌の科学:研究の最前線) |
高コレステロール血症の成人におけるLactobacillus plantarum ECGC 13110402 の コレステロール低下効果: 二重盲検、ランダム化、プラセボ対照、パイロット介入試験 |
Enver Keleszade、Sofia Kolida、Adele Costabile |
|
|
| 要約 |
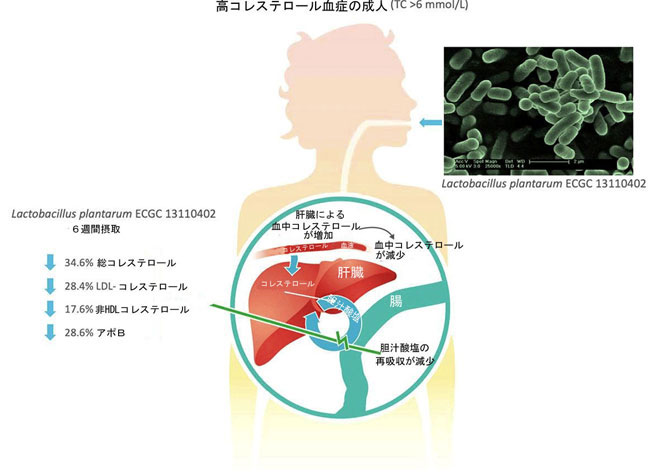
Lactobacillus plantarum ECGC13110402 は、高い胆汁酸塩加水分解酵素とコレステロール低下活性を持つプロバイオティクスです。この並行二重盲検プラセボ対照ランダム化パイロットスタディでは、16 人の高コレステロール血症成人を対象に、L. plantarum ECGC13110402 のコレステロール低下能力を調査しました。参加者は、4 ×109 CFU のカプセル化されたL.plantarum ECGC13110402 (有効、n=8) またはプラセボ (n=8) を 6 週間にわたって 1 日 1 回摂取し、その後 3 週間のウォッシュアウトを行いました。空腹時の血液サンプルを採取し、血中脂質、肝機能、ビタミン D を分析しました。 L. plantarum ECGC 13110402 を 6 週間毎日摂取したところ、プラセボと比較して、総コレステロール が平均 34.6% (p=0.001)、LDL-コレステロールが 28.4% (p=0.03)、非HDL-コレステロールが 17.6% (p=0.001)、アポB(訳者注:アポリポタンパク質B(アポB)は、血中の脂質を運ぶタンパク質で、脂質代謝やコレステロール代謝に重要な役割を担っています。アポBの値が高いと動脈硬化性疾患の危険因子となるため、注意が必要です)が 28.6% (p=0.008) 減少し、生物学的かつ統計的に有意な減少が認められました。肝機能バイオマーカーとビタミン D に変化は見られず、研究全体を通じて副作用は認められませんでした。この研究の結果は、L. plantarum ECGC 13110402 が脂質異常症患者の脂質プロファイルを安全に改善できることを示唆しています。 |
 |
| グラフィック アブストラクト |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 材料と方法 |
| 2.1. 研究デザイン、設定、実験デザイン |
| 2.2. 介入とコンプライアンス |
| 2.3. 人体計測、体組成評価および血圧 |
| 2.4. 採血と血液化学検査 |
| 2.5. 胃腸および気分パラメータ |
| 2.6. 検出力計算と統計分析 |
| 3. 結果 |
| 3.1. ベースラインの人口統計学的変数 |
| 3.2. 人体計測データ、体組成および血圧 |
| 3.3. 脂質パラメータ |
| 3.4. 肝機能バイオマーカーとビタミンD |
| 3.5. 胃腸症状と気分 |
| 4. 考察 |
本文 |
| 1.はじめに |
| 心血管疾患(CVD)は世界中で死亡の主な原因です。世界保健機関(WHO)は、2019年に心血管疾患で亡くなった人の数は合計1,790万人で、世界の死亡者の32%を占めると推定しています(世界保健機関、2021年)。心血管疾患の中で最も一般的なタイプである冠状動脈性心疾患(CHD)は、2000年以降死亡者数が最も増加しており、世界の総死亡者の16%を占めています(世界保健機関、2020年)。疫学的研究は、総血清コレステロール値の上昇と冠動脈疾患リスクの間に正の相関関係があることを示唆しています (世界保健機関、2003 年)。一方、多数の疫学的、臨床的、遺伝学的研究は、一貫した証拠を提供し、冠動脈疾患の発症における LDL-コレステロールおよびその他のアポ B 含有リポタンパク質の因果関係を明白に立証しています (Ference ら、2017 年)。LDL-コレステロールが 1.0 mmol/L 低下するごとに、主要な血管イベントの年間発生率が 5 分の 1 強低下すると推定されています (Ference ら、2017 年)。これは、低密度リポタンパク質を管理して心臓イベントのリスクを軽減することの重要性をさらに示しています。 |
| 食事と行動を変える戦略は、冠状動脈性心疾患予防の第一線であり、低コレステロール/低飽和脂肪、高食物繊維食、喫煙と過度のアルコール摂取の中止、活動的なライフスタイルの採用を生涯にわたって遵守することに基づいています(Arnett et al.,2019、Visseren et al.,2021)。これらの戦略は非常に効果的ですが、簡単には持続できません。スタチン、フィブラート、選択的コレステロール吸収阻害薬、胆汁酸捕捉剤など、いくつかの確立された薬理学的アプローチは、コレステロールを効果的に管理するための追加サポートを提供できます(Arnett 他、2019年)。しかし、薬物療法の遵守率は、心血管疾患の一次予防では50%、二次予防では66%に及ぶことがあります(Arnett et al.,2019)。これは主に、多剤併用、副作用、さらには副作用と薬物療法の結果に関する信念のためです。その結果、患者の要求と臨床実践の間にギャップが生じ、現在のアプローチの限界により、血中コレステロールプロファイルを改善し、心血管の健康をサポートするための現在の戦略を補完する非薬物療法への関心が高まっています。 |
| ヒトの腸内には、代謝的に非常に多様な微生物叢が存在しています (Claassen et al., 2013)。いくつかの細菌群は、細胞表面へのコレステロールの吸着、細胞膜への同化、コレステロールエステラーゼ活性、3-ヒドロキシ-3-メチルグルタリルコエンザイム A (HMG-CoA) 還元酵素発現の減少、胆汁酸塩加水分解酵素 (BSH) 活性による胆汁酸の脱抱合など、脂質の代謝に影響を与えるメカニズムを備えています (Klaver & Van der Meer, 1993)。Lactobacillus, Bifidobacterium, Enterococcus, Clostridium, Bacteroidesなど、いくつかの腸内細菌群は胆汁酸塩加水分解酵素活性を持っています (Begley et al., 2006; Jones et al., 2008)。 胆汁酸塩加水分解酵素は、胆汁の有害な影響を最小限に抑えることができるため、消化管内での細菌の生存を高める役割を果たします。胆汁の加水分解は細胞自体に利益をもたらしますが、同時に管腔内の胆汁酸塩の脱抱合も増加し、腸肝再循環を妨げます。脱抱合されると、胆汁酸は溶解性が低下し、腸で吸収されず糞便中に排泄されます。 コレステロールはその後、恒常性反応における胆汁酸の新規合成に使用され、間接的に血清コレステロールを低下させます(Begley et al.,2006、Lew et al.,2018)。 |
| 多くのヒト介入研究で、高コレステロール血症の改善に有望なプロバイオティクス戦略として、Lactobacillus plantarum株が注目されています (Cairella & Marchini,1995、Costabile et al.,2017、Fuentes et al.,2013)。L. plantarum ECGC 13110402 は、in vitro での胆汁酸塩加水分解酵素活性が高く、in vivo でのコレステロール低減活性が高いことから選ばれたプロバイオティクス株です。著者らは、L. plantarum ECGC 13110402をカプセル化した2×109 CFUを1日2回摂取したところ、正常から軽度の高コレステロール血症の被験者において、LDL-コレステロール(13.9%)、総コレステロール(37.6%)、トリアシルグリセリド(53.9%)が有意に減少し、HDL-コレステロール(14.7%、60歳以上の被験者、6~12週間)が有意に増加したと報告しました(Costabile et al.,2017)。 |
| このパイロット研究の目的は、16 人の高コレステロール血症患者における L. plantarum ECGC 13110402 のコレステロール低下効果を評価することでした。 主な有効性の結果には、LDL-コレステロール、アポ B、非 HDL-コレステロールに重点を置いた血中脂質への影響が含まれました。副次的な研究結果には、胃腸 (GI) 症状と気分パラメータへの影響が含まれていました。また、ボランティアの健康状態を監視するために、肝機能バイオマーカーと血圧も測定されました。脂溶性ビタミンへの潜在的な影響を判断するために、ビタミン D レベルが分析されました。 |
| 2. 材料と方法 |
| 2.1. 研究デザイン、設定、実験デザイン |
| これは、英国ホワイトランズカレッジ生命健康科学部ローハンプトン大学スポーツ・運動科学研究所で実施された二重盲検ランダム化プラセボ対照並行群間研究です。この研究は www.clinicaltrials.gov (NCT03540108) に登録されており、すべての研究手順はヘルシンキ宣言と適正臨床実施基準、および CONSORT チェックリスト (表 S1) と SPIRIT (標準プロトコル項目: 介入試験の推奨事項) ガイドラインに準拠しています。研究プロトコルは、ローハンプトン大学研究倫理委員会 (参照: LSC18/241) と NHS 研究倫理委員会 (IRAS プロジェクト ID: 259363) によって承認されました。参加者情報シートを読み、医療スクリーニング質問票を完了する前に、研究への参加資格を評価し、すべての対象者から書面によるインフォームドコンセントを得ました。 |
| 研究参加者は、2019年9月から2021年2月にかけて募集され、ローハンプトン大学の地域、地元のGP診療所、ソーシャルメディアプラットフォームで配布された広告を通じて2021年5月まで追跡されました。署名済みのインフォームドコンセントを提供し、すべての包含基準(表1)を満たした潜在的な参加者は、身長と体重、座位血圧、空腹時の血液サンプルの測定が行われるスクリーニングセッションに出席しました。血液サンプルは、血中脂質、グルコース、全血球数について分析されました。すべての選択基準(n=16)を満たした適切な個人が研究への参加を招待されました(表1)。介入を実施し、結果を評価する参加者と研究者は、介入グループと対応する治療について盲検化されていました。独立した研究者が、各ボランティアに特定の番号を割り当て、グループ割り当て情報が秘匿されたままであることを保証するために、乱数生成器 (GraphPad QuickCalcs、San Diego, CA, USA) を使用して治療シーケンスへのランダム割り当てを生成しました。すべての研究参加者に対する主要結果分析の完了時に、サンプルの盲検化が解除されました。研究参加者は性別によって層別化され、1:1 の比率を使用して 2 つの治療グループのいずれかにランダムに割り当てられました (図 1)。 |
| 表1 主な参加基準と除外基準 |
 |
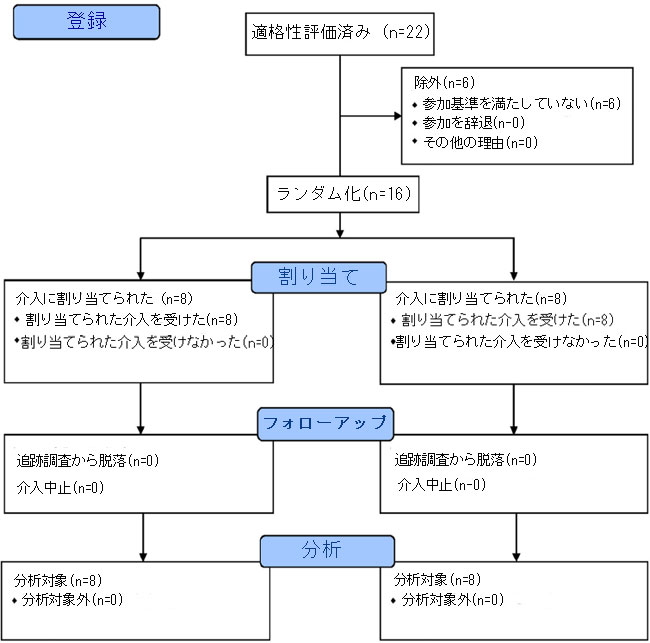 |
| 図 1. 介入を通じた研究参加者の流れ |
| 2.2. 介入とコンプライアンス |
| この研究は、2 つのフェーズで構成されました。1 つは治療期間 (6 週間)、もう 1 つは有効成分または同等のプラセボを使用した期間、もう 1 つはウォッシュアウト期間 (3 週間) です。試験対象基準の遵守を確認するためのスクリーニング訪問に続いて、この研究にはベースライン、中間点、エンドポイント (それぞれ 3 週目と 6 週目)、もう 1 つはウォッシュアウト訪問 (9 週目) が含まれていました。栄養補助食品 (有効成分またはプラセボ) に対するコンプライアンスは、毎日の日記で評価され、胃腸症状と気分も記録されました (表 S2)。 |
| 参加者は、治療期間中、1 日 1 回昼食後に有効成分またはプラセボのいずれか 1 カプセルを摂取するよう求められました。有効成分は、カプセル形式 (DR1 植物性カプセル) の L. plantarum ECGC 13110402 4 × 109 CFU (50 mg) で、充填キャリア (コーンスターチ 188.6 mg、ステアリン酸マグネシウム 3.2 mg、二酸化ケイ素 3.2 mg) が追加されています。プラセボは、外観が同一のカプセルで、コーンスターチ 238.6 mg、ステアリン酸マグネシウム 3.2 mg、二酸化ケイ素 3.2 mg が含まれています。有効成分とプラセボの配合は味も外観も似ており、Nutrilinea (Milan, Italy) によってブレンド、カプセル化、およびブリスター パックでブラインド パッケージされ、同じ色とサイズの不透明容器に入れられました。参加者には、研究全体を通じて製品の一貫性を確保するために、保管条件についてアドバイスが与えられました。ボランティアは、試験期間中(治療およびウォッシュアウト期間)に通常の食習慣や身体活動パターンを変えないように、また、表 1 に報告されているように、プレバイオティクスサプリメント、プロバイオティクス、主要パラメータに作用する薬剤、および胃腸運動に作用する薬剤を摂取しないように求められました。研究前の 6 か月間に抗生物質を投与されたボランティアは除外され、服用した薬剤は毎日の日記に記録されました。 |
| 2.3. 人体計測、体組成評価および血圧 |
| 体重、身長、ウエスト、ヒップ周囲径、血圧を含む人体計測は、標準化された手法(Lohman et al., 1988)に従ってすべての訪問時に測定されました。体組成は、Tanita BC-418 MA セグメント体組成計(Tanita Corporation, Tokyo, Japan)を使用して、生体電気インピーダンス分析(BIA)によって評価されました。研究参加者は、各訪問に備えて事前検査ガイドラインに従うよう求められました(表 S3)。 |
| 2.4. 採血と血液化学検査 |
| 空腹時の血液サンプルは、標準化されたプロトコル (World Health Organization, 2010) に従って、23G バタフライ針 (Greiner Bio-One GmbH、クレムスミュンスター、オーストリア) を使用して、被験者の肘静脈から 9 ml K2EDTA チューブ (Vacuette®; Greiner Bio-One GmbH、Kremsmünster, Austria) と 9 ml リチウムヘパリンチューブ (Vacuette®; Greiner Bio-One GmbH、Kremsmünster, Austria) に採取され、空腹時の 総コレステロール、LDL-コレステロール、HDL-コレステロール、トリアシルグリセリド、ALT、AST、ALP、アポ B、GGT、アルブミン、総ビリルビン、総タンパク質、およびビタミン D (25-ヒドロキシコレカルシフェロール) が測定されました。 すべてのサンプルは、遠心分離まで氷上に保管されました。 血漿サンプルは 1000 g で 15 分間遠心分離して回収し、1.5 ml のマイクロ遠心管に分注して、採取後 1 時間以内に -20 ℃ で凍結しました。サンプル分析は、Affinity Biomarker Labs (Imperial College London、W12 0BZ) が Siemens ADVIA 1800 化学分析装置 (Siemens Healthcare Diagnostics Inc.、Germany) と Siemens ADVIA Centaur XP 免疫化学分析装置 (Siemens Healthcare Diagnostics Inc.、Germany) を使用して実施しました。 |
| 2.5. 胃腸および気分パラメータ |
| 治療中およびウォッシュアウト期間中の胃腸および気分パラメータの変化は、胃腸および気分変化質問票に記録されました。以下のパラメータが毎日記録されました: 排便回数、ブリストルチャート (Lewis & Heaton, 1997) による便の硬さ、腹痛、胃または腸の膨張、鼓腸の発生および重症度 (なし、軽度、中等度、重度)。 気分の変化 (幸福、機敏、活発、ストレス) は、次のように記録されました: 正常より少ない、正常、正常以上。 |
| 2.6. 検出力計算と統計分析 |
| この研究は、血中脂質に関する過去のヒト介入研究(Cho & Kim,2015、Dixon et al.,2020 、Tamayo,2008)の知見に基づき、総コレステロールの変化の平均(±SD)log 変化:1.2 に基づいて、80% の統計検出力を提供するように検出されました(MGH Biostatistics Hedwig Software)。これらの計算を考慮すると、両側 0.05 有意水準で治療の差を検出するには、16 人の参加者(15% の脱落を許容)が必要でした。 |
| 最初の一連の統計分析では、2 つの研究グループのベースライン特性を比較しました。すべてのデータ結果の連続性と正規分布は、非対称 t 検定分析の前に確立されました。正規分布していない連続変数を比較するために、Mann-Whitney U 検定が使用されました。その後、ベースライン後の時点の結果が調べられ、時点は別の分析で分析されました。分析は共分散分析 (ANCOVA) を使用して実行され、期間開始時の結果は共変量と見なされました。分析は、次の研究期間で実行されました: 3 週目 - ベースラインに対して調整済み、6 週目 - ベースラインに対して調整済み、ウォッシュアウト期間 - ベースラインに対して調整済み、ウォッシュアウト期間 - 6 週目に対して調整済み。特定の胃腸変数 (腹痛および膨満感) は、正に偏った分布を示しました。分析方法の仮定を満たすために、値は対数スケールで分析されました。ゼロ値を許容するために、変換前にすべての値に小さな定数が追加されました。 |
| 統計分析は、Stata バージョン 15.1 (Stata Corp.、College Station, TX, USA) および GraphPad Prism バージョン 9.0.0 (GraphPad Software, Inc.、San Diego, CA, USA) を使用して実施しました。差は、p < 0.05 のレベルで統計的に有意であるとみなされました。 |
| 3. 結果 |
| 3.1. ベースラインの人口統計学的変数 |
| ベースラインでは、測定された人体計測パラメータにおいて、アクティブグループとプラセボグループの間に統計的に有意な差は見られませんでしたが、拡張期血圧はプラセボグループと比較して治療グループで有意に低かったです(p =0.003、表S4)。 |
| その後の分析では、ベースライン後の時点での結果の変化に関して治療グループ間の違いを比較しました。 |
| 3.2. 人体計測データ、体組成および血圧 |
| L. plantarum ECGC 13110402 の摂取により、プラセボと比較して、3 週目にウエスト周囲径 (p=0.005)、ヒップ周囲径 (p=0.002)、脂肪量 (p=0.03) など、さまざまな人体計測および体組成の測定値が有意に減少しました。この効果は一時的であり、ヒップ周囲径の変化を除いて、6 週目または 9 週目に有意差は認められませんでした (表 S5)。ヒップ周囲径は、ウォッシュアウト終了時 (9 週目) にプラセボと比較してアクティブ グループで有意に低くなりました (p=0.04)。 |
| 3.3. 脂質パラメータ |
| アクティブ治療およびプラセボ治療が血中脂質濃度に与える影響は表 2 に示されています。アクティブグループの総コレステロール濃度は、治療期間のベースラインから 3 週間 (p=0.001) およびベースラインから 6 週間 (p=0.001) においてプラセボグループと比較して有意に低かった。ベースラインから 9 週目 (ウォッシュアウト) までの期間では、アクティブグループとプラセボグループの総コレステロールに有意差は認められなかった。 |
| 表 2 ベースライン、3 週目、6 週目 (治療終了時)、9 週目 (ウォッシュアウト) におけるアクティブグループ (n=8) とプラセボグループ (n=8) の血中脂質濃度 (平均 ± 標準偏差)。 |
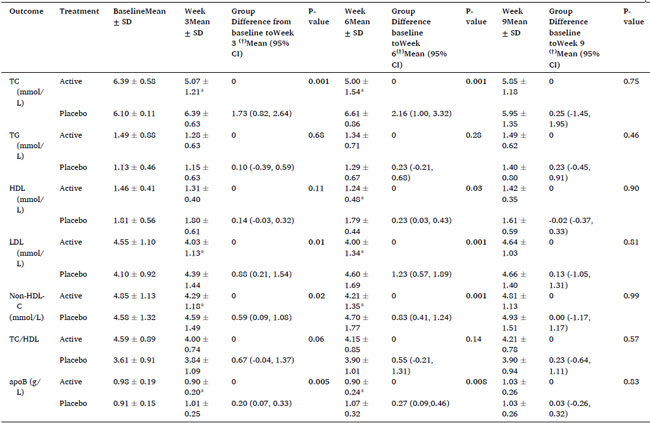 |
TC: 総コレステロール、TG: トリグリセリド、HDL: 高密度リポタンパク質、LDL: 低密度リポタンパク質、Non-HDL-C: 非高密度リポタンパク質コレステロール、TC/HDL 比: 総コレステロールと高密度リポタンパク質コレステロールの比、apoB: アポリポタンパク質 B。 (†) ANCOVA 分析から計算し、ベースライン値を調整。 * p < 0.05 で統計的有意性を示します。 |
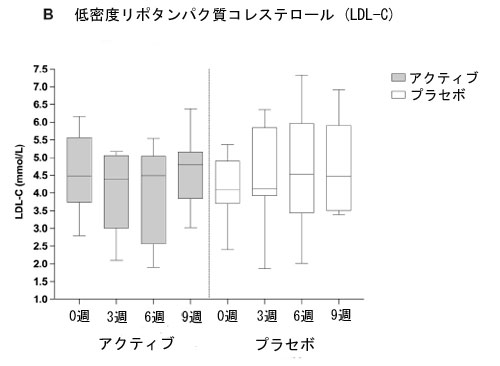
| LDL-コレステロール濃度は、ベースラインから 3 週目 (p=0.01) およびベースラインから 6 週目 (p=0.001) の治療期間において、プラセボと比較してアクティブグループで統計的に有意に低かった。ベースラインから 9 週目 (ウォッシュアウト) の期間では、アクティブ グループとプラセボ グループの間に有意差は認められなかった。 |
| ベースラインから 3 週間までの期間において、2 つの治療グループ間で HDL-コレステロール濃度に統計的に有意な変化は見られませんでした。アクティブグループでは、ベースラインから 6 週間までの期間に HDL-コレステロールの統計的に有意な減少が見られました (p=0.03)。この期間中、アクティブグループとプラセボグループの両方でこのバイオマーカーの減少傾向が見られました。全体として、プラセボグループの HDL-コレステロールは、ベースラインから 6 週間までの期間で平均 0.23 mM 高くなりました。 |
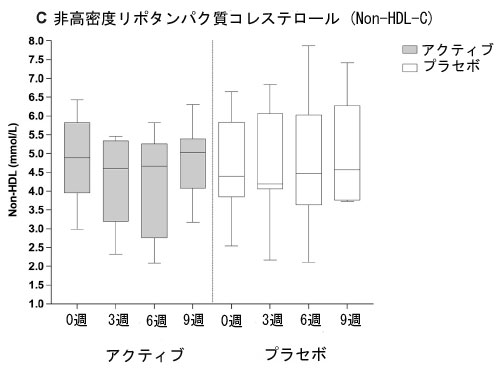
| 総コレステロールおよび LDL-コレステロールと同様に、非HDL-コレステロール濃度は、ベースラインから 3 週目 (p=0.02) およびベースラインから 6 週目 (p=0.001) の両方において、プラセボと比較してアクティブ グループの方が統計的に有意に低かった。ベースラインから 9 週目 (ウォッシュアウト) の期間では、アクティブ グループとプラセボ グループの間に有意差は認められなかった。 |
| アポB濃度は、ベースラインから3週目(p=0.005)および6週目治療期間(p=0.008)の両方で、プラセボと比較してアクティブグループの方が統計的に有意に低かった。他の血中脂質バイオマーカーと同様に、ベースラインから9週目(ウォッシュアウト)の期間では治療グループ間で有意差は認められなかった。 |
| 研究期間中、どちらのグループでも 総コレステロール/高密度リポタンパク質比または トリグリセリド濃度に統計的に有意な変化は認められませんでした。 |
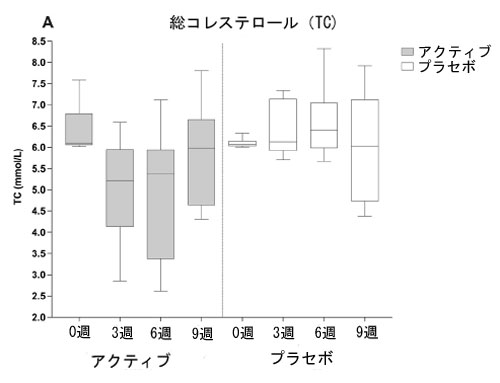
| 図 2 は、アクティブグループとプラセボグループのベースラインから 9 週間までの血中脂質バイオマーカー濃度の推移を示しています。総コレステロール (A)、LDL-コレステロール (B)、非 HDL-コレステロール(C)、およびアポ B (D) は、アクティブ治療の 6 週間にわたって減少傾向を示していますが、この効果はプラセボグループでは見られませんでした。 |
 |
 |
 |
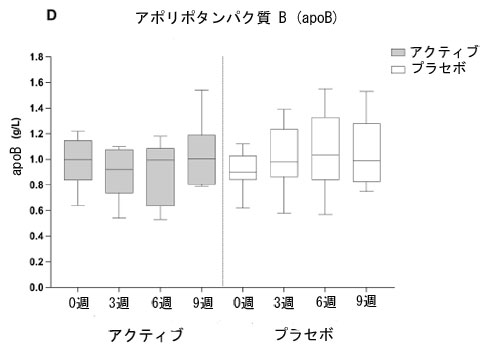 |
| 図 2 A 総コレステロール (TC)、B 低密度リポタンパク質コレステロール (LDL-C)、C 非高密度リポタンパク質コレステロール (非 HDL-C)、D アクティブグループおよびプラセボグループの 3 週目および 6 週目 (治療終了時) と 9 週目 (ウォッシュアウト時) のアポリポタンパク質 B (apoB) 血中脂質濃度 (mmol/L)。箱ひげ図は、最小値から最大値までの分布を持つ個々のデータ ポイントを表します。太線は中央値、下列と上列は 25 パーセンタイルと 75 パーセンタイル、下列と上列は最小値と最大値を表します。 |
| 3.4. 肝機能バイオマーカーとビタミンD |
| 治療期間中、肝機能検査 (総タンパク質、アルブミン、ALT、AST、GGT、ビリルビン) に統計的に有意な変化は認められませんでした。ウォッシュアウト期間終了時に、プラセボと比較して、アクティブ グループではグロブリン値が統計的に有意に減少しました (p=0.03)。研究期間中、ビタミン D レベルに統計的に有意な変化は認められませんでした (表 3 および表 S6)。 |
| 表3 ベースライン、3週目、6週目(治療終了時)、9週目(ウォッシュアウト)におけるアクティブグループ(n=8)とプラセボグループ(n=8)の肝機能バイオマーカーとビタミンD濃度(平均±標準偏差) |
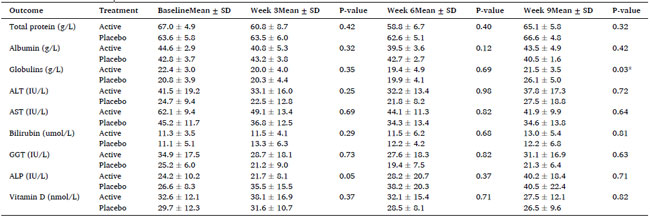 |
ALT: アミノトランスフェラーゼ、AST: アスパラギン酸アミノトランスフェラーゼ、GGT: ガンマグルタミルトランスフェラーゼ、ALP: アルカリホスファターゼ、apoB: アポリポタンパク質 B。 (†) ANCOVA 分析から計算し、ベースライン値を調整。 * p < 0.05 で統計的有意性を示します。 |
| 3.5. 胃腸症状と気分 |
| どちらの研究グループでも、排便頻度や排便形態に統計的に有意な変化は見られませんでした。同様に、研究期間中、腹痛、膨満感、鼓腸に統計的に有意な変化は見られず、個々の 1 日値で 1 を超える胃腸症状 (存在するが、十分に許容される) が報告された人はいませんでした。研究期間中、幸福感、注意力、エネルギー、ストレス レベルに統計的に有意な変化は見られませんでした (表 S7 – S8)。 |
| 4. 考察 |
| この二重盲検プラセボ対照試験では、L. plantarum ECGC 13110402 株が脂質異常症患者の脂質プロファイルを安全に改善できることが示されました。研究結果では、L. plantarum ECGC 13110402 の補給後に総コレステロール、LDL-コレステロール、非 HDLコレステロール、アポ B などの 冠状動脈性心疾患パラメータが改善することが示唆されました。 これらの結果は、この L. plantarum 株による胆汁酸脱抱合の増加によるものと考えられます。さらに、補給によって忍容性、気分、ビタミン D レベル、肝臓パラメータは変化しませんでした。したがって、この研究は、L. plantarum ECGC 13110402 補給が脂質異常症患者の脂質プロファイルを改善するための効果的で安全な戦略である可能性があることを示唆しています。 |
| アクティブグループとプラセボグループのグループ差を、各研究ポイントのベースラインに合わせて調整したところ、脂質プロファイルにおいて統計的かつ生物学的に有意な減少が3週間という早い段階で観察され、介入終了時(6週間)にはアクティブグループで統計的に有意な減少が維持されていました。総コレステロール、LDL-コレステロール、アポB、非HDL-コレステロールの減少はアクティブグループでのみ発生し、L. plantarum ECGC 13110402の摂取に直接関連しており、治療中止後(ウォッシュアウト)にはアクティブグループとプラセボグループの間で脂質パラメータに有意差は認められませんでした。プロバイオティクスが腸内に定着することはめったにありませんが、そのことが有効性を損なうことはなく、腸内通過中に増殖し、代謝的に活性になることがあります(Sanders et al., 2019)。参加者は研究期間中、食習慣や活動レベルを変えないように指示されていたため、脂質への影響はL. plantarum ECGC 13110402の摂取に関連していることが研究結果から示唆され、冠状動脈性心疾患リスク管理をサポートする食事戦略の機能性を高める可能性が強調されました。 |
| いくつかの研究で、プロバイオティクス菌株のコレステロール低下能が調査されていますが、その効果はさまざまです (Costabile et al., 2017; Fuentes et al., 2013; Jones et al., 2012)。Fuentes と共著者は、高コレステロール血症の成人における L. plantarum の 3 剤配合のコレステロール低下効果について報告し、総コレステロールと LDL-コレステロールがそれぞれ 17.4% と 17.6% 低下したことを報告しました (Fuentes et al., 2013)。 Jonesと共著者らは、高コレステロール血症の成人における >Lactobacillus reuteri NCIMB 30242 のコレステロール低下効果を調査し、プラセボと比較して 総コレステロールが 9.14%、LDL-コレステロールが 11.64%、非 HDL-コレステロールが 11.30%、アポ B が 13.39% という統計的に有意な減少を示した (Jones ら、2012)。これまでの研究のほとんどは 総コレステロールと LDL-コレステロールのみに焦点を当てており、軽度の減少のみが報告されている。L. plantarum ECGC 13110402 は、正常から軽度の高コレステロール血症の成人の脂質プロファイルを大幅に改善し、高コレステロール血症のサブグループでは総コレステロールが 36.7% という統計的に有意な減少を示した (P=0.0045) ことが以前に報告されている。しかし、追加の冠状動脈性心疾患バイオマーカーへの影響は調査されていません (Costabile et al.,2017)。このパイロット追跡調査の結果は、プロバイオティクスの摂取により、複数の冠状動脈性心疾患リスクバイオマーカーが統計的に非常に有意に減少したことを示していますが、著者の知る限りでは、これほどの変化はこれまで報告されていませんでした。 |
| コレステロール、特に LDL-コレステロールを減らすことは、世界中で冠状動脈性心疾患管理の基礎となっています。LDL-コレステロールをターゲットとした薬理学的戦略の使用により、過去 30 年間で 心血管疾患による死亡は減少しましたが、これは冠状動脈性心疾患関連の死亡率には反映されていません。LDL-コレステロール目標を達成できない患者が増えていますが、これは部分的には、高強度スタチン処方の不足や処方された治療への順守不良が原因です (Caesar et al.,2016、Le Roy et al.,2019 )。スタチンの使用と LDL-コレステロール目標達成への影響を調べた米国を拠点とする研究では、LDL-コレステロール値が高い 2,740 万人の成人のうち、60% 以上が LDL-コレステロール目標を達成できなかったことが報告されています (Weng et al.,2010)。これらの調査結果は、既存のライフスタイル、食事、および医薬品戦略をサポートするために、複数の冠状動脈性心疾患リスクバイオマーカーに有効で、耐容性の高いコレステロール管理アプローチに対する満たされていないニーズがあることを示唆しています(Hosono,1999、Lye.Rahmat-Ali et al.,2010)。 |
| 乳酸菌を含む腸内細菌が体内のコレステロールサイクルと相互作用するメカニズムはいくつか説明されています。研究により、乳酸菌は成長中にコレステロールを細胞膜に取り込むことができ、このプロセスによって膜の強度が増し、細胞の溶解に対する抵抗力が強化されることがわかっています (Lye.Rusul et al.,2010)。コレステロール粒子は、一部の乳酸菌株の細胞膜に吸着し、その後、受動的に体から除去されます (Hosono、1999)。ただし、ヒト宿主にとって生物学的に重要な変化を媒介する可能性が最も高いメカニズムは、宿主の代謝と相互作用する細菌の酵素プロセスを伴うメカニズムです。乳酸菌株を含む特定の腸内細菌は、コレステロールをコプロスタノールに変換する触媒となるコレステロールエステラーゼを発現することが報告されています。コプロスタノールはコレステロールとは異なり、ヒトの腸で吸収されにくく、その後糞便中に排泄されます (Aicha et al., 2019; Kenny et al., 2020)。最近の研究では、肝臓でのコレステロール代謝に関与する遺伝子 (HMG-CoA 還元酵素など) の発現に影響を与えたり (Lew et al., 2018)、胆汁酸塩加水分解酵素活性を介して胆汁酸の恒常性に干渉したりすることで、乳酸菌が宿主の代謝経路により直接的に関与していることが示されています。 |
| 胆汁酸塩加水分解酵素は抱合胆汁酸の C24 アシルアミド結合の加水分解を触媒し、腸肝循環から除去します。これにより肝臓でのコレステロール利用が促進され、胆汁酸の新規合成が促進され、胆汁酸のレベルが一定に保たれます (Begley et al.,2006)。胆汁酸塩加水分解酵素活性を持つプロバイオティクスは、腔内胆汁酸塩の脱抱合を促進することが示されています。脱抱合された胆汁酸は溶解性が低下し、腸で吸収されて糞便中に排泄されるか、腸内細菌叢によって二次胆汁酸代謝物にさらに生体変換されます (G´erard,2013、Joyce et al.,2014、Ridlon et al.,2006)。 L. plantarum ECGC 13110402 は、高い胆汁酸塩加水分解酵素活性、高いコレステロール同化、細胞膜吸着など、in vitro でのコレステロール低下の複数の作用機序を実証するために選択されました (Costabile ら、2017)。この研究で観察されたコレステロール低下の程度は、細胞膜への受動吸着ではなく、主に胆汁酸塩加水分解酵素活性とコレステロール同化によるものであり、細胞膜への受動吸着は生物学的意義がそれほど高くないと考えられます。L. plantarum ECGC 13110402 は、腸-肝軸内の宿主脂質代謝との相互作用を通じて、血中脂質プロファイルの改善とコレステロール管理の既存戦略のサポートを目的とした食事療法の機能性を高める可能性を示しています。 |
| 胆汁酸の再循環を遮断してコレステロールを減らすという概念は新しいものではありません。コレスチラミン、コレスチポール、コレセベラムなどの胆汁酸捕捉剤は、細菌の胆汁酸塩加水分解酵素によるコレステロール減少のメカニズムと類似点があります。つまり、これらの薬剤は酸と結合することで肝臓での再吸収を防ぎ、肝臓のコレステロール需要を増加させます。コレスチラミンの最大 1 日用量 24 g、コレスチポール 20 g、コレセベラム 4.5 g を使用すると、LDL-コレステロールが 18 ~ 25% 減少します (Mazidi et al.,2017)。ただし、低用量でも消化管の副作用があり、一般的に処方される薬剤との大きな薬物相互作用があるため、臨床現場での使用は制限されています。現在、LDL-コレステロールを管理する最も効果的な薬剤はスタチンです。中程度のスタチン治療では LDL-コレステロールが約 30% 減少しますが、高用量の治療では 50% を超える減少をもたらす可能性があります (Vissaren et al., 2021)。明らかな利点があるにもかかわらず、筋肉関連の副作用が原因の一部ですが、メディアによる否定的な報道もあって、治療の遵守率は低いです (Matthews et al., 2016; Nielsen & Nordestgaard, 2016)。最近の英国を拠点とする研究では、6 年後、高強度スタチン治療の遵守率は 72% に低下し、低強度スタチン治療ではわずか 48% に低下したと報告されています (Khunti et al., 2018)。現在の薬物治療の限界に対する認識が高まるにつれて、血中脂質プロファイルを改善するための非薬物アプローチへの関心が高まっています。植物ステロールとスタノールに関する 80 件を超える研究を徹底的に検討した結果、欧州食品基準庁は、1 日 2.4 g の摂取で LDL-コレステロールが 7 ~ 10.5% 減少する可能性があるという結論を出しました。評価委員会は、冠状動脈性心疾患のリスク軽減という観点から、LDL-コレステロールのこの程度の減少は生物学的に重要であると判断しました (Laitinen & Gylling,2012)。この研究結果から、L. plantarum ECGC 13110402 を毎日摂取すると、副作用がない場合でも、6 週間の治療終了時に LDL-コレステロールが統計的かつ生物学的に有意に 28.4% 減少する可能性があることが示唆されています。 |
| この研究では、複数の冠状動脈性心疾患マーカーで生物学的および統計的に有意な効果が観察されましたが、一定の限界があります。この研究は 12 週間の介入として設計されており、0、6、9、12 週間のサンプリング ポイントとそれに続く 3 週間のウォッシュアウトが行われます。COVID-19 の制限により、研究期間は 6 週間の治療とそれに続く 3 週間のウォッシュアウトに制限されました。当初の計画どおり、より多くのサンプリング ポイントでより長い研究を行っていれば、効果がより長い治療期間にわたって累積されたのか、または 6 週間でピークに達したのかを示すことができたかもしれません。同様に、COVID-19 の制限により、当初のボランティア サンプル サイズは 50 から 16 に減少しました。結果は、両側 0.05 の有意性で治療の差がある統計的有意性を示していますが、サンプル サイズが大きいほど、高コレステロール血症の集団をより代表する可能性があります。最後に、研究のボランティアは、試験期間中に食習慣や運動パターンを変えたり、プレバイオティクスやプロバイオティクスのサプリメントを摂取したりしないように求められました。これは研究目的には必要でしたが、現実世界の状況を反映していない可能性があります。 |
| 結論として、この研究の結果は、L. plantarum ECGC 13110402 を毎日摂取することが、高コレステロール血症の成人の脂質プロファイルを改善するための、忍容性が高く、安全で効果的な手段である可能性があることを示唆しています。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Journal of Functional Foods 89 (2022) 104939に掲載されたThe cholesterol lowering efficacy of Lactobacillus plantarum ECGC 13110402 in hypercholesterolemic adults: a double-blind, randomized,placebo controlled, pilot human intervention study.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


