ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
過体重被験者の体脂肪に対するLactobacillus plantarum LMT1-48の効果 :ランダム化二重盲検プラセボ対照試験 |
Minji Sohn et al., |
|
|
要約 |
| 背景:我々は、韓国の発酵食品と新生児の糞便から分離されたLactobacillus plantarum株LMT1-48(以下L. plantarumLMTI-48)が、過体重患者の治療に適したプロバイオティクスサプリメントであるかどうかを調査した。 |
| 方法:このランダム化二重盲検プラセボ対照臨床試験では、BMI が 25 ~ 30kg/m2 のボランティア 100 名がランダムに割り当てられました (1:1)。2×1010コロニー形成単位のL. plantarum LMT1-48を受ける群、またはプラセボ治療群に投与する。 体組成は二重エネルギー X 線吸収測定法によって測定され、腹部内臓脂肪面積 (VFA) と皮下脂肪面積はコンピューター断層撮影スキャンによって測定されました。 体脂肪、腹部内臓脂肪面積、人体計測パラメータ、バイオマーカーの変化、2 つの治療グループ間で比較されました (ClinicalTrials.gov 番号: NCT03759743)。 |
| 結果:12 週間の治療後、L. plantarum LMT1-48 グループの体重は 76.6±9.4 kg から 75.7±9.2 kg に大幅に減少しました。しかし、プラセボグループでは変化がありませんでした(グループ間 P=0.022)。同様のパターンが 2 つのグループ間の腹部内臓脂肪面積で見つかりました (P=0.041)。 血清インスリンレベル、対応するインスリン抵抗性の恒常性モデル評価、およびレプチンレベルは、L. plantarum LMT1-48 グループで減少しましたが、プラセボグループでは増加しました (すべて P<0.05)。 L. plantarum LMT1-48 による治療による体重および BMI の減少は、乳酸菌レベルの増加と有意に相関していました。 L. plantarum LMT1-48 もオシリバクターのレベルを大幅に増加させました。 これらはトリグリセリドおよびアラニントランスアミナーゼレベルと負の相関がありました。 |
結論:L. plantarum LMT1-48 の投与により、これらの患者の体重、腹部 腹部内臓脂肪面積、インスリン抵抗性、レプチンレベルが減少しました。 過体重の被験者に有効であり、抗肥満症治療の可能性を示唆しています。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.方法 |
| 2.1.研究参加者 |
| 2.2.研究デザイン |
| 2.3.介入・手続き |
| 2.4.糞便収集と腸内微生物叢の分析 |
| 2.5.バイオインフォマティクス解析 |
| 2.6.統計分析 |
| 3.結果 |
| 3.1.ベースライン特性 |
| 3.2. L. plantarum LMT1-48 摂取が人体計測および生化学パラメータに及ぼす影響 |
| 3.3. L. plantarum LMT1-48 摂取が人体計測および生化学パラメータに及ぼす影響 |
| 3.4. L. plantarum LMT1-48摂取による体脂肪への影響 |
| 3.5.肥満関連サイトカインおよびホルモンに対する L. plantarum LMT1-48 摂取の影響 |
| 3.6. L. plantarum LMT1-48摂取が腸内細菌叢に及ぼす影響 |
| 3.7安全性評価 |
| 4.議論 |
| 5.結論 |
本文 |
| 1.はじめに |
| 肥満は過剰な脂肪の蓄積として定義され、心血管疾患、糖尿病、数種類の癌などの他の疾患のリスクを高める複雑な慢性病状です[1]。 肥満は世界的な公衆衛生問題となっており、2016 年には世界の成人の 39% が過体重、13% が肥満でした [2]。 肥満の治療は、食事、運動、行動の修正などの包括的なライフスタイル管理から始まりますが[3]、薬理学的介入が必要になることもよくあります。 ただし、新しく開発された抗肥満薬には副作用がある可能性があるため、注意して使用する必要があります。 したがって、肥満の治療に使用できる安全で効果的な新しい治療法が必要とされています。 |
| 肥満の寄与因子の中でも、腸内マイクロバイオームは栄養素の獲得、エネルギー調節、脂肪貯蔵のプロセスに影響を与えるため、最近かなりの注目を集めています[4]。 人間の腸内には何千もの異なる細菌種が生息しており、宿主との共生関係を維持し、宿主の代謝において重要な役割を果たしています[5]。 宿主と微生物の共代謝により、多糖類は発酵して短鎖脂肪酸となり、エネルギー源として使用したり、ペプチド YY やグルカゴン様ペプチド-1 (GLP-1) などのホルモンを調節する G タンパク質共役受容体に結合したりできます。 )[5]。 腸内マイクロバイオームの変化と肥満の発症との関連を説明するメカニズムはまだ不完全ですが、微生物の腸内細菌叢の異常を回復し、腸の恒常性を維持することを目的としたさまざまな方法が、肥満を治療する有望な代替療法として試みられています。 これらには、プレバイオティクス、プロバイオティクス、および/またはシンバイオティクスの補給、および糞便微生物移植が含まれます[6]。 |
| プロバイオティクスは、宿主に有益な効果をもたらす生きた微生物です [5]。 多くの研究は、プロバイオティクスの補給が常在微生物叢の組成および活性の調節に役立つ可能性があり、それによって肥満に対抗する可能性があることを示唆しています[7]。 多くの研究は、微生物の多様性の増加、病原性細菌の増殖の阻害、短鎖脂肪酸の産生の刺激、食欲の調節など、肥満の治療と予防におけるプロバイオティクスの役割の可能性を示唆しています[8]。 報告されているプロバイオティクスの中で、抗肥満効果のある種のほとんどは、Lactobacillus と Bifidobacterium に属しています[9]。 |
| Lactobacillus は人間の腸内に通常存在するグラム陽性嫌気性菌の属で、L. acidophilus, L. curvatus, L.gasseri, L.rhamnosus, L.casei, L.amyhlovorus, L.sakei,および L. plantarum, は、肥満と闘うための代替戦略として提案されています [10,11]。 体重と脂肪量に対する効果を超えて、2.4×109 コロニー形成単位 (CFU) の 乳酸菌種のサプリメントを肥満手術と組み合わせた場合、追加の減量効果も示したことが報告されています [12]。 中でも、L. plantarum は食品への使用に安全であると一般に認識されており、古くから広く使用されているため、大きな注目を集めています [13]。 |
| プロバイオティクスの抗肥満効果は厳密に菌株特異的であり [7]、研究者はより強力な治療活性を持つプロバイオティクス菌株を探し続けています [14]。 我々は、韓国の発酵食品と新生児の糞便から新規の L. plantarum 株 (LMT1-48) を単離し、その強力な抗肥満活性とその根底にある分子機構を in vitro および高脂肪食誘発肥満マウスモデルで報告しました。 15、16]。 ここでは、肥満患者におけるL. plantarum | LMT1-48 の有効性と安全性を調査しました。
| 2.方法 |
| 2.1.研究参加者 |
| 117 人の健康な成人ボランティアが適格性についてスクリーニングされ、肥満指数 (BMI) の範囲が 25 kg/m2 以上から 30 kg/m2 未満であると定義されています。 そのうち、 慢性疾患の併存症(糖尿病や心血管疾患など)、 抗生物質またはプロバイオティクスを含む製品の摂取、 体重に影響を与える可能性のある薬剤の使用(食欲不振薬、抗うつ薬、ベータ遮断薬、利尿薬、ホルモン避妊薬、ステロイドなど)、 食事管理プログラムへの参加、 3か月以内に体重の変動が10%を超えることなどの除外基準に従って 7 件を除外した後、100 件がこの研究に含まれました。 すべての参加者は、研究手順と研究に関連する可能性のあるリスクについて説明を受け、書面によるインフォームドコンセントを提出しました。 |
| 2.2.研究デザイン |
| これは、二重盲検、プラセボ対照、単施設ランダム化対照試験 (RCT) でした。 この検査は、韓国の適正臨床基準ガイドラインおよび 2013 年ヘルシンキ宣言 (第 7 回改訂) に従って実施されました。 参加者は、性別による層別化による動的割り当て法を使用して、LMT1-48 またはプラセボ治療群のいずれかに 1:1 の比率でランダムに割り当てられました。 被験者には盲検化のための個別のスクリーニングコードが提供されました。 実験プロトコールは、ソウル大学盆唐病院の治験審査委員会 (B-1805-469-004) によって承認され、www.clinicaltrials.gov (NCT03759743) に登録されました。 |
| 2.3.介入・手続き |
| 治験製品(L. plantarum LMT1-48)は、プロバイオティクス製造業者(Medytox Inc.、ソウル、韓国)から提供されたものと同じパッケージで参加者に与えられました。 LMT1-48 カプセルには 10% の L. plantarum LMT1-48 と 90% のマルトデキストリンが含まれており、プラセボ カプセルには 100% のマルトデキストリンが含まれていました。 無作為化訪問では、L. plantarum LMT1-48 またはプラセボ カプセルが被験者に配布され、被験者は 12 週間にわたって 1 日 1 回、そのうち 2 つを摂取するように求められました。 各 L. plantarum LMT1-48 カプセルには、1 × 1010 CFU の L. plantarum LMT1-48 が含まれていました。 プロトコールの順守は、来院のたびに残ったカプセルを数えることによって厳密に監視されました。 |
| 研究の開始から終了まで、参加者は公開された規則を遵守することで健康的なライフスタイルを維持するよう指導されました[17]。 1 日のカロリー摂取量は、CAN-Pro 5.0 ソフトウェア (KNS、ソウル、韓国) と、訪問前 1 週間以内の 3 日間 (平日 2 日、週末 1 日) の食事摂取情報を使用して計算されました。 |
| バイタルサイン、人体測定値、体脂肪、腹部脂肪蓄積を0週目(ベースライン)、6週目、および12週目にチェックしました(補足図1)。 全身組成の測定には、二重エネルギー X 線吸光光度法 (Horizon W、Hologic Inc.、ベッドフォード、マサチューセッツ州、米国) を使用しました。 腹部コンピューター断層撮影スキャン (Somatom Sensation 16、Siemens、ミュンヘン、ドイツ) を使用して、腹部内臓脂肪面積 (VFA) と皮下脂肪面積 (SFA) を測定しました。 腹部の総脂肪面積(TFA)は、腹部内臓脂肪面積と 皮下脂肪面積の合計として計算されました。 |
| 空腹時血糖値(日立、東京、日本にある 747 臨床化学分析装置を使用)、アスパラギン酸トランスアミナーゼ(AST)およびアラニントランスアミナーゼ(ALT)(ニコチンアミドアデニン ジヌクレオチド水素紫外線 [NADH-UV] 法)などの生化学パラメーター。 アルカリホスファターゼ (AnaSpec、サンノゼ、カリフォルニア州、米国)、クレアチニン (Jaffe の速度論的方法)、血中尿素窒素 (Jaffe の速度論的方法)、 および脂質パネル(747 Clinical Chemistry Analyzer)は、0週目(ベースライン)、6週目、および12週目に測定されました。 |
| 胃抑制ポリペプチド(GIP)およびGLP-1のレベル(ELISA、MilliporeSigma、米国マサチューセッツ州バーリントン)、インスリン(ECLIA、Linco、米国ミズーリ州セントチャールズ)、グルカゴン(Mercodia AB、 スウェーデン、ウプサラ)、遊離脂肪酸(747 臨床化学分析装置)、および高感度 C 反応性タンパク質(CRP-Latex [II]X2、Denka Seiken Co.、東京、日本)を、ベースラインおよび12週間後の血清サンプルから測定しました。 アディポネクチン(ELISA、大塚製薬株式会社、東京、日本)およびレプチン(R&D Systems、ミネアポリス、米国ミネソタ州)を血漿サンプルから測定しました |
| 2.4.糞便収集と腸内微生物叢の分析 |
| 糞便サンプルを収集し、Macrogen (韓国、ソウル) が提供する滅菌糞便収集キットを使用して訪問日から 3 日以内に凍結しました。 糞便サンプルからの DNA は、メーカーのプロトコルに従って DNeasy PowerSoil Kit (QIAGEN、ドイツ、ヒルデン) を使用して抽出され、量と品質は、VICTOR Nivo (PerkinElmer、ウォルサム、ワシントン州) を使用して PicoGreen (Promega、米国ウィスコンシン州マディソン) によって測定されました。 米国マサチューセッツ州)。 16S rDNA シーケンスでは、Illumina 16S Metagenomic Sequencing Library Preparation プロトコル (Illumina、サンディエゴ、カリフォルニア州、米国) に従って糞便サンプルを次のように調製しました。 16S rRNA 遺伝子は、16S プライマー V3 ~ V4 を使用してゲノム DNA から増幅されました。 その後の制限サイクル増幅ステップを実行して、多重化インデックスと Illumina シーケンス アダプターを追加しました。 最終生成物は、PicoGreen を使用して正規化され、プールされました。 ライブラリーのサイズは、TapeStation DNA スクリーンテープ D1000 (Agilent Technologies、サンタクララ、カリフォルニア州、米国) を使用して検証し、Illumina MiSeq プラットフォームを使用して配列決定しました。 |
| 2.5.バイオインフォマティクス解析 |
| シーケンスが完了した後、インデックスシーケンスを使用して MiSeq 生データがサンプルごとに分類され、各サンプルの FASTQ ファイルが生成されました。 FASTP (v. 0.19.7) プログラム [18] を使用してアダプター配列を削除し、2 つのリードが重複する領域でエラー修正を実行しました。 各サンプルごとに分離されたペアエンド データは、FLASH (v. 1.2.11) [19] を使用して単一のシーケンスに組み立てられました。 得られた配列は、CD HIT out と CD HIT EST に基づく操作分類単位 (OTU) 解析プログラムを使用して、シーケンシングエラーと考えられる低品質配列、あいまいな配列、キメラ配列を除去した後、97% 以上の配列類似性でクラスター化されました [20]。 これは種レベルの 操作分類単位を形成するために使用されました。 各操作分類単位 の代表配列について、リファレンス DB (NCBI 16S Microbial) 上で BLAST+ (v. 2.9.0) [21] を行い、最も類似性の高い対象の生物情報と QIIME を用いて分類学的割り当てを行った( v. 1.9) [22,23]。 サンプル内の微生物群集の種の多様性と均質性を確認するために、シャノン指数が取得され、希薄化曲線と Chao1 値によってアルファ多様性情報が確認されました [23] |
| 2.6.統計分析 |
| サンプルサイズ 100 人の被験者により、90% の検出力、0.05 の両側タイプ I 誤差、および 15% の許容ドロップアウト率が保証されました。 有効性分析は、主要結果として追跡調査の体脂肪評価とともに少なくとも1回の治験薬の投与を受けたすべての無作為化参加者として定義される完全な分析セットに対して実施されました。 連続変数の臨床変数と腸内微生物の特徴は、2 サンプルの Student の t 検定または Wilcoxon の順位和検定で分析されました。 安全性エンドポイントには、治験薬の投与を受けた患者における有害事象および重篤な有害事象の発生率が含まれ、それらはカイ二乗検定またはフィッシャーの直接確率検定を使用して分析されました。 栄養補助食品後の臨床値と対数変換された微生物叢数の間の関係は、スピアマンの相関分析の対象となりました。 微生物データの P 値は、多重比較のために Benjamini-Hochberg 法を使用して調整されました。 |
| 有意性は両側 P<0.05 として定義されました。 すべての臨床および微生物統計分析は、R ソフトウェア バージョン 4.1.0 (R Development Core Team、オーストリア、ウィーン) および RStudio バージョン 1.4.1103 (RStudio、ボストン、マサチューセッツ州、米国) を使用して実施されました。 |
| 3.結果 |
| 3.1.ベースライン特性 |
| 100人の被験者はL. plantarum LMT1-48グループとプラセボグループにランダムに割り当てられました(補足図2)。 プラセボの被験者の 1 人は、治験製品を受け取る前に研究への参加を辞退しました。 研究期間中、L. plantarum LMT1-48群の被験者4名とプラセボ群の被験者10名が追跡有効性評価に失敗したため脱落した。 そして最終的に85人の被験者(L. plantarum LMT1-48群46人、プラセボ群39人)がこのRCTを完了した。治験薬を投与された被験者のベースライン特性を表 1 にまとめます。 この研究には、BMIがL. plantarum LMT1-48群で27.1±1.5kg/m2、プラセボ群で27.3±1.6kg/m2の中年韓国人被験者が参加した。 すべてのベースラインパラメータに関して、2 つのグループ間に統計的に有意な差はありませんでした 。 |
| 表 1. 研究参加者のベースライン特性 |
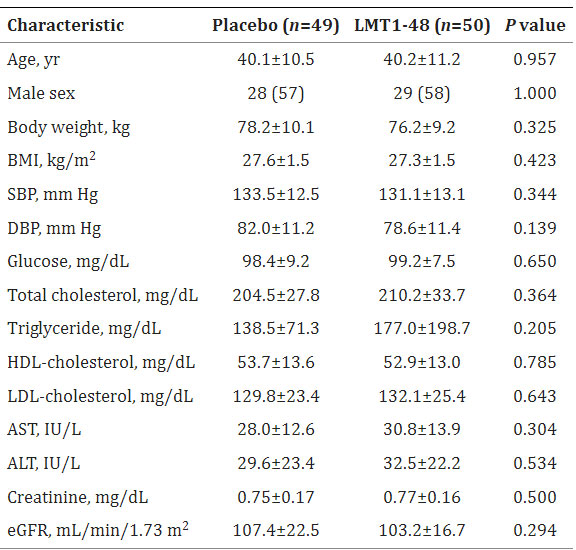 |
| 値は平均±標準偏差または数値 (%) として表示されます。 |
| LMT1-48、Lactobacillis. plantarumLMT1-48; BMI、肥満指数。 SBP、最高血圧。 DBP、拡張期血圧。 HDL、高密度リポタンパク質。 LDL、低密度リポタンパク質。 AST、アスパラギン酸アミノトランスフェラーゼ。 ALT、アラニンアミノトランスフェラーゼ。 eGFR、推定糸球体濾過率。 |
| 3.2. L. plantarum LMT1-48 摂取が人体計測および生化学パラメータに及ぼす影響 |
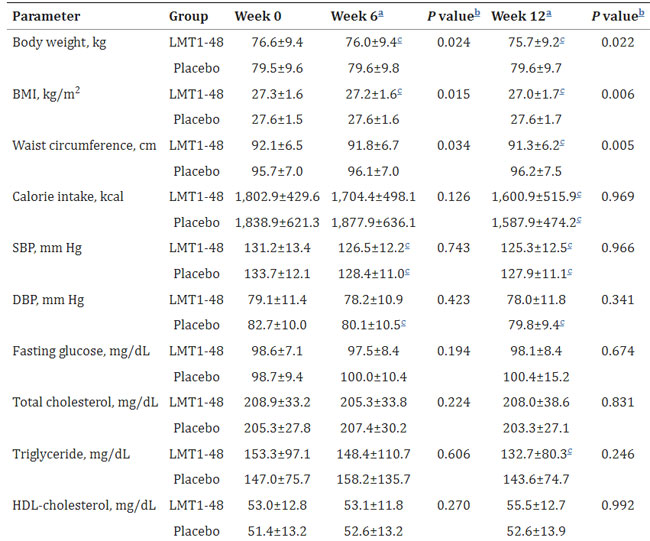
| 体重、BMI、腹囲、その他の生化学的パラメータを含む人体計測パラメータの変化を表 2 および図 1 に示します。 L. plantarum LMT1-48 グループは、ベースラインの 76.6 ± 9.4 kg から 12 週間の 75.7 ± 9.2 kg への有意な体重減少を示しました (P<0.05)。 BMI と腹囲は、L. plantarum LMI1-48 グループで同様の減少パターンを示しました。 |
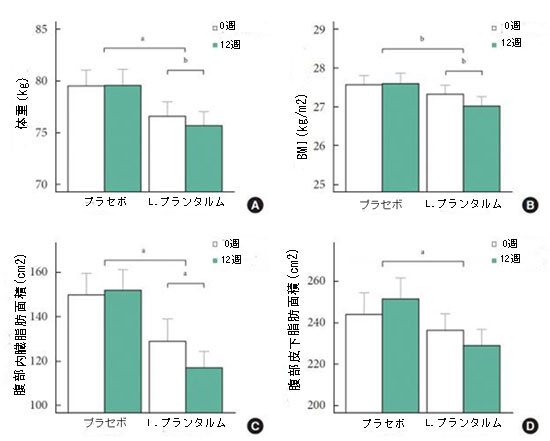 |
| 図 1. 体重、肥満指数 (BMI)、および腹部脂肪蓄積に対する L. plantarum LMT1-48 摂取の影響 |
| (A) 体重、(B) BMI、(C) 腹部内臓脂肪面積、(D) 腹部皮下脂肪面積。 データは、平均値±平均値の標準誤差として表示されます。 LMT1-48、Lactobacillis. plantarumLMT1-48。 aP<0.05、bP<0.01。 |
| 表 2. 人体計測値および血液生化学的プロファイルに対するLactobacillis. plantarum株 LMT1-48 の影響 |
 |
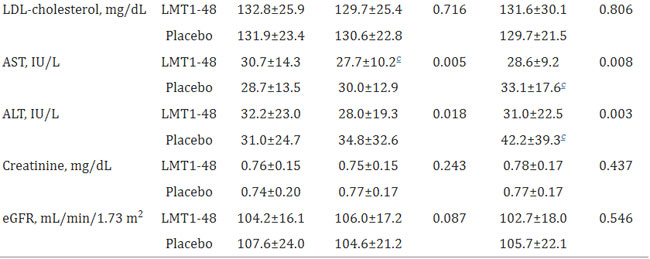 |
| 値は平均±標準偏差として表示されます。 分析は、完全な分析セット (n=85) からのデータに基づいていました。 |
| BMI、肥満指数。 SBP、最高血圧。 DBP、拡張期血圧。 HDL、高密度リポタンパク質。 LDL、低密度リポタンパク質。 AST、アスパラギン酸アミノトランスフェラーゼ。 ALT、アラニンアミノトランスフェラーゼ。 eGFR、推定糸球体濾過率。 |
a グループ内の差異は、データの分布に従って対応のあるスチューデントの t 検定またはウィルコクソンの符号付き順位検定を使用して評価されました。 b 2 つのグループ間のベースライン値に対する各時点の差は、上記のように Student の t 検定または Wilcoxon の順位和検定を使用して評価されました。 ベースライン値と比較して cP<0.05。 |
| L. plantarum LMT1-48 群とプラセボ群の間に有意差はありませんでしたが、L. plantarum LMT1-48 の 12 週間摂取後にトリグリセリド (TG) レベルが減少しました (P<0.05)。 ASTおよびALTレベルは、プラセボ群と比較してL. plantarum LMT1-48群で有意に減少した(P<0.05)。 グルコースおよび他の脂質バイオマーカーのレベル、および腎機能は、L. plantarum LMT1-48 の補給によって変化しませんでした。 |
| 3.3. L. plantarum LMT1-48摂取による体脂肪への影響 |
| プラセボまたは L. plantarum> LMT1-48 を 12 週間摂取した後の体重、BMI、腹部脂肪面積の変化を図 1 に示します。腹部内臓脂肪は、L. plantarum LMT1-48 群で 128.9±68.8 から 117±49.9 cm2 に有意に減少しました。 プラセボ群では、149.8 ±60.9 から 151.9 ± 58.1 cm2 に増加しました (P<0.05)。 また、L. plantarum LMT1-48 の摂取は、腹部皮下脂肪をプラセボ群と比較して 236.4±53.7 から 229±53 cm2 に有意に減少させ、腹部皮下脂肪 は 244.1±65.4 から 251.5±63.2 cm2 に増加しました (P<0.05)。 腹部総脂肪面積は、プラセボ群と比較して、L. plantarum LMT1-48補給により365.3±78.4から346.0±72.8cm2への有意な減少を示し、プラセボ群では393.9±81.6から403.4±72.7cm2へ増加した(P<0.05)。 さらに、腹部内臓脂肪(-11.9 ± 48.5 cm2 対 2.1 ± 21.5 cm2)、腹部皮下脂肪 (-7.4 ± 27.8 cm2 対 7.5 ± 31.7 cm2)、および腹部総脂肪面(-19.3 ± 48.5 cm2 対 9.6 ± 43.7 cm2) も減少しました。 L. plantarum LMT1-48 グループの割合はプラセボグループの割合よりも有意に大きかった (それぞれ P<0.05)。 ただし、全身の脂肪量はどちらのグループでも大きく変化しませんでした。 |
| 3.4.肥満関連サイトカインおよびホルモンに対するL. plantarum LMT1-48 摂取の影響 |
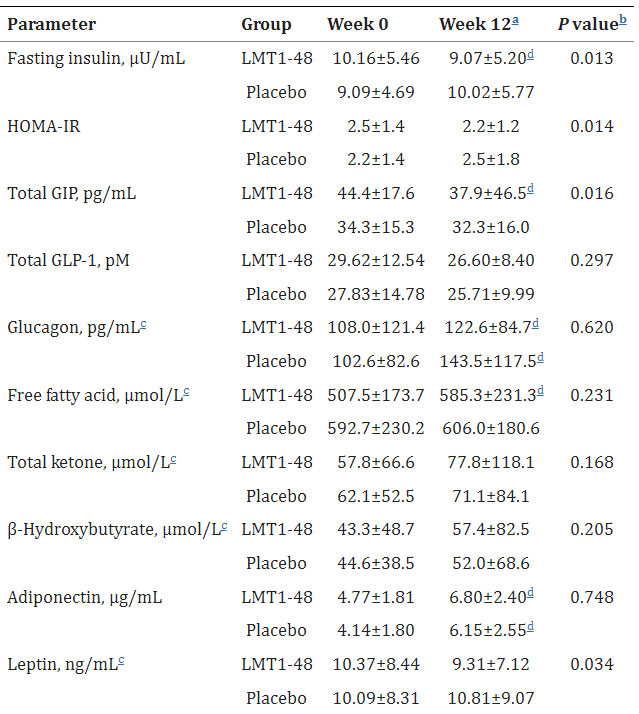
| L. plantarum LMT1-48 グループの肥満関連バイオマーカー レベルの変化を表 3 に示します。インスリン レベルは L. plantarum LMT1-48 グループで減少しましたが、プラセボ グループでは増加し、グループ間で有意な差がありました (P< 0.05)。 対応するインスリン抵抗性の恒常性モデル評価でも、2 つのグループで同様の反対の傾向が示されました (グループ間の差については P<0.05)。 同様に、レプチンレベルは、L. plantarum LMT1-48 グループでは減少しましたが、プラセボグループでは増加する傾向がありました (P<0.05)。 血清グルカゴンおよび血漿アディポネクチンレベルは両グループで増加しましたが、有意差はありませんでした。 |
| 表 3. 肥満関連バイオマーカーおよびホルモンに対するL. plantarum LMT1-48 の影響 |
 |
 |
| 値は平均±標準偏差として表示されます。 分析は、完全な分析セット (n=85) からのデータに基づいていました。 |
| LMT1-48、Lactobacillis. plantarum株LMT1-48; HOMA-IR、インスリン抵抗性の恒常性モデル評価。 GIP、胃抑制ポリペプチド。 GLP-1、グルカゴン様ペプチド-1。 hs-CRP、高感度 C 反応性タンパク質。 |
a グループ内の差異は、データの分布に従って対応のあるスチューデントの t 検定またはウィルコクソンの符号付き順位検定を使用して評価されました。 bベースライン値からの各時点でのグループ間の差異は、データの分布に従ってスチューデントの t 検定またはウィルコクソンの順位和検定を使用して評価されました。 c対数変換後に比較した値、 ベースライン値と比較した場合、dP<0.05の差。 |
| 3.5. L. plantarum LMT1-48摂取が腸内細菌叢に及ぼす影響 |
| 腸内微生物の変化を図2および補足図3に示します。シャノン指数(家族レベルでのマイクロバイオームα多様性)は、L. plantarum LMT1-48の補給により1.64から1.78に大幅に増加しました(P<0.05)。 微生物の豊富さと多様性。 門レベルでは、L. plantarum LMT1-48 の 12 週間投与により、Actinobacteria (0.23%) およびFirmicutes (7.24%) の有病率が有意に増加しましたが、Bacteroidetes の有病率は有意に減少しました (6.98%; P<0.05)。 Firmicutes とBacteroidetes の相対存在比(F/B 比)は、ベースラインで 0.53 でしたが、L. plantarum LMT1-48 の 12 週間摂取後に 0.80 に増加し、群間で有意な差がありました(P<0.05)。 他のあまり普及していない門は、L. plantarum LMT1-48 の摂取によって変化しませんでした。 |
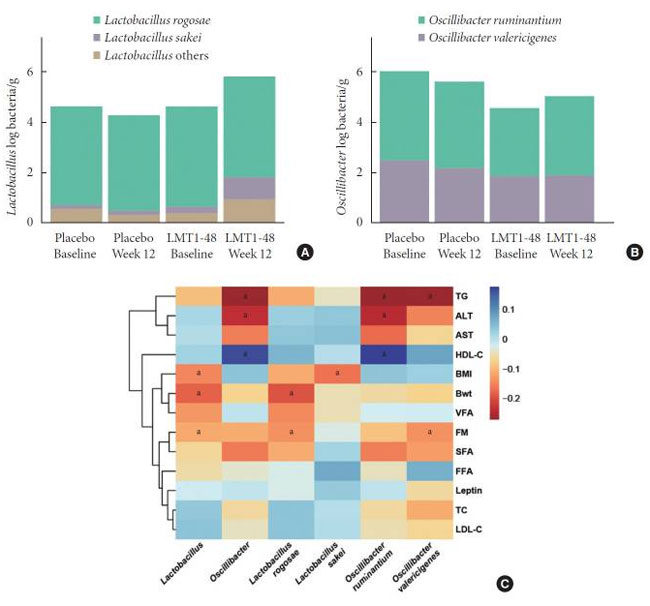 |
図 2. L. plantarum LMT1-48 またはプラセボを 12 週間摂取した後の腸内細菌叢の対数平均稀少数の変化 (A) Lactobacillus および (B) Oscillibacter、および (C) 微生物と肥満の間のスピアマン相関係数のヒートマップ に関連した特性。 LMT1-48、Lactobacillis. plantarumLMT1-48; TG、トリグリセリド。 ALT、アラニンアミノトランスフェラーゼ。 AST、アスパラギン酸アミノトランスフェラーゼ。 HDL-C、高密度リポタンパク質コレステロール。 BMI、肥満指数。 Bwt、体重。 VFA、内臓脂肪面積。 FM、脂肪量。 SFA、皮下脂肪面積。 FFA、遊離脂肪酸。 TC、総コレステロール。 LDL-C、低密度リポタンパク質コレステロール。 a誤検出率調整済み P<0.05。 |
| Lactobacillus属は、BMI(ρ=–0.15、P<0.05)、体重(ρ=–0.18、P<0.05)、体脂肪量(ρ=–0.11、P<0.05)と負の相関がある傾向があった。L. plantarum LMT1-48 補給後に増加しますが、変動が大きいため有意ではありません。 残念ながら、検出された L. plantarum の数が少なすぎるため、この種はバイオインフォマティクス分析中に除外されました。 その代わりに、L. sacei の存在量は、プラセボ群と比較して L. plantarum LMT1-48 群で有意に増加しました (P<0.05)。 L. Sakei の存在量は BMI と負の相関がありました (ρ=–0.16、P<0.05)。 |
| Oscillibacter 属の存在量は、L. plantarum LMT1-48 を 12 週間投与した後に有意に増加しました。 これは肥満と関連していると報告されており[24]、トリグリセリド(ρ=-0.27)、アラニンアミノトランスフェラーゼ(ρ=-0.23)、高密度リポタンパク質 (HDL) コレステロール のレベルと負の相関があった。 (ρ 0.17; すべて P<0.05)。 |
| Oscillibacter属、Oscillospiraceae科、およびOscillibacter ruminantium種の分類学的有病率ランクの上位および下位レベルも、プラセボと比較してL. plantarum LMT1-48摂取により有意に増加しました(P<0.05) |
| 3.6安全性評価 |
| 12週間の研究期間中の有害事象発生率に関して、群間に有意差は観察されなかった。 L. plantarum LMT1-48グループでは12.0%(被験者6/50、イベント10)、プラセボグループでは4.1%(被験者2/49、イベント4)(補足表1)。 重篤な有害事象は報告されませんでした。 さらに、どちらのグループでも身体検査におけるバイタルサインの臨床的に重大な異常な測定値はありませんでした(データは示されていません)。 |
| 4.議論 |
| このRCTでは、L. plantarum LMT1-48を12週間栄養補給すると、プラセボ群と比較して体重、BMI、腹囲のレベルが有意に減少しました。L. plantarum LMT1-48 の体重減少効果は 6 週目に最初に現れ、時間の経過とともに徐々に減少するようでした。 さらに、腹部の 内臓脂肪 と 皮下脂肪 も大幅に減少しました。 さらに、試験期間中、両グループにおいて重篤な副作用は観察されませんでした。 これらの発見は、L. plantarum LMT1-48 の補給が安全性の懸念なしに体重と腹部脂肪の減少にプラスの効果があることを示しています。 |
| L. plantarum LMT1-48 投与後、体重はわずかではあるが大幅に減少しました。 しかし、腹部肥満は他の代謝疾患と関連している可能性が高いため[25]、L. plantarum LMT1-48の摂取に応じた腹囲と内臓脂肪の同時減少は、肥満患者の予後改善に臨床的意義を持つ可能性がある。 |
| L. plantarum LMT1-48 は、前臨床研究で抗肥満効果が示された L. plantarum の新たに同定された株です [15、16]。 L. plantarum LMT1-48抽出物を3T3-L1脂肪細胞に投与すると、ペルオキシソーム増殖因子活性化受容体ガンマ(PPARγ)、CCAAT/エンハンサー結合タンパク質(C/EBP)、脂肪酸シンターゼ(FAS)、および脂肪酸結合タンパク質 4 (FABP4)などの脂肪生成遺伝子を下方制御することにより、脂肪細胞の分化と脂質蓄積が阻害された[16]。 高脂肪食を与えた肥満マウスを用いた動物研究では、L. plantarum LMT1-48の投与により体重と脂肪量が減少した[16]。 さらに、肝臓の脂肪生成遺伝子である PPARγ、ホルモン感受性リパーゼ (HSL)、ステアロイル CoA デサチュラーゼ 1 (SCD-1)、および脂肪酸トランスロカーゼ (FAT/CD36) の下方制御とともに、肝臓において肝臓重量と肝臓 TG レベルが減少しました。 |
| このような乳酸産生細菌種の投与は代謝状態を改善することが報告されていますが、その効果は特定の菌株、組み合わせ、投与量、および使用する溶媒に関連しています[10]。 健康な高コレステロール血症成人に対するヨーグルト製剤中の5×1010 CFUのL. reuteri NCIMB 30242の投与[26]および1×1010 CFUのL. reuteri JBD301の投与では、承認された抗肥満薬であるオルリスタットと同様に体重が減少した[27]。 レプチン抵抗性およびトリグリセリドレベルによって引き起こされる高いレプチンレベルは、肥満の重症度に関連する重要なパラメーターです[28、29]。 特に、トリグリセリド は血液-脳関門を通過するレプチンの輸送を阻害することが報告されています [29]。 |
| 腸内微生物叢は、胆汁酸の恒常性、アミノ酸と短鎖脂肪酸の生物学、エネルギー消費を変化させることにより、肝疾患の進行の主要な原因因子として集合的に知られています[30]。 L. plantarum LMT1-48の補給により肝酵素レベルが低下したという我々の発見は、L. plantarum LMT1-48が肝臓の脂肪蓄積に好ましい影響を与える可能性があることを示唆しています。 |
| 遊離脂肪酸とアディポネクチンのレベルは両方とも、L. plantarum LMT1-48 グループで増加しました。 ラット肝臓では、脂肪生成と遊離脂肪酸レベルは逆相関関係にあります[31]。 SGLT2 阻害剤の投与後、酸化のために動員される遊離脂肪酸のレベルが一時的に増加することが示されています [32]。 したがって、L. plantarumの補給後の脂肪生成と脂肪分解に関与する遺伝子の発現の変化がマウスモデルで観察されたように、遊離脂肪酸レベルの増加は脂質代謝の調節に関連している可能性があります[16,33]。 アディポネクチンは骨格脂質の取り込みと酸化を増加させ[34]、長期的には併発疾患を引き起こすことなく安全に遊離脂肪酸の除去を助けることが期待されています。 |
| 私たちがテストした血清バイオマーカーの中で、GIP レベルはプラセボ グループと比較して L. plantarum LMT1-48 グループで有意に減少しました。 脂肪生成と脂質生成の刺激は、GIP 誘発性肥満に作用する可能性があります [35]。 健康な成人では、GIP(3-30)NH2 による GIP の阻害は、脂肪細胞の TG レベルを低下させることにより脂質代謝を誘導しました [36]。 これらの発見は、GIP 分泌の阻害が、肥満のヒト被験者における L. plantarum LMT1-48 誘導性の抗肥満効果に部分的に寄与している可能性があるという考えを裏付けています。 さらに、膵臓β細胞からのインスリン分泌の増加は、GIP 誘発性肥満の主要なメカニズムです [37]。 総合すると、L. plantarum LMT1-48 の体重減少効果は、GIP レベルの低下とその後のインスリン分泌の阻害によって媒介される可能性があります。 我々の知る限り、我々の発見は、GIPがヒトにおけるプロバイオティクスの抗肥満効果に関与している可能性を示唆する初めてのものである。 L. plantarum LMT1-48がどのようにGIPレベルを調節して肥満を軽減するかはまだ調査されていない。 |
| ここで我々は、L. plantarum LMT1-48の補給により腸内細菌叢が有意に有利に変化することを発見した。L. plantarum LMT1-48 によって誘導される放線菌種の存在量の減少は、体重の減少に関連している可能性があります。 ある研究では、痩せた双子の被験者と比較して、肥満者の放線菌の存在量が増加しました[38]。 肥満者の細菌多様性は痩せている人よりも低いため[39]、家族レベルでのシャノン多様性指数の増加は、腸内微生物叢の変化とL. plantarum LMT1-48の抗肥満効果との間に関係がある可能性を示唆している。 |
| F/B 比は L. plantarum LMT1-48 の補給により増加しました。 プロバイオティクスが投与されると、F/B 比は一方向にシフトせず、むしろ正常なバランスに戻ります [40]。L. plantarum LMT1-48 を含むマウスでのいくつかの実験では、L. plantarum を投与することによって F/B 比が上昇し、抗炎症効果という利点も加わりました [15,40]。 過体重または肥満の韓国成人 747 人中、F/B 比は 2 を超えていました [41]。 ベースラインでの F/B 比が 0.53 であったことを考えると、この比の増加は回復を示していると考えるのが合理的です。 これまでのところ、環境要因が初期の研究で十分に調査されていないため、肥満を制御するための明確な F/B 比を設定することは困難です [42]。 |
| L. plantarum LMT1-48の補給によりO.ruminantium>の存在量が大幅に増加したことは注目に値します。 この種は、痩せた被験者よりも肥満者の方がより多く減少することが報告されている[43,44]。 ある研究では、L. plantarum によって発酵された食品を摂取することによって O.ruminantium の量が増加することが示されています [45]。 他の報告による発見も、体重減少におけるOscillibacter媒介機構の関与を示唆している。 酪酸は、エネルギー消費を増加させ、インスリン感受性を改善するように作用する短鎖脂肪酸であり、O.ruminantium の主要な代謝最終生成物です [46,47]。 さらに、Oscillibacterは、血液中のインクレチンの分解に関与する酵素であるジペプチジルペプチダーゼ-4 (DPP-4) 活性を示します[48]。 このRCTでは短鎖脂肪酸は分析されていないが、L. plantarum LMT1-48による治療によりOscillibacter種の存在量が増加し、その後酪酸放出とDPP-4様酵素活性が増加することにより、肥満患者の体重減少が誘導された可能性がある。 。 |
| 12週間の研究中、どちらの被験者グループにも臨床的に重篤な副作用はありませんでした。 両グループの遵守レベルは 95% 以上で、韓国の発酵食品や新生児の糞便から分離された乳酸生成菌である L. plantarum LMT1-48 が安全であるという考えを裏付けています。 |
| 5.結論 |
| 結論として、この 二重盲検、プラセボ対照、単施設ランダム化対照試験(RCT) は、人間の肥満の治療における L. plantarum LMT1-48 の治療可能性を実証しました。 さらに、腸内細菌叢に関する我々のデータは、腸内細菌叢が人間のエネルギー代謝と肥満の病因において重要な役割を果たしているという他の研究とほぼ一致しています。 彼らはまた、プロバイオティクスを用いて腸内マイクロバイオームを操作する介入には、肥満および肥満関連疾患を軽減するための大きな治療可能性があるという考えを支持しています。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Diabetes Metab J 2023;47:92-103に掲載されたEffect of Lactobacillus plantarum LMT1-48 on Body Fat in Overweight Subjects: A Randomized, Double-Blind, Placebo-Controlled Trialを日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


