ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
Lactobacillus plantarum 45は酸化ストレスの抑制を通じてSHP2を活性化し、 骨芽細胞と破骨細胞の分化を調節する |
Yaming Yang et al., |
|
|
| 要約 |
背景:本研究の目的は、Lactobacillus plantarum 45(LP45)を観察し、LP45が酸化ストレス誘発性損傷を軽減し、骨芽細胞と破骨細胞のバランスを調節するメカニズムを調査することです。 |
| 材料と方法: 酸化ストレスレベルと骨芽細胞および破骨細胞関連タンパク質を、免疫蛍光染色、ウェスタンブロッティング、活性酸素種(ROS)蛍光プローブおよびELISAで検出しました。骨芽細胞増殖能はCCK-8アッセイで測定しました。X線観察とHE染色を使用して、LP45の骨粗鬆症に対する効果を検出しました。 |
| 結果:LP45群およびリポ多糖(LPS)+ LP45群では、LPS群と比較して、チロシンホスファターゼ2(SHP2)およびSrcの発現レベルが有意に増加し、NOX4、P22、P47、IL-1β、NLRP3、IRF3、RANK、β-カテニンおよびINF-βの発現レベルが抑制されました。LPS群と比較して、LPS + LP45群ではスーパーオキシドジスムターゼ(SOD)濃度が増加し、マロンジアルデヒド(MDA)濃度が減少しました。LP45群およびLPS + LP45群では、OPG、RANKL、RUNX3、RANK、β-カテニンのタンパク質発現が増加しました。LP45群およびLPS + LP45群では、NF-κB、CREB、AP-1のタンパク質発現が有意に減少しました。結果は、免疫蛍光染色およびROS蛍光プローブによっても確認されました。 X線観察とHE染色により、LP45は骨粗鬆症の進行を抑制できることが示されました。 |
| 結論: LP45 は、酸化ストレスの生成を阻害して チロシンホスファターゼ2シグナル伝達経路を活性化することで抗酸化作用を発揮し、骨芽細胞の分化を促進し、破骨細胞の形成を抑制して骨の恒常性を維持し、骨代謝を改善します。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.材料と方法 |
| 2.1.細胞と試薬 |
| 2.2.細胞培養とグループ化 |
| 2.2.1. Lactobacillus plantarum 45培養 |
| 2.2.2.マクロファージの培養とグループ化 |
| 2.2.3.骨芽細胞および破骨細胞の培養 |
| 2.2.4.細胞共培養システムとグループ分け |
| 2.3.CCK-8 細胞増殖能アッセイ |
| 2.4.ウェスタンブロッティング |
| 2.5.免疫蛍光染色 |
| 2.6.活性酸素種蛍光プローブ |
| 2.7.酵素結合免疫吸着法(ELISA) |
| 2.8. 実験マウスとモデリンググループ |
| 2.9. ヘマトキシリンエオジン(HE )染色 |
| 2.10.統計分析 |
| 3.結果 |
| 3.1.マクロファージにおける酸化ストレス関連タンパク質の発現と 活性酸素種蛍光プローブ |
| 3.2.マクロファージにおける炎症性サイトカイン関連タンパク質の発現 |
| 3.3.骨芽細胞における関連タンパク質の発現とRANKL免疫蛍光染色 |
| 3.4.破骨細胞における関連タンパク質の発現 |
| 3.5. チロシンホスファターゼ2ノックアウトマクロファージにおける関連タンパク質の発現 |
| 3.6. Lactobacillus plantarum 45は骨粗鬆症の進行を抑制できる |
| 4.考察 |
本文 |
| 1.はじめに |
| 骨粗鬆症は、骨組織に影響を及ぼす全身性骨格疾患で、骨量が減少し、骨の脆弱性が高まり、骨折や死亡のリスクが高まります [1]。骨形成と骨分解のバランスは、正常な骨格恒常性を維持するために不可欠ですが、骨芽細胞と破骨細胞の機能の不均衡は、さまざまな重症度の骨格疾患を引き起こす可能性があり、その中で最も一般的なのは骨粗鬆症です [2]。骨リモデリングは、破骨細胞と骨芽細胞が関与する密接に結合したプロセスです。破骨細胞は、マクロファージコロニー刺激因子 (M-CSF) と核サイトカイン κB 受容体活性化リガンド (RANKL) を活性化することにより、H、Cl、カテプシン K (CTSK)、およびマトリックスメタロプロテアーゼ (MMP) を阻害する多核細胞です [3–5]。通常、細胞内の一次活性酸素種(ROS)は、シグナル伝達経路、炎症反応、細胞増殖とアポトーシス、および組織修復において重要な役割を果たします[6]。大量の文献で、酸化ストレスが骨粗鬆症の原因因子であることが特定されています。破骨細胞の分化は酸化ストレスの影響を受けます。酸化ストレスは骨芽細胞のアポトーシスを誘導し、骨芽細胞の活動を低下させる可能性があり、骨粗鬆症の発生と進行において、骨の恒常性の不均衡を引き起こす主な要因です[7、8]。酸化ストレスは、破骨細胞の産生と骨芽細胞および骨細胞のアポトーシスを増加させ、骨芽細胞系への骨前駆細胞の分化を減少させ、骨芽細胞の活動を低下させる可能性があると提案されています[9]。そのため、酸化ストレスの抑制は、骨粗鬆症を予防または遅延するための要となる可能性があります。 |
| 健康な腸内細菌叢は骨の恒常性と密接に関係している[10]。具体的には、腸内細菌叢は免疫系機能を媒介して骨代謝を調節することで宿主の骨の恒常性に影響を与える可能性があり[11]、腸内細菌叢の異常は破骨細胞の活動を増強し、骨粗鬆症の発生と進行につながる可能性がある[12]。活性物質としてのプロバイオティクスは、抗酸化特性を有することが証明されており、抗菌代謝物の分泌と宿主物質の変換による抗菌特性の増強、エネルギー物質との競合、細胞接触依存性の特異的殺傷など、いくつかのメカニズムを通じて病原性微生物の増殖を抑制し、リポ多糖(LPS)と炎症性サイトカインの産生を減らすことも証明されている[13]。これまでの研究では、プロバイオティクスは骨量減少を減らし、骨芽細胞の老化を抑制し、破骨細胞による骨吸収を減らし、骨アルカリホスファターゼの発現を高めることが示されています [14, 15]。たとえば、Lactobacillus plantarum(LP)は、骨代謝に関連する炎症性サイトカインとマーカーの発現を調節することで、免疫関連の骨格の健康に影響を与えることが検証されています [16]。したがって、プロバイオティクスは骨粗鬆症の予防と治療にプラスの役割を果たす可能性があります。 |
| Src相同領域2ドメイン含有タンパク質チロシンホスファターゼ2(SHP2)は、PTPN11によってコードされるタンパク質チロシンホスファターゼであり、シグナル伝達におけるその役割には複数の異なる細胞表面受容体が必要である[17]。証拠によると、チロシンホスファターゼ2は線維芽細胞増殖因子によって引き起こされる一連のシグナル伝達経路を制御する能力があり、その発現は抗酸化ストレス下で顕著に上昇する[18]。これは骨芽細胞と破骨細胞の分化に重要であるが、その基礎となる分子および細胞メカニズムはまだ不明である[19]。これまでの研究では、マクロファージが特定の機能性タンパク質とRNAを分泌して輸送し、線維芽細胞や上皮細胞などの多くの種類の細胞に影響を与えることが示されている[20, 21]が、骨芽細胞と破骨細胞への影響については詳細に調査する必要がある。まとめると、Lactobacillus plantarum45 がマクロファージ由来のエクソソームを調節することで チロシンホスファターゼ2を介して骨の恒常性を調節する抗酸化作用を発揮するかどうかは未だ結論が出ておらず、それらの相互作用の具体的なメカニズムを明らかにする必要があります。本研究では、Lactobacillus plantarum45 が抗酸化ストレス作用を発揮してチロシンホスファターゼ2を活性化し、骨芽細胞の分化を促進し、破骨細胞の形成を抑制することが明らかになりました。 |
| 2.材料と方法 |
| 2.1.細胞と試薬 |
| マウス前頭蓋骨芽細胞株(MC3T3-E1 細胞)とマウス単球マクロファージ(RAW264.7 細胞)は、Wuhan Procell Co., Ltd. (China)から提供されました。この研究で使用した試薬には、LP45の凍結乾燥細菌粉末(Hebei Inatural Biotech Co., Ltd., China)、細胞培養培地(Dulbecco's Modified Eagle Medium (DMEM), Sangon Biotech (Shanghai) Co., Ltd., China)、ウシ胎児血清(FBS, Sangon Biotech (Shanghai) Co., Ltd.)、トランスウェル細胞培養チャンバー(Shanghai Cuihua Biotechnology Co., Ltd.)、LPS(Sigma-Aldrich, St. Louis, MO, USA)、抗生物質(Shanghai Aladdin Biochemical Technology Co., Ltd., China)、およびプレドニゾン酢酸塩(Cisen Pharmaceutical Co., Ltd.、Shandong, China)が含まれていた。 |
| 2.2.細胞培養とグループ化 |
| 2.2.1. Lactobacillus plantarum 45培養 |
| Lactobacillus plantarum 45(LP45) は、Hebei Yiran Biotechnology Co., Ltd. (China) から購入しました。LP45 は、MRS 培地で 37°C の一定温度で培養しました。その後、インキュベーターで増殖させて 3 回連続で継代し、細菌溶液の濃度を調整した後、3 世代目の細胞を 18 時間増殖させて株の生存能力を回復しました。LP45 の上清を濾過 (孔径 0.22 μm) して得、LP45 を 4°C で 30 分間 4000 rpm で遠心分離しました。LP45 濃度は、後で使用するために細胞カウンターを使用して 1 × 108 CFU/mL に調整しました。 |
| 2.2.2.マクロファージの培養とグループ化 |
| マクロファージ RAW264.7 細胞は、10% ウシ胎児血清と抗生物質を添加した高グルコース DMEM (HDMEM、HyClone、Logan、UT、USA) で培養しました。RAW264.7 細胞を 3 世代継代し、その後 96 ウェル プレートに 2 × 105 細胞/mL (100 μL/ウェル) の密度で接種しました。16~20 時間の細胞接着後、新鮮な培養培地に交換しました。細胞を4つのグループに分けました:LPSグループ(LPS(10 μg/mL)を含むHDMEMを連続培地に12時間添加)、LP45グループ(LP45(1×108 CFU/mL)を含むHDMEMを連続培地に12時間添加)、LPS + LP45グループ(LPS(10 μg/mL)を含むHDMEMを6時間添加した後、LP45(1×108 CFU/mL)を6時間添加)、およびブランクコントロールグループ(ブランクコントロールとしてリン酸緩衝生理食塩水(PBS)を添加) |
| 2.2.3.骨芽細胞および破骨細胞の培養 |
| MC3T3-E1 細胞を 6 ウェル細胞培養プレートに 1 × 106 細胞/ウェルの密度で播種し、骨形成誘導剤 (50 μg/mL アスコルビン酸、10 mmol/L β-グリセロリン酸ナトリウム、および 10–8 mol/mL デキサメタゾン)、10% ウシ胎児血清、および 1% ペニシリン-ストレプトマイシンを含む最小必須培地 α (α-MEM) で、5% CO2、37°C のインキュベーター内で培養しました。次に、マクロファージ RAW264.7 細胞を 10% ウシ胎児血清を含む MEM に移しました。次に、骨髄細胞を 70 μm フィルターを使用して濾過し、MEM + 10% ウシ胎児血清+ 10 ng/mL M-CSF 培地を含む T75 培養フラスコに播種しました。 37℃、5% CO2のインキュベーターで24時間培養した後、上清から細胞を採取し、MEM + 10%ウシ胎児血清 + 30 ng/mL M-CSF培地に2×105細胞/mLの密度で播種し、48時間後に100 ng/mL RANKLを培地に14日間添加して細胞分化を誘導した。 |
| 2.2.4.細胞共培養システムとグループ分け |
| 細胞共培養システムはトランスウェルチャンバーを用いて構築した。具体的には、マウス骨芽細胞(MC3T3-E1細胞)と破骨細胞をリン酸緩衝生理食塩水で洗浄した後、トリプシン消化し、6ウェルトランスウェル下部チャンバーに5×104細胞/mLの密度で別々に接種し培養した。次に、マウスRAW264.7細胞をトリプシン消化し、別の6ウェルトランスウェル上部チャンバーに2.5×104細胞/mLの密度で接種し培養した。次に、骨芽細胞および破骨細胞をグルココルチコイド(1 μmol/L)で前処理し、マクロファージ-骨芽細胞培養システムおよびマクロファージ-破骨細胞培養システムをそれぞれ4つのグループに分けました:LPSグループ(10 μg/mL LPS)、LP45グループ(1×108 CFU/mL LP45)、LPS + LP45グループ(10 μg/mL LPS + 1×108 CFU/mL LP45)、およびブランクコントロールグループ(ブランクコントロールとしてリン酸緩衝生理食塩水を追加)です。製造元の指示に従って、Lipofectamine 2000(Invitrogen Life Technologies, Carlsbad, CA, USA)を使用して、マクロファージにsiRNA-NCおよびsiRNA-SHP2を一過性にトランスフェクトします。48時間トランスフェクションします。 |
siRNA-SHP2: 5′-TCCCGACCCTTATCGTACGATCTAATAAATTCAAGAGATTCTACTATCT |
| TACTTATTATCTATTT-3′; iRNA-NC: 5′-TCCCTTCTCCGAACGTGTCACGTTTTCAGAGAA |
| CGTGACGTTCGGAGAATT-3′。 |
| 2.3.CCK-8 細胞増殖能アッセイ |
| MC3T3-E1 細胞を 3 継代培養した後、細胞濃度を 2105 細胞/mL に調整し、ウェルあたり 100 μL の細胞液を 96 にドッキングしました。ウェルプレートでは、16~20 時間の細胞接着後、新鮮な培養培地を交換し、96 ウェルプレートでウェルあたり 10 μL のバッチ発酵上清を播種し、ブランクグループとして 10 μL の細胞培養培地を播種し、参照前に 5% CO2 インキュベーターで 37°C で 12 時間インキュベートしました。CCK-8 キットの細胞増殖は、説明書に従って測定しました。細胞インキュベーターの各ウェルに 10 μL の CCK-8 溶液を加えました。0、24、48 時間インキュベートし、450 nm で OD を測定しました。 |
| 2.4.ウェスタンブロッティング |
| まず、各グループからRAW264.7細胞とMC3T3-E1細胞を採取し、溶解しました。煮沸、超音波処理、遠心分離後、上清を採取してタンパク質サンプルを取得し、その濃度を定量しました。BCAタンパク質検出キット(Beijing Solar Biotechnology Co., Ltd., Beijing, China)を使用しました。次に、20μgのタンパク質をSDS-PAGEで処理し、細胞膜に転写し、5%スキムミルクで1時間密封しました。その後、20μgのタンパク質をSDS-PAGEにかけ、膜に転写し、5%スキムミルクで1時間ブロックしました。その後、マクロファージRAW264.7タンパク質サンプルを、ニコチンアミドアデニンジヌクレオチドリン酸オキシダーゼ4(NOX4)(Abcam、UK、ab154244、1:1000)、P22(Abcam、ab191512、1:500)、P47(Abcam、ab308256、1:1000)、Src(Abcam、ab133283、1:1000)、インターロイキン-1ベータ(IL-1β)(Abcam、ab254360、1:1000)、ヌクレオチド結合オリゴマー化ドメイン様受容体タンパク質3(NLRP3)(Abcam、ab263899、1:1000)、インターフェロン調節因子3(IRF3)(Abcam、 ab68481、1:1000)、インターフェロン-β (INF-β) (Abcam、ab313885、1:1000)、グリセルアルデヒド-3-リン酸デヒドロゲナーゼ (GAPDH) (Abcam、ab9485、1:2500) に対する一次抗体でインキュベートし、骨芽細胞 (MC3T3-E1 細胞) および破骨細胞タンパク質サンプルは、オステオプロテゲリン (OPG) (Abcam、ab183910、1:1000)、RANKL (Abcam、ab9957、1:1000)、ラント関連転写因子 3 (RUNX3) (Cell Signaling Technology、USA、ab154244、1:1000)、RANK (Abcam、ab305233、1:1000) に対する一次抗体でインキュベートしました。 β-カテニン (Abcam、ab32572、1:5000)、核因子-κB (NF-κB) (Abcam、ab207297、1:1000)、cAMP応答性エレメント結合タンパク質 (CREB) (Abcam、ab32515、1:1000)、活性化タンパク質-1 (AP-1) (Abcam、ab230273、1:1000)、GAPDH (Abcam、ab9485、1:2500) を4°Cで一晩インキュベートしました。翌日、膜を洗浄し、二次抗体とともに室温で1時間インキュベートしました。洗浄後、膜をECL試薬を使用して可視化し、ImageJ 1.52ソフトウェアを使用して半定量分析を行いました。 |
| 2.5.免疫蛍光染色 |
| 骨芽細胞表面のRANKLの発現は、免疫蛍光法によって検出されました。骨芽細胞を4%パラホルムアルデヒドで30分間固定し、PBSで3回洗浄し、5%ウシ血清アルブミンで1時間ブロックした後、RANKL抗体(Abcam、ab65024、1:500)とともに4°Cで一晩インキュベートしました。洗浄後、蛍光ヤギ抗ウサギ二次抗体IgG(Abcam、ab150077、1:500)を添加し、暗所で2時間インキュベートしました。洗浄後、抗蛍光消光シーリング剤DAPIを添加して膜をシールし、蛍光顕微鏡下で画像を観察し、写真を撮影しました。 |
| 2.6.活性酸素種蛍光プローブ |
| マクロファージ RAW264.7 細胞を、ROS 感受性プローブ CellROX Green Reagent を使用して、5 μM PBS とともに暗所で 37°C で 30 分間インキュベートし、その後 0.05% トリプシン-EDTA 溶液で採取し、新鮮な培地に懸濁して、フローサイトメトリーで直ちに分析しました。 |
| 2.7.酵素結合免疫吸着法(ELISA) |
| マロンジアルデヒド(MDA)およびヒトスーパーオキシドジスムターゼ(SOD)抗原をマイクロプレートにコーティングし、各ウェルに100μLの抗原を添加し、37°Cで4時間放置した後、ウェル内の液体を捨てました。次に、5%FBSを添加して37°Cで40分間ブロッキングしました。3回洗浄した後、希釈したサンプルをマイクロプレートのウェルに100μLずつ添加し、37°Cで40~60分間放置しました。洗浄液で3回洗浄した後、酵素標識抗体を添加して37°Cで60分間反応させました。3回洗浄した後、TMB(発色基質)を添加して反応を停止しました。マイクロプレートリーダーで波長450nmでOD値を測定しました。サンプル中のSODとMDAの濃度は標準曲線をプロットすることによって計算されました。 |
| 2.8. 実験マウスとモデリンググループ |
| この研究では、10~12週齢、体重20~25gのメスのC57BL/6マウス18匹を選択しました。マウスはSPFレベルの実験室で飼育され、マウスの状態は毎日観察されました。各ケージには5匹の動物が飼育され、水分制限はなく、標準的な食事で、室温は24~26℃、湿度は55~60%、照明時間は12/12時間で、実験中はマウスはSPF実験室で飼育されました。マウスは、模擬群、モデル群、LP45群に分けられ、各群6匹ずつでした。モデル群およびLP45群のC57BL/6雌マウスは、注射部位を75%アルコールで消毒した後、3%イソフルランで麻酔し、麻酔が効かなくなったら背中の皮膚を整え、手術部位を消毒し、背中の腎臓付近の両側を縦に切開し、筋膜を切開して筋肉と腹膜を分離し、脂肪組織に付着したピンク色の卵巣組織を見つけ、両側の卵巣組織を完全に除去し、残った模擬群のマウスは卵巣の隣にある脂肪組織の小片を除去し、手術針と縫合糸を層ごとに使い、ゲンタマイシンで消毒した。手術感染を防ぐため、術後3日間は創傷部にゲンタマイシンを継続的に塗布した。その後、X線撮影を行った。本研究の動物実験は、河北大学実験動物倫理委員会の承認を得ている。倫理番号:2022011805。 |
| 2.9. ヘマトキシリンエオジン(HE )染色 |
| 組織切片を脱パラフィンし、ヘマトキシリン溶液で数分間染色しました。ヘマトキシリン 5 分、塩酸アルコール酸性化 2 秒、アンモニア抗青色 30 秒、水道水で 1 時間すすぎ、蒸留水で簡単にすすぎます。アルコールで脱水した後、切片をエオシン溶液で 3 分間染色し、アルコールで脱水し、キシレンで透明化し、中性ガムでマウントし、光学顕微鏡で観察しました。 |
| 2.10.統計分析 |
| データの分析と処理には SPSS 25.0 と GraphPad を使用しました。測定データは平均 ± 標準偏差 (x¯±s) として表され、複数グループ間の比較にはカイ二乗検定、2 グループ間の比較には独立サンプル t 検定によって分析されました。p < 0.05 は統計的に有意であると見なされました。2 グループ間の比較には独立サンプル t 検定を使用しました。p < 0.05 は統計的に有意であると見なされました。 |
| 3.結果 |
| 3.1.マクロファージにおける酸化ストレス関連タンパク質の発現と 活性酸素種蛍光プローブ |
| 活性酸素種蛍光プローブの結果では、ブランクコントロールグループと LP45 グループの間で活性酸素種の相対蛍光強度に有意差がないことが示されました。ブランクコントロールグループと比較して、LPS(リポ多糖)グループでは 活性酸素種の相対蛍光強度が大幅に増加しました。しかし、LPS グループに LP45 (Lactobacillus plantarum 45)を追加した後、活性酸素種が大幅に減少し、酸化ストレスが大幅に減少したことが示されました。ウエスタンブロットの結果では、ブランクコントロールグループと LP45 グループの間で NOX4、P22、P47 の相対タンパク質発現レベルに有意差がないことが示されました。ブランクコントロールグループと比較して、LPS グループでは NOX4、P22、P47 のタンパク質発現が大幅に増加しました。しかし、LPS グループでは LP45 を追加した後、NOX4、P22、P47 のタンパク質発現が大幅に減少しました。 ELISAの結果、ブランクコントロール群とLP45群の間でマロンジアルデヒドとスーパーオキシドジスムターゼの濃度に有意差がないことが示されました。ブランクコントロール群と比較して、LPS群ではマロンジアルデヒドが有意に増加し、スーパーオキシドジスムターゼが有意に減少しました。LP45はLPS中のスーパーオキシドジスムターゼ濃度を有意に増加させ、マロンジアルデヒド濃度を減少させました(図1)。 |
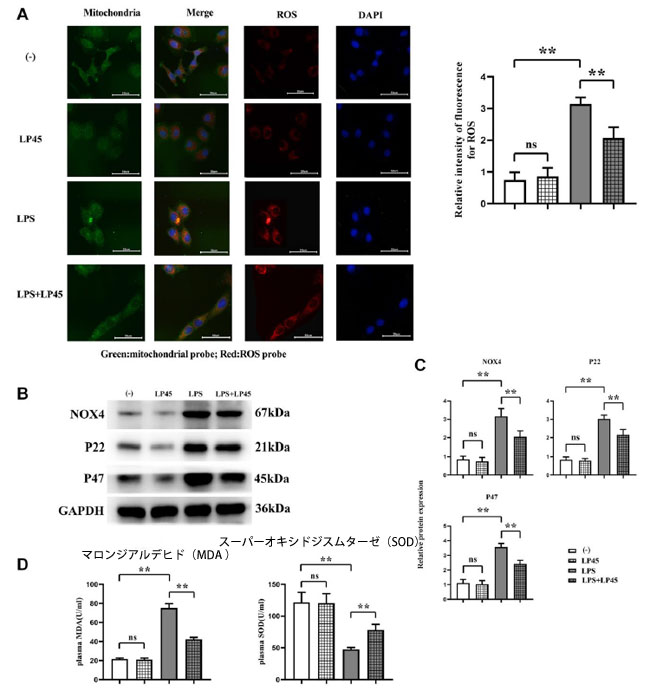 |
図 1 マクロファージにおける酸化ストレスレベルと NOX4、P22、P47 のタンパク質発現をそれぞれ免疫蛍光法とウェスタンブロッティングで検出し、マロンジアルデヒド(MDA )と スーパーオキシドジスムターゼ(SOD) の濃度を ELISA で検出しました。 (A) 各グループのマクロファージの酸化ストレスレベルを免疫蛍光法で検出し、LPS グループと LPS + LP45 グループで 活性酸素種(ROS )の相対蛍光強度を検出しました。 (B) 4 つのマクロファージ グループにおける NOX4、P22、P47 のタンパク質発現をウェスタンブロッティングで検出しました。 (C) マクロファージにおける NOX4、P22、P47 のタンパク質発現。 (D) ELISA によるマロンジアルデヒド(MDA )とスーパーオキシドジスムターゼ(SOD) の濃度の検出。 **p < 0.05、略語: ns: 統計的に有意な差なし。 LPS:リポ多糖、LP45: Lactobacillus plantarum 45 |
| 3.2.マクロファージにおける炎症性サイトカイン関連タンパク質の発現 |
| ウエスタンブロッティングの結果、ブランクコントロール群とLP45群の間で、チロシンホスファターゼ2(SHP2)、Src、NLRP3、IL-1β、p-IRF3、IFN-βの相対タンパク質発現に有意差がないことが示されました。ブランクコントロール群と比較して、LPS群ではNLRP3、IL-1β、p-IRF3、IFN-βのタンパク質発現が有意に増加し、チロシンホスファターゼ2(SHP2)とSrcの相対タンパク質発現が有意に減少しました。しかし、LPS群と比較して、LPS+LP45群ではNLRP3、IL-1β、p-IRF3、IFN-βの相対タンパク質発現が有意に減少し、チロシンホスファターゼ2(SHP2)とSrcの相対タンパク質発現が有意に増加しました(図2)。 |
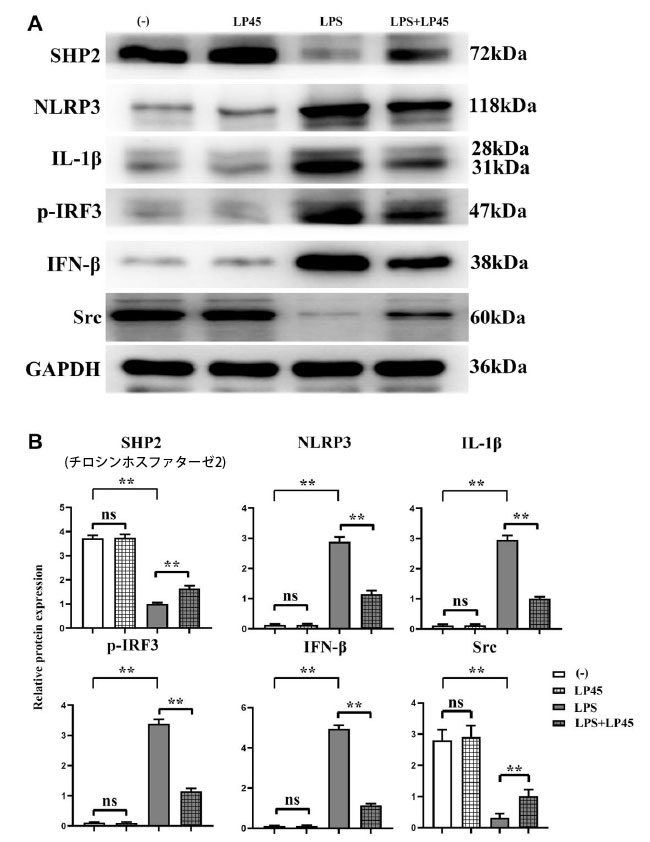 |
図 2 ウェスタンブロッティングによるマクロファージにおける炎症性サイトカイン関連タンパク質の発現の検出。 LP45(Lactobacillus plantarum 45)はSHP2 (チロシンホスファターゼ2)を活性化し、これらの炎症性サイトカインの発現を阻害します。 (A) ウェスタンブロッティングによるマクロファージにおける炎症性サイトカイン関連タンパク質の発現の検出。 (B) マクロファージにおける炎症性サイトカイン関連タンパク質の発現レベル。 **p < 0.05、略語: ns: 統計的に有意な差なし。LPS:リポ多糖、LP45: Lactobacillus plantarum 45 |
| 3.3.骨芽細胞における関連タンパク質の発現とRANKL免疫蛍光染色 |
| グルココルチコイドを骨芽細胞に前処理し、マクロファージと共培養した後、免疫蛍光染色の結果、ブランクコントロール群とLP45群の間でRANKL (核サイトカイン κB 受容体活性化リガンド)の相対蛍光強度に有意差がないことが示されました。ブランクコントロール群と比較して、LPS群のRANKLの相対蛍光強度は有意に減少しました。しかし、LPS群と比較して、LPS+LP45群のRANKLの相対蛍光強度は有意に増加しました。ウエスタンブロッティングの結果、ブランクコントロール群とLP45群の間でOPG、RANKL、RUNX3、RANK、β-カテニンの相対タンパク質発現に有意差がないことが示されました。ブランクコントロール群と比較して、LPS群のOPG、RANKL、RUNX3、RANK、β-カテニンの相対タンパク質発現は有意に減少しました。しかし、LPS群と比較して、LPS + LP45群のOPG、RANKL、RUNX3、RANK、β-カテニンの相対タンパク質発現は有意に増加しました。CCK8の結果は、48時間でブランクコントロール群とLP45群のOD値に有意差がないことを示しました。ブランクコントロール群と比較して、LPS群のOD値は有意に減少しましたが、LPS + LP45群のOD値はLPS群と比較して有意に増加しました(図3)。 |
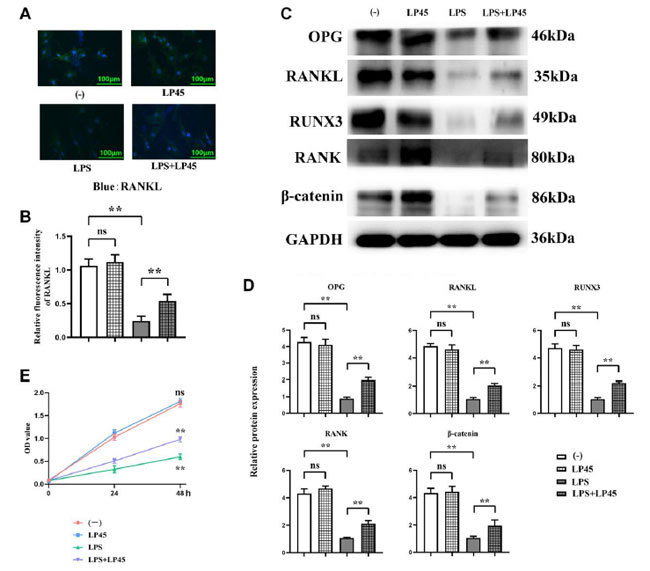 |
図 3 免疫蛍光法およびウェスタンブロッティングによる骨芽細胞における関連タンパク質の発現の検出。 LP45(Lactobacillus plantarum 45)は、マクロファージのヒストンプロテアーゼを調節し、骨芽細胞にエクソソームを分泌することで骨芽細胞の分化を促進します。 (A) 免疫蛍光法による骨芽細胞における RANKL 発現の検出。 (B) 各グループの骨芽細胞における RANKL 発現。 (C) ウェスタンブロッティングによる骨芽細胞における関連タンパク質の発現の検出。 (D) 骨芽細胞における関連タンパク質の発現レベル。 (E) CCK8 実験結果。 **p < 0.05、略語: ns: 統計的に有意な差なし。LPS:リポ多糖、LP45: Lactobacillus plantarum 45 |
| 3.4.破骨細胞における関連タンパク質の発現 |
| ウェスタンブロッティングの結果、ブランクコントロール群とLP45群の間でNF-κB、CREB、AP-1の相対タンパク質発現に有意差がないことが示されました。ブランクコントロール群と比較して、LPS群のNF-κB、CREB、AP-1の相対タンパク質発現は有意に増加しました。しかし、LPS群と比較して、LPS+LP45群のNF-κB、CREB、AP-1の相対タンパク質発現は有意に減少しました(図4)。 |
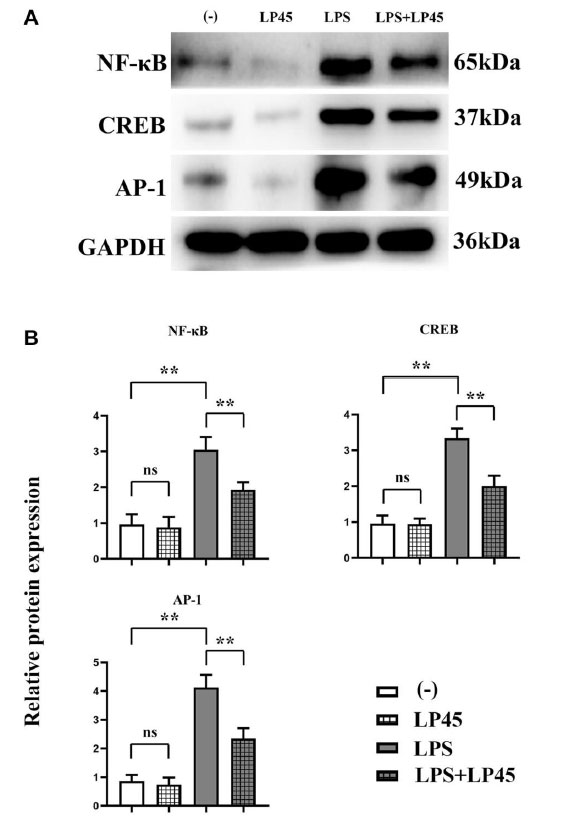 |
図 4 ウエスタンブロッティングによる破骨細胞における関連タンパク質の発現の検出。LP45(Lactobacillus plantarum 45)は、マクロファージのヒストンプロテアーゼを調節し、破骨細胞にエクソソームを分泌することで、破骨細胞の形成を阻害します。 (A) ウエスタンブロッティングによる破骨細胞における関連タンパク質の発現の検出。 (B) 破骨細胞における関連タンパク質の発現レベル。 **p < 0.05、略語: ns: 統計的に有意な差なし。LPS:リポ多糖、LP45: Lactobacillus plantarum 45 |
| 3.5. チロシンホスファターゼ2ノックアウトマクロファージにおける関連タンパク質の発現 |
| ウェスタンブロッティングの結果、ブランクコントロール群とLP45群の間で、SHP2(チロシンホスファターゼ2)、Src、NOX4、P47、NLRP3、IL-1β、p-IRF3、IFN-βの相対タンパク質発現に有意差がないことが示されました。ブランクコントロール群と比較して、LPS群ではNOX4、P47、NLRP3、IL-1β、p-IRF3、IFN-βの相対タンパク質発現が有意に増加し、SHP2とSrcの相対タンパク質発現が有意に減少しました。しかし、LPS群と比較して、LPS+LP45群ではNOX4、P47、NLRP3、IL-1β、p-IRF3、IFN-βの相対タンパク質発現が有意に減少し、SHP2とSrcの相対タンパク質発現が有意に増加しました。しかし、SHP2-siRNAを導入した後、4つのグループにおけるチロシンホスファターゼ2とSrcの相対的なタンパク質発現は有意に減少し、有意差は見られませんでした。ブランクコントロールグループとLP45グループではNOX4、P47、NLRP3、IL-1β、p-IRF3、IFN-βの相対的なタンパク質発現に変化はありませんでしたが、NOX4、P47、NLRP3、IL-1β、p-IRF3、IFN-βの相対的なタンパク質発現は有意に増加し、LPSグループとLPS + LP45グループ間の有意差は解消されました(図5)。 |
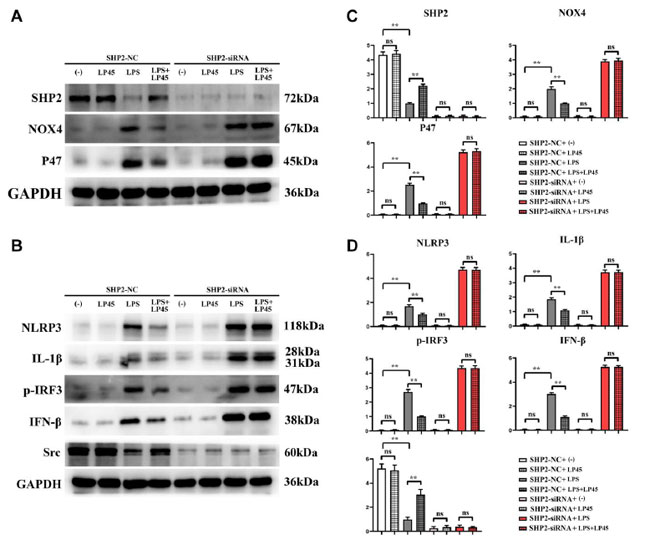 |
図 5 SHP2(ウェスタンブロッティングによるチロシンホスファターゼ2)ノックアウトの有無によるマクロファージにおける関連タンパク質の発現の検出。LP45(Lactobacillus plantarum 45) は抗酸化ストレス効果を発揮して チロシンホスファターゼ2を活性化し、炎症性サイトカインの発現を調節して骨芽細胞と破骨細胞の分化を制御します。 (A) ウェスタンブロッティングを使用して、チロシンホスファターゼ2(SHP2)ノックアウトマクロファージにおけるチロシンホスファターゼ2(SHP2)、NOX4、P47 の発現を検出しました。 (B) ウェスタンブロッティングを使用して、チロシンホスファターゼ2(SHP2)ノックアウトマクロファージにおける NLRP3、IL-1β、p-IRF3、IFN-β、Src の発現を検出しました。 (C) チロシンホスファターゼ2(SHP2)、NOX4、P47 の発現統計。 (D) NLRP3、IL-1β、p-IRF3、IFN-β、Src の発現統計。 **p < 0.05、略語: ns: 統計的に有意な差なし。 |
| 3.6. Lactobacillus plantarum 45は骨粗鬆症の進行を抑制できる |
| X線とHE染色により、LP45(Lactobacillus plantarum 45)の骨粗鬆症に対する効果を観察した。その結果、模擬群の海綿骨は整然と並び、連続性が良く、構造が比較的充実しており、形態構造が完全であることがわかった。モデル群の海綿骨の数は少なく、構造は不均一で、接続が悪く、骨折が壊れ、隙間が広がり、海綿骨の骨折と吸収によって生じた空洞が目立った。しかし、LP45群の海綿骨の数は比較的多く、厚く充実しており、隙間が小さくなり、配列が整然としており、海綿骨の連続性が優れていた(図6)。まとめると、LP45 は酸化ストレスの生成を阻害して チロシンホスファターゼ2 シグナル伝達経路を活性化することで抗酸化作用を発揮し、骨芽細胞の分化を促進し、破骨細胞の形成を抑制して骨の恒常性を維持し、骨代謝を改善します (図 7)。 |
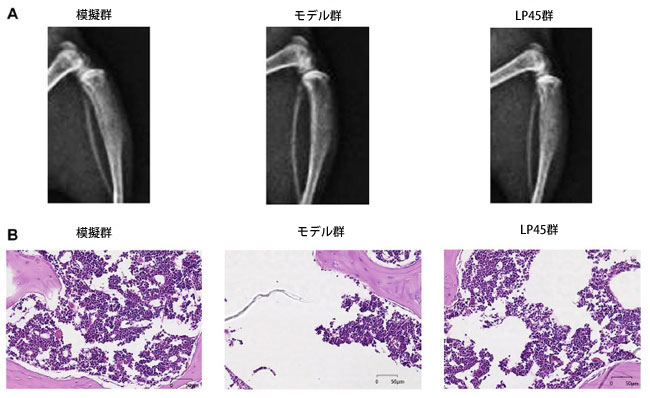 |
図 6 LP45(Lactobacillus plantarum 45)は骨粗鬆症の進行を抑制します。 (A) マウスの X 線写真、 (B) HE 染色結果。 **p < 0.05。LP45群:Lactobacillus plantarum 45群 |
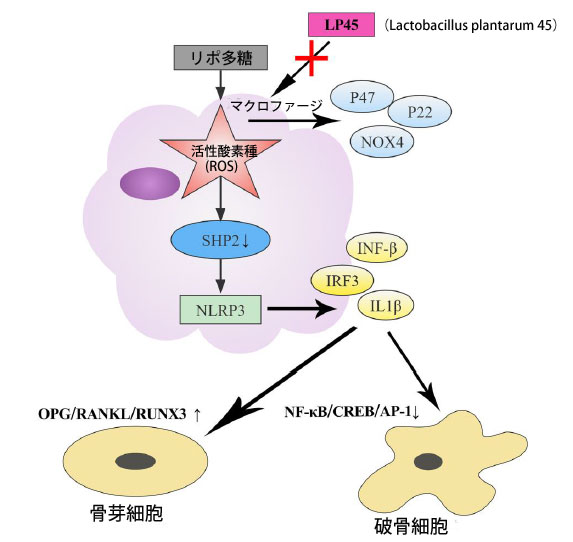 |
図 7 酸化ストレスの抑制を通じて チロシンホスファターゼ2 (SHP2) を活性化し、骨芽細胞と破骨細胞の分化を制御する LP45(Lactobacillus plantarum 45)の模式図。 略語: LPS:リポ多糖、LP45: Lactobacillus plantarum 45、ROS:活性酸素種 |
| 4.考察 |
| 骨粗鬆症の発症は主に骨再建の動的バランスの乱れに起因し[22]、酸化ストレスは骨再建と恒常性維持において主要な役割を果たしている[23]。骨芽細胞と破骨細胞のバランスを維持することは、骨粗鬆症の治療に極めて重要である。免疫細胞は細胞間接触またはエクソソームの分泌を介して骨芽細胞および破骨細胞と相互作用し、さまざまな炎症性骨疾患と密接に関連している[24]。活性化マクロファージは骨粗鬆症の重症度と密接に関連していることが判明している[25]。分泌因子は骨細胞上のマクロファージの調節を決定づける因子であり、リポ多糖(LPS)などの刺激因子に反応して特定のサイトカインが放出され、細胞損傷と酸化ストレスを引き起こす[26]。マクロファージは、良性因子による刺激下での体外組織回復および骨芽細胞分化に対して免疫調節効果を有し[27]、例えば、M2マクロファージ分泌OPGは骨芽細胞前駆細胞(間葉系幹細胞、MSCなど)の分化および活性化を刺激し[28]、骨の石灰化を増加させ、骨の恒常性および骨細胞の再生を促進する[29]。プロバイオティクスは、免疫系を媒介することで骨格系の恒常性に影響を与え、骨芽細胞と破骨細胞のバランスを調節し、骨格の再構築に大きく貢献することができる[30]。本研究では、LP45(Lactobacillus plantarum 45)が抗酸化作用を発揮し、マクロファージを調節して骨の恒常性を促進する特定のメカニズムを詳細に調査した。 |
| プロバイオティクスは、腸内細菌叢のバランスを改善することで宿主動物に有益な生きた微生物の栄養補助食品と定義され、近年広く研究されています。特に、Lactobacillus plantarumへの関心は、ここ数十年で飛躍的に高まっています [31]。Liu X は、Lactobacillus plantarum HFY15 が Wnt/β-カテニンおよび OPG/RANK/RANKL シグナル伝達経路の調節に積極的な役割を果たすことを発見しました [32]。さらに、Lactobacillus plantarum GKM3 およびLactobacillus paracasei GKS6 は、OVX マウスモデルで骨粗鬆症を抑制し、骨芽細胞の分化を促進し、骨形成タンパク質 (BMP) および RANKL 経路を介して RANKL 誘導性破骨細胞分化を抑制しました [33]。したがって、プロバイオティクスは骨の健康に潜在的に有益な効果を発揮します。 |
| 酸化ストレスは、破骨細胞の産生と骨芽細胞および骨細胞のアポトーシスを増加させ、骨芽細胞系列への骨前駆細胞の分化を減少させ、骨芽細胞の活性を低下させるため、酸化ストレスの抑制は骨粗鬆症の予防または遅延の重要なステップです。NOX4は活性酸素種の主な発生源であり[34]、NOXの重要な構成要素として、タンパク質P22とP47は酸化ストレスの調節に不可欠です。この研究の結果、NOX4、P22、およびP47のタンパク質発現がLPS群で上昇し、LP45(Lactobacillus plantarum 45)の添加後に著しく減少したことが明らかになりました。さらに、ELISAの結果は、Lactobacillus plantarum 45がリポ多糖中のスーパーオキシドジスムターゼ(SOD)濃度を有意に増加させ、マロンジアルデヒド(MDA )濃度を減少させたことを示しており、これはリポ多糖が酸化ストレスを誘発する可能性があるのに対し、Lactobacillus plantarum 45には抗酸化ストレス効果があることを示唆しています。炎症性サイトカインは骨代謝の主な調節因子として機能し、直接的または間接的に骨芽細胞と破骨細胞の形成と機能を調節することにより、血管機能を破壊し、骨量減少を引き起こし、骨の石灰化を阻害し、骨の強度を低下させる可能性がある[35]。 チロシンホスファターゼ2 (SHP2)は細胞で高度に発現しているタンパク質であり、多くの疾患と密接に関連している[36]。 報告されているように、チロシンホスファターゼ2は骨芽細胞と破骨細胞の分化に深く関与している。 この研究の結果、LPS群ではIL-1β、NLRP3、IRF3、INF-βのタンパク質発現が増加し、チロシンホスファターゼ2発現が著しく減少したが、Lactobacillus plantarum 45添加後は逆の結果となったことから、リポ多糖はチロシンホスファターゼ2を分解して炎症性サイトカインの産生を誘導するのに対し、Lactobacillus plantarum 45は抗酸化ストレス効果を発揮してチロシンホスファターゼ2を活性化し、炎症性サイトカインをダウンレギュレーションできることが示された。 |
| 骨芽細胞と破骨細胞の異常な分化は、骨吸収と骨形成の不均衡を引き起こし、これが骨粗鬆症の主な原因となる。グルココルチコイドは骨芽細胞と骨細胞のアポトーシスを促進することで骨形成の減少と骨量減少を引き起こし、骨粗鬆症の発生と進行につながる可能性がある[1]。OPG/RANKL/RANKシグナル伝達経路と古典的なNF-κBシグナル伝達経路は、破骨細胞の骨吸収と骨芽細胞の骨形成を制御する極めて重要なシグナル伝達経路である[37]。炎症性サイトカインによるOPG、NF-κB、RANKLの発現の制御は、骨芽細胞と破骨細胞の分化の重要な要因であることが判明している[38]。この研究の結果、マクロファージと骨芽細胞の共培養後、LPS グループでは IL-1β、NLRP3、IRF3、INF-β の発現レベルが増加しましたが、Lactobacillus plantarum 45の添加によって大幅に抑制され、Lactobacillus plantarum 45が炎症性サイトカインのレベルをダウンレギュレーションし、骨芽細胞関連のシグナル伝達経路を活性化できることが示されました。 |
| チロシンホスファターゼ2およびチロシンホスファターゼ2関連シグナル伝達経路の調節は、骨の発達や変性疾患の治療に寄与する可能性があり、チロシンホスファターゼ2は骨芽細胞および破骨細胞の形成において重要な調節因子として作用する[28]。Timothy J Baulerは、チロシンホスファターゼ2ノックアウト成体マウスは生体内で骨芽細胞の分化を阻害し、脊柱後弯症、側弯症、骨硬化症などの骨構造異常を呈することを発見した[39]。Yi Zhouは、チロシンホスファターゼ2ノックアウトマウスは骨粗鬆症になりやすく、これは破骨細胞の大量分化と関連していることを発見した[40]。本研究では、チロシンホスファターゼ2ノックアウトマクロファージにリポ多糖を添加後、細胞内のNOX4、P22、P47などの酸化ストレス関連タンパク質のレベルが上昇し、IL-1β、NLRP3、IRF3、INF-βなどの炎症性サイトカインの発現が高くなるのに対し、Lactobacillus plantarum 45を添加すると逆のことが分かりました。まとめると、Lactobacillus plantarum 45は酸化ストレスの生成を抑制してチロシンホスファターゼ2シグナル伝達経路を活性化し、骨芽細胞の分化を促進し、破骨細胞の形成を抑制して骨の恒常性を維持し、骨代謝を改善することで抗酸化作用を発揮し、骨粗鬆症の予防と治療に新たなアイデアとアプローチを提供します。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Aging (Albany NY). 2024 Apr 15; 16(7): 6334–6347.に掲載されたLactobacillus plantarum 45 activates SHP2 through inhibition of oxidative stress to regulate osteoblast and osteoclast differentiation. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


