ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
Lactobacillus plantarumは、COVID-19に対する保護効果をもたらす可能性のある自然サイトカイン反応を誘導する:in vitroサイトカイン反応アッセイと組み合わせた単群、二重盲検、前向き試験 |
Yasunari Kageyama, et al., |
|
|
| 要約 |
腸内微生物叢は、腸-肺軸を通じて気道生理機能と免疫機能を間接的に調節することができます。最近の微生物叢研究によると、新型コロナウイルス感染症 (COVID-19) の患者は、疾患の病態生理と密接に関連する特定の腸内細菌叢異常(dysbiosis:腸内毒素症、腸内細菌叢異常、腸内細菌その乱れ)を呈しています。したがって、プロバイオティクスを使用して腸内微生物叢のバランスを取り戻すことは、COVID-19 の制御に効果的である可能性があります。しかし、COVID-19 でプロバイオティクスを使用する根拠は依然として不明です。本研究では、in vitro サイトカイン応答アッセイを実施し、続いて単群二重盲検前向き試験を実施して、COVID-19 に対するプロバイオティクス乳酸菌の免疫学的有効性を評価しました。本研究では、呼吸器 RNA ウイルスの感染に対して強力な保護効果を示す Lactobacillus plantarum (L. plantarum)、Bifidobacterium longum、および Lactococcus lactis ssp. lactis に焦点を当てました。予防目的での長期にわたる毎日摂取の実現可能性を考慮し、健康な非感染者を被験者として登録しました。私たちの以前のパイロット試験では、COVID-19に対して特に処方された漢方薬である経口清肝排斥煎じ薬(QFPD)が、血漿中のTNF-α、IL-1β、IL-18、IL-8をアップレギュレーションすることを実証しました。そのため、本研究では、QFPDによって誘発されるサイトカインの変化を利用して、乳酸菌の抗COVID-19免疫調節能の指標として、生来のサイトカイン指数QICI [=(TNF-α) x (IL-1β) x (IL-18) x (IL-8)/(IL-6)] を定義しました。合計20人の適格なボランティアが登録され、そのうち18人が介入を完了しました。L. plantarumは、in vitroサイトカイン応答アッセイですべての被験者で著しく高い生来のサイトカイン指数を示しました。その後の試験では、L. plantarumの経口摂取により、ベースラインと比較して、自然サイトカイン指数が有意に上昇し(平均変化倍数、17倍、P = 0.0138)、COVID-19における複雑な免疫調節異常の主な要因であるIL-6の血漿レベルが低下しました(P = 0.0128)。サイトカイン指数は18人中16人(88.9%)で増加しましたが、変化倍数にはかなりの個人差がありました(1~128倍)。これらの自然サイトカインの変化に沿って、L. plantarumの摂取はナチュラルキラー細胞の活性を有意に高めました。対照的に、経口B. longumは、ベースラインと比較して、自然サイトカイン指数の有意な増加を誘発しませんでした(平均変化倍数、2倍、P = 0.474)。結論として、L. plantarumは優れたQFPD様免疫調節能力を示し、ウイルス感染に対する初期の免疫応答によって生成される血中サイトカイン環境を模倣しました。抗COVID-19プロバイオティクスとしてのL. plantarumの毎日の摂取は、パンデミック中のCOVID-19の予防に可能な選択肢となる可能性があります。本研究は、2020年5月22日に大学病院医療情報ネットワーク-臨床試験レジストリに試験番号UMIN000040479で前向きに登録されました。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.1.対象 |
| 2.2.被験者募集 |
| 2.3.研究デザイン |
| 2.4.インビトロサイトカイン応答アッセイ |
| 2.5.臨床試験 |
| 2.6.先天性免疫細胞活性アッセイ |
| 2.7.好中球活性 |
| 2.8.ナチュラルキラー細胞活性 |
| 2.9.マクロファージ活性 |
| 2.10.統計分析 |
| 3.結果 |
| 3.1.清肝排毒煎じ薬誘発性自然サイトカイン指数が最も高い乳酸菌と最も低い乳酸菌の選択 |
| 3.2.L. plantarum 摂取は、生体内で清肝排毒煎じ薬のような自然サイトカイン反応を誘発します |
| 3.3.L. plantarum 摂取による自然免疫細胞活性への影響 |
| 4.考察 |
本文 |
| 1.はじめに |
| 新型コロナウイルス感染症(COVID-19)パンデミックは、世界の公衆衛生に対するますます深刻な脅威になりつつあります。原因コロナウイルスである重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)は、主に、ウイルス侵入分子であるアンジオテンシン変換酵素2(ACE2)と膜貫通型セリンプロテアーゼ2(TMPRSS2)を共発現する気道上皮細胞のサブポピュレーションに感染します(1-3)。特に、アンジオテンシン変換酵素2と膜貫通型セリンプロテアーゼ2は下部消化管、特に回腸と結腸の腸管上皮細胞と前駆細胞で共発現しているため、SARS-CoV-2はヒトの腸管上皮細胞にも感染する可能性があることを示す証拠がいくつかあります(2-5)。ACE2を発現する腸管上皮細胞におけるSARS-CoV-2の標的感染と活発な複製は、ヒト腸オルガノイドを使用して実証されています(5-8)。 COVID-19患者の便検体や肛門/直腸スワブからSARS-CoV-2 RNAが検出されており(9-11)、患者の便からは感染性ウイルスが分離されている(8)。COVID-19患者のかなりの割合で、下痢や腹痛などの胃腸症状が同時にみられる(12-14)。これらの知見から、SARS-CoV-2の腸管感染と腸内細菌叢の間に悪影響がある可能性が浮上している。 |
| 腸内細菌叢は、腸管と呼吸器の相互作用、つまり腸-肺相関において重要な役割を果たしており、腸内細菌由来の分子(構造成分、代謝物、毒素など)が気道の生理機能と免疫機能を調節している(15-17)。腸内細菌叢の乱れは気道粘膜の免疫緊張の異常につながり、呼吸器ウイルス感染に対する免疫反応の調節異常を引き起こす可能性がある(15-17)。最近のマイクロバイオーム研究では、COVID-19患者の腸内細菌の特定の分類群に組成の変化が見られることが明らかになっている(18-21)。特に、変化の一部は炎症誘発性サイトカインの血清レベル、症状の重症度、糞便中のSARS-CoV-2ウイルス量と相関しており、COVID-19関連の腸内細菌叢の乱れが疾患の病態生理と密接に関連していることを示唆している(19-21)。 |
| 数多くの動物実験および臨床研究により、様々な乳酸菌(LAB)種のプロバイオティクス株の経口摂取が、呼吸器RNAウイルスによる感染に対する予防および治療効果を示したことが実証されています(22-26)。COVID-19の生命を脅かす症状と合併症は、好中球増加、リンパ球減少、T細胞免疫の低下、炎症性メディエーターの過剰産生を伴う複雑な免疫調節異常による過剰炎症によって引き起こされます(27-29)。L. plantarum DR7やL. paracasei 8700:2などの特定のプロバイオティクス乳酸菌株は、呼吸器ウイルス感染に対する優れた免疫調節および抗炎症能力を持っているため、治療用途に適している可能性があります(30、31)。一方、特定の炎症誘発性乳酸菌株は、早期の抗ウイルス免疫応答を引き起こす可能性のある生来のサイトカイン変化を誘発することが知られており、予防的に使用できる可能性があります(32、33)。特に、これまでの前臨床研究およびランダム化比較試験では、プロバイオティクス乳酸菌のうち、Lactobacillus plantarum(L. plantarum)(33-39)、Bifidobacterium longum(B. longum)(40,41)、およびLactococcus lactis ssp. lactis(L. lactis ssp. lactis)(42)が、宿主の自然免疫を強化することにより、インフルエンザウイルス感染に対して強力な保護効果を発揮することが実証されています。 |
| Lactobacillus, Bifidobacterium および Lactococcus は最も代表的な乳酸菌であり、人の健康に有益なプロバイオティクス特性を持つと認識されています (43,44)。L. plantarum は、植物由来のグラム陽性、通性嫌気性、桿菌で、人の腸管と口腔内に分布しています。これは、漬物、ザワークラウト、キムチなど、さまざまな発酵植物食品と密接な関連があるヘテロ発酵性乳酸菌です。B. longum は、V 字型または Y 字型の形態を持つグラム陽性、偏性嫌気性、ヘテロ発酵性細菌で、主に新生児から高齢者まで人の腸内に生息します。L. lactis ssp. lactisは、生乳や発酵乳製品によく含まれる、グラム陽性、通性嫌気性、球状の細菌です。 |
| 清肝排毒煎じ薬(QFPD)は、中国語で「肺を浄化し、毒素を除去する煎じ薬」を意味し、COVID-19に特化して新たに処方された漢方薬であり、その治療使用は中国の公式管理ガイドラインで推奨されている(45)。中国での臨床試験では、清肝排毒煎じ薬が軽症から重篤な症例の回復を早め、病気の進行を防ぐことが実証されている(46-49)。後ろ向き臨床研究では、清肝排毒煎じ薬がC反応性タンパク質、クレアチンキナーゼ、乳酸脱水素酵素などのCOVID-19バイオマーカーの血中濃度を低下させることも示されている(50)。私たちの以前の研究では、清肝排毒煎じ薬の薬理作用が、ウイルス感染に対する初期の自然免疫応答を媒介する重要なサイトカインであるTNF-α、IL-1β、IL-18、IL-8の血漿レベルの上昇と関連していることが実証されている(51)。 |
| したがって、プロバイオティクスを使用して腸内細菌叢のバランスを取り戻すことは、COVID-19の制御に効果的である可能性があります。しかし、私たちが知る限り、COVID-19患者に対するプロバイオティクスの有効性に焦点を当てた研究はなく、COVID-19に対してプロバイオティクスを使用する根拠は依然として不明です。さらに、免疫逃避変異を伴う新しいSARS-CoV-2変異体が頻繁に出現し、急速に広がっているため、多様な予防オプションを調査する必要があります。COVID-19の予防に対するプロバイオティクスの免疫学的有効性を調べるために、L. plantarum、B. longum、およびL. lactis ssp. lactisを使用して、in vitroサイトカイン応答アッセイを組み合わせた単群二重盲検前向き試験を実施しました。清肝排毒煎じ薬によって誘発される自然サイトカインの変化は、乳酸菌の抗COVID-19免疫調節能の指標として使用されました。さらに、乳酸菌摂取が自然免疫細胞の活動に及ぼす影響を調べました。 |
| 2.材料と方法 |
| 2.1.対象 |
| 参加者は、大学病院医療情報ネットワーク-臨床試験登録ウェブサイト、高輪クリニック(Tokyo, Japan)ウェブサイト、電子メールニュースレターのお知らせ、および個人的な連絡を通じて募集されました。以下のすべての包含基準を満たす個人が登録されました:i)20歳から70歳までの健康な成人、ii)研究登録時にSARS-CoV-2のPCRおよびIgM/IgG抗体検査が陰性である(過去および現在SARS-CoV-2に感染していない)。胸部画像検査は本研究では使用されませんでした。以下の除外基準のいずれかを満たす個人は、この試験から除外されました:i)妊娠中、ii)授乳中、iii)他の臨床試験に重複して登録、iv)登録前6か月以内に感染症の病歴、v)慢性炎症性疾患、免疫関連疾患、または腫瘍性疾患の現在または過去の病歴、vi)登録前6か月以内に医薬品の使用歴。 vii) 高血圧、心血管疾患、脳血管疾患、糖尿病、肥満(BMI ≥ 30)(52,53)、慢性閉塞性肺疾患、慢性腎臓病など、COVID-19の高リスクに関連する基礎疾患。したがって、登録された被験者には記録および報告された併存疾患はありませんでした。 |
| 2.2.被験者募集 |
| 清肝排毒煎じ薬を使用した 18 人の健康な被験者に対する以前の研究 (51) では、得られた効果サイズ r は 0.816 (TNF-α)、0.881 (IL-1β)、0.724 (IL-18)、0.796 (IL-8) でした。平均値 0.804 が、今回の試験の推定効果サイズとして採用されました。事前両側検定力分析は、有意水準 α 0.05、望ましい検定力 1-β 0.8、推定効果サイズ 0.804 で実施され、必要なサンプル サイズは合計 15 人であることが示されました。 |
| 参加者の募集は、2020年5月27日から2020年6月2日の間に高輪クリニック(Tokyo, Japan)で行われました。合計20名のボランティアが適格性についてスクリーニングされ、適格であると判断され、本試験に登録されました(図1)。in vitroサイトカイン反応アッセイは、2020年6月7日から9日の間に実施されました。乳酸菌は、2020年6月25日から8月17日の間に登録されたすべての参加者に投与されましたが、そのうち2名は、乳酸菌処方後に高輪クリニックを受診しなかったため、主な分析から除外されました。その結果、18名(男性1名、女性17名、年齢28〜66歳、平均年齢±SD 44.2±10.1歳)が介入を完了し、データが統計分析にかけられました。 |
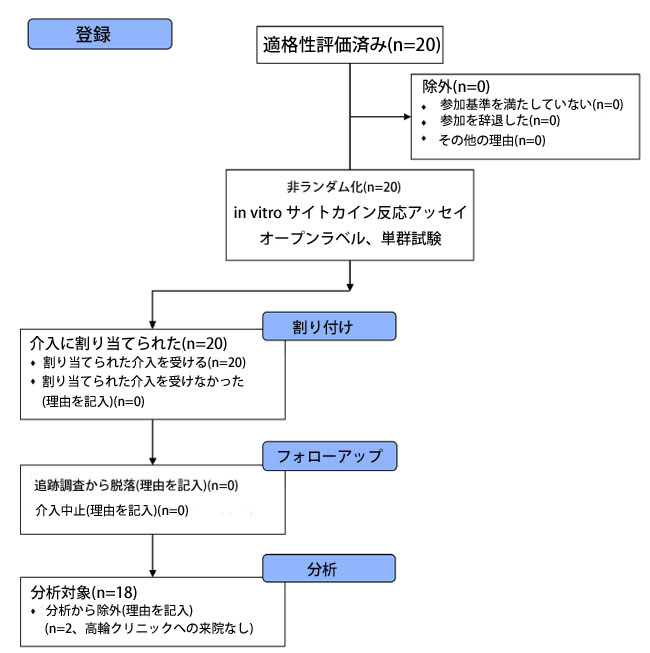 |
| 図 1 本研究の参加者の CONSORT フロー図。CONSORT; 試験報告の統合基準。 |
| 2.3.研究デザイン |
| 本研究は、in vitro サイトカイン反応アッセイと単群二重盲検前向き試験という 2 つの連続した実験手順で構成されていました。 |
| 各被験者の最適な乳酸菌は、各乳酸菌と末梢血の共培養を使用して決定されました。清肝排毒煎じ薬誘発性自然サイトカイン変化は、乳酸菌の抗COVID-19免疫調節能を評価するための指標として使用されました。清肝排毒煎じ薬誘発性自然サイトカイン指数(QICI)は次のように定義されました:清肝排毒煎じ薬誘発性自然サイトカイン指数=(TNF-α)x(IL-1β)x(IL-18)x(IL-8)/(IL-6)、ここで括弧はpg / mlでのサイトカインの血漿レベルを表します。IL-6は、COVID-19患者の複雑な免疫調節異常の重要な要因であるため、分母として採用されました(54-56)。 |
| 最高および最低の清肝排毒煎じ薬誘発性自然サイトカイン指数を示す乳酸菌 は、その後の臨床試験で使用され、摂取した 乳酸菌が in vitro サイトカイン反応 (in vitro QICI) を再現できるかどうかが調べられました。試験は、次の 3 つの連続セッションで構成されていました: i) 検証 (最高清肝排毒煎じ薬誘発性自然サイトカイン指数を示す乳酸菌を使用した介入)、ii) ウォッシュアウト、および iii) コントロール (最低清肝排毒煎じ薬誘発性自然サイトカイン指数を示す乳酸菌を使用した介入) セッション。主要評価項目は、ベースラインと比較した 7 日間の各乳酸菌セッション後の TNF-α、IL-1β、IL-18、IL-8、IL-6 の血漿レベルと清肝排毒煎じ薬誘発性自然サイトカイン指数の変化でした。副次評価項目は、ベースラインと比較した 7 日間の各乳酸菌セッション後の血液学的パラメータの変化でした。 |
| 2.4.インビトロサイトカイン応答アッセイ |
| L. plantarum SNK12 [2x1012 コロニー形成単位/g (cfu/g); Bio-Lab Co., Ltd.] は、強力な免疫調節、抗炎症、抗ウイルス能力を持つプロバイオティクス株です (57,58)。プロバイオティクス B. longum BB536 株 (1.5x1011 cfu/g; Morinaga Milk Industry Co., Ltd.) は、抗アレルギー効果 (59,60)、ウイルス感染からの保護 (41,61)、腸内細菌叢の調整 (62-64) など、さまざまな臨床効果を発揮することが報告されています。L. lactis ssp. lactis は、形質細胞様樹状細胞を活性化し、インターフェロン (IFN) の産生能力を高めることで、免疫調節および抗ウイルス効果を発揮します (42)。本研究では、市販のプロバイオティクス株L. lactis ssp. lactis LLL970(1x1011 cfu/g、Synbio Tech、Inc.)を使用しました。 |
| 生乳酸菌は、市販のビーズバイブレーター(PS-2000、Kurabo Industries Ltd.)で0.5gの3.0mmジルコニアビーズを用いて室温で3分間、4,600rpm(1分間にサンプルチューブが8の字型に動く回数)で2回振動させて破砕し、その後60℃で20分間加熱した。死乳酸菌は、ダルベッコリン酸緩衝生理食塩水(Ca2+およびMg2+を含まない)に100µg/mlの濃度で懸濁した。 |
| 乳酸菌が末梢血免疫細胞による清肝排毒煎じ薬様サイトカイン産生を刺激する能力は、以前の研究 (65-67) で説明したように評価されました。簡単に説明すると、各被験者からのヘパリン処理末梢血 (0.4 ml) を、10% ウシ胎児血清 (FBS、Sigma-Aldrich、Merck KGaA) を添加した 1 ml RPMI-1640 培地 (DS Pharma Biomedical Co., Ltd.) で各殺菌乳酸菌懸濁液 (4 µg) と共培養し、加湿インキュベーター内で 5% CO2、37˚C で 48 時間培養しました。培養上清中の TNF-α、IL-1β、IL-8、IL-6 の濃度は、V-PLEX Proinflammatory Panel 1 Human キット (カタログ番号 K15049D-1、Meso Scale Diagnostics、LLC) を使用して測定し、IL-18 の濃度は、Human IL-18 ELISA キット (カタログ番号 ab215539、Abcam) を使用して製造元のプロトコルに従って測定しました。データは、最高または最低の清肝排毒煎じ薬誘発性自然サイトカイン指数を持つ種の特徴付けのための清肝排毒煎じ薬誘発性自然サイトカイン指数値を計算するために使用されました。 |
| 2.5.臨床試験 |
| 本試験は、単群、二重盲検、前向き試験でした。各被験者は、in vitro サイトカイン応答アッセイで最高の清肝排毒煎じ薬誘発性自然サイトカイン指数 (1x1011 cfu/日) を示した生乳酸菌を、7 日間 (1 日目から 7 日目) にわたり、1 日 2 回朝と夕方の食間に経口摂取するよう指示されました。7 日間のウォッシュアウト期間 (8 日目から 14 日目) の後、陰性対照試験が実施され、in vitro サイトカイン応答アッセイで最低の清肝排毒煎じ薬誘発性自然サイトカイン指数(1x1011 cfu/日) を示した 乳酸菌 が、7 日間 (15 日目から 21 日目) にわたり、1 日 2 回朝と夕方の食間に経口投与されました。各被験者から 0、8、22 日目に末梢血サンプルが採取されました。被験者も担当医師も、最終的な採血が完了するまで、in vitro 乳酸菌評価の結果、処方された乳酸菌、またはその清肝排毒煎じ薬誘発性自然サイトカイン指数特性について知りませんでした。血漿中のTNF-α、IL-1β、IL-18、IL-8、IL-6の濃度は前述のとおり定量化されました。血液学的検査および血液生化学検査(表SIIに記載されているパラメータ)はSRL, Inc.に委託されました。 |
| 2.6.先天性免疫細胞活性アッセイ |
| 試験完了後、合計約 9 か月で、18 人の試験参加者から 10 人の健康な被験者が無作為に選択され、単純ランダム化により L. plantarum グループ (n=5) または B. longum グループ (n=5) にランダムに割り当てられました。L. plantarum と B. longum の摂取と採血は、試験と同じプロトコル (1x1011 cfu/日、7 日間毎日 2 回) で実施されました。7 日間の摂取後、以下に詳細を説明する標準的な方法を使用して、先天性免疫細胞活性を測定しました。 |
| 2.7.好中球活性 |
| 好中球の貪食活性の測定は、BML, Inc. に委託しました。簡単に説明すると、各被験者のヘパリン添加末梢血 (0.1 ml) を、ダルベッコリン酸緩衝生理食塩水[-(Ca2+ および Mg2+ なし)] で 4 倍に希釈した 40 µl の蛍光マイクロビーズ (Fluoresbrite® YG Carboxylate Microspheres 1.75 µm、Polysciences, Inc.) と混合し、37˚C で 30 分間穏やかに撹拌しながらインキュベートしました。サンプルを 2 ml の 10X FACS 溶解液 (BD Biosciences) で 4˚C で 15 分間処理し、穏やかな低張条件下で赤血球を溶解した後、FACSCalibur™ フローサイトメーター (BD Biosciences) を使用してフローサイトメトリー分析を行いました。顆粒球は、高粒度を有する中サイズの細胞として特徴付けられ、中前方散乱 (FSC)/高側方散乱 (SSC) ゲーティングを設定することによって分離されました。蛍光陽性顆粒球 (蛍光マイクロビーズを貪食した顆粒球) の総顆粒球数に対する割合は、BD CellQuest™ Pro ソフトウェア バージョン 6.0 (BD Biosciences) を使用して計算されました。 |
| 2.8.ナチュラルキラー(NK)細胞活性 |
| クロム51(51Cr)放出アッセイを使用したナチュラルキラー細胞活性の分析は、SRL, Inc.に委託しました。リンパ球は、製造元の指示に従って、密度勾配遠心分離(Lymphosepar I、Immuno-Biological Laboratories Co., Ltd.)を使用して5 mlの末梢血から分離されました。リンパ球は、ダルベッコリン緩衝生理食塩水(-)で2回洗浄し、10% ウシ胎児血清を添加したRPMI-1640で1x106細胞/ mlで再懸濁しました。合計 200 µl のアリコート (エフェクター細胞、2 x 105) を、51Cr (PerkinElmer, Inc.) で放射標識したヒト慢性骨髄性白血病 K562 細胞 (標的細胞、1 x 104 細胞/10 µl、カタログ番号 CCL-243、American Type Culture Collection) と混合し、5% CO2 インキュベーターで 37˚C で 3.5 時間インキュベートしました。細胞を遠心分離で回収し、残留 51Cr 放射能を WIZARD® Automatic Gamma Counter (PerkinElmer, Inc.) を使用して測定しました。エフェクターを含まない培地 (RPMI-1640、10% ウシ胎児血清) で処理したクロム51負荷 K562 細胞を使用して、自発的に放出されたクロム51を定量しました。 |
| 2.9.マクロファージ活性 |
| マクロファージ活性については、IFN-γ刺激を受けた単球およびマクロファージによって主に産生される活性化マーカーであるネオプテリンの血清レベル(68,69)を評価した。血清ネオプテリンの測定はSRLInc.に委託した。血清(0.3 ml)を逆相高速液体クロマトグラフィーカラムスイッチング法(LC-2000Plus、JASCO Corporation)(70)で分析した。前処理カラムにはWakosil GP-N6 4.6x150 mm、分析カラムにはWakosil-II 5C18 HG 4.6x250 mm(FUJIFILM Wako Pure Chemical Corporation)を使用した。ネオプテリンレベルは、蛍光検出器(FP-2025、JASCO Corporation)でその天然蛍光(励起353 nm、発光438 nm)を検出することで測定した。 |
| 2.10.統計分析 |
| in vitro サイトカイン応答アッセイでは、陰性対照サンプル(登録された 20 人の被験者のうち 14 人、表 SI)で IL-1β が検出されなかった場合、検出下限値の 0.5 倍(0.05 pg/ml)を使用して清肝排毒煎じ薬誘発性自然サイトカイン指数値を計算しました。 |
| 試験データの分析では、外れ値を識別するために四分位範囲(IQR)法が使用されました。Q1-1.5x IQRを下回る値、またはQ3 + 1.5x IQR(Q1、第1四分位、Q3、第3四分位)を上回る値は外れ値と見なされ、統計分析から除外されました(71、72)。対応のあるペアの統計的検定を実行するために、外れ値のペアの値は、外れ値ではない範囲に入っている場合でも除外されました。清肝排毒煎じ薬誘発性自然サイトカイン指数スコアを計算する際、外れ値とゼロ値は次のように処理されました。i) 外れ値を単純に除去することで清肝排毒煎じ薬誘発性自然サイトカイン指数スコアが不当に低下するのを避けるため、外れ値は、外れ値ではない値から計算された平均値に置き換えられました。 ii) IL-1βおよびIL-18の測定におけるゼロ値は、検出下限値の0.5倍の値に置き換えられた(IL-1β、0.05 pg/ml、IL-18、8.30 pg/ml)(73,74)。 |
| データの正規性は、まず正規四分位点プロットとシャピロ・ウィルク検定を使用して調べられました。これらの正規性検定の結果に基づいて、臨床試験のデータに対してはフリードマン検定が使用され、その後ネメニ事後検定が行われました。また、自然免疫細胞活性のアッセイのデータに対しては、両側対応のあるスチューデントt検定が使用されました。 |
| すべての統計解析は、R (R Foundation for Statistical Computing; https://www.R-project.org/) (75) のグラフィカルユーザーインターフェイスである EZR v1.53 (自治医科大学さいたま医療センター) を使用して実施しました。事前サンプルサイズの計算と事後検出力分析は、G*Power v3.1.9.2 (Department of Experimental Psychology, Heinrich Heine University Düsseldorf; https://www.psychologie.hhu.de/arbeitsgruppen/allgemeine-psychologie-und-arbeitspsychologie/gpower) (76) を使用して実施しました。事後検出力分析のスピアマンの順位相関係数は、EZR v1.53(75) を使用して計算しました。P<0.05 は統計的に有意差を示すと判断されました。 |
| 3.結果 |
| 3.1.清肝排毒煎じ薬誘発性自然サイトカイン指数が最も高い 乳酸菌と最も低い乳酸菌の選択 |
| まず、3 種類のプロバイオティクス 乳酸菌(L. plantarum、B. longum、L. lactis ssp. lactis) の中で、最も高い清肝排毒煎じ薬誘発性自然サイトカイン指数と最も低い清肝排毒煎じ薬誘発性自然サイトカイン指数を持つ種を、in vitro サイトカイン応答アッセイを使用して 20 人の被験者それぞれで特定しました。L. plantarum はすべての被験者の中で最も高い清肝排毒煎じ薬誘発性自然サイトカイン指数を示しましたが、B. longum は最も低い清肝排毒煎じ薬誘発性自然サイトカイン指数を示しました (表 SI)。L. plantarum の 清肝排毒煎じ薬誘発性自然サイトカイン指数 は B. longum の 52~7,210 倍 (平均 ± SD、1,350±1,870、95% CI、458~2,250) 高く、L. lactis ssp. lactis の 3~188 倍 (平均 ± SD、33±44、95% CI、12~54) 高くなりました。今回の結果から、L. plantarum には血液免疫細胞による自然サイトカイン産生を刺激する優れた清肝排毒煎じ薬様能力があることが示されました。そのため、その後の臨床試験ではすべての被験者に L. plantarum と B. longum が選択されました。 |
| 3.2.L. plantarum の摂取は、生体内で清肝排毒煎じ薬のような自然サイトカイン反応を誘発します |
| L. plantarum が、in vitro で観察された清肝排毒煎じ薬のような免疫調節活性を生体内で再現できるかどうかを調べるために、3 つの連続セッションを含む単群、二重盲検、前向き試験が実施されました。 i) 最初の 7 日間に L. plantarum を使用した検証セッション、 ii) 7 日間のウォッシュアウト期間、および iii) 最後の 7 日間に B. longum を使用したコントロール セッションです。 L. plantarum 摂取前 (0 日目) と摂取後 (8 日目)、および B. longum 摂取後 (22 日目) に採取した末梢血サンプルについて、血漿 TNF-α、IL-1β、IL-18、IL-8、IL-6、および 清肝排毒煎じ薬誘発性自然サイトカイン指数を評価しました。 |
| 表 I に示すように、L. plantarum の経口摂取により、血漿 IL-1β [中央値 (IQR)、0.000 (0.000-0.000) vs. 0.134 (0.092-0.292) pg/ml、Friedman 検定後 P=0.0000310、Nemenyi 事後検定後 P=0.00284] が有意に増加し、血漿 IL-6 [中央値 (IQR)、1.180 (0.812-2.130) vs. 0.495 (0.425-0.775) pg/ml、Friedman 検定後 P=0.0131、Nemenyi 事後検定後 P=0.0128] が減少しました。TNF-α、IL-18、IL-8 の血漿レベルには有意差はありませんでした。清肝排毒煎じ薬誘発性自然サイトカイン指数値は有意に増加しました [平均変化倍数、17 倍、中央値 (IQR)、1,760 (680-3,550) vs. 12,300 (5,440-42,200)、Friedman 検定後 P=0.0173、Nemenyi 事後検定後 P=0.0138]。清肝排毒煎じ薬誘発性自然サイトカイン指数値は 18 人中 16 人 (88.9%) で増加しましたが、変化倍数にはかなりの個人差がありました (1-128 倍、平均変化倍数、19 倍、図 2A)。これは、L. plantarum に対する反応性には個人差が大きいことを示唆しています。 |
| 対照的に、B. longum の経口摂取は、血漿 IL-1β の有意な減少を引き起こしました [中央値 (IQR)、0.134 (0.092-0.292) vs. 0.000 (0.000-0.000) pg/ml、Friedman 検定後 P=0.0000310、Nemenyi 事後検定後 P=0.000706]。ただし、煎じ薬誘発性自然サイトカイン指数値は有意に変化しませんでした [平均倍数変化、2 倍、中央値 (IQR)、12,300 (5,440-42,200) vs. 2,780 (940-9,820)、Friedman 検定後 P=0.0173、Nemenyi 事後検定後 P=0.474]。 清肝排毒煎じ薬誘発性自然サイトカイン指数値は18人中8人(44.4%)で増加したが、変化率はL. plantarumセッション中に得られた値よりも著しく低かった(1~9倍、平均変化率3倍、図2B)。今回の結果は、経口投与されたL. plantarumが、以前の実験で経口清肝排毒煎じ薬によって誘発されたものと同様の生体内サイトカイン変化を誘発することを示唆している(51)。 |
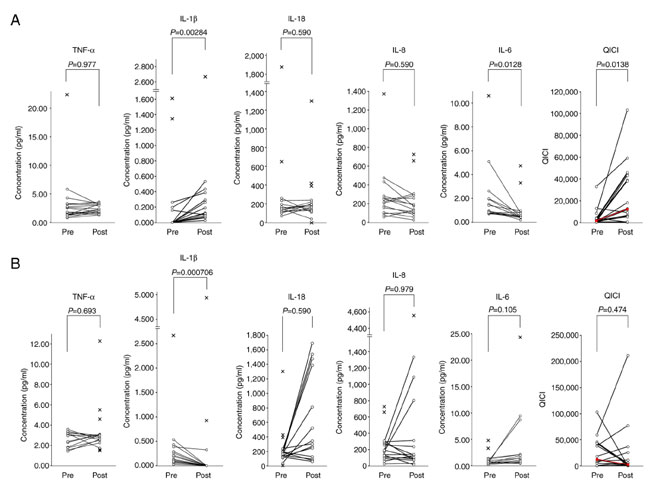 |
図 2 (A) Lactobacillus plantarum SNK12 および (B) Bifidobacterium longum BB536 の経口摂取前 (pre) および摂取後 (post) の血漿サイトカイン濃度およびQICI値の変化。 清肝排毒煎じ薬誘発性自然サイトカイン指数(QICI)は次のように定義されます: QICI=(TNF-α) x (IL-1β) x (IL-18) x (IL-8)/(IL-6)、 括弧は血漿サイトカイン濃度 (pg/ml) を表します。十字マークは外れ値を示します。各赤線は中央値の変化を表します。データは、Friedman 検定とその後の Nemenyi 事後検定を使用して統計的に分析されました。 QICI:Qingfei Paidu 煎じ薬誘発性自然サイトカイン指数。 |
 |
| L. plantarum の摂取は、平均赤血球ヘモグロビン濃度にもわずかではあるが有意な変化を引き起こした [中央値 (IQR)、33.3 (32.4-33.9) vs. 32.6 (32.1-33.1)%、Friedman 検定後の P=0.00456、Nemenyi 事後検定後の P=0.00836]。B. longum セッション中は、血液学的パラメータに有意な変化は観察されなかった。 |
| 事後両側検定の結果、試験終了後、満足のいく効果サイズ[0.845(L. plantarumセッションの清肝排毒煎じ薬誘発性自然サイトカイン指数)-1.20(B. longumセッションのIL-1β)]と統計的検出力[0.908(L. plantarumセッションのQICI)-0.996(B. longumセッションのIL-1β)]が得られたことが明らかになった。 |
| 3.3.L. plantarum 摂取による自然免疫細胞活性への影響 |
| 続いて、本研究では、L. plantarum 誘発性サイトカイン変化 (清肝排毒煎じ薬誘発性自然サイトカイン指数値の増加) が自然免疫細胞の活性増加につながるかどうかを調べた。L. plantarum 摂取は、ウイルス感染宿主細胞を直接攻撃する抗ウイルス自然免疫の重要なエフェクターである ナチュラルキラー細胞の活性を著しく高めた (表 II、図 3A) (77,78)。対照的に、B. longum 摂取は好中球の貪食活性を著しく促進した (表 II、図 3B)。血清ネオプテリン濃度で評価したところ、L. plantarum も B. longum も摂取してもマクロファージは活性化しなかった (表 II、図 3C)。本結果は、ウイルス感染に対する L. plantarum と B. longum の免疫学的利点をさらに裏付けた。 |
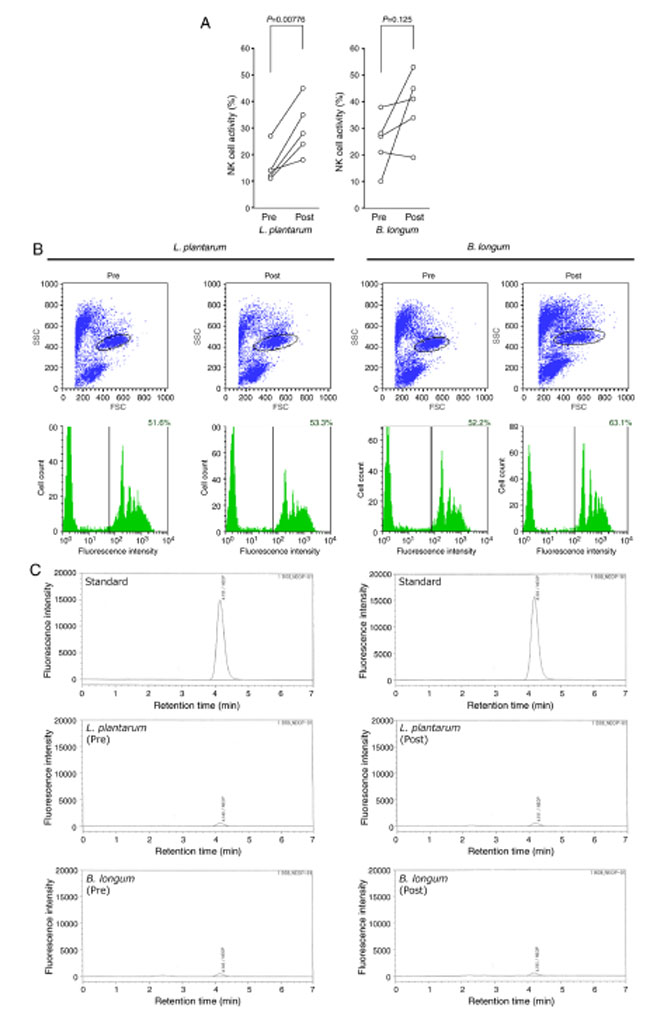 |
図 3 L. plantarum または B. longum 摂取による自然免疫細胞活性への影響。 (A) L. plantarum または B. longum 摂取前 (pre) と摂取後 (post) のナチュラルキラー細胞活性。 (B) 好中球の貪食活性。代表的なフローサイトメトリー プロットを上段に示します。縦軸と横軸はそれぞれ SSC と FSC です。黒線で囲まれた領域は、中 FSC/高 SSC として特徴付けられる顆粒球集団 (顆粒球ゲーティング) を表します。顆粒球ゲーティングによって分離された顆粒球の蛍光強度のヒストグラムを下段に示します。縦軸と横軸はそれぞれ細胞数と蛍光強度を示します。各ヒストグラムの黒い縦線は、蛍光陽性顆粒球 (蛍光マイクロビーズを貪食した顆粒球) の閾値を示します。貪食活性は、蛍光陽性顆粒球と顆粒球の総数の比として計算され、各ヒストグラムの右上隅に示されています。 (C) マクロファージ活性。単球とマクロファージの活性化マーカーであるネオプテリンの血清レベルを、逆相高性能液体クロマトグラフィーを使用して測定しました。代表的なクロマトグラムを示します。縦軸と横軸は、それぞれネオプテリンの天然蛍光の強度と保持時間を示しています。 NK:ナチュラルキラー、L. plantarum:Lactobacillus plantarum、B. longum:Bifidobacterium longum、FSC:前方散乱、SSC:側方散乱。 |
 |
| 4.考察 |
| L. plantarum は、呼吸器ウイルス、特に季節性および高病原性インフルエンザウイルスによる感染に対する宿主防御機構のいくつかの側面を強化することを示唆する多くの証拠があります。たとえば、マウスに L. plantarum を経口投与すると、肺でのウイルス複製が大幅に抑制され、気道の炎症が減少し、生存率が向上しました (33-39)。その根本的な免疫学的効果は多岐にわたることが知られており、I 型 IFN 産生の刺激 (37,39)、ナチュラルキラー細胞活性の増強 (36,39)、T ヘルパー 1 型細胞介在性免疫応答の促進 (33,34,39)、小腸および肺での IgA 依存性粘膜免疫の活性化 (34,35) などがあります。同様に、ランダム化比較試験により、L. plantarum の経口摂取により、上気道および下気道感染症のリスクが軽減され、感染患者の呼吸器症状が緩和されることが実証されています (30,79)。保護効果は、顆粒球の貪食活性の増強、血漿中の炎症性サイトカイン IFN-γ および TNF-α の減少、抗炎症性サイトカイン IL-4 および IL-10 の上昇、CD8+ T 細胞の活性化、および気管支肺胞洗浄液 (BALF) および血清中の特異的分泌型 IgA 中和抗体の誘導と関連しています (30,31)。 |
| L. plantarum の多様な免疫調節能と一致して、L. plantarum SNK12 株はインフルエンザ A ウイルス亜型 H1N1 に対する防御効果を示すことが示されています (57,58)。L. plantarum SNK12 株は、日本の長野県木曽地域で 400 年以上生産されている伝統的な無塩漬物である土着の赤カブから分離されました (80)。最近の動物実験では、インフルエンザウイルス感染前に L. plantarum SNK12 株をマウスに経口投与すると、対照マウスや抗インフルエンザ薬オセルタミビルを投与したマウスと比較して、気管支肺胞洗浄液と肺のウイルス量が抑制され、気管支肺胞洗浄液と血清中の中和抗体の力価が上昇し、気管支肺胞洗浄液と糞便中の特異的 IgA レベルが上昇することが実証されています (57,58)。 |
| 本研究では、L. plantarum SNK12 が、in vitro およびヒトの両方で評価したところ、炎症性サイトカインのサブセットをアップレギュレーションできることも明らかになりました。患者は広範囲の炎症症状を呈するため、この免疫調節効果は、インフルエンザウイルスに対する臨床的利益の可能性と矛盾する可能性があります。ただし、急性で低レベルの炎症は、宿主防御機構の初期段階の生理学的根拠であり、ウイルス感染に対する保護的役割を果たすことが実証されていることは注目に値します。Kechaou ら (32) は、IL-8 および IL-12 の産生を刺激する優れた能力を持つ炎症性 L. plantarum 株を、インフルエンザウイルス感染の前または後に経口投与すると、マウスの肺でのウイルス増殖が著しく抑制され、臨床症状が緩和されることを実証しました。さらに、Parkら(33)は、プロバイオティクスL. plantarum株をマウスに摂取させると、気管支肺胞洗浄液中のIL-12とIFN-γのレベルが上昇し、低度の炎症が誘発され、インフルエンザウイルスに対する防御効果が得られることを明らかにした。 |
| 清肝排毒煎じ薬は、COVID-19の症状に特化して最適化された21種類の伝統的な漢方薬で構成されています(43)。清肝排毒煎じ薬は、中国での臨床試験で軽度から重度の疾患の患者に満足のいく治療効果が実証されており(46-50)、COVID-19の治療薬として正式に推奨されています(43)。私たちの最近の臨床研究では、経口摂取した清肝排毒煎じ薬が、ウイルス感染に対する自然免疫応答の重要なメディエーターであるTNF-α、IL-1β、IL-18、IL-8の血中濃度を上昇させることが示されました(51)。TNF-α、IL-1β、IL-18は、樹状細胞とマクロファージの外来一本鎖RNA (ssRNA)センサーであるToll様受容体(TLR)7/TLR8とNLRファミリーピリンドメイン含有3(NLRP3)によって直接誘導されます(81-83)。これらの「最初期」サイトカインは、広範囲にわたる下流の抗ウイルス免疫カスケードを開始し、調整します(81-83)。特に、最近のメタゲノミクス研究では、COVID-19患者およびSARS-CoV-2感染に反応しない患者の上気道では、TLR7/8およびNLRP3/インフラマソームを介した炎症経路が病気の早期段階で強く抑制されていることが実証されています(84,85)。これらの知見は、抗SARS-CoV-2免疫の初期段階で活性化したTLR7/8およびNLRP3駆動型炎症経路の重要性を強調しています。私たちは、ssRNAウイルスに対するTLR7/8およびNLRP3駆動型早期自然免疫応答によって生成される血液サイトカイン環境を模倣する清肝排毒煎じ薬が、SARS-CoV-2感染の予防に有効である可能性があるという仮説を立てました(51)。本研究では、経口清肝排毒煎じ薬によって誘発されるものと同様の生来のサイトカイン変化を刺激することができるL. plantarumが、COVID-19に対する予防効果も提供する可能性があることが示唆されました。 |
| IL-6は、重症COVID-19の特徴である複雑な免疫調節異常と全身性過剰炎症において重要な役割を果たしており、IL-6の血中濃度はCOVID-19の重症度と死亡率に関連している(54-56)。IL-6とTNF-αの産生は、ssRNAウイルスに反応して、一般的なTLR7/8駆動型細胞内シグナル伝達によって直接刺激される(81-83)。しかし、今回の試験では、L. plantarumの摂取によりTNF-αの血漿濃度が有意に上昇したのに対し、IL-6の血漿濃度は低下した。この逆の効果のメカニズムは不明であるが、L. plantarumの血中IL-6を減少させる能力は、未感染者への予防的投与の指標となる可能性がある。 |
| 最近のトランスクリプトーム研究では、疲弊したナチュラルキラー細胞反応がCOVID-19の重症度と致死率を決定することが実証されています。Liuら(86)は、ナチュラルキラー細胞におけるIL-15を介した炎症の緩和が主にCOVID-19の重症度に関連していることを特定しました。Sahooら(87)による研究でも、IL-15を介したナチュラルキラー細胞の疲弊、老化、アポトーシスが重症/致死性のCOVID-19の重要な決定要因であることを強調しています。したがって、L. plantarumによるナチュラルキラー細胞の活性化は、重症または致死性のCOVID-19におけるナチュラルキラー細胞の疲弊と機能不全を改善するための補助療法として有効である可能性があります。 |
| 現在の研究の主な限界は、参加者数が少ないこと、被験者として未感染者を選んだこと、被験者の性別比が女性に偏っていることである。結論を確認し一般化を判断するには、より大規模なコホートでのさらなる臨床研究が必要である。L. plantarumの予防的日常使用の実現可能性を調べるために、採用された未感染被験者は健康であった。その結果、被験者の胸部CT画像は得られなかった。L. plantarumがCOVID-19患者の同様のサイトカイン変化を引き起こし、胸部CT所見を改善できるかどうかを明らかにするには、さらなる研究が不可欠である。中等度の生理的炎症を引き起こすことで自然免疫を強化する能力を持つプロバイオティクス株を特定するためにも、さらなる研究が必要である。さらに、B. longum を使用したコントロールセッション (15 日目~ 21 日目) では、血液サンプルは 14 日目ではなく、ベースラインとして 8 日目に採取されました。血漿中の IL-1β および IL-6 レベルは 8 日目までに L. plantarum によってアップレギュレーションまたはダウンレギュレーションされていたため、B. longum の効果がなくても 8 日目~ 22 日の間に IL-1β および IL-6 レベルが 0 日目のレベルに自然に回復した可能性を排除することはできません。同様に、L. plantarum セッションでは煎じ薬誘発性自然サイトカイン指数有意に増加しましたが (表 I、0 日目と 8 日目の比較)、B. longum セッションでは煎じ薬誘発性自然サイトカイン指数 に有意な変化は見られませんでした (8 日目と 22 日目の比較)。B. longum は、L. plantarum によってアップレギュレーションされた 煎じ薬誘発性自然サイトカイン指数値を維持しました。したがって、B. longum が in vivo で煎じ薬誘発性自然サイトカイン指数スコアにプラスの効果を及ぼした可能性も排除できません。 |
| ワクチンや治療用抗体の有効性に影響を及ぼす可能性のある関連変異を持つ新しい SARS-CoV-2 変異体の最近の出現を考慮すると、COVID-19 に対する多様な予防および治療オプションを準備する必要性が高まっています。本研究では、L. plantarum が、ウイルス感染に対する宿主防御機構の初期段階に不可欠な炎症性自然サイトカイン応答を模倣する優れた能力を示したことが示されました。プロバイオティクス L. plantarum 株を毎日摂取することは、パンデミック中に未感染者を SARS-CoV-2 感染から保護するための、かなり安全で費用対効果が高く、実行可能なオプションである可能性があります。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Exp Ther Med. 2022 Jan; 23(1): 20.に掲載されたLactobacillus plantarum induces innate cytokine responses that potentially provide a protective benefit against COVID-19: A single-arm, double-blind, prospective trial combined with an in vitro cytokine response assay. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


