ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(植物性ヨーグルト、プランタルム菌:研究の最前線) |
プロバイオティクスLactiplantibacillus plantarum KU210152とその発酵豆乳は神経芽細胞腫細胞の酸化ストレスを軽減する |
Hyun-Ji Bock et al., |
|
|
| 要約 |
Lactiplantibacillus plantarum KU210152 のプロバイオティクス特性と神経保護効果、および豆乳への応用を評価しました。L. plantarum KU210152 は、人工胃腸条件に対する高い耐性、腸細胞 (HT-29:ヒト結腸腺がん) への高い接着性、および安全な酵素産生を示しました。加熱殺菌乳酸菌で処理したヒト結腸腺がん細胞から得られた馴化培地を使用して、神経保護効果を評価しました。加熱殺菌乳酸菌は、細胞生存率アッセイ、形態学的観察、および 活性酸素種産生の抑制により神経保護効果を示しました。加熱殺菌した L. plantarum KU210152 は、腸細胞(ヒト結腸腺がん)における脳由来神経栄養因子 (BDNF) およびチロシン水酸化酵素 (TH) の発現を増加させました。 ヒト神経芽細胞腫(SH-SY5Y)細胞では、L. plantarum KU210152 加熱殺菌乳酸菌による前処理により、Bax/Bcl-2比が減少し、脳由来神経栄養因子およびチロシン水酸化酵素発現がアップレギュレーションされました。加熱殺菌乳酸菌はカスパーゼ9およびカスパーゼ3の活性を阻害しました。L. plantarum KU210152の神経保護効果は、発酵豆乳でも確認されました。したがって、L. plantarum KU210152と発酵豆乳はどちらも、酸化ストレスに対する神経保護効果を持つ機能性成分として使用できます。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 材料と方法 |
| 2.1. 細菌株と培養条件 |
| 2.2. 細胞培養条件 |
| 2.3. 人工胃液および胆汁酸塩に対する耐性 |
| 2.4. ヒト結腸腺がん細胞への接着能力 |
| 2.5. 酵素生産 |
| 2.6. 加熱殺菌した 乳酸菌馴化培地の調製 |
| 2.7. 発酵豆乳の調製 |
| 2.8. 生菌数、pH、滴定酸度 |
| 2.9. 発酵豆乳上清の調製 |
| 2.10. 乳酸菌馴化培地または発酵豆乳上清の H2O2 誘導 ヒト神経芽細胞腫細胞に対する効果 |
| 2.11. 活性酸素種生成 |
| 2.12. リアルタイムPCRを使用した相対的遺伝子発現解析 |
| 2.13. カスパーゼ-9 およびカスパーゼ-3 活性 |
| 2.14. 統計分析 |
| 3. 結果と考察 |
| 3.1. 模擬胃腸条件に対するプロバイオティクス株の耐性と ヒト結腸腺がん細胞への接着能力 |
| 3.2. 酵素生産 |
| 3.3. H2O2誘導ヒト神経芽細胞腫細胞に対する乳酸菌馴化培地の効果 |
| 3.4. 乳酸菌馴化培地が ヒト神経芽細胞腫細胞の形態変化と 活性酸素種生成に与える影響 |
| 3.5. 加熱殺菌した乳酸菌と 乳酸菌馴化培地の相対的遺伝子発現に対する影響 |
| 3.6. 乳酸菌馴化培地のカスパーゼ 9 およびカスパーゼ 3 活性への影響 |
| 3.7. 豆乳の発酵中および冷蔵保存中の pH、滴定酸度、生菌数の変化 |
| 3.8. 発酵豆乳のヒト神経芽細胞腫細胞に対する影響 |
| 3.9. 発酵豆乳がヒト神経芽細胞腫細胞の形態変化と活性酸素種産生に及ぼす影響 |
| 4. 結論 |
本文 |
| 1.はじめに |
| アルツハイマー病、パーキンソン病、ハンチントン病などの神経変性疾患は、神経系の継続的かつ不可逆的な劣化を伴います。活性酸素種レベルと抗酸化防御システムの反応との間の不均衡が酸化ストレスを引き起こします(Dasuri et al., 2013)。活性酸素種によって引き起こされる累積的な酸化ストレスはアポトーシスに関連し、神経変性疾患の発症に重要な役割を果たします(Patten et al., 2010)。過酸化水素(H2O2)は、分子状酸素を使用する正常および/または異常な代謝プロセスの副産物です。過酸化水素は、ミトコンドリア機能不全、脂質過酸化、DNA損傷を引き起こし、神経細胞でアポトーシスを誘導します(Nissanka & Moraes, 2018)。 |
| 腸-脳軸(GBA)は、消化管と脳の間の双方向シグナル伝達経路です(Cryan & O'Mahony、2011)。宿主と腸内細菌叢の相乗効果により、腸-脳軸を介して宿主の脳と行動が制御されます。さらに、腸-脳軸は、精神衛生と認知機能に関連する疾患の潜在的な治療ターゲットです(Cryan et al.、2019)。腸-脳軸に関するこれまでの研究に基づくと、腸内細菌叢は、プロバイオティクス、プレバイオティクス、抗生物質の投与、および糞便細菌叢移植によって修正できます(Yeo、2023)。これらのアプローチは、細菌叢修正能力を通じて精神衛生を強化することが示唆されています(M¨orkl et al.、2020)。いくつかの研究では、プロバイオティクス菌株が神経疾患の治療に有益であると報告されています(Ishii et al., 2021; Sharma et al., 2023)。 |
| プロバイオティクスは、「適切な量を投与すると宿主に健康上の利益をもたらす生きた微生物」と定義されています。いくつかの研究では、プロバイオティクスには抗菌、免疫調節、抗酸化、抗がんなどの有益な特性があることが報告されています (De Marco et al., 2018; Oh et al., 2018)。プロバイオティクスは、酸化ストレス、神経伝達物質レベルの低下、神経疾患を悪化させる慢性炎症など、いくつかの有害な生理学的プロセスから宿主を守ります (Westfall et al., 2017)。さらに、プロバイオティクスは、うつ病のような行動の緩和や不安の正常化など、脳機能に有益な調節効果を発揮します (Gazerani, 2019)。 |
| プロバイオティクス細菌はさまざまな発酵食品に存在し、乳製品はプロバイオティクスの主なキャリアです(Pramanik et al., 2023)。しかし、ベジタリアン代替品の需要、アレルギー性、乳糖不耐症などのいくつかの理由から、牛乳の代替品が研究されています。いくつかの代替品の中で、豆乳はプロバイオティクス株の優れた基質です(Farnworth et al., 2007)。大豆製品、特に豆乳ヨーグルトは、プロバイオティクスの潜在的な媒体として機能し、宿主に健康上の利点をもたらす可能性があります(Valero-Cases et al., 2020)。 |
| 豆乳にはイソフラボンやサポニンなどの生理活性化合物が含まれており、乳糖やコレステロールは含まれていません (Rui et al., 2019)。大豆に含まれるイソフラボンは、骨粗鬆症、更年期障害、心血管疾患、がんの治療に有益な効果があることが研究されています (Omoni & Aluko, 2005)。乳酸菌は、イソフラボンのグルコシド型をイソフラボンアグリコンに発酵します。これらの大豆イソフラボンアグリコンは、グルコシド型よりも吸収されやすい (Choi et al., 2022)。 |
| 本研究では、Lactiplantibacillus plantarum KU210152 のプロバイオティクス特性と神経保護効果を調査しました。菌株のプロバイオティクス特性は、人工消化条件に対する耐性、腸管接着能力、酵素産生を調べることで評価しました。神経保護効果は、神経バイオマーカーとアポトーシス因子のレベルを測定することで評価しました。さらに、プロバイオティクス菌株 L. plantarum KU210152 を発酵豆乳に添加し、処理した発酵豆乳の神経保護効果を評価しました。 |
| 2. 材料と方法 |
| 2.1. 細菌株と培養条件 |
| Lactiplantibacillus plantarum KU210152 はキムチサンプルから分離されました。Streptococcus thermophilus P206 は ABT-B 市販ヨーグルトスターターカルチャーから分離されました。Lacticaseibacillus rhamnosus GG(LGG) は韓国のタイプカルチャーコレクション(KCTC、Daejeon, Korea)から入手し、参照株として使用しました。 L. plantarum KU210152 と Lacticaseibacillus rhamnosus GGは de Man、Rogosa、Sharpe ブロス (MRS、Difco Laboratories、Detroit, MI, USA) で 37 ◦C で 24 時間培養されました。 Streptococcus thermophilus P206 は市販のヨーグルトから分離され、この菌株は MRS ブロスで 37 ◦C で 18 時間培養されました。細菌サンプルは 14,240 × g で 4 ◦C で 5 分間遠心分離して調製し、ペレットを 3 回洗浄してリン酸緩衝生理食塩水 (PBS、HyClone Laboratories、Logan、UT、USA) に再懸濁しました (Cheon et al.、2020)。加熱殺菌細胞は細菌細胞を水浴で 80 ◦C で 30 分間加熱して調製し、プレートカウント法で殺菌細胞を確認しました。 |
| 2.2. 細胞培養条件 |
| ヒト結腸腺がん(HT-29、KCLB 30038)細胞は、ロズウェルパーク記念研究所(RPMI、HyClone)1640培地で培養しました。ヒト神経芽細胞腫(ATCC CRL-2266)細胞は、ダルベッコ改変イーグル培地(DMEM、HyClone)で培養しました。各培地には、10%ウシ胎児生理食塩水(FBS、HyClone)と1%ペニシリン(HyClone)溶液が含まれていました。細胞は、5%CO2環境で37℃で培養されました。 |
| 2.3. 人工胃液および胆汁酸塩に対する耐性 |
| 細菌株の胃腸条件に対する耐性は、Song et al. (2020) の記述に従って、若干の修正を加えて評価しました。 人工胃腸条件は、それぞれ、1) 0.3% ペプシン (Sigma-Aldrich、St. Louis, MO, USA) (w/v) を含む MRS ブロス (pH 2.5) と 2) 0.3% 豚胆汁抽出物 (Sigma-Aldrich) (w/v) を含む MRS ブロスを使用してシミュレートしました。前培養した 乳酸菌株 (1 × 108 コロニー形成単位 (CFU)/mL) を各タイプの MRS ブロスに接種し、37 ◦C で 3 時間および 24 時間培養しました。細菌株の生存率は次の式を使用して決定されました。 |
| 生存率(%)=Nt/Ni×100 |
| ここで、Nt と Ni はそれぞれ、処理後の生存細菌細胞数 (log CFU/mL) と初期細胞数 (log CFU/mL) を示します。 |
| 2.4. ヒト結腸腺がん細胞への接着能力 |
| 乳酸菌株の接着能力は、Son ら (2018) が説明した方法に若干の修正を加えて腸細胞を使用して評価しました。ヒト結腸腺がん細胞を 24 ウェル プレートに播種し (1 × 105 細胞/mL)、24 時間培養しました。次に、培地を抗生物質を含まない培地に交換し、1 × 108 CFU/mL 乳酸菌を細胞に加えました。2 時間培養した後、付着していない細菌細胞を リン酸緩衝生理食塩水 で 3 回洗浄し、付着した細胞を 1 % Triton X-100 (Sigma-Aldrich) を使用して ヒト結腸腺がん細胞から剥離しました。細菌を MRS 寒天培地上で計数し、次の式を使用して接着能力を決定しました。 |
| 接着能力(%)=Na/Ni×100 |
| ここで、Na と Ni はそれぞれ付着した細菌細胞の数 (CFU/mL) と初期細胞数 (CFU/mL) を示します。 |
| 2.5. 酵素生産 |
| 乳酸菌株による酵素生産は、API ZYM キット (bioM´erieux、Marcy-l'´Etoile、France) を使用して評価しました。生菌細胞 (65 μL) をカップルに加え、37 ◦C で 4 時間インキュベートしました。ZYM A および ZYM B 試薬で 5 分間インキュベートした後、色の濃さに基づいて酵素生産を推定しました。 |
| 2.6. 加熱殺菌した 乳酸菌馴化培地の調製 |
| 神経保護効果を調べるために、Cheon et al. (2020) の方法で乳酸菌馴化培地 (CM)を製造しました。ヒト結腸腺がん細胞を 6 ウェルプレート (5 × 105 細胞/mL) に播種し、単層が形成されるまでインキュベートしました。熱不活化乳酸菌(1 × 109 CFU/mL) を単層に加えて 乳酸菌馴化培地を調製し、細胞をリン酸緩衝生理食塩水で処理してコントロール馴化培地を調製しました。ヒト結腸腺がん細胞を 24 時間処理した後、14,000 × g、4 ◦C で 10 分間遠心分離して上清を収集しました。次に、上清を 0.45 μm フィルターを使用してろ過しました。コントロール馴化培地と乳酸菌馴化培地は両方とも、さらなる実験のために –80 ◦C で保存しました。 |
| 2.7. 発酵豆乳の調製 |
| 豆乳(Maeil Dairies Co.、Seoul, Korea)を90 ◦Cで10分間殺菌し、42 ◦Cに冷却しました。次に、殺菌した豆乳を3等分し、各サンプルに前培養したS. thermophilus P206懸濁液を1 %(v/v)加えました。発酵豆乳サンプルの調製では、3つのサンプルのうち2つに1 %(v/v)Lacticaseibacillus rhamnosus GGおよびL. plantarum KU210152カルチャーを(別々に)接種し、3つの豆乳サンプルをpHが4.5に達するまで42 ◦Cで発酵させました。酸性化後の生細胞数を測定するために、発酵豆乳サンプルを冷蔵庫で4 ◦Cで21日間保存しました。 3 種類の異なる発酵豆乳サンプルを準備し、次のようにラベル付けしました。 CY:S. thermophilus P206 で発酵させた対照発酵豆乳、GY:S. thermophilus P206 と Lacticaseibacillus rhamnosus GGで発酵させた発酵豆乳、PY:S. thermophilus P206 と L. plantarum KU210152 で発酵させた発酵豆乳。 |
| 2.8. 生菌数、pH、滴定酸度 |
| 生菌数は、Song et al.(2021)の記載に従って、豆乳発酵中および21日間保存後のMRS寒天培地上のコロニー数を数えることによって測定しました。pHはpHメーター(WTW、ドイツ、ヴァイハイム)を使用して測定しました。発酵豆乳サンプルの滴定酸度を測定するために、各サンプル10gを10mLの蒸留水と混合し、pHが8.3に上昇するまで0.1N NaOHで滴定しました。滴定酸度は次の式を使用して計算しました。 |
| 滴定酸度(%)=N/S×0.009×100 |
| ここで、N、S、0.009はそれぞれ、0.1N NaOHの添加量(mL)、サンプル重量(g)、乳酸の換算係数を示します。 |
| 2.9. 発酵豆乳上清の調製 |
| 発酵豆乳上清は、Song et al. (2021) の方法に若干の変更を加えて調製した。 発酵豆乳サンプル (10 g) を滅菌蒸留水 (2.5 mL) と混合し、均質化した。混合物を 4 ◦C で 5 分間 14,240 × g で遠心分離した。上清の pH を 1 M NaOH を使用して 7.0 に調整し、上記と同じ条件で遠心分離した。収集した上清を 0.45 μm フィルターでろ過し、発酵豆乳上清を -20 ◦C で保存した。 |
| 2.10. 乳酸菌馴化培地または発酵豆乳上清の H2O2 誘導 ヒト神経芽細胞腫細胞に対する効果 |
| Cheon ら (2020) の方法に従って、乳酸菌馴化培地または発酵豆乳上清の効果を評価するために MTT アッセイを実施した。ヒト神経芽細胞腫細胞を 96 ウェルプレート (1 × 106 細胞/mL) に播種し、24 時間インキュベートした。乳酸菌馴化培地または発酵豆乳上清で 4 時間前処理した後、細胞を H2O2 で 20 時間インキュベートした。培地を捨て、3-(4, 5-ジメチルチアゾール-2-イル)-2, 5-ジフェニルテトラゾリウム臭化物 (MTT) 溶液 (5 mg/mL) を加えた。次に、反応した MTT 溶液を取り除き、ジメチルスルホキシド (DMSO) を加えました。溶液の吸光度を 570 nm で測定しました。細胞生存率は次の式を使用して決定しました。 |
| 細胞生存率(%)=As/Ac×100 |
| ここで、As と Ac はそれぞれサンプルとコントロールで処理された細胞の吸光度を表します。 |
| 乳酸菌馴化培地または発酵豆乳上清の効果は、ヒト神経芽細胞腫細胞の形態変化を観察することによっても評価されました。細胞は、上記と同じ条件下で 乳酸菌馴化培地または発酵豆乳上清と H2O2 で処理され、Nikon Eclipse Ti2-U 蛍光顕微鏡 (Nikon Co., Ltd., Tokyo, Japan) と DS-Ri2 デジタルカメラ (Nikon Co., Ltd.,) を使用して観察されました。 |
| 2.11. 活性酸素種生成 |
| ヒト神経芽細胞腫 細胞を 12 ウェル プレートに播種し (1 × 106 細胞/mL)、発酵豆乳上清で 4 時間、H2O2 で 20 時間処理しました。細胞を リン酸緩衝生理食塩水で洗浄し、2′,7′-ジクロロジヒドロフルオレセイン ジアセテート (DCFH-DA) (Sigma-Aldrich) を加えました。37 ◦C で 30 分間インキュベートした後、細胞を再度リン酸緩衝生理食塩水で洗浄し、Nikon Eclipse Ti2-U 蛍光顕微鏡 (Nikon Co., Ltd.,) を使用して観察し、DS-Ri2 デジタル カメラ (Nikon Co., Ltd.,) を使用して画像を撮影しました。これらの画像は、ImageJ ソフトウェア (National Institutes of Health, Bethesda, MD, USA) を使用して分析しました。 |
| 2.12. リアルタイムPCRを使用した相対的遺伝子発現解析 |
| アポトーシス関連遺伝子および神経細胞バイオマーカーの発現を決定するために、ヒト結腸腺がんおよびヒト神経芽細胞腫細胞から抽出したRNAを使用してリアルタイムPCR(RT-PCR)を実施しました。ヒト結腸腺がん細胞は、単層が形成されるまで6ウェルプレート(5×105細胞/mL)で培養し、加熱殺菌した乳酸菌で24時間処理しました。ヒト神経芽細胞腫細胞は、6ウェルプレート(1×106細胞/mL)に播種し、サンプルで処理しました。4時間後、細胞をH2O2で3時間処理しました。総RNAは、RNeasy® Miniキット(Qiagen、Hilden, Germany)を使用して抽出し、単離したRNAは、cDNA合成キット(Thermo-Fisher Scientific、Waltham, MA, USA)を使用してcDNAに逆転写しました。アポトーシス関連遺伝子(Bcl-2関連Xタンパク質、Bax、B細胞リンパ腫2、Bcl-2)および神経バイオマーカー(脳由来神経栄養因子、チロシンヒドロキシラーゼ)の発現は、SYBR Green PCRマスターミックスを使用したリアルタイムPCRによって評価されました。グリセルアルデヒド-3-リン酸デヒドロゲナーゼ(GAPDH)をハウスキーピング遺伝子として使用し、遺伝子発現は2-ΔΔCt法を使用して分析しました。プライマー配列は表S1(Bock et al.、2023)に記載されています。 |
| 2.13. カスパーゼ-9 およびカスパーゼ-3 活性 |
| ヒト神経芽細胞腫細胞におけるカスパーゼ-9 およびカスパーゼ-3 の活性は、それぞれカスパーゼ-9 アッセイ キット (比色法) およびカスパーゼ-3 アッセイ キット (比色法) (Abcam、Cambridge, UK) を使用して測定しました。細胞は 6 ウェル プレート (1 × 106 細胞/mL) に播種し、サンプルで 4 時間、H2O2 で 6 時間処理しました。製造元の指示に従って、100 μg のタンパク質を含む細胞溶解物を、10 mM DTT (ジチオトレイトール) を含む 2 × 反応バッファー 50 μL と等量で混合しました。次に、カスパーゼ-9活性を評価するためにLEHD-ρ-NA基質(4 mM)5 μLを添加し、カスパーゼ-3活性を評価するためにDEVD-ρ-NA基質(4 mM)5 μLを添加した。37 ◦Cで2時間インキュベートした後、400 nmで吸光度を測定した。 |
| 2.14. 統計分析 |
| すべての実験結果は 3 回繰り返して取得され、平均 ± 標準偏差として提示されています。有意差を確認するために、ダンカンの多重範囲検定とスチューデントの t 検定による一元配置分散分析 (ANOVA) を使用しました。値は P < 0.05 で有意とみなされ、すべてのデータは SPSS (IBM、ニューヨーク州アーモンク、米国) を使用して分析されました。 |
| 3. 結果と考察 |
| 3.1. 模擬胃腸条件に対するプロバイオティクス株の耐性とヒト結腸腺がん細胞への接着能力 |
| プロバイオティクスとして応用するには、乳酸菌株は胃酸と胆汁酸塩に耐性でなければなりません (Son et al., 2018)。表 1 は、乳酸菌株の胃酸と胆汁酸塩に対する耐性能力を示しています。酸性胃条件下では、Lacticaseibacillus rhamnosus GG細胞と L. plantarum KU210152 細胞の生存率はそれぞれ 98.67 % と 100.12 % でした。Lacticaseibacillus rhamnosus GG細胞と L. plantarum KU210152 は、それぞれ 94.99 % と 96.68 % という高い胆汁酸塩耐性を示しました。これらの結果は、両方の乳酸菌株が胃腸条件下で生存できることを示しました。 |
| プロバイオティクス微生物にとって、腸管上皮細胞への接着能力は重要な基準です(Alp&Kuleas¸an、2019)。L. plantarum KU210152は、Lacticaseibacillus rhamnosus GG細胞(1.71 %)よりもヒト結腸腺がん細胞(5.58 %)への接着性が高かった(表1)。したがって、L. plantarum KU210152は、潜在的なプロバイオティクス株として使用できる可能性があります。 |
| 表 1 本研究で使用した乳酸菌のプロバイオティクス特性 |
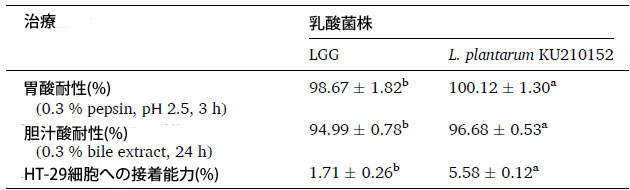 |
| データは、3 回の実験の平均 ± 標準偏差として示されています。同じ実験の異なる菌株では、異なる上付き文字 (a、b) の平均値に有意差がありました (P < 0.05、Student t 検定)。LGG:Lacticaseibacillus rhamnosus GG、L. plantarum:Lactiplantibacillus plantarum、HT-29 cell:ヒト結腸腺がん細胞 |
| 3.2. 酵素生産 |
| 乳酸菌による酵素生産を調査し、その潜在的な副作用と利点を明らかにしました (表 S2)。β-グルクロニダーゼは発がん性物質に関連する有害な酵素です (´Sli˙ zewska et al., 2020)。ただし、Lacticaseibacillus rhamnosus GGと L. plantarum KU210152 は β-グルクロニダーゼを生成しませんでした (表 S2)。 グリコシド結合を加水分解する β-グルコシダーゼは、豆乳発酵中のイソフラボンの吸収とバイオアベイラビリティの向上に重要です (Rekha & Vijayalakshmi, 2011)。 β-ガラクトシダーゼはラクトースをグルコースとガラクトースに加水分解し、ラクトース不耐症の症状を緩和することができます(Son et al., 2018)。本研究では、両方の乳酸菌株が大量のβ-ガラクトシダーゼとβ-グルコシダーゼを生産しました。したがって、L. plantarum KU210152はプロバイオティクスとして安全に使用でき、発酵豆乳や乳製品に含まれることは消費者にとって有益です。 |
| 3.3. H2O2誘導ヒト神経芽細胞腫細胞に対する乳酸菌馴化培地の効果 |
| 生細胞は細胞毒性が強いため使用できなかったため、神経保護効果の評価には馴化培地を使用しました。乳酸菌馴化培地の保護効果はMTTアッセイを使用して評価しました。神経保護効果を特定する前に、加熱殺菌乳酸菌の細胞毒性を評価しました。 Lacticaseibacillus rhamnosus GG馴化培地とL. plantarum KU210152 馴化培地の両方のグループで、細胞生存率は100%を超えました(図1A)。細胞生存率は、ヒト神経芽細胞腫細胞をさまざまな濃度のH2O2(0~300μM、図1B)にさらすことによって測定しました。150μM H2O2では、細胞生存率は50.92%でした。したがって、乳酸菌馴化培地実験には150μM H2O2を使用しました。 H2O2(150 μM)への曝露により細胞生存率は52.85 %に大幅に減少しましたが、Lacticaseibacillus rhamnosus GG馴化培地とL. plantarum KU210152 馴化培地による前処理により、細胞死はそれぞれ58.75 %と73.38 %減少しました(図1C)。L. plantarum KU210152 馴化培地は、H2O2処理群と比較して細胞生存率を著しく増加させました。 |
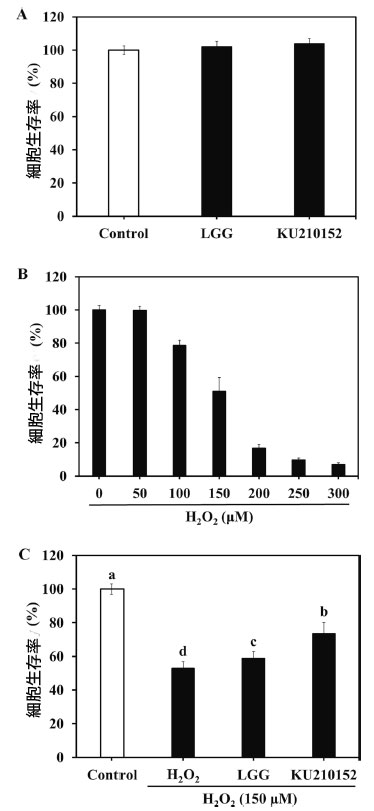 |
図 1. 乳酸菌馴化培地の ヒト神経芽細胞腫細胞に対する神経保護効果。 (A) 乳酸菌馴化培地のヒト神経芽細胞腫細胞に対する効果、 (B) H2O2 の ヒト神経芽細胞腫細胞に対する効果、 (C) H2O2 処理した ヒト神経芽細胞腫細胞に対する 乳酸菌馴化培地の効果。 LGG:加熱殺菌した Lactaseibacillus rhamnosus GG (LGG) の馴化培地、KU210152:加熱殺菌した Lactiplantibacillus plantarum KU210152 の馴化培地。 データは 3 回の実験の平均 ± 標準偏差として示されています。エラー バー上の異なる文字は有意差 (P < 0.05) を示します。 |
| 3.4. 乳酸菌馴化培地が ヒト神経芽細胞腫細胞の形態変化と 活性酸素種生成に与える影響 |
| アポトーシス細胞死には、細胞の収縮、膜のブレブ形成、核の凝縮、アポトーシス細胞体などの形態変化が伴います (Hollville & Martin, 2016)。図 2A は、H2O2 と 乳酸菌馴化培地で処理した後の ヒト神経芽細胞腫細胞の形態変化を示しています。 H2O2 で処理した細胞では、神経突起の消失、細胞の収縮、凝集が見られました。しかし、L. plantarum KU210152 馴化培地 は、H2O2 のみで処理したグループと比較して、細胞損傷を防ぎ、細胞内の神経突起が無傷であることを示しました。 |
| 2′,7′-ジクロロジヒドロフルオレセインジアセテート(DCFH-DA)法を使用して、H2O2誘導ヒト神経芽細胞腫細胞における活性酸素種生成を測定しました。 非蛍光化合物である2′,7′-ジクロロジヒドロフルオレセインジアセテートは、細胞内エステラーゼによって非蛍光2′,7′-ジクロロジヒドロフルオレセインに加水分解されます。2′,7′-ジクロロジヒドロフルオレセインは蛍光ジクロロフルオレセイン(DCF)に酸化されます(Mehri et al., 2012)。図2Bに示すように、細胞をH2O2にさらすと、活性酸素種生成が著しく誘導されました。しかし、L.plantarum KU210152 馴化培地で前処理すると、活性酸素種生成が著しく阻害されました。これは、L. plantarum KU210152が活性酸素種生成を抑制することで神経保護効果を発揮することを示唆しています。 |
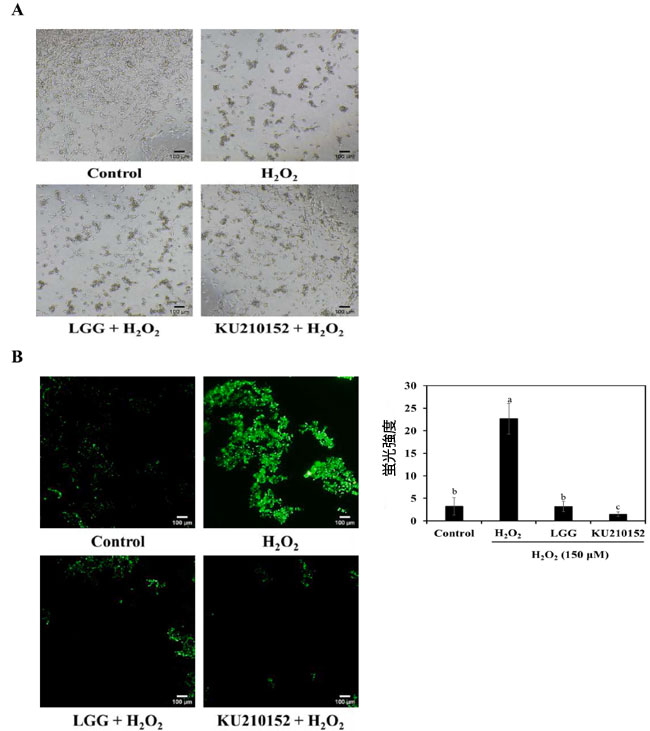 |
図 2. 乳酸菌馴化培地の ヒト神経芽細胞腫細胞に対する効果。 (A) 形態変化、(B) 活性酸素種 (ROS) 生成。 LGG:加熱殺菌した Lactaseibacillus rhamnosus GGの馴化培地、 KU210152:加熱殺菌した Lactiplantibacillus plantarum KU210152 の馴化培地。 白と黒のスケール バーは、倍率 40 倍で 100 μm を示します。グラフは、imageJ を使用して 活性酸素種の蛍光強度を表しています。データは平均 ± 標準偏差として示されています。 |
| 3.5. 加熱殺菌した乳酸菌と 乳酸菌馴化培地の相対的遺伝子発現に対する影響 |
| 成長因子のニューロトロフィンファミリーのメンバーである脳由来神経栄養因子は、ニューロンの生存、分化、シナプス可塑性を調節します (Binder & Scharfman, 2004)。脳由来神経栄養因子は、筋萎縮性側索硬化症、パーキンソン病、アルツハイマー病などの神経変性疾患の治療に効果があります (Cheon et al., 2020)。チロシン水酸化酵素は、チロシンの L-DOPA へのヒドロキシル化を触媒する重要な酵素です (Wang et al., 2002)。 チロシン水酸化酵素は、黒質のドーパミン作動性ニューロンの喪失を抑制します (Wang et al., 2002)。 |
| 成長因子のニューロトロフィンファミリーのメンバーである脳由来神経栄養因子は、ニューロンの生存、分化、シナプス可塑性を調節します (Binder & Scharfman, 2004)。脳由来神経栄養因子は、筋萎縮性側索硬化症、パーキンソン病、アルツハイマー病などの神経変性疾患の治療に効果があります (Cheon et al., 2020)。チロシン水酸化酵素は、チロシンの L-DOPA へのヒドロキシル化を触媒する重要な酵素です (Wang et al., 2002)。 チロシン水酸化酵素は、黒質のドーパミン作動性ニューロンの喪失を抑制します (Wang et al., 2002)。 |
| 抗アポトーシス因子である Bcl-2 はミトコンドリア外膜に存在し、シトクロム C の放出を阻害します (Borner、2003)。プロアポトーシス因子である Bax は細胞質に存在します。Bax がミトコンドリア膜に移行すると、ミトコンドリア膜の透過性が高まります。最終的に、シトクロム C の分泌とカスパーゼ カスケードの活性化が起こり、アポトーシスが誘導されます (Leist & J¨a¨attel¨a、2001)。アポトーシスを評価するには、個々の遺伝子の発現を比較するよりも、Bax/Bcl-2 比の方が適しています (Raisova ら、2001)。 |
| H2O2のみで処理した細胞では、未処理群と比較して、Bax/Bcl-2比が1.83倍増加したことが観察されました(図3B)。しかし、L. plantarum KU210152 馴化培地で前処理すると、この比は0.91倍減少し、Lactaseibacillus rhamnosus GG 馴化培地で観察された効果(0.95倍)と類似しています。 |
| H2O2 処理した細胞では、脳由来神経栄養因子と チロシン水酸化酵素の発現が減少しました (図 3C)。Lactaseibacillus rhamnosus GG 馴化培地または L. plantarum KU210152 馴化培地で処理すると、脳由来神経栄養因子の発現がそれぞれ 1.36 倍と 1.93 倍増加しました。さらに、Lactaseibacillus rhamnosus GG 馴化培地と L. plantarum KU210152 馴化培地は、チロシン水酸化酵素の発現をそれぞれ 1.42 倍と 3.25 倍にアップレギュレーションしました。脳由来神経栄養因子とチロシン水酸化酵素の発現の増加は、Lactaseibacillus rhamnosus GG 馴化培地よりも L. plantarum KU210152 馴化培地の方が高かったです。L. plantarum KU210152 は、アポトーシス関連遺伝子の発現を減少させ、ニューロン バイオマーカーの発現を増加させることで、顕著な神経保護効果を発揮します。 |
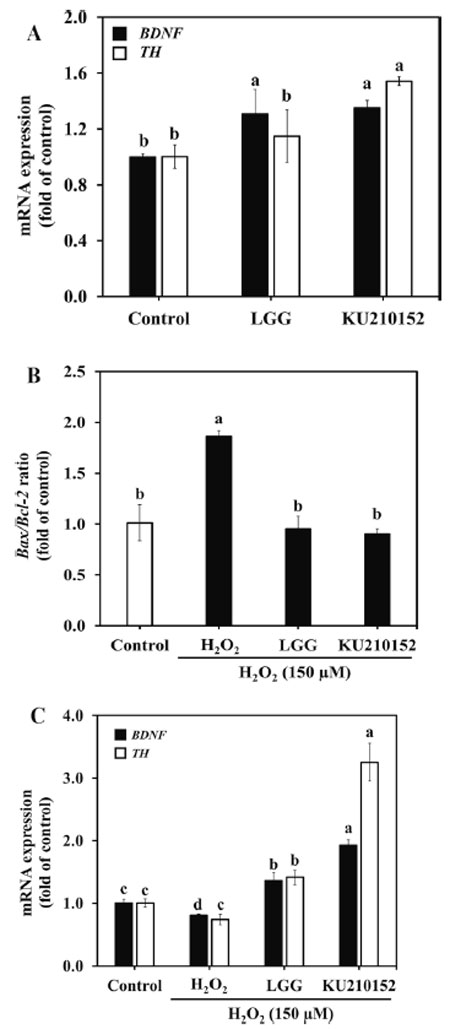 |
図 3. ヒト結腸腺がん細胞およびヒト神経芽細胞腫細胞における神経バイオマーカーおよびアポトーシス関連遺伝子の mRNA 発現。 (A) ヒト結腸腺がん細胞における 脳由来神経栄養因子および チロシン水酸化酵素発現。 (B) ヒト神経芽細胞腫細胞における Bax/Bcl-2 比。 (C)ヒト神経芽細胞腫細胞における 脳由来神経栄養因子および チロシン水酸化酵素発現。 LGG:加熱殺菌した Lactaseibacillus rhamnosusGG の馴化培地 KU210152:加熱殺菌した Lactiplantibacillus plantarumKU210152 の馴化培地。 データは 3 回の実験の平均 ± 標準偏差として示されています。エラー バー上の異なる文字は有意差 (P< 0.05) を示します。 BDNF:脳由来神経栄養因子。 TH:チロシン水酸化酵素。Bax:Bcl-2 関連 X タンパク質。 Bcl-2:B細胞リンパ腫2。 |
| 3.6. 乳酸菌馴化培地のカスパーゼ 9 およびカスパーゼ 3 活性への影響 |
| シトクロム C の放出により、アポトーシス プロテアーゼ活性化因子 1 に結合してアポトーシス複合体の形成が誘導され、カスパーゼ 9 が活性化されます。活性化されたカスパーゼ 9 はカスパーゼ 3 およびカスパーゼ 3 を活性化し、DNA の断片化、分解、アポトーシスを引き起こします (Vodovotz ら、2004)。 |
| 図4Aでは、H2O2への曝露により、対照群と比較してカスパーゼ9活性が156.26%増加しました。しかし、Lactaseibacillus rhamnosusGG 馴化培地とL. plantarum KU210152 馴化培地は、酵素活性をそれぞれ101.74%と92.37%改善しました。カスパーゼ3活性もL. plantarum KU210152 馴化培地処理後に減少しました。H2O2処理した細胞では酵素活性が173.37%増加しました(図4B)。Lactaseibacillus rhamnosus GG 馴化培地またはL. plantarum KU210152 馴化培地で前処理した後、酵素活性はそれぞれ116.86%と99.55%減少しました。これらの結果は、L. plantarum KU210152 馴化培地がカスパーゼ 9 およびカスパーゼ 3 の活性を阻害することでヒト神経芽細胞腫細胞のアポトーシスを防ぐことができることを示しています。 |
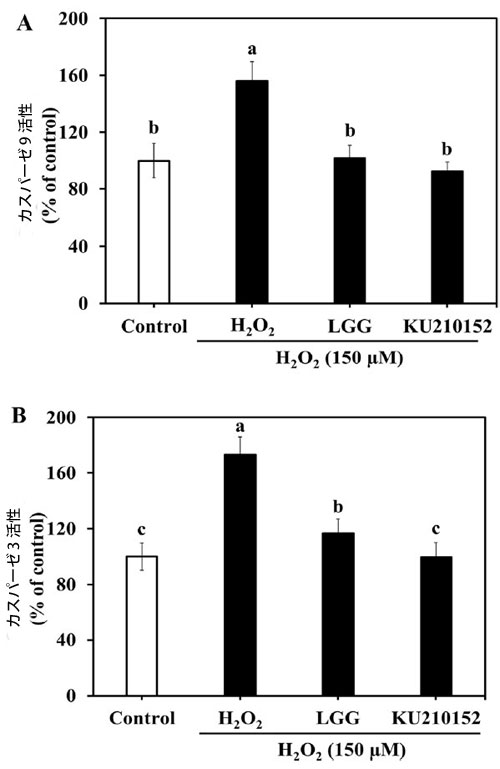 |
図 4. ヒト神経芽細胞腫細胞におけるカスパーゼ 9 およびカスパーゼ 3 の活性に対する乳酸菌馴化培地の効果。 (A) カスパーゼ 9 活性、(B) カスパーゼ 3 活性。 LGG:加熱殺菌した Lactaseibacillus rhamnosus GG (LGG) の 馴化培地、KU210152:加熱殺菌した Lactiplantibacillus plantarum KU210152 の 馴化培地。 データは、3 回の実験の平均 ± 標準偏差として示されています。 エラー バー上の異なる文字は、有意差 (P < 0.05) を示します。 |
| 3.7. 豆乳の発酵中および冷蔵保存中の pH、滴定酸度、生菌数の変化 |
| 発酵中の 3 種類の発酵豆乳サンプルの pH、滴定酸度、生菌数の変化を図 5A~C に示します。3 つのサンプルの初期 pH は約 6.7 でした。3 つのサンプルすべてにおいて、発酵の 6 時間の間に pH は徐々に低下しました。CY、GY、PY サンプルの最終 pH 値はそれぞれ 4.6、4.4、4.5 でした。さらに、3 つのサンプルすべてにおいて 滴定酸度の値は徐々に増加しました。GY サンプルは 0.10 % から 0.60 % と最も大きな変化を示し、これに PY サンプル (0.10 %~0.50 %) が続き、CY サンプルは 0.10 %~0.47 % と最も低い増加を示しました。生菌細胞の総数は徐々に増加しました。3 つのサンプルでは、初期の生菌数は 7.22~7.54 log CFU/mL で、最終細胞数は 8.87~9.00 log CFU/mL でした。 |
| 21日間の冷蔵保存中、pH、滴定酸度、生乳酸菌を毎週測定した(図5D~F)。CY、GY、PYサンプルは21日後もpHと滴定酸度の値は一定であった。しかし、発酵豆乳サンプル3つすべてにおいて、生菌細胞の総数はわずかに減少した。21日間の保存後、CYサンプルの生乳酸菌数は8.80 log CFU/mLから8.45 log CFU/mLに減少し、GYサンプルの生乳酸菌数は8.92 log CFU/mLから8.24 log CFU/mLに減少した。PYサンプルの生乳酸菌数の変化は8.62 log CFU/mLから7.96 log CFU/mLの範囲であった。3つのタイプのうち、CYタイプは最も減少が少なかった。 GY および PY サンプルの減少は、保管中にも同様でした。生菌数の減少は、発酵豆乳の栄養濃度に依存します (Choi et al.、2022)。 |
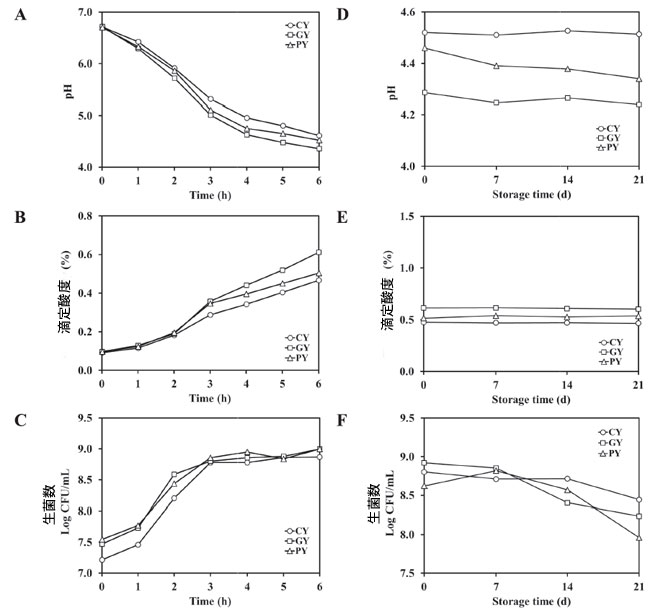 |
図 5. 発酵中 (A–C) および冷蔵保存中 (D–F) の発酵豆乳サンプルの pH、滴定酸度 (TA)、生細胞数の変化。 CY:Streptococcus thermophilus P206 で発酵させた豆乳。 GY:Lactaseibacillus rhamnosus GG と S. thermophilus P206 で発酵させた豆乳。 PY:Lactiplantibacillus plantarum KU210152 と S. thermophilus P206 で発酵させた豆乳。 |
| 3.8. 発酵豆乳のヒト神経芽細胞腫細胞に対する影響 |
| 発酵豆乳上清の細胞毒性を 3 つの異なる濃度 (1、1/2、1/4 希釈) で測定した。MTT アッセイでは、3 つの発酵豆乳上清の 1 希釈サンプルの細胞生存率は 40 % 未満であることが明らかになった (図 6A)。3 種類の 1/2 および 1/4 希釈発酵豆乳上清は、約 100 % の生存率を示した。細胞生存率は、さまざまな濃度の H2O2 (0 ~ 300 μM) に曝露した後、用量依存的に徐々に減少した (図 6B)。200 μM H2O2 で処理すると、細胞生存率は 48.32 % になった。そのため、1/2 および 1/4 に希釈した発酵豆乳上清と 200 μM H2O2 をその後の発酵豆乳実験に使用しました。H2O2で処理した細胞は 45.68 % の生存率を示しました (図 6C)。1/2 および 1/4 に希釈した PY サンプルは両方とも、細胞生存率をそれぞれ 57.38 % と 63.57 % 改善しました。GY サンプルも 1/4 希釈濃度で H2O2 処理群よりも高い細胞生存率 (55.59 %) を示しましたが、その値は PY よりも低かった。 |
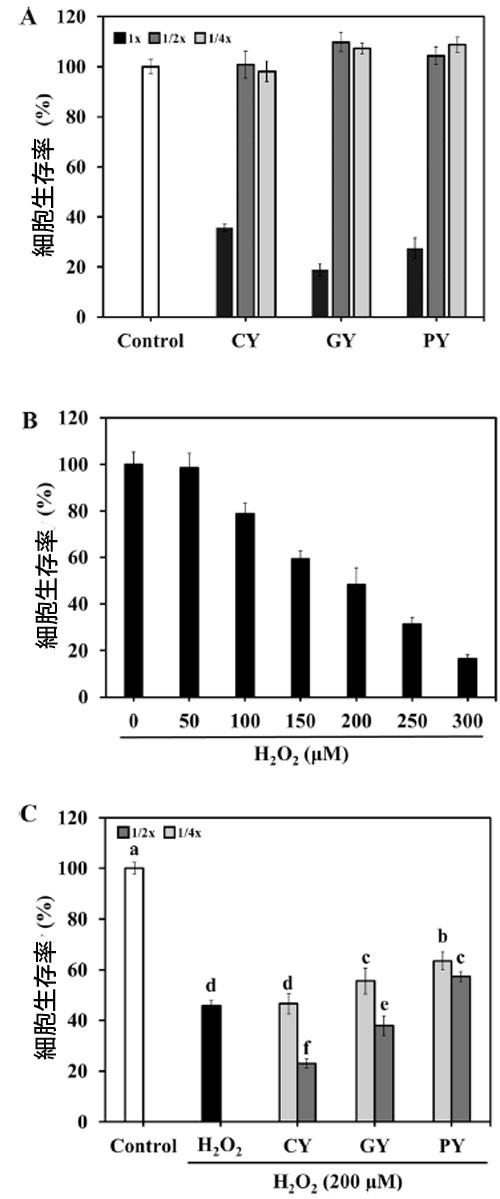 |
図 6. 発酵豆乳サンプルのヒト神経芽細胞腫細胞に対する神経保護効果。 (A) 発酵豆乳の ヒト神経芽細胞腫細胞に対する効果、 (B) H2O2 の ヒト神経芽細胞腫細胞に対する効果、 (C) 発酵豆乳サンプルの H2O2 誘導ヒト神経芽細胞腫細胞に対する効果。 CY:Streptococcus thermophilus P206 で発酵させた豆乳、 GY:Lactaseibacillus rhamnosus GGと S. thermophilus P206 で発酵させた豆乳、 PY:Lactiplantibacillus plantarum KU210152 と S. thermophilus P206 で発酵させた豆乳。 データは 3 回の実験の平均 ± 標準偏差として示されています。エラー バーの異なる文字は、有意差 (P < 0.05) を示します。 |
| 3.9. 発酵豆乳がヒト神経芽細胞腫細胞の形態変化と活性酸素種産生に及ぼす影響 |
| PYサンプルの保護効果は、ヒト神経芽細胞腫細胞の形態変化に基づいて特定されました(図7A)。H2O2処理により、神経突起の消失と細胞の収縮が見られました。PY(1/4希釈)による前処理により、細胞損傷が緩和されました。PY(1/4希釈)で処理した細胞では、正常な神経突起と収縮の減少が見られました。これらの結果は、プロバイオティクスL. plantarum KU210152で発酵させた豆乳が、神経変性疾患に対する効果的な機能性食品である可能性を示唆しています。 |
| 図 7B は、細胞を発酵豆乳上清と H2O2 で処理した後の活性酸素種生成を示しています。H2O2 のみに曝露すると、対照群と比較して活性酸素種生成が著しく誘導されました。3 つの発酵豆乳上清のうち、1/4 希釈の PY サンプルは活性酸素種生成を著しく弱めました。この研究では、L. plantarum KU210152 で発酵させた豆乳は、活性酸素種生成を阻害することで神経保護効果を発揮しました。 |
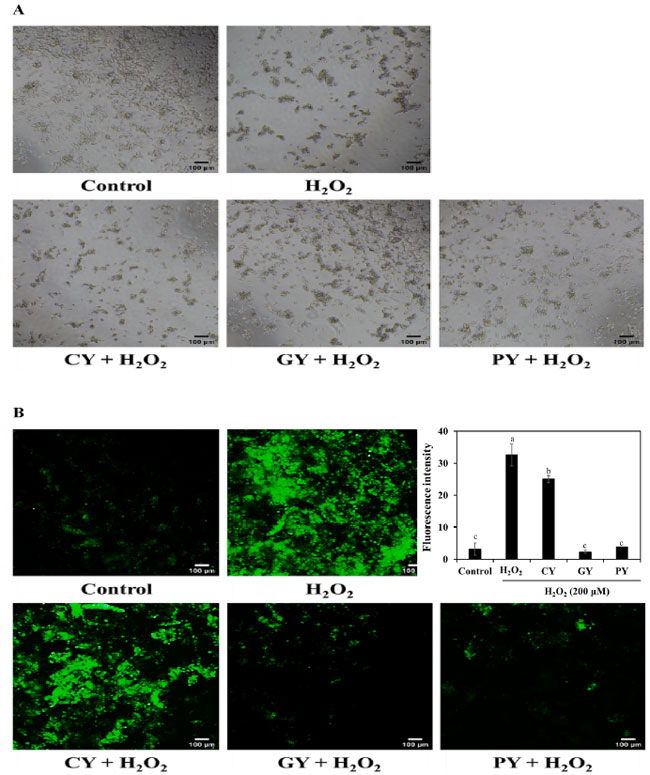 |
図 7. 発酵豆乳サンプルのヒト神経芽細胞腫細胞への影響。 (A) 形態変化、(B) 活性酸素種生成。 CY:Streptococcus thermophilus P206 で発酵させた豆乳、 GY:Lactaseibacillus rhamnosus GG と S. thermophilus P206 で発酵させた豆乳、 PY:Lactiplantibacillus plantarum KU210152 と S. thermophilus P206 で発酵させた豆乳。 白と黒のスケールバーは、倍率 40 倍で 100 μm を示しています。グラフは imageJ を使用して活性酸素種の蛍光強度を表しています。データは平均 ± 標準偏差として示されています。 |
| 4. 結論 |
| 本研究では、L. plantarum KU210152 のプロバイオティクス特性と神経保護効果を評価しました。L. plantarum KU210152 は、人工胃腸条件に対する高い耐性、ヒト結腸腺がん細胞への高い接着性、有益で安全な酵素の産生を示しました。L. plantarum KU210152 馴化培地による前処理により、ヒト神経芽細胞腫細胞の 過酸化水素誘発性生存率の低下と形態学的損傷が軽減されました。L. plantarum KU210152馴化培地 は、ニューロンにおける活性酸素種生成を抑制しました。さらに、L. plantarum KU210152 は、アポトーシス関連遺伝子の発現を減少させ、ニューロンバイオマーカーのレベルを増加させました。L. plantarumKU210152 馴化培地による前処理により、カスパーゼ 9 およびカスパーゼ 3 の活性が阻害されました。さらに、L. plantarum KU210152 と S. thermophilus P206サンプルで発酵させた豆乳は、過酸化水素処理した ヒト神経芽細胞腫細胞の生存率と形態変化を弱めました。L. plantarum KU210152 と S. thermophilus P206で発酵させた豆乳は活性酸素種生成も抑制しました。したがって、L. plantarum KU210152 はプロバイオティクス、神経保護、抗酸化特性があり、神経変性疾患を予防するための発酵食品の予防成分として使用できます。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Food Research International 177 (2024) 113868に掲載されたProbiotic Lactiplantibacillus plantarum KU210152 and its fermented soy milk attenuates oxidative stress in neuroblastoma cells.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


