ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(植物性ヨーグルト、プランタルム菌:研究の最前線) |
プラントベース発酵飲料のプロバイオティクススターターカルチャーとしての Lactobacillus plantarum PMO 08 |
Young Joo Oh et al., |
|
|
| 要約 |
Lactobacillus plantarum PMO 08 は、プラントベース(植物性)のプロバイオティクス飲料のスターターカルチャーとして評価されました。さまざまな培養条件下での生存率、標準化トマト培地での酸性化能力、発酵パラメータ、飲料特性を評価しました。Lactobacillus plantarum PMO 08 はさまざまな培養条件下で増殖することができ、最適条件に達するまでの培養時間と乳酸菌の接種濃度の間には高い相関関係がありました (r2 = 0.997)。L. plantarum で発酵させた場合、ヨーグルトスターターカルチャーよりも酸度 (0.958 ± 0.002%) と乳酸菌数 (9.78 ± 0.14 Log10 CFU/mL) が有意に高くなりました。人工胃液と人工腸液での生存率はそれぞれ 96% と 95% であり、プロバイオティクスの要件が満たされていることが示されました。発酵後、総ポリフェノールおよびグルタミン含有量、抗酸化活性が増加しました。L. plantarum PMO 08 発酵飲料ではプロリン含有量が大幅に増加しました。したがって、L. plantarum PMO 08 は、発酵によって機能的品質が向上する可能性のあるノンデイリー(非乳製品)プロバイオティクス飲料の効果的なスターターカルチャーです。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 結果 |
| 2.1. L. plantarum PMO 08 の生存率に対する培養温度、pH、NaCl 濃度の影響 |
| 2.2. プラントベース基質の酸性化能力 |
| 2.3. プラントベースプロバイオティクス飲料の物理化学的および微生物学的特性 |
| 2.4. 人工胃液中の生存率 |
| 2.5. ポリフェノール含有量と抗酸化活性 |
| 2.6. 遊離アミノ酸組成 |
| 3. 考察 |
| 4. 材料と方法 |
| 4.1. 細菌株 |
| 4.2. 温度、pH、NaCl 濃度が細菌の生存率に与える影響 |
| 4.3. 植物培養基質の調製と酸性化能力 |
| 4.4. プラントベースプロバイオティクス飲料の調製 |
| 4.5. ブリックス、pH、滴定酸度の分析 |
| 4.6. 微生物分析 |
| 4.7. 人工胃液に対する耐性 |
| 4.8. DPPHラジカル消去活性 |
| 4.9. 総ポリフェノール含有量の測定 |
| 4.10. 遊離アミノ酸組成の測定 |
| 4.11. 統計分析 |
| 5. 結論 |
本文 |
| 1.はじめに |
| 世界のプロバイオティクス市場の大幅な成長により、従来の乳製品の代替品としてプラントベースのプロバイオティクス飲料の需要が高まっています [1]。「プロバイオティクス」という言葉は、「適切な量を投与すると宿主に健康上の利益をもたらす生きた微生物」と定義されています [2]。プロバイオティクスは一般的にサプリメント(粉末、カプセル、錠剤)の形で提供されますが、消費者の摂取の利便性と機能品質の向上の好みに応えるために徐々に多様化しています。たとえば、プロバイオティクスカルチャーを加えた発酵乳製品、乳酸菌を含む液体として摂取するプロバイオティクスショット、乳酸菌発酵オート麦を混ぜたプロバイオティクス飲料などのプロバイオティクス製品のさまざまな液体キャリアなどがあります [3,4]。 |
| 発酵乳製品と比較して、プラントベースプロバイオティクス飲料には乳製品成分が含まれていないため、乳糖不耐症や動物性コレステロールや脂肪に関する懸念がありません [5]。プラントベース発酵製品のその他の健康上の利点には、抗酸化ビタミン、生理活性化合物、ミネラルなどの微量栄養素の供給、乳酸菌発酵によるフラボノイド成分の吸収率と生理活性の増加があり、腸の健康が改善され、抗酸化活性と免疫機能が強化されます [6,7]。植物に含まれるポリフェノールはプレバイオティクスとして作用し、有益なヒト腸内細菌の増殖と腸管上皮細胞への付着を促進するため、プラントベースプロバイオティクス飲料はシンバイオティクスとしても提供できることが期待されています [8]。初期の研究では、大豆、オート麦、大麦などの植物性タンパク質や炭水化物源など、発酵乳の代替品としてプラントベースプロバイオティクス飲料を製造するために使用される基質に焦点を当てていました [9]。しかし、最近の研究では、桑、ブロッコリー、緑茶などポリフェノールを豊富に含む果物、野菜、お茶など植物材料を拡大する試みがなされている[10,11,12]。 |
| 植物発酵に適した微生物を得るためには、伝統的な発酵食品を含む様々な植物源から乳酸菌を分離し、そのプロバイオティクス特性を決定する必要がある[9]。そのような努力にもかかわらず、現在利用できる工業化されたプロバイオティクススターターカルチャーは限られている。植物から分離されたLactobacillus plantarumは、有機酸、ポリフェノール、果物や野菜のpHに関連するものなど、微生物にとって敵対的な条件のマトリックスにうまく適応できるため、植物発酵により適している[13]。Lactobacillus plantarum PMO 08は、韓国の伝統食品であるキムチから分離された乳酸菌の一種であり、優れた胆汁酸脱抱合能力を特徴とする[14]。高脂肪食(脂肪45%食)を用いた前臨床研究によると、L. plantarum PMO 08はコレステロール代謝に関与する転写因子であるSREBP-2 mRNA(訳者注: SREBP-2は細胞内のコレステロールの低下を感知して、細胞がコレステロール不足になることを防ぐ働きがある)の発現を調節することにより抗コレステロール効果を発揮します[15]。人工胃腸液では、L. plantarum PMO 08は乳製品から分離されたL. caseiよりも高い生存率を示し、腸管上皮細胞への優れた接着性によりプロバイオティクスの要件を満たしました[16]。さらに、Jangら[17]は、L. plantarum PMO 08が用量依存的に化合物48/80またはヒスタミン誘発性掻痒を抑制し、これがTNF-aやIL-4などの抗炎症性サイトカインを調節して過敏症を抑制する能力に起因すると報告しました。したがって、L. plantarum PMO 08 の優れた抗コレステロール効果と免疫過敏症抑制効果を考慮して、スターターカルチャーとしての実現可能性と、植物材料を発酵させることにより生きた細菌を含むプロバイオティクス飲料を提供する能力が本研究で評価されました。 |
| トマトは、取り扱いが容易で、世界中で入手可能であり、乳酸菌発酵に適しているため、植物発酵の品質を研究するための基質として一般的に使用されています[18,19]。また、リコピン、ナリンゲニン、ビタミンCなどの栄養素が豊富なスーパーフードとして健康上の利点もあります[18]。肥満や心血管疾患などの生活習慣病の予防に寄与するため、トマトはプロバイオティクスの優れたキャリアです[20]。 |
| 本研究では、韓国の伝統的な発酵食品であるキムチから分離したL. plantarum PMO 08を使用して、植物ベースのプロバイオティクス飲料の開発を目的とした。スターターカルチャーとしての有用性を調べるために、L. plantarum PMO 08の増殖特性と酸性化能力を検証し、発酵品質の指標として使用される滴定酸度(TA)、生菌数、発酵トマトジュース中の遊離アミノ酸含有量を測定した。次に、L. plantarum PMO 08を使用して製造した発酵トマトジュースの抗酸化活性、総ポリフェノール含有量、胃腸耐性を、ヨーグルトスターターカルチャーを使用して製造したものと比較した。 |
| 2. 結果 |
| 2.1. L. plantarum PMO 08 の生存率に対する培養温度、pH、NaCl 濃度の影響 |
| 図 1A は、L. plantarum PMO 08 の最適な培養温度を特定するために使用された、培養温度が 乳酸菌の生存率に与える影響を示しています。細胞増殖は 30 °C (102.2 ± 1.7%) でピークに達し、45 °C では 4.4% に抑制されました。対照的に、ヨーグルトスターターは 45 °C で 37 °C よりも高い増殖率 [107.9 ± 1% (p < 0.05)] を示し、25 °C 以下では細胞増殖が抑制されました。L. plantarum PMO 08 培養物の耐酸性は、図 1B に示すように、pH を 2.5 から 8.0 まで変化させながら MRS ブロスで 24 時間生存率を測定することによって推定されました。 L. plantarum PMO 08 の最適 pH は 5.0 ~ 7.5 であったのに対し、ヨーグルトスターターカルチャーの最適 pH は 6.5 ~ 8.0 であった。L. plantarum PMO 08 の耐塩性は、図 1C に示すように、NaCl 濃度を 1 ~ 10% に変化させながら MRS ブロス中の 乳酸菌生存率を測定することによって調べた。Lactobacillus plantarum PMO 08 は、1% NaCl の MRS ブロスで最も高い 乳酸菌生存率 (103.2%) を示し、NaCl 濃度が 8% までのブロスでは有意な増殖阻害は観察されなかった。ヨーグルトスターターカルチャーでは、L. plantarum PMO 08 と同様に 1% NaCl で最大増殖率が観察されたが、5% を超える NaCl 濃度では有意な増殖抑制が観察された。これらの結果は、L. plantarum PMO 08 が広範囲の pH および塩分濃度にわたって生存可能であることを考慮すると、幅広い植物基質環境でスターター培養物として使用できることを示しています。 |
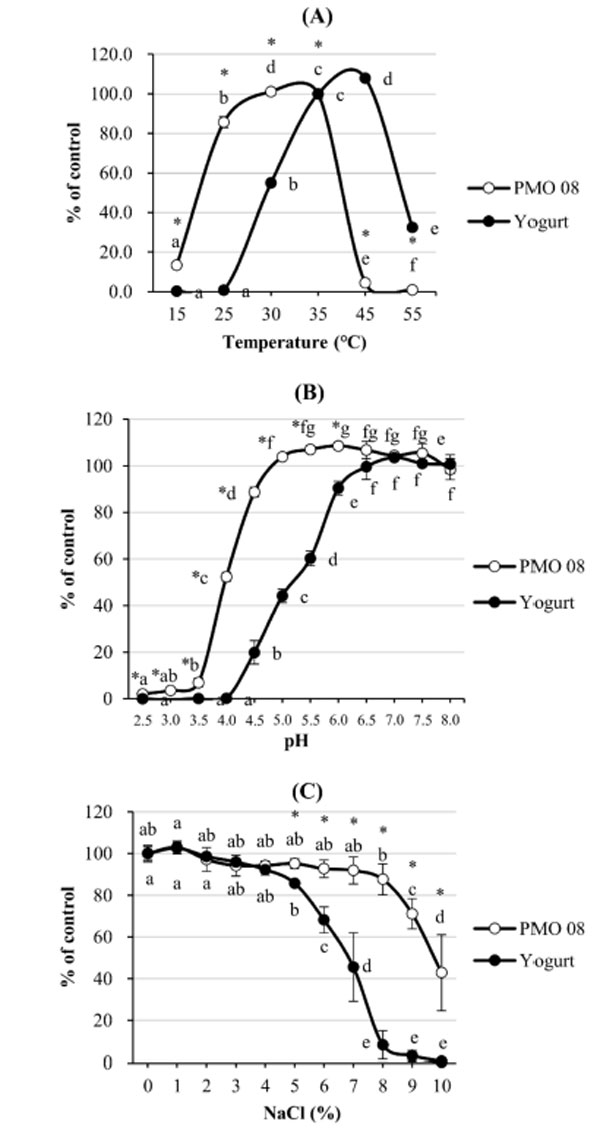 |
図 1 培養条件が細菌細胞の増殖に与える影響。 (A) 温度、(B) pH、(C) NaCl 濃度。 PMO 08: Lactobacillus plantarum PMO 08、Yogurt: Lactobacillus acidophilus、Streptococcus thermophilus、Bifidobacterium lactis のスターターカルチャー混合物。 すべての値は平均 ± 標準偏差 (n = 3) として示されています。異なる文字の値は、Duncan の多重範囲検定によると、p < 0.05 で有意に異なります。* PMO 08 とYogurtの間に有意差があります (p < 0.05)。 |
| 2.2. プラントベース基質の酸性化能力 |
| L. plantarum PMO 08 をスターターカルチャーとして使用するために、標準化されたプラントベース基質を調製しました。図 2 は酸性化能力の測定を示しています。トマトジュースが 乳酸菌接種後に pH 4.0 に達するのに必要な時間をモニタリングすることにより、乳酸菌接種量の増加とともに酸性化能力が増加することを確認しました。pH 4 に達するのに必要なインキュベーション時間と 乳酸菌接種濃度の間には非常に高い相関 (r2 = 0.997) が観察され、L. plantarum PMO 08 がスターターカルチャあーとして実現可能であることが確認されました。 |
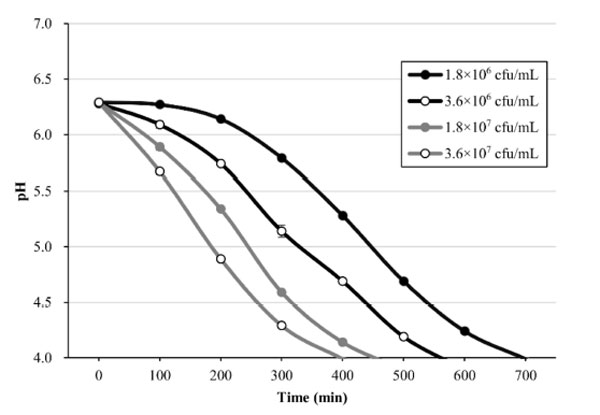 |
図 2 希釈トマトジュースにおける L. plantarum PMO 08 の異なる接種レベルの酸性化曲線。 すべての値は平均 ± 標準偏差 (n = 3) として示されています。発酵は 37 °C で実施されました。 |
| 2.3. プラントベースプロバイオティクス飲料の物理化学的および微生物学的特性 |
| 表 1 は、試験用に製造された生菌を含む発酵プロバイオティクス飲料の品質比較の結果を示しています。L. plantarum PMO 08 を使用して調製したプラントベースプロバイオティクス飲料は、固形分が 4.63 ± 0.03 °Brix (%)、酸度が 0.958 ± 0.002%、pH が 3.39 ± 0.03、乳酸菌数数が 9.78 ± 0.14 Log10 CFU/mL でした。乳酸菌数と酸度は、ヨーグルトスターターカルチャーを使用して調製した飲料よりも有意に高くなりました (p < 0.05)。非発酵飲料と発酵飲料の両方が、総好気性細菌、大腸菌/大腸菌群、酵母、カビに汚染されていないことが確認されました。 |
| 表 1 発酵飲料と非発酵飲料の物理化学的および微生物学的特性 |
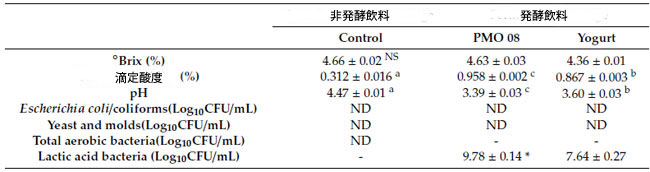 |
データは平均±標準偏差(n = 3)として示されています。a–c 同じ行内の異なる上付き文字の値は、ダンカンの多重範囲検定(p < 0.05)によると有意に異なります。 * p < 0.05、t検定によるとヨーグルトスターターカルチャー(Yogurt)と比較。 NS:有意差なし。-:分析なし。ND:検出不能(<1 CFU/mL)。 |
| 2.4. 人工胃液中の生存率 |
| 人工胃液中のプラントベースプロバイオティクス飲料の生存率は、図 3 に示されています。L. plantarum PMO 08 で発酵させたプロバイオティクス飲料の人工胃液および人工腸液中の生存率は、それぞれ最大 96.2 ± 2.3% および 95.3 ± 2.51% でした。ヨーグルトスターターカルチャーで発酵させたプロバイオティクス飲料の人工胃液中での生存率は 78.0 ± 3.5% で、人工腸液中の L. plantarum PMO 08 で発酵させた飲料の生存率 91.0 ± 3.6% よりも有意に低く (p < 0.05)、これは L. plantarum PMO 08 で発酵させた飲料の生存率と同程度でした。 |
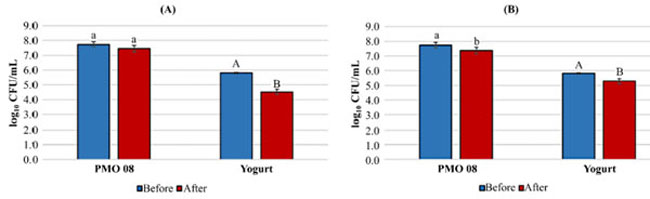 |
図 3 人工胃液中の発酵飲料の生存率。 (A) 0.3% ペプシンを含む人工胃液条件 (pH 2.5)。 (B) 0.1% パンクレアチンを含む 0.45% 胆汁酸塩条件。 PMO 08: L. plantarum PMO 08 を含む発酵飲料。 Yogurt: Lactobacillus acidophilus、Streptococcus thermophilus 、および Bifidobacterium lactis を含むヨーグルトスターターカルチャーを含む発酵飲料。 乳酸菌の生菌数は、各段階の細胞を MRS 寒天培地に播種し、37 °C で 48 時間培養して測定しました。 試験前: 試験前の各発酵飲料の生菌数。 試験後: 試験後の各発酵飲料の生菌数。 値は 3 回の反復の平均として表され、エラーバーは標準偏差を表します。エラーバー上の異なる小文字と大文字は、それぞれ PMO 08 とヨーグルトスターターカルチャーの有意差を示しています (p < 0.05)。 |
| 2.5. ポリフェノール含有量と抗酸化活性 |
| プラントベースプロバイオティクス飲料のポリフェノール含有量は、L. plantarum PMO 08 で発酵させた場合 154.7% 増加し、ヨーグルトスターターカルチャーで発酵させた場合 134.1% 増加しました (図 4A)。DPPH ラジカル消去能アッセイの結果を図 4B に示します。各飲料を精製水で 10%、5%、2.5% (v/v) に希釈して試験サンプルを調製し、その後、異なる濃度で DPPH ラジカル消去活性を評価しました。DPPH 消去活性は用量依存的に有意に増加しました (p < 0.05)。 DPPH フリーラジカル消去率は、L. plantarum PMO 08 で発酵させた飲料では 37.29% ~ 88.92%、ヨーグルトスターターカルチャーで発酵させた飲料では 31.02% ~ 87.38% の範囲でした。 |
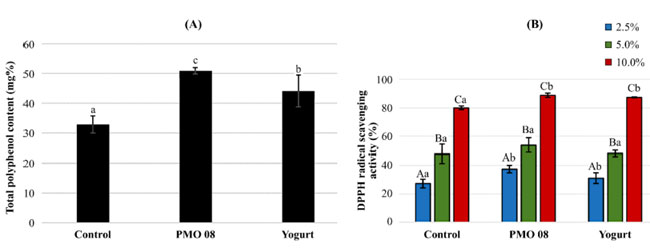 |
図 4 発酵中の総ポリフェノール含有量と抗酸化活性の変化。 (A) 総ポリフェノール含有量。値は 3 回の反復の平均として表され、エラー バーは標準偏差を表します。 (B) 1,1-ジフェニル-2-ピクリルヒドラジルラジカル消去活性。 Control: 非発酵トマトジュース飲料。 PMO 08: L. plantarum PMO 08 で発酵させたトマトジュース。 Yogurt: Lactobacillus acidophilus、Streptococcus thermophilus、および Bifidobacterium lactis を含むヨーグルト スターター カルチャーで発酵させたトマトジュース。 1 列目 (青)、各飲料濃度の 2.5% (v/v)。2 列目 (緑)、各飲料濃度の 5% (v/v)。3 列目 (赤)、各飲料濃度の 10% (v/v)。各飲料は精製水で希釈しました。異なる大文字は、同じ種類の発酵飲料の異なる濃度間の有意差を示します。異なる小文字は、3 種類の発酵飲料間の有意差を示します (p < 0.05)。 |
| 2.6. 遊離アミノ酸組成 |
| 表 2 は、プラントベースプロバイオティクス飲料の遊離アミノ酸含有量を示しています。非発酵および発酵トマト飲料の両方において、グルタミン酸が主要なアミノ酸であり、アスパラギン酸とアラニンがそれに続きます。発酵後、グルタミンとプロリンを除くすべてのアミノ酸含有量が減少しました。特に、L. plantarum PMO 08 で発酵させたトマト飲料では、イソロイシン、バリン、メチオニンの含有量が 100% 減少しました。逆に、プラントベースプロバイオティクス飲料のグルタミン含有量は、L. plantarum PMO 08 で発酵させた場合は 405% (p < 0.05)、ヨーグルトスターター培養物で発酵させた場合は 1849% (p < 0.05) 増加しました。さらに、L. plantarum PMO 08発酵飲料中のプロリン含有量は有意に増加しました(p < 0.05)。 |
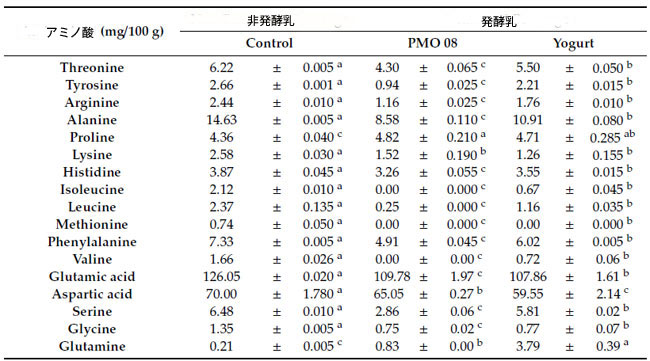 |
すべての値は平均±標準偏差(n = 3)として示されています。 Control:非発酵トマトジュース飲料、PMO 08:L. plantarum PMO 08で発酵させたトマトジュース、Yogurt:Lactobacillus acidophilus、Streptococcus thermophilus、およびBifidobacterium lactisを含むヨーグルトスターターカルチャーで発酵させたトマトジュース。 a–c 同じ行内の異なる上付き文字の値は、Duncanの多重範囲検定によると有意に異なります(p < 0.05)。 |
| 3. 考察 |
| 発酵乳を含むすべてのプロバイオティクス製品において、生乳酸菌は重要な品質指標であるため、最終製品中の生乳酸菌数を増やすことが重要です [3,21]。本研究では、L. plantarum PMO 08 は 30 °C で最も高い 乳酸菌数を示し、pH 3.5~8.0、NaCl 0~8.0% で細胞増殖が起こりました。したがって、PMO 08 の特性は、広範囲の pH および無機塩濃度での野菜や果物の発酵に適しています。発酵終了時に、L. plantarum PMO 08 カルチャーは pH 3.39、滴定酸度0.958% を示し、酸味と腐敗菌にとって好ましくない環境を与える乳酸を放出しました [22]。 pHの急激な低下はプロバイオティクス機能にとって特に重要であり、胃腸液のpHよりも3.5~4.5低いpH範囲の食品は、有害細菌の細胞増殖を抑制し、有益細菌の生存率を高めることでプロバイオティクス効果を高めます[23]。 |
| 本研究では、トマトを培養基質として用いてプラントベースのプロバイオティクス飲料を製造した。Lactobacillus plantarum PMO 08 は 乳酸菌数が 9.78 Log10 CFU/mL であり、発酵乳の国際基準を満たしていた。生菌数が多いことは酸性化に不可欠であり、発酵飲料の官能品質に大きく影響する [10]。トマトジュースを用いた 乳酸菌発酵に関する以前の研究では、比較的高い 乳酸菌数が 8.0~9.9 Log10 CFU/mL、pH が 3.2~4.0、滴定酸度が 0.65% 以上と報告されており、本研究の結果とよく一致している [19]。生菌数が多いため、乳酸菌で発酵させたトマトジュースは、菜食主義者や乳糖不耐症の消費者にとって発酵乳の適切な代替品である [24]。 |
| プロバイオティクスが効果を発揮するには、生菌数が多いだけでなく、胃腸内での高い生存率を維持する必要があります。したがって、人工胃腸液中の乳酸菌の生存率は、潜在的なプロバイオティクスの性能に影響を与える重要な指標であり、スターターカルチャーは、酸、消化酵素(ペプシンなど)、胆汁酸などの胃腸管の物理化学的障壁に耐える必要があります [25,26]。人工胃腸液の結果と同様に [16]、L. plantarum PMO 08 で発酵させたプロバイオティクス飲料は、人工胃液中で高い生存率(96%)を示し、0.45% の胆汁酸塩に耐性がありました。したがって、トマト培養物はプロバイオティクスのキャリアとして使用でき、L. plantarum PMO 08 は効果的なプロバイオティクススターター培養物です。対照的に、ヨーグルト乳酸菌は人工胃液中での生存率が78%であり、Streptococcus thermophilusなどの一部のスターターカルチャー乳酸菌の限界を示している[27]。 |
| 発酵によって誘導されるアミノ酸代謝は、食品の味、栄養、安全性に影響を与える主要な要因です [28]。本研究では、L. plantarum PMO 08 によるトマト発酵中に総遊離アミノ酸含有量が減少したことから、遊離アミノ酸が窒素源として使用されたことが示唆されました。対照的に、L. plantarum PMO 08 で発酵させた飲料ではプロリンとグルタミンの含有量が大幅に増加しました。細菌、真菌、植物におけるよく知られた重要なアミノ酸であるプロリンは、膜の完全性を維持し、タンパク質の凝集を防ぐことでストレス保護剤として機能します [29,30]。さらに、高浸透圧条件下でのプロリンの外因性添加は、細胞増殖、乳酸産生、および保存を改善する可能性があります [31]。グルコース飢餓などのストレス条件下では、L. plantarum B21 は培養培地中のプロリン含有量をアップレギュレーションしました [32]。そのため、プロリンはストレス下におけるL. plantarum PMO 08の適応性に寄与し、ヨーグルトスターターカルチャーよりも消化管内での生細胞数と生存率が高くなると考えられます。グルタミンは、グルタミン酸とアンモニア(NH3)からグルタミン酸シンターゼによって合成されるアミノ酸であり、生物のNH3とpH恒常性を介した窒素交換に関与しており、ほとんどの細胞でプリン、ピリミジン、アミノ糖のヌクレオチド基質として機能します[33]。グルタミンは小腸細胞と免疫細胞にとって重要な燃料であり、腸表面の完全性に重要な役割を果たしています[34]。より具体的には、免疫調節栄養素として、グルタミンはタイトジャンクションタンパク質(オクルディン、クローディン-1、およびゾナオクルデンス-1)を調節し、TNF-αやIL-17Aなどのサイトカインの連鎖反応を制御し、感染を予防するための局所分泌型IgA(sIgA)産生を増加させます[35]。L. plantarum PMO 08を使用した以前の研究では、IL-4やTNF-αなどの炎症性サイトカインを調節することで掻痒が改善したことが報告があります[17]。したがって、腸管グルタミン濃度と体内での免疫調節効果を比較することにより、L. plantarum PMO 08の作用機序を調査するためのさらなる研究が必要です。 |
| プロバイオティクスの機能特性は、キャリア食品や付随する成分によって異なる場合があります [36]。トマトは、リコピン、ベータカロチン、ビタミンC、ポリフェノールなどの抗酸化物質が豊富であり、乳酸菌発酵によって機能成分が強化された発酵飲料の製造に使用できます [37,38]。さらに、植物のポリフェノール成分の一部はプレバイオティクスとして機能し、それによって細胞増殖率と腸管上皮細胞への有益細菌の付着を増加させ、シンバイオティクスとして機能する可能性があります [8]。本研究では、L. plantarum PMO 08を使用したトマト発酵により、発酵前レベルと比較して、総ポリフェノール含有量が154.7%増加し、DPPHラジカル消去活性が濃度依存的に増加しました。この側面は、発酵中にポリフェノールが動員されて抗酸化活性が強化されることと一致しており [39]、これはポリフェノール化合物の重合によって抗酸化能力が高まったことで説明できます [40]。さらに、Ricci et al. [41] は、異なる供給源から分離された L. plantarum 株でチェリージュースを発酵させた場合、総ポリフェノール含有量は変化しませんでしたが、各乳酸菌種のポリフェノール代謝物の分布が変化し、ポリフェノールの利用可能性が L. plantarum 株によって異なることを明らかにしたと報告しました [41]。具体的には、L. plantarum は一般に p-ヒドロキシフェニル乳酸とフェニル乳酸を生成しますが、p-クマリン酸、カフェ酸、ジヒドロカフェ酸などの他の酸は、L. plantarum 株によって利用性が異なります。したがって、L. plantarum PMO 08 によるトマト発酵中のポリフェノール代謝物と DPPH ラジカル消去活性の主要な機能指標を決定するには、追跡調査が必要です。 |
| 本研究の限界は、ヨーグルト菌株にはL. plantarum PMO 08 とは異なる種が含まれていたため、発酵品質を簡単に比較できなかったことです。しかし、結果から、プラントベースのスターターカルチャーに適した菌株を開発する必要があることが確認されました。 |
| さらに、市販のヨーグルトスターターカルチャーと比較して、L. plantarum PMO 08プロバイオティクス飲料は滴定酸度と生細胞数が有意に高いが、抗酸化活性は同等であることが示された。したがって、抗酸化活性に寄与する物質を特定し、その含有量を増やすために、最適な培養条件に関する今後の研究も必要である。さらに、このスターターカルチャあーを使用して製造されたプラントベースのプロバイオティクス飲料に、より多くの健康上の利点があるかどうかは判明していないため、対象機能に適した生物活性に関するin vivo研究が必要である。 |
| 4. 材料と方法 |
| 4.1. 細菌株 |
| Lactobacillus plantarum PMO 08 は Pulmuone Co., Ltd. (Cheongju, Republic of Korea) から入手し、ヨーグルトスターターカルチャー(S. thermophilus、L. acidophilus、および Bifidobacterium lactis BB-12) は Chr. Hansen Holding A/S (Hoersholm, Denmark) から入手しました。使用前に、各 乳酸菌カルチャーを Man Rogosa Sharpe (MRS) ブロス (Difco Laboratories Inc.、Detroit, MI, USA) で 37 °C で 24 時間培養しました。 |
| 4.2. 温度、pH、NaCl 濃度が細菌の生存率に与える影響 |
| 培養温度の影響は 15 ~ 55 °C の範囲で測定し、pH の影響は 1 N NaOH と 1 N HCl を使用して 2.5 ~ 8.0 の範囲で測定しました。塩濃度依存の生存率は、1.0 ~ 10.0% の NaCl を含む MRS ブロスを使用して測定しました。L. plantarum PMO 08 とヨーグルトスターターカルチャーの生存率は、UV-VIS 分光光度計 (VersaMax、Molecular Devices、 CA, USA) を使用して 600 nm でのサンプルの吸光度を測定することで比較しました。 |
| 4.3. 植物培養基質の調製と酸性化能力 |
| スターターカルチャーとしてのL. plantarum PMO 08の活性を試験するために、標準化されたプラントベースの基質を調製し、その酸性化能力を評価した。プラントベースの基質として、トマトは、これまでの研究と世界中で入手可能であることから、乳酸菌発酵に適していると考えられた[18]。標準化されたトマト基質は、市販のトマトペースト(Empresas Carozzi S.A.、Antofagasta, Chile)に精製水を加えて5°Brixに希釈した後、1N NaOHで溶液のpHを6.5±0.5に設定して使用した。その後、溶液を121°Cで15分間滅菌した。L. plantarum PMO 08の酸性化能力は、L. plantarum PMO 08の異なる接種量でpHが4.0に達するのに必要な時間を測定することによって評価した。 |
| 4.4. プラントベースプロバイオティクス飲料の調製 |
| 調製したトマトペーストを精製水を加えて 5 °Brix まで希釈し、200 ± 20 bar の圧力下でホモジナイザー (BBX24B-CE、Next Advance、NY、USA) に通し、105 °C で 30 分間殺菌しました。接種には、L. plantarum PMO 08 とヨーグルトスターター 乳酸菌 を 107 CFU/mL の濃度に希釈して接種し、恒温槽で 37 °C で 24 時間培養しました。発酵前後の物理化学的特性と微生物特性を比較するために、乳酸菌接種なしのトマトペースト飲料を対照として使用しました。 |
| 4.5. ブリックス、pH、滴定酸度の分析 |
| 製造された発酵飲料の特性は、屈折計 (RX-5000、Atago, Tokyo, Japan) を使用して糖度を測定することによって調査されました。3 回の反復の平均は、°Brix (%) として表されました。サンプルの pH は、pH メーター (Orion 2 STAR、Thermo Fisher Scientific、Waltham, MA, USA) を使用して測定されました。酸度は滴定法を使用して測定されました。簡単に説明すると、サンプル 1 mL を蒸留水 49 mL で希釈し、0.1 N NaOH 溶液を使用して pH 8.3 に滴定しました。酸度は乳酸のパーセンテージとして表されます。滴定に使用した 0.1 N NaOH の量を計算し、次の式を使用して酸度 (パーセンテージ) に変換しました [1]。 |
| 滴定酸度(%)=(0.1NNaOHのml×NaOH規定液×0.009)/サンプル重量(g)×100 |
| 4.6. 微生物分析 |
| プロバイオティクス飲料中の大腸菌/大腸菌群、酵母とカビ、および乳酸菌を数えました。各飲料は滅菌生理食塩水で段階的に希釈されました。その後、各希釈サンプル 1 mL を 3 M Petrifilm™ プレート (3M Corp.、St. Paul, MN, USA) に加え、大腸菌/大腸菌群と酵母とカビを数え、MRS 寒天プレート (Difco Laboratories Inc.、Detroit, MI, USA) に接種して乳酸菌を数えました。大腸菌/大腸菌群と乳酸菌の数は 37 °C で 48 時間培養した後に測定し、酵母とカビの数は 25 °C で 3~5 日間培養した後に測定しました。非発酵トマトジュース(対照群)では、殺菌効果を確認するために 乳酸菌数の代わりに総細菌数を測定し、その他の微生物分析は発酵ジュースの場合と同じでした。総細菌数は 3 M Petrifilm™ Aerobic Count プレートを使用して測定し、総細菌数の計数は 37 °C で 48 時間培養した後に実施しました。結果はジュース 1 ミリリットルあたりの log コロニー形成単位 (CFU) として表されます。 |
| 4.7. 人工胃液に対する耐性 |
| 人工胃液に対する耐性は、Valero-Cases ら [35] の記載に従って測定しました。人工胃液と人工腸液は別々に試験しました。簡単に言うと、飲料の人工胃液に対する耐性は、飲料を 0.3% (w/v) ペプシン (Sigma-Aldrich、 St. Louis, MO, USA) を含む PBS 中で 37 °C で 2 時間培養することにより、pH 2.5 に制御して測定しました。人工腸液に対する耐性は、pH 7.0 に調整した 0.45% (w/v) 胆汁酸塩 (Sigma-Aldrich、St. Louis, MO, USA) と 0.1% パンクレアチン (Sigma-Aldrich) を含む PBS に 37 °C で 2 時間曝露した後に測定しました。生細胞数は、MRS 寒天培地上で 37 °C で 48 時間培養して測定しました。各ストレス処理後の生菌数は Log10 CFU で表されます。生存率 (%) は、培養後の生菌数 (N) を初期生菌数 (N0) と比較することで測定しました。 |
| 生存率(%)=培養後の生菌数 (N)/初期生菌数 (N0)×100 |
| 4.8. DPPHラジカル消去活性 |
| DPPHラジカル消去活性は、Bloisらの方法[42]を使用して評価しました。簡単に説明すると、精製水中の異なる濃度(10%、5%、2.5%(v/v))の飲料2.0mLを、等量の新しく調製したエタノール中の0.469 mM DPPH(Samchun Chemical Co., Ltd.、Pyeongtaek, South Korea)と混合しました。25℃の暗所で30分間インキュベートした後、反応混合物を4℃で10分間、8000×gで遠心分離しました。上澄み液の吸光度を517 nmで測定しました。サンプルのDPPHラジカル消去活性(%)は、次の式を使用して計算しました。 |
| DPPHラジカル消去活性(%)=[1-(サンプルOD/コントロールOD)]×100 |
| ここで、サンプルODは DPPH 溶液と混合したサンプルの光学密度であり、コントロールODは DPPH 溶液を含む蒸留水の光学密度です。 |
| 4.9. 総ポリフェノール含有量の測定 |
| 総ポリフェノール含有量を測定するために、各サンプル (0.01 mL) を精製水に溶解して溶液を調製しました。この溶液に、mL のフォリン・チオカルト試薬を加え、続いて 20% 炭酸ナトリウム (0.15 mL) を加えました。混合物を室温で 40 分間反応させました。次に、725 nm で吸光度を測定しました。標準として没食子酸 (Sigma Chemical Co.、St. Louis, MO, USA) を使用しました。 |
| 4.10. 遊離アミノ酸組成の測定 |
| アミノ酸組成は、以前に報告された方法 [43] に従い、Capcell Pak C18 UG 120 カラム (内径 4.6 mm、長さ 150 mm、粒子サイズ 5 μm) を備えた HPLC 1260 (Agilent Technologies、CA, USA) を使用して測定しました。分析検出器を使用して、プロリン (262 nm) を除くすべてのアミノ酸を 338 nm で測定しました。アミノ酸の濃度は mg/100 g サンプルとして表されます。 |
| 4.11. 統計分析 |
| すべての統計分析には SPSS 22.0 (IBM Corp.、Armonk, NY, USA) を使用しました。すべての実験では、一元配置分散分析に続いて Duncan の多重範囲検定または Student の t 検定を使用して統計的有意性を評価しました。データは 3 回の反復の平均と標準偏差として表され、差は p < 0.05 で統計的に有意であると判断されました。 |
| 5. 結論 |
| 本研究の結果、L. plantarum PMO 08 は、pH 3.5~8.0、培養温度 15~35 °C、塩分濃度 0~8% の幅広い培養条件下で増殖できることが確認されました。 乳酸菌含有量が 9 Log10 CFU/mL 以上と高く、低 pH での 乳酸菌安定性は、L. plantarum PMO 08 をスターターカルチャーとして使用する可能性を示しています。 さらに、人工胃腸液中での生存率が高いことが確認され、プロバイオティクスの基本要件を満たしています。 発酵によって総ポリフェノール含有量、抗酸化活性、グルタミン含有量が増加し、生菌数が増えることに加えて、L. plantarum PMO 08 は健康増進に有用であることがわかりました。ノンデイリープロバイオティクス市場におけるプロバイオティクススターターカルチャーとしてのL. plantarum PMO 08の将来的な応用を確実にするために、今後の研究では、さまざまな植物源を使用して発酵品質の適合性を判断し、生物活性成分または生物活性の発酵条件を最適化する必要があります。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Molecules. 2020 Nov; 25(21): 5056.に掲載されたLactobacillus plantarum PMO 08 as a Probiotic Starter Culture for Plant-Based Fermented Beverages. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


