ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(ケフィア:研究の最前線) |
ケフィアはストレス耐性を高め、 マウスの心的外傷後ストレス障害関連の行動および血液学的変化を軽減する |
Vitalii A Balatskyi et al., |
|
|
| 要約 |
心的外傷後ストレス障害(PTSD)は、心的外傷体験後の行動、認知、免疫、神経化学的障害を特徴とする複雑な精神疾患です。様々な治療法が試みられていますが、効果的な長期治療法は限られており、ストレス耐性を高める予防戦略の必要性が浮き彫りになっています。本研究では、PTSD様症状、特に急性の回避不能ストレスによって引き起こされる恐怖および不安関連行動を示すマウスモデルにおいて、ケフィアの長期摂取が行動、血液学的、および生化学的パラメータに及ぼす影響を評価しました。雄のC57BL/6Jマウスは、電気足ショックによるストレス誘導前に2ヶ月間毎日ケフィアを摂取し、回復期の5ヶ月間も継続して摂取しました。行動試験の結果、ケフィアを摂取したマウスは、オープンフィールド、高架式十字迷路、明暗箱テストにおける探索行動の増加など、不安様行動が減少しました。また、これらのマウスは嫌悪文脈テストにおけるフリージングエピソード(恐怖や驚きで体がすくんで動けなくなる状態)が減少し、恐怖記憶の減弱を示しました。血液学的分析では、赤血球数および単球の軽度減少とパラオキソナーゼ(PON)活性の上昇が認められ、抗酸化防御の強化と抗炎症性免疫応答への移行が示唆されました。大脳皮質のRT-qPCR解析では、酸化ストレス応答および神経保護に関与する遺伝子(TXNRD1、UGDH、HSPB8、GADD45B、PPARGC1A)の定常転写レベルの増加と、炎症誘発性サイトカイン遺伝子IL6転写レベルの低下が示されました。これらの結果は、ケフィアの長期摂取が、免疫経路および酸化ストレス経路の調節を介して、ストレス誘発性の行動および生理学的変化を軽減することを示唆しています。総合すると、私たちの研究結果は、おそらく腸-脳軸に関連するメカニズムを介して、ストレス耐性を促進し、PTSD様症状を緩和するための機能的な食事介入としてのケフィアの可能性を裏付けています。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 材料および方法 |
| 2.1. 実験デザイン |
| 2.2. ストレス誘発手順および嫌悪文脈テスト |
| 2.3. オープンフィールドテスト |
| 2.4. 高架式十字迷路試験 |
| 2.5. 明暗箱テスト |
| 2.6. ビー玉埋め試験 |
| 2.7. 血液学的パラメータ |
| 2.8. 血漿中のパラオキソナーゼ、ミエロペルオキシダーゼ活性、および総タンパク質濃度とグルコース濃度の測定 |
| 2.9. ポリメラーゼ連鎖反応(RT-qPCR) |
| 2.10. 統計解析 |
| 3. 結果 |
| 3.1. マウスの体重と被毛の状態 |
| 3.2. 行動試験 |
| 3.3. 血液学的パラメータ |
| 3.4. 血漿の生化学的および代謝的パラメータ |
| 3.5. マウス大脳皮質におけるmRNAレベル |
| 4. 考察 |
| 5. 結論と展望 |
本文 |
| 1.はじめに |
| 心的外傷後ストレス障害(PTSD:以下PTSDと表示)は、トラウマ的な出来事への曝露後に発症する多面的な精神疾患です。PTSDは、侵入的な記憶、気分障害、認知障害、過覚醒、回避行動、そして持続的な脅威感を特徴とします(Miao et al., 2018; Dmytriv et al., 2023; Pinna et al., 2023; Balatskyi et al., 2025)。PTSD患者は、うつ病、神経変性疾患、物質使用障害、そして様々な併存疾患を発症するリスクが高くなります。現在進行中のロシア・ウクライナ戦争の影響を受けているウクライナ国民においても、同様の傾向が最近観察されています(Lushchak et al., 2023)。予防戦略はPTSDに対処する最も効果的な手段と考えられていますが、既存のアプローチには広範な臨床適用を裏付ける十分なエビデンスが不足しています(Bisson et al., 2021)。したがって、ストレス耐性を高めるための、新しく利用しやすい介入の開発は、依然として研究上の優先事項となっています。 |
| 腸-脳軸がストレス反応と感情的幸福感の中心的な調節因子であるという認識が高まっているにもかかわらず、特にPTSDをはじめとするメンタルヘルスを対象とした食事介入は、未だ十分に研究されていません(Yin et al., 2014; Kearney et al., 2022; Rook, 2024)。機能性食品、特にプロバイオティクスや生理活性化合物を豊富に含む食品は、微生物代謝物や神経活性化合物を介して脳機能を調節する可能性が実証されています(Gomez-Pinilla and Gomez, 2011; Gradus et al., 2017)。発酵乳製品(FDP)は、腸内細菌叢の構成と機能に影響を与えることから、特に注目されています。マウスによるケフィア摂取は、炎症誘発性サイトカインのレベルを低下させ、抗炎症性サイトカインのレベルを上昇させることで炎症の調節にプラスの影響を与えること、また酸化ストレスを調節することが知られています(Gogineni, 2013; Albuquerque Pereira et al., 2024; Mariana et al., 2024)。実験研究では、発酵乳由来のペプチドがストレス曝露マウスの不安様行動を減少させ、脳損傷を軽減することが示されています(Joung et al., 2021; 2023)。さらに、ヒトを対象とした研究では、発酵乳製品摂取と不安レベルの低下との関連が報告されています(Sousa et al., 2022)。これらの効果は、主に腸-脳軸(免疫、神経、内分泌経路を介して消化管と中枢神経系を繋ぐ双方向コミュニケーションシステム)の調節に起因すると考えられています(Dmytriv et al., 2024a; Dmytriv et al., 2024b; Loh et al., 2024)。しかし、発酵乳製品がストレス関連行動に及ぼす長期的な影響とその根底にある分子メカニズムについては、まだ十分に解明されていません。 |
| 多くの研究が発酵製品の微生物的または代謝的メカニズムに焦点を当てていますが、私たちの研究の最初のステップは、特定のケフィアがPTSD様マウスモデルにおいて測定可能な行動学的および生理学的効果を誘発できるかどうかを判定することでした。このアプローチにより、個々の微生物的または生化学的成分の寄与を分析する前に、ケフィアの総合的な生物学的影響を評価することができました。今後の研究では、これらの効果の根底にある特定の活性因子と経路の特定に焦点を当てます。 |
| 本研究では、ケフィアの長期摂取が、PTSDマウスモデルにおけるストレス誘発性の行動学的、血液学的、および分子生物学的変化を軽減できるかどうかを検証しました。本研究の結果は、ケフィアがストレス耐性を高め、PTSDの症状を緩和する機能的な食事介入として機能する可能性を示す説得力のあるエビデンスを示しています。 |
| 2. 材料および方法 |
| 2.1. 実験デザイン |
| 8~11ヶ月齢の雄C57BL/6Jマウスを、12時間明暗サイクル(午前6時~午後6時)、室温22℃±2℃、相対湿度50~60%に制御された実験室環境で飼育した。マウスは対照群と実験群に無作為に割り付けられた(各群5~7匹)。対照群には標準的なげっ歯類用飼料(タンパク質21.8%、脂肪4.8%、炭水化物69.1%、繊維3.9%)を与え、実験群には別々の皿で飼料とケフィアを無制限に摂取させた。飼料、水、ケフィアは自由に摂取させた。 |
| ケフィア(モロキヤ、ウクライナ)は、ケフィアスターターカルチャーを加えた標準化牛乳から作られました。100gあたりの栄養成分:炭水化物 3.9g(糖質 3.9gを含む)、タンパク質 2.9g、脂質 2.5g(飽和脂肪酸 1.58g)、食塩相当量 0.05g、エネルギー 209kJ(50kcal)。 |
| ケフィア摂取開始から2ヶ月後、マウスはストレス誘発前にベースライン行動テスト(オープンフィールドテスト)を受けました。その後、PTSD様症状を誘発するため、マウスは2日間にわたり2回の電気ショックを足に与え、その後さらに5ヶ月間ケフィア摂取を継続しました。行動テストは複数の時点で実施されました(図1参照)。具体的には、嫌悪文脈テスト(2日目と7日目)、オープンフィールドテスト(9日目)、高架式プラス迷路テスト(11日目)です。長期的な行動への影響は、5ヶ月後にオープンフィールドテスト、高架式プラス迷路テスト、明暗箱テスト、ビー玉埋めテストを用いて評価しました。 |
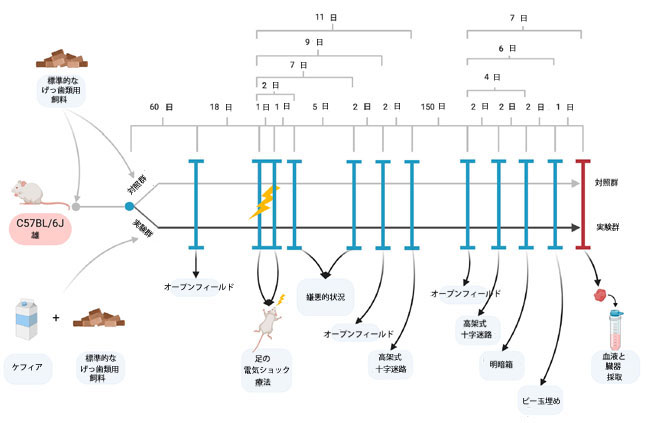 |
| 図1. 実験計画 |
| すべての手順は、ヴァシル・ステファニク・プレカルパチア国立大学の動物実験委員会によって承認され、科学目的で使用される動物の保護に関する指令 2010/63/EU に基づいて実施されました。 |
| 2.2. ストレス誘発手順および嫌悪文脈テスト |
| ストレスは、刺激発生器に接続された金属格子床ショックチャンバーを用いて誘発した。この急性フットショックパラダイムは、げっ歯類における外傷誘発性恐怖および不安のモデル化に広く用いられており、PTSD様モデルまたは文脈恐怖モデルと呼ばれることが多い(Martinho et al., 2021)。ヒトのPTSDのすべてのパラメータを再現するわけではないが、持続性恐怖記憶およびストレス反応性を評価することが可能である。各マウスはチャンバー内に7分間置かれた。2分間の順応の後、5分間で15回の電気ショック(0.8mA、10秒間持続、10秒間隔)が与えられ、これを2日間連続して繰り返した(Martinho et al., 2022)。2日目と7日目には、嫌悪文脈テストのために、マウスをショックを与えずに同じチャンバーに再曝露した。すくみ行動は、呼吸を除いて3秒以上動かないことと定義され、ビデオ録画から採点されました(Martinho et al.、2021)。 |
| 2.3. オープンフィールドテスト |
| オープンフィールドテストは、マウスの運動行動および不安様行動の測定に一般的に用いられています(Seibenhener and Wooten, 2015)。この研究では、16個の正方形(10×10 cm)に分割された40×40 cmのポリ塩化ビニル製チャンバー内で行動活動を評価しました。運動行動および不安関連行動は、10分間のビデオ録画からToxTracソフトウェア(v2.98)を用いて記録・分析されました(Rodriguez et al., 2018; https://sourceforge.net/projects/toxtrac/)。評価項目は、平均移動速度、中央の正方形(内側の領域)での滞在時間、および排泄物数でした。 |
| 2.4. 高架式十字迷路試験 |
| 不安関連行動は、中央のプラットフォームで交差する2本のオープンアームと2本のクローズドアームを備えた標準的な高架式十字迷路(EPM)を用いて評価した。マウスは10分間迷路を探索し、オープンアームとクローズドアームでの滞在時間を記録した(Walf and Frye, 2007)。 |
| 2.5. 明暗箱テスト |
| マウスを、暗部と明部がそれぞれ1つずつ設けられた仕切り付きガラス箱(各区画30×30×40cm)に入れた。マウスを暗部に入れ、蓋を閉めた後、10分間観察した。明部への入室回数、そこでの滞在時間、および最初の入室までの潜伏時間を記録しました(Bourin and Hascoët, 2003; Crawley and Goodwin, 1980)。 |
| 2.6. ビー玉埋め試験 |
| 各ケージに厚さ5cmの木くずを詰め、ビー玉20個を4列に並べた。マウスをケージ内に30分間放置し、75%以上埋められたビー玉の数を数えた(Angoa-Pérez et al., 2013; Sampson, 2024)。 |
| 2.7. 血液学的パラメータ |
| 12時間絶食後、CO2麻酔下で後眼窩穿刺により血液を採取した。サンプルの半分を遠心分離(1500 g、15分、4℃)して血漿を採取し、残りは血液学的検査に使用した。 |
| ヘモグロビンは、ドラブキン試薬(Genesis LLC、ウクライナ)を用いて540 nmで測定した。ヘマトクリット値は、マイクロキャピラリーチューブを用いて2000 gで20分間遠心分離し、評価した。赤血球および白血球数は、それぞれ3% NaClまたは5%酢酸+メチレンブルーで希釈した後、ゴリャエフチャンバーを用いて測定した。白血球分画は、ロマノフスキー法またはメイ・グリューネヴァルト・ギムザ法で染色した血液塗抹標本を用いて、1000倍の倍率で1匹あたり200個の細胞を計数した。細胞は標準プロトコル(O'Connell et al., 2015)に従って分類し、様々な白血球型の割合を測定した。 |
| 2.8. 血漿中のパラオキソナーゼ、ミエロペルオキシダーゼ活性、および総タンパク質濃度とグルコース濃度の測定 |
| 血漿中のパラオキソナーゼ(PON)活性は、4-ニトロフェニル酢酸を基質として、405 nmで分光光度計を用いて測定した。反応混合物は、50 mMリン酸カリウム緩衝液(pH 7.0)、1 mM CaCl2、および3.2 mM 4-ニトロフェニル酢酸から構成された。PON活性の算出には、p-ニトロフェノールの吸光係数14,000 M-1 cm-1を用いた(Vatashchuk et al., 2023)。ミエロペルオキシダーゼ(MPO)活性は、3,3',5,5'-テトラメチルベンジジン(TMB)の過酸化水素依存性酸化反応として測定し、Multiskan MCC/340マイクロプレートリーダー(Yadav et al., 2014)を用いて450 nmにおける吸光度を測定した。血漿中のグルコース濃度および総タンパク質濃度は、標準キットおよびBradfordアッセイ(Bradford, 1976)を用いて測定した。 |
| 2.9. ポリメラーゼ連鎖反応(RT-qPCR) |
| 全RNAの分離、RNA定量、およびリアルタイム定量ポリメラーゼ連鎖反応(RT-qPCR)は、既報(Demianchuk et al., 2024)に従って実施した。RT-qPCRにはAriaMxシステム(Agilent Technologies, Inc.)を用いた。メッセンジャーRNA(mRNA)レベルの相対的変化率は、RPL27遺伝子(リボソームタンパク質L27をコードする遺伝子)の発現のCq値を基準として、2-ΔΔCq法(Livak and Schmittgen, 2001)を用いて算出した。 |
| 大脳皮質サンプルから総RNAを既報(Demianchuk et al., 2024)に従って抽出した。RT-qPCRはAriaMxシステム(Agilent Technologies)を用いて実施した。対象遺伝子の相対転写産物レベルは、2-ΔΔCq法(Livak and Schmittgen, 2001)を用いて算出し、RPL27を参照遺伝子として標準化した。オリゴヌクレオチド配列(表1参照)はMetabion International AG(ドイツ、シュタインキルヒェン)から提供された。 |
| 表1.本研究で定量的リアルタイムポリメラーゼ連鎖反応によるmRNAレベルの解析に使用したオリゴヌクレオチド配列。 |
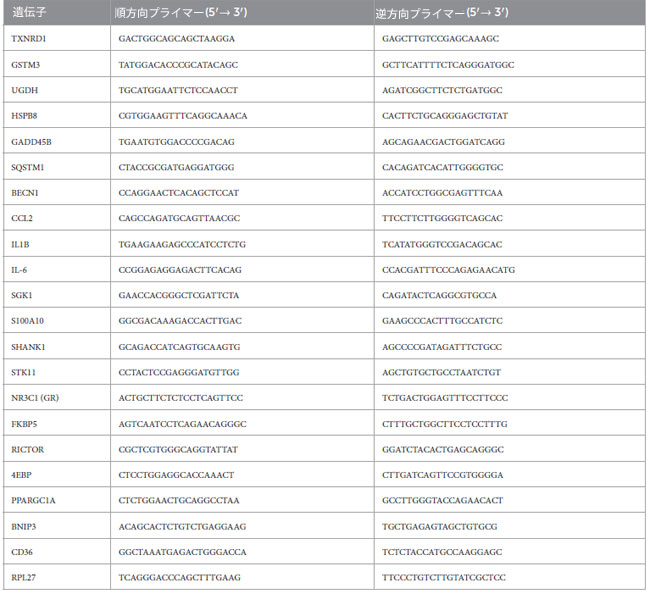 |
| 前頭前皮質は、PTSDの病態の中核を成す感情調節、認知制御、そして恐怖反応の消去に重要な役割を果たすことから、分子解析の対象として選択されました。この領域は、再現性の高いRNA単離と信頼性の高いRT-qPCR測定に十分な組織量を提供します。 |
| 2.10. 統計解析 |
| データは平均値±標準誤差(SEM)として提示されています。統計解析はGraphPad Prism v10.0.0(GraphPad Software社、マサチューセッツ州ボストン、米国)を用いて実施しました。群間差は、対応のないStudent's t検定およびHolm-Sidak検定を用いて評価しました。GraphPad Prismに実装されている線形混合効果モデルを用いて、治療の経時的影響を評価しました。多重比較はt検定を用いて実施し、その後、Benjamini-Krieger-Yekutieli法を用いてp値調整を行いました。 |
| 3. 結果 |
| 3.1. マウスの体重と被毛の状態 |
| 最初のオープンフィールド試験(足部ショック処置前に実施)の誘導前、ケフィアを摂取したマウスは対照群と比較して体重が有意に高く(約8%(p = 0.01))、体重増加が認められました(図2A)。しかし、実験終了時には、体重差は統計的に有意ではなくなりました(図2B)。ケフィアを摂取したマウスは、対照群と比較して、身体活動の増加、行動の活発化、被毛の光沢向上など、被毛の状態も著しく改善しました(図2C)。 |
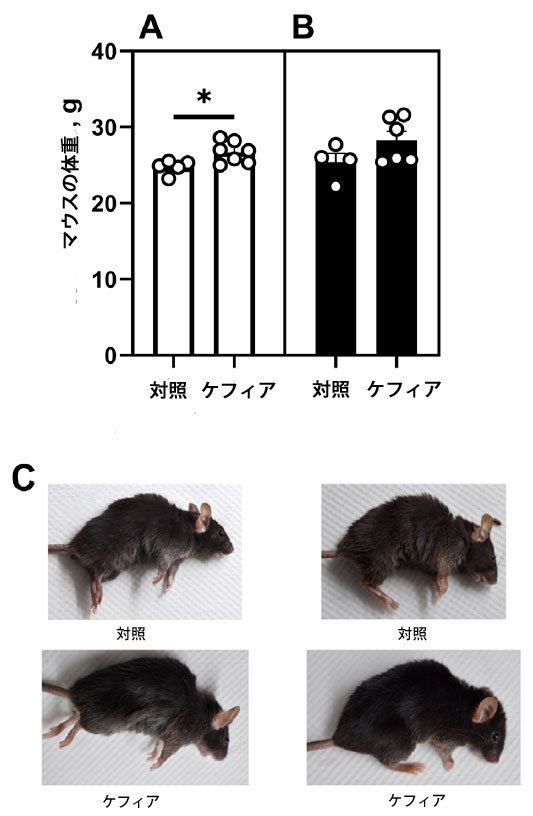 |
| 図2. マウスの体重(A)足部ショック処置前、(B)実験終了時、(C)麻酔下の対照群およびケフィア摂取群のマウスの毛皮の状態。データは平均値±標準誤差(SEM)、n = 4-6で示されている。*対照群との有意差(P < 0.05)は、無対スチューデントt検定によって示された。 |
| 3.2. 行動試験 |
| オープンフィールド試験は、ストレス曝露前、ストレス曝露1週間後、およびストレス誘発5ヶ月後の3回実施しました(図1)。対照マウスはストレス曝露後に運動量が低下し、平均速度は1回目と比較して2回目の試験で56%(p < 0.001)、3回目では44%(p < 0.001)低下しました。ケフィアを投与されたマウスも、2回目の試験でストレス曝露前と比較して33%(p = 0.005)低下しましたが、行動は経時的に安定した状態を維持しました(図3A)。 |
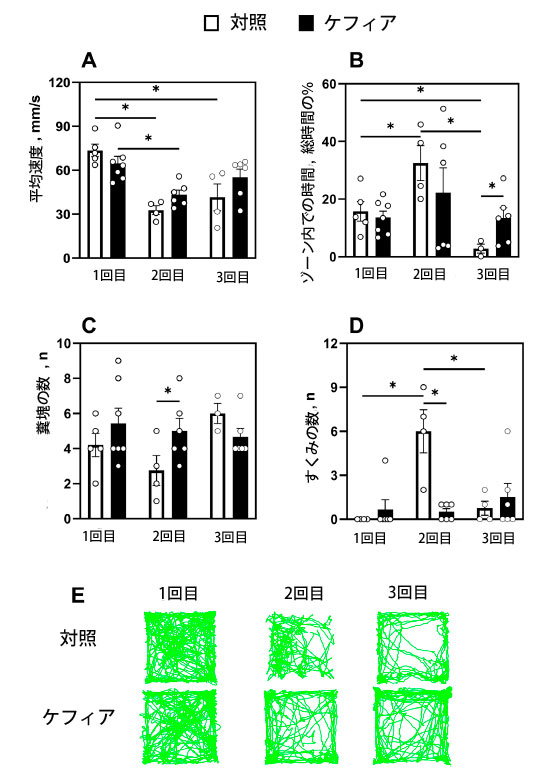 |
| 図3. 1回目(足部ショック前)、2回目(足部ショック1週間後)、3回目(足部ショック5ヶ月後)のオープンフィールド試験の結果の比較。(A) マウスの平均速度、(B) オープンフィールド中央のマス目での滞在時間、(C) 糞塊の数、(D) マウスのすくみの数、(E) マウスの代表的な移動軌跡。データは平均±SEM(n = 3-7)として示されている。* 混合効果モデルアプローチによるグループ間の有意差(P < 0.05)を判定し、その後、多重検定のためにBenjamini-Krieger-Yekutieli法によるp値調整を行った一対比較を行った。 |
| 不安様行動に関しては、対照群マウスは1回目の試験と比較して2回目の試験で内側のゾーンに2倍の時間を費やしました(p = 0.03)。しかし、3回目の試験では中心にいた時間が顕著に減少し、それぞれ1回目と2回目の試験で観察された値の82%(p = 0.044)、91.3%(p = 0.04)になりました。対照的に、ケフィアを摂取したマウスは、すべての試験を通して中央領域を安定して探索し、3回目の試験中に対照群よりも約5倍長い時間(p = 0.03)を内側のゾーンで過ごしました(図3B)。これは不安の軽減を示唆しています。糞便の塊の数は、2回目の試験でケフィア群が約2倍(p = 0.04)排泄した以外は有意差はありませんでした(図3C)。対照動物では 2 回目の試験中にすくみ行動(訳者注:Freezing behavior(すくみ態行動)恐怖や驚きで体がすくんで動けなくなる状態)がピークに達したのに対し、ケフィアを摂取したマウスでは一貫してすくみ行動が低下し、2 回目の試験中に対照動物よりも有意に少ないエピソード数を示しました (p < 0.001) (図 3D)。 |
| 嫌悪的文脈テストでは、ケフィアを摂取したマウスは、対照マウスと比較して、恐怖反応が著しく低下し、2日目のすくみエピソードが76%減少し(p = 0.03)、7日目には91%減少しました(p = 0.02)(図4A、B)。これは、恐怖関連反応が持続的に減衰していることを示しています。 |
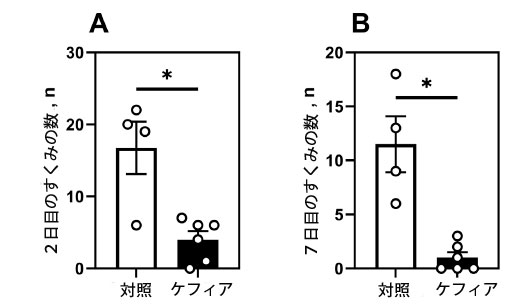 |
図4. 嫌悪的文脈テスト。(A) 2日目の嫌悪的文脈におけるマウスのすくみの数、(B) 7日目の嫌悪的文脈におけるマウスのすくみの数。データは平均±SEM(n = 4-6)として示されている。*無対スチューデントt検定により、対照群と有意差あり(P < 0.05)。 |
| 高架式十字迷路(EPM)およびビー玉埋め行動(ビー玉埋め行動)の第1ラウンド(足部ショックから1週間後)では、群間有意差は認められませんでした(図5A~C)。しかし、第2ラウンド(ストレスから5ヶ月後)では、ケフィアを摂取したマウスは対照群と比較して、高架式十字迷路のオープンアーム内で12倍(p = 0.004)長く過ごし(図5D)、不安が軽減されたことが示されました。クローズドアームへの進入回数には差がなく(図5E)、ビー玉埋め行動にも差はありませんでした(図5F)。 |
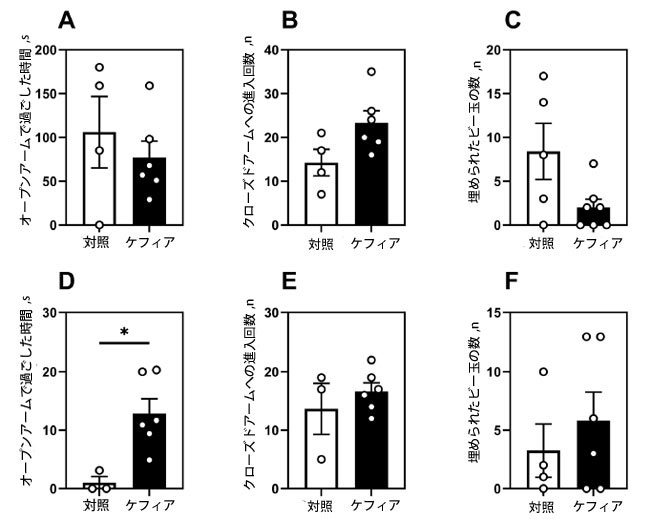 |
| 図5. 高架式十字迷路とビー玉埋め込みテスト。この図は、2回の高架式十字迷路テストのデータを示しています。最初のテストはフットショックの1か月後(A~C)、2回目のテストはフットショックの5か月後(D、E、F)に実施しました。最初のテスト。(A)高架式十字迷路のオープンアームで過ごした時間、(B)高架式十字迷路のクローズドアームへの進入回数、(C)ビー玉埋め込みテストで埋められたビー玉の数。2回目のテスト。(D)高架式十字迷路のオープンアームで過ごした時間、(E)高架式十字迷路のクローズドアームへの進入回数、(F)ボール埋め込みテストで埋められたボールの数。データは平均±SEM、n = 3-7として示されています。*無対合スチューデントt検定により、対照群と有意差がありました(P < 0.05)。 |
| 明暗箱テスト(ストレス後5ヶ月)において、ケフィアを摂取したマウスは対照群と比較して、明領域への進入回数が有意に増加し(p = 0.003)、明領域への進入潜時も短縮しました(p = 0.002)(図6A、B)。また、これらのマウスはテスト中の排便回数が43%減少しました(p = 0.04)(図6C)。これは、ケフィアの抗不安作用をさらに裏付けています。 |
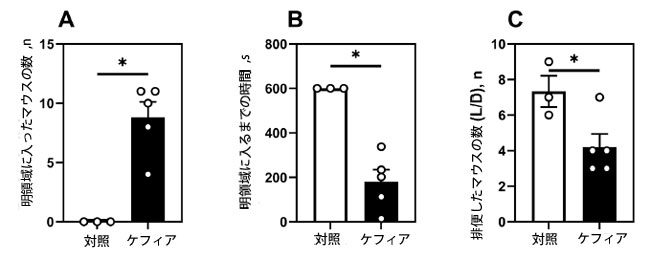 |
| 図6. 明暗箱テスト(足部ショックから5ヶ月後)。(A) 明暗箱の明領域に入ったマウスの数、(B) 潜伏時間(マウスが初めて明領域に入るまでの時間)、(C) 明暗箱内で排便したマウスの数。データは平均±SEM(n = 4-6)として示されている。*無対スチューデントt検定により、対照群と有意差が認められた(P < 0.05)。 |
| 3.3. 血液学的パラメータ |
| 血液学的パラメータのうち、ケフィア摂取マウスでは対照群と比較して赤血球数のみが有意に低下(17%)した(p = 0.001)(表2)。ヘモグロビン濃度、ヘマトクリット値、総白血球数には群間有意差は認められなかった。 |
| 表2.対照群およびケフィア摂取群のマウスの末梢血中の血液学的パラメータ。 |
 |
| データは平均±SEM(n=4-6)として示されています。*無対スチューデントt検定によると、対照群と有意差がありました(P < 0.05)。 |
| 白血球分画分析の結果、ケフィア摂取群では単球の割合が50%低下し(p = 0.03)、幼若白血球の割合が27%上昇しました(p = 0.01)。その他の白血球サブタイプ(リンパ球、分葉球、桿状好中球)の割合は群間で差がありませんでした。 |
| 表3.対照群およびケフィア摂取群のマウスの末梢血中の白血球組成。 |
 |
| データは平均±SEM(n=4-6)として示されています。*対照群と比較して有意差(P < 0.05)を示しました(無対スチューデントt検定)。NF:検出されませんでした。 |
| 3.4. 血漿の生化学的および代謝的パラメータ |
| 血糖値、総血漿タンパク質、ミエロペルオキシダーゼ(MPO)活性において、群間有意差は認められなかった(図7A~C)。しかし、パラオキソナーゼ(PON)活性はケフィア群で22%高く(p = 0.03)、抗酸化能の増強が示唆された(図7D)。 |
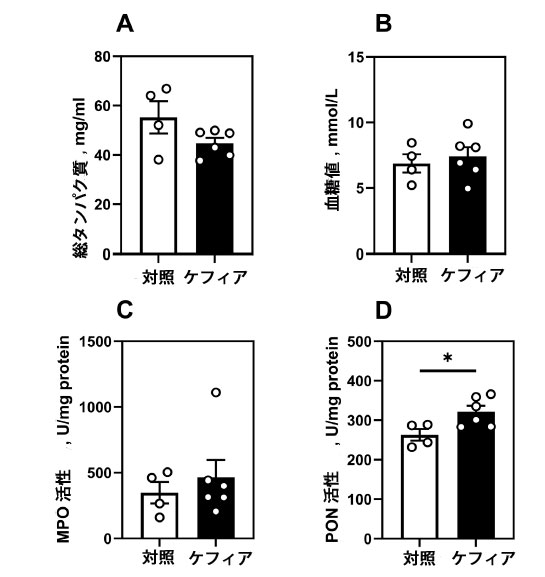 |
| 図7. 代謝および生化学的血液パラメータ。(A) 総タンパク質、(B) 血糖値、(C) ミエロペルオキシダーゼ活性、(D) パラオキソナーゼ活性。データは平均値±標準誤差(SEM)、n = 4-6として示しています。*無対スチューデントt検定により、対照群との有意差(P < 0.05)が認められました。 |
| 3.5. マウス大脳皮質におけるmRNAレベル |
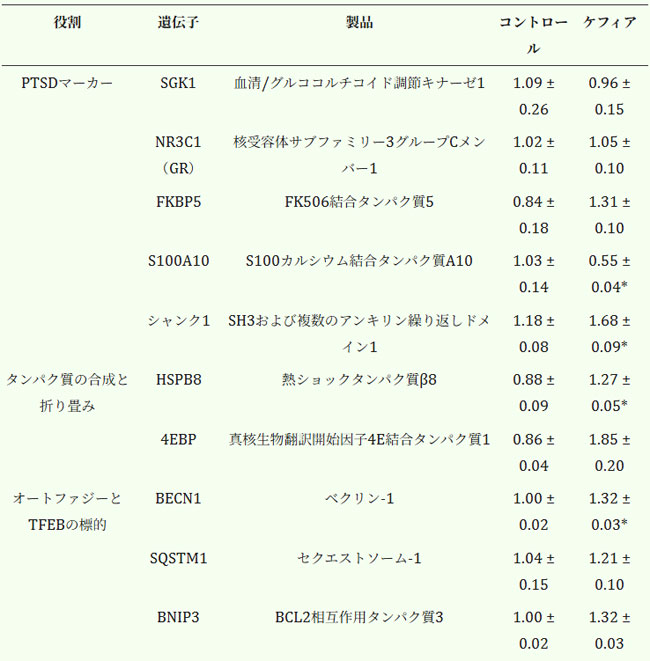
| 大脳皮質組織のRT-qPCR解析により、酸化ストレス応答、炎症、神経可塑性、オートファジー、エネルギー代謝に関与する遺伝子の転写レベルにおいて、対照群とケフィア摂取群の間で有意な転写差が認められた(表4)。抗酸化防御遺伝子のうち、TXNRD1とUGDHはそれぞれ34%(p = 0.049)、40%(p < 0.001)増加した。GSTM3の発現は変化しなかった。 |
| 表4. マウス大脳皮質におけるmRNA転写産物。データは平均±SEM(n = 3-5)として示されている。 |
 |
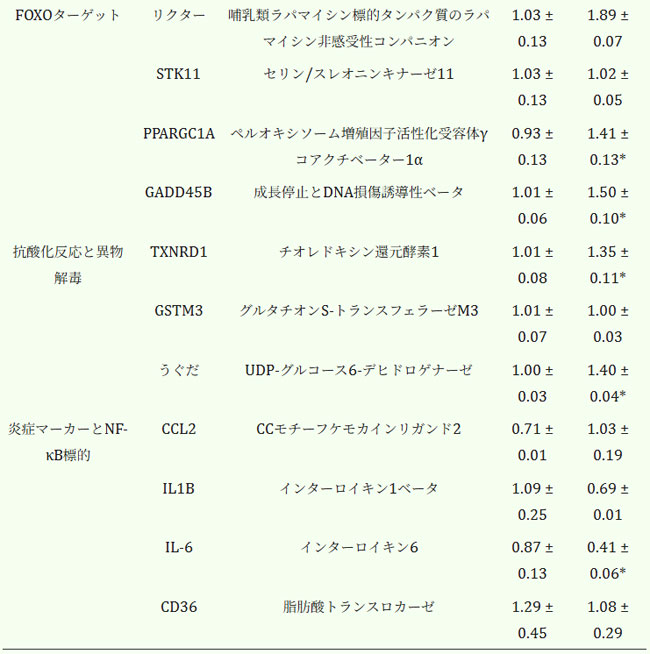 |
| *無対スチューデントt検定によると対照群と有意に異なる(P < 0.05)。 |
| 神経可塑性関連遺伝子では顕著な差が見られ、SHANK1とGADD45Bはそれぞれ43%(p = 0.006)、50%(p = 0.004)上昇したのに対し、S100A10は47%(p = 0.04)低下した。オートファジー関連遺伝子では、BECN1が32%(p < 0.001)上昇した一方、SQSTM1とBNIP3は変化がなかった(表4)。 |
| タンパク質恒常性に関しては、HSPB8が44%増加しました(p = 0.03)。mTORシグナル伝達および代謝調節に関連する遺伝子もケフィア摂取に反応を示しました。RICTORは84%増加し(p = 0.002)、EIF4EBP1はほぼ2倍に、PPARGC1Aは52%増加しました(p = 0.04)。STK11およびCD36には有意差は認められませんでした(表4)。 |
| 4. 考察 |
| 発酵乳製品、特にケフィアは、免疫調節、抗酸化作用の増強、神経保護作用の可能性など、多面的な健康効果を持つことがますます認識されています(Moineau and Goulet, 1991; Mitsuoka, 2014; Silva et al., 2023)。これらの効果は、主にケフィアが腸内細菌叢を調節し、腸-脳軸に影響を与える能力に起因すると考えられています(Perdigón et al., 2002; Kim et al., 2016; Kumar et al., 2021; Chakrabarti et al., 2022)。本研究では、心的外傷後ストレス障害(PTSD)のマウスモデルにおいて、ケフィアの長期摂取が行動、生理機能、および脳の遺伝子発現に有益な効果をもたらすことが示されました。 |
| 私たちの研究では、ケフィアを摂取したマウスは毛並みが改善し、体重も対照群と比較して8%増加しました。したがって、これは食事へのケフィアの追加と、実験群がより多くのカロリーを摂取したことの両方によるものであり、それが外観の改善につながった可能性があると考えています。また、マウスはストレス耐性の向上を示し、オープンフィールド、高架式十字迷路、明暗箱、嫌悪文脈テストなど、複数の行動テストにおいて安定した探索行動と不安様行動の軽減を示しました。対照的に、対照マウスは運動量が有意に低下し、中枢探索行動の減少やすくみ反応の増加など、不安の兆候が顕著でした。これらの行動改善は、ケフィアが腸内細菌叢由来の代謝物、特にγ-アミノ酪酸(GABA)作動性およびセロトニン作動性に影響を及ぼす代謝物を介して中枢神経伝達を調節するという過去の報告と一致しています(Van De Wouw et al., 2020; Icer et al., 2024)。ケフィアペプチドはBDNF/TrkBシグナル伝達を活性化し、ストレス誘発性高体温を軽減することも示されており、ストレス耐性におけるその役割をさらに裏付けています(Chen et al., 2021; Balasubramanian et al., 2024)。オープンフィールド試験において、マウスの排便回数に対するケフィアの興味深い効果も観察されました。これは、2回目の試験(ストレス負荷後)でのみ、ケフィアを摂取したマウスの排便回数が増加したためです。ケフィアは腸管運動に影響を与えないことが以前から指摘されていました(Van De Wouw et al., 2020)。これは、ケフィアの摂取とストレスの組み合わせによって説明できます。例えば、ケフィアは短鎖脂肪酸(酪酸、プロピオン酸、酢酸)の存在により大腸のpHを低下させます。その結果、マウスではストレスによりコルチコステロイドの分泌が増加し、腸管運動に影響を与える可能性があります(Unsal and Balkay, 2012)。これらが相まって蠕動運動を増加させ、マウスの排便回数が対照群と比較して増加した理由です。しかし、一定期間後、適応により排便回数は正常化しました。 |
| しかし、強迫行動の有無を判定するために使用されるビー玉掘りテストでは、差異は認められませんでした。これらの結果は、異なる神経回路の関与に関連している可能性があります(Shin and Liberzon, 2010)。不安と恐怖は主に扁桃体の過剰活性化と関連しているのに対し、強迫性障害は脳回路において異なる局在を示し、特に皮質-線条体-視床-皮質ループに顕著です(Li and Mody, 2016)。ケフィアはこれらの脳の調節領域には影響を与えない可能性があります。また、このテストの感度が不十分であったか、サンプル数が不十分であったことが原因である可能性もあります。 |
| 全身レベルでは、ケフィアの補給はヘモグロビンやヘマトクリット値に影響を与えることなく赤血球数をわずかに減少させ、酸素輸送が維持されていることを示唆しています。単球における赤血球数の低下と幼若白血球における赤血球数の上昇は、炎症性免疫プロファイルの低下を示唆しており、ケフィアの既知の免疫調節作用と一致しています(Karaffová et al., 2021; Ben Taheur et al., 2022)。 |
| 生化学分析の結果、ケフィアは血漿中のグルコース濃度とタンパク質濃度、そしてミエロペルオキシダーゼ(MPO)活性に影響を与えなかったことが示され、急性全身性炎症反応を誘発しないことが示唆されました。しかし、ケフィアを投与されたマウスにおけるパラオキソナーゼ(PON1)活性の上昇は、抗酸化防御と脂質代謝の強化を示唆しており、これは心血管系および神経保護効果の両方に寄与している可能性があります(Jakubowski, 2024)。 |
| マウス大脳皮質において、ケフィア摂取は酸化ストレス応答、炎症、シナプス可塑性、細胞代謝に関連する複数の遺伝子の発現に影響を与えました。TXNRD1とUGDHのmRNAレベルの上昇が観察されました。これらはいずれも、細胞の抗酸化防御と代謝適応を制御するNrf2経路に関連しています(Tonelli et al., 2018; Wu et al., 2012)。これらの転写変化は、直接的な抗酸化作用ではなく、防御的な分子応答の活性化を示唆している可能性があります。 |
| IL6発現の適度な減少は、神経炎症シグナル伝達の減弱を反映している可能性があり、これはおそらくNrf2-NF-κBクロストークを介して媒介されていると考えられます(Saha et al., 2020)。同時に、BECN1、HSPB8、およびGADD45B転写産物の変化は、オートファジーおよびストレス適応経路の潜在的な調節を示唆していますが、その機能的意義はまだ明らかにされていません。 |
| SHANK1、RICTOR、EIF4EBP1、PPARGC1Aといった神経可塑性とエネルギー代謝に関与する遺伝子も転写産物の変化を示しました。これらの遺伝子はmTORC2およびミトコンドリア生合成経路に関与しているため、その発現調節はストレスに対する細胞応答の代償作用を反映している可能性があります(Costa-Mattioli and Monteggia, 2013; Huang and Fingar, 2014)。 |
| 全体として、観察された転写変化は、ケフィアが抗酸化防御、炎症、シナプス調節に関連する分子ネットワークに影響を与える可能性を示唆しています。しかし、mRNAレベルは必ずしもタンパク質量や酵素活性を反映するわけではないため、これらの知見は慎重に解釈し、タンパク質レベルまたは機能レベルでの今後の研究で検証する必要があります。 |
| 分子解析は、PTSDにおける認知制御と感情調節において中心的な役割を果たす前頭前皮質に限定されました。海馬や扁桃体などの他の領域は、組織が限られているため、本研究では検討されていません。しかしながら、今後の研究ではこれらの領域も対象とすることで、ケフィアの効果に関するより包括的な神経解剖学的理解が得られるでしょう。 |
| 以上の結果を総合すると、ケフィアの長期摂取は、PTSD様マウスモデルにおいて、行動反応の改善、免疫および酸化ストレスマーカーの調節、神経可塑性および代謝調節に関与する遺伝子の発現増強を通じて、広範な保護効果を発揮することが示唆されます。これらの結果は、ケフィア摂取が、おそらく腸-脳軸に関わるメカニズムを介して、ストレス耐性を高め、トラウマ関連疾患を軽減するための機能的な食事戦略となる可能性を示唆しています。しかしながら、これらの知見は、最適な投与量、菌株の選択、および併用療法に関するさらなる研究の必要性も示しています。 |
| このテーマに関するさらなる研究により、ケフィアによるマイクロバイオームの調節と本研究で得られた結果との間に直接的な相関関係があるかどうかを明らかにする必要がある。16S rRNAシークエンシングを実施し、マイクロバイオームの多様性を特定し、大腸組織におけるタイトジャンクションタンパク質であるオクルディンおよびZO-1の発現を検証し、短鎖脂肪酸やトリプトファン代謝物である5-ヒドロキシトリプタミンなどの腸内代謝物を研究する必要がある。さらに、本研究では、ケフィアを栄養補助食品として摂取することの総合的な効果を明らかにした。したがって、今後の研究では、観察された効果の原因となる特定の菌株および代謝物を特定することを目指し、これはトランスレーショナル・アプリケーションにおいて極めて重要である。 |
| 5. 結論と展望 |
| 本研究は、ケフィアの長期摂取が、外傷性ストレスに曝露されたマウスにおいて、ストレス誘発性の行動変化を有意に減弱させ、生理学的および分子学的パラメータを良好に調節することを実証した。ケフィアを投与されたマウスは、オープンフィールド、高架式十字迷路、明暗箱、嫌悪的文脈パラダイムを含む複数の検証済み試験において、不安様行動の減少を示した。行動改善に加えて、ケフィア摂取は、パラオキソナーゼ活性の上昇や単球レベルの減少など、血液学的および生化学的マーカーの有益な変化をもたらし、抗酸化防御の強化と全身性炎症の軽減を示唆した。分子レベルでは、大脳皮質において、ケフィアは酸化ストレス耐性、神経保護、シナプス可塑性、オートファジー、および代謝調節に関連する主要遺伝子の発現を調節した。これらの知見は、ケフィアが免疫系と神経系の両方における適応経路を活性化することで、ストレス耐性を促進することを示唆しており、その媒介として腸-脳軸が考えられます。総合的に、私たちのデータは、PTSD関連症状の予防または緩和のための機能的な食事介入としてのケフィアの可能性を裏付けています。本研究の結果は予備的なものであり、動物モデルに限定されていますが、ケフィア全般、特にモロキアケフィアが、人間のメンタルヘルスとレジリエンスを支援することを目的とした栄養戦略に貢献する可能性を示唆しています。 |
| 本研究は、ケフィアがストレス耐性を高めるための機能的な食事介入としての可能性を示唆しています。今後の研究では、ケフィアの効果に関与する特定の微生物株と代謝物の特定、最適な投与量と投与期間の決定に焦点を当てるべきです。ケフィアはマウスのストレス耐性向上に寄与する可能性があり、メンタルヘルスの観点からさらなる研究が必要です。さらに、ケフィアを他の栄養療法や治療法と組み合わせることで、その効果をさらに高めることができる可能性があります。総じて、ケフィアは腸-脳軸の調整を通じてメンタルヘルスをサポートするための、有望で利用しやすいツールです。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Front Physiol. 2025 Nov 14;16:1682807.に掲載されたKefir enhances stress resilience and mitigates PTSD-related behavioral and hematological changes in mice.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


