ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(ケフィア:研究の最前線) |
Lactococcus lactis subsp. cremoris YRC3780 YRC3780は腸間膜リンパ節樹状細胞の機能を変化させ、制御性T細胞を誘導するT細胞分化のバランスを調節する |
Ryogo Nakagawa et al., |
|
|
| 要約 |
はじめに 腸管免疫系は、食物に対する免疫反応の誘導において極めて重要な役割を果たします。T 細胞反応の場合、樹状細胞 (DC) が特に重要です。しかし、腸管樹状細胞による食物に対する免疫反応の調節については十分に説明されていません。本研究では、伝統的な発酵乳製品であるケフィアから分離された乳酸菌株である Lactococcus lactis subsp. cremoris YRC3780 が、腸管樹状細胞による T 細胞への抗原提示によって誘導される免疫反応に及ぼす影響と、これらの免疫調節効果の作用機序を分析しました。L. cremoris YRC3780 は、動物とヒトの両方の研究で花粉症の症状を改善することが示されています。 |
方法 BALB/c マウスの腸間膜リンパ節 (MLN) からの CD11c+ 細胞を L. cremoris YRC3780 とともに腸間膜リンパ節樹状細胞として培養し、制御性 T 細胞 (Treg) を誘導する遺伝子の発現を qPCR で調べました。さらに、腸間膜リンパ節樹状細胞を、卵白アルブミン (OVA) 特異的 TCR と 卵白アルブミン抗原ペプチドを発現する DO11.10 トランスジェニック マウスの CD4+ T 細胞および L. cremoris YRC3780 と共培養しました。制御性 T 細胞の誘導はフローサイトメトリーで調べ、遺伝子発現は DNA マイクロアレイと qPCR で分析し、サイトカインの産生は ELISA で測定しました。TLR2 欠損マウスの 腸間膜リンパ節樹状細胞と L. cremoris YRC3780 の成分を使用して、腸間膜リンパ節樹状細胞による L. cremoris YRC3780の認識を調べました。 |
結果 L. cremoris YRC3780 は、腸間膜リンパ節樹状細胞における 制御性 T 細胞 誘導に関与する遺伝子の発現を増強し、腸間膜リンパ節樹状細胞と CD4+ T 細胞の共培養システムで Foxp3+CD4+T 細胞を誘導しました。腸間膜リンパ節樹状細胞に対する効果は、TLR2 以外の受容体によって媒介されている可能性が高いです。CD4+ T 細胞遺伝子発現のマイクロアレイ解析およびサイトカイン ELISA と併せて、L. cremoris YRC3780 は Th1 および 制御性 T 細胞の誘導を促進し、腸間膜リンパ節樹状細胞の抗原提示を介して複数の遺伝子が関与する Th1/Th2 および 制御性 T 細胞/Th17 細胞のバランスを調節することが実証されました(訳者注:Th1は細菌やウイルスなどの異物に対して細胞傷害性T細胞とマクロファージの活性化を介する細胞性免疫に関与し、Th2はB細胞からの抗体産生促進を介して体液性免疫に関与します。Th1細胞が主に細胞内病原性細菌に対して防御的に働くのに対して、Th17細胞は細胞外で増殖する細菌に対して機能を発揮する)。 |
考察 私たちの研究結果は、樹状細胞によって媒介される腸の免疫応答の調節と乳酸菌の抗アレルギー効果についての洞察を提供します。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 材料と方法 |
| 2.1. マウス |
| 2.2. 乳酸菌 |
| 2.3. 培地および試薬 |
| 2.4. 免疫細胞の調製 |
| 2.5. 細胞培養 |
| 2.6. qRT-PCR |
| 2.7. DNA マイクロアレイ |
| 2.8. ELISA |
| 2.9. フローサイトメトリー |
| 2.10. 統計分析 |
| 3.結果 |
| 3.1. L. cremoris YRC3780 は腸間膜リンパ節樹状細胞培養における制御性 T 細胞誘導因子の遺伝子発現を増強する |
| 3.2. L. cremoris YRC3780 は腸間膜リンパ節樹状細胞と T 細胞共培養システムにおける Foxp3+CD4+T 細胞の抗原特異的誘導を促進した |
| 3.3. 腸間膜リンパ節樹状細胞と T 細胞の共培養システムにおける L. cremoris YRC3780 の CD4+T 細胞の遺伝子発現に対する影響 |
| 3.4. 腸間膜リンパ節樹状細胞と T 細胞共培養システムにおける CD4+T 細胞によるサイトカイン産生に対する L. cremoris YRC3780 の効果 |
| 4. 考察 |
本文 |
| 1.はじめに |
| 腸管免疫系は、食物に対する免疫応答の誘導において極めて重要な役割を果たしている。T 細胞応答の場合、樹状細胞 (DC) が重要であり、腸管樹状細胞は他の部位の樹状細胞よりも制御性 T 細胞 (Treg) を誘導する能力が高い (1)。したがって、食物成分に対する免疫応答は腸管樹状細胞の特性によって影響を受ける可能性がある。食物成分が腸管樹状細胞に及ぼす影響については複数の報告がある (1~10) が、腸管樹状細胞による食物に対する免疫応答の調節は十分に解明されていない。 樹状細胞による制御性 T 細胞誘導促進のメカニズムに関しては、ある研究では Lactobacillus 株が腸間膜リンパ節 (MLN) 樹状細胞の網膜脱水素酵素 (RALDH) 活性を増強したことが示され (3)、別の研究では 2 つのプロバイオティクス Lactobacillus 株がインテグリン αvβ8 発現を誘導したことが報告されています (4)。しかし、このような制御についてはさらに検討する必要があります。本研究では、コーカサス地方の伝統的な発酵乳製品であるケフィアから分離された乳酸菌株 Lactococcus lactis subsp. cremoris YRC3780 がマウス 腸間膜リンパ節樹状細胞を介した応答に及ぼす影響を検討しました。 |
| L. cremoris YRC3780 は、動物およびヒトの両方の研究で花粉症の症状を改善することが示されています (11、12)。アトピー性皮膚炎様の皮膚炎症のマウスモデルでは、L. cremoris YRC3780 の経口投与により、アレルゲン誘発性皮膚反応が緩和されました (13)。この以前の研究では、腸管樹状細胞を含むさまざまな種類の免疫細胞の存在下で、L. cremoris YRC3780 がアレルゲン特異的 CD4+ T 細胞による IFN-γ および IL-12 の産生を促進し、IL-4 の産生を阻害することが実証されました (13)。 |
| 本研究では、腸管樹状細胞を介した腸管免疫応答に対するL. cremoris YRC3780の効果をさらに詳細に検討しました。腸間膜リンパ節樹状細胞の遺伝子発現、およびこれらの腸間膜リンパ節樹状細胞によって誘導されるCD4 + T細胞応答を、特に制御性 T 細胞の誘導に注目して解明しました。腸間膜リンパ節樹状細胞を使用することで、この乳酸菌が腸管樹状細胞による抗原提示を介して、Tヘルパー(Th)1細胞および制御性 T 細胞の誘導を促進し、Th2細胞の誘導を抑制し、Th1/Th2および制御性 T 細胞/Th17細胞のバランスを調節することを示すことができました。 |
| 2. 材料と方法 |
| 2.1. マウス |
| BALB/c マウスは、CLEA Japan (Shizuoka, Japan) または Charles River Laboratories Japan (Yokohama, Japan) から購入しました。BALB/c マウスの DO11.10 マウス (14) および RAG2 欠損/DO11.10 マウス (組み換え活性化遺伝子 2 を欠損した DO11.10 マウス) は、三共ラボサービス (Tokyo, Japan) から入手して飼育しました。BALB/c マウスの Toll 様受容体 (TLR)2 欠損マウス (15) は、オリエンタルバイオサービス (Kyoto, Japan) から購入しました。マウスには CE-2 飼料 (CLEA Japan) と蒸留脱イオン水を自由に摂取させ、12 時間の明暗サイクルの下、温度制御された室内の特定病原体フリー環境で飼育しました。 6~10週齢の雌BALB/cマウス、10~22週齢の雌DO11.10マウスおよびRAG2欠損/DO11.10マウス、9~10週齢の雄TLR2欠損マウスおよびその対照BALB/cマウスを使用しました。すべての実験は東京大学実験動物の飼育および使用に関する指針に従って実施され、東京大学大学院農学生命科学研究科実験動物倫理委員会の承認を得ました(承認番号P19-025、P21-044、およびP22-056)。 |
| 2.2. 乳酸菌 |
| L. cremoris YRC3780 を M17 ブロスに接種し、30°C で 16 時間培養した。その後、細菌細胞を 4°C で 8000 rpm で 10 分間遠心分離して回収し、2 回洗浄し、滅菌蒸留水に再懸濁した。100°C で 10 分間熱処理した後、細胞を凍結乾燥した (3)。L. cremoris JCM 16167 は、熱処理を 110°C で 10 分間行ったことを除いて同じ手順で調製した。L. cremoris JCM 16167 を使用した実験では、L. cremoris YRC3780 の熱処理も 110°C で 10 分間行った。 |
| さらに、L. cremoris YRC3780 細菌細胞を以下のように分画した。細菌細胞を超音波処理し、100°C で 10 分間熱処理し、1000 g で 5 分間遠心分離した。上清を次に 13000 g で 20 分間遠心分離した。上清を細胞質画分として使用した。沈殿物をドデシル硫酸ナトリウム (SDS) で 30 分間処理し、トリプシンで 37°C で 3 時間酵素処理し、13000 g で 20 分間遠心分離した。沈殿物を SDS で 30 分間処理し、洗浄した後、3% トリクロロ酢酸で 4°C で 24 時間、37°C で 24 時間処理して細胞壁画分を得た。さらに、RNA 画分を得るために、RNeasy Mini Kit (QIAGEN, Hilden, Germany) を使用して、製造元が提供するプロトコルに従って細菌細胞内の RNA を抽出しました。DNA 画分を得るために、DNase Blood & Tissue Kit (QIAGEN) を使用して、提供されたプロトコルに従って細菌細胞内の DNA を抽出しました。 |
| 2.3. 培地および試薬 |
| 100 U/mL ペニシリン G カリウム (Meiji Seika Pharma, Tokyo, Japan)、100 μg/mL ストレプトマイシン硫酸塩 (Meiji Seika Pharma,)、50 μM 2-メルカプトエタノール (Tokyo Chemical Industry, Tokyo, Japan)、0.03% l-グルタミン (FUJIFILM Wako Pure Chemical Corporation, Osaka, Japan)、および 0.2% 炭酸水素ナトリウム (FUJIFILM Wako Pure Chemical Corporation,) を含む RPMI 1640 (Nissui Pharmaceutical, Tokyo, Japan) に、最終濃度 10% になるように加熱不活化ウシ胎児血清 (FCS) (Gibco, Carlsbad, CA, United States; Sigma Aldrich, St Louis, United States) を添加して調製し、10% FCS-RPMI として使用しました。 |
| 細胞培養には、組換えヒト形質転換成長因子 (TGF)-β1 および組換えヒト潜在性 TGF-β1 を R&D Systems (Minneapolis, MN, United States) から購入しました。DMSO は Sigma Aldrich (St Louis, MO, United States) から購入しました。OVA323-339 ペプチド (OVAp) (ISQAVHAAHAEINEAGR) は Eurofins Genomics (Tokyo, Japan) から購入しました。 |
| 酵素免疫測定法(ELISA)によるサイトカイン分析では、コーティング用の一次抗体として精製ラット抗マウス IL-4(11B11)および精製ラット抗マウス IFN-γ(R4-6A2)を使用し、BD Biosciences(Franklin Lakes, NJ, United States)から購入しました。二次抗体としてビオチンラット抗マウス IL-4(BVD6-24G2)およびビオチンラット抗マウス IFN-γ(XMG1.2)を使用し、これもBD Biosciencesから購入しました。標準溶液用の組み換えIL-4および組み換えIFN-γは、Peprotech(Cranbury, New Jersey, United States)から購入しました。ストレプトアビジンアルカリホスファターゼはBD Biosciencesから購入しました。検出用の発色基質として、p-ニトロフェニルリン酸二ナトリウムをTokyo Chemical Industryから購入しました。 TGF-β1 の測定には、マウス TGF-β1 DuoSet ELISA キットと試薬希釈濃縮液 1 を R&D Systems から購入し、TMB 基質試薬セットを BD Biosciences から購入しました。 |
| フローサイトメトリー用に、精製抗マウスCD16/32抗体(93)、APC/Cy7抗マウスCD11c抗体(N418)、FITC抗マウスTCR DO11.10抗体(KJ1-26)、APC抗マウスCD4抗体(GK1.5)およびPEラットIgG2b、κアイソタイプコントロール抗体(RTK4530)はBioLegend(San Diego, CA, United States)から購入しました。FOXP3モノクローナル抗体PE(FJK-16 s)、FOXP3モノクローナル抗体PE/Cy7(FJK-16 s)およびIL-10モノクローナル抗体PE(JES5-16E3)はThermo Fisher Scientific(Waltham, MA, United States)から購入しました。 |
| 2.4. 免疫細胞の調製 |
| 樹状細胞の分離には、BALB/c マウスまたは TLR2 欠損マウスから得た腸間膜リンパ節を、0.5 mg/mL コラーゲナーゼ (FUJIFILM Wako Pure Chemical Corporation) と 10 μg/mL DNase I (Roche Diagnostics、Mannheim、Germany) を含む 10% FCS-RPMI で消化し、消化物を濾過して細胞懸濁液を得た。得られた全細胞から、磁気活性化細胞選別 (MACS) 細胞分離システム (Miltenyi Biotec、Bergisch Gladbach、Germany) を製造元の指示に従って使用して、CD11c+ 細胞を磁気的に精製した。培養用の樹状細胞として高純度の CD11c+ 細胞を得るために、磁気活性化細胞選別による CD11c+ 精製を 2 回実施した。 |
| CD4+-T 細胞の分離のために、DO11.10 マウス、RAG2 欠損/DO11.10 マウス、TLR2 欠損マウス、およびコントロール マウスから脾細胞 (SPL) を取得しました。脾細胞全体から CD4+ 細胞を 磁気活性化細胞選別システムを使用して分離しました。複数のマウスから細胞を分離し、必要な数の細胞を得るためにプールしました。 |
| DNA マイクロアレイの解析では、磁気活性化細胞選別濃縮 脾細胞 CD4+T 細胞を FACS Aria (BD Biosciences) を使用して分類し、CD4+Kj1.26+ T 細胞を得ました。染色および洗浄バッファーには、2% 加熱不活化ウシ胎児血清を含む リン酸緩衝生理食塩水を使用しました。 |
| 2.5. 細胞培養 |
| 腸間膜リンパ節樹状細胞単一培養システムでは、BALB/c マウスまたは TLR2 欠損マウス由来の 腸間膜リンパ節樹状細胞(qRT-PCR の場合は 1 × 105 細胞、フローサイトメトリーの場合は 2~4 × 105 細胞) を L. cremoris YRC3780 (特に記載がない限り 100 µg/mL) または L. cremoris YRC3780 の各画分 (10 または 100 µg/mL) とともに培養しました。培養は潜在性 TGF-β1 (10 ng/mL) の存在下でも行いました。細胞は 96 ウェル平底プレート (Corning、ニューヨーク州ニューヨーク、米国) で 200 µL の 10% FCS-RPMI とともに 37°C、5% CO2 加湿雰囲気下で qRT-PCR の場合は 18 時間、ELISA およびフローサイトメトリーの場合は 48 時間培養しました。 |
|
腸間膜リンパ節樹状細胞 と T 細胞の共培養システムでは、BALB/c マウス由来の 腸間膜リンパ節樹状細胞 (2 × 104 細胞) と DO11.10 マウスまたは RAG2 欠損/DO11.10 マウス由来の 脾細胞 CD4+T 細胞 (2 × 105 細胞) を、OVAp (訳者注:OVApは、がん抗原ペプチド)(10 nM) 存在下で L. cremoris YRC3780 と共培養しました。また、潜在性 TGF-β1 (10 ng/mL) 存在下での培養も行いました。細胞内IL-10の分析では、BALB/cマウス由来の腸間膜リンパ節樹状細胞(4×104細胞)とRAG2欠損/DO11.10マウス由来の脾細胞 CD4+T細胞(4×105細胞)をOVAp(100nM)存在下でL. cremoris YRC3780と共培養し、最後の4時間にGolgiStopタンパク質輸送阻害剤(0.1%、BD Biosciences)を添加した。培養は、腸間膜リンパ節樹状細胞単独培養システムの場合と同様に、qRT-PCRの場合は48時間または60時間、DNAマイクロアレイの場合は60時間、ELISAの場合は48時間、フローサイトメトリーの場合は72時間実施した。 |
| 2.6. qRT-PCR |
| QIAShredder (QIAGEN、Hilden, Germany) および RNeasy Mini Kit (QIAGEN) を使用して細胞から全 RNA を抽出しました。cDNA は SuperScript VILO MasterMix (Thermo Fisher Scientific) で合成しました。続いて、QuantiTect SYBR Green PCR Kit (QIAGEN) および LightCycler (Roche Diagnostics) または CFX Connect Real-Time PCR Detection System (Bio-Rad、CA, United States) を使用してリアルタイム PCR を実施しました。cDNA は特定のプライマー (補足表) を使用して増幅しました。相対的な遺伝子発現は、標的 cDNA が 1 サイクルで 2 倍になったと仮定して計算しました。結果は、内部コントロールとして GAPDH 遺伝子発現に標準化しました。 |
| 2.7. DNA マイクロアレイ |
| 解析は Cell Innovator (Fukuoka, Japan) に委託しました。抽出した全 RNA は、SurePrint G3 Mouse GE 8x60K Ver. 2.0 (Agilent Technologies、Santa Clara, CA, United States) を使用して次のように解析しました。標識は Low Input Quick Amp Labeling Kit (Agilent Technologies) を使用して行いました。次に、メーカーの指示に従ってハイブリダイゼーション、洗浄、スキャンを行いました。データは Feature Extraction ソフトウェア (Agilent Technologies) を使用して定量化し、統計解析ソフトウェア R を使用して quantile 法で正規化しました。 |
| 2.8. ELISA |
| 培養上清中のサイトカイン産生は、特異的サンドイッチELISAを用いて測定した。IL-4およびIFN-γは以下のように定量した。96ウェル免疫プレート(Nunc、Roskilde, Denmark)を一次抗体でコーティングし、4°Cで一晩インキュベートした。プレートを洗浄し、室温で2時間ブロックした後、サンプルおよび標準を添加し、室温で2時間または4°Cで一晩インキュベートした。結合したサイトカインは二次抗体で検出し、室温で1時間インキュベートした。次にプレートを洗浄し、酵素を添加し、室温で30分間インキュベートした。洗浄後、発色基質を添加した。吸光度は波長405 nmで測定した。TGF-βは、製造元の指示に従って、マウスTGF-β1 DuoSet ELISAキット(R&D Systems)で定量した。潜在性TGF-βの活性化のために、サンプルを1M塩酸(FUJIFILM Wako Pure Chemical Corporation)と室温で10分間反応させ、次に1.2M水酸化ナトリウム((FUJIFILM Wako Pure Chemical Corporation)/0.5M HEPES((FUJIFILM Wako Pure Chemical Corporation)溶液を加えて中和しました。吸光度はマイクロプレートリーダーモデル680(Bio-Rad)で測定し、データはマイクロプレートマネージャーIII(Bio-Rad)で分析しました。 |
| 2.9. フローサイトメトリー |
| 細胞は次のように染色しました。抗CD16/32抗体を4°Cで15分間添加して、Fc受容体をブロックしました。細胞を洗浄した後、細胞表面の標的タンパク質を蛍光標識抗体で4°Cで20分間染色しました。死細胞を染色するために、細胞表面を抗体で染色した後、サンプルにヨウ化プロピジウム(Sigma Aldrich)を添加し、サンプルをすぐに洗い流しました。以下に説明する細胞内染色では、固定前にヨウ化プロピジウムの代わりに固定可能な生存率染料eFluor 780(Thermo Fisher Scientific)を添加しました。細胞内Foxp3は、Foxp3/転写因子染色バッファーセット(Thermo Fisher Scientific)を使用して、製造元の指示に従って染色しました。細胞内 IL-10 も、この染色キットの同じ指示に従って染色されました。細胞表面染色後、染色キットの作業溶液を使用して細胞を固定し、4°C で 2 時間透過処理しました。次に、抗 CD16/32 抗体を 4°C で 15 分間添加して Fc 受容体をブロックし、次に蛍光標識 IL-10 モノクローナル抗体を使用して IL-10 を 4°C で 30 分間細胞内で染色しました。 |
| RALDH 活性の評価には、ALDEFLUOR アッセイ キット (StemCell Technologies, Vancouver, Canada) を使用しました。上記のように細胞表面染色とヨウ化プロピジウムによる死細胞染色を行った後、BAAA (BODIPY-アミノアセトアルデヒド) を含む ALDEFLUOR 試薬を添加し、37°C で 15 分間インキュベートしました。BAAA がアルデヒド脱水素酵素 (ALDH) と反応すると、緑色蛍光化合物 BAA (BODIPY-アミノ酢酸) が生成され、これが細胞内に保持されます。RALDH 活性は、ALDH 阻害剤 (N,N-ジエチルアミノベンズアルデヒド、DEAB) を含むコントロール サンプルと比較して確認しました。 |
| 蛍光レベルは FACS Verse (BD Biosciences) で測定され、データは FLOWJO ソフトウェア (BD Biosciences) を使用して分析されました。 |
| 2.10. 統計分析 |
| 結果は平均±SDとして示されています。統計分析には、Student t検定またはTukeyのHSD検定を使用しました。DNAマイクロアレイ解析にはRパッケージlimmaを使用し、2つの実験からそれぞれ2つのサンプルを組み合わせました(n=4)。差はp < 0.05で有意とみなされました。 |
| 3.結果 |
| 3.1. L. cremoris YRC3780 は腸間膜リンパ節樹状細胞培養における制御性 T 細胞誘導因子の遺伝子発現を増強する |
| BALB/c マウスの 腸間膜リンパ節由来の CD11c+DC を L. cremoris YRC3780 の存在下で培養した (図 1)。Aldh1a2 (RALDH2 をコード)、Itgav (インテグリン αv)、Itgb8 (インテグリン β8)、および Il10 (IL-10) の発現は、L. cremoris YRC3780 の添加によって有意にアップレギュレーションされた (図 1A~D)。TGF-β の遺伝子発現も分析したところ、有意ではないものの、数値的な増加が観察された (図 1E)。また、別のL. cremoris標準株JCM 16167でも、L. cremoris YRC 3780より若干低いレベルではあるものの、樹状細胞におけるこのような遺伝子発現の増強が観察されることがわかった(補足図S1)。レチノイン酸の産生に関与する酵素RALDH2の遺伝子発現が増強されていたため、酵素活性が実際に増強されているかどうかを確認するために、上記と同じ培養条件下でフローサイトメトリーにより、生きたCD11c +樹状細胞中のALDH +樹状細胞の割合を分析した。L. cremoris YRC3780の添加により、RALDH酵素活性を持つALDH +樹状細胞の割合が有意に増加した(図1F、G)。インテグリンαvとβ8は、TGF-βを活性化する細胞接着分子である。これらのインテグリンをコードする遺伝子の発現が増強されたため、潜在性TGF-βが実際に活性TGF-βに変換されるかどうかを確認するために、上記と同じ培養条件下で不活性TGF-β(潜在性TGF-β)を添加した。上清中のサイトカインの量をELISAで分析したが、潜在性TGF-βおよび活性TGF-βの量は、L. cremoris YRC3780の添加によって有意に変化しなかった(補足図S2)。 |
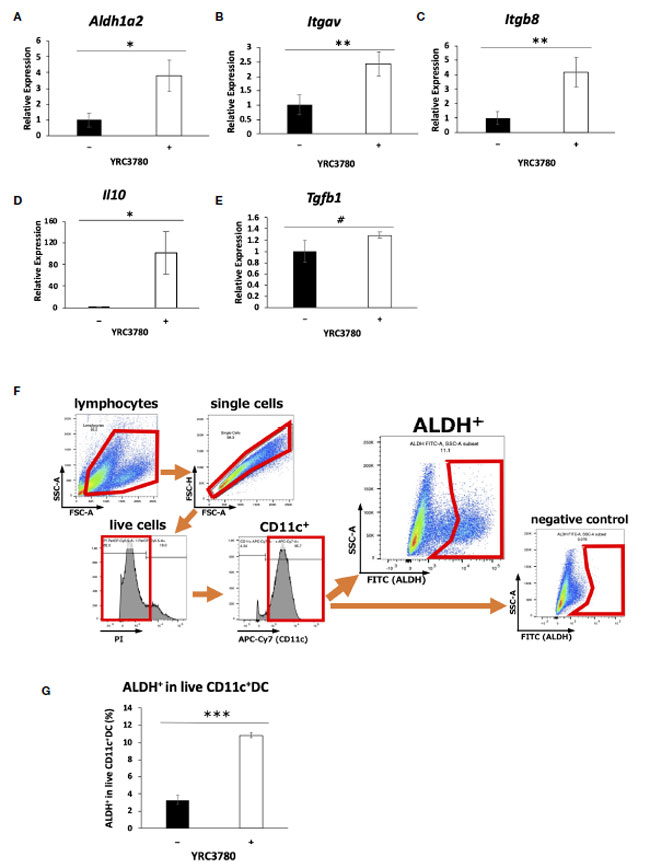 |
図 1 L. cremoris YRC3780 は 腸間膜リンパ節樹状細胞培養における制御性 T 細胞誘導因子の遺伝子発現を増強しました。 BALB/c マウスの腸間膜リンパ節樹状細胞を L. cremoris YRC3780 の存在下 (100 μg/mL) または非存在下で培養しました。 Aldh1a2 (A)、Itgav (B)、Itgb8 (C)、Il10 (D)、および Tgfb1 (E) の発現を qRT-PCR で測定しました。生 CD11c+DC 中の ALDH+DC の割合をフローサイトメトリーで分析しました (F、G)。 このプロットは 2 つの独立した実験からの代表的なデータセットを示しています。統計分析には Student t 検定を使用しました (#p<0.1、*p <0.05、**p<0.01、***p<0.001)。 |
| 多くの乳酸菌株はTLR2を介して免疫細胞に認識されるため(2、16)、腸間膜リンパ節樹状細胞によるL. cremoris YRC3780の認識におけるTLR2の関与をTLR2欠損マウスを用いて調べた。TLR2欠損マウスまたは対照群としてのBALB/cマウスの腸間膜リンパ節からのCD11c + DCを、L. cremoris YRC3780存在下で培養した(図2)。対照群およびTLR2欠損マウスの両方において、L. cremoris YRC3780の添加によりAldh1a2、Itgav、Itgb8およびIl10の発現が有意に増加したのに対し、Tgfb1の発現は変化しなかった(図2A~E)。また、フローサイトメトリーにより、生きたCD11c + DC中のALDH + DCの割合を分析した。 L. cremoris YRC3780 を添加すると、コントロールマウスと TLR2 欠損マウスの両方で RALDH 酵素活性を持つ ALDH+DC の割合が大幅に増加しました (補足図 S3、図 2F)。上記遺伝子の発現を誘導する L. cremoris YRC3780 の成分を明らかにするために、細胞質画分と細胞壁画分を調製し、樹状細胞培養物に添加しました。次に、未処理の熱処理 L. cremoris YRC3780 調製物によって安定的にアップレギュレーションされる 4 つの遺伝子 Aldh1a2、Itgav、Itgb8、および Il10 の発現を分析しました。細胞質画分は、Aldh1a2、Itgav、および Itgb8 の発現を誘導しました。発現レベルは、未処理の熱処理 L. cremoris YRC3780 の発現レベルと同等でした (図 3)。細胞壁画分は、Itgb8の発現を有意に増強し、Aldh1a2の発現を増強する傾向があり、その発現レベルは細胞質画分によって誘導されるレベルと比較して有意に異ならなかった(図3)。結果は、細胞質と細胞壁の両方の成分が腸間膜リンパ節樹状細胞によって認識されたことを示唆した。次に、細胞質画分に含まれる可能性のあるL. cremoris YRC3780 DNAとRNAの活性をさらに調べた。L. cremoris YRC3780のRNAとDNAは、Itgb8の発現を有意に増強した(補足図S4)。 |
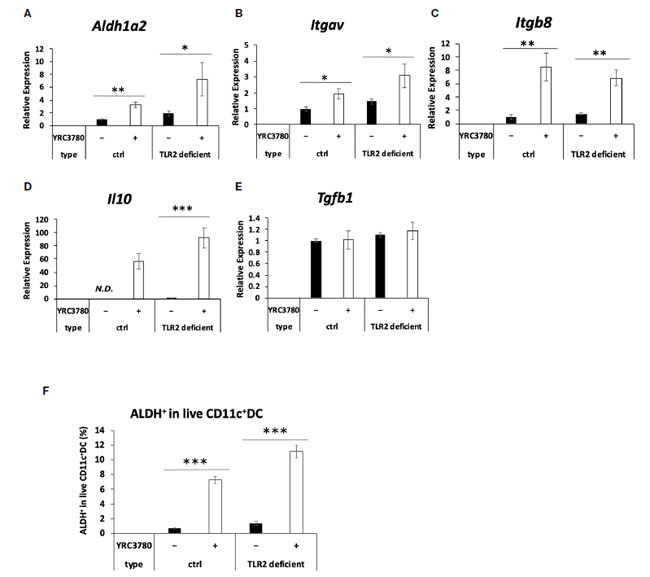 |
図 2 TLR2 欠損マウスの 腸間膜リンパ節樹状細胞培養における制御性 T 細胞誘導因子の遺伝子発現に対する L. cremoris YRC3780 の効果。 TLR2 欠損または野生型 BALB/c マウス (ctrl) の 腸間膜リンパ節樹状細胞を、L. cremoris YRC3780 の存在下または非存在下で培養しました。 Aldh1a2 (A)、Itgav (B)、Itgb8 (C)、Il10 (D)、および Tgfb1 (E) の発現を qRT-PCR で測定しました。生 CD11c+DC 中の ALDH+DC の割合をフローサイトメトリーで分析しました (F)。 プロットは、2 つの独立した実験からの 1 つの代表的なデータセットを示しています。統計分析には、スチューデント t 検定を使用しました (*p <0.05、**p<0.01、***p<0.001)。ND、検出されませんでした。 |
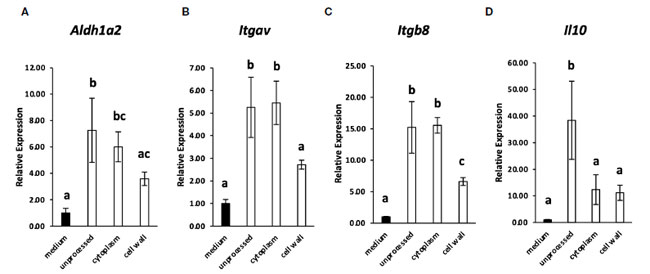 |
図 3 L. cremoris YRC3780 の細胞質および細胞壁画分が腸間膜リンパ節樹状細胞培養における 制御性 T 細胞誘導因子の遺伝子発現に及ぼす影響。 BALB/c マウスの 腸間膜リンパ節樹状細胞 を培地のみで、または未処理の L. cremoris YRC3780、細胞質画分、または YRC3780 の細胞壁画分 (100 μg/mL) の存在下で培養しました。 Aldh1a2 (A)、Itgav (B)、Itgb8 (C)、および Il10 (D) の発現は qRT-PCR によって測定されました。 このプロットは、2 つの独立した実験からの 1 つの代表的なデータセットを示しています。統計分析には Tukey の HSD 検定を使用しました。共通の文字を共有しない値は有意に異なります。 |
| 3.2. L. cremoris YRC3780 は、腸間膜リンパ節樹状細胞と T 細胞共培養システムにおける Foxp3+CD4+T 細胞の抗原特異的誘導を促進した |
| L. cremoris YRC3780 は、Foxp3+ Treg を誘導する因子 (RALDH2 およびインテグリン αvβ8) の発現を促進した。Foxp3+ T 細胞の誘導を確認するために、BALB/c マウスの 腸間膜リンパ節からの CD11c+樹状細胞 と、卵白アルブミン特異的 TCR トランスジェニック DO11.10 マウスの 脾細胞からの CD4+T 細胞を、L. cremoris YRC3780 および OVAp とともに培養した。CD4highKj1.26highT 細胞における Foxp3 発現細胞の割合をフローサイトメトリーで分析した (補足図 S5)。 DO11.10マウス由来T細胞との共培養システムにおけるFoxp3+T細胞の割合は、L. cremoris YRC3780の添加により大幅に増加しました(図4A)。 |
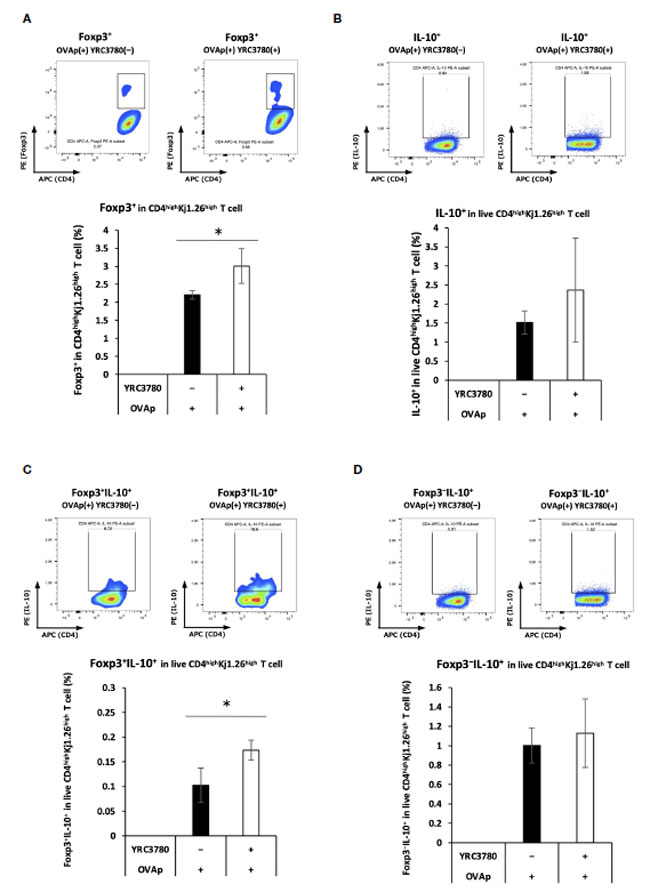 |
| 図 4 L. cremoris YRC3780 は、腸間膜リンパ節樹状細胞と T 細胞共培養システムにおける Foxp3+CD4+T 細胞の抗原特異的誘導を増強しました。BALB/c マウスの 腸間膜リンパ節からの CD11c+DC と DO11.10 または RAG2 欠損/DO11.10 マウスの 脾細胞からの CD4+T 細胞を、L. cremoris YRC3780 および OVAp とともにインキュベートしました。CD4highKj1.26highT 細胞における Foxp3 発現 (A)、IL-10 発現 (B)、Foxp3+IL-10+- (C)、および Foxp3-IL-10+ (D) 細胞の割合をフローサイトメトリーで分析しました。両グループの各集団について、代表的なフローサイトメトリー プロットを示します。各プロットは、2 つの独立した実験の代表的なデータセット 1 つを示しています。統計分析には、Student t 検定を使用しました (*p <0.05)。 |
| 遺伝子発現解析により、L. cremoris YRC3780 の添加により腸間膜リンパ節樹状細胞における IL-10 発現が増加することが明らかになりました。IL-10 の存在により IL-10 産生 制御性T細胞の誘導が促進されることから、この培養システムで CD4+ T 細胞における Foxp3/IL-10 発現を調べました。BALB/c マウスの腸間膜リンパ節からの CD11c+DC と RAG2 欠損/DO11.10 マウスの 脾細胞からの CD4+T 細胞を、L. cremoris YRC3780 および OVAp の存在下で共培養しました。生 CD4highKj1.26highT 細胞中の Foxp3/IL-10 発現細胞の割合をフローサイトメトリーで分析しました (補足図 S6)。Foxp3+IL-10+ T 細胞の割合が増加しました (図 4C)。総IL-10+T細胞の割合(図4B)にもFoxp3−IL-10+T細胞の割合(図4D)にも有意な変化は見られませんでした。 |
| 3.3. 腸間膜リンパ節樹状細胞と T 細胞の共培養システムにおける L. cremoris YRC3780 の CD4+T 細胞の遺伝子発現に対する影響 |
| L. cremoris YRC3780 が腸間膜リンパ節樹状細胞による T 細胞分化に及ぼす影響を調べるために、BALB/c マウス 腸間膜リンパ節からの CD11c+DC と RAG2 欠損/DO11.10 マウス 脾細胞からの CD4+T 細胞を L. cremoris YRC3780 と OVAp の存在下で共培養しました。抗原特異的 (Kj1.26+) CD4+ T 細胞をフローサイトメトリーで精製し、これらの CD4+T 細胞における遺伝子発現を DNA マイクロアレイで解析しました。各 CD4+T 細胞サブセットに特徴的な以下の遺伝子を特定し、L. cremoris YRC3780 の添加によるこれらの遺伝子の差次的発現を観察しました (図 5A、B)。 |
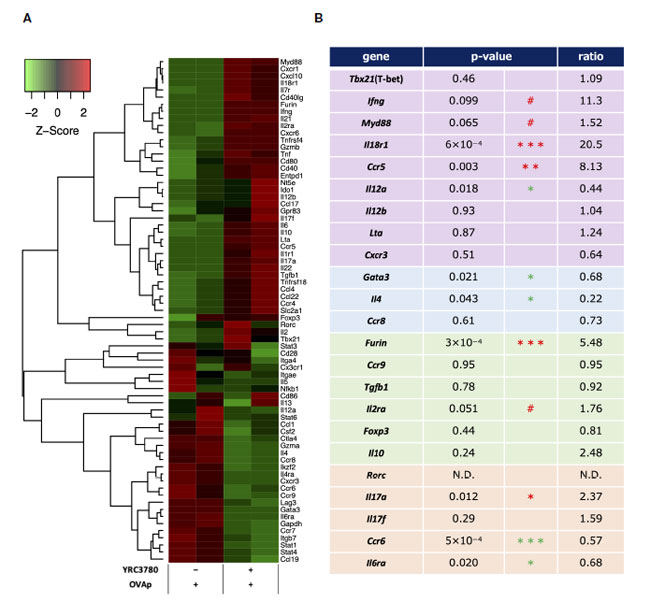 |
図 5 腸間膜リンパ節樹状細胞と T 細胞共培養システムにおける L. cremoris YRC3780 の有無での抗原刺激 CD4+T 細胞のマイクロアレイ解析。 BALB/c マウス 腸間膜リンパ節からの CD11c+DC と RAG2 欠損/DO11.10 マウス 脾細胞からの CD4+T 細胞を、L. cremoris YRC3780 および OVAp の有無で共培養しました。抗原特異的 (Kj1.26+) CD4+ T 細胞をフローサイトメトリーで精製し、これらの細胞における遺伝子発現を DNA マイクロアレイで解析しました。T 細胞分化に関連する遺伝子のシグナルは、R パッケージの gene filter を使用して Z スコア正規化によって標準化され、R パッケージの gplots を使用してヒートマップとして表されました (A)。ヒートマップは、2 つの独立した実験の代表的なデータ セットを示しています。これら2つのデータセット(B)から、個々のTサブセット関連遺伝子のp値と比率を計算した。統計解析には limma R パッケージを使用しました (#p<0.1、*p <0.05、**p<0.01、*** p<0.001、赤が増加、緑が減少)。 |
| Th1関連遺伝子のうち、Ifng(IFN-γ)、Myd88(MyD88)、Il18r1(IL-18R)、Ccr5(CCR5)の発現が増加または増加傾向にあり、Il12a(IL-12p35)の発現は減少した。Th2関連遺伝子のうち、Gata3(GATA-3)およびIl4(IL-4)の発現は減少した。制御性T細胞関連遺伝子のうち、マイクロアレイ解析によるとFoxp3(Foxp3)の発現は有意に変化しなかったが、Furin(furin)の発現は増加した。Th17関連遺伝子のうち、Il17a(IL-17A)の発現は増加し、Ccr6(CCR6)およびIl6ra(IL-6R)の発現は減少した。 Lta (LT-α; TNF-β) や Cxcr3 (CXCR3) などの Th1 関連遺伝子、Ccr8 (CCR8) などの Th2 関連遺伝子、Ccr9 (CCR9)、Tgfb1 (TGF-β)、Il10 (IL-10)、Il2ra (IL-2R; CD25) などの制御性T細胞関連遺伝子、Rorc (RORgt) や Il17f (IL-17F) などの Th17 関連遺伝子の発現も評価しましたが、有意な変化は検出されませんでした。 |
| 上記と同じ培養条件下で、CD4+T細胞サブセットの代表的な遺伝子、発現が変動する遺伝子、腸管免疫系の重要な遺伝子の発現レベルをqRT-PCRで解析した。qRT-PCR解析の結果、L. cremoris YRC3780の添加による各遺伝子の発現の増減は、DNAマイクロアレイ解析の結果と概ね一致していた(図6A~I)。一部の遺伝子では、マイクロアレイ解析では有意に変化しなかった発現が、qRT-PCR解析ではより明確に変化していた。具体的には、Th1応答関連遺伝子であるTbx21、Ifng、Il18r1の発現が有意に増加していた。 Th2応答関連遺伝子であるGata3、Il4、Ccr8の発現は有意に減少し、制御性T細胞応答関連遺伝子であるFoxp3の発現は増加する傾向がありました。これらの結果から、L. cremoris YRC3780はTh1と制御性T細胞の誘導を促進し、Th2細胞の誘導を抑制し、Th1-Th2とTreg-Th17のバランスを調節していることが示唆されました。 |
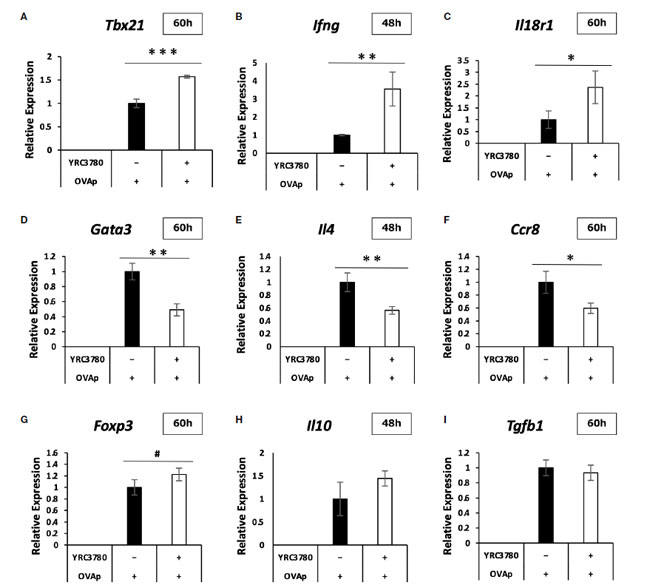 |
図 6 腸間膜リンパ節樹状細胞と T 細胞共培養システムにおける CD4+T 細胞の遺伝子発現に対する L. cremoris YRC3780 の効果。 BALB/c マウス腸間膜リンパ節からの CD11c+DC と RAG2 欠損/DO11.10 マウス 脾細胞からの CD4+T 細胞を、L. cremoris YRC3780 と OVAp の存在下で共培養しました。qRT-PCR を使用して、代表的な CD4+-T 細胞サブセット関連遺伝子の発現レベルを分析しました。Tbx21 (A)、Ifng (B)、Il18r1 (C)、Gata3 (D)、Il4 (E)、Ccr8 (F)、Foxp3 (G)、Il10 (H)、および Tgfb1 (I)。 このプロットは、2 つの独立した実験の代表的なデータセットの 1 つを示しています。統計解析にはスチューデントt検定を使用した(#p<0.1、*p<0.05、**p<0.01、***p<0.001)。 |
| 3.4. 腸間膜リンパ節樹状細胞と T 細胞共培養システムにおける CD4+T 細胞によるサイトカイン産生に対する L. cremoris YRC3780 の効果 |
| 腸間膜リンパ節樹状細胞と T 細胞共培養システムにおける遺伝子発現結果に基づいて、サイトカイン産生を ELISA で分析しました。BALB/c マウスの腸間膜リンパ節からの CD11c+DC と RAG2 欠損/DO11.10 マウスの脾細胞からの CD4+T 細胞を、L. cremoris YRC3780 と OVAp の存在下または非存在下で共培養しました。上清中のサイトカインの量を ELISA で分析しました。結果、L. cremoris YRC3780 を添加すると IFN-γ の産生が大幅に増加し、IL-4 の産生が大幅に減少することが示されました (図 7A、B)。 L. cremoris YRC3780 の添加により樹状細胞におけるインテグリン αvβ8 遺伝子の発現が促進されたことから、L. cremoris YRC3780 が共培養系において TGF-β 活性化を促進する可能性を調べるため、上記と同じ培養系に潜在型 TGF-β を添加して活性型 TGF-β の産生も解析した。しかし、活性型 TGF-β の量は検出限界以下であった(データ未掲載)。 |
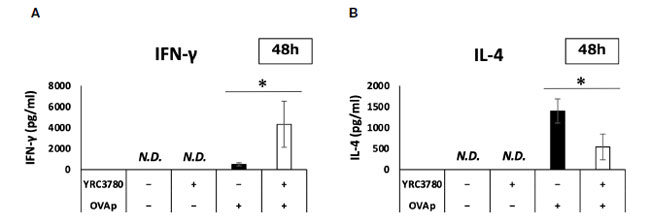 |
図 7 L. cremoris YRC3780 が腸間膜リンパ節樹状細胞と T 細胞共培養システムにおけるサイトカイン産生に及ぼす影響。 BALB/c マウスの腸間膜リンパ節からの CD11c+DC と RAG2 欠損/DO11.10 マウスの 脾細胞からの CD4+T 細胞を、L. cremoris YRC3780 と OVAp の存在下または非存在下で共培養しました。上清中の IFN-γ (A) と IL-4 (B) の量を ELISA で分析しました。プロットは、2 つの独立した実験の代表的なデータセットの 1 つを示しています。 統計分析には、Student t 検定を使用しました (*p <0.05)。ND、検出されませんでした。 |
| 4.考察 |
| ここでは、腸管免疫系を最大限に模倣し、抗原提示が起こるin vitro実験系である樹状細胞とT細胞の共培養系において、腸管樹状細胞を用いて乳酸菌の効果を検討した。この系は、実際に乳酸菌を食品成分として経口摂取したときに起こる免疫応答の変化を再現すると期待される。 |
| L. cremoris YRC3780 は、腸間膜リンパ節樹状細胞において、制御性T細胞の誘導に関与するいくつかの遺伝子の発現をアップレギュレーションすることがわかりました。RALDH2 とインテグリン αvβ8 の遺伝子発現が増加し、RALDH2 については、実際の酵素活性を持つ 樹状細胞の割合が増加しました。RALDH2 は、レチノールから誘導されるレチナールをレチノイン酸に変換する酵素であり、レチノイン酸は Treg の誘導を促進します (17)。インテグリン αvβ8 は、TGF-β の不活性型である潜在型 TGF-β に作用して、活性型 TGF-β を生成します (18)。したがって、L. cremoris YRC3780 は、レチノイン酸と活性型 TGF-β の産生を促進することで、制御性T細胞の誘導を促進したと考えられます。実際、L. cremoris YRC3780 を 腸間膜リンパ節樹状細胞と T 細胞の共培養システムに添加すると、Foxp3+CD4+T 細胞の割合が増加しました。ある研究では、Lactobacillus株が腸間膜リンパ節樹状細胞のRALDH活性を高めることが示されており(3)、別の研究では、2つのプロバイオティクスLactobacillus株がインテグリンαvβ8の発現を誘導したことが報告されています(4)。しかし、私たちの本研究は、プロバイオティクス乳酸菌が腸管樹状細胞でRALDH2やインテグリンαvβ8を含む複数の制御性T細胞誘導因子を強化し、同時にFoxp3 + CD4 + T細胞を誘導することを実証したユニークな報告です。 |
| L. cremoris YRC3780 を腸間膜リンパ節樹状細胞培養物に添加すると、TGF-β を活性化するインテグリン αvβ8 の遺伝子発現が増強されることから、活性 TGF-β を測定することで TGF-β の活性化を直接評価しようとしたが、培養上清中の活性 TGF-β の量は 腸間膜リンパ節樹状細胞培養物では変化せず、腸間膜リンパ節樹状細胞と T 細胞の共培養物では検出限界以下であった。TGF-β は細胞や潜在性 TGF-β 結合タンパク質 (LTBP)、プロテアーゼ、細胞外マトリックスタンパク質などさまざまなタンパク質に結合するため (19)、この結合が測定を妨げている可能性がある。 |
| L. cremoris YRC3780 を添加すると、腸間膜リンパ節樹状細胞で IL-10 の遺伝子発現が増加することがわかりました。IL-10 濃度の高い環境は、IL-10+腸間膜リンパ節樹状細胞の分化を促進します (20)。IL-10+Foxp3+CD4+T 細胞の頻度の増加が観察されました (図 4C)。これは、樹状細胞による IL-10 産生の増加がこの増加に寄与した可能性があります。IL-10 の増加によって Foxp3−IL-10+T (Tr1) 細胞が誘導された可能性もありますが (21, 22)、これらの細胞の割合の有意な増加は観察されませんでした (図 4D)。c-Maf や Egr-2 (22) などの Tr1 細胞の発達と機能に関連する転写因子は、マイクロアレイ解析では調べていません。厳密に区別することはできませんが、YRC 3780 株の添加によって Foxp3+IL-10- 細胞の頻度に大きな変化が見られなかったため、Tr1 細胞の影響は最小限であったと考えられます。 |
| マイクロアレイ解析とそれに続くqRT-PCRおよびELISA解析により、L. cremoris YRC3780がT細胞分化に影響を与えることが明らかになった。Th1関連遺伝子では、マスターTh1転写因子であるTbx21(T-bet)(23)の遺伝子発現が増加した。この結果は、Th1細胞への分化が促進されたことを示している。さらに、Th1サイトカインIFN-γの遺伝子発現が増加し、タンパク質の産生が増加していることを確認した。IL-18受容体であるIL-18Rおよび受容体アダプター分子であるMyD88の遺伝子発現増加に関しては、Th1細胞がIL-18R/MyD88シグナル伝達経路を介して活性化されることが報告されている(24)。したがって、私たちの結果は、L. cremoris YRC3780によるTh1分化の促進を裏付ける可能性がある。 Th2関連遺伝子については、Th2細胞のマスター転写因子であるGATA-3(25)の遺伝子発現が低下した。この結果は、Th2への分化が抑制されたことを示している。IL-4の遺伝子発現も低下しており、タンパク質の産生が低下していることを確認した。ケモカイン受容体CCR8の遺伝子発現低下については、このケモカイン受容体はTh2細胞で高発現しており、Th2応答の活性化に寄与することが報告されている(26, 27)。したがって、私たちの結果は、L. cremoris YRC3780によるTh2分化の抑制を支持するものである。制御性T細胞関連遺伝子の場合、マスター制御性T細胞転写因子であるFoxp3の遺伝子発現が増加する傾向にあり、培養において実際にFoxp3発現T細胞の割合が増加しており、制御性T細胞への分化が促進されていることを示している。また、タンパク質分解酵素であるfurinの遺伝子発現が増加した。フーリンは制御性T細胞に特異的に発現しているわけではないが、潜在性関連ペプチドと成熟TGF-βを含むTGF-βの前駆体であるプロTGF-βに作用して制御性T細胞を誘導することが知られている(19、28、29)。したがって、フーリン遺伝子発現の増加は、L. cremoris YRC3780によるTreg分化の促進を支持する可能性がある。Th17関連遺伝子の場合、IL-17aの遺伝子発現は増加したが、シグナル強度は非常に低く、マイクロアレイ解析に使用した8つのサンプルのうち7つで検出限界以下であった。また、Th17細胞のマスター転写因子であるRORγt(30)の遺伝子発現は検出されなかった。さらに、RORγtとともにTh17細胞で高発現することが知られているケモカイン受容体であるCCR6の発現は減少した(30、31)。これらの結果は、L. cremoris YRC3780 が Th17 分化に及ぼす影響は限定的であることを示唆しています。L. cremoris YRC3780 による T 細胞サブセットの調節には、T 細胞サブセットに特異的な転写因子やサイトカインだけでなく、Ccr5、Ccr6、Furin などの他の関連遺伝子も関与しているようです。 |
| L. cremoris YRC3780 を投与した TLR2 欠損マウスの腸間膜リンパ節樹状細胞では、対照マウスと同様に、Aldh1a2、Itgav、Itgb8、および Il10 の発現増加が観察されました。さらに、RALDH 酵素活性 (すなわち、RALDH 酵素活性を持つ樹状細胞の割合) は、TLR2 欠損マウスと対照マウスの両方で増加しました。これは、L. cremoris YRC3780 が TLR2 以外の受容体を介して腸間膜リンパ節樹状細胞を刺激できることを示唆しています (図 2)。L. cremoris YRC3780 の成分を認識するパターン認識受容体を特定することはできませんでしたが、結果は、細胞質と細胞壁の両方の成分が腸間膜リンパ節樹状細胞によって認識されたことを示唆しています。細胞質画分は、調べた 3 つの遺伝子 (Aldh1a2、Itgav、および Itgb8) の発現を増強しました。さらに、L. cremoris YRC3780 の DNA および RNA 画分が Itgb8 の発現を増加させることも観察されました ( 補足図 S4 )。多くの乳酸菌株は TLR2 を介して認識されますが (2、5、16、32、33)、DNA または RNA が活性成分であり、TLR3 または TLR9 などの受容体によって認識されることを示す報告もあります (2、6、16、34、35)。これは L. cremoris YRC3780 の場合にも当てはまり、細胞質の異なる成分が異なる遺伝子の発現を誘導する可能性があります。このグラム陽性株の細胞壁画分が TLR2 とは独立して活性を持っているように見えるのはむしろ驚きでした。おそらく、NOD 様受容体などのパターン認識受容体が関与している可能性があります。形質細胞様 樹状細胞を活性化する Lactococcus lactis subsp. lactis株はTLR4を刺激すると報告されているため(6)、細胞壁成分も同様のメカニズムで認識される可能性がある。 |
| 本研究では、乳酸菌株としてL. cremoris YRC3780を使用した。この株を研究した動機は、臨床研究で示されているこの株のアレルギー抑制効果のメカニズムを細胞レベルで解明することであった(11)。また、Lactobacillusなどの乳酸菌の免疫調節機能については多くの研究で報告されているが(2、16)、Lactococcusなどの乳酸球菌に関する報告はほとんどない(2、6、10)。私たちの結果は、制御性T細胞の誘導とTh2細胞分化の阻害が、このLactococcus株によるアレルギー緩和の根底にあるメカニズムである可能性を示唆している(11–13)。私たちの結果は、マウスアレルギーモデルでこの株によって観察されたTh2応答のダウンレギュレーションと一致している(12、13)。 L. cremoris YRC3780 は、炎症を軽減するために重要な抗炎症性サイトカインである IL-10 の産生も促進したため、このサイトカインも L. cremoris YRC3780 の抗アレルギー効果に関与している可能性があります。さらに、別の L. cremoris 株である JCM 16167 は、腸間膜リンパ節樹状細胞の制御性T細胞関連遺伝子の発現を促進したことから、このような活性は複数の Lactococcus 株で観察できる可能性があります。さらに、Lactobacillus 株は、腸管樹状細胞の ALDH 活性、またはインテグリン αvβ8 の発現を促進することが報告されています (3、4)。したがって、Lactobacillaceae 科などの他の乳酸菌が、RALDH2 と TGF-β 活性化インテグリンの両方の産生を促進できる可能性があります。 腸間膜リンパ節樹状細胞の遺伝子発現に関するデータは限られているため、これらの機能はこれまでの研究では明らかにされていなかった可能性があります。 |
| 制御性T細胞生成などの腸管免疫反応はさまざまな要因の影響を受けるため、in vitro 培養条件では腸内環境を完全に再現できない可能性があります。現在、花粉アレルギーマウスモデルで結果を確認するための実験を準備中です。 |
| 要約すると、腸管樹状細胞によるT細胞への抗原提示によって誘導される免疫応答に対するL. cremoris YRC3780株の効果と、これらの免疫調節効果の作用機序を分析しました。結果は、L. cremoris YRC3780がTh1および制御性T細胞(特にIL-10過剰産生制御性T細胞)の誘導を促進し、Th1-Th2および制御性T細胞-Th17のバランスを調節することを示唆しています。制御性T細胞の誘導は腸管樹状細胞による抗原提示に特有である可能性があります。T細胞サブセットの調節には多くの異なる遺伝子が関与しています。これらの特性は、乳酸菌の抗アレルギー効果を媒介している可能性があります。さらに、樹状細胞における作用機序は、TLR2以外の受容体によって媒介されることが示唆されました。私たちの研究結果は、乳酸菌が腸管免疫系に及ぼす免疫調節効果のメカニズムについての洞察を提供します。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Front Immunol. 2024; 15: 1395380. に掲載されたLactococcus lactis subsp. cremoris YRC3780 modifies function of mesenteric lymph node dendritic cells to modulate the balance of T cell differentiation inducing regulatory T cells. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


