ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(ケフィア:研究の最前線) |
発酵により、生体内で利用可能なフェノール化合物が変化し、 乳製品マトリックス中のアロニアジュースのα-グルコシダーゼ阻害効果が高まります。 |
Xue Du and Angela D. Myracle |
|
|
| 要約 |
2015 年、糖尿病の有病率は全世界で 4 億 1,500 万人に達しました。 ポリフェノールを豊富に含む食品の摂取は、糖尿病患者の血糖コントロールに役立ちます。 発酵により、一般的に低いポリフェノールの生体利用能が増加する可能性があります。 アロニア (Aronia melanocarpa) は、北米原産のポリフェノールを豊富に含むベリーです。 プロアントシアニンとアントシアニンは、アロニアに含まれる主要なフェノール化合物です。 この研究では、アロニア ケフィアは、アロニア ジュースを加えた牛乳を発酵させて作られました。 消化中のアロニア ケフィアの生体利用能ポリフェノールの変化は、in vitro モデルを使用して評価されました。 発酵がアロニア ポリフェノールの潜在的な生物活性に与える影響を評価しました。 結果によると、アロニア ケフィアの生体アクセス可能なポリフェノールは消化中に増加し、抗酸化能が高まりました (DPPH 消去の IC50 は 1 mL あたり 24.07 mg ケフィアから 1 mL あたり 8.97 mg ケフィアに減少しました)。 |
| 消化されたアロニア ケフィアは生体アクセス可能なアントシアニン (シアニジン-3-ガラクトシド、シアニジン-3-アラビノシド、シアニジン-3-キシロシド) は少なかったものの、非発酵コントロール (IC50: 1 mL あたり 484.93 mg ケフィア) と比較して、抗酸化能は同等で、α-グルコシダーゼに対する阻害活性が強かった(IC50: 1 mL あたり 152.53 mg ケフィア)。 |
| これらの結果は、発酵により、より高い抗酸化能とより優れた α-グルコシダーゼ阻害活性を持つ代謝物が生成される可能性があることを示しています。 アロニア ケフィアを食事に取り入れることは、腹部への副作用なしに血糖値をコントロールするのに役立つ良い戦略です。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 材料と方法 |
| 2.1. 化学物質 |
| 2.2. 食品材料 |
| 2.3. サンプルの準備 |
| 2.4. in vitro 消化手順 |
| 2.5. フェノール化合物の超高性能液体クロマトグラフィー分析 |
| 2.6. DPPH フリーラジカル消去アッセイ |
| 2.7. ラット腸管α-グルコシダーゼ阻害活性 |
| 2.8. 豚膵臓α-アミラーゼ阻害活性 |
| 2.9. 統計分析 |
| 3. 結果 |
| 3.1. 生体アクセス可能なフェノール化合物の定量 |
| 3.2. 抗酸化能 |
| 3.3. 炭水化物加水分解酵素の阻害活性 |
| 4. 考察 |
| 5. 結論 |
本文 |
| 1.はじめに |
| 糖尿病は過去数十年間、世界的な問題となっています。2015 年には、米国で 3,030 万人 (9.4%)、世界で 4 億 1,500 万人が糖尿病に罹患していました(1)。 糖尿病は、平均寿命の短縮や生活の質の低下と関連しています(2)。 糖尿病患者にとって、糖尿病性網膜症、神経障害、腎症などの合併症の進行を遅らせるには、厳格な血糖コントロールが不可欠です(3)。 食後のブドウ糖吸収の調整は、高血糖の管理における重要な方法の 1 つです。 合成医薬品は、糖質加水分解酵素を阻害してブドウ糖の吸収を遅らせたり減らしたりするために使用されます。薬の有効性にもかかわらず、そのほとんどは胃腸管や肝臓系に影響を及ぼす副作用があります(3,4)。 研究によると、植物由来の食物ポリフェノールは、in vitro で炭水化物加水分解酵素を阻害する同様の活性を示し、副作用なしで血糖コントロールを助ける可能性があることが示唆されています(3)。 |
| 食物ポリフェノールは、日常の食事の一部として摂取されるのが一般的です。 植物性食品、特にベリー類に多く含まれています。 一般的に、ポリフェノールは小腸内で不安定で分子サイズが大きいため、バイオアベイラビリティ(人体に投与された薬物のうち、どれだけの量が全身に循環するのかを示す指標。 生物学的利用能ともいわれる。 薬物が静脈内に直接投与される場合、バイオアベイラビリティは100%になる。)が低くなります(5)。 食品マトリックス(訳者注:食品の主要成分であるタンパク質、脂質、糖質は、口腔、消化管内で消化酵素により構成成分に分解されて腸上皮から細胞内・体内に取り込まれる。これらの分子内および分子間で相互作用し、さらに微量栄養素や低分子化合物とも会合して複雑な複合体を形成しており、その構造や相互作用は栄養素の溶解性や分散性に影響を与え、その結果、消化管内での酵素被消化性、さらに吸収率にも関与している。この食品成分の複合体を、その性質も含めてフードマトリックスと呼んでいる。栄養素や生理活性化合物は、その成分を単独で摂取した場合と、まるごとの食品として摂取した場合では、フードマトリックスの効果により消化吸収率や生体利用効率が異なる)はポリフェノールの吸収を制限または改善し、バイオアベイラビリティに影響を与える可能性があります(6)。 ポリフェノールのバイオアベイラビリティを高めるために、カプセル化を使用して消化管内での安定性を高めるなど、いくつかの方法が提案されています(7,8)。 さらに、一部の微生物は複雑なフェノール化合物を分解することができ、代謝物はより生理活性になる可能性があります(9)。 |
| アロニア(Aronia melanocarpa)は、北アメリカ東部原産のベリーです(10)。 アロニアには、ブルーベリー(生重量1gあたり没食子酸相当1~4mg)などの他の多くの植物性食品よりも多くのポリフェノール(生重量1gあたり没食子酸相当7~12mg)が含まれています(11~13)。 アロニアの渋い口当たりは、プロシアニジン含有量が多いためです。 アロニアは渋みがあり甘みがないため、生で食べることはほとんどありません。 アロニアは、伝統的にアメリカ先住民によって風邪の治療薬として使われてきまし(14)。 フェノール化合物は、アロニアの治療効果をもたらす主要な生理活性物質であると考えられています。 Park らは、インフルエンザウイルスのさまざまなサブタイプに対するアロニアの抗ウイルス活性を観察しました(15)。 ロシアでは、アロニアは高血圧症や動脈硬化症の治療に自然療法として使用されています(14)。 Loo らが実施した最近の研究では、アロニアジュースの摂取により高血圧症患者の軽度の炎症が軽減されることが示されました(16)。 Broncel らは、アロニア抽出物の摂取によりメタボリックシンドローム患者の酸化ストレスが軽減されることを観察しました(17)。 |
| ケフィアは、乳酸菌、酵母、時には酢酸菌を含む最大 30 種の微生物からなる発酵乳製品です(18)。 ケフィアの機能特性は、抗菌、抗発がん、抗炎症効果など、十分に文書化されています(19)。 ケフィアは天然に乳糖を含まないため、乳糖不耐症の人にとって優れたカルシウムとタンパク質の供給源となります。 この研究では、アロニアポリフェノールを組み込むためのマトリックスとしてケフィアが選択されました。
その理由は次のとおりです。 (1) ケフィアはタンパク質が豊富で、アロニアの口当たりの渋みを最小限に抑えることができ(20)、小腸でのポリフェノールの分解を防ぐ可能性があります(21)。 (2) ケフィアスターターの多様な微生物群は、フェノール化合物を代謝し、バイオアベイラビリティを高める可能性があります(22)。アロニアをケフィアに組み込むことは、アロニアの潜在的な健康促進特性を最適化する良い方法である可能性があります。 (3) ケフィアの酸性 pH は、アントシアニンの分解を防ぐのに役立ちます(23)。 |
|
消化は食事成分のバイオアベイラビリティに影響を与える重要なプロセスです(24)。なぜなら、消化管内の pH や酵素などの要因が成分を変化させ、その遊離および吸収挙動を変える可能性があるからです(8)。 消化中のアロニアポリフェノールの変化を理解することは、その潜在的な生物活性を評価する上で重要です。 摂取前のアロニアの機能特性は十分に研究されていますが、発酵マトリックスの変化と消化後の潜在的な抗糖尿病特性に関する知識は不明のままです。 私たちの知る限り、これは発酵乳マトリックス中のアロニアポリフェノールのバイオアクセシビリティを調べた最初の研究です。 この研究の目的は次のとおりです。 (1) ケフィア発酵が乳マトリックス中のアロニアポリフェノールの潜在的な生物活性に与える影響を調査すること。 (2)in vitroモデルを用いて、消化管におけるアロニアケフィアのバイオアクセシビリティと抗酸化能の変化を評価する |
| 2. 材料と方法 |
| 2.1. 化学物質 |
| アセトニトリル(HPLC グレード)、塩化アンモニウム、リン酸水素ナトリウム、塩酸、メタノール、塩化カリウム、チオシアン酸カリウム、水酸化ナトリウム、重炭酸ナトリウム、可溶性デンプン、尿素は、Fisher Scientific(Waltham, MA, USA)から購入しました。 2,2-ジフェニル-1-ピクリルヒドラジル(DPPH)、ジニトロサリチル酸、ギ酸、牛胆汁、p-ニトロフェニル β-D-グルコピラノシド(pnp-G)、酒石酸カリウムナトリウム四水和物、ブタ α-アミラーゼ、ラット腸粉末、HPLC 標準物質(ケルセチン、クロロゲン酸、ネオクロロゲン酸、シアニジン-3-ガラクトシド)は、Sigma-Aldrich(St Louis, MO, USA)から入手しました。 ウシ血清アルブミン、グルコース、グルコサミン塩酸塩、グルクロン酸、リパーゼ、塩化マグネシウム、ムチン、ペプシン、リン酸一ナトリウム、尿酸は MP Biomedicals (Santa Ana, CA, USA) から購入しました。 塩化カルシウムは Ward's Science (Rochester, NY, USA) から、リン酸二水素カリウムは Alfa Aesar (Haverhill, MA, USA) から購入しました。 使用した水はすべて Millipore 水システム (EMD Millipore、Billerica, MA, USA) から入手しました。 |
| 2.2. 食品材料 |
| アロニア(Aronia melanocarpa、品種「バイキング」)は、2014年の栽培シーズンにコネチカット大学(Storrs, CT, USA)から、均一な濃い紫色の見かけの熟度に基づいて収穫されました。ベリーは茎を取り除き、洗浄し、-20 °Cで保管しました。冷凍ベリーは、ガスレンジの鍋を使用して熱処理(100 °C、5分)し、家庭用ジューサー(Hamilton Beach, Southern Pines, NC,USA)でジュースにしました。ジュースはすぐに使用しました。市販のケフィアスターター(Yogourmet®, Lachute, QC, Canada)と2%ミルク(Oakhurst®,Portland, ME, USA)は、地元のスーパーマーケットで購入しました。 |
| 2.3. サンプルの準備 |
| アロニア ケフィアは、次の方法で調製しました。2% ミルクをアルミ鍋で 82 °C に加熱し、氷浴で 26 °C に冷却しました。冷却したミルクと市販のスターター (ミルク 1 クォートあたり 5 g) をガラス ボウルで混ぜました。混合物を 5 分間かき混ぜて、スターターが完全に溶解していることを確認しました。作りたてのアロニア ジュースをミルク スターター マトリックス (15%、w/w) に加え、よく混ぜました。混合物を通気性のある布で覆い、室温 (23 °C) で一晩発酵させました。24 時間発酵させた後、アロニア ケフィアを浸漬ブレンダー (Hamilton Beach®, Southern Pines, NC, USA) で均質化しました。均質化したアロニア ケフィアを密閉ガラス瓶に移し、in vitro 消化を行う前に 4 °C で 24 時間保存しました。アロニア ケフィアを 3 バッチ作成し、in vitro 消化を個別に実行しました。 |
| ケフィアスターターを加えていない牛乳とアロニアジュースを非発酵対照として使用しました。非発酵対照は、2% 牛乳と 15% (w/w) の作りたてのアロニアジュースをガラス瓶で混ぜて蓋をして作りました。混合物を 4 °C で 24 時間 (ケフィアを作る発酵時間) 保管し、その後 pH 4.5 (ケフィアの pH) に酸性化しました。酸性化した非発酵対照は、in vitro 消化プロセスを実行する前に、さらに 24 時間冷蔵庫 (4 °C) で保管しました。バッチは 3 連で作成しました。 |
| 2.4. in vitro 消化手順 |
| 消化プロセスは、摂取後の消化管におけるポリフェノールの変化を評価するために、Oomen らの改良法を使用してシミュレートされました(25)。 消化ごとに、消化管の 3 つのコンパートメント (口、胃、小腸) がシミュレートされました。 人工消化液 (唾液、胃液、腸液、胆汁) は、in vitro 消化を行う前に新鮮に調製されました。 消化液の組成は表 1 に示されています。 |
| 表1 消化液の成分 |
 |
| 有機溶液と無機溶液を蒸留水で別々に500mLに調整しました。他の成分を有機溶液と無機溶液の混合物に加え、2M NaOHまたは濃HClでpHを適切な間隔に調整しました。 |
| 消化液の pH 値は、濃 HCl または 2 M NaOH で適切な範囲に調整されました。 消化プロセスは次のように実行されました。 プロセスは、唾液を 27 mL のアロニア ケフィア (2 : 3、v/v) に加えて開始されました。 混合物を Isotemp™ ウォーターバス (Fisher's Scientific, Waltham, MA, USA) で 37 °C で 5 分間穏やかに撹拌しました。 経口消化サンプルの 3 分の 1 を取り出し、経口消化画分として収集しました。 胃消化は、残りの経口消化サンプルに胃液 (4 : 5、v/v) を加え、混合物を振とう式ウォーターバス (Edvotek®、Washington D.C., USA.) で 37 °C で 2 時間インキュベートして開始しました。 このプロセスは、食物の流入により胃の pH 環境が胃消化の開始時に安定していないため、2 つの部分から構成されています。 最初の 1 時間は、残りの経口消化物に胃液 1 部を加え、混合物の pH は調整されませんでした。 2 時間目は、混合物に胃液 3 部を加え、濃塩酸で pH を 2.0 に調整しました。 胃消化の終了時に、胃消化物の半分を取り除き、胃消化画分として収集しました。 残りの胃消化サンプルに NaHCO3 (1 M) を加えることで小腸での消化が開始され、pH は 5.7 になりました。 腸液と胆汁が混合物に加えられました (4 : 2 : 9、v/v)。 混合物の pH を 2 M 水酸化ナトリウムで 7.5 に調整し、混合物を振とう水浴で 37 °C で 2 時間インキュベートしました。 腸消化物はすべて小腸消化分画として収集しました。 収集された個々の分画の量は異なりますが、各分画には同量のアロニア ケフィア (9 mL) が含まれていました。 すべてのインキュベーションは暗所で実施し、混合物は酸素への曝露を減らすためにパラフィルムで密封しました。 消化の各段階のアロニア ケフィア コントロールは、酵素と胆汁なしで同じ手順で処理しました。 非発酵コントロールは、同じ in vitro 消化手順で処理しました。 |
| 収集したサンプルはすべて、0 °C で 10 分間、16 639 g (Eppendorf 5804R、Hamburg, Germany) で遠心分離しました。 収集した上清は、消化酵素を不活性化し、フェノール化合物を安定化するために、濃塩酸で pH 2.0 に酸性化しました(5)。 上清にメタノール (2 : 1、v/v) を加え、-20 °C で冷却してタンパク質を沈殿させました。 30 分後、混合物中のタンパク質を 0 °C で 30 分間遠心分離して除去しました (16 639 g、Eppendorf 5804R)。 サンプルは 0.20 μm シリンジ フィルター (Corning Inc.、Corning, NY,USA) で濾過し、濾過した上清の一部を -80 °C で保存してフェノール化合物の定量と抗酸化能を評価しました。 残りの濾過した上清は真空下で蒸発させて (Eppendorf Vacufuge plus、Hamburg, Germany)、メタノールを除去しました。 水性上清は C18 カートリッジ (Sigma-Aldrich、St Louis, MO, USA) で精製し、水で洗浄して還元糖を除去しました。 上清中のフェノール化合物はメタノールで溶出しました。 精製したサンプルは真空下で乾燥させ、超純水に再懸濁しました。 再懸濁したサンプルは酵素阻害活性分析のために -80 °C で保存しました。 消化は 3 回実施しました。 |
| 2.5. フェノール化合物の超高性能液体クロマトグラフィー分析 |
| ポリフェノールのプロファイルは消化中に変化するため、これらの変化を監視することは、消化管におけるポリフェノールの代謝の可能性と、消化がポリフェノールの潜在的な生物活性に与える影響を理解するために重要です。 この研究では、収集した消化物中のアントシアニンとフェノール酸 (クロロゲン酸とネオクロロゲン酸) の定量を、フォトダイオード アレイ (PDA) 検出器を備えた超高性能液体クロマトグラフィー (UPLC) (Agilent Technologies1290 Infinity、Santa Clara, CA, USA) で実施しました。 使用した方法は、Teleszko ら(26) の方法を変更したものです。分離は、C18 カラム (3 μm、150 × 4.6 mm、Thermo Scientific、Waltham, MA, USA) を使用して 25 °C で実施しました。 サンプルは 1.3 mL/分の流速で注入されました。 フェノール化合物は、水中の 4.5% ギ酸 (相 A) とアセトニトリル中の 4.5% ギ酸 (相 B) からなるグラジエント移動相で溶出されました。 グラジエントは次のとおりでした: 0 分: 相 B 1%、4.5 分: 相 B 10%、7 分: 相 B 20%、10 分: 相 B 24%、14 分: 相 B 36%、15 分: 相 B 60%、16 分: 相 B 1%。 実行後の時間は 5 分でした。 サンプルには、内部標準としてケルセチン (25 μg mL-1) が添加されました。 外部検量線は、シアニジン-3-ガラクトシド(3.9、7.8、15.6、31.2、62.5、125、250 μg mL−1、r2 = 0.9987)、クロロゲン酸(3.9、7.8、15.6、31.2、62.5、125、250 μg mL−1、r2 = 0.9999)、ネオクロロゲン酸(3.9、7.8、15.6、31.2、62.5、125、250 μg mL−1、r2 = 0.9998)標準を使用して作成されました。 アントシアニンは520 nmで検出され、シアニジン-3-ガラクトシド当量として表されました。 個々のアントシアニンは、Jakobek L. らが報告した溶出順序によって識別されました(11)。 クロロゲン酸とネオクロロゲン酸は 320 nm で検出されました。 ピーク面積を使用して定量化し、結果を 1 部あたりのポリフェノールの mg で表しました (1 部には 9 mL のアロニア ケフィアが含まれています)。 測定は 3 回繰り返して実施しました。 |
| 2.6. DPPH フリーラジカル消去アッセイ |
| ポリフェノールの抗酸化能は、その潜在的な健康効果を評価するための重要なパラメータです。本研究では、各消化画分の抗酸化能を 2,2-ジフェニル-1-ピクリルヒドラジル (DPPH) フリーラジカル消去活性によって評価しました。この方法は、Duymus ら 27 の方法からわずかに変更したものです。簡単に言うと、0.3 mM DPPH 溶液 (150 μL) と希釈サンプル (150 μL) を等量、96 ウェル プレートにロードしました。混合物を暗所で室温で 30 分間インキュベートし、Biotek プレート リーダー (ELx800、Winooski、VT、USA) を使用して 515 nm で吸光度を読み取りました。DPPH 溶液と水の混合物をこのアッセイの陰性対照として使用しました。 清掃率は次の式で計算されました。 |
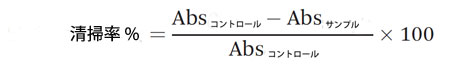 |
| 各画分の消去活性を 5 つの異なる濃度で測定し、IC50 値を計算しました。これは、DPPH フリーラジカルの 50% を消去するサンプルの濃度です。測定は 3 回繰り返して実施しました。 |
| 2.7. ラット腸管α-グルコシダーゼ阻害活性 |
| α-グルコシダーゼは、小腸で二糖類とオリゴ糖を分解してグルコースを放出する重要な炭水化物加水分解酵素です(28)。 この研究では、Oki らが報告した方法を修正してα-グルコシダーゼ阻害活性を評価しました(29)。 α-グルコシダーゼは、超音波処理を施した氷浴で pH 6.9 (1 : 30、w/v) の 0.1 M リン酸ナトリウム緩衝液を使用してラット腸粉末から抽出しました。超音波処理は 12 回 (各ラウンド 30 秒) 行い、各超音波処理後に混合物をボルテックスしました。混合物を 0 °C で 16,639 g で 10 分間遠心分離しました。上清は 0.45 μm シリンジ フィルター (Phenomenex、Torrance, CA, USA) で濾過し、アッセイで使用するまで氷上に保管しました。サンプル (50 μL) と α-グルコシダーゼ抽出物 (100 μL) を混合し、暗所で 37 °C で 10 分間インキュベートしました。対照試料の調製には水を使用しました。反応は 50 μL の 4-ニトロフェニル α-グルコピラノシド (pnp-G、5 mM) の添加によって開始しました。混合物を暗所で 37 °C で 30 分間インキュベートし、405 nm で読み取りました。背景色を補正するために、リン酸緩衝液 (0.1 M) を使用してサンプル ブランクを調製しました。腸管 α-グルコシダーゼに対するサンプルの阻害活性は次のように計算しました。 |
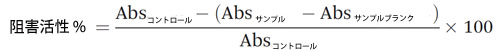 |
| 各サンプルの 5 つの希釈度を測定して IC50 値を計算しました。測定は 3 回繰り返して行いました。 |
| 2.8. 豚膵臓α-アミラーゼ阻害活性 |
| 膵臓α-アミラーゼは、小腸でグリコシド結合を加水分解して複合炭水化物の消化を開始する重要な酵素です。豚膵臓α-アミラーゼに対するサンプルの阻害効果は、Nampoothiriらが報告した方法を修正して実施しました(30)。 簡単に説明すると、0.006 M塩化ナトリウムを含むリン酸ナトリウム緩衝液(0.02 M、pH 6.9)を使用してα-アミラーゼとデンプンを溶解しました。100 μLサンプルと100 μL α-アミラーゼ溶液(100 単位 mL−1)を混合し、25 °Cで10分間インキュベートしました。100 μLデンプン溶液(1 g mL−1)を加えて反応を開始しました。混合物をさらに 10 分間 25 °C でインキュベートしました。反応は、200 μL のジニトロサリチル酸試薬を加えて停止し、混合物を 100 °C のウォーターバスで 5 分間インキュベートしました。ジニトロサリチル酸試薬は、2% NaOH (2 M、v/v) および 30% (w/v) 酒石酸カリウムナトリウム四水和物を含む水中の 1 g mL-1 ジニトロサリチル酸で作られました。混合物の温度が室温 (23 °C) に達したら、混合物 50 μL を 96 ウェル マイクロプレートにロードし、200 μL の水で希釈して 540 nm で読み取りました。サンプル ブランクは、背景色を補正するためにリン酸ナトリウム緩衝液を使用して作成しました。コントロールはリン酸ナトリウム緩衝液を使用して作成しました。サンプルの α-アミラーゼ阻害活性は、次のように計算されました。 |
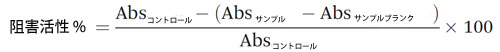 |
| 個々のサンプルの阻害活性は、5 つの異なる希釈度でテストされました。IC20 値、つまり 20% 豚膵臓 α-アミラーゼを阻害するサンプルの濃度が計算されました。測定は 3 回実施されました |
| 2.9. 統計分析 |
| データは平均±標準偏差として示されています。統計分析は SAS Studio (Cary, NC, USA) を使用して実施されました。差異を評価するために、分散分析と Tukey の HSD 事後分析を実施しました。有意水準は α = 0.05 に設定されました。 |
| 3. 結果 |
| 3.1. 生体アクセス可能なフェノール化合物の定量 |
| 消化管消化中のアロニアケフィアおよび非発酵対照における生体アクセス可能なフェノール化合物の個々の含有量を表2に示し、総アントシアニン含有量を図1に示します。 4つの主要なモノマーアントシアニン(シアニジン-3-ガラクトシド、シアニジン-3-グルコシド、シアニジン-3-アラビノシド、シアニジン-3-キシロシド)と2つの主要なフェノール酸(クロロゲン酸およびネオクロロゲン酸)が超高性能液体クロマトグラフィー分析によって特定され、定量されました。 クロロゲン酸の代謝物であるカフェ酸は検出されませんでした。 |
| 表2 アロニアケフィアと非発酵対照における個々のフェノール化合物の定量 |
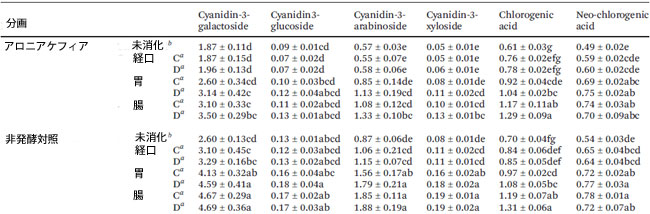 |
データは平均±標準偏差(n = 3)として示され、同じ列の同じ文字の値は、p < 0.05で有意差がありません。 a Cはコントロール(消化酵素なし)を表し、Dは消化物(消化酵素あり)を表します。 b 未消化サンプルは消化前のサンプルです。 アントシアニンは、1部あたりのシアニジン-3-ガラクトシドのmgとして表されました。クロロゲン酸は、1部あたりのクロロゲンのmgとして表されました。ネオクロロゲン酸は、1部あたりのネオクロロゲンのmgとして表されました。 |
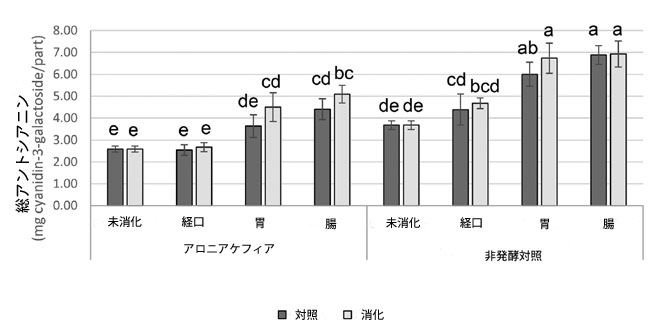 |
図 1 アロニア ケフィアと非発酵コントロール中の総アントシアニンの定量、 データは平均 ± 標準偏差 (n = 3) として示され、同じ文字のバーは p < 0.05 で有意差がありません。 |
| アロニア ケフィアのフェノール化合物のほとんどは、胃消化後に増加しましたが、シアニジン-3-グルコシドは経口消化サンプルと比較して変化がありませんでした。腸消化中、クロロゲン酸含有量が増加し(1.04 ± 0.02 mg/部から1.29 ± 0.09 mg/部へ)、その他の特定されたアントシアニンとフェノール酸は同じままでした。胃腸消化後、未消化のアロニア ケフィアと比較して、生体利用可能なアントシアニンの総量は96.9%増加しました。腸消化ケフィア中の総アントシアニンは、1部あたり5.09 ± 0.40 mg(1部 = 9 mLアロニア ケフィア)でした。市販のケフィア 1 食分は 240 mL なので、アロニア ケフィア 1 食分には 135.73 mg の生体利用可能なアントシアニンが含まれています。 |
| アロニア ケフィアとアロニア ケフィア コントロールの間では、消化の各段階でフェノール化合物に差は見られませんでした (表 2 および図 1)。腸内消化後、非発酵コントロールには、アロニア ケフィア (それぞれ 3.50 ± 0.29 mg/部、1.33 ± 0.10 mg/部、0.13 ± 0.01 mg/部) と比較して、シアニジン-3-ガラクトシド、シアニジン-3-アラビノシド、シアニジン-3-キシロシド (それぞれ 4.69 ± 0.36 mg/部、1.88 ± 0.19 mg/部、0.19 ± 0.02 mg/部) が多く含まれていました。クロロゲン酸とネオクロロゲン酸については、非発酵コントロールとアロニア ケフィアの間に差は見られませんでした。腸で消化された非発酵対照食品中の総生体利用可能アントシアニンは、消化されていない非発酵対照食品よりも88.5%高かった。消化後、非発酵対照食品におけるアントシアニンの増加は、アロニアケフィアにおける増加と比較して低かった。 |
| 3.2. 抗酸化能 |
| アロニア ケフィアと非発酵対照の抗酸化活性は、DPPH フリーラジカルの除去能を使用して測定されました。IC50 値が計算され、その結果が図 2 に示されています。アロニア ケフィアは、胃腸消化全体にわたって抗酸化能を示しました。アロニア ケフィア消化物の抗酸化能は、胃消化中に改善され (DPPH IC50 値は 1 部あたり 24.07 ± 0.78 mg から 1 部あたり 12.01 ± 0.57 mg に増加)、腸消化後も一定に保たれました (DPPH IC50: 1 部あたり 8.97 ± 0.93 mg)。アロニア ケフィア消化物は、各消化段階で対応するアロニア ケフィア対照と比較して同様の抗酸化能を示しました。アロニアケフィアと非発酵コントロールは、胃と腸での消化後に同様の抗酸化能を示しました。DPPHのIC50値と総アントシアニンの間には強い相関が見られました(r = −0.89)、またIC50値とクロロゲン酸とネオクロロゲン酸の含有量の合計の間にも強い相関が見られました(r = −0.90)。 |
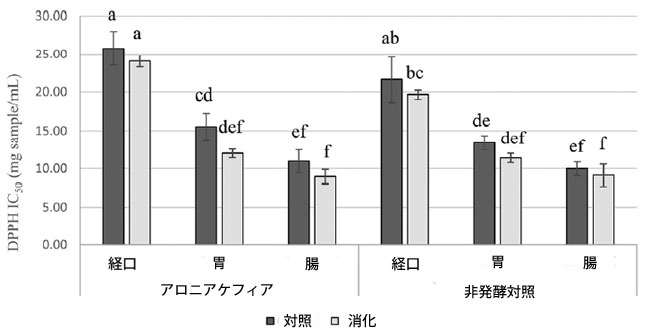 |
図 2 消化中のアロニア ケフィアと非発酵コントロールの抗酸化能、 データは平均 ± 標準偏差として表示 (n = 3)、同じ文字のバーは p < 0.05 で有意差なし。 |
| 3.3. 炭水化物加水分解酵素の阻害活性 |
| 腸内消化アロニアケフィアと非発酵対照のα-グルコシダーゼと膵臓α-アミラーゼに対する阻害効果を試験した。結果を図3と4に示す。 消化アロニアケフィアはα-グルコシダーゼに対して強い阻害活性を示し、α-アミラーゼに対しては弱い阻害活性を示した。消化アロニアケフィアは非発酵対照と比較してα-グルコシダーゼに対してより強い阻害効果を示した。α-グルコシダーゼ阻害に対するアロニアケフィアと非発酵対照のIC50値はそれぞれ1mLあたり152.53±15.24mgケフィアと365.16±48.84mg非発酵対照であった。消化したアロニア ケフィアと消化した非発酵コントロールは、膵臓 α-アミラーゼに対して同様の阻害活性を示しました。アロニア ケフィアと非発酵コントロールの α-アミラーゼの IC20 値は、ケフィア 1mL あたり 146.52 ± 5.37 mg、非発酵コントロール 1mL あたり 196.21 ± 5.50 mg でした。プレーン ケフィアは、サンプルと同じ方法で in vitro 消化システムを使用して処理されました。プレーン ケフィアの酵素に対する阻害活性は観察されませんでした。 |
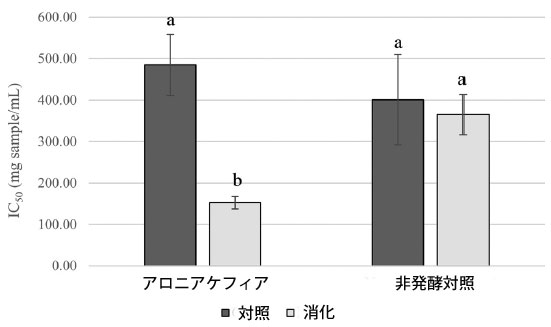 |
図 3 腸内消化アロニアケフィアと非発酵コントロールの α-グルコシダーゼ阻害活性、 データは平均 ± 標準偏差として表示 (n = 3)、同じ文字のバーには有意差はありません (p < 0.05)。 |
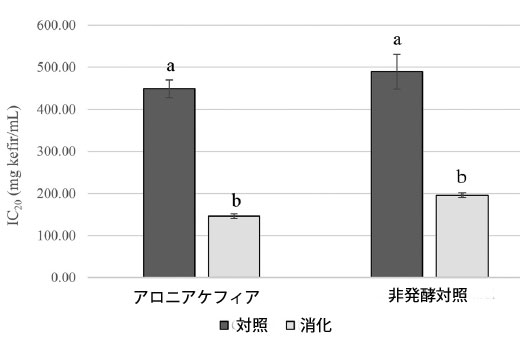 |
図 4 腸内消化アロニアケフィアと非発酵コントロールの膵臓α-アミラーゼ阻害活性、 データは平均±標準偏差(n = 3)として表示、同じ文字のバーは p < 0.05 で有意差なし。 |
| 4. 考察 |
| この研究では、模擬消化中のアロニアケフィア中のフェノール化合物の生体内利用性と抗酸化能を調べた。発酵がアロニアポリフェノールと炭水化物加水分解酵素阻害活性に与える影響を評価した。 |
| この研究で使用された in vitro 消化モデルは、口、胃、小腸という消化管の 3 つの部分をシミュレートしました。このモデルで使用された消化液 (唾液、胃液、十二指腸液、胆汁) には、対応する酵素だけでなく、消化管内のフェノール化合物をキレート化し、その生体内利用性を変化させる可能性のある塩化カルシウムなど、ヒトの消化液に存在する他の化合物も含まれていました(31)。 |
| この研究では、口内の主な消化酵素である唾液α-アミラーゼは、アロニアケフィアがタンパク質を豊富に含む飲料であり、模擬経口消化の持続時間が短いため、予想通り、アロニアケフィア中の生体アクセス可能なフェノール化合物の放出にほとんど影響を与えませんでした。 |
| 胃での消化中、酸性環境はアロニアケフィア中の遊離アントシアニンとフェノール酸の安定化に役立ちます。胃内の低 pH 環境は、フェノールタンパク質複合体からのフェノール化合物の遊離に寄与し、生体利用可能なアントシアニンとフェノール酸の増加につながります(8,32,33)。さらに、オリゴマーおよび/またはポリマーのフラバン-3-オールであるプロアントシアニンは、アロニアで最も豊富な生理活性成分です。酸性環境によるプロアントシアニンの脱重合は、モノマーアントシアニンレベルの向上に寄与し、アロニアポリフェノールのバイオアベイラビリティを高める可能性がある(34,35)。Bermudezsoto らは、食物マトリックスがない場合、消化酵素はアロニアポリフェノール含有量に影響を与えないと報告した(5)。この研究では、同様の傾向が観察され、消化酵素は胃で消化されたアロニアケフィア中のバイオアクセス可能なフェノール化合物の量を変えなかった。 |
| 小腸はほとんどのフェノール化合物の主な吸収部位であるため、生体利用可能なポリフェノールの量が重要です(36)。多くの研究で、フェノール化合物は小腸の弱アルカリ環境により不安定であることが実証されています。Bermudezsoto らは、アロニアジュースの試験管内消化後に 35% を超えるアントシアニンと 20% のフェノール酸が失われたことを実証する研究を実施しました(5)。Correa-Betanzo らも同様の結果が報告されており、試験管内消化中にブルーベリーのアントシアニンが 10%~15% に減少しました(37)。Bouayed らリンゴを試験管内で腸内消化すると、アントシアニンが完全に失われるが、フェノール酸が増加すると報告されている(38)。ただし、ポリフェノールの種類と食品マトリックスによっては、小腸で生体利用可能なポリフェノールの変化が異なる可能性がある。本研究では、アロニア ケフィアの生体利用可能なクロロゲン酸が増加し、腸内消化中にアントシアニン含有量は変化しなかった。クロロゲン酸の増加は、ケフィアマトリックスからの遊離に加えて、アントシアニンの分解に起因する可能性がある。同様の結果は、タンパク質を豊富に含む食品マトリックスを使用して、小腸でのポリフェノールの分解を防ぐ他の研究でも観察された。 Lamothe らが実施した研究では、小腸における茶ポリフェノールの安定性が乳製品マトリックス (牛乳、ヨーグルト、チーズ) によって改善されることが示されました(21)。腸内消化中のブドウアントシアニンの安定性に対する食品マトリックス (乳製品と卵) の保護効果は、Pineda-Vadillo らによって観察されました(39)。Stanisavljevic らは、食品マトリックス中のアロニアジュースの in vitro 消化後、生体利用可能なアントシアニンと総フェノール化合物が増加したと報告しました(40)。参照された研究では、アントシアニンと総フェノール含有量を、消化プロセス全体の前後でのみテストした (個々の消化段階でテストしたわけではない) ため、小腸における可溶性アントシアニンの変化は不明のままであることに注意することが重要です。消化されたアロニアケフィアと対照群の間で、アントシアニン、クロロゲン酸、ネオクロロゲン酸に有意差は見られませんでした。したがって、消化酵素と胆汁はフェノール化合物の放出に寄与しませんでした。 |
| ポリフェノールの抗酸化能力は、その健康促進特性と関連しています。ポリフェノールを摂取すると、酸化ストレスが軽減され、炎症誘発性バイオマーカーの生成が抑えられ、2 型糖尿病などの慢性疾患のリスクが低下する可能性があります(41)。摂取前には強力な抗酸化能力を持つ食品でも、消化の過程で抗酸化活性が失われる場合があります。これは、消化管内の過酷な条件や他の食品成分との相互作用によって生じる構造変化が原因です。ポリフェノールを豊富に含む食品は、in vitro 消化管消化後に抗酸化能が失われることが多くの研究で実証されており、この低下はフェノール化合物の分解に関連しています(37,42)。この研究では、腸で消化されたアロニアケフィアの抗酸化能は経口で消化されたアロニアケフィアよりも高く、消化中にフェノール化合物が徐々に放出されることがその増加に寄与している可能性があります(39)。食品が腸管腔内で抗酸化能を発揮することは重要であり、そこでは食物ポリフェノールが異常細胞の増殖とがんの進行を阻害する可能性があります(5)。さらに、腸管腔内の食物ポリフェノールは、不飽和脂肪酸を酸化から保護するなど、消化中に他の食品成分を保護する効果がある可能性があります(39,43)。ポリフェノールの不飽和脂肪酸に対する保護作用は、より健康な心血管状態に寄与する可能性があります。 |
| α-グルコシダーゼと膵α-アミラーゼは、複合炭水化物の分解に重要な役割を果たす炭水化物加水分解酵素です。これらの酵素を阻害すると、炭水化物の吸収が遅れ、高血糖や糖尿病合併症の進行を抑えるのに役立ちます。膵α-アミラーゼとα-グルコシダーゼは小腸に存在するため、本研究では腸で消化されたサンプルのみを酵素阻害活性について検査しました。酵母α-グルコシダーゼは他の研究で頻繁に使用されていますが、本研究ではラットの小腸粉末から抽出したα-グルコシダーゼを使用しています。これは、哺乳類のα-グルコシダーゼの方がヒトのα-グルコシダーゼに関連しているためです(44)。この研究では、アロニアのポリフェノールが酵素阻害活性に影響を与える主要な化合物であることが実証されました。同じ方法で処理したプレーンケフィアでは阻害活性が見られなかったためです(データ未掲載)。食事性ポリフェノールが膵臓α-アミラーゼとα-グルコシダーゼに及ぼす阻害効果は十分に文書化されています(45)。この研究では、腸で消化されたアロニアケフィアはα-グルコシダーゼに対して強い阻害活性を示し、膵臓α-アミラーゼに対してはわずかな阻害効果を示しました。膵α-アミラーゼの強力な阻害は、大腸で未消化の複合炭水化物につながり、腹痛、鼓腸、および/または下痢を引き起こす可能性があります(46)。アカルボースなどの治療薬は、膵α-アミラーゼとα-グルコシダーゼの両方に非特異的阻害効果をもたらすため、胃腸の副作用を引き起こす可能性があります。この効果により、膵α-アミラーゼよりもα-グルコシダーゼに対するアロニアケフィアの特異的阻害活性は、高血糖の管理に望ましい可能性があります(47,48)。アロニアケフィアを通常の食事に取り入れることは、副作用を引き起こすことなく食後血糖値をコントロールするための良い戦略かもしれません。 |
| 発酵により、アロニア ケフィアの生体アクセス可能なポリフェノールの組成が変化しました。消化前、アロニア ケフィアの総アントシアニン濃度は、非発酵対照よりも低かったことが観察されました。差は有意ではありませんでしたが、傾向が見られました。経口、胃、腸での消化後、アロニア ケフィアには非発酵対照よりも有意に少ないアントシアニンが含まれていました。これらの結果は、発酵によりアロニア ケフィアのアントシアニン含有量が減少したことを示しています。アロニア ケフィアと非発酵対照の間で、クロロゲン酸とネオクロロゲン酸のレベルに差はありませんでした。これは、発酵によってこれら 2 つのフェノール酸の量が変化しなかったことを示しています。さらに、アロニア ケフィアのクロマトグラム (320 nm と 280 nm) では、消化前と消化の各段階で、非発酵コントロールと比較して新しいピークが観察されました (データ未掲載)。この観察結果は、発酵によって代謝物が生成されたことを示しています。アントシアニンの分解がフェノール代謝物の発生源である可能性があります(49)。代謝物はサイズが小さいため、親化合物に比べて吸収されやすく、生物学的利用能が高い可能性があります(9,50)。発酵の影響をよりよく理解するには、代謝物の特定が必要です。発酵は、総アントシアニンのレベルを低下させたにもかかわらず、アロニア ポリフェノールの抗酸化能に影響を与えませんでした。これらの結果は、発酵によって親化合物よりも高い抗酸化能を示す代謝物が生成される可能性があることを示しています。発酵がフェノールを多く含む食品の抗酸化能を高めることは、他の研究でも観察されています。Curiel らが実施した研究では、乳酸菌による発酵により、マートルベリーホモゲネートの抗酸化能が高まったことが観察されました(51)。さらに、Hunaefi らは、24 時間の乳酸発酵により、赤キャベツの芽に含まれるフェノール化合物の総量は減少しましたが、抗酸化活性は増加したと述べています(52)。Zhao らも、乳酸菌による発酵により、茶抽出物中のフラバン 3 オール含有量が減少し、フェノール酸誘導体が増加したと報告しています(22)。抗酸化活性が上昇したという証拠もありました(22)。これらの結果は、発酵がさまざまな食品マトリックス中の食物ポリフェノールの抗酸化能を高める実行可能な方法である可能性があることを示しています。 |
| 発酵により、アロニアポリフェノールのα-グルコシダーゼ阻害活性が高まりました。これは、アロニアケフィアのIC50値(1mLあたり152.53 mgケフィア)が非発酵対照(1mLあたり365.16 mg非発酵対照)よりも低いことから結論付けられます。消化されたアロニアケフィアのより強い炭水化物分解酵素阻害効果は、発酵によって生成されたポリフェノールの代謝物によるものと考えられます。Frediansyahらは、乳酸菌による発酵により黒ブドウジュースのα-アミラーゼおよびα-グルコシダーゼに対する阻害活性が高まるという同様の結果を観察しました(53)。発酵は、食物ポリフェノールの炭水化物分解酵素阻害活性を高める効果的な戦略である可能性があります。 |
| アロニアポリフェノールの潜在的な利点を理解するために、炭水化物分解酵素阻害活性と抗酸化能を利用するのがより適切な基準です。この研究では、非発酵対照と比較してアロニアケフィア中のアントシアニン(シアニジン-3-ガラクトシド、シアニジン-3-アラビノシド、シアニジン-3-キシロシド)のレベルが低下していることが観察されましたが、発酵により抗酸化能を変えることなくアロニアポリフェノールのα-グルコシダーゼ阻害活性が増加しました。発酵は、アロニアポリフェノールの潜在的な生物活性を高め、食後血糖コントロールを促進するための優れた戦略です。したがって、発酵は、機能性食品としてのアロニアケフィアの健康に有益な特性を高めるための効果的な方法である可能性があります。食物ポリフェノールのバイオアベイラビリティを改善する発酵の潜在的作用をよりよく理解するには、さらなる研究が必要です。 |
| 5. 結論 |
| この研究では、アロニアケフィアのポリフェノールの安定性と生体内利用性を、in vitro 胃腸消化モデルを使用して評価し、発酵がアロニア ポリフェノールに与える影響を評価しました。消化後、アロニアケフィアの生体内利用性ポリフェノールと抗酸化能が増加しました。消化されたアロニア ケフィアは、α-グルコシダーゼに対する強い阻害活性を示しましたが、膵臓 α-アミラーゼに対する阻害活性は弱かった。腸内消化されたアロニアケフィアには、腸内消化された非発酵コントロールと比較して、シアニジン-3-ガラクトシド、シアニジン-3-アラビノシド、シアニジン-3-キシロシドが少なく含まれていましたが、同様の抗酸化能を示しました。発酵により、アロニア ポリフェノールの α-グルコシダーゼに対する阻害活性が高まりました。結論として、アロニア ケフィアの摂取は、副作用なしに血糖値のコントロールに役立つ可能性があります。発酵は、食物ポリフェノールのバイオアベイラビリティを高めるための優れた戦略である可能性があります。発酵が食物ポリフェノールのバイオアベイラビリティに及ぼすプラスの影響をよりよく理解するには、アロニア ケフィアの代謝産物を特定する必要があります。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Food Funct., 2018, 9, 2998–3007に掲載されたFermentation alters the bioaccessible phenolic compounds and increases the alpha-glucosidase inhibitory effects of aronia juice in a dairy matrix following in vitro digestion. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


