ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(ケフィア:研究の最前線) |
ケフィアペプチドは、脂質代謝調節を介して高脂肪食誘発肥満ラットの |
Yu-Tang Tung et al. Mol. Nutr. Food Res. 2018, 62, 1700505 |
|
スコープ:肥満は世界中で流行の割合に達しています。肥満は、高い罹患率を伴う多数の深刻な健康合併症に関連する複雑な代謝障害です。本研究では、高脂肪食(HFD)によるラットの肥満に対するケフィアペプチドの効果を評価しました。 |
はじめに |
|
肥満は世界的に、特に発展途上国と先進国で流行の割合に達しています。5歳未満の子供と成人の肥満は、2013年と2014年にそれぞれ4200万人以上、19億人以上と推定されました [1] 。肥満は複雑な代謝障害であり、罹患率の高い多数の深刻な健康合併症に関連しています。2型糖尿病、冠状動脈硬化性心疾患、高血圧や高脂血症などの心血管疾患を含みます。肥満は、過剰な脂肪重量と、脂肪細胞の過形成および肥大に起因する脂肪組織の拡大を特徴とし、これが体重増加を引き起こします。肥満は、エネルギー摂取量と消費量の不均衡であり、遺伝的、環境的、心理社会的要因間の相互作用が原因で発生します [5] 。 肥満の治療への利用可能な薬理学的アプローチには、いくつかの副作用が含まれます。したがって、多くの科学者が天然物由来の抗肥満薬に関心を持っています [6,7] 。ケフィアはコーカサス山脈に起源があり、ケフィア粒と呼ばれる菌体外多糖とタンパク質の複合体に含まれる乳酸菌と酵母によるミルクの共生発酵によって伝統的に生産されます。ケフィアは、高コレステロールの治療、胃腸疾患、アレルギーと喘息、抗菌作用、腫瘍抑制、創傷治癒の速度の増加、高血圧と虚血性心疾患の予防など、幅広い健康上の利点と関連しています [8–10] 。私たちの以前の研究は、ケフィアペプチドがマウスモデルで高フルクトースコーンシロップによって誘発される非アルコール性脂肪性肝疾患を予防することを最初に示しました。さらに、ケフィアは豊富な天然生理活性ペプチドを含み、アンジオテンシン変換酵素阻害、抗血栓、ミネラル結合、オピオイド、免疫調節、抗菌、抗酸化効果などのさまざまな生物学的活性を示します [12–15] 。 本研究では、ケフィアペプチドの抗肥満効果を評価しました。私たちは動物に、大豆油8%とケフィアペプチドを添加した甘くした練乳44%を含む適度な高エネルギー食を8週間与えました。脂質生成経路と脂質酸化経路に関与するいくつかのタンパク質の発現は、ケフィアペプチド処理後に測定されました。炎症遺伝子(TNF-α、IL-6、IL-1β、およびTGF-β)の発現レベルも評価して、ケフィアペプチド治療後の酸化的損傷状態を監視しました。 |
結果 |
|
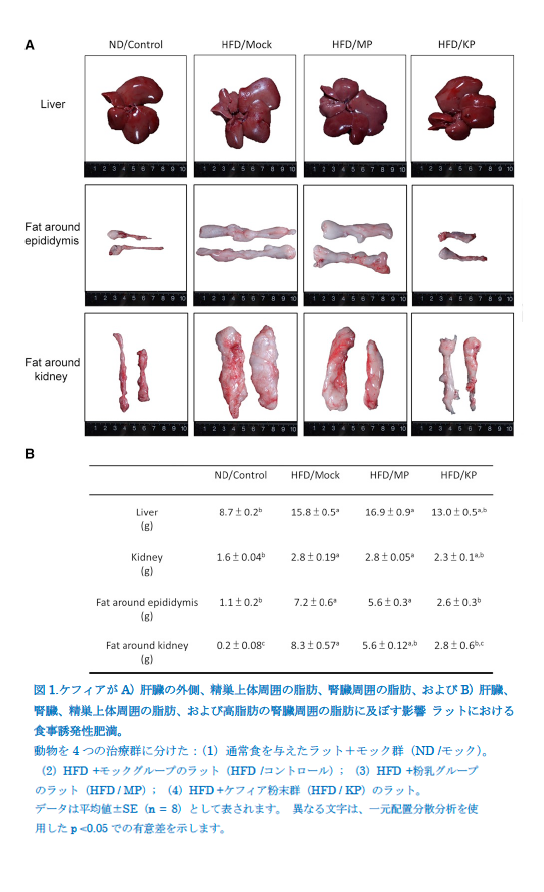
HFD誘発肥満ラットの精巣上体と腎臓の腫瘤周辺の肝臓、腎臓、脂肪体に対するケフィアペプチドの影響 研究の終わりに、肝臓、腎臓、精巣上体周囲の脂肪体および腎臓組織の重さを量りました(図1)。精巣上体と腎臓の周りの脂肪体は、体内の白い脂肪組織でした。HFD /モック群は、研究の終わりに、肝臓、腎臓、精巣上体周囲の脂肪体、および腎臓重量周囲の脂肪体(図1AおよびB)を有意に増加させました(p <0.05)。HFD /モックグループの初期BWはHFDグループと有意差はありませんでしたが、HFD /モックグループと比較してHFD / KPグループのBWゲインは低くなりました(p <0.05)(補足情報表S3)。ND /コントロール、HFD /モック、HFD / MP、およびHFD / KPグループの精巣上体周囲の脂肪は、それぞれ1.1±0.2、7.2±0.6、5.6±0.3、および2.6±0.3 gでした。 ND /コントロール、HED /モック、HED / MP、およびHED / KPグループの腎臓の周囲の脂肪は、それぞれ0.2±0.1、8.3±0.6、5.6±0.1、および2.8±0.6 gでした。精巣上体と腎臓の周りの脂肪体量は、ND /対照群よりもHFD /モック群の方がそれぞれ5.55倍(p <0.05)と40.50倍(p <0.05)大きかった。ただし、HFD / KPグループでは、HFD /モックグループと比較して、精巣上体と腎臓の周囲の脂肪体がそれぞれ64%(p <0.05)および66%(p <0.05)大幅に減少しました(図1B)
|
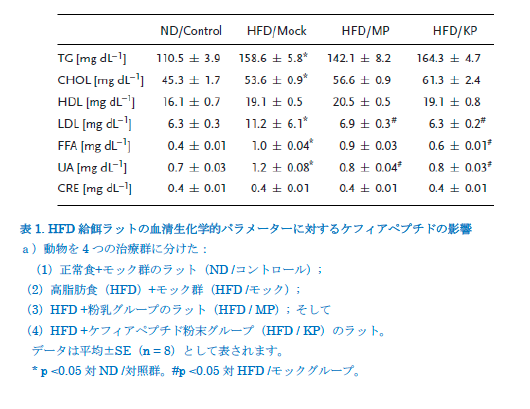
HFD誘発肥満ラットの血清生化学的パラメーターに対するケフィアペプチドの影響 表1は、異なる処理ラット群の血清TG、CHOL、HDL、LDL、FFA、UA、およびCREレベルを示しています。 Sprague DawleyラットのHFDは、TG、CHOL、LDL、FFA、およびUAの血清レベルを44%(p <0.05)、18%(p <0.05)、78%(p <0.05)、150%(p NDと比較して、それぞれ<0.05)、および71%(p <0.05)。処理群へのケフィアペプチド補充(HFD / KP)は、HFD /モック群(p <0.05)と比較して、LDL(44%)、FFA(40%)、およびUA(33%)の血清レベルを有意に減少させました。
|
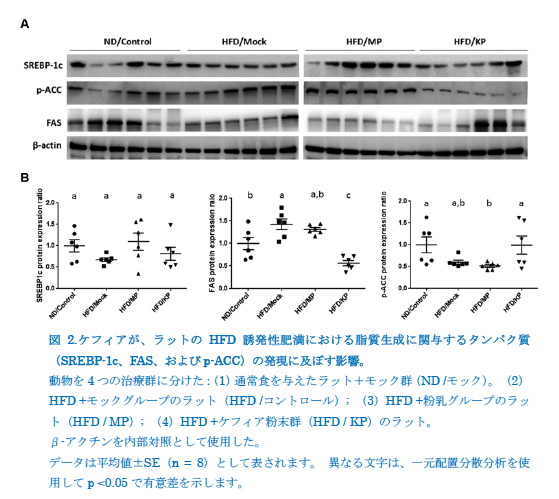
HFD誘発肥満ラットの脂質生成と脂質酸化に関与するタンパク質の発現に対するケフィアペプチドの影響 脂質生成(SREBP-1c、FAS、およびp-ACC)と脂質酸化(p-AMPK、PPAR-α、およびCPT1)に関与するタンパク質の発現パターンを、ウエスタンブロット分析を使用して4つの実験ラットグループで評価しました。 図2は、肝臓の脂質生成の調節におけるケフィアペプチドの効果を媒介する分子メカニズムを示し、SREBP-1c、FAS、およびp-ACCのタンパク質発現を分析しました(図2A)。SREBP-1c発現の有意差は、4つのグループ間で観察されませんでした。ただし、FAS式は、ND /コントロールグループと比較してHFD /モックグループで43%大幅に増加しました(p <0.05)。 HFD / KPグループはHFD /モックグループ(p <0.05)と比較してFAS式の61%の有意な減少を示しました。リン酸化ACC(p-ACC)のレベルは、ND /コントロールグループと比較して、HFD /モックグループおよびHFD / MPグループでそれぞれ45%および52%減少しました。しかし、HFD / KPグループは、HFD / MPグループと比較してp-ACCレベルの有意な増加を示しました(p <0.05)。これらの結果は、KPが脂質酸化の刺激と脂質生成経路の阻害を介して脂肪体沈着に影響を与えたことを示しています。
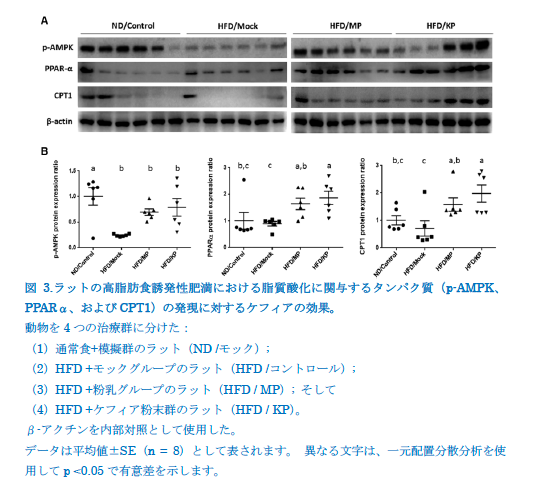
図3は、脂質酸化に関与するタンパク質(p-AMPK、PPAR-α、CPT1)の発現に対するKPの影響を示しています。HFD /モックグループは、ND /コントロールグループ(p <0.05)と比較して、76%のp-AMPKの大幅な減少を示し、HFD / KPグループは、224%のp-AMPKの大幅な増加を示しました HFD /モックグループ(p <0.05)。HFD / KPグループは、p-ACCに付随するp-AMPKの有意な増加を示しました。これは、脂肪酸合成を阻害する適応メカニズムを示唆しています。ND /コントロール群とHFD /モック群の間で、PPAR-αとCPT1に有意差は観察されませんでした。ただし、PPAR-αおよびCPT1タンパク質の発現は、HFD / Mockグループと比較して、HFD / MPおよびHFD / KPグループで有意にアップレギュレートされました(p <0.05)。HFD / KPグループは、p-AMPKとp-ACCの増加を示し、肝臓でのTG蓄積を減少させました。 |
HFD誘発肥満ラットのTNF-α、IL-6、IL-1β、およびTGF-βのmRNAレベルに対するケフィアペプチドの影響 |
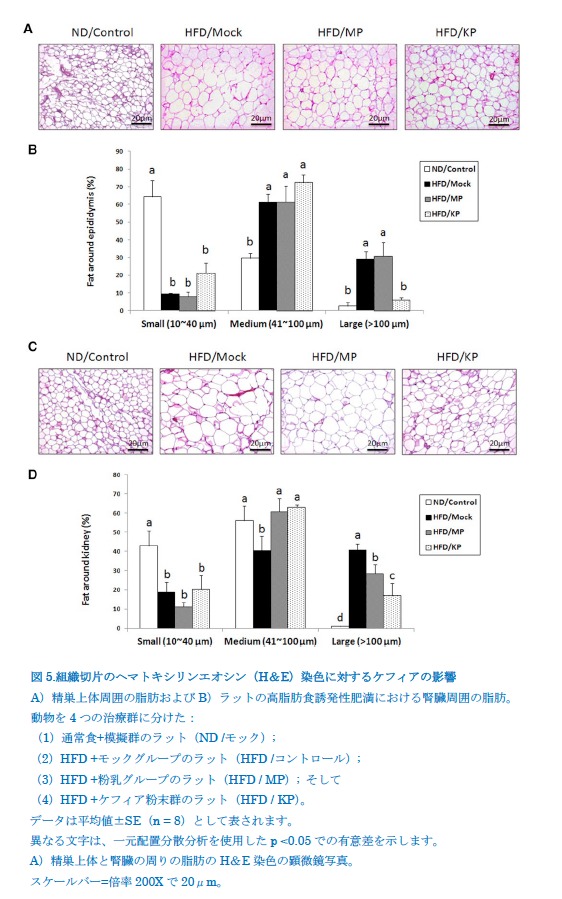
HFD誘発肥満ラットの精巣上体および腎臓組織周辺の脂肪体の組織化学的染色に対するケフィアペプチドの影響
|
議論 |
ケフィアは、ケフィア粒で作った発酵乳飲料です。ケフィア粒は、乳酸菌、酵母、酢酸菌を含む微生物共生混合物です [27,28] 。ケフィアは、免疫系の調節、乳糖不耐症の症状の軽減、コレステロールの低下、抗酸化作用、抗炎症作用、消化促進作用、抗発癌作用など、数多くの生物学的活動を示します。[28–31] Ebner et al. [12]は、アンギオテンシン変換酵素阻害作用、抗菌作用、免疫調節作用、オピオイド作用、ミネラル結合作用、抗酸化作用、および抗血栓作用を持つ16ペプチドを含む、ウシケフィアからの236カゼイン由来のユニークなペプチドを特定しました。現在のin vitroデータは、ケフィアが脂肪生成転写因子発現のダウンレギュレーションを介して3T3-L1脂肪細胞の分化を阻害することを示しました。以前のin vivo動物研究では、ob / obマウスをケフィアで治療すると、脂肪生成経路の阻害を介して、BW、エネルギー消費、および基礎代謝率の非アルコール性脂肪性肝疾患が大幅に改善されることが示されました。 Chen et al. [15]は、KPが、JAK2 / STAT3およびJAK2を介したJAK2シグナル伝達の活性化を介して、高フルクトース誘発脂肪肝動物モデルにおける/ AMPK経路において、BW、エネルギー摂取、炎症反応、脂肪肝の形成などの非アルコール性脂肪肝疾患のいくつかの症状を改善することも実証しました。本研究は、初めて、KPがHFD誘発性肥満ラットの肥満を改善することを実証しました。さらに、脂肪酸代謝におけるKPの明確な機能を解明するために、オレイン酸誘発脂肪肝細胞モデルを確立し、KFPの異なる画分で処理しました。オイルレッドO染色分析のデータは、ケフィアペプチドパウダーと3つの異なるKFP画分(> 30 kD、3–30 kD、および<3 kD)が、0.66 mMオレイン酸処理後の肝細胞の脂肪酸蓄積を有意に減少させることを示しました(サポート情報図S2)。遺伝子発現レベルでは、オレイン酸誘発性脂肪肝細胞におけるケフィアペプチドまたは3つの異なるKFP画分による治療も実証され、ACCおよびFAS(脂質合成関連遺伝子)のmRNAレベルが大幅に低下し、AMPKおよびCPT1(脂質酸化-関連遺伝子)は、特に3 kD未満のKFP治療群で有意に増加しました(補足情報図S3)。 肥満は異常または過剰な脂肪蓄積として定義され、発展途上国および先進国の健康を損なう可能性があります。前脂肪細胞の増殖は、体重増加の期間中の脂肪細胞数を増加させ、前脂肪細胞は成熟脂肪細胞に分化し、これがTGを蓄積して肥大する。ラットモデルにおけるHFD誘発性肥満内臓腔の病因は、ヒトと同様です。本研究では、HFD誘発性肥満のラットに対するケフィアの唯一のペプチドの混合物であるKPの効果を調査しました。KPは、8週間毎日サプリメント(164 mg kg–1)として投与されました。KPによる治療は、HFD誘発BWゲイン、腹膜および精巣上体脂肪体の脂肪組織重量、および脂肪細胞サイズを改善しました(図1および5)。内臓腔の体脂肪は、糖尿病、高脂血症、高血圧、および動脈硬化の複数の危険因子の主要な原因です。以前の研究は、肥満がTG、CHOL、LDLの増加やHDLの減少など、血漿脂質に悪影響を与えることを実証しました。 本研究は、肥満ラットが実際にTG、CHOL、LDL、FFA、およびUAの上昇を示し、KPがLDL、FFA、およびUAのレベルを低下させ、脂肪細胞の分化を部分的に阻害する可能性があることを示しました(表1)。ケフィアペプチドによる処理は、TGが吸収に必要なMGまたはFFAに加水分解されなかったため、血清TGをわずかに増加させました(表1)。ケフィアは、そのペプチドが肝臓での消化と脂肪吸収を阻害するため、非アルコール性脂肪性肝疾患を効果的に防止する可能性があります。私たちの以前の研究[22]は、140 mg kg–1 BWのケフィアでob / obマウスを治療すると、模擬治療したob / obマウスと比較して、肝臓のTGとCHOL(それぞれ26と27%)が大幅に減少することを示しました。ただし、血清TGおよびCHOLレベルはケフィアと模擬治療ob / obマウス間で有意差はなかった。Hyson et al.[37]は LDLの血中濃度とその酸化は心血管リスクと関連しており、LDLは健康の主要な指標であることを示しました。したがって、ケフィアペプチドによる治療は、LDL含有量を減らして心血管疾患の発症を保護する可能性があります。 FASは肝臓での脂肪酸合成における主要な酵素です。本研究における肥満ラットはFASタンパク質の上昇を示し、KPによる治療はFAS含有量を有意に減少させた。これらの結果は、KPが脂質生成を介してFFAレベルを低下させたことを示唆しています。p-AMPKは、ACCの阻害とp-ACCの活性化を介して脂肪酸の代謝を調節し、最終的には脂肪酸のβ酸化を刺激し、脂肪酸の生合成をダウンレギュレートします。肝臓のp-AMPKが増加すると、PPAR-αおよびCPT1の産生が刺激され、脂肪酸の酸化が増加します。本研究ではFASが大幅に減少し、KPs治療によりp-ACC、p-AMPK、PPAR-α、およびCPT1レベルが大幅に増加しました。これらの結果は、KPがHFD誘発肥満ラットにおける脂質生成の阻害および脂質酸化の刺激を介して脂質蓄積を改善したことを示しています。 結論として、ケフィアペプチドはHFD誘発性肥満の脂質代謝経路を仲介する可能性があります。まず、KPによるHFD誘発肥満ラットの治療により、FAS酵素が大幅に減少し、脂質生成を阻害するためにp-ACCタンパク質が増加することがわかりました。第二に、KPはp-AMPK、PPAR-α、およびCPT1の発現の増加を介して脂肪酸酸化を増加させました。第三に、KPの投与は炎症反応(TNF-α、IL-1β、およびTGF-β)を有意に減少させ、酸化的損傷を調節しました。これらの結果は、KPがBW増加、炎症反応、精巣上体と腎臓の周囲の脂肪組織脂肪沈着の形成、および脂肪生成の阻害と脂質酸化の刺激を介した脂肪細胞サイズを含む肥満を明らかに改善したと考えられました。 |
略語 |
ACC:アセチル-CoAカルボキシラーゼ AMPK:AMP活性化タンパク質キナーゼ BW:体重 CHOL:総コレステロール CPT1:肝カルニチンパルミトイルトランスフェラーゼ-1 CRE:クレアチニン FAS:脂肪酸シンターゼ FFA:遊離脂肪酸 H&E:ヘマトキシリンおよびエオシン HDL:高密度リポタンパク質 HFD、高脂肪食; KFP:ケフィア発酵ペプチド KP:ケフィアペプチド LDL:低密度リポタンパク質 MP:粉乳 PPAR-α、ペルオキシソーム増殖因子活性化受容体-α; SE:標準エラー TG:トリグリセリド UA:尿酸 |
|
この文献はMol. Nutr. Food Res. 2018, 62, 1700505に掲載されたKefir Peptides Prevent Hyperlipidemia and Obesity in High-Fat-Diet-Induced Obese Rats via Lipid Metabolism Modulationの一部を省略して日本語に訳したものです。タイトルをクリックして原論文の全文を英文で読むことが出来ます |