ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
睡眠の質と健康における腸内微生物叢の役割: 腸内微生物叢をサポートする食事戦略 |
Monika Sejbuk , Adam Siebieszuk , Anna Maria Witkowska |
|
|
| 要約 |
食物繊維、不飽和脂肪酸、ポリフェノールなどの食事成分は、食事のタイミングと間隔とともに、質の高い睡眠と健康全般に不可欠な様々な代謝物を産生する腸内細菌叢の能力に大きな影響を与えます。本レビューでは、短鎖脂肪酸、トリプトファン、セロトニン、メラトニン、γ-アミノ酪酸などの様々な代謝物を介して睡眠を調節する腸内細菌叢の役割を探ります。植物性食品を豊富に含むバランスの取れた食事は、これらの睡眠を調節する代謝物の産生を促進し、健康全般に有益な可能性があります。本レビューは、食習慣が腸内細菌叢の構成、産生する代謝物、そしてそれが睡眠の質や関連する健康状態に及ぼす影響について調査することを目的としています。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 方法 |
| 3. レビュー |
| 3.1. 腸内細菌叢は宿主の概日リズムにどのように影響するのか? |
| 3.2. 概日リズム、クロノタイプ、そして腸内細菌叢との相互作用:睡眠調節への洞察 |
| 3.3. 腸内細菌叢由来代謝物と睡眠パターンへの影響 |
| 3.3.1. 短鎖脂肪酸(SCFA) |
| 3.3.2. トリプトファンの代謝とセロトニン産生 |
| 3.3.3. メラトニン |
| 3.3.4. γ-アミノ酪酸(GABA) |
| 3.4. 睡眠障害と腸内細菌叢の乱れに起因する合併症 |
| 3.5. 腸の健康に影響を与える食事要素と栄養戦略 |
| 3.5.1. 食事のタイミングと食事間隔 |
| 3.5.2. 食物繊維 |
| 3.5.3. ポリフェノール |
| 3.5.4. 脂肪の質と量 |
| 3.5.5. ショ糖と果糖 |
| 3.5.6. 過剰な肉の摂取 |
| 3.5.7. アルコール |
| 4. 強みと限界 |
| 5. 要約 |
| 6. 結論 |
本文 |
| 1.はじめに |
| 腸内細菌叢とは、ヒトの消化管に生息する数百万種の微生物を指します[1]。その多様性は、出生前から健康に大きな影響を与え、民族や性別など多くの要因の影響を受けます。一方、腸内マイクロバイオームは、これらの微生物だけでなく、それらが産生する代謝物、遺伝物質、その他の環境条件も含むより広範な概念です[2]。出生から生涯を通じて、マイクロバイオームは健康に大きな影響を与える動的な変化を経験します。 |
| 満期新生児では、腸内細菌叢の構成は分娩方法や授乳方法によって変化します[3]。自然分娩では、母親の膣管の特性を反映したコロニー形成が見られ、ラクトバチルス属、プレボテラ属、スネアチア属などの細菌が優勢です[4]。一方、帝王切開では、母親の皮膚や口腔内に生息する微生物に似た、異なるタイプのコロニー形成が起こります。例えば、エンテロバクター・ホルマエケイ、エンテロバクター・キャンサーゲナス、ヘモフィルス・パラインフルエンザ、ヘモフィルス・アエジプティウス、ヘモフィルス・インフルエンザ、ヘモフィルス・ヘモリチカス、腐性ブドウ球菌、ブドウ球菌ルグドゥネンシス、黄色ブドウ球菌、ストレプトコッカス・オーストラリス、ベイヨネラ・ディスパル、ベイヨネラ・パルブラなどが挙げられます。重要なのは、帝王切開では膣内細菌叢だけでなく、糞便中の細菌叢にも曝露されないことです[5]。 |
| 授乳方法は、新生児および乳児の腸内細菌叢の構成にも影響を与えます。母乳で育てられた新生児および乳児の腸内細菌叢は、主にラクトバチルス属、ブドウ球菌属、ビフィズス菌属で構成されています。一方、人工乳で育てられた乳児の腸内細菌叢は、主にロゼブリア属、クロストリジウム属、アナエロスティペス属で構成されています[6]。また、人工乳で育てられた乳児は、腸内細菌叢の成熟を促進し、炎症プロセスに寄与する可能性のある微生物の増殖を促進することが観察されています[6]。 |
| 一般的に、生後2年間は腸内細菌叢が最もダイナミックかつ劇的に変化する時期です。乳児は、環境中に生息する多種多様な微生物に遭遇するだけでなく、食生活が固形食へと拡大していく重要な発達期を経験します。固形食の導入は、微生物の多様性の構造的・機能的多様性を急速に変化させ、腸内構成を成人のそれに近づけていきます[7]。5歳までに腸内細菌叢の基礎が確立され、その後の人生における基本構造を決定します。そして、思春期には腸内細菌叢の構成が安定します[7,8]。 |
| 微生物叢の構成は、過去の感染症や抗生物質の使用、特に生後2年間における使用[9]、ならびに非ステロイド性抗炎症薬やプロトンポンプ阻害薬[7]の影響を受けます。人生の後半においては、食事、生活習慣、慢性的なストレス、環境への曝露、そして外因性物質が微生物叢の形成に重要な役割を果たします[7,10,11]。 |
| 2. 方法 |
| 本レビューに関連する研究を同定するため、PubMedデータベースを用いて文献の体系的な検索を実施した。検索文字列は以下の通りである(「腸内マイクロバイオーム」または「短鎖脂肪酸」または「睡眠と腸内マイクロバイオーム」または「食事とマイクロバイオーム」または「概日リズム」または「マイクロバイオームと概日リズム」または「クロノタイプ」または「トリプトファン代謝」または「セロトニン産生」または「γ-アミノ酪酸」または「睡眠障害」または「睡眠障害と腸内マイクロバイオームの腸内細菌叢異常」または「食事性成分」または「食事性成分とマイクロバイオーム」または「食物繊維」または「ポリフェノール」または「脂肪」または「西洋型食事」または「果糖」または「ショ糖」または「肉」または「アルコール」)。検索対象は5年以内の論文に限定した。ただし、この範囲内のデータが利用できない場合は、以前の年の研究も含められました。 |
| 3. レビュー |
| 3.1. 腸内細菌叢は宿主の概日リズムにどのように影響するのか? |
| 生物時計は、時間の経過への反応を促進し、環境の変化を予測し、様々な生理学的プロセスを制御する、生体内の複雑なシステムです。この概念は、細胞レベルから全身レベルに至るまで、時間の測定または知覚に関わるすべてのメカニズム、構造、経路を包含しています[12]。概日時計は最も特化したタイプの生物時計です。ヒトにおいては、ほぼ24時間周期で機能する、支配的で多階層かつ堅牢なタイミングシステムとして機能します。概日時計は、光や食物摂取などの外部シグナルによって同期され、それらのシグナルは概日時計の位相に影響を与えます[13,14]。主に単細胞生物で構成される腸内細菌叢の中には、より原始的な形態の生物時計が存在する可能性があります。これらのより単純で仮説的なタイミングシステムの機能は、マイクロバイオームのリズミカルな活動に観察することができます。 [12]。 |
| 腸内細菌叢の量的および質的構成の乱れはディスバイオシス(腸内毒素症、腸内細菌叢の乱れ)を引き起こし、身体機能を混乱させ、潜在的に病気や睡眠障害につながる可能性があります[15,16]。腸内細菌叢と宿主の相互依存性は、宿主の概日リズムとマイクロバイオームの活動の調節に相互に影響を与えていることを示唆しています[12]。現代のライフスタイル(西洋型の食事、夜間の人工光への曝露、遅い食事、不規則な睡眠覚醒サイクルなど)に起因する病因は、宿主のマイクロバイオームと宿主の関係を破壊し、腸内細菌叢と宿主の概日時計の変化につながります。これらの変化は、今度は、睡眠障害、慢性炎症、文明病の発症に好ましい環境を作り出します[17]。 |
| 常在微生物の周期的な活動に影響を及ぼす最も重要な要因の一つは、宿主の概日時計です。食習慣の変化、電子機器の使用、時差ぼけ、交代勤務、ストレスなどにより概日時計が継続的に乱れると、腸内細菌叢の構成に悪影響を及ぼします[18,19]。しかし、この影響は一方的なものではなく、腸内細菌叢の周期性が概日時計の機能にも影響を及ぼすことが実証されています[12,13]。例えば、マウスでは、プレバイオティクスによる食物繊維の補給が、細菌叢による短鎖脂肪酸の周期的な産生を介して概日時計を正に制御することが示されています[13]。これは、他の新たな知見とともに、腸内細菌叢の周期性と宿主の概日時計との明確な関連性を浮き彫りにしています。しかしながら、この関係の正確な性質は不明のままであり、腸内細菌叢のリズムが宿主の概日リズムにどの程度影響するかを判断するにはさらなる研究が必要である[12,13]。 |
| 食事のタイミングと構成は、体内時計の正常な機能を維持するために不可欠な要素です[20]。さらに、腸内細菌叢の構成、位置、機能には昼と夜の違いが見られ、これは宿主の摂食周期に依存します[19]。 |
| 脳と腸は、腸内細菌叢-腸-脳軸によって繋がっています。腸内細菌叢は、免疫調節経路、神経内分泌経路、自律神経経路の3つの経路を通じて脳機能に影響を与えます(図1)。免疫調節経路では、腸内細菌叢が免疫細胞と相互作用し、プロスタグランジンE2、サイトカイン、サイトカイン反応因子のレベルに影響を与えます。これらのプロセスは脳機能を調節します[21]。主に迷走神経によって構成される自律神経経路においては、腸管筋叢の感覚神経が腸管の運動神経とシナプス結合を形成します。 これらの運動神経は、腸管ホルモン分泌の神経調節と腸管運動パターンの制御に関与しています。腸管神経系は、迷走神経と脳を繋ぐシナプス結合も形成し、腸内細菌叢、迷走神経、そして脳を結ぶ経路を形成します[22]。腸内細菌叢によって産生されるアンモニアやD-乳酸などの神経毒性代謝物は、この経路を通じて脳機能、睡眠の質、ストレス反応に悪影響を及ぼす可能性があります[23,24]。神経内分泌経路は、腸内細菌叢が中枢神経系や視床下部-下垂体-副腎系に影響を及ぼすもう一つの経路であり、主にセロトニン、コルチゾール、メラトニンなどの神経伝達物質の分泌を調節することで作用します[22]。 |
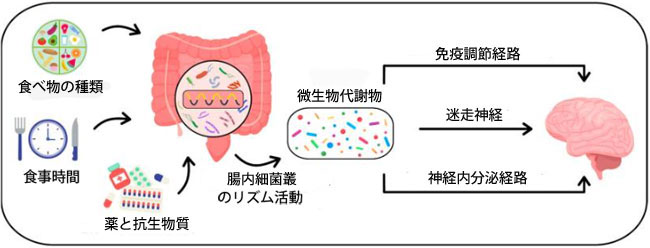 |
| 図1. 腸内細菌叢の構成と活性に影響を与える因子の視覚的表現および脳とのコミュニケーション経路 |
| ヒトの腸内に生息する微生物は、様々な神経伝達物質やサイトカイン(短鎖脂肪酸、ドーパミン、γ-アミノ酪酸、5-ヒドロキシトリプトファン、メラトニンなど)を産生する能力があります。これらの代謝物は迷走神経だけでなく、腸管内分泌細胞を調節することで中枢神経系にも相互作用します[25]。例えば、ラクトバチルス属やビフィドバクテリウム属の細菌はγ-アミノ酪酸(GABA)を分泌しますが[26]、GABAの欠乏は睡眠障害と正の相関関係にあります。不眠症やうつ病の患者では、γ-アミノ酪酸のmRNA発現異常がしばしば観察されます[27]。 |
| 前述のように、腸内細菌叢による代謝産物の産生はリズミカルに行われ、宿主の概日リズムと代謝に大きな影響を与えます[28]。これは、腸内細菌叢が宿主の概日リズムと代謝の恒常性に及ぼす影響をさらに裏付けるものです。さらに、腸内細菌叢は食事中のコリンをトリメチルアミンに変換するプロセスに関与しており、トリメチルアミンはその後肝臓で変換されます。このプロセスは、宿主の内皮細胞における概日時計遺伝子の発現に影響を与える可能性があります[29,30,31]。 |
| 3.2. 概日リズム、クロノタイプ、そして腸内細菌叢との相互作用:睡眠調節への洞察 |
| 光は、視床下部視交叉上核に位置するヒトの概日時計の最適な機能と正確な微調整を担う主要な要因です[32,33]。しかし、食事時間、食品の種類、運動、体温、さらには社会的交流など、他の多くの刺激や環境シグナルも概日リズムに大きな影響を与える可能性があります[33]。 |
| 腸-脳軸は、脳と腸の双方向コミュニケーションを可能にする複雑な生物学的システムです。腸内細菌叢はこの相互作用を調節する上で極めて重要な役割を果たし、様々なシグナル伝達経路に影響を及ぼします。体内時計は消化生理と腸管バリア機能を制御しているほか、ホルモンやペプチドの発現を調節しています。これらのプロセスは、空腹感や満腹感を通じて食物摂取量を調節します [34]。腸内細菌叢の多様性と構成は日々変化しており、時間帯、摂取する食品の種類、断食の有無に大きく依存しています [35,36]。そのため、食習慣の異常や不適切な食習慣は、体内時計の機能に悪影響を及ぼす可能性があります [36]。腸内細菌叢と概日リズムの関係は双方向であり、腸内細菌叢の乱れと概日リズムの乱れは相互に影響を及ぼします [37]。 |
| クロノタイプの概念は、個人の概日リズム表現型を指し、覚醒、活動、睡眠の時間的な好みを包含します。体内時計のリズムに応じて、朝型クロノタイプと夜型クロノタイプに区別できます。これらはさらに、極度クロノタイプと中等度クロノタイプに分類されます。さらに、どちらでもないタイプと呼ばれる第3のタイプも存在します[38,39]。成人人口の約40%は朝型クロノタイプと夜型クロノタイプに分類され、約60%は典型的な分類に当てはまらないどちらでもないタイプです。これらの個人は、睡眠と活動のスケジュールに柔軟性を維持する傾向があり、状況や好みに応じて一日のさまざまな時間帯に適応しやすい傾向があります[40]。 |
| 朝型の人は、日の出と日の入りの時刻に合わせて睡眠パターンを調節し、早寝早起きする傾向があります。彼らは通常、早朝に精神的および肉体的なパフォーマンスのピークを迎えます。一方、夜型の人は就寝と起床がかなり遅く、精神的および肉体的なパフォーマンスが最も高まるのは午後の時間帯です。しかしながら、彼らは朝の覚醒レベルに問題を抱える可能性が高くなります[40,41]。 |
| 腸内細菌叢は、朝の起床に伴う不快感に関与している可能性があります。夜型の人は朝型に比べて、エンテロバクターレス(腸内細菌目)とエンテロバクテリアセアエ(腸内細菌科)の数が多いことが観察されています[42]。睡眠時間の延長に関連する可能性のある細菌株には、ラクノスピラセアエ(訳者注:ラクノスピラは、ヒトの腸内細菌叢に存在する、有益な働きをすることで知られる細菌の一種です)、オドリバクター、ヴィクティバラ科、レンティスファエラ、レンティスフムラリアなどがあります[42]。 |
| 腸内細菌叢-腸-脳軸は概日リズムに影響を与え、ひいては脳のメラトニンへの反応にも影響を与えることが実証されています。例えば、セレノモナデール目およびネガティビクテス目の菌数が多い人は不眠症のリスクが高まる可能性があります[42]。逆に、アナエロフィラム目や腸内細菌目などの細菌は、腸管上皮の時計遺伝子に作用し、夜型クロノタイプのオッズを高め、体重増加につながる可能性があります[42]。したがって、腸内細菌叢が健康全体に及ぼす計り知れない影響についての共通理解を深めるためのさらなる解析が不可欠です。 |
| 3.3. 腸内細菌叢由来代謝物と睡眠パターンへの影響 |
| 腸内細菌叢は、睡眠の質に影響を与える代謝物を産生することが知られています。腸内細菌叢によって直接的または間接的に産生される主要な代謝物には、短鎖脂肪酸、セロトニン、メラトニン、γ-アミノ酪酸などがあります[43,44,45,46](図2)。 |
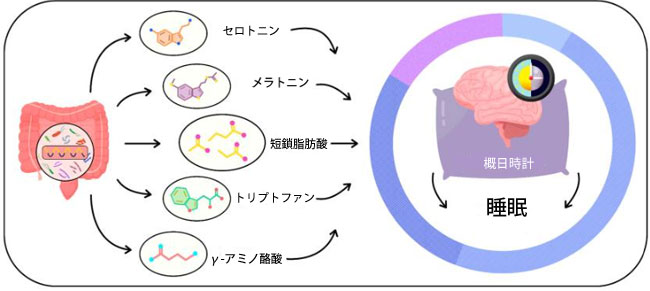 |
| 図2. 腸内細菌叢によって生成される代謝物 |
| 3.3.1. 短鎖脂肪酸 |
| 消化管の中で最も長い部分である小腸は、消化、乳化、栄養素の吸収というプロセスに特化しており、少量の単純炭水化物、脂肪、タンパク質のみが大腸に到達するようにしています。対照的に、食物繊維などの複合炭水化物は小腸では消化されず、大腸の腸内細菌叢によって代謝されます[46]。消化されない食物繊維は腸内細菌叢にとって重要な栄養素であり、その構成、存在量、機能性に影響を与えます[47]。食物繊維は、10個以上のモノマー単位を含む炭水化物ポリマーで構成されており、ヒトの小腸における内因性酵素による加水分解に抵抗性を示します[48]。食物繊維のもう一つのカテゴリーであるプレバイオティクスは、宿主微生物によって選択的に利用され、健康効果をもたらす基質を指します[49]。プレバイオティクスの大部分は食物繊維に分類されますが、すべてのプレバイオティクスがこの分類に該当するわけではないことに注意することが重要です[49]。 |
| 食物繊維は、全粒穀物、野菜、果物、ナッツ、種子、豆類などの植物性食品に豊富に含まれています[50]。大腸では、腸内細菌叢による発酵を経て、短鎖脂肪酸が生成されます。短鎖脂肪酸は、最大6個の炭素原子からなる鎖長を持つ小さな有機モノカルボン酸です[51]。短鎖脂肪酸は主に酢酸、プロピオン酸、酪酸で構成されており、そのモル比はおよそ60:20:20です。生成された短鎖脂肪酸は腸管上皮細胞によって吸収され、門脈循環へと輸送され、その後肝細胞によって利用されます[51,52]。 短鎖脂肪酸は、腸管バリアの完全性、粘液産生、セロトニン放出を改善・促進することで腸の健康に貢献します[53,54]。さらに、酢酸、酪酸、プロピオン酸などの短鎖脂肪酸はヒトの脳脊髄液中に同定されており、中枢神経系の恒常性と血液-脳関門の完全性の維持に関与していることが示唆されています[55]。 |
| 微生物叢によって産生される短鎖脂肪酸の一つである酪酸は、牛乳、バター、チーズなどの乳製品にも天然に含まれています[56]。酪酸は門脈循環に容易に吸収され、肝臓へ輸送されます[57]。これは、全身濃度と門脈酪酸濃度の濃度勾配によって証明されています。酪酸とグリセロールの3分子からなるエステルであるトリブチリンをマウスに投与したところ、4時間にわたり非急速眼球運動(NREM)睡眠が約50%増加しました。このことから、酪酸は睡眠を誘発するシグナル分子として作用する可能性があることが示唆されます[57]。 |
| 別の研究では、患者を2つのグループに分けました。急性および慢性不眠症患者(26~55歳、20名)からなる研究グループと、年齢と性別を一致させた健康な対照群(38名)です。2つのグループ間で腸内細菌叢に有意な差が見られました。研究グループの患者は、短鎖脂肪酸の産生を担う微生物を含む腸内細菌叢の多様性と豊富さが低いことが示されました。慢性不眠症患者では、酪酸産生に寄与することが知られているフェカリバクテリウム、プレボテラ、およびローズブリアの数の減少も観察されました。この減少は睡眠の質と不眠症の発症にも影響を与える可能性があります[58]。 |
| 便中の短鎖脂肪酸値が高い人は不眠症の症状を経験する可能性が高くなります。興味深いことに、便中の短鎖脂肪酸値の高さは肥満関連疾患の患者でも観察されています[54,59,60]。腸内に存在する腸管クロム親和性細胞には、短鎖脂肪酸との結合を担う特異的受容体があり、これがセロトニン産生に影響を及ぼす可能性があります[61]。重要な神経伝達物質であるセロトニンは、腸管内の腸管クロム親和性細胞と求心性神経線維とのシナプス様結合を介して脳に影響を及ぼす可能性があります[61,62]。前述のように、便中の短鎖脂肪酸値が高いのは肥満者や睡眠障害のある人で観察されており、腸内細菌叢の乱れや腸管バリア透過性の低下が原因である可能性があります[54,62]。したがって、健康な腸内細菌叢を維持することは睡眠の質に大きな影響を与えると考えられています。 |
| ラクノスピラ科UCG004やオドリバクターなど、短鎖脂肪酸の産生を担う6種類の細菌が、睡眠時間の延長に効果があることが実証されています[51]。短鎖脂肪酸は、神経系の主要な抑制性神経伝達物質であるセロトニンとγ-アミノ酪酸(GABA)の産生に作用することで睡眠に影響を与えることが示されています。γ-アミノ酪酸は覚醒に関わるシステムの抑制に関与しているため、睡眠促進に重要な役割を果たします[42,63]。 |
| 研究によると、睡眠障害のある人では腸内細菌叢の構成に変化が見られることが示されています。不眠症患者では、食物繊維から短鎖脂肪酸への代謝を担う細菌の減少が観察される一方で、短鎖脂肪酸は睡眠時間に有益な効果をもたらす可能性があります[54,57,58]。 |
| 3.3.2. トリプトファンの代謝とセロトニン産生 |
| トリプトファンは必須アミノ酸であり、主にチーズ、牛乳、ナッツ、種子、魚、赤身の肉などのタンパク質を豊富に含む食品に含まれています[44,47]。トリプトファンの大部分は小腸で吸収され、吸収されなかった部分は大腸内の微生物の基質として機能します[64]。一方、セロトニン(5-HT)はモノアミン神経伝達物質であり、概日リズム、体温調節、感情制御、認知機能、痛覚など、多くの生理学的プロセスにおいて極めて重要な役割を果たしています。セロトニンは、体内時計、特に睡眠覚醒サイクルを調節する必須ホルモンであるメラトニンの前駆体です[43]。セロトニンの大部分は腸管の腸管クロム親和性細胞(訳者注:腸管クロム親和性細胞は消化管内の特殊な細胞で、腸からの刺激を感知し、体内のセロトニンの約90%を生成します)によって産生され、その合成には律速酵素であるトリプトファン水酸化酵素が利用されます[45,65]。腸管におけるセロトニン産生は、栄養素、腸内細菌叢、宿主由来のシグナル伝達ホルモン、ペプチドなど、様々な因子の影響を受けることに留意することが重要です。これらの因子は、免疫応答、栄養代謝、そして腸管恒常性に直接的および間接的に影響を及ぼします[45,66]。筋層間神経叢は、はるかに少量ではあるものの、依然として重要な量のセロトニンが産生されるもう一つの部位です[45,67]。 |
| トリプトファン水酸化酵素(TPH)は、セロトニンの合成に関与する特異的な酵素です。体内では、トリプトファン水酸化酵素の2つのアイソフォームが同定されています。TPH1は主に腸管の腸管クロム親和性細胞に存在し、TPH2は主に中枢神経系およびセロトニン作動性ニューロンに存在します[68,69]。トリプトファン水酸化酵素と律速酵素はどちらもセロトニンの産生に関与し、セロトニンは腸管クロム親和性細胞の頂端膜にある小胞に貯蔵されます[70]。 |
| 腸内細菌叢が様々な代謝物の産生を調節することでセロトニン分泌に重要な役割を果たしている可能性は注目に値します。前述のように、これらの代謝物の1つは短鎖脂肪酸[71,72]であり、これはTPH1の産生を増加させ、それによってセロトニン合成の増加に寄与する可能性があります[45,70]。このメカニズムは、ラットの結腸の盲腸付近の腔に投与された短鎖脂肪酸がセロトニン産生を増加させたという研究[73]など、他の研究によっても裏付けられています。腸内常在細菌がセロトニン産生を増加させるという事実に加えて、病原性微生物は逆の状況を引き起こし、セロトニンの産生を減少させることで疾患の発症に寄与する可能性があります。例えば、腸管病原性大腸菌感染は、腸管セロトニントランスポーターの活性低下と発現低下につながる可能性があります[74]。 |
| 3.3.3. メラトニン |
| メラトニンは、ヒトを含む昼行性の生物の睡眠・覚醒サイクルの調節において重要な役割を果たします。この天然の睡眠促進ホルモンは、環境光の変化に応じて合成され、暗闇の中でピークに達します。 |
| メラトニンは、脳内のニューロン表面に存在するメラトニン受容体(主にMT1およびMT2)と相互作用することで、睡眠・覚醒メカニズムに作用します。これらの受容体は、特に海馬、視床下部、基底核に豊富に存在します。メラトニン受容体の活性化は、γ-アミノ酪酸、セロトニン、グルタミン酸などの神経伝達物質の放出を調節し、睡眠調節に関与する脳構造に作用します。メラトニンは概日リズムに作用し、睡眠・覚醒相を調節し、睡眠の質に影響を与えます。メラトニン濃度は夜間にピークに達し、入眠プロセスを促進し、朝方に減少して覚醒相への移行を促進します。したがって、メラトニンは体内時計を明暗サイクルに同期させ、睡眠恒常性を維持する上で重要な役割を果たしています[75,76,77]。 |
| 注目すべきことに、腸管細胞によるメラトニン産生量は松果体(訳者注:松果体は、脳の中央に位置する小さな内分泌器官で、主に睡眠覚醒リズムを調節するホルモンであるメラトニンを分泌します )によるものよりも約400倍多い。さらに、メラトニンの分泌量は食物摂取頻度と相関しているようである[78]。 |
| 不眠症やその他の睡眠障害に苦しむ患者は、腸内細菌叢の構成と機能に障害を示すことが多い[79]。前述のように、セロトニンは腸の腸クロム親和性細胞で産生されるメラトニンの前駆体である。これらの細胞の活動はマイクロバイオームによって調節され得る[43,80,81]。したがって、腸内細菌叢は最適なメラトニン産生をサポートする上で重要な役割を果たしている可能性があり、それが睡眠調節や概日リズムに関連する他の機能に有益な効果をもたらす可能性がある。また、メラトニンが特定の腸内細菌の推定生物時計の活動に影響を与え、それによってそれらの全体的な機能に影響を及ぼすことも観察されている[82]。しかし、これらの相互作用のメカニズムは複雑であり、さらなる研究が必要である。 |
| 3.3.4. γ-アミノ酪酸(GABA) |
| γ-アミノ酪酸は非タンパク質アミノ酸であり、脳内における主要な抑制性神経伝達物質です。ストレス緩和と睡眠調節に役割を果たします[83]。γ-アミノ酪酸はシナプス後神経細胞の過分極を引き起こし、抑制性シナプス後電位を発生させます。これにより細胞内の負電荷が増加し、神経鞘の脱分極が困難になり、神経インパルスの発生確率が低下します[84,85]。 |
| γ-アミノ酪酸サプリメントの摂取が睡眠の質に有益である可能性を示唆する研究があることは注目に値します。ある研究では、不眠症患者に4週間にわたり1日300mgのγ-アミノ酪酸を投与したところ、睡眠効率の向上と入眠潜時の短縮が認められました[86]。別の研究では、γ-アミノ酪酸とL-テアニンを含む混合物の使用により、入眠潜時の短縮と、レム睡眠(急速眼球運動睡眠)とノンレム睡眠(非急速眼球運動睡眠)の両方の増加が認められました[87]。 |
| 迷走神経は、γ-アミノ酪酸が脳腸相関と相互作用する可能性のある経路の一つであることに留意することが重要です。例えば、γ-アミノ酪酸産生細菌であるラクトバチルスをマウスに投与すると、うつ病マーカーと不安様行動が減少することが研究で示されていますが、迷走神経を切断したマウスではこのような効果は観察されませんでした[27,88]。 |
| γ-アミノ酪酸の食事からの供給源としては、豆やエンドウ豆の芽、米、オート麦、小麦、ほうれん草、ジャガイモ、多くの野菜などが挙げられますが、その量は比較的少量です。食品中のこの酸の存在は、ラクトコッカス ラクティス、ラクトバチルス ブレビス、およびその他の乳酸菌を食品製造プロセスに組み込むことによって高めることができます [44]。さらに、γ-アミノ酪酸は脳内で別の神経伝達物質であるグルタミン酸からも生成されます [83]。研究では、腸内細菌の特定の株が γ-アミノ酪酸生成できることが実証されています。この神経伝達物質を合成する方法の 1 つに、グルタミン酸脱炭酸酵素 (GAD) システムの使用があります。gadA または gadB 遺伝子によってコードされているピリドキサール-5'-リン酸に依存する酵素を介したグルタミン酸からγ-アミノ酪酸への変換は、この経路の重要なステップです。統合微生物ゲノム/ヒトマイクロバイオームプロジェクトデータベースの予備的研究によると、gadB遺伝子の相同遺伝子を含む細菌属が26属あり、その中にはバクテロイデス属も含まれ、ヒトの腸内細菌叢に豊富に存在することが示されています[83,89]。 |
| γ-アミノ酪酸産生に関与する常在細菌には、ラクトバチルス属、ビフィドバクテリウム属、バクテロイデス属などがある。ラクトバチルス属およびビフィドバクテリウム属に属する細菌は、腸管神経系におけるγ-アミノ酪酸濃度を上昇させることが実証されている[26]。しかし、ルミノコッカス科や大腸菌K12などの他の細菌株は、γ-アミノ酪酸を利用し、その分解を引き起こす可能性がある[90,91,92]。腸内細菌叢はγ-アミノ酪酸の代謝に影響を与える可能性があり、腸内細菌叢の乱れは睡眠障害の発症に寄与する可能性があることが観察されている。 |
| 3.4. 睡眠障害と腸内細菌叢の乱れに起因する合併症 |
| 適切な睡眠は多くの生理学的プロセスに関与しており、睡眠パターンの異常は健康への悪影響のリスクを高める可能性がある[93,94]。したがって、睡眠障害は概日リズムの変化によって引き起こされる独特な疾患群であり、不眠症や日中の過度の眠気などがその主な症状である[44,95]。 |
| 50年前に行われた初期の研究では、睡眠時間の異常と死亡リスクの上昇との間に相関関係があることが示されました。100万人以上のアメリカ人成人を対象とした画期的な調査では、睡眠時間が短すぎる場合も長すぎる場合も、死亡リスクを高める可能性があることが示されました[96]。その後の研究によってこれらの知見は裏付けられ、6時間以下の睡眠だけでなく、9時間を超える睡眠も死亡リスクを高めることが示されています[97,98,99,100]。 |
| 睡眠障害は、体内の2つの炎症マーカー、すなわちCRP(訳者注:CRPとは、「C反応性蛋白(C-reactive protein)」の略称で、体内に炎症や組織損傷が起きた際に、肝臓で産生されるタンパク質です)とIL-6の上昇と関連しています[101]。腸内細菌叢によって産生される短鎖脂肪酸には抗炎症作用があり、睡眠障害患者ではこれらの化合物の産生に関与する特定の細菌の数が少ないことが研究で観察されています[58]。 |
| 肥満は睡眠障害や不眠症を伴うことが多い。複数のコホート研究のメタアナリシスでは、睡眠時間が短いことと肥満リスクの上昇との間に相関関係があることが示されている[102,103,104]。さらに、睡眠の質が悪いと、カロリー制限食を遵守しているにもかかわらず、脂肪の減少が悪くなる傾向がある[105]。肥満の発症は、腸内細菌叢の乱れとも正の相関関係にある[106]。注目すべきことに、肥満者では、アッカーマンシア属、フェカリバクテリウム属、オシリバクター属、およびアリスティペス属に属する細菌の存在量が減少している[106]。同様に、慢性不眠症患者ではフェカリバクテリウム属の菌数の減少が観察されている[58]。 |
| 睡眠時間を1週間4~5時間に短縮するだけで、組織の耐糖能が低下し、インスリン感受性が低下することが実証されています[107]。さらに、習慣的な短時間睡眠(4.5~6時間)は、2型糖尿病患者のグリコヘモグロビン値の有意な上昇と関連付けられています[108]。さらに、腸内細菌叢の不均衡も炭水化物代謝障害の発症に関与している可能性があり、膵β細胞機能不全、脂質およびグルコース代謝異常、慢性炎症などの生理学的プロセスに影響を及ぼす可能性があります[109]。腸内細菌叢はトリプトファン代謝において重要な役割を果たしています。この化合物が適切に処理されると、インスリン分泌にプラスの影響を与え、血糖値を下げ、抗炎症作用を高めることができます[110,111]。逆に、6週間にわたる研究では、慢性的に睡眠不足の健康な成人において、就床時間を通常より1時間長くすると、組織のインスリン感受性が改善することが示されました[112]。したがって、睡眠障害と、睡眠に影響を与える腸内細菌叢の乱れの両方が、体内の炭水化物代謝の異常の発症に影響を及ぼす可能性があることを認識することが重要です[45,73,110]。 |
| 心血管疾患は世界中で死亡の主な原因であり、高血圧、心不全、動脈硬化症がこのカテゴリーの疾患の最も一般的な形態です [113]。高血圧は、腸の機能障害、消化器系と神経系の接続性の変化、腸内細菌叢の変化など、多くの要因に関連する疾患です。研究によって証明されているように、高血圧患者は腸内細菌叢の豊かさと多様性が著しく低下しており [114,115]、フィルミクテス属と バクテロイデス属の比率が有意に高いことが報告されています [116]。腸内細菌の組成は、主にこれらの細菌が産生する代謝物を介して、血圧調節に大きな影響を与えます。いくつかの代謝物は特に影響力が強く、この調節力学において重要な役割を果たしているようです。短鎖脂肪酸の産生障害は、腸内細菌叢の乱れによって引き起こされる可能性があり、その結果、腸管クロム親和性細胞がセレトニンの産生を刺激する可能性があります。この神経伝達物質は迷走神経のセレトニン3受容体に作用し、腸管から脳への迷走神経の求心性活動を阻害します。さらに、血流中に放出されたセレトニンは血管収縮を引き起こし、動脈血圧の上昇に影響を与える可能性があります[117]。腸内細菌叢の乱れと、血管透過性、炎症状態、血圧の調節におけるその役割との関連性を示唆する研究が増えています[118,119]。 |
| 腸内細菌叢の異常は、血管内への免疫細胞の浸潤と炎症を通じて、アンジオテンシンII誘発性高血圧および血管機能障害の発症に寄与する可能性がある[120]。高血圧ドナーの糞便をマウスの腸管に移植した研究では、移植患者の血圧が上昇することが示された[121]。さらに別のランダム化比較試験では、ポリフェノールを豊富に含む食事が高齢者の腸管透過性を有意に改善し、セルロースを消化して酪酸を産生する腸内細菌数を増加させ、血圧を低下させることが示された[122]。腸内細菌叢の異常に加えて、睡眠の質の低下や睡眠時間の不足などの睡眠障害も高血圧の発症に寄与する[123,124]。したがって、睡眠障害や腸内細菌叢など、複数の関連する因子を考慮した包括的な患者ケアアプローチが極めて重要である。 |
| もう一つの重要な公衆衛生上の懸念は精神疾患の蔓延であり、これも睡眠障害や腸内細菌叢の乱れに関連している可能性がある[125,126]。ヒトおよび動物における睡眠不足は時計遺伝子の発現変化をもたらし、それがストレスに対する神経生物学的反応に影響を及ぼすことが示されており、ストレス感受性を高め、その後の疾患リスクを高める可能性がある[127]。腸内細菌叢は、ドーパミン、トリプトファン、γ-アミノ酪酸、短鎖脂肪酸、メラトニンなど、様々な神経伝達物質の産生に極めて重要な役割を果たしている。これらの代謝物は、腸管神経系と中枢神経系の両方の機能に大きな影響を与える[128]。さらに、不眠症やうつ病の患者ではγ-アミノ酪酸発現の異常が頻繁に観察されている[129]。 |
| アルツハイマー病は、中枢神経系を侵す最も一般的な神経変性疾患です。アルツハイマー病の特徴的な病理学的メカニズムは炎症反応を誘発し、最終的には神経細胞のアポトーシスまたは壊死に至り、不可逆的な脳損傷を引き起こします[130]。大腸菌、乳酸菌、サッカロミセス、バチルスなどの特定の細菌株は、γ-アミノ酪酸、5-ヒドロキシトリプタミン、ドーパミン、酪酸、ヒスタミン、セロトニンなど、様々なアミノ酸を合成することができます。これらのアミノ酸は、脳活動の調節において重要な役割を果たしている可能性があります[131,132]。高齢者の腸内細菌叢は、一般的に多様性の低下と細菌レベルの低下を示し、結果として酪酸産生が低下します[133]。これは炎症の発生や認知機能低下の進行に寄与している可能性がある [134,135]。腸内細菌叢の構成がβアミロイド病理の重症度や認知障害に影響を及ぼすことを示唆する証拠が増えている。腸内細菌叢はアルツハイマー病の発症に重要な役割を果たしている可能性があり、腸脳相関の乱れは特に注目に値する。腸内細菌叢のディスバイオーシスによって引き起こされる炎症とアルツハイマー病の間に相関関係があることを示唆する証拠が増えている [130,136]。さらに、睡眠障害はアルツハイマー病の発症リスク増加に関連付けられている [137,138,139]。以前に発表したように、多数の研究で睡眠障害の発生と腸内細菌叢のディスバイオーシスの関係が示唆されている [60,77,140]。 |
| 3.5. 腸の健康に影響を与える食事要素と栄養戦略 |
| 食習慣は腸内細菌叢の構成に大きな影響を与えます。食事の質、摂取タイミング、食事の規則性、食事間隔などが重要な要素であり、これらはすべて腸内細菌叢に影響を与えます[33,35,141](図3)。これらの要因は広く研究されており、科学文献にも十分に記載されています。 |
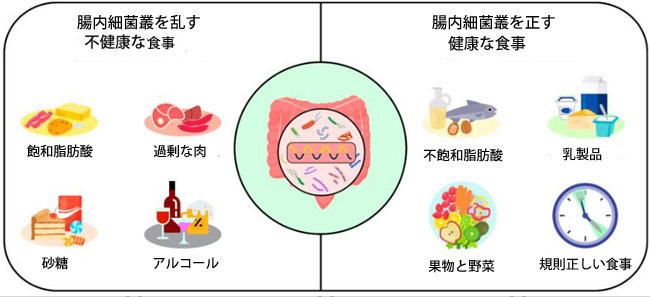 |
| 図3. 食事が腸内細菌叢に与える影響 |
| 3.5.1. 食事のタイミングと食事間隔 |
| 消化管に入る食物は、消化管内にある末梢時計の主要な同期装置として機能します。そのため、夜遅くに食事をすると健康に悪影響を与え、ホルモン分泌の変化、概日リズムの乱れ、腸内細菌叢の構成の変化といった深刻な合併症のリスクが高まります[32,142]。人体は通常、午前10時頃に始まる活動期と午後10時に始まる休息期という2つの主要な段階で機能します[33]。これらの段階の規則性は、主に活動期に起こるホルモン産生の変動によって影響を受けます[143]。 1日の最後の食事を1時間遅らせるだけでも、C反応性タンパク質、インスリン、グルコース、グリコヘモグロビンの値が上昇し、HDLコレステロールの値が減少することが示されている[144]。さらに、1日のうち早い時間に食事を摂ると、より大きな減量につながることも実証されている[145]。さらに、時間制限のある食事が腸内細菌叢の変化と関連していることを示唆する証拠もある。特定の時間に食物を摂取することを制限することで、オシリバクターやルミノコッカス科などの善玉菌が増加し、ラクトバチルスやラクトコッカスの数が減少することが観察されている[142]。さらに、特に午後2時以降など遅い時間に食事を摂る人は、ラクノスピラ属細菌の値が上昇する傾向があり、これはこの遅い時間帯のカロリー摂取量の増加と関連している[146,147]。 |
| 食事のタイミングに加えて、食事の頻度と規則性も重要な考慮事項です。頻度とは1日に摂取する食事の回数を指し、規則性は食事の一貫性の指標です[148,149]。宿主の概日リズムは、不規則な時間に食事を摂取したり、食事を全く摂らなかったりすることで影響を受ける可能性があります[33]。例えば、睡眠スケジュールがずれやすい夜型の人は、朝食を抜く傾向があります。この傾向は、睡眠負債を蓄積する習慣に起因すると考えられ、その結果、朝食を犠牲にして朝の睡眠時間を長くすることがよくあります[33]。 |
| 3.5.2. 食物繊維 |
| 摂取する食品の種類、品質、および起源は、腸内細菌叢を形成し、その構成と機能に影響を与えます。これらの要因は、宿主と細菌叢の相互作用にも影響を与えます。西洋型のライフスタイルに典型的な食生活では、食物繊維の重要な供給源である複合炭水化物の摂取が著しく不足しています。この不足は、微生物の多様性を不可逆的に減少させ、消化器系における特定の微生物種の消失につながる可能性があります[53,150]。この食生活の特徴である糖質と飽和脂肪酸の摂取量の増加と食物繊維の摂取量の減少は、2型糖尿病、がん、肥満、炎症性腸疾患などの慢性疾患の有病率の上昇に寄与している可能性があります[53,151]。 |
| 2009 年の食品規格委員会による定義 [152] によれば、食物繊維は 10 個以上のモノマー単位からなる食用炭水化物ポリマーで、内因性消化酵素に抵抗性があり、そのため小腸で加水分解も吸収もされないもの [48,153,154] とされています。食物繊維は多様性に富むことが特徴であるため、その説明は、起源、化学組成、物理化学的性質などさまざまな分類に基づいて行われ、さらに重合度に基づいて細分化されます [153]。食物繊維は起源によっても分類でき、一般的な起源には穀物、野菜、果物、ナッツ、種子、豆類、豆類などがあります。異なる植物群の繊維はさまざまな化学組成を持ち、腸内細菌叢の多様な構成と好ましい相互作用をする可能性があります。したがって、単に繊維の量に焦点を当てるのではなく、さまざまな植物性食品を含む多様な食事を維持することが重要です[152,153,154]。 |
| 食物繊維は溶解性によっても分類できます。不溶性食物繊維は強固な水素結合によって結合し、外因性グルコシダーゼによる加水分解に抵抗性のある結晶性の疎水性構造を形成します。一般的な不溶性食物繊維には、セルロース、ヘミセルロース、リグニンなどがあります。これらの繊維は便のかさを増やすのに役立ちますが、腸内細菌叢による利用は水溶性食物繊維に比べて低いです[154,155]。その結果、水溶性食物繊維は腸内細菌叢によってより容易に代謝され、ヒトの腸内細菌叢の豊富さと多様性に大きな影響を与えます[153,155]。水溶性食物繊維は結腸に到達すると、様々な分解機構によってオリゴ糖や単糖に変換され、特定の輸送システムによって吸収されてエネルギーに変換されます[156]。腸内細菌叢による食物繊維の分解により、有機酸、ガス、および大量の短鎖脂肪酸が生成される[154,157]。 |
| 短鎖脂肪酸の生成は、胃腸疾患、がん、炎症性疾患のリスク軽減、機能性便秘の緩和、睡眠の質の改善など、体に多くの利点をもたらします[150,158]。さらに、ほとんどの種類の水溶性食物繊維は腸内微生物の増殖を促進するため、プレバイオティクスと呼ばれています[49,159]。したがって、食物繊維が豊富な食品を十分に摂取すると、腸内微生物の多様性と豊富さにプラスの影響を与えることができます[154]。しかし、慢性的または定期的な食物繊維欠乏は、栄養源として粘膜糖タンパク質の分泌につながり、結腸粘膜バリアの侵食につながる可能性があります[160]。これは今度は腸バリア機能不全を引き起こし、致命的な大腸炎にエスカレートする可能性があります[160]。毎食に様々な植物由来製品を取り入れた多様な食生活を確保することは、全体的な健康を維持するために不可欠です[53,153,161,162]。オメガ3脂肪酸と不飽和脂肪酸を豊富に含む食品を摂取し、飽和脂肪酸の摂取を制限することが推奨されます。 |
| 3.5.3. ポリフェノール |
| ポリフェノールは植物に天然に存在する有機化合物です。果物、野菜、穀物、茶、コーヒー、ワイン、ナッツ、種子、スパイス、豆類、油など、幅広い食品に含まれています[163,164]。ポリフェノールはフェノール性の構造的特徴を特徴としていますが、その構造には大きな多様性があり、それがいくつかのサブグループに分類される根拠となっています。ポリフェノールは、フェノール環の数と、これらの環を連結する構造要素に基づいて分類されます。ポリフェノールの主要な構造グループは、フラボノイド、フェノール酸、リグナン、スチルベンです[164,165]。広範な文献において、ポリフェノールは抗炎症、免疫調節、抗がん、抗糖尿病、心臓保護、神経保護、胃保護など、多くの生物学的機能において重要な役割を果たしていることが強調されています[166,167,168]。ポリフェノールとその活性代謝物は、短鎖脂肪酸と分岐鎖アミノ酸の産生を刺激し、さまざまな疾患、特に胃腸障害の治療と予防に有益である可能性がある[51]。 |
| バイオアベイラビリティや生物活性といった概念は、ポリフェノールの有効性を評価する際に用いられます[169,170]。ポリフェノールのうち、小腸で直接吸収されるのはごくわずかです。より複雑なポリフェノールは、大腸で腸内細菌叢によって低分子量の代謝物に変換されます[171]。大腸に到達したこれらの吸収されない複合ポリフェノールは、腸内細菌叢の構成に影響を与え、宿主の健康に有益な効果を発揮する可能性があります[171]。ポリフェノールの微生物代謝によって生成される二次代謝物は、プレバイオティクス分子として作用し、特定の微生物株の増殖を変化させることができます[171]。 |
| ポリフェノールは腸内細菌叢と相互作用し、プレバイオティクスとして様々な微生物株の増殖を促進し、腸内細菌叢の構成に良い影響を与えます。ポリフェノールは宿主の消化酵素によって消化されないため、腸内細菌の基質として機能します[172,173]。この特性により、ポリフェノールはビフィドバクテリウムやラクティプランティバチルスなどの健康増進に有益な細菌株の増殖を著しく促進する一方で、クロストリジウムや大腸菌などの有害菌の増殖を抑制します[174]。 |
| ポリフェノールが腸内細菌叢とどのように相互作用するかはまだ解明されていません。しかし、直接的な影響と間接的な影響の両方があると考えられます。例えば、ポリフェノールは特定の細菌の増殖を直接的に刺激または阻害することができます。刺激の場合、細菌のポリフェノール代謝能力とポリフェノール耐性が密接に関連しているのに対し、阻害の場合は、ポリフェノールの抗菌作用が重要な役割を果たします[175,176]。さらに、ポリフェノールには、抗炎症作用、抗酸化作用、免疫調節作用、抗癌作用、心血管保護作用など、さまざまな有益な効果がある可能性があります[170,177]。したがって、植物性食品からポリフェノールを摂取することは、腸内生態系の非生物的状態と生物全体の健康を維持するために不可欠です。 |
| 3.5.4. 脂肪の質と量 |
| 脂肪の質と量は腸内細菌叢に影響を与えます。脂肪には飽和脂肪酸、一価不飽和脂肪酸、多価不飽和脂肪酸があり、これらは炭素原子間の二重結合の有無によって分類されます[178]。飽和脂肪酸の主な供給源は動物性食品であり、不飽和脂肪酸は主に植物性食品に由来します。 |
| 飽和脂肪酸の過剰摂取は、いくつかの動物実験で観察されているように、バクテロイデス門の減少とフィルミクテス門およびプロテオバクテリア門の増加と関連している可能性がある[179,180]。この変化は腸管バリアの障害につながる可能性がある[181]。逆に、オメガ3多価不飽和脂肪酸の摂取は、腸内細菌叢の組成と存在量を変化させ、短鎖脂肪酸(SCFA)の濃度を調節し、炎症誘発性メディエーターの濃度を変化させることで、腸内細菌叢に影響を与える可能性がある[182]。オメガ3脂肪酸の主な供給源である魚油の多量摂取は、腸内細菌叢の増殖を抑制し、ビフィズス菌の増殖を増加させ、腸内細菌叢に有利に働く可能性がある[183]。さらに、オメガ3多価不飽和脂肪酸は腸粘膜層の厚さの増加に寄与し、腸内微小環境を改善し、粘膜バリアの機能を高める可能性がある[184]。 |
| さらに、オメガ3脂肪酸は強力な抗炎症作用を持ち、腸の健康維持に不可欠な短鎖脂肪酸の産生を増加させる可能性があります[182,185]。エクストラバージンオリーブオイルなどの一価不飽和脂肪酸の摂取も有益な効果があり、特に腸内細菌叢の多様性を高めることが示されています。興味深いことに、このオリーブオイルはポリフェノールが豊富で、腸内細菌叢に良い影響を与えます[186,187]。オメガ3多価不飽和脂肪酸、不飽和脂肪酸を豊富に含む製品を摂取し、飽和脂肪酸を制限することは、腸内細菌叢に有益な効果をもたらす可能性があります。 |
| 3.5.5. ショ糖と果糖 |
| 過剰な糖質摂取は腸内細菌叢に大きな影響を与え、様々な健康関連の変化を引き起こします。ショ糖や果糖などの糖質を多く含む食事は、腸壁の透過性を低下させ、腸内細菌叢の構成を変化させる可能性があります[188,189]。糖質と脂肪を多く含む西洋型の食事は、1日以内に腸内細菌叢に影響を及ぼす可能性があります[190]。この食事を摂取している人では、バクテロイデス属の減少とフィルミクテス属の増加が観察されています[191]。食物繊維を多く含む食事とは対照的に、西洋型の食事は短鎖脂肪酸の産生を減少させ、腸内バリアを損ないます[192,193]。また、糖質の過剰摂取はプロテオバクテリアの増加にもつながります[193]。さらに、プレボテラの減少につながる可能性があり[193]、これは慢性不眠症患者にも観察されています[58]。 |
| 3.5.6. 過剰な肉の摂取 |
| 肉の過剰摂取、特に赤身肉や高度に加工された肉の過剰摂取は、フィルミクテス属細菌やプロテオバクテリアの増加につながる可能性があります[194]。さらに、動物性脂肪を多く含む食事は、短鎖脂肪酸やリポ多糖類の産生を減少させ、全身性の低レベルの炎症を引き起こす可能性があります[16,195]。体内での短鎖脂肪酸の最適な産生は、睡眠の質に影響を与える要因です[158]。これらの酸はトリプトファン水酸化酵素1の産生に影響を与え、セロトニン合成の増加に寄与する可能性があります[45,66]。肉を含む加工食品の過剰摂取は、腸管透過性を高める可能性もあります[196]。 |
| 3.5.7. アルコール |
| アルコール飲料の摂取は腸内細菌叢の機能に悪影響を及ぼす[197,198]。妊婦のアルコール摂取は新生児の腸内細菌叢に影響を及ぼす可能性がある[198,199]。妊娠中にアルコールを摂取した母親から生まれた新生児では、メガモナス属細菌の増加が観察されており、これが後の腸内細菌叢の定着に影響を与える可能性がある[200]。慢性および急性のアルコール摂取は、腸内細菌叢に特定の変化をもたらす可能性がある[201]。アルコール摂取は、アクチノバクテリアとプロテオバクテリアの数を増加させ、フィルミクテス属細菌の数を減少させる可能性がある[202]。慢性的なアルコール摂取は、バクテロイデス属細菌の減少とプロテオバクテリアの増加につながる可能性がある。さらに、腸管透過性の増加など、腸管バリアに悪影響を与える可能性がある[198,203]。 |
| 4. 強みと限界 |
| PubMedデータベースを徹底的に検索し、議論されたトピックに関連するすべてのシステマティックレビューとメタアナリシスを見つけるためにあらゆる努力を払いました。本論文では、食生活の多様性と腸内細菌叢、特定の代謝産物の産生、そして睡眠の質への影響との関係を分析しています。さらに、睡眠障害と腸内細菌叢が合併症の発生にどのように寄与するかについても検証しています。本論文の目的は、過去の知見と本研究の現在の理解を形作ったデータと方法論を収集し、最新かつ詳細な文献分析を提供することでした。 |
| 本研究の限界の一つは、既存の文献に依存していることです。これらの文献の多くは、比較的小規模な参加者を対象とした研究です。より信頼性が高く包括的な結論を導き出すためには、より多くの参加者を対象とした更なる研究を行い、腸内細菌叢と食事が睡眠に与える影響をより深く理解する必要があります。 |
| さらに、この記事では腸内細菌叢が睡眠の質に与える影響に関する現在の知識をレビューしていますが、さまざまな集団や状況にわたってこれらの問題を調査するには、より詳細な実験的研究が必要です。 |
| 最後に、腸内マイクロバイオームと食事に関する研究では、多様な方法論が用いられており、結果を比較し明確な結論を導き出すことが困難となっています。こうした方法論の違いには、食物摂取量の測定方法、マイクロバイオームの分析に用いられる技術、そして研究対象となる多様な集団が含まれます。 |
| 5. 要約 |
| 研究によると、腸と脳は腸-腸内細菌叢-脳軸を介してつながっており、腸内細菌叢は免疫調節、神経内分泌、迷走神経経路を介して脳に影響を与えていることが示唆されています[21,22]。ヒトの腸に定着する微生物は、神経系に影響を及ぼす神経伝達物質を含む様々な代謝物を産生します。微生物による代謝物の産生は周期的に起こり、宿主の概日リズムと代謝の調節に重要な役割を果たしています。この新たな証拠は、腸内細菌叢が代謝恒常性と生体のリズムに重要な影響を与えていることを示唆しています[26,28]。 |
| 食物繊維は腸内細菌叢によって大腸内で発酵され、短鎖脂肪酸が生成されます。研究によると、ラクノスピラ科UCG004やオドリバクターなどの短鎖脂肪酸産生に関与する特定の細菌株は、睡眠時間の延長に寄与することが示されています[51]。短鎖脂肪酸は、γ-アミノ酪酸とセロトニンの合成を調節することで睡眠に影響を与える可能性があります。神経系の主要な抑制性神経伝達物質であるγ-アミノ酪酸は、覚醒経路を抑制することで睡眠促進に重要な役割を果たします[42,63]。 |
| 腸内におけるセロトニン産生は、腸内細菌叢、食事、宿主のシグナル伝達ホルモン、ペプチドに依存しています[45]。腸内細菌叢は、最適なメラトニン産生をサポートする上で重要な役割を果たし、睡眠調節やその他の概日リズム関連機能に大きな影響を与えている可能性があります[75,76,79]。 |
| 栄養は腸内細菌叢に大きな影響を与えます。細菌叢の構成に影響を与える要因には、食事の質、食事のタイミング、そしてその規則性が含まれます[33,35]。研究では、早めの食事が代謝恒常性と概日リズムに良い影響を与えることが示されています[35,142]。さらに、オリーブオイルに含まれる一価不飽和脂肪酸や魚油に含まれるオメガ3系多価不飽和脂肪酸など、健康的な脂肪を豊富に含む食事は、腸内細菌叢に良い影響を与える可能性があります[182]。さらに、様々な植物性食品に含まれる食物繊維や、植物に天然に含まれるポリフェノールを定期的に摂取することで、腸内細菌叢の多様性と機能をサポートし、全体的な健康に貢献します[53,153,171,173]。したがって、健康的な脂肪、食物繊維、ポリフェノールを含む、栄養価の高い食事を定期的に摂取するバランスの取れた食事は、健康な腸内細菌叢と全体的な健康、ひいては睡眠の質を維持するために不可欠です。 |
| 6. 結論 |
| 食物繊維、ポリフェノール、不飽和脂肪酸を豊富に含む食品を含む多様な食事を摂取することは、腸内細菌叢に好ましい影響を与え、睡眠パターンに影響を与える可能性があります。腸内細菌叢によって合成される短鎖脂肪酸、γ-アミノ酪酸、セロトニン、メラトニン、トリプトファンなどの代謝物は、睡眠調節を含む生理機能の調節に重要な役割を果たしています。腸内細菌叢構成の不均衡は、睡眠障害だけでなく、肥満、心血管疾患、精神疾患などの慢性疾患の発症にも関連している可能性があります。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Nutrients. 2024 Jul 13;16(14):2259.に掲載されたThe Role of Gut Microbiome in Sleep Quality and Health: Dietary Strategies for Microbiota Support.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


