ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
不眠症に対するマイクロバイオームベースの治療法 |
Chenyu Li et al., |
|
|
| 要約 |
不眠症は、認知機能障害、免疫機能の低下、代謝機能障害、心血管疾患、そして生活の質の低下など、身体的および精神的健康に多大なリスクをもたらします。世界的に不眠症が著しく増加していること、そして腸内細菌叢とこの疾患との関連を示す科学的エビデンスが増加していることから、不眠症への介入として腸内細菌叢を標的とする治療法が注目を集めています。本レビューでは、食事療法、プロバイオティクス、プレバイオティクス、ポストバイオティクス、シンバイオティクスによる介入、そして糞便細菌叢移植など、不眠症に対する現在のマイクロバイオームに基づく治療法を概説します。さらに、これらの技術の有効性と弱点を評価し、将来の研究に有益な知見を提供します。 |
| 目次(クリックして記事にアクセスできます) |
| 1. 不眠症:学術的視点 |
| 2. 睡眠調節における腸内細菌叢の重要な役割 |
| 3. 腸内細菌叢によって制御される不眠症関連経路の可能性 |
| 3.1. 腸内細菌叢はHPA軸(視床下部-下垂体-副腎系)を調節し、睡眠に影響を与える |
| 3.2. 腸内細菌叢由来代謝物と睡眠への影響 |
| 3.2.1. 短鎖脂肪酸 |
| 3.2.2. 神経伝達物質 |
| 3.3. 腸内細菌叢は睡眠障害によって引き起こされる免疫系の刺激に関与する |
| 3.4. 腸内細菌叢は迷走神経を活性化し、睡眠に影響を与える |
| 4. 不眠症に対するマイクロバイオームに基づく治療法 |
| 4.1. 食事の改善 |
| 4.2. プレバイオティクス |
| 4.3. プロバイオティクス |
| 4.4. ポストバイオティクス |
| 4.5. シンバイオティクス |
| 4.6. 糞便微生物移植(FMT) |
| 5. 結論と展望 |
本文 |
| 1. 不眠症:学術的視点 |
| 不眠症は、入眠困難または睡眠状態の維持困難、ならびに日中の睡眠障害を特徴とする一般的な睡眠障害です[1]。成人の約40%が不眠症の症状を呈し、10.8%が慢性不眠症に苦しんでいます[2]。特に、慢性疾患を抱える高齢者やストレスの高い人は、不眠症に非常にかかりやすいことが知られています[3]。睡眠不足は、慢性疾患(例:心血管疾患、糖尿病、肥満)や精神疾患(例:うつ病、不安症)のリスクを高めます[4,5,6,7]。不眠症の一般的な評価方法としては、自己申告質問票(ピッツバーグ睡眠品質指数(PSQI)、小栗・白川・安積睡眠評価尺度、不眠症重症度指数など)や睡眠ポリグラフモニタリング(脳波(EEG)、眼球運動、筋電図など)があり、睡眠状態、不眠症の症状、睡眠の質を測定します [8,9]。不眠症の治療は、睡眠の質と量の両方を改善することを目指します [10]。現在の不眠症治療は、主に薬物療法と心理療法です。しかし、ベンゾジアゼピンなどの薬物療法には、過度の神経毒性、依存性、耐性などの副作用があります [11]。認知行動療法などの心理療法は長期的な有効性が実証されていますが、訓練を受けたセラピストの不足と費用の高さから、その利用は限られています [12]。シーケンシングとマルチオミクス解析技術の発達により、腸内細菌叢の生物学に関する現在の理解は、睡眠の調節における腸内細菌叢の重要な役割を明らかにし、不眠症の症状を緩和するためのマイクロバイオームベースの治療法の可能性を浮き彫りにしている[13]。 |
| 2. 睡眠調節における腸内細菌叢の重要な役割 |
| ヒトの腸内には、細菌、真菌、ウイルス、古細菌など、多量の微生物が生息しています[14]。腸内細菌叢は、代謝プロセスへの関与、免疫機能のサポート、神経系の健康への影響などを通じて、恒常性の維持に重要な役割を果たしています[15]。腸内細菌叢の構成は、遺伝的背景、年齢、健康状態などの宿主特異的な要因、および食事、運動、異物(抗生物質、プレバイオティクス、プロバイオティクス、ポストバイオティクスなど)、衛生状態などの環境要因によって変化する可能性があります[16]。腸内細菌叢構成の不均衡は、いわゆるディスバイオシス(dysbiosis)と呼ばれ、睡眠効率に大きな影響を与えます。例えば、腸内細菌叢が枯渇したマウスは、活動期における非急速眼球運動睡眠(NREM睡眠)が著しく減少しました[17]。対照的に、活動期には、これらのマウスはノンレム睡眠とレム睡眠の両方でより長い時間過ごし、ノンレム睡眠とレム睡眠の遷移頻度も増加した。臨床研究では、健康な人と不眠症患者では、腸内細菌叢の構成、多様性、代謝機能に明確な違いがあることが示されている[18]。不眠症患者は、微生物多様性が低く、短鎖脂肪酸(SCFA)産生細菌が少なく、潜在的な病原性細菌が拡大している[19]。門レベルでは、不眠症患者は健康な人よりもバクテロイデス門の相対的存在量が高く、フィルミクテス門と放線菌の相対的存在量が低い[18,20,21]。属レベルでは、ゲミガー属とフシカテニバクター属が不眠症患者の主要な細菌属である[18]。腸内細菌叢と睡眠の間に新たな相関関係が見られるようになったことを受け、微生物バランスの回復を目指す戦略は、不眠症治療の新たな道筋となる。本レビューでは、食事療法、プロバイオティクス、プレバイオティクス、ポストバイオティクス、シンバイオティクスによる介入、そして糞便細菌叢移植(FMT)といった、マイクロバイオームに基づく不眠症治療の先進性を概説し、腸内細菌叢プロファイルを繊細に制御することで不眠症治療が有望な可能性を示唆する。 |
| 3. 腸内細菌叢によって制御される不眠症関連経路の可能性 |
| 図1に示すように、不眠症に対するマイクロバイオームに基づく治療法の基盤は、腸内細菌叢と脳の関係にあります。腸内細菌叢は、脳-腸内細菌叢軸(視床下部-下垂体-副腎軸、細菌叢代謝物、免疫系、迷走神経からなる双方向コミュニケーションシステム)を通じて睡眠に影響を与えます。 |
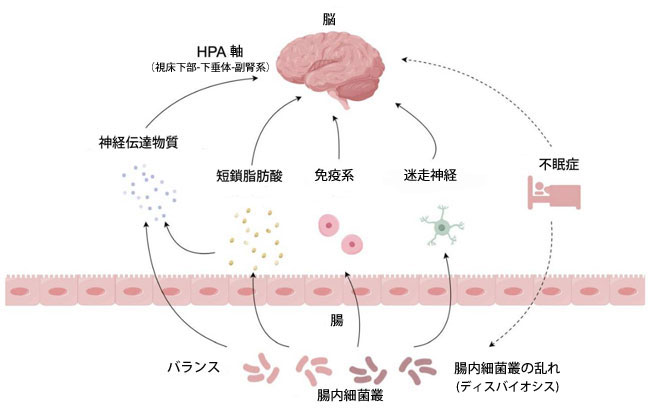 |
| 図1 腸内細菌叢が睡眠を調節するメカニズム |
| 3.1. 腸内細菌叢はHPA軸を調節し、睡眠に影響を与える |
| HPA軸(訳者注:視床下部-下垂体-副腎系)は、ストレスへの対応、代謝、免疫などの恒常性を調節する神経内分泌システムです)は、副腎皮質刺激ホルモン(ACTH)やコルチゾールなどのホルモンを調節することで、ストレスに対する身体の反応を調整する神経内分泌系である[22]。入眠時にはHPA軸の活動が抑制され、副腎皮質刺激ホルモンとコルチゾールの分泌が減少する。逆に、覚醒時にはHPA軸の活動が亢進し、副腎皮質刺激ホルモンとコルチゾールの血漿濃度が上昇する[23,24]。HPA軸と不眠症の間には双方向の関係があり、活性化したHPA軸は睡眠を浅くし、夜間の覚醒回数を増やす可能性がある。一方、不眠症患者は健常者と比較して、24時間血漿中の副腎皮質刺激ホルモンとコルチゾール濃度が有意に高い傾向がある[25]。腸内細菌叢は、微生物抗原、サイトカイン、プロスタグランジンを介してHPA軸を刺激する一方で、その代謝物である短鎖脂肪酸はHPA軸の反応を減弱させる可能性がある[26]。したがって、腸内細菌叢を介してHPA軸の活性を制御することは、不眠症治療の潜在的なアプローチとなる可能性がある。 |
| 3.2. 腸内細菌叢由来代謝物と睡眠への影響 |
| 短鎖脂肪酸や神経伝達物質など、腸内細菌叢の主要な代謝物は、睡眠の調節に重要な役割を果たします。 |
| 3.2.1. 短鎖脂肪酸 |
| 短鎖脂肪酸は、消化管における嫌気性細菌発酵の最終産物であり、主に酢酸、プロピオン酸、酪酸から構成されています[27]。研究によると、不眠症患者では短鎖脂肪酸産生細菌の相対的な存在量が低いことが示されています[19]。短鎖脂肪酸は、神経伝達物質の産生を促進し、抗炎症作用を発揮し、概日リズムの調整を促進することで睡眠を調節します[28,29,30]。腸管において、短鎖脂肪酸はトリプトファン水酸化酵素1のレベルを高めるか、腸管クロム親和性細胞上の特定の受容体に結合することで、セロトニン分泌を促進します[28]。さらに、短鎖脂肪酸は炎症性サイトカインの産生を抑制し、抗炎症性サイトカインの放出とT細胞の分化を促進します[29]。これらの作用は、脳内の神経炎症を軽減し、睡眠の質を向上させるのに役立ちます。短鎖脂肪酸は概日時計遺伝子の発現に影響を与え、概日リズムの調整を助けることが示されています[30]。特に、げっ歯類を対象とした最近の研究では、酪酸を投与するとマウスのノンレム睡眠が約50%増加することが示されました[31]。 |
| 3.2.2. 神経伝達物質 |
| 腸内細菌叢は、γ-アミノ酪酸(GABA)やセロトニンなど、睡眠調節に重要な役割を果たす様々な神経伝達物質を産生する能力を持っています。γ-アミノ酪酸は中枢神経系の主要な抑制性神経伝達物質であり、γ-アミノ酪酸受容体の活性化は睡眠を促進します[32]。γ-アミノ酪酸は主にグルタミン酸作動性ニューロンとその関連受容体の活動を阻害し、それによってノンレム睡眠を促進します[33]。原発性不眠症患者は、健常者と比較して脳内γ-アミノ酪酸濃度が約30%低下していました[34]。健常者の便検体のトランスクリプトーム解析により、バクテロイデス属、パラバクテロイデス属、および大腸菌属においてγ-アミノ酪酸産生経路が活発に発現していることが明らかになりました[35]。 |
| セロトニンはモノアミン伝達物質であり、主に大脳皮質とシナプスに存在する [36]。セロトニン作動系は睡眠覚醒行動および睡眠構造に関与している。脳内のセロトニン欠乏症を持つラットは、睡眠覚醒周期の概日リズムの乱れを示し、非活動期のノンレム睡眠の減少と活動期の徐波睡眠の持続時間の増加を特徴とした [37]。広域スペクトル抗生物質によってセロトニンが枯渇したマウスも、非活動期のノンレム睡眠が減少した [17]。パラクロロフェニルアラニン(PCPA)は脳内のセロトニンを枯渇させて不眠症を引き起こす可能性があるが、セロトニン前駆体を投与することで睡眠行動を回復させることができる [38]。特定のプレバイオティクスおよびプロバイオティクスは、セロトニン前駆体であるトリプトファンの産生を調節することにより、そのレベルを上昇させることができる [39]。マウスとヒト由来の土着胞子形成細菌は、腸内におけるセロトニンの合成を促進する可能性がある[40]。セロトニンはまた、概日リズムを調節し睡眠を促進するホルモンであるメラトニンの前駆体でもある[41]。高齢の不眠症患者ではメラトニン分泌の低下が観察されている[42]。メラトニンの補給は睡眠効率を改善し、入眠潜時を短縮すると報告されている[43,44]。 |
| 3.3. 腸内細菌叢は睡眠障害によって引き起こされる免疫系の刺激に関与する |
| 慢性不眠症は免疫系を刺激し、炎症反応を活性化し、酸化ストレスを増加させる可能性があり、腸内細菌叢はこれらのプロセスに大きく寄与している[45]。研究により、不眠症患者ではIL-1βレベルの上昇とTNF-αレベルの低下がみられることが明らかになった。免疫因子の変化は、様々な免疫関連疾患と密接に関連するプレボテラ属細菌の相対的存在量の増加と関連している[46]。腸内細菌叢によって産生される短鎖脂肪酸は、TNF-αやIL-6などの炎症性サイトカインの放出を抑制することができる[47]。プロバイオティクスの補給は、マウスの脳の抗酸化能を高めることで、炎症と酸化ストレスを軽減する[48]。 |
| 3.4. 腸内細菌叢は迷走神経を活性化し、睡眠に影響を与える |
| 迷走神経は、腸内細菌叢、脳、睡眠の間のつながりを媒介する。ラクトバチルス・ラムノサスの摂取は、正常マウスにおいて中枢γ-アミノ酪酸(GABA)受容体の発現を変化させ、不安および抑うつ関連行動を軽減したが、迷走神経切断マウスでは減少が見られなかった[49]。さらに、睡眠不足によって引き起こされた全身性炎症を呈するマウスの糞便細菌叢を移植すると、無菌(GF)マウスにおいて血漿中の炎症マーカー値が上昇したが、この効果は迷走神経切断無菌マウスでは観察されなかった[50]。 |
| 4. 不眠症に対するマイクロバイオームに基づく治療法 |
| このセクションでは、食事療法、プレバイオティクス、プロバイオティクス、ポストバイオティクス、シンバイオティクスによる介入、そして糞便微生物移植(FMT)など、不眠症に対するマイクロバイオームに基づく治療法に焦点を当てます。図2に示すように、これらすべてが睡眠改善に有益な知見をもたらします。 |
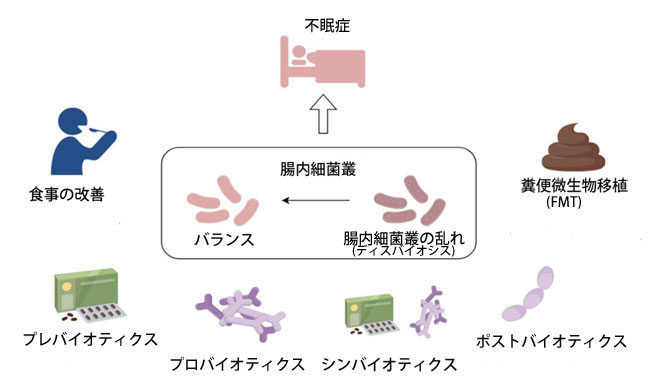 |
| 図2. 食事の変更、プレバイオティクス、プロバイオティクス、シンバイオティクス、ポストバイオティクス、糞便微生物叢移植など、不眠症に対する現在のマイクロバイオームベースの治療法の概要。 |
| 4.1. 食事の改善 |
| 食生活パターンとは、食事における様々な食品、飲料、栄養素の量、割合、種類、または組み合わせとして定義されます[51]。成人期以降、人は睡眠の調節に重要な役割を果たす有益な微生物組成を維持するために、主に健康的な食事に依存します。全身代謝プロファイルは、不眠症患者は健常者と比較してエネルギー代謝産物のレベルが有意に高いことを示しています[52]。さらに、肥満者はフェカリバクテリウムの顕著な減少を示しており、これは慢性不眠症患者にも観察されています[19,53]。しかし、カロリー制限食と身体活動の増加を組み合わせることで、肥満の青年は腸内におけるラクトバチルス属細菌群の量を増やすことができ、睡眠促進に有益な役割を果たすことが知られています[54]。高グリセミック指数およびグリセミックロードの食事は、不眠症および睡眠の質の低下のリスク増加と関連しています[55,56]。これは、長期にわたる高糖質摂取が免疫系を刺激し、過剰な炎症反応を引き起こし、睡眠が断片化されるためです [57,58]。逆に、植物、抗酸化物質、不飽和脂肪が豊富な食事パターンである地中海式ダイエットは、睡眠の質の改善と睡眠時間の延長に関連付けられています [59]。潜在的な理由としては、酪酸産生細菌の増加と、腸内細菌叢の代謝活動の大幅な変化にあります [60]。一部の機能性食品の睡眠改善効果も報告されています。研究によると、霊芝は、ビフィズス菌、インドール-3-カルボン酸、アセチルリン酸などの有益な細菌とその代謝産物を豊富に含み、腸内細菌叢の組成を変化させることで、マウスの入眠潜時を短縮し、睡眠時間を延長できることが示されています [61]。さらに、習慣的なお茶の摂取は、腸内細菌叢-胆汁酸軸を通じて、腸内細菌叢の不均衡や慢性不眠症による胆汁酸の代謝障害を緩和することができる[62]。 |
| 4.2. プレバイオティクス |
| プレバイオティクスは、消化されない食品成分であり、大腸内の特定の細菌の増殖と活性を選択的に刺激することで宿主の健康に有益です。げっ歯類を用いた研究では、プレバイオティクスが睡眠調節に良い影響を与えることが実証されています。プレバイオティクス食(ガラクトオリゴ糖、ポリデキストロース、ラクトフェリン、ホエイタンパク質濃縮物(乳脂肪球状膜タンパク質-10)を配合)は、マウスの睡眠パターンに良い影響を与え、通常の状況ではノンレム睡眠を増強し、ストレスの多い状況ではレム睡眠を延長させました[63]。糞便代謝分析では、プレバイオティクス食はアロテトラヒドロデオキシコルチコステロン値を低下させることが示されました。この代謝物はγ-アミノ酪酸(GABA)作動性神経系を阻害する可能性があり、妊娠中の睡眠の質の低下とも関連しています。別の研究では、プレバイオティクス食(ガラクトオリゴ糖とポリデキストロースを配合)を摂取したラットは、睡眠障害下で対照食を摂取したラットと比較して、ノンレム睡眠とレム睡眠が長くなることが示されました[64]。マイクロバイオーム解析の結果、プレバイオティクス群ではパラバクテロイデス・ディスタソニスの相対的存在量が増加しており、これは睡眠の促進と概日リズムの回復と関連している[65]。プレバイオティクスを含む食事を与えられたラットは、ストレス曝露時の睡眠効率が向上し、糞便中にはα多様性の上昇とラクトバチルス・ラムノサスの相対的存在量の増加が認められた[66]。 |
| プレバイオティクスの有益な効果は臨床試験でも実証されています。ヒト研究では、45人の参加者がランダムに3つのグループに分けられ、それぞれフルクトオリゴ糖(FOS)、ガラクトオリゴ糖(GOS)、またはプラセボが投与されました[67]。結果によると、ガラクトオリゴ糖グループの参加者は睡眠の質が改善し、唾液コルチゾール覚醒反応が有意に低下しました。このコルチゾールの減少は、腸内細菌叢におけるビフィズス菌の相対的存在量の増加と相関しており、ビフィズス菌はガラクトオリゴ糖を代謝し、精神的健康にプラスの影響を与えることが知られています[68]。難消化性デキストリンは、炎症とHPA軸(視床下部-下垂体-副腎系)の活性を軽減することで、2型糖尿病の女性患者の睡眠の質を改善することが示されている別のプレバイオティクスです[69]。ランダム化二重盲検プラセボ対照試験でも、プレバイオティクス酵母マンナンの睡眠改善効果が報告されています[70]。脳波モニタリングの結果、酵母マンナン群では、ノンレム睡眠ステージ3の持続時間と就寝時間がプラセボ群と比較して有意に長かったことが示されました。さらに、メタボローム解析により、糞便中のプロピオン酸およびγ-アミノ酪酸(GABA)濃度の変化が、プレバイオティクス介入による睡眠促進効果に寄与する重要な要因であることが確認されました。 |
| 多くの伝統漢方処方はプレバイオティクスと同様の作用を持ち、睡眠促進効果を発揮します。黄連(オウレン)と桂皮(ケイヒ)からなる膠太丸は、睡眠を促進し、慢性的な睡眠不足によって引き起こされる炎症やインスリン抵抗性を緩和すると報告されています[71]。オミクス解析の結果、膠太丸をマウスに投与すると、ラクノスピラ科、バクテロイデス属、アッカーマンシア属の相対的存在量が有意に増加することが示されました。白毫(バイレミアン)は、腸内細菌叢の構成を再構築し、神経伝達物質のレベルを回復させることで、マウスにおけるPCPA誘発性不眠症を有意に軽減することが報告されています[72]。 |
| 4.3. プロバイオティクス |
| プロバイオティクスは、腸内細菌叢のバランスを促進することで宿主の健康をサポートする生きた微生物です[73]。プロバイオティクスは、有害な細菌と栄養素を競合し、有益な代謝産物を産生し、宿主の免疫反応を調節することで、腸内細菌叢を再構築します[74]。睡眠におけるマイクロバイオームの役割に関する理解が深まるにつれ、プロバイオティクスの補給は不眠症を軽減する効果的な治療法として浮上しています(表1)。げっ歯類を用いた研究では、プロバイオティクス補給が睡眠改善に有効であることが実証されています。プロバイオティクスであるラクトバチルス・ブレビスDL1-11で発酵させた乳を投与されたマウスは、プラセボを投与されたマウスと比較して、入眠潜時が短縮し、睡眠時間が長くなりました[75]。これは、DL1-11が大量のγ-アミノ酪酸を産生するため、リラックス効果を促進し、睡眠の質を向上させることができるためです。別の研究では、ラクトバチルス ファーメンタムPS150TMが視床下部のアデノシンA1受容体の発現を増加させることで、正常なマウスの睡眠を効果的に促進し、カフェイン誘発性不眠症マウスの不眠症症状を軽減したことが報告されています[76]。同じ研究チームはまた、ラクトバチルス ファーメンタムPS150TMが初夜効果(FNE)による睡眠障害のあるマウスのノンレム睡眠を回復できることも発見しました。これは、腸内細菌叢の組成を再構築する能力によるものと考えられます[77]。初夜効果とは、睡眠研究で観察される現象で、人は見慣れない環境にさらされると覚醒度と不安が高まり、その結果、急性不眠症を引き起こすことが多いとされています[78]。睡眠障害がストレスや不安のレベルと密接に関連していることは間違いありません。さらに、多くのプロバイオティクスが睡眠の質と精神的健康の両方を同時に改善することが示されていることが示されている。ラクトバチルス ファーメンタムPS150TMは、セロトニン経路を変化させることで、慢性的な軽度のストレスを受けたラットのうつ病と不安を軽減することが示されている[79]。このことは、適切な量を投与すると精神的な健康上の利益をもたらすプロバイオティクスであるサイコバイオティクスが睡眠を改善する可能性があることを浮き彫りにしている[80]。 |
| 表 1. プロバイオティクス治療による睡眠への影響 |
 |
 |
| 数多くのヒト試験により、サイコバイオティクスが睡眠の質を改善する可能性があることが実証されています。ビフィドバクテリウムの補給は、特にストレスを感じている人の睡眠の質を改善する可能性があることから注目を集めています。ビフィドバクテリウム・ブレーベCCFM1025は、HPA軸(視床下部-下垂体-副腎系)の活性を抑制することで、ストレス誘発性不眠症と診断された患者の睡眠を改善し、ストレスレベルを軽減しました[81]。ビフィドバクテリウム・ロンガム1714の投与は、試験のストレスによる睡眠障害を経験している健康な成人の睡眠の質を著しく改善し、日中の機能障害を軽減しました[82]。しかし、この研究の脳波(EEG)モニタリング結果には有意な変化は見られませんでした。ビフィドバクテリウム・ロンガム1714に関する補足研究では、ピッツバーグ睡眠品質指数(PSQI)スコアに有意な変化は見られませんでしたが、全体的な睡眠時間の増加が指摘されました[83]。ビフィドバクテリウム・アドレセンティスSBT2786は、レム睡眠時間を増加させることで総睡眠時間を延長させることができましたが、主観的な睡眠の質を向上させることはありませんでした[84]。興味深いことに、研究者らは、ストレスレベルの高い参加者がビフィドバクテリウム・アドレセンティスSBT2786のより大きな効果を実感し、睡眠時間の大幅な改善と日中の疲労感の軽減を示したことを発見しました。ビフィドバクテリウム・アドレセンティスSBT2786をサイコバイオティクスと分類するには十分な証拠はありませんが、高ストレス下にある個人を対象としたサブグループ解析は、ビフィドバクテリウム・アドレセンティスSBT2786がメンタルヘルスに及ぼす可能性を示唆しています。 |
| 多くの乳酸菌株は、睡眠を促進する可能性のあるサイコバイオティクスでもあります。ラクトバチルス プランタラム PS128 は、不眠症を自覚した患者の深い睡眠を大幅に改善し、疲労感と抑うつ症状を軽減しました [85]。げっ歯類の研究では、ラクトバチルス プランタラム PS128が線条体のセロトニンとドーパミンを増加させる可能性があることが示されており、これが有益な効果の根本的なメカニズムである可能性があります [86]。ラクトバチルス ガセリ CP2305 も腸内細菌叢の組成を改善し、唾液中のコルチゾール濃度を低下させることで、ストレスを軽減し、睡眠を改善することが示されています [87]。ラクトバチルス カゼイ シロタミルクは、睡眠時間を延長し、起床時の眠気を軽減することで、学業試験のストレスに直面している人を助けました [88]。脳波モニタリングにより、睡眠、ストレス、プロバイオティクスの相互作用がさらに明らかになりました。試験が近づくにつれて、参加者は睡眠潜時の延長やノンレム睡眠ステージ3時間の短縮など、睡眠に関する困難が増した。しかし、シロタ乳酸菌による介入により、これらの悪影響は著しく軽減された。シロタ乳酸菌は、睡眠障害のある人の日中のパフォーマンスを効果的に改善することも報告されている[89]。ラクトコッカス ラクチス亜種クレモリス YRC3780も、日本で実施された二重盲検プラセボ対照臨床試験で証明されているように、睡眠を改善し、ストレスを軽減する可能性を示している[90]。この研究では、ラクトコッカス ラクチス亜種クレモリス YRC3780介入を受けた参加者で主観的な睡眠の質と精神的健康が有意に改善したと報告された。脳波記録では実質的な差は見られなかったものの、ラクトコッカス ラクチス亜種クレモリス YRC3780群では朝のコルチゾール値の低下が認められた。これは、睡眠の客観的な改善が、HPA軸(視床下部-下垂体-副腎系)内でのストレス反応の減少と関連している可能性があることを示唆している。 |
| プロバイオティクスは睡眠の質を改善するだけでなく、睡眠不足に伴う有害な影響を軽減します。フェカリバクテリウム・プラウスニッツィによる前コロニー化は、睡眠不足のマウスにおいて炎症反応を抑制し、アポトーシスを減少させ、腸管バリアの完全性を保護することができます [91]。その根本的なメカニズムは、フェカリバクテリウム・プラウスニッツィがクレブシエラやブドウ球菌などの有害細菌の存在を減らすことで腸内細菌叢の恒常性を回復させ、同時にアッカーマンシアなどの有益細菌の増殖を促進することです。ラクティプランティバチルス・プランタラム124 による前コロニー化も、酸化ストレス、炎症、結腸バリアの損傷、そして睡眠不足によって引き起こされる腸内細菌叢の異常を軽減しました [92]。腸内細菌叢の分析により、ラクティプランティバチルス・プランタラム124 はデュボシエラ、フェカリバキュラム、バチルス、ラクノクロストリジウム、ビフィドバクテリウムなどの有益な細菌の豊富さを回復することで腸内細菌叢のバランスを整えることが示されました。 |
| 4.4. ポストバイオティクス |
| ポストバイオティクスとは、宿主に健康上の利益をもたらす非生物微生物とその成分を指します[93]。ポストバイオティクスには、不活化されたプロバイオティクスに加え、短鎖脂肪酸、ビタミン、有機酸、そしてテイコ酸やペプチドグリカンなどの細胞成分といった代謝産物も含まれ、これらは非生物状態でも宿主に健康上の利益をもたらします[94]。プロバイオティクスと比較して、ポストバイオティクスは生物活性を持たないため、より安全です。げっ歯類を用いた研究では、マウスに酪酸を直接注射することで、短鎖脂肪酸が睡眠を延長させることが確認されています[31]。さらに、ヒトを対象とした研究では、短鎖脂肪酸の混合物による治療が、睡眠導入に有益なコルチゾール反応を有意に減弱させることが示されています[95]。グラム陽性細菌の細胞壁成分であるリポテイコ酸は、マウスにおいて用量依存的にノンレム睡眠を増加させることが分かっています[96]。加熱殺菌したラクトバチルス・ブレビスSBC8803をマウスに投与したところ、活動期のノンレム睡眠が有意に減少し、不活動期のノンレム睡眠時間が延長した[97]。ラクトバチルス・ブレビスSBC8803は迷走神経活動を調節し、セロトニンの放出を促進することが報告されている[98,99]。さらに、加熱殺菌したラクトバチルス・ブレビスは、マウスの不活動期のノンレム睡眠とレム睡眠を増加させ、加熱殺菌したラクトバチルス・ガセリCP2305は慢性ストレスを受けた人の睡眠障害を改善した[100]。 |
| 4.5. シンバイオティクス |
| シンバイオティクスは、プロバイオティクスとプレバイオティクスの混合物であり、相乗的に作用して宿主の健康を促進します。シンバイオティクスが純粋な不眠症に及ぼす影響を具体的に検討した研究は少ないものの、有望な結果が得られていることが研究で示されています。二重盲検ランダム化比較試験の結果、シンバイオティクス製剤(SIM01)がCOVID-19急性期後の不眠症を効果的に軽減することが示されました[101]。さらに、別の臨床研究では、シンバイオティクスの補給が、血液透析を受けている末期腎疾患患者の睡眠の質を改善する可能性があることが示唆されました[102]。 |
| 4.6. 糞便微生物移植(FMT) |
| 糞便微生物移植(FMT)は、健康なドナーの便を患者の消化管に移植する医療行為です[103]。健康なドナーから採取した多様な微生物は、腸内を有益な細菌で再増殖させるのに役立ち、腸内細菌叢のバランスが回復することで、有害な病原体に対する宿主防御として機能します。糞便微生物移植は、炎症性腸疾患(IBD)に伴う潰瘍性大腸炎の治療において有望な結果を示しています[104]。現在、腸内細菌叢がマイクロバイオーム・脳軸を介して中枢神経系に影響を及ぼす可能性があることから、精神疾患の潜在的な治療法として糞便微生物移植に焦点を当てた研究が増えています(表2)。臨床研究では、洗浄腸内細菌叢移植(WMT)が、様々な基礎疾患を持つ患者の睡眠障害を有意に改善することが実証されています[105]。 16s rRNAの結果は、糞便微生物移植がビフィドバクテリウム、プレボテラ7、ルミノコッカス・グナバス、フェカリバクテリウムなどの有益細菌の相対的存在量を増加させ、大腸菌-赤痢菌や連鎖球菌などの有害細菌の相対的存在量を減少させたことを示した。 糞便微生物移植はまた、睡眠効率の改善、精神的健康の増進、胃腸症状の緩和により、睡眠障害や精神障害を経験する過敏性腸症候群の患者を支援した[106]。 注目すべきことに、睡眠の質の改善を経験した患者は、うつ病や過敏性腸症候群症状の重症度も大幅に減少した。 これは、腸内細菌叢の再構築が患者の包括的な改善につながることを示唆している。 別のオープンラベル観察研究では、睡眠障害を経験している胃腸疾患の患者で同様の結果が得られ、著者らは全体的な改善は糞便微生物移植治療後の細菌叢の多様性の増加に起因すると示唆した[107]。実際の研究では、糞便微生物移植(FMT)、プロバイオティクス、慢性不眠症の関連性がさらに示されました [108]。さまざまな慢性疾患の患者が不眠症の有無に基づいて無作為に2つのグループに分けられ、4週間の糞便微生物移植治療を受けました。その結果、糞便微生物移植は不眠症患者の睡眠の質を有意に改善し、入眠時間を短縮し、睡眠効率を高めました。腸内細菌叢の組成を比較することで、研究者らは、糞便微生物移植によって、ラクトバチルス、ビフィドバクテリウム、およびツリシバクターを含む短鎖脂肪酸産生プロバイオティクスの相対的な存在量が有意に増加することを発見しました。ただし、これらの研究はすべて、不眠症を他の疾患に関連する合併症として調査したため、睡眠の改善は疾患症状の緩和にも起因する可能性があり、睡眠障害に対する糞便微生物移植の有効性についてはさらなる調査が必要です。さらに、糞便微生物移植の安全性も考慮する必要があります [109]。糞便微生物移植サンプルの安全性評価は、既知の病原体の特定とドナーの完全な健康状態に基づいています。また、腸内細菌叢に関する理解が限られているため、ドナーの細菌叢に日和見有害細菌が含まれているかどうかを判断することは困難です。 |
| 表2. 糞便微生物移植治療による不眠症への効果 |
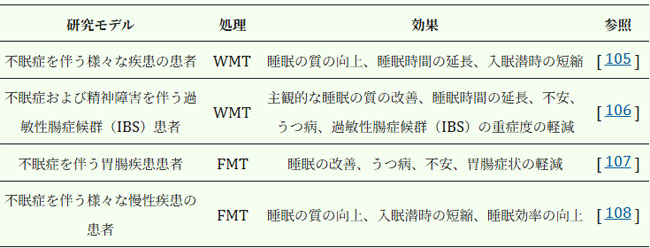 |
| WMT: 洗浄腸内細菌叢移植、FMT:糞便微生物移植 |
| 5. 結論と展望 |
| 本レビューでは、不眠症の症状を緩和し、睡眠の質を高めるための最新のマイクロバイオームに基づく治療法について述べる。食事は腸内細菌叢を形成し、睡眠の調節に重要な役割を果たしている。エネルギーや糖分の過剰摂取など、食習慣の乱れが見られる人は不眠症になりやすい。睡眠の質を改善するためには、地中海式ダイエット、プレバイオティクスサプリメント、機能性食品の摂取が強く推奨される。ビフィズス菌と乳酸菌を含むプロバイオティクス療法は、特にストレスによって引き起こされる急性不眠症の患者において、睡眠の質と睡眠効率の改善に効果があることが示唆されている。フェカリバクテリウムやラクティプランティバチルスなどの特定の菌株を用いたプレコロニー化などのプロバイオティクス療法は、睡眠不足による悪影響を大幅に軽減することができる。現在、純粋不眠症の治療におけるシンバイオティクスの効果に関する研究は限られているが、その相乗効果の可能性についてはさらなる調査が必要である。不眠症は他の健康状態と併発することが多く、糞便微生物移植療法は病気の症状を緩和するだけでなく、睡眠の質を改善する効果も示されています。 |
| しかし、いくつかの問題については更なる検討が必要です。 |
| (1)プロバイオティクスと糞便微生物移植の投与量:他のマイクロバイオームベースの治療法とは異なり、プロバイオティクス、シンバイオティクス、および糞便微生物移植は、生きた微生物を腸内へ導入することを伴います。この導入の効果は、特定のプロバイオティクス株の増加のみに依存するのではなく、むしろ、様々な微生物種間の複雑な相乗作用または拮抗作用を伴う、バランスの取れた腸内細菌叢の構成を達成することに大きく依存します。多くの研究において、プロバイオティクスの投与量が多いほど必ずしも良い結果が得られるわけではなく、複数の菌株を組み合わせることで、より高い治療効果が得られる場合が多いことが示されています[110]。有益なマイクロバイオームの量が不足すると腸内細菌叢の構成が再構築されない可能性があり、過剰になるとディスバイオシス(腸内細菌叢の乱れ)につながる可能性があります。したがって、治療における生きた微生物の適切な投与量を検討することは、治療効果を高めるために不可欠です。
(2)腸内細菌叢の乱れと睡眠障害:腸内細菌叢と睡眠の間には双方向の関係があることは広く認められているものの、腸内細菌叢の乱れ自体がどのように睡眠障害につながるのかを検討した研究は限られています。腸内細菌叢の乱れが不眠症にどのように寄与するのかを解明し、睡眠障害と密接に関連する特定のマイクロバイオーム種を特定することは、不眠症の緩和を目的とした標的マイクロバイオーム療法の開発に重要です。 (3)測定方法:ほとんどの臨床研究では、睡眠の質の改善を評価するために、脳波などの客観的な指標ではなく、自己評価質問票を用いています。客観的なデータが不足しているため、マイクロバイオームに基づく療法の有効性を正確に評価することが困難になっています。さらに、結果に一貫性がないと、不眠症治療に関する患者の選択に悪影響を及ぼす可能性があります。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Int J Mol Sci. 2024 Dec 9;25(23):13208.に掲載されたMicrobiome-Based Therapeutics for Insomnia.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


