ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
過敏性腸症候群のための低FODMAP食:マイクロバイオームからの洞察 |
Haoshuai Zhang, Qi Su |
|
|
| 要約 |
過敏性腸症候群(IBS)は、慢性的な腹痛、膨満感、排便習慣の変化を特徴とする、広く普及している消化器疾患です。発酵性オリゴ糖、二糖類、単糖類、および多価アルコールの摂取を制限する低FODMAP食(訳者注:FODMAP(フォドマップ::Fermentable Oligosaccharides, Disaccharides, Monosaccharides, And Polyols)とは、小腸で吸収されにくい特定の糖質のことです。これらは大腸で発酵しやすく、過敏性腸症候群(IBS)などの症状を引き起こす可能性があります。低FODMAP食は、これらの糖質の摂取を制限することで、IBSの症状を緩和するための食事療法です)は、IBSの症状緩和に効果的な食事療法として注目されています。本レビュー論文は、低FODMAP食が腸内細菌叢に及ぼす影響と、IBS管理におけるその作用機序に関する最新の知見を統合することを目的としています。低FODMAP食に伴う微生物組成と機能の変化を検証し、これらの変化が腸内環境の健康と症状緩和に及ぼす影響について考察します。さらに、症状の改善と、微生物多様性および長期的な腸内環境への潜在的な悪影響とのバランスについても検証します。新たなエビデンスによると、低FODMAP食はIBSの症状を大幅に軽減できる一方で、有益な微生物群集の減少につながる可能性も示唆されています。これらの影響を軽減するための戦略(再導入期やプロバイオティクスの使用など)が評価されています。本レビューでは、マイクロバイオームの反応における個人差を考慮した、IBSにおける食事管理における個別化アプローチの重要性を強調しています。食事、腸内マイクロバイオーム、そしてIBSの症状との複雑な関係を理解することは、IBS患者にとってより効果的で持続可能な食事戦略の開発につながるでしょう。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. IBSとは? |
| 3. 腸内細菌叢と低FODMAP食の関係 |
| 4. 低FODMAP食の有効性と臨床的エビデンス |
| 5. 低FODMAP食が症状を緩和するメカニズムおよび制限 |
| 6. 臨床実践におけるFODMAP個別化の重要性 |
| 7. 結論 |
本文 |
| 1.はじめに |
| 過敏性腸症候群(IBS)は、慢性的な腹部不快感、膨満感、排便不整といった症状を呈し、世界中の人々にとって大きな課題となっています。これらの苦痛な症状に対し、発酵性炭水化物の摂取制限に重点を置いた低FODMAP食が、IBS関連の症状を効果的に緩和する有望な食事療法として注目されています。本レビューでは、低FODMAP食が腸内細菌叢に及ぼす影響と、IBS管理におけるそのメカニズムについて、現状の知見を掘り下げます。この食事療法に伴う微生物組成と機能の変化を検証することで、腸内環境の健康と症状緩和への影響を明らかにします。しかしながら、低FODMAP食はIBS症状の軽減に期待が寄せられている一方で、微生物多様性と長期的な腸内環境への潜在的な悪影響が懸念されています。本レビューでは、これらの影響を相殺するための再導入段階やプロバイオティクスの使用といった戦略について掘り下げます。 IBSにおける食事管理には個別化されたアプローチが必要であることを強調し、腸内細菌叢の反応における個人差を考慮することの重要性を強調します。本レビューは、食事、腸内細菌叢、そしてIBSの症状の間の複雑な相互作用を解明することで、IBS患者のニーズに合わせた、より効果的で持続可能な食事戦略の開発への道を開くことを目指しています。 |
| 2. IBSとは? |
| 機能性腸障害(FBD)という用語は、慢性的な胃腸機能障害、または中部または下部消化管に起因する構造上の病理学的異常を指すために使用されます。臨床症状は主に、腹部膨満、膨張、排便習慣異常、そして特定不能な機能性腸障害として現れます[1]。FBDは、過敏性腸症候群(IBS)、機能性便秘(FC)、機能性下痢(FDr)、機能性腹部膨満/膨張、そして特定不能なFBDdの5つの主要なタイプに分類されます。機能性胃腸障害には、排便回数の減少または困難、そしてしばしば残便感と腹部膨満感を伴う乾燥した硬い便を特徴とする機能性便秘(FC)を含む、様々な病態が含まれます。機能性下痢(FDr)は、排便回数の増加、水様便または軟便、便意切迫感、および腹痛を呈する。機能性腹部膨満/膨張は、必要な疼痛や排便不規則性を伴わない腹部膨満感または外観として現れる。これらの疾患は、識別可能な構造的異常を欠き、症状プロファイルに基づき、他の器質的病理を除外した後に診断される。これらの疾患の中で、過敏性腸症候群(IBS)は最も一般的なタイプの機能性腸疾患の1つである。IBSは、腹痛または不快感が排便または排便習慣の変化、ならびに排便障害の特徴と関連する機能性腸疾患と定義される[1]。また、憩室炎または細菌性胃腸炎などの特定の急性事象後にもよく見られる[2,3]。感染後IBS(PI-IBS)も主要なタイプであり、主に水質汚染と原虫および蠕虫感染によって引き起こされます[4]。IBSの臨床症状は通常、膨満感、鼓腸、全身症状の増加、および便秘や下痢などの排便習慣の変化に関連して説明できます[5]。IBSは、主な便のパターンによって、便秘を伴うIBS(IBS-C)、下痢を伴うIBS(IBS-D)、混合型IBS(IBS-M)、およびサブタイプ不明のIBSの4つの主なサブタイプに分類できます。IBSは、胃腸管への永久的な損傷、腸出血、または癌などの他の深刻な合併症を引き起こさない生命を脅かす疾患ではありませんが、依然として治療が難しく、世界的に一般的なヘルスケア問題です。過去数十年にわたって、IBSの有病率は増加しています。ローマIII基準[6]に基づくと、IBSの世界的有病率は2006年から2019年の間に9.2%増加した[7]。ほとんどの研究によると、世界のさまざまな地域のコミュニティ内のIBSの有病率は約10~15%である[8,9,10,11]。アジア地域に関しては、日本、中国、韓国の有病率はそれぞれ14.9%、5.5%、15.6%と異なっている[10]。さらに、香港のIBSの有病率はローマII基準に基づくと6.6%であり[12]、約46,000人に上る。研究では、有病率は性別と年齢の要因に関連していることも示されている。世界中で、女性のIBSの有病率は男性よりも有意に高く[13]、50歳以上のIBSの有病率は50歳未満と比較して低い[14]。 IBSは、政府の経済予算や患者の生活の質に深刻な影響を及ぼします。西洋諸国では、英国では消化器科外来診療所への紹介患者の40~60%をIBS患者が占めており[15]、米国ではIBSに関連する年間の国民医療費は16億6,000万ドルに上ります[16]。さらに、IBS患者の健康関連の生活の質(HRQoL)は、胃食道逆流症、糖尿病、末期腎不全などの特定の病状の患者よりも悪いようです[17]。たとえば、ほとんどのIBS患者は自由と自発性の欠如を感じており、症状の予測不可能性を強調し、親戚や友人から偏見や誤解を感じることがあると述べています[18]。以前の研究によると、IBS患者はパフォーマンスを向上させるために最善を尽くしているにもかかわらず、症状のために継続して働くことが困難であることが示されています。米国の研究によると、IBS患者の5%以上が仕事の中断を必要とし、それが欠勤につながり、結果として患者の20%以上が仕事の生産性の低下を感じていることが示唆されています[19]。したがって、IBSは患者個人だけでなく社会全体にも影響を与えており、その有病率の増加は緊急に取り組むべき課題です。 |
| 過敏性腸症候群(IBS)は、一般的に腸管脳相互作用障害に起因するとされています。IBSの発症メカニズムは複雑で完全には解明されていませんが、遺伝、食事要因、感染、腸内細菌叢、心理的合併症(ストレス、不安、うつ病)など、多くの危険因子が特定されています。現在のIBSの治療法は通常、個別的な評価、説明、安心に基づいています。食事の変更、主な症状を対象とした薬物治療、心理療法が有効な場合があります。伝統的に、普段の食事で食物繊維の摂取量を増やすと、主に便秘などのIBS症状を効果的に軽減できます[20]。サイリウムは代表的な食物繊維サプリメントです。臨床試験では、プラセボと比較して、サイリウムを摂取した方が3ヶ月目に症状の重症度が改善し、1ヶ月目と2ヶ月目の腹痛が十分に緩和されることが研究で示されています[21]。サイリウムによる治療が無効の場合は、薬物治療が使用されます。主に排便習慣の改善や腹部膨満感、腹痛の症状緩和に使用される薬剤には、抗痙攣薬(ジサイクロミン)、下剤(マグネシウム塩)、抗下剤(ロペラミド)、抗うつ薬[22]、非吸収性抗生物質(リファキシミン)[23]などがあります。これらの治療選択肢に加えて、プロトンポンプ阻害薬(PPI)とアモキシシリン、クラリスロマイシンなどの2種類の抗生物質を併用する除菌療法も一般的に使用されています。過去の研究データでは、1ヶ月間リファンピシン200 mgを1日4回投与された204名のIBS患者のうち8名のうち7名で症状スコアが有意に改善したことが示されています[24]。プレバイオティクスもここ数十年で利用されるようになり[25]、乳酸菌とビフィズス菌[27]を含む単一または複数菌株のプロバイオティクス[26]の使用も含まれています。プレバイオティクスの使用は、腸内細菌叢を変化させ、過敏性腸症候群(FBD)の症状を緩和する可能性のある有望なアプローチです[28,29]。前述のように、食物繊維サプリメントと薬物療法はIBS患者の症状を緩和することができ、除菌療法も効果的です。しかし、食物繊維サプリメントの効果には限界があり、下痢の症状を改善することしかできません。同様に、抗生物質の過剰使用は宿主にとって不健康であり、抗生物質耐性につながる可能性があります。薬剤耐性の出現と蔓延は、宿主の治療に影響を与えるだけでなく、他の深刻な疾患や公衆衛生問題にもつながる可能性があります。したがって、実際に問題を解決できる、より効果的で潜在的に有益なIBS症状の治療方法の開発が緊急に求められています。 |
| 3. 腸内細菌叢と低FODMAP食の関係 |
| ほとんどの動物は、様々な生理学的利点をもたらす原核生物と共生しています。ヒトの消化管(GI)細菌叢は、ヒトの健康において重要な役割を果たしています。細菌、真菌、ウイルス、原生動物、古細菌など、数百万もの微生物群が小腸に定着し、ヒトの健康に不可欠な代謝、免疫機能、そして保護機能を提供しています[30]。ヒトの体内の細菌叢は、量と質の両面で非常に膨大です。消化管に生息する細菌、古細菌、真核生物は「腸内細菌叢」と定義されています。これらは数千年にわたって宿主と共進化し、複雑かつ相互に有益な関係を築いてきました[31]。量的に見ると、人体に存在する細菌の数は非常に膨大で、ヒト細胞の数とほぼ同等である [32]。中でも大腸細菌群集は、約 10~11 個/g と、細菌総数のかなりの部分を占めている [33]。ヒトのような多細胞生物にとって、腸管の主な機能は栄養素の濃縮と吸収であり、真核生物と原核生物の相互作用の重要な場であり、実験の場となっている。消化管の微生物叢の構成は、各領域の生理学的特性を反映している (図 1)。消化管微生物叢はヒトの健康に重要な役割を果たしており、これまでの研究で、人体と長期にわたって共存する有益な共生細菌は、上皮免疫抑制特性 [34] や免疫抑制性 T 細胞の発達を刺激する多様な能力 [35] を示すことが示されている。これは、宿主の健康維持に重要な役割を果たす腸内微生物叢の存在を強く示唆している。同様に、腸内細菌叢は宿主に多くの恩恵をもたらします。例えば、腸内バリア機能の強化や腸内壁の構築[36]、エネルギーの抽出[37]、病原体からの防御[38]などです。腸内細菌叢の構成は、環境と宿主の選択圧によって影響を受けます。したがって、腸内細菌叢は柔軟性が高く、環境条件、食習慣、宿主の健康状態など、様々な要因が微生物種の多様性に影響を与える可能性があります。 |
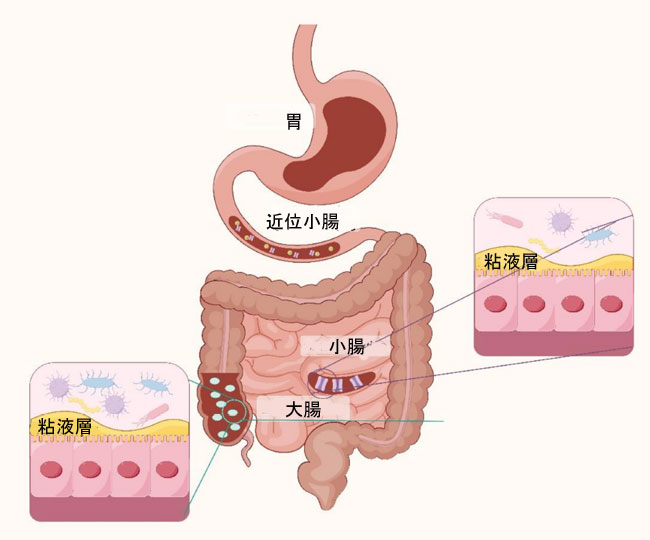 |
| 図1 人間の消化管の構造構成の図 |
| 食事は腸内細菌叢の構成に大きな影響を与えると報告されている [39]。ヒポクラテスは「汝の食を薬とし、汝の薬を食とせよ」という概念を提唱しており、これは食事と腸内細菌叢の構成要素との関係を明確に説明することができる。腸内細菌叢は、宿主の生涯を通じて、最初から最後まで共に過ごす。乳児の場合、母乳オリゴ糖(HMO)は乳児期初期の細菌叢の発達に役割を果たし [40]、それに続いて固形食の導入により細菌の多様性が増加する [41]。このプロセスは、長期ケア施設に入居する高齢者集団に見られる多様性の減少で最高潮に達し、これはおそらく食事の多様性の減少によるものである [42]。宿主が摂取する栄養素は、腸内細菌叢の種類、存在量、および成長状態に直接影響を与え、それによって腸内におけるさまざまな微生物群の相対的および絶対的な存在量に影響を与える可能性がある。そのため、腸内細菌叢の構成に対する様々な食事成分の影響を調査することは、特定の習慣的な食生活の健康効果を評価する上で極めて重要です。通常、IBS患者では小腸細菌過剰増殖症(SIBO)がよく見られ[32,43,44]、これは良質な細菌(好気性および嫌気性)が消化管で過剰に増殖し、水素、メタン、二酸化炭素、特定の短鎖脂肪酸など、宿主が利用できない多くの物質を生成する代謝活動につながるものです。小腸でのこれらの物質の蓄積は、過度のげっぷ、鼓腸、心窩部および腹部の痛み、吐き気、早期満腹感、疲労などの症状を引き起こし[45]、排便習慣の変化につながります。これらの症状はその後、IBSの発症に寄与し、患者に大きな苦痛をもたらします。上記の理由に基づき、発酵性オリゴ糖、二糖類、単糖類、および多価アルコールを表すFODMAP [46]と呼ばれる新しい仮説が提唱されました。代表的なFODMAP食品には、果糖、フルクタン、乳糖、糖アルコール、ガラクトオリゴ糖(GOS)などがあります。FODMAP食品の消化管への影響は、発酵だけでなく、腸内細菌叢、メタボローム、透過性、および腸管免疫の変化によっても発揮されると考えられます(図2)。これらの物質はすべて、かなりの量の糖を含んでいます。研究では、高糖質食は腸内微生物の多様性を低下させる可能性があることが明らかになっています[47]。さらに、FODMAP食品は様々な短鎖脂肪酸と有機酸を誘発し[48]、これらは急速に発酵し、小腸内細菌叢の増殖を促します。これは、回腸造設術後の回復と磁気共鳴画像法(MRI)による研究の両方で明確に実証されています。過敏性腸症候群(IBS)の治療において、低FODMAP食への関心が高まっており、この食事が腸内マイクロバイオームの形成においていかに重要な役割を果たすかを理解すべき時が来ています。 |
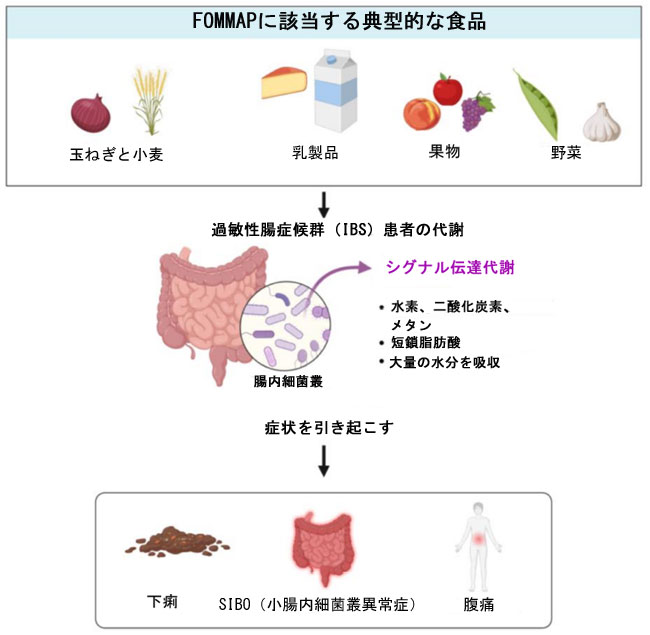 |
| 図2. FODMAPは腸内細菌によって代謝され、腸内で有害細菌の増殖を招き、宿主に一連の症状を引き起こす |
| 4. 低FODMAP食の有効性と臨床的エビデンス |
| 低FODMAP食を摂取すると、食物繊維、フルクタン、微量栄養素、GOSの摂取量が大幅に減少します[49]。低FODMAP食を実践するということは、日常生活において、発酵性は高いものの吸収率の低い短鎖炭水化物(SCC)とポリオールの摂取量を減らすことで、痛みを伴う症状を緩和することを意味します。これまでの研究は、主に、低FODMAP食が腸管上皮バリアの透過性を変化させることで疾患の症状を改善する仕組み[50–53]、低FODMAP食が消化管マイクロバイオームの構成成分に影響を及ぼすメカニズム、そして疾患や患者の健康状態への影響が重要である可能性に焦点を当てています。食事療法は、IBS患者の症状を改善するための基本的な方法として既に使用されています。英国国立医療技術評価機構(NICE)のガイドラインが提唱する「伝統的なIBS食事療法」では、健康的な食事、栄養、適切な食事間隔を置いたライフスタイル[54]の重要性を推奨しています。これには、適切な食事間隔、ソフトドリンク、アルコール、カフェイン入り飲料の代わりに水を飲むこと、脂肪や再加熱食品の摂取を減らすこと、全粒粉パン、ふすまを多く含む食品、玄米などの高繊維食品の過剰摂取を避けることなどが含まれており、これらを通じて消化器系の健康と全体的な健康状態を大幅に改善することができます。 |
| 特に、低FODMAP食はFODMAP食品の食事制限を意味し、IBS患者の治療に推奨されています。IBS患者の症状緩和におけるこの食事の優位性を示すために、多数のランダム化比較試験(RCT)が実施されてきました。2008年には、食事中のFODMAPと症状との関連性を示した最初の研究で、IBS患者は、ブドウ糖を摂取した後よりも、盲検下で段階的に摂取したフルクトースまたはフルクタンの方が消化器症状を経験する可能性が高いことがわかりました[55]。その後、IBS症状のある患者における低FODMAP食の有効性を裏付けるエビデンスがますます増えています。米国の研究グループは臨床患者を募集し、下痢を伴うIBS患者(IBS-D)を対象に、低FODMAP食と通常の食事推奨事項を比較する比較有効性試験を設計しました。結果[56,57]によると、低FODMAP食群では標準的な食事推奨群と比較して、IBSに伴う最も厄介な症状である腹痛と膨満感の緩和を経験した人の割合が有意に高かったことが示された。さらに、IBSの標準的な食事推奨と比較して、便の硬さ、排便回数、および切迫感に関して顕著な改善が観察された。低FODMAP食群では、IBSの標準的な食事推奨群と比較して、生活の質(QOL)指標の改善と不安の軽減も顕著であった。カナダの研究グループ[58]はまた、IBSの症状は食事中のFODMAP含有量と関連しており、37人のIBS患者におけるメタボロームの変化と関連していることを発見した。3週間にわたり、19人の患者は低FODMAP食で治療され、残りの18人の患者は高FODMAP食で治療された。さらに、FODMAP食品がIBS症状の緩和に効果があることが確認されている試験があるにもかかわらず、低FODMAP食におけるグルテンの有無の影響も重要です。そのため、2021年にはIBS患者49名を対象とした二重盲検プラセボ対照ランダム化試験が実施されました[59]。患者は2つのグループに分けられ、介入群には低FODMAP食とともにグルテンパウダー5g/日を摂取させ、プラセボ群には低FODMAP食とともにプラセボとして米粉5gを摂取させました。その結果、IBS患者において、グルテン含有食品の摂取後の症状悪化は、食品中のフルクタンの存在のみに起因するものであり、グルテンが症状の原因である患者はごくわずかであることが示されました。地域によって食習慣は様々ですが、多くの地域では、低FODMAP食が伝統的な食事と比較してIBS症状の改善に有意な効果があることが示されています[46,60–64]。いくつかの研究の中で、オーストラリアの伝統的な食事と低FODMAP食を比較した研究が最も代表的なものとして際立っています[65]。その結果、低FODMAP食で治療されたIBS患者は、典型的なオーストラリアの食事を摂取した患者や、自身の習慣的な食事を摂取した被験者と比較して、腹痛や膨満感などの消化器症状が有意に軽減したことが示されました。近年、多くの研究機関[66]は、6つの異なるランダム化臨床試験[58,65,67–69]の解析に基づき、低FODMAP食がIBS治療の第一選択療法とみなせると示唆しています。 6件の試験はすべて、プラセボの選択、試験参加者数、盲検化の成功率、介入期間に関して程度の差はあるものの、一貫した結果はこの食事療法の有効性を示しています。低FODMAP食の実践に関する経験的エビデンスはランダム化試験の結果を裏付けており、患者の約70%に反応が見られました。他の食事療法と比較して、低FODMAP食は依然として大きな利点を有しています。米国で行われた84名の下痢型IBS患者を対象としたランダム化比較試験[64]では、NICE食事療法[54]と低FODMAP食が比較されました。主要評価項目である全体的な症状緩和は達成されませんでしたが、低FODMAP食では個々の症状が臨床的にも統計的にも改善しました。また、英国で実施された研究では、低FODMAP食はNICE食と比較して利点が増加していることが示されています。全体として、低FODMAP食がIBSの第一選択治療として使用できることを証明する決定的な証拠は現在のところありませんが、大多数の患者は、短期的に低FODMAP食を摂取することで、ある程度の消化器症状の改善を経験しています。このアプローチは多くの栄養士から支持と推奨を得ています。低FODMAP食事療法は、今後の発展と成長が期待できます。 |
| 5. 低FODMAP食が症状を緩和するメカニズムおよび制限 |
| FODMAPは、小腸で吸収されにくく、その後小腸または大腸で発酵される炭水化物群です。しかし、すべてのFODMAPがIBS患者の症状を悪化させるわけではありません。FODMAPがIBS患者の症状を誘発する主なメカニズムは2つあります。第一に、FODMAPは小腸で吸収されにくく、浸透圧特性[48,70]を有するため、小腸への水分分泌が促進されます。これにより、小腸の膨張や著しい体液貯留が起こり、腹部症状を引き起こすだけでなく、結腸に輸送される体液量も増加させる可能性があります。さらに、FODMAPは結腸細菌叢によって急速に発酵されるため[67]、ガス産生による結腸膨張を引き起こし、痛みや膨満感を伴います。最近の研究結果では、低FODMAP食は結腸微小循環灌流を促進し、血管内皮増殖因子の発現を低下させることで、内臓過敏症を改善できることが明らかになっています[71]。したがって、低FODMAP食は上記のシナリオを予防し、IBS患者の苦痛を軽減し、回復率と生活の質の向上につながります。研究では、食事中の化合物が宿主の代謝に影響を及ぼすことで、直接的または間接的に腸内細菌叢を形成することが示されています(図3)。例えば、以前の研究では、マウスにおける急性ビタミンA欠乏症がバクテロイデス・ブルガトゥスの増加につながることが明らかになっています。これは、レチノールが細菌の増殖を阻害するためと考えられます。おそらく、通常は細菌の増殖を抑制するデオキシコール酸などの胆汁酸を減少させることで、この現象が引き起こされると考えられます。腸内細菌叢の形成に役割を果たすことから、低FODMAP食と従来の食事療法、あるいは偽食事療法における消化管細菌叢の構築の違いを調査するために、多くのランダム化プラセボ対照RCTが設計されています。近年、多くの研究で、過敏性腸症候群(IBS)患者における低FODMAP食の臨床的有効性が継続的に実証されています。これらの研究はすべて、低FODMAP食が消化管の不快感を大幅に改善し、患者の生活の質を大幅に向上させることを示しています[72]。並行して行われた単盲検プラセボ対照試験では、英国の消化器内科クリニックから52名の患者が登録され、通常の食事療法を受ける対照群と、同じ研究栄養士が設計した低FODMAP食療法を受ける群の2つのグループに分けられ、4週間にわたって実施されました。その結果、低FODMAP食療法を受けた患者の半数以上が、腸の症状の十分な緩和と、IBS重症度スコアの大幅な低下を示しました。研究[73–76]では、低FODMAP食療法を受けたIBS患者は、IBS患者と比較して腸内細菌叢の構成が異なることが示されています。英国の研究グループは、メタゲノミクスを用いて、IBS患者と健常者の便検体の高解像度の分類学的および機能的プロファイルを決定しました。低FODMAP食を4週間摂取した後、臨床反応と腸内細菌叢の種がすべて変化し[73]、腸内細菌叢の有益な細菌(バクテロイデス属)が増加し、有害な細菌(フィルミクテス属)が減少しました。さらに、低FODMAP食はIBS患者の症状を改善するだけでなく、患者の腸内細菌叢の構成と相対的な存在量を変化させ、代謝物の変化につながり、最終的に腸内環境を改善するという代替メカニズムによって作用する可能性もあります。このことを考慮すると、腸内細菌叢は将来、IBSの検出[77]や低FODMAP食の効果のバイオマーカーとなる大きな可能性を秘めており、イギリスを拠点とするある研究チーム[78]は、代謝物がIBSのサブタイプを特定するためのバイオマーカーとして使用できることを証明しました。 |
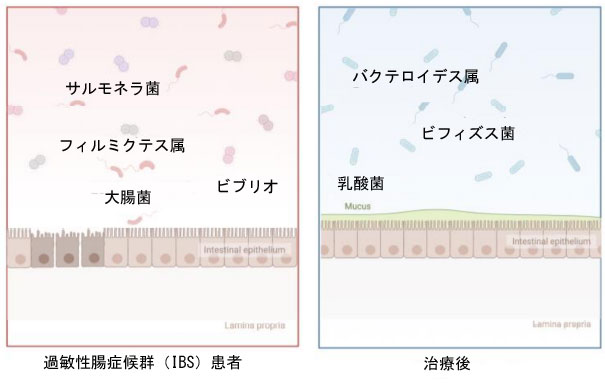 |
| 図3. 低FODMAP食は腸内細菌叢に影響を与えます。低FODMAP食による治療後、患者の腸内細菌叢の構成には大きな変化が見られ、有害細菌が減少し、有益細菌が増加します |
| 近年、適切に設計された臨床試験の発表が増えており、4週間の低FODMAP食介入後、腸の症状はある程度改善したものの、腸内細菌叢の構成に大きな変化が見られ、特に有益な微生物群の多様性と存在量の減少が特徴的であることが示されています。これは予想外ですが否定できない結果です。IBS治療のための食事療法を含む多くの研究[78,79,80,81,82]は、プラセボ効果、期間の制限、厳密な評価項目の欠如、ランダム化/盲検化の欠如、遵守を確認するための食事評価の限界などの問題を抱えています。さらに、さまざまなランダム化単盲検試験の結果から、低FODMAP食は、従来の食習慣や一部の地域で典型的な食習慣と比較して、総細菌量が少ないことが明らかになっています[80,83]。過敏性腸症候群(IBS)患者の糞便細菌プロファイルの多変量モデル化では、低 FODMAP 食が糞便細菌に大きな影響を与える可能性があることも示されています [82]。特に糞便細菌種 [84,85]、放線菌、特にビフィドバクテリウム [84,86,87] の減少につながります。研究では、ビフィドバクテリアの割合と濃度の明らかな減少が示されており、絶対量の低下も実証されています。ビフィドバクテリアは、厳密に嫌気性のグラム陽性細菌の一種で、発酵性の桿菌を持ち、最終的に Y 字型または棍棒状になることが多く、人間の消化管で優勢な細菌群集の 1 つであり、消化管の健康に重要な役割を果たしています。したがって、ビフィドバクテリアの提案されている利点の中で、腸管病原性の抑制とロタウイルス感染の軽減 [88] は、最も確立された結果の一部です(図 4)。さらに、ビフィズス菌は乳酸と酢酸を放出することで大腸のpH調節に重要な役割を果たしており[89]、様々な有害な病原菌や腐敗菌の増殖を抑制します。また、多くの研究で、ビフィズス菌は有機酸[90]、抗菌ペプチド[91]、クオラムセンシング阻害剤[92]、免疫刺激などの産生を通じて病原菌を阻害することが実証されており、特定の感染症を予防する能力に関する分子論的な手がかりを提供しています。言い換えれば、ヒトの腸内におけるビフィズス菌の減少または消失は、有害な状態を示していると考えられます。低FODMAP食は、一定期間の治療後、ほとんどのIBS患者に顕著な効果を示していますが、制限食は依然として腸内細菌叢にある程度の変化を引き起こし[66,93]、宿主の健康に潜在的な脅威をもたらします。したがって、低 FODMAP 食には、臨床応用性を高めるための改善の余地がまだかなり残されています。 |
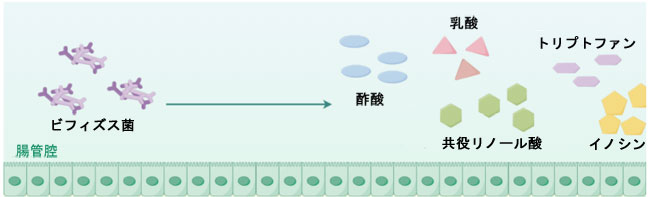 |
| 図 4. ビフィズス菌によって産生され、免疫メディエーターとして機能する代謝物 |
| 6. 臨床実践におけるFODMAP個別化の重要性 |
| 低FODMAP食がIBSに対する最も効果的な食事療法である可能性を示唆する研究が増えており、第二選択治療として推奨されているにもかかわらず[94]、その副作用、特に腸内ビフィズス菌の著しい減少[95,96]は依然として懸念事項です。さらに、低FODMAP食に関する臨床試験のほとんど[97]は短期的な臨床エンドポイント(12週間以内)を評価しており、IBSの症状の慢性化を考慮すると、より長期にわたる食事療法の持続性の方がより意義深いと言えるでしょう。既存の研究では、この方法が宿主のカルシウム摂取量を減少させる可能性も示唆されています[86]。その結果、患者において骨折や骨粗鬆症のリスクが高まる可能性があります。さらに、多くの研究によると、IBS患者の大多数(70~89%)は特定の食品が症状を悪化させると報告しており、その結果、多くの患者が特定の食品を制限または排除しています[60]。そのため、標準的な低FODMAP食事療法はすべての患者に適しているとは限りません。最近では、Staudacher HMと彼のチーム[98]は、短期臨床試験に参加した18人のIBS患者を登録し、構造化されたFODMAP制限、再導入、および個別化を経て、12か月にわたる長期研究に参加しました。結果は、登録された患者の約70%が、個別化された低FODMAP食事を摂取した後に症状が十分に緩和したと報告し、食事療法によってビフィズス菌が大幅に減少することはなかったが、症状も大幅に緩和されたことを示しています。他の研究グループの研究結果[98,99]でも、低FODMAP食事を3段階に分ける治療法の有効性と実現可能性が確認されています。表1には、3つの段階が微生物叢にどのように影響するかについての主な研究がリストされています。 FODMAP制限は治療の終わりではなく、むしろ出発点に過ぎません。FODMAP制限は、主に診断的アプローチとみなされるべきです。治療期間が経過しても患者の症状が改善しない場合は、直ちに制限を中止し、別の治療法を検討することをお勧めします。また、低FODMAP食は健康的な食習慣ではないため、あまり長く続けない方がよいでしょう。4週間[100]のみが推奨され、最長12週間まで続けるべきではありません[101]。その後、FODMAP制限が効果を発揮すれば、患者は次の段階であるFODMAP再導入に進むことができます。FODMAP再導入段階では、高FODMAP食品チャレンジを用いて食事の誘因を特定し、3日間かけて用量を増やしながらテストすることを指します。マンゴーなど、ある種類の FODMAP のみを多く含む食品を用いた個別試験は、例えば果糖など、そのカテゴリーの FODMAP 全体に対する個人の耐性を確かめるために用いられる [98]。試験に用いる食品は、すべての FODMAP を代表するものでなければならない。しかし、この点に関して発表された研究は限られている。今日推奨されている例としては、パン、玉ねぎ、レンズ豆、牛乳(乳糖)、マンゴー(果糖)、アプリコット(ソルビトール)、キノコ(マンニトール)、そして複数の FODMAP を混合して含む食品などが挙げられる [102]。理想的には、次の食物負荷試験の前には症状が最小限であるべきであり、これは 3 日間の厳格な FODMAP 制限のクリアランス期間を設けることで達成できる [103]。クリアランス期間は、前回の負荷試験の残留効果と、次回の負荷試験中の症状への影響を防ぐのに役立つ。ただし、前回の負荷試験中に症状が現れなかった場合、患者は次の食品の種類を選択して負荷試験を行うことができる。食物チャレンジで症状が引き起こされなければ、その食品は患者の通常の食事に追加するのに適しているとみなすことができます。第3段階は、最も重要な要素でもあるFODMAP個別化であり、継続的な自己管理期間です。第3段階では、長期的な適用のために食事をより個別化するように調整し、食事の多様性を奨励し、栄養ガイドラインを満たし、FODMAP制限が腸内細菌叢に及ぼす可能性のある悪影響を軽減することが含まれます[104]。FODMAP個別化の目標は、食事のカテゴリーを強化し、栄養摂取量を改善しながら、同時にIBS症状をコントロールすることです。これにより、患者が徐々により正常な日常の食事に戻るのに役立ちます。研究によると、FODMAPの再導入と個別化の後、最大83%の患者[105]でIBS症状の重症度スケールで50ポイント以上の減少が見られ、症状の減少は55%から89%の範囲でした。さらに、食事の栄養摂取量とFODMAP摂取量はベースラインの習慣レベルに戻り、ベースラインと比較して食生活関連の生活の質が改善しました[106]。重要なのは、通常の食事に戻った患者と比較して、FODMAP個別化を受けた患者は食生活への悪影響を経験しなかったことです。 |
| 表 1. 3 つの FODMAP 段階の役割と微生物叢への影響を調査した研究 |
 |
| 7. 結論 |
| ご存知の通り、過敏性腸症候群(IBS)は世界中で蔓延している疾患であり、世界人口の約10~15%が罹患していると推定されています。この慢性の胃腸疾患は、腹痛、膨満感、排便障害、消化不良といった症状を含む持続的な不快感を引き起こし、生活の質(QOL)に重大な影響を及ぼします。患者は不安や抑うつなどの心理的問題、さらには社会生活や職業上の課題を経験することもあります。さらに、患者は症状の緩和を求めて頻繁に医療機関を受診するため、IBSは医療資源への負担となります。IBSの有病率と有害な影響を理解することは、患者のQOL(生活の質)をより適切に管理し、向上させるために不可欠です。 |
| 要約すると、低FODMAP食はIBS(過敏性腸症候群)の管理において重要な食事療法として際立っており、慢性的な腹痛、膨満感、そして不規則な排便習慣を緩和します。これらの食事療法が症状緩和に有効であることは十分に裏付けられていますが、低FODMAPアプローチと腸内細菌叢との複雑な相互作用を認識することが重要です。新たな研究では、低FODMAP食が腸内細菌叢の構成と機能に及ぼす潜在的な影響が強調されています。この食事療法は症状の改善をもたらす一方で、有益な微生物(ビフィズス菌)の減少など、意図しない結果をもたらす可能性もあることが示唆されています。腸内細菌叢のこのような変化は、腸の健康と全体的な健康状態への長期的な影響について懸念を引き起こします。これまでの研究は、低FODMAP食が腸内ビフィズス菌の増殖に与える影響に主に焦点を当ててきたが、他の有益な微生物群や様々なマイクロバイオーム指標への影響については見落とされてきた[113]。こうした懸念に対処するため、症状の緩和を維持しながら微生物多様性を回復し、腸内環境の健康を促進するための、再導入段階、食事の個別化、プロバイオティクスの導入といった戦略が提案されている。これらのアプローチは、低FODMAP食において、各人のマイクロバイオームが食事介入に対して独自の反応を示すことを認識し、個別化された食事管理の重要性を強調している。 |
| さらに、この研究結果は、食事、腸内細菌叢、そしてIBSの症状との複雑な関係性について、さらなる調査の必要性を強調しています。低FODMAP食が腸内細菌叢に及ぼす長期的な影響を解明し、症状管理と微生物バランスを最適化する戦略を洗練させるには、継続的な研究努力が不可欠です。これらのメカニズムをさらに深く掘り下げることで、食事の選択が腸の健康とIBSの症状にどのように影響するかについての理解を深めることができます。この微妙な理解は、個々の細菌叢の反応に合わせた、より的を絞った持続可能な食事戦略の開発に役立ち、最終的にはIBS患者の生活の質を向上させるでしょう。低FODMAP食への反応を予測するバイオマーカーの特定は非常に関心が高く、現在の研究のホットスポットとなっています。 |
| 将来、低FODMAP食は、他の治療法と比較して、過敏性腸症候群(IBS)の臨床患者の治療において重要な役割を果たすことが期待されています。さらに、その潜在的応用範囲は、症状緩和にとどまらず、炎症性腸疾患(IBD)や腸内細菌叢の異常といった他の疾患領域にも広がる可能性があります。さらなる研究によって、この食事療法が健康に及ぼす包括的な影響が明らかになり、個別化医療の発展を促進し、患者にとってより効果的な治療選択肢を提供できる可能性があります。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Nutrients. 2025 Jan 31;17(3):544. に掲載されたLow-FODMAP Diet for Irritable Bowel Syndrome: Insights from Microbiome. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


