ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
宿主由来のLactobacillus plantarumは、腸内微生物群集とプリンヌクレオシドの加水分解酵素による分解を改善することで高尿酸血症を軽減する |
Yang Fu et al., |
|
|
| 要約 |
腸内細菌叢は、高尿酸血症(HUA)および痛風の発症に関係している。しかし、宿主の腸内に存在するLactobacillusなどのプロバイオティクスが高尿酸血症の発症を予防できるかどうかは不明である。本研究では、高尿酸血症ガチョウの盲腸からLactobacillus plantarum SQ001を分離し、尿酸(UA)とヌクレオシドの共培養に関するin vitroアッセイを行った。メタボロミクスおよびゲノムワイド解析により、この菌株はヌクレオシド加水分解酵素遺伝子を介してヌクレオシドの取り込みおよび加水分解を促進する可能性があることが明らかになった。iunH遺伝子の機能的役割は、異種発現および遺伝子ノックアウト研究によって確認された。L. plantarum SQ001の経口投与により、Lactobacillu属菌種の存在量が増加し、血清尿酸レベルが低下した。さらに、L. plantarum は、尿酸合成に関与する主要酵素である肝臓キサンチンオキシダーゼと腎臓再吸収タンパク質グルコーストランスポーター 9 (GLUT9) の発現を低下させ、腎臓排泄タンパク質ATP 結合カセットトランスポーター G2(ABCG2)の発現を増強しました。私たちの研究結果は、L. plantarum が高尿酸血症による腸内細菌叢の異常を改善する可能性があることを示唆しており、高尿酸血症 または痛風患者に対するプロバイオティクス療法としての潜在的応用についての洞察を提供します。 |
| eLife ダイジェスト |
| 私たちの血液には、腎臓に運ばれ、尿を通して体外に排出される老廃物など、多くの成分が含まれています。そのような分子の 1 つである尿酸は、細胞が古い DNA やその他の類似の分子を分解するときに形成されます。このプロセスにはいくつかの段階があり、DNA はヌクレオシドと呼ばれる中間分子に分解され、その後尿酸に変換されます。 |
| 血流中の尿酸値が高くなりすぎると(高尿酸血症と呼ばれる状態)、人間や他の動物は高血圧、慢性腎臓病、その他の病気を発症する可能性があります。最近の研究では、人間の腸内に生息するある種の「善玉」細菌が尿酸値の調節に影響を与える可能性があることが示唆されています。しかし、これらの細菌が果たす正確な役割は不明です。 |
| 今回、Fu, Luo et al.は、高尿酸血症のガチョウの腸から、Lactobacillus plantarumとして知られる有益な細菌種の 1 つを分離しました。研究チームは、尿酸を含む環境とヌクレオシドを含む環境の 2 つの環境で細菌を培養しました。実験により、Lactobacillus plantarumは尿酸に直接作用しないものの、ヌクレオシドを他の分子に変換できる酵素を持っていることが明らかになりました。 |
| 全ゲノム解析とメタボローム解析を用いたさらなる調査により、Lactobacillus plantarumにはプリンと呼ばれるヌクレオシドの一種に作用する酵素をコードする遺伝子が 3 つ含まれていることが判明しました。これらの遺伝子の 1 つをノックアウトすると、細菌がプリンを他の分子に変換できなくなります。その後、Fu, Luo et al.は、Lactobacillus plantarumがガチョウとマウスの高尿酸血症の影響を軽減するのに役立つことを実証しました。 |
| これらの発見は、腸内に生息する微生物が宿主の尿酸値をどのように調節するかについて貴重な洞察を提供します。また、人間の高尿酸血症の予防と治療の将来の戦略にも役立つ可能性があります。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.結果 |
| 2.1.食事依存型高尿酸血症 における腸内細菌叢の違い |
| 2.2.L. plantarum SQ001 は in vitro でヌクレオシドを加水分解します |
| 2.3.L. plantarum SQ001 のプリン代謝はヌクレオシドによって活性化されました |
| 2.4.L. plantarum SQ001 は、高尿酸血症を軽減する可能性のあるヌクレオシド加水分解酵素を介してヌクレオシドを加水分解します |
| 2.5.L. plantarum SQ001 および代謝物を含む L. plantarum SQ001 は、高カルシウム・高タンパク質食誘発性高尿酸血症を軽減します |
| 2.6.L. plantarum SQ001 はマウスモデルで 高尿酸血症を軽減します |
| 3.考察 |
| 4.材料と方法 |
| 4.1.動物管理 |
| 4.2.高尿酸血症モデリング処理 |
| 4.3.高尿酸血症ガチョウモデルにおけるL. plantarum SQ001および代謝物を含むL. plantarum SQ001の経口投与治療 |
| 4.4.マウスの腹腔内注射と経口投与 |
| 4.5.サンプル収集 |
| 4.6.生化学パラメータの分析 |
| 4.7.ウェスタンブロット分析 |
| 4.8.16S rRNA シーケンシング |
| 4.9.株と培地 |
| 4.10尿酸分解速度の測定 |
| 4.11.ヌクレオシド分解速度の測定 |
| 4.12.高速液体クロマトグラフィーによる測定 |
| 4.13.異種発現および遺伝子ノックアウト |
| 4.14.非標的メタボロミクス分析 |
| 4.15.統計分析 |
本文 |
| 1.はじめに |
| 高尿酸血症(HUA)は、血清尿酸(UA)値が420μmol/l(7mg/dl)を超える代謝障害で、世界人口の8~25%が罹患しています(Li et al., 2022)。高尿酸血症の発症率は、プリンとグルコースを多く含む食事の影響で、特に若年層で増加しています。さらに、高尿酸血症は痛風、腎障害、糖尿病、高血圧、心血管疾患など、さまざまな健康リスクと関連付けられており、公衆衛生上の重大な懸念となっています(Johnson et al., 2018; Zhang et al., 2019a)。 |
| 高尿酸血症の調節には、主に肝臓、腎臓、腸の 3 つの臓器が関与しています (Dalbeth et al., 2021)。肝臓のプリン代謝の上方制御と腎臓の尿酸排泄の阻害は、高尿酸血症の発症において極めて重要な役割を果たしており、腸は 尿酸の生成と排泄の両方に寄与しています (Dalbeth et al., 2021; Niu et al., 2018)。腸は、総尿酸排泄量の約 3 分の 1 を占めています。腸に分泌されると、尿酸は腸内細菌叢による代謝を受けます。そのため、腸内細菌叢のディスバイオーシス(訳者注:腸内毒素症、腸内細菌叢の乱れ)は、尿酸分解の調節不全や宿主の全身性炎症と密接に関連しています (Yun et al., 2017)。しかし、特定の腸内細菌が宿主の尿酸レベルの上昇や炎症にどのように影響するかは不明です。 |
| プロバイオティクスとプレバイオティクスは、腸内細菌叢の調節と全体的な健康増進に対する有益な効果により、有望な自然療法として浮上しています (Zhao et al., 2022b; Wang et al., 2022)。プロバイオティクス、プレバイオティクス、さらには糞便移植を通じて腸内細菌叢を調節し、腸のバランスを維持することは、微生態学的観点から高尿酸血症を管理するための新しいアプローチとなる可能性があります。乳酸菌はよく知られたプロバイオティクスであり、腸内細菌叢の調節と 高尿酸血症の緩和に利用されていることが報告されています (Cao et al., 2022a)。これまでの研究では、乳酸菌による 高尿酸血症の緩和に関与する 2 つのメカニズムが実証されています。一つ目は尿酸を直接分解すること(Wu et al., 2021)、そしてもう一つは腸内で尿酸の前駆体であるヌクレオシドを分解することです(Cao et al., 2022b; Li et al., 2014; Hsu et al., 2019)。しかし、これらのLactobacillus属が尿酸またはヌクレオシドを分解する具体的なメカニズムは、まだ完全には解明されていません。最近の研究では、クローン化され組み換えられたLactobacillus由来のリボヌクレオシド加水分解酵素RihA-Cとヌクレオシド加水分解酵素Nhy69が、Lactobacillus内の潜在的な分解メカニズムに光を当てていることが示されています(Li et al., 2023a; Li et al., 2023b)。しかしながら、Lactobacillusにおける遺伝子ノックアウトの検証に関する証拠は限られており、高尿酸血症における宿主由来のLactobacillusの軽減はまだ不明です。 |
| 高尿酸血症の信頼性が高く安定した動物モデルの確立は、研究者の間で議論の的となっています。マウスモデルは 高尿酸血症や痛風の研究で広く利用されていますが、以前の研究で説明されているように、特定の課題があります。ウリカーゼ活性と尿酸濃度の変動に加えて、マウスのモデリング形式は、ヒトの 高尿酸血症の発症とも異なります (Lu et al., 2019)。以前の研究では、ガチョウが 高尿酸血症と痛風の調査に優れたモデルとなることが実証されています (Wang et al., 2021; Fu et al., 2024; Xi et al., 2019; Dalbeth et al., 2016)。 |
| ここでは、高カルシウム・高タンパク質(HCP)食で誘発される高尿酸血症ガチョウモデルを確立し、高尿酸血症ガチョウからLactobacillus plantarum株SQ001を単離しました。そのヌクレオシド分解機能は、市販株と比較したin vitro実験で調査されました。ゲノムワイド解析により、L. plantarum SQ001には、ヌクレオシド分解に寄与する可能性のある4つの遺伝子(iunH、yxjA、rihA、およびrihC)があることが明らかになりました。その後、大腸菌での異種発現とL. plantarum SQ001での遺伝子ノックアウトを通じて、iunHのヌクレオシド加水分解酵素機能を確認しました。L. plantarum SQ001の経口投与により、高尿酸血症ガチョウおよびマウスモデルにおけるL. plantarum SQ001の緩和効果がさらに検証されました。結論として、私たちの研究結果は、宿主由来の腸内細菌が宿主のディスバイオーシス(腸内細菌叢の乱れ)と高尿酸血症を軽減できることを実証し、高尿酸血症または痛風の改善に対するL. plantarumの潜在的な治療的使用についての洞察を提供しました。 |
| 2.結果 |
| 2.1.食事依存型高尿酸血症 における腸内細菌叢の違い |
| 腸内細菌叢の潜在的な影響を調べるために、ガチョウを通常の食事または高カルシウム・高タンパク質食事に割り当て、それぞれの食事を 28 日間連続して与えました (図 1a)。実験食の食事レシピと栄養レベルについては、以前の記事 (Fu et al., 2024) を参照してください。高カルシウム・高タンパク質食事を 28 日間与えられたガチョウでは、最終平均体重の低下 (p < 0.0001)、死亡率の上昇 (p < 0.0001)、肝臓の相対重量の上昇 (p = 0.0254、図 1b–d) により、成長パフォーマンスが著しく悪化していることが示されました。さらに、血清生化学の結果から、高尿酸血症モデルの構築が成功したことが示されました。 高尿酸血症群では血清尿酸(p < 0.0001)、キサンチンオキシダーゼ(XOD; p < 0.0001)、血中尿素窒素(BUN; p < 0.0001)、クレアチニン(p < 0.0001)が有意に上昇し、尿酸は閾値(420 μmol l−1; 図1e、f)を超えていました。 |
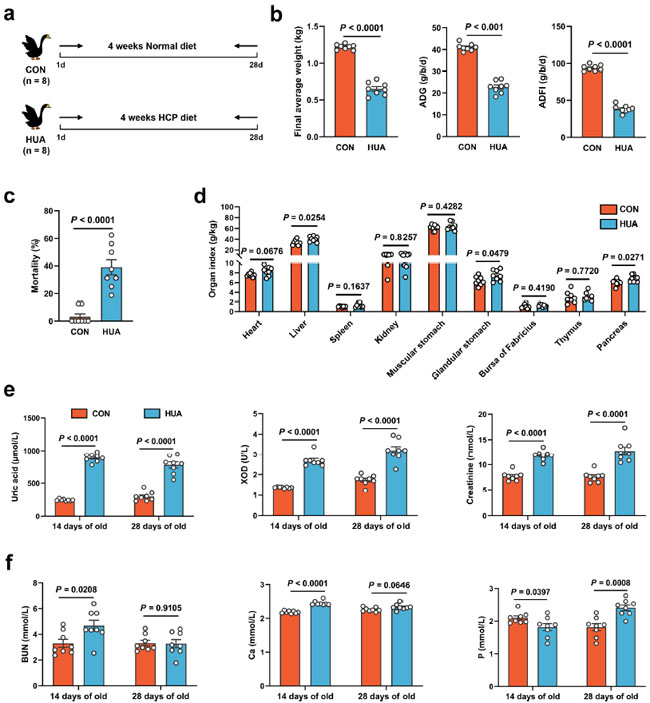 |
図 1. 食事依存性高尿酸血症 (HUA) における成長と代謝の違い。 (a) 実験設計。 (b) コントロール食 (CON、n = 8) または 高カルシウム・高タンパク質食 (HUA、n = 8) の 28 日後のガチョウの最終平均体重、平均日飼料摂取量 (ADFI)、および平均日増加量 (ADG)。 (c) コントロール食(CON、n = 8) または 高カルシウム・高タンパク質食 (HUA、n = 8) の 28 日後のガチョウの死亡率。 (d) コントロール食 (CON、n = 8) または高カルシウム・高タンパク質食 (HUA、n = 8) の 28 日後のガチョウの臓器指数。 (e) コントロール食 (CON、n = 8) または高カルシウム・高タンパク質食 (HUA、n = 8) の 14 日または 28 日後のガチョウの血清尿酸 (UA)、キサンチンオキシダーゼ (XOD)、およびクレアチニン濃度。 (f) コントロール食 (CON、n = 8) または高カルシウム・高タンパク質食 (HUA、n = 8) を 14 日間または 28 日間摂取した後のガチョウの血中尿素窒素 (BUN)、カルシウム (Ca)、およびリン (P) レベル。(b–f) の統計的有意性は、対応のない両側スチューデント t 検定によって決定されました。エラーバーの付いたデータは、平均 ± 標準誤差を表します。 |
| 食事パターンが腸内微生物叢のリモデリングに与える影響を調べるため、コントロールグループおよび 高尿酸血症ガチョウの盲腸糜粥の 16S リボソーム RNA (rRNA) 遺伝子配列決定を 28 日後に実施しました。高カルシウム・高タンパク質食は、ガチョウの腸内微生物叢のアルファ多様性のわずかながら有意な減少を引き起こしました (Chao 指数、p = 0.0027、Shannon 指数、p = 0.0100、図 2a、b)。主座標分析 (PCoA) における Bray–Curtis 非類似度測定基準を使用したベータ多様性の分析では、コントロール食と 高尿酸血症食間で腸内微生物シグネチャの明確な分離が示されました (p = 0.0040、図 2c)。分類学的変化の LDA (線形判別分析) 効果サイズ (LEfSe) 分析では、高カルシウム・高タンパク質食が明確な細菌濃縮をもたらしたことが明らかになりました。通常の食事を与えられたガチョウに存在する主な細菌科は、Butyricicoccaceae(p = 0.0003)、Ruminococcaceae(p = 0.0103)、およびLactobacillaceae(p = 0.0003)でした。逆に、Ruminococcustorksグループ(p < 0.0001)およびRuminococcusgauvreauilグループ(p = 0.0005)は、ガチョウに高カルシウム・高タンパク質食を与えた場合に有意な増殖を示しました(図2d、e、および図2—図補足1A–C)。 |
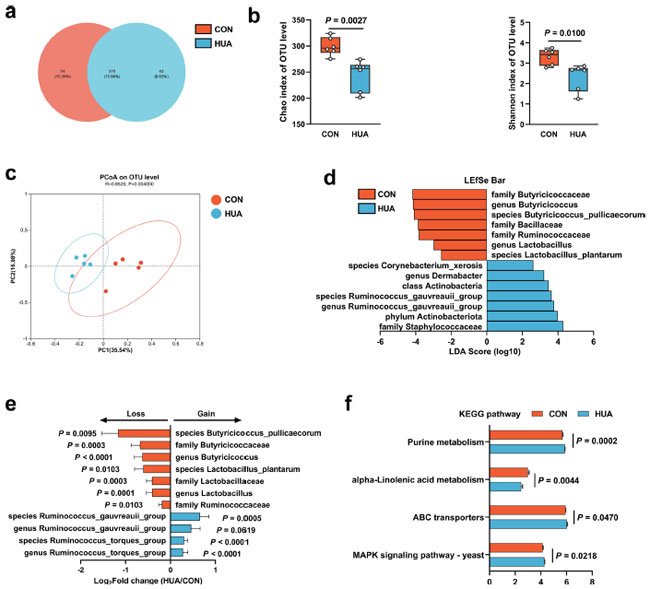 |
図 2. 食事依存性高尿酸血症 (HUA) における腸内細菌叢の違い。 (a) 28 日後にコントロール食 (CON、15.20%) または 高カルシウム・高タンパク質食 (HUA、8.83%) を与えられたガチョウの糞便サンプルにおける細菌操作分類単位 (OTU) のベン図。(b) アルファ多様性分析に基づく指定グループの Chao および Shannon 指数 (n = 6)。(c) コントロールグループと 高尿酸血症 グループ間の 95% 信頼区間での OTU レベルの細菌の主成分分析 (n = 5、r = 0.6520、p = 0.0040)。(d) コントロールグループと 高尿酸血症グループの糞便細菌叢の LDA 効果サイズ (LEfSe) 分析から得られた線形判別分析 (LDA) スコア。Kruskal–Wallis ≤0.05 の細菌と LDA >2 の細菌が報告されています。 (e) 細菌の相対存在量の変化傾向 (n = 5)。x 軸は、コントロールグループと比較した 高尿酸血症グループの細菌の相対存在量の log2 倍変化を示しています。(f) コントロールと 高尿酸血症グループの糞便サンプルからの 16S データの PICRUSt (Phylogenetic Investigation of Communities by Reconstruction of Unobserved States) 予測分析に基づく主要なパスウェイの変化の概要。Wilcoxon 順位和検定で p ≤ 0.05 のパスウェイが報告されています。(b) の統計的有意性は、対応のない両側 Student t 検定によって決定されました。エラーバーの付いたデータは、平均 ± s.e.m. を表します。 |
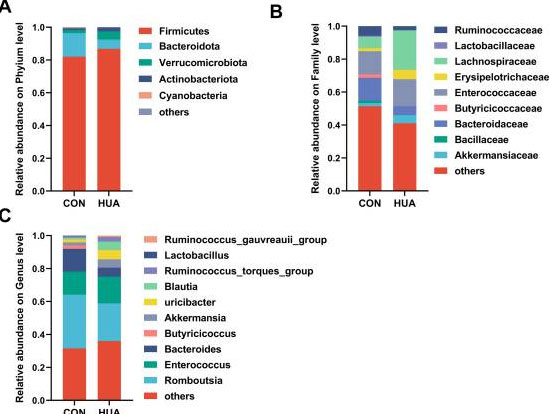 |
図2—図補足1。 食事依存性高尿酸血症(HUA)における腸内細菌の相対的豊富さ。 28日間のコントロール食(CON、n = 8)または高カルシウム・高タンパク質食(高尿酸血症[HUA]、n = 8)摂取後のガチョウの門(A)、科(B)、属(C)レベルでの腸内細菌の相対的豊富さ。 |
| これらの調査結果は総合的に、高カルシウム・高タンパク質食が腸内微生物のリモデリングに重大な影響を及ぼしていることを示しており、特にLactobacillus 属とButyricicoccus属の存在量の変化に反映されています。さらに、PICRUSt (未観測状態の再構築によるコミュニティの系統発生調査) 予測分析に基づく京都遺伝子ゲノム百科事典 (KEGG) 経路の存在量プロファイルでは、腸内微生物叢におけるプリン代謝 (p = 0.0002) とマイトジェン活性化プロテインキナーゼ (MAPK) シグナル伝達経路 (p = 0.0218) が大幅に増加し、α-リノレン酸代謝が大幅に減少していることが明らかになりました (図 2f)。この研究の全体的な調査結果から、ガチョウの 高尿酸血症は有害な影響を及ぼし、腸内微生物叢の構成に変化をもたらすことが示唆されました。 |
| 2.2.L. plantarum SQ001 は in vitro でヌクレオシドを加水分解します |
| 高尿酸血症ガチョウから採取した盲腸糜粥サンプルから L. plantarum SQ001 株を取得しました。L. plantarum SQ001 の全ゲノム配列決定を実施し、完全なゲノムが得られました。RefSeq の 18 株と比較すると、L. plantarum SQ001 は L. plantarum A (GCF_000463075.2、0.866) に近いことがわかりました (図 3a)。走査型電子顕微鏡検査では、長い棒状であることが示されました (図 3b)。高尿酸血症における L. plantarum SQ001 による緩和のメカニズムを解明するために、まず L. plantarum SQ001 の 尿酸代謝能力を調査しました。 L. plantarum SQ001 は 尿酸の分解には影響しません (図 3c、d) が、尿酸生成の前駆体であるプリンヌクレオシド (イノシンとグアノシン) を代謝することができます。結果は、L. plantarum SQ001 が 6 時間以内に両方のプリンヌクレオシドを完全に吸収または加水分解したことを示しました (p < 0.0001、図 3e、f)。これらの結果は、L. plantarum SQ001 が尿酸を直接分解するのではなく、その前駆体を代謝することによって高尿酸血症を軽減することを示しています。 |
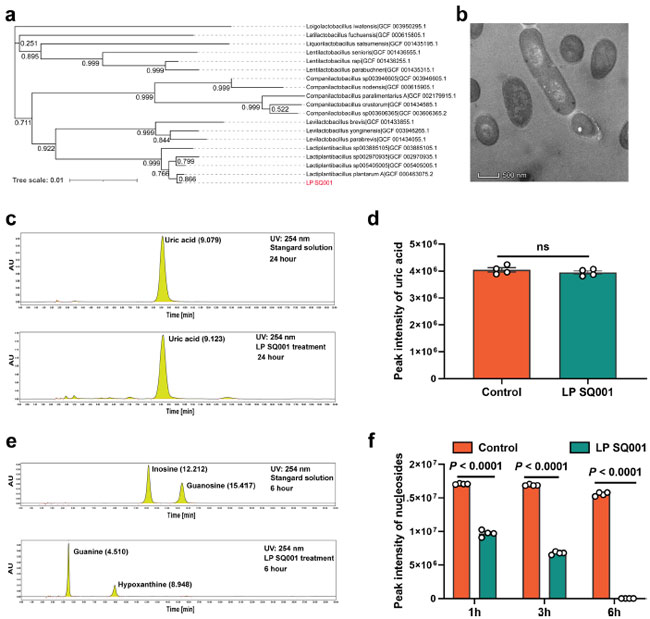 |
| 図 3. L. plantarum SQ001 は in vitro でヌクレオシドを加水分解できます。 (a) L. plantarum SQ001 の系統樹。L. plantarum SQ001 の 16S リボソーム RNA (rRNA) を抽出し、異なる起源の 18 株と比較しながら、系統樹を配列および blast しました。ブートストラップ値は枝の下に表示されています。(b) L. plantarum SQ001 株の透過型電子顕微鏡結果。倍率 12,000。(c) 高性能液体クロマトグラフィー (HPLC) 分析による L. plantarum SQ001 による尿酸の分解。(d) 24 時間処理後の L. plantarum SQ001 による尿酸のピーク強度 (n = 4)。(e) HPLC 分析による L. plantarum SQ001 によるイノシンとグアノシンの分解。 (f) 1、3、6 時間処理後の L. plantarum SQ001 によるヌクレオシドのピーク強度 (イノシンおよびグアノシン、n = 4)。(e) の統計的有意性は、対応のない両側 Student t 検定によって決定されました。エラーバーの付いたデータは、平均 ± 標準誤差を表します。LP SQ001、L. plantarum SQ001、LP 23180、L. plantarum 23180。 |
| 2.3.L. plantarumSQ001 のプリン代謝はヌクレオシドによって活性化されました |
| L. plantarum SQ001 がヌクレオシド分解に関与していることは明らかですが、L. plantarum SQ001 に対する具体的な代謝の影響は不明です。さらに、ヌクレオシド溶液 (イノシン、アデノシン、グアノシン) との共培養 6 時間後、主成分分析 (PCA) とボルケーノ プロットにより、L. plantarum SQ001 がヌクレオシド溶液の組成を変更し、存在するイノシンの量を減らしたことが明らかになりました (図 4a~c)。KEGG 分析により、プリン代謝経路における代謝物の濃縮が明らかになりました (図 4d)。示差代謝物のヒートマップから、L. plantarum SQ001 はイノシン (p < 0.0001)、グアノシン (p < 0.0001)、アデノシン (p < 0.0001) のレベルを有意に低下させ、一方でグアニン (p < 0.0001)、キサンチン (p < 0.0001)、プロリン (p < 0.0001、図 4e) のレベルを上昇させることが明らかになりました。 |
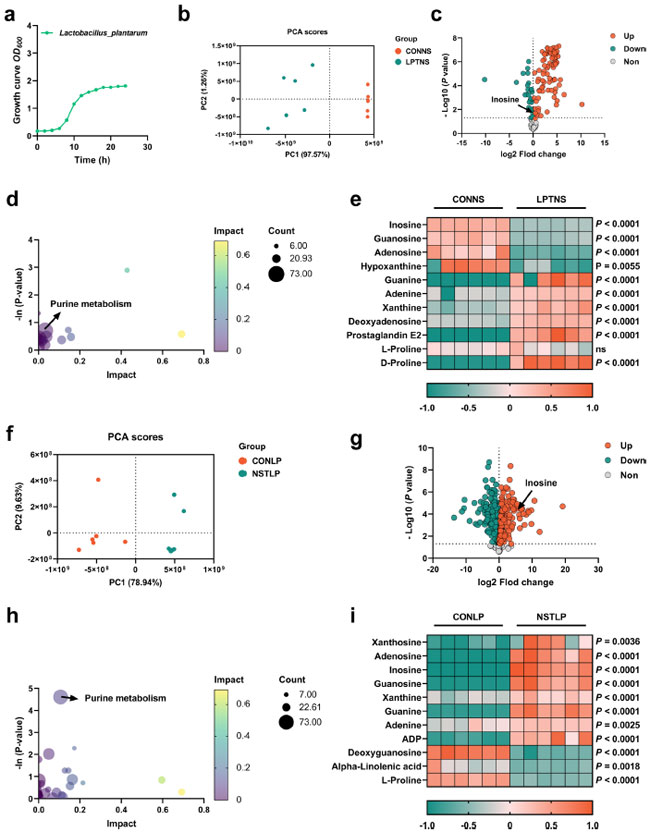 |
図4. L. plantarum SQ001のプリン代謝はヌクレオシドによって活性化された。 (a) L. plantarum SQ001 の成長曲線。(b) L. plantarum SQ001または コントロール食処理したヌクレオシド溶液サンプルから収集されたさまざまな代謝物の主成分分析 (PCA) スコア プロット。収集されたすべてのデータは、95% 信頼区間内にあります。赤はコントロールヌクレオシド溶液グループ、緑はL. plantarum SQ001 処理ヌクレオシド溶液グループを表します。(c) L. plantarum SQ001 処理ヌクレオシド溶液と L. plantarum SQ001 処理ヌクレオシド溶液の比較における変化した代謝物のボルケーノ プロット。(d) コントロールヌクレオシド溶液グループとL. plantarum SQ001 処理ヌクレオシド溶液グループ間の変化した代謝物の KEGG (京都遺伝子ゲノム百科事典) ベースのパスウェイ過剰表現分析。バブルのサイズは、各パスウェイに含まれる重要な代謝物の割合を表します。バブルは影響に応じて色分けされています。(e) コントロールヌクレオシド溶液グループとL. plantarum SQ001 処理ヌクレオシド溶液グループ間のマーカー代謝物の変化を示す細胞外液体クロマトグラフィー質量分析 (LC-MS) データのヒートマップ (n = 6)。代謝物レベルの増加は赤で示され、緑は代謝物の減少を示します。 (f) ヌクレオシドまたはコントロール食処理した LP サンプルから収集されたさまざまな代謝物の主成分分析 (PCA)スコア プロット。収集されたすべてのデータは 95% 信頼区間内にあります。赤は コントロール L. plantarum SQ001グループ、緑は ヌクレオシド溶液処理 L. plantarum SQ001グループを表します。(g) ヌクレオシド溶液処理 L. plantarum SQ001と コントロール L. plantarum SQ001の比較における変化した代謝物のボルケーノ プロット。(h) ヌクレオシド溶液処理 L. plantarum SQ001。 グループと コントロール L. plantarum SQ001グループ間の変化した代謝物の KEGG ベースのパスウェイ過剰表現分析。バブルのサイズは、各パスウェイに含まれる重要な代謝物の割合を表します。バブルは影響に応じて色分けされています。(i) ヌクレオシド溶液処理 L. plantarum SQ001グループと コントロール L. plantarum SQ001グループ間のマーカー代謝物の変化を示す細胞内 LC-MS データのヒートマップ (n = 6)。代謝物レベルの増加は赤で示され、緑は代謝物の減少を示します。(e、i) の統計的有意性は、対応のない両側 Student t 検定によって決定されました。エラー バーの付いたデータは平均 ± s.e.m. を表します。 CONNS: コントロールヌクレオシド溶液、LPTNS: L. plantarum SQ001 処理ヌクレオシド溶液、CONLP: コントロール L. plantarum SQ001、NSTLP: ヌクレオシド溶液処理 L. plantarum SQ001。 |
| さらに、ヌクレオシド(イノシン、アデノシン、グアノシン)とのインキュベーションの有無による L. plantarum SQ001 の細胞内代謝変化を調べました。主成分分析 (PCA) およびボルケーノ プロットから、ヌクレオシド溶液によって L. plantarum SQ001 の細胞内代謝物組成が変化し、イノシン含有量が増加したことが示されました(図 4f、g)。KEGG 分析では、プリン代謝経路における代謝物の顕著な増加が示されました(図 4h)。代謝産物レベルの違いを示すヒートマップでは、イノシン(p < 0.0001)、グアノシン(p < 0.0001)、アデノシン(p < 0.0001)、グアニン(p < 0.0001)、キサンチン(p < 0.0001)、アデニン(p = 0.0025)の有意な増加が示されましたが、α-リノレン酸(p = 0.0018)およびプロリン(p < 0.0001)のレベルは有意に減少しました(図 4i)。 |
| 全体として、L. plantarum SQ001 によるヌクレオシドの吸収と加水分解を確認しました。さらに、リノレン酸やプロリンなどの、合成される可能性のあるいくつかの有益な代謝産物を特定しました。ただし、L. plantarum SQ001 がヌクレオシドを吸収して加水分解する正確なメカニズムは不明です。 |
| 2.4.L. plantarum SQ001 は、高尿酸血症を軽減する可能性のあるヌクレオシド加水分解酵素を介してヌクレオシドを加水分解します。 |
| ゲノムは 3,549,454 bp で構成され、3361 のコード配列 (CDS) と 85 の RNA 遺伝子を含むと予測されました (図 5a)。L. plantarumSQ001 のゲノムに含まれる合計 2,739 のタンパク質コード遺伝子は、オーソログ グループ クラスター (COG) を使用して注釈付けされました。これらのうち、機能不明の遺伝子 (S) が最も多く (19.51%)、次に (G) 炭水化物輸送と代謝、(E) アミノ酸輸送と代謝、(F) ヌクレオチド輸送と代謝に関与する遺伝子が続きました (図 5b)。 |
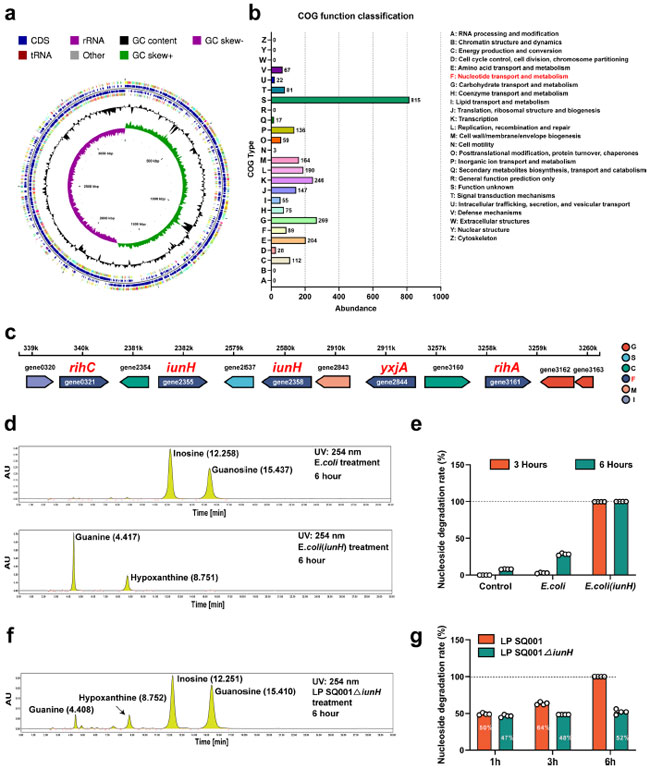 |
図 5. L. plantarum SQ001 はヌクレオシド加水分解酵素を介してヌクレオシドを分解し、高尿酸血症 (HUA) を軽減する可能性があります。 (a) L. plantarum SQ001 のゲノムマップ。(b) L. plantarum SQ001 のオーソロググループ (COG) レパートリーのクラスター。(c) ヌクレオチドトランスポーター代謝に関与する遺伝子は、各スキャフォールド上に線形プロットとして配置され、各遺伝子はコーディング方向がラベル付けされ、オーソロググループ機能分類によって色分けされています。(d) 高性能液体クロマトグラフィー (HPLC) 分析による E. coli および E. coli (iunH) によるイノシンとグアノシンの分解。(e) E. coli での異種発現後の L. plantarum SQ001 遺伝子 iunH のヌクレオシド分解速度。(f) HPLC 分析による L. plantarum SQ001∆iunH によるイノシンとグアノシンの分解。(g) 遺伝子 iunH ノックアウト後の L. plantarum SQ001 のヌクレオシド分解速度。 yxjA: ヌクレオシドパーミアーゼ; iunH: ヌクレオシドヒドロラーゼ; rihC: リボヌクレオシドヒドロラーゼ; rihA: ピリミジン特異的リボヌクレオシドヒドロラーゼ。 |
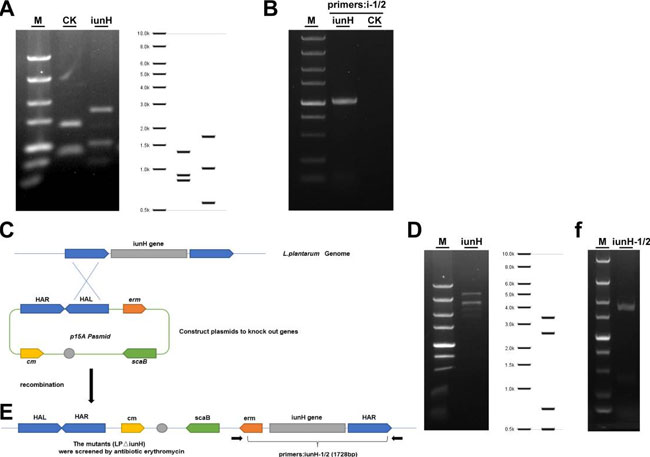 |
図5—図補足1. 遺伝子iunHの異種発現とノックアウト検証。 (A) p15A-cm-Pgenta、p15A-cm-iunH 制限酵素消化マップ。M: DL 5000 DNA マーカー、ストライプのサイズは上から下まで 5、3、2、1.5、1、0.75、0.5、0.25、0.1 kb。(B) 組み換えプラスミド p15A-cm-Pgenta、p15A-cm-iunH の異種発現の PCR 検証。i1: Pgenta-iunH-1、i2: iunH-2、PCR 産物: 2100 bp (変異体、i1/i2)、M: DL5000 DNA ラダー、CK: Nissle1917/p15A-cm-Pgenta。(C) 遺伝子をノックアウトするためのプラスミドの構築。 (D) p15A cm-HA-erm scaB iunH 制限エンドヌクレアーゼ消化マップ。M: DL 5000 DNA マーカー。(E) 組換え株は耐性についてスクリーニングされ、単一のコロニーが PCR 検証用に選択され、組換え欠失株が成功しました。(F) 組換えプラスミド p15A-cm-HA-erm scaB iunH、iunH-1: check-iunH-1、iunH-2: check-iunH-2 の異種発現の PCR 検証、PCR 産物: 1728 bp (変異体、iunH-1/2)、M: DL5000 DNA ラダー。 |
| ヌクレオチド輸送および代謝の分野では、L. plantarum SQ001 のゲノムには 89 個のタンパク質コード遺伝子が含まれていました。2 つの遺伝子はヌクレオシド加水分解酵素 (iunH)、2 つはリボヌクレオシド加水分解酵素 (rihA、rihC)、1 つはヌクレオシドパーミアーゼ (yxjA) として特定されました (図 5c)。これらの遺伝子は、L. plantarum SQ001 による 高尿酸血症の緩和に関連している可能性があります。ただし、高尿酸血症における L. plantarum SQ001 の役割はさらに明らかにする必要があります。 |
| ここでは、L. plantarum SQ001 によるヌクレオシドの分解におけるヌクレオシド加水分解酵素 (iunH) の役割に注目しました。まず、異種発現による iunH の役割を決定し、E. coli は iunH の異種発現の 3 時間後にイノシンとグアノシンを完全に分解しました (図 5d、e および図 5—図補足 1A、B)。さらに、ノックアウト実験により、L. plantarum SQ001 は iunH 遺伝子ノックアウトによりヌクレオシド分解が 50% 減少することを確認しました (図 5f、g および図 5—図補足 1C–F)。 |
| 全体として、L. plantarum SQ001 はヌクレオシド加水分解酵素 iunH を介してヌクレオシドを加水分解することが実証されました。ただし、高尿酸血症のガチョウに対する L. plantarum SQ001 の緩和効果はまだ検証されていません。 |
| 2.5.L. plantarum SQ001 および代謝物を含む L. plantarum SQ001 は、高カルシウム・高タンパク質食誘発性高尿酸血症を軽減します |
高尿酸血症における L. plantarum SQ001 の機能的役割をさらに確認するために、高尿酸血症ガチョウにそれぞれ 14 日間経口投与し、L. plantarum SQ001 および代謝物を含む L. plantarum SQ001 を投与しました (図 6a)。 結果は、最終平均体重の改善 (p < 0.0001、図 6b)、死亡率の減少 (p = 0.0003、図 6c)、肝臓 (p = 0.0800)、腎臓 (p = 0.0200、図 6d) など、成長パフォーマンスが著しく改善したことを示しました。さらに、L. plantarum SQ001 と代謝物を含む L. plantarum SQ001 の両方で、血清尿酸(p < 0.0001)、キサンチンオキシダーゼ (XOD) (p < 0.0001)、血中尿素窒素 (BUN) (p < 0.0001)、およびクレアチニン含有量 (p < 0.0001) が有意に減少し、血清インターロイキン-1β (IL-1β、p < 0.0001)、腫瘍壊死因子-α (TNF-α、p < 0.0001)、およびインターフェロン-γ (IFN-γ、p < 0.0001) レベルが低下しました (図 6e~g)。 L. plantarum SQ001 を経口投与したガチョウと、代謝物を含む L. plantarum SQ001 を経口投与したガチョウでは、絨毛長 (p = 0.0051)、および陰窩深度 (p = 0.0122、図 7a、b) を含む小腸表現型の損傷が軽減されました。さらに、L. plantarum SQ001 は、病理切片に反映されているように、肝臓と腎臓の炎症細胞浸潤などの病理学的損傷を軽減しました (p < 0.0001、図 7c、d)。これらの結果は、L. plantarum SQ001 がガチョウの 高尿酸血症を軽減することを示していますが、腸内細菌が果たす役割は不明です。 |
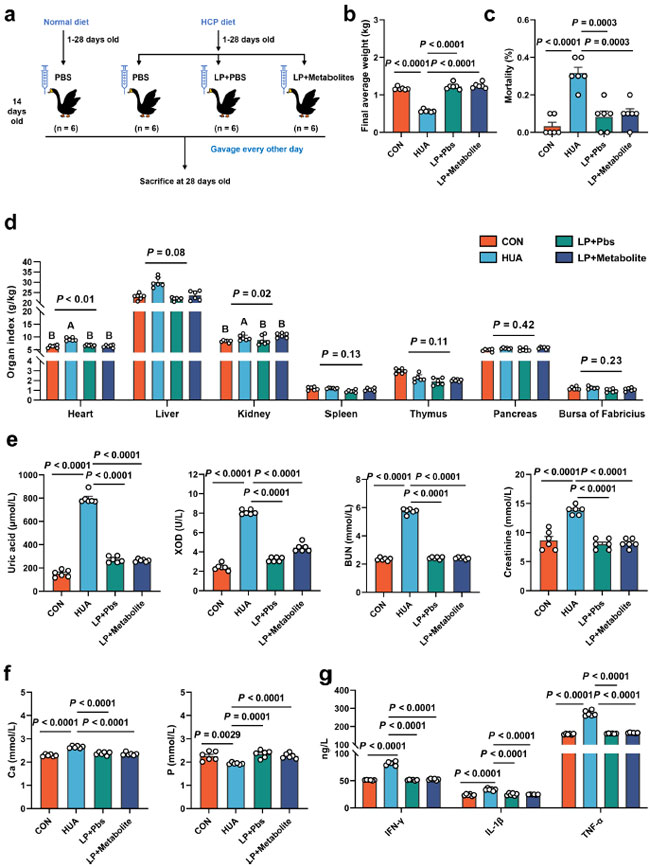 |
図 6. L. plantarum SQ001 および代謝物を含む L. plantarum SQ001 は 高カルシウム・高タンパク質食誘発性高尿酸血症を軽減します。 (a) 実験設計。(b) L. plantarum SQ001 および代謝物を含む L. plantarum SQ001 が 高カルシウム・高タンパク質食餌を与えられたガチョウ (n = 6) の最終平均体重に及ぼす影響。(c) L. plantarum SQ001 および代謝物を含む L. plantarum SQ001 が高カルシウム・高タンパク質食を与えられたガチョウ (n = 6) の死亡率に及ぼす影響。(d) L. plantarum SQ001 および代謝物を含む L. plantarum SQ001 が高カルシウム・高タンパク質食を与えられたガチョウ (n = 6) の臓器指数に及ぼす影響。(e) L. plantarum SQ001 および代謝物を含む L. plantarum SQ001 が 高カルシウム・高タンパク質食餌を与えられたガチョウ (n = 6) の血清尿酸、キサンチンオキシダーゼ (XOD)、血中尿素窒素 (BUN)、およびクレアチニンに及ぼす影響。 (f) L. plantarum SQ001 および代謝物を含む L. plantarum SQ001 が高カルシウム・高タンパク質食餌を与えられたガチョウ (n = 6) の血清 Ca および P レベルに及ぼす影響。 (g) L. plantarum SQ001 および代謝物を含む L. plantarum SQ001 が高カルシウム・高タンパク質食餌を与えられたガチョウ (n = 6) の血清 IFN-γ、IL-1β、および TNF-α レベルに及ぼす影響。 (b–f) の統計的有意性は、対応のない両側 Student t 検定によって決定されました。 (d) の有意差は、Bonferroni の多重比較検定を用いた一元配置分散分析によって評価されました。エラーバーの付いたデータは、平均 ± 標準誤差を表します。 |
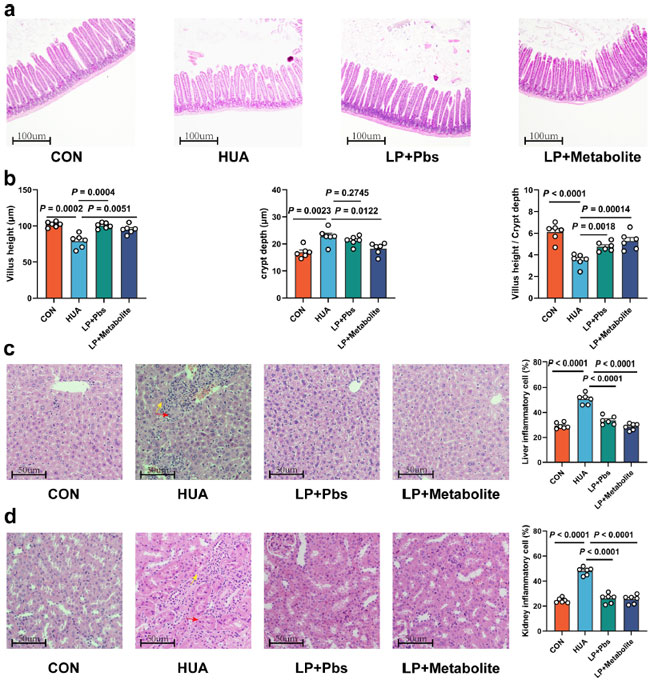 |
図 7. L. plantarum SQ001 および代謝物を含む L. plantarum SQ001 は、高カルシウム・高タンパク質の食事誘発性小腸、肝臓、腎臓の損傷を軽減できる可能性がある。 (a) ガチョウの小腸切片の代表的な H&E 染色画像と組織学的スコア (n = 6)。スケールバー: 100 µm。(b) 絨毛の高さ、陰窩の深さ、および絨毛の高さ/陰窩の深さの値 (n = 6)。切片ごとに 6 つの陰窩を数えました。(c) ガチョウの肝臓切片の代表的な H&E 染色画像と炎症細胞率 (n = 6)。スケールバー: 50 µm。(d) ガチョウの腎臓切片の代表的な H&E 染色画像と炎症細胞率 (n = 6)。スケールバー: 50 µm。b の統計的有意性は、対応のない両側 Student t 検定によって決定されました。エラーバーの付いたデータは、平均 ± 標準誤差を表します。 |
| 盲腸糜粥の配列解析により、L. plantarum SQ001 と代謝物を含む L. plantarum SQ001 の両方が、高尿酸血症グループと比較して、微生物叢の豊富さ (Chao 指数、p < 0.0001) と均一性 (Shannon 指数、p < 0.0001) を有意に増加させたことが明らかになりました (図 8a と図 8—図補足 1A)。PCoA 解析により、L. plantarum SQ001、代謝物を含む L. plantarum SQ001、および 高尿酸血症グループで腸内微生物叢の分離が示されました (図 8b)。配列決定の結果、L. plantarum SQ001 および代謝物を含む L. plantarum SQ001 は、Firmicutes 門 (図 8—図補足 1B)、Lachnospiraceae 科 (p = 0.0218)、Ruminococcaceae 科 (p = 0.0049、図 8c)、Lactobacillaceae 科 (p = 0.0005、図 8d)、および Butyricicoccaceae 科 (p = 0.0278、図 8e および図 8—図補足 1C) の相対的存在量を有意に増加させることが示されました。一方、Lactiplantibacillus 属 (p = 0.0012)、Butyricicoccus 属 (p = 0.0350)、および L. plantarum 属 (p = 0.0003)、B. pullicaecorum 属 (p = 0.0059) の相対的存在量も著しく増加しました (図 8d、e、および図 8—図補足 1D)。全体として、L. plantarum SQ001 は 高カルシウム・高タンパク質食誘発性の腸内微生物障害を改善し、Lactobacillus 属および Butyricicoccus 属の存在量を回復および増加させ、最終的にガチョウの高尿酸血症を軽減しました。 |
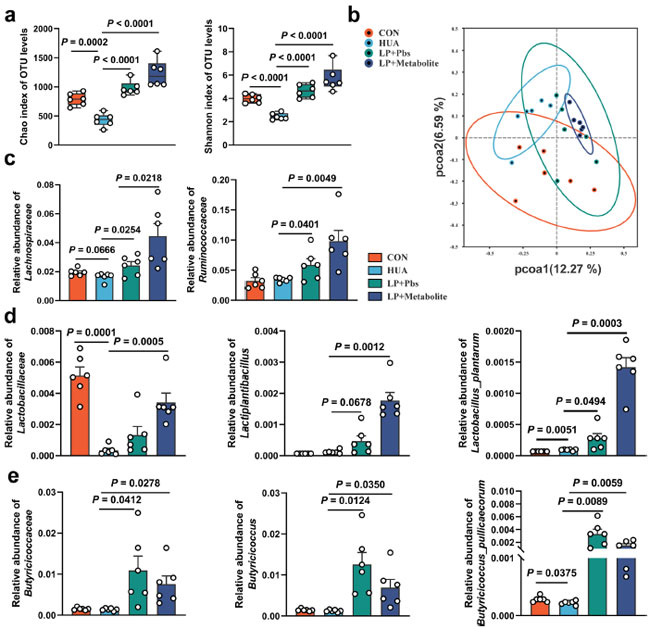 |
図 8. L. plantarum SQ001 および代謝物を含む L. plantarum SQ001 は、高カルシウム・高タンパク質食誘発性腸内細菌障害を緩和します。 (a) アルファ多様性分析に基づく指定グループの Chao および Shannon 指数 (n = 6)。 (b) 指定グループの 95% 信頼区間での細菌の主成分分析 (n = 6)。 (c) 高カルシウム・高タンパク質食餌を与えられたガチョウにおける、Lachnospiraceae 科および Ruminococcaceae 科の相対的存在量に対する L. plantarum SQ001 および代謝物を含む L. plantarum SQ001 の影響 (n = 6)。 (d) 高カルシウム・高タンパク質食餌を与えられたガチョウにおける、Lactobacillaceae 科、Lactiplantibacillus 属、および Lactobacillus plantarum 種の相対的存在量に対する L. plantarum SQ001 および代謝物を含む L. plantarum SQ001 の影響 (n = 6)。 (e) L. plantarum SQ001 および代謝物を含む L. plantarum SQ001 が、高カルシウム・高タンパク質食餌を与えられたガチョウ (n = 6) における Butyricicoccaceae 科、Butyricicoccus 属、Butyricicoccus pullicaecorum 種の相対的存在量に及ぼす影響。(a、c – e) の統計的有意性は、対応のない両側 Student t 検定によって決定されました。エラーバーの付いたデータは、平均 ± 標準誤差を表します。 |
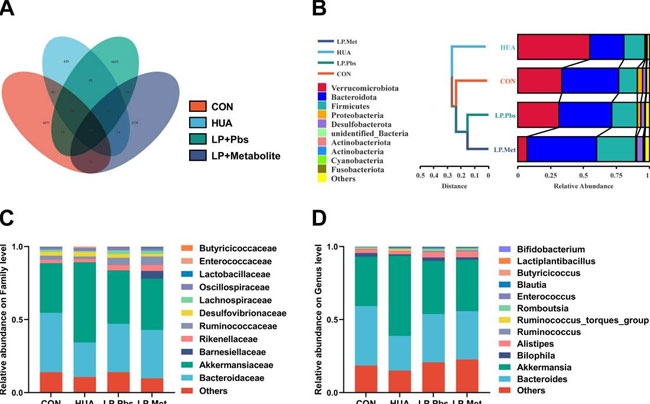 |
図8—図補足1。L. plantarum SQ001およびL. plantarum SQ001とその代謝物のガチョウの腸内細菌叢への影響。 (A) 示されたグループのガチョウの糞便サンプルにおける細菌操作分類単位 (OTU) のベン図。示されたグループのガチョウの門 (B)、科 (C)、属 (D) レベルでの腸内細菌の相対的豊富さ。 |
| 2.6.L. plantarum SQ001 はマウスモデルで 高尿酸血症を軽減します |
| L. plantarum SQ001 の 高尿酸血症軽減における役割をさらに調査するために、昆明マウスを追加の高尿酸血症モデルとして利用し、L. plantarum SQ001 を経口投与しました (図 9a)。L. plantarum SQ001 は、高尿酸血症モデルマウスで膝関節の厚さ (p = 0.0011、図 9b)、相対腎臓重量 (p = 0.0038、図 9c)、血清尿酸レベル (p = 0.0022)、血清キサンチンオキシダーゼ (XOD)活性 (p = 0.0348) を有意に減少させました (図 9d)。 尿酸形成に関与する主要な肝酵素をさらに分析したところ、L. plantarum SQ001 は肝臓におけるホスホリボシルピロリン酸合成酵素 (PRPS、p = 0.0044) およびキサンチンオキシダーゼ (XO、p < 0.0001、図 9e) の発現を有意に低下させることが明らかになりました。さらに、L. plantarum SQ001 は、グルコーストランスポーター 9 (GLUT9、p = 0.0085) を含む腎臓における尿酸再吸収に関連するタンパク質の発現を低下させ、尿酸排泄タンパク質 ATP 結合カセットトランスポーター G2 (ABCG2、p = 0.1028、図 9f) の発現を増加させました。総合すると、これらの知見は、L. plantarum SQ001 が主に肝臓における尿酸産生を低下させ、腎臓における尿酸排泄を促進することによって高尿酸血症を軽減できることを示唆しています。 |
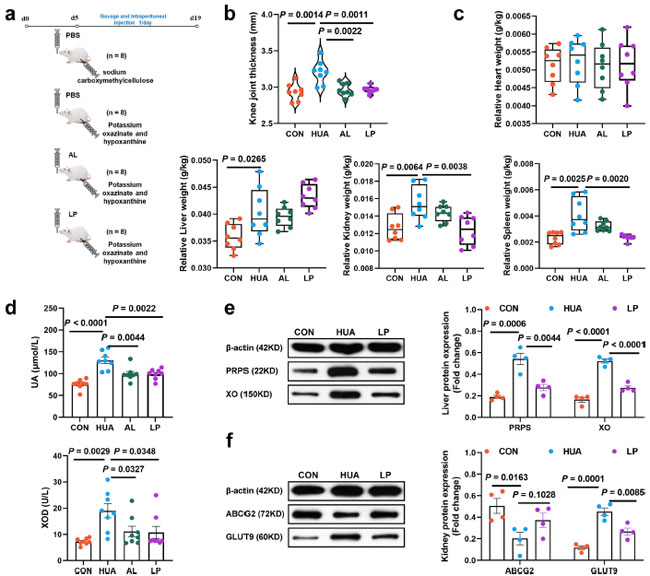 |
図 9. マウスにおける高尿酸血症および尿酸 (UA) 代謝のタンパク質発現レベルに対する L. plantarum SQ001 の効果。 (a) 実験設計。(b)ML. plantarum SQ001 がマウスの膝関節の厚さに及ぼす影響 (n = 8)。(c) L. plantarum SQ001 がマウスの臓器指数 (心臓、肝臓、腎臓、脾臓) に及ぼす影響 (n = 8)。(d) L. plantarum SQ001 が 高カルシウム・高タンパク質食餌を与えられたガチョウの血清尿酸、キサンチンオキシダーゼ (XOD) に及ぼす影響 (n = 8)。(e) コントロール食、高尿酸血症、およびL. plantarum SQ001グループ (n = 4) の肝臓組織における代表的なウェスタンブロッティング画像とタンパク質 (ホスホリボシルピロリン酸合成酵素 [PRPS]、キサンチンオキシダーゼ[XO]) の定量。(f) コントロール食、高尿酸血症、およびL. plantarum SQ001 グループ (n = 4) の腎臓組織における代表的なウェスタンブロッティング画像とタンパク質 (ABCG2、GLUT9) の定量。 (b–f) の統計的有意性は、対応のない両側スチューデント t 検定によって決定されました。エラー バーの付いたデータは、平均 ± 標準誤差を表します。CON、コントロール グループ、HUA、高尿酸血症モデルグループ、AL、アロプリノールグループ、LP、L. plantarum SQ001 グループ。 |
| L. plantarum SQ001 の 高尿酸血症緩和効果をさらに確認するために、血清代謝物の非標的メタボロミクス解析を実施しました。主成分分析 (PCA)により、2 つのグループが異なる代謝物プロファイルを示すことが実証されました (図 10a、b)。パスウェイ エンリッチメント解析により、特定された代謝物は主にプリン代謝に関連していることが明らかになりました (図 10c、d)。L. plantarum SQ001 はイノシンとキサントシンのレベルを低下させ、L-プロリン、L-バリン、L-アルギニン、L-タルギニン、および L-メチオニンのレベルを有意に上昇させました (図 10e)。腸内細菌叢をさらに調査したところ、L. plantarum SQ001 は Chao (p < 0.0001) および Shannon 指数 (p = 0.0002、図 10f) を有意に上昇させることが示されました。 主成分分析 (PCA)により、4 つのグループ間で腸内細菌叢に明確な違いがあることが明らかになりました (図 10g)。操作的分類単位の種構成分析により、L. plantarum SQ001 は Fimicutes と Bacteroideta の比率を回復し、Lactobacillaceae、Lactobacillus、Lactobacillus murinus、および Lactobacillus reuteri の存在量を増加させ、Staphylococcus および Staphylococcus xylosus の存在量を減少させることが明らかになりました (図 10h ~ k)。さらに、L. plantarum SQ001 は L. plantarum の存在量を増加させました (図 10l)。さらに、スピアマン相関分析により、Lactobacillus (p = 0.0360) および L. plantarum (p = 0.0120) は血清イノシン濃度と有意に負の相関を示しましたが、Bacteroides はイノシンと実質的に正の相関を示しました (p = 0.0070、図 10m)。さらに、分析の結果、Lactobacillus属とL. plantarum属は血清中のインドール-3-カルボン酸(ICA)レベルと実質的に正の相関関係にあるのに対し、Bacteroides属はインドール-3-カルボン酸と有意に負の相関関係にあることが示されました。 |
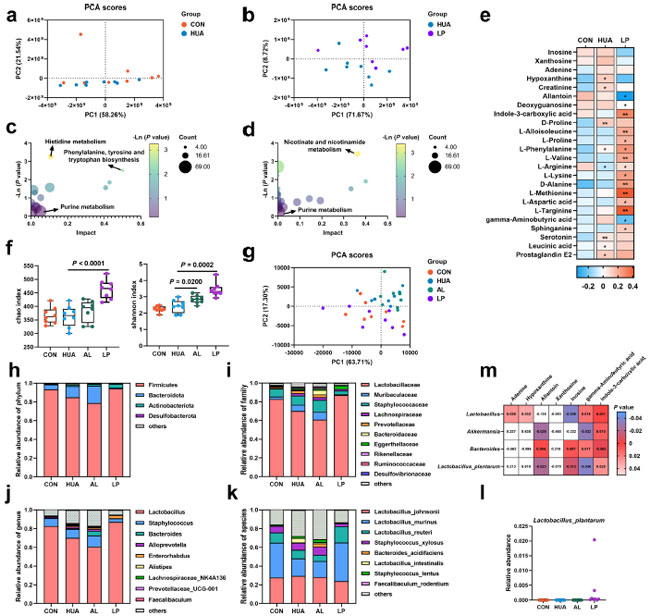 |
図 10. マウスの血清代謝物および腸内細菌叢に対する L. plantarum SQ001 の効果。 (a) 血清サンプルの主成分分析。黄色は コントロール食グループ (n = 8)、緑色は 高尿酸血症グループ (n = 8) を表します。(b) 血清サンプルの主成分分析。緑色は 高尿酸血症グループ (n = 8)、紫色はL. plantarum SQ001グループ (n = 8) を表します。(c) 京都遺伝子ゲノム百科事典 (KEGG) ベースのコントロール食および高尿酸血症グループ間の変化した代謝物のパスウェイ過剰表現分析。バブルのサイズは、各パスウェイに含まれる重要な代謝物の割合を表します。バブルは影響に応じて色分けされています。(d) 京都遺伝子ゲノム百科事典 (KEGG)ベースの 高尿酸血症およびL. plantarum SQ001グループ間の変化した代謝物のパスウェイ過剰表現分析。バブルのサイズは、各パスウェイに含まれる重要な代謝物の割合を表します。バブルは影響に応じて色分けされています。 (e) CON、高尿酸血症、およびL. plantarum SQ001グループ間のマーカー代謝物の変化を示す血清代謝物の液体クロマトグラフィー-質量分析 (LC-MS) データのヒートマップ (n = 8)。代謝物レベルの増加は赤で示され、代謝物の減少は青で示されます。(f) アルファ多様性分析に基づく指定グループの Chao および Shannon 指数 (n = 8)。(g) 指定グループの 95% 信頼領域での細菌の主成分分析 (n = 8)。マウスの門 (h)、科 (i)、属 (j)、および種 (k) レベルでの腸内細菌の相対的存在量 (n = 8)。(l) マウスにおける Lactobacillus plantarum 種の相対的存在量に対する L. plantarum SQ001 の影響 (n = 7)。(m) 血清代謝物と腸内細菌のスピアマン相関分析。 (e、f) の統計的有意性は、対応のない両側スチューデント t 検定によって決定されました。ns、有意性なし。*p < 0.05、**p < 0.01、***p < 0.001。エラーバー付きのデータは平均 ± s.e.m. を表します。CON、コントロール グループ、HUA、高尿酸血症モデル グループ、AL、アロプリノール グループ、LP、L. plantarum SQ001 グループ。 |
| 全体的に、これらの結果は、L. plantarum SQ001 が、Lactobacillusなどの有益な腸内細菌の量を増やし、尿酸前駆物質のレベルを低下させることによって、肝臓と腎臓の尿酸代謝を調節することを示しています。 |
| 3.考察 |
| 腸内微生物障害は、高プリン食によって引き起こされる高尿酸血症の形成と強く関連している可能性があります。私たちの研究では、高尿酸血症ガチョウの盲腸における Lactobacillus、L. plantarum、Butyricicoccus、および B. pullicaecorum の存在量の大幅な減少と、R.torques および R.gauvreauil グループの有意な増加を観察しました。高尿酸血症 モデル ガチョウから得られた L. plantarum SQ001 は、in vitro アッセイでヌクレオシド分解機能を示しました。高尿酸血症ガチョウに経口投与した後、血清 尿酸レベルが大幅に低下し、肝臓および腎臓の炎症が緩和され、同時に腸内微生物障害が回復しました。さらに、高尿酸血症マウス モデルに L. plantarum SQ001 を経口投与したところ、同様に Lactobacillus >および L. plantarum の存在量が増加し、血清尿酸レベルが低下しました (図 11)。これらの結果は、宿主由来の有益な細菌であるL. plantarumが腸内細菌叢を改善し、宿主の高尿酸血症を軽減することを示唆しています。 |
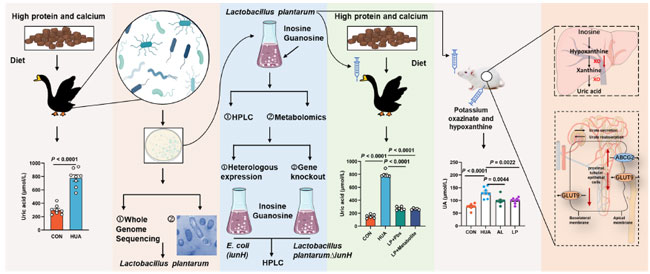 |
| 図 11.仮説。 結果は、宿主由来の Lactobacillus plantarum SQ001 がヌクレオシド加水分解酵素 iunH を介してヌクレオシドを加水分解し、腸管のヌクレオシド輸送を減らし、肝臓の尿酸生成を低下させ、腎臓排泄を回復させ、最終的に高尿酸血症 (HUA) を軽減することを示唆しています。iunH: イノシン-ウリジンヌクレオシド N-リボヒドロラーゼ; GLUT9: グルコーストランスポーター 9、尿酸再吸収トランスポーター; ABCG2: ATP 結合カセットトランスポーター G2、尿酸排泄トランスポーター。 |
| Lactobacillus属および Butyricicoccus属の存在量が少ないことから、高尿酸血症の発症に拮抗的な役割を果たしている可能性が示唆されます。研究では、L. plantarum、Lactobacillus rhamnosus、Limosilactobacillus などのLactobacillus属を経口投与すると、腸内細菌叢のバランスが維持され、Lactobacillusの存在量が増加し、血清尿酸レベルが低下することが示されています (Wang et al., 2022; Cao et al., 2022a; Zhao et al., 2022a)。私たちの研究結果では、L. plantarum SQ001 が腸内細菌叢の乱れと血清尿酸の上昇を改善し、代謝性疾患に関連する Firmicutes と Bacteroidetes の比率を回復させることも示されました。 高尿酸血症マウスモデルにおいて、L. plantarum SQ001は肝臓の尿酸合成タンパク質ホスホリボシルピロリン酸合成酵素(PRPS)、キサンチンオキシダーゼ(XO)、および腎臓の尿酸再吸収タンパク質グルコーストランスポーター 9(GLUT9)の発現を減少させ、腎臓の尿酸排泄タンパク質ATP 結合カセットトランスポーター G2(ABCG2)の発現を増加させました。健康な体では、尿酸レベルはその産生と排泄の微妙なバランスによって調節されています。尿酸の過剰産生または不十分な排泄は高尿酸血症の発症につながる可能性があります(Li et al.、2023b)。酵素ホスホリボシルピロリン酸合成酵素(PRPS)とキサンチンオキシダーゼ(XO)は尿酸合成に不可欠であり、その産生を触媒します。グルコーストランスポーター 9(GLUT9)は腎近位尿細管の頂端刷子縁膜(尿側)に位置し、尿酸再吸収トランスポーターとして機能します。逆に、ATP 結合カセットトランスポーター G2(ABCG2)は主に腎臓の近位尿細管細胞の基底外側(血液側)膜に存在し、尿細管からの尿酸の排泄を促進します。グルコーストランスポーター 9(GLUT9)発現のダウンレギュレーションとATP 結合カセットトランスポーター G2(ABCG2)発現のアップレギュレーションにより 尿酸排泄が増加し、血清中の 尿酸蓄積が減少します(Dalbeth et al.、2021)。 |
| この研究では、L. plantarum SQ001 は血清中の炎症誘発性サイトカイン IL-1β の発現をさらに低下させました。一方、高尿酸血症ガチョウの肝臓と腎臓の炎症は緩和されました。しかし、L. plantarum SQ001 が炎症を緩和するメカニズムは解明されていません。研究では、L. plantarum は短鎖脂肪酸 (SCFA) の産生と短鎖脂肪酸(SCFA) 産生有益細菌の豊富さを促進することで炎症を緩和できることが示されています (Chien et al., 2022; Wei et al., 2021)。Butyricicoccus と B. pullicaecorum は、酪酸産生を改善することで腸のバリア機能を強化し、炎症を抑制することが報告されており、その根本的なメカニズムの可能性が示唆されています (Marteau, 2013; Devriese et al., 2017)。 L. plantarum SQ001 は、腸内の Lactobacillus、L. plantarum、Butyricicoccus、および B. pullicaecorum の存在量を高め、腸絨毛の形態を改善し、腸バリアを回復させることが観察されました。R.torques グループは、胃腸障害の発症と関連付けられており、クローン病および炎症性腸疾患の患者ではその存在量が有意に増加していました (Joossens et al., 2010; Henke et al., 2019)。R. gauvreauil グループは、腸内微生物の存在量が少ないことと関連しており、アテローム性動脈硬化性心血管疾患の患者ではその存在量が多くなっています (Henke et al., 2019)。ただし、R.torques グループ、R. gauvreauil グループと 高尿酸血症の発症との因果関係を示す証拠は不十分です。我々の結果は、L. plantarum SQ001 が 高カルシウム・高タンパク質食による R.torque および R.gauvreauil グループの存在量の増加を逆転させることを示唆した。さらに、高尿酸血症マウス モデルでは、L. plantarumSQ001 は Lactobacillaceae、Lactobacillus、L. murinus、および L. reuteri の存在量を増加させ、Staphylococcus および S. xylosus の存在量を減少させた。S. xylosus は皮膚の常在病原体であり、皮膚炎の原因物質の 1 つであるが、腸内での S. xylosus の役割は不明である (Kim ら、2017)。この結果はまた、Lactobacillus、特に L. plantarum この研究では、L. plantarum SQ001 は血清中の炎症誘発性サイトカイン IL-1β の発現をさらに低下させました。一方、高尿酸血症ガチョウの肝臓と腎臓の炎症は緩和されました。しかし、L. plantarum SQ001 が炎症を緩和するメカニズムは解明されていません。研究では、L. plantarum は短鎖脂肪酸 (SCFA) の産生と短鎖脂肪酸(SCFA) 産生有益細菌の豊富さを促進することで炎症を緩和できることが示されています (Chien et al., 2022; Wei et al., 2021)。Butyricicoccus と B. pullicaecorum は、酪酸産生を改善することで腸のバリア機能を強化し、炎症を抑制することが報告されており、その根本的なメカニズムの可能性が示唆されています (Marteau, 2013; Devriese et al., 2017)。 L. plantarum SQ001 は、腸内の Lactobacillus、L. plantarum、Butyricicoccus、および B. pullicaecorum の存在量を高め、腸絨毛の形態を改善し、腸バリアを回復させることが観察されました。R.torques グループは、胃腸障害の発症と関連付けられており、クローン病および炎症性腸疾患の患者ではその存在量が有意に増加していました (Joossens et al., 2010; Henke et al., 2019)。R. gauvreauil グループは、腸内微生物の存在量が少ないことと関連しており、アテローム性動脈硬化性心血管疾患の患者ではその存在量が多くなっています (Henke et al., 2019)。ただし、R.torques グループ、R. gauvreauil グループと 高尿酸血症の発症との因果関係を示す証拠は不十分です。我々の結果は、L. plantarum SQ001 が 高カルシウム・高タンパク質食による R.torque および R.gauvreauil グループの存在量の増加を逆転させることを示唆した。さらに、高尿酸血症マウス モデルでは、L. plantarum SQ001 は Lactobacillaceae、Lactobacillus、L. murinus、および L. reuteri の存在量を増加させ、Staphylococcus および S. xylosus の存在量を減少させた。S. xylosus は皮膚の常在病原体であり、皮膚炎の原因物質の 1 つであるが、腸内での S. xylosus の役割は不明である (Kim ら、2017)。この結果はまた、Lactobacillus、特に L. plantarum と血清 インドール-3-カルボン酸(ICA)レベルの間に強力な正の相関関係があることを示した。研究では、毒素がシトクロムP450 2E1(CYP2E1)などの酵素によって代謝され、反応性種に変換され、酸化損傷と肝不全を引き起こすことが実証されています。インドール-3-カルボン酸(ICA)はCYP2E1に結合して不活性化し、有害な反応中間体の形成を阻害し、肝細胞への酸化損傷を軽減します(Li et al., 2024)。さらに、L. gallinarum由来のインドール-3-カルボン酸(ICA)は、CD4 + Tregの分化を阻害し、CD8 + T細胞の機能を強化することで大腸がんを抑制しました(Fong et al., 2023)。ただし、高尿酸血症におけるインドール-3-カルボン酸(ICA)の緩和効果とメカニズムについては、さらなる検証が必要です。結論として、L. plantarum SQ001は腸内細菌叢障害を改善し、有益な細菌の量を増やし、高尿酸血症を緩和しました。驚くべきことに、スピアマン相関分析により、血清代謝物と腸内細菌に関して、イノシンとLactobacilluおよびL. plantarumの間に有意な負の相関関係があることが明らかになりました。LactobacilluおよびL. plantarumはイノシンを加水分解することで作用する可能性があります。と血清 インドール-3-カルボン酸(ICA)レベルの間に強力な正の相関関係があることを示した。研究では、毒素がシトクロムP450 2E1(CYP2E1)などの酵素によって代謝され、反応性種に変換され、酸化損傷と肝不全を引き起こすことが実証されています。インドール-3-カルボン酸(ICA)はCYP2E1に結合して不活性化し、有害な反応中間体の形成を阻害し、肝細胞への酸化損傷を軽減します(Li et al., 2024)。さらに、L. gallinarum由来のインドール-3-カルボン酸(ICA)は、CD4 + Tregの分化を阻害し、CD8 + T細胞の機能を強化することで大腸がんを抑制しました(Fong et al., 2023)。ただし、高尿酸血症におけるインドール-3-カルボン酸(ICA)の緩和効果とメカニズムについては、さらなる検証が必要です。結論として、L. plantarum SQ001は腸内細菌叢障害を改善し、有益な細菌の量を増やし、高尿酸血症を緩和しました。驚くべきことに、スピアマン相関分析により、血清代謝物と腸内細菌に関して、イノシンとLactobacilluおよびL. plantarumの間に有意な負の相関関係があることが明らかになりました。LactobacilluおよびL. plantarumはイノシンを加水分解することで作用する可能性があります。 |
| これまでの研究では、一部の乳酸菌が高尿酸血症を軽減できることが示されています。中国のスラリー水から分離された株Limosilactobacillus fermentum JL-3は、尿酸を分解して高尿酸血症を軽減しましたが、尿酸を低下させる具体的なメカニズムは解明されていません(Cao et al., 2022b)。尿酸を加水分解する以外に、さまざまな供給源の乳酸菌は、ヌクレオシドを加水分解することで血清中の尿酸レベルを低下させることができます。たとえば、中国のザワークラウトから分離されたLactobacillus paracasei X11とL. plantarum DM9218-A、および中国のマスタードから分離されたL. plantarum GKM3は、この能力を示しています(Li et al., 2014; Hsu et al., 2019; Li et al., 2023a; Li et al., 2023b)。しかし、これらのLactobacillu属菌がヌクレオシドを分解するメカニズムはまだ完全には解明されていません。最近の研究では、中国のザワークラウト由来のL. plantarumと鶏の盲腸内容物由来のLactobacillus aviariusがヌクレオシドを分解できることが示されており、遺伝子クローニングと組み換えによりリボヌクレオシド加水分解酵素RihA-Cとヌクレオシド加水分解酵素Nhy69を得ることで、考えられる分解メカニズムが解明されました(Li et al., 2023a; Li et al., 2023b)。これらの研究では細菌における分解機能の検証が調査されているものの、株における重要な遺伝子の欠損に関する機能検証は解明されていません。さらに、高尿酸血症緩和特性を持つ宿主由来および再利用の乳酸菌株の調査は未だ行われていないが、これらの特定の乳酸菌株は、高尿酸血症に罹患した宿主内で拮抗作用を示すことが多い。我々の結果は、L. plantarum SQ001 が 4 つのヌクレオシド加水分解関連酵素 (iunH、yxjA、rihA、および rihC) を含むことを示し、ヌクレオシド加水分解酵素 iunH がヌクレオシド (イノシンおよびグアノシン) の分解に関与していることを示唆した。メタボロミクスは、このアッセイでヌクレオシドが効率的に核酸塩基に変換されたことを示した。核酸塩基輸送と宿主の尿酸値との直接的な関連はまだ確立されていないが、腸管上皮細胞における核酸塩基輸送タンパク質の不在は、それらの取り込みおよび尿酸産生の代謝を減少させ、宿主血清尿酸を減少させるために必要である可能性がある。さらに、細胞内外のエクトヌクレオシドレベルの変化は、yxjAなどのヌクレオシドトランスポーター関連酵素の役割を明らかにする可能性がありますが、さらなる検証が必要です。メタボロミクスは、ヌクレオシドとの共培養後にリノレン酸とプロリンの増加を示しました。研究では、リノレン酸が豊富な食品の摂取は痛風再発のリスクの低下に関連しており、α-リノレン酸は腎臓で尿酸を再吸収するURAT1タンパク質を阻害することが示唆されています(Zhang et al.、2019b; Saito et al.、2020)。さらに、微生物由来のプロリンは腸と腎臓での尿酸排泄を促進し、高尿酸血症の緩和に役立ちます(Fu et al.、2024)。 |
| 結論として、本研究では高尿酸血症ガチョウとマウスの腸内細菌の変化を調査し、宿主由来のL. plantarum株におけるヌクレオシド加水分解機能を持つ重要な遺伝子を発見し、最終的にin vitroおよびin vivo実験でプリンヌクレオシド加水分解機能を実証しました。この研究は、高尿酸血症代謝への洞察に貢献し、宿主由来の腸内細菌を介した高尿酸血症または痛風治療のための新しい戦略を提供することが期待されます。 |
| 4.材料と方法 |
| 主要リソース テーブル |
 |
 |
| 4.1.動物管理 |
| 実験手順は、以前に概説したものと同一です (Fu et al., 2024)。健康な生後 1 日の雄ガチョウは Shixing (中国広東省) から入手しました。これらのガチョウはステンレス製のケージに 5 羽ずつ入れて飼育し、餌と水を無制限に摂取できるようにしました。環境は慎重に管理され、最初は 33 ± 1°C の温度で、その後 26°C で安定するまで毎週 2.5 ± 0.5°C ずつ下げていきました。相対湿度は 45% から 60% に維持されました。 |
| 4.2.高尿酸血症モデリング処理 |
| 実験手順は、以前に説明した方法論に準拠しました (Fu et al., 2024)。1 日齢の雄ガチョウ 80 羽を、コントロールグループ (CON) と 高尿酸血症グループの 2 つのグループにランダムに割り当てました。1 日目から 28 日目まで、食事の配合と栄養レベルは、以前の発表 (Fu et al., 2024) に従いました。コントロールグループには標準食を与え、高尿酸血症グループには 高カルシウム・高タンパク質食を与えました。 |
| 4.3.高尿酸血症ガチョウモデルにおけるL. plantarum SQ001および代謝物を含むL. plantarum SQ001の経口投与治療 |
| 実験手順は、以前に説明した方法論 (Fu et al., 2024) に準拠しました。1 日齢の雄ガチョウ 120 羽を選択し、コントロールグループ (A) と 高尿酸血症グループ (B) の 2 つのグループに割り当てました。14 日間の 高尿酸血症モデリング治療後、高尿酸血症グループはさらに 3 つのサブグループ (B、C、および D) に割り当てられました。14 日目から 28 日目まで、A と B はリン酸緩衝生理食塩水 (PBS) を投与され、C はリン酸緩衝生理食塩水に再懸濁したL. plantarum SQ001細菌を投与され、D は代謝物を含むL. plantarum SQ001 (濃度 > 1 × 1010 CFU のL. plantarum SQ001を含む) を投与されました。すべてのグループの各反復から 1 羽のガチョウが 28 日目に分析のために屠殺されました。 |
| 4.4.マウスの腹腔内注射と経口投与 |
| 実験手順は、以前に説明した方法論に準拠しました (Li et al., 2023b)。5 週齢の雄の昆明マウス (25 ± 2 g) 32 匹を、中国広東省の広東省医学実験動物センターから入手し、華南農業大学実験動物センターの SPF (特定病原体フリー) 施設で飼育しました。マウスはステンレス製のケージで飼育され、各ケージには最大 4 匹のマウスが収容され、滅菌された餌と水が自由に与えられました。環境は 25 ± 1°C の一定温度に保たれ、12 時間の明暗サイクルでした。マウスが環境に適応できるように、5 日間の順応期間が設けられました。すべてのマウスは、研究期間中、一貫した維持食を与えられました。32 匹のマウスは、体重に基づいて 4 つのグループに分けられました。モデル群 (高尿酸血症) には、5% カルボキシメチルセルロースナトリウム溶液に溶解したヒポキサンチン (100 mg/kg) を経口投与し、オキソン酸カリウム (300 mg/kg) を腹腔内に毎日投与しました。経口投与グループには、モデリング治療に加えて、毎日 39 mg/ml アロプリノール (アロプリノールグループ) または新鮮な細菌溶液 0.2 ml (L. plantarum SQ001グループ、1 × 1010 CFU/ml) を投与しました。コントロールグループ (CON) には同量のカルボキシメチルセルロースナトリウムを投与し、コントロールグループとモデルグループの両方にリン酸緩衝生理食塩水を経口投与しました。実験は 19 日間にわたって行われ、最終日にノギスを使用して膝関節の厚さを測定しました。倫理ガイドラインに従い、すべてのマウスは CO2 過剰投与とそれに続く頸椎脱臼によって人道的に安楽死させられました。 |
| 4.5.サンプル収集 |
| 実験手順は、以前に記載されたものと同じ方法論に従いました (Fu et al., 2024)。各個体から血液サンプルを収集し、血清を遠心分離 (1200 × g、10 分、4°C) で分離し、分析のために -30°C で保存しました。心臓、肝臓、腎臓、脾臓、胸腺、膵臓、ファブリキウス嚢、筋性胃、腺性胃全体を収集し、重量を測定しました。十二指腸、空腸、回腸、盲腸の長さを測定しました。肝臓、腎臓、空腸 (約 1~2 cm) は、リン酸緩衝生理食塩水で洗浄した後に採取しました。盲腸と結腸糜粥を収集し、さらに分析するまで-80°C で保存しました。動物の体重は、治療期間中、定期的に監視しました。 |
| 4.6生化学パラメータの分析 |
| 実験手順は、以前説明したものと同じ方法論に準拠しました (Fu et al., 2024)。血清尿酸、キサンチンオキシダーゼ (XOD)、血中尿素窒素 (BUN)、クレアチニン、カルシウム、リン (P) は生化学キットで測定しました。キットはすべて Jiancheng (Nanjing, China) から購入しました。IL-1β、TNF-α、IFN-γ レベルは、製造元のプロトコルに従って、酵素結合免疫吸着測定 (ELISA) キット (Meimian Industrial、Jiangsu, China) で測定しました。 |
| 4.7.ウェスタンブロット分析 |
| 総タンパク質は、プロテアーゼおよびホスファターゼ阻害剤を添加したRIPA(Sigma-Aldrich)緩衝液で抽出し、BCAアッセイキット(Thermo Fisher Scientific、USA)でタンパク質濃度を測定した。等量のタンパク質(20μg)を10%ドデシル硫酸ナトリウム-ポリアクリルアミドゲルで電気泳動し、分離したタンパク質をポリフッ化ビニリデン(PVDF)膜(Amersham International、GE Healthcare)に転写した。膜は、3%ウシ血清アルブミン(BSA)を含むTween添加トリス緩衝生理食塩水(TBST)で室温で1時間ブロックし、その後、一次抗体(補足ファイル1)で4℃で一晩ブロックした。TBSTで数回洗浄した後、膜を3%3%ウシ血清アルブミンを含むTween添加トリス緩衝生理食塩水で二次抗体とともに室温で1時間インキュベートした。その後、膜をECLウェスタンブロッティング基質(Amersham International、GE Healthcare、Chicago, IL, USA)で処理し、化学発光検出システム(Bio-Rad Laboratories、Hercules, CA, USA)を使用して画像化しました。バンドの強度はImageJソフトウェアを使用して定量化しました。 |
| 4.8.16S rRNA シーケンシング |
| 実験手順は、以前説明したものと同じ方法論に従いました (Fu et al., 2024)。盲腸内容物からの微生物ゲノム DNA は、Majorbio (Shanghai, China) の標準プロトコルに従って 16S rRNA 遺伝子シーケンシングを受けました。アンプリコン シーケンス バリアントを分類するために、SILVA データベースが使用されました。各サンプルのアルファ多様性を評価し、細菌の存在量と均一性を判定しました。グループ間の腸内微生物群集構造の違いは、Unifrac ベースの加重 PCoA を使用して分析され、グループ間の統計的差異は ANOSIM 分析で評価されました。統計的に有意な差異を持つ細菌種を特定するために、ノンパラメトリック因子 Kruskal–Wallis 検定と順位検定が使用されました。その後、LEfSe 分析の LDA スコアを使用して、これらの差異に対する種の豊富さの影響を推定しました。細菌種と血清メタボロミクス間の相関係数は、Spearman 相関分析を使用して計算されました。 16S rRNA データによって予測された機能経路は、PICRUSt ソフトウェアを使用して示されました。 |
| 4.9.株と培地 |
| 実験手順は、以前説明したものと同じ方法論に従いました (Fu et al., 2024)。L. plantarum 株 SQ001 (CGMCC NO 24791) と標準 E. coli 株は、水鳥栄養研究所 (South China Agricultural University, Guangdong, China) から入手しました。LB (Luria-Bertani) および MRS (deMan Rogosa Sharpe) 培地は、Huankai (Guangdong, China) から入手しました。盲腸糜粥を採取した後、懸濁液をクリーンベンチで 9 段階の希釈度で培養しました。次に、単一コロニーを採取し、液体培地で培養した後、16S rRNA 配列決定のために DNA を抽出し、NCBI 比較により株を同定しました。E. coli は LB 液体培地で培養し、L. plantarum は MRS 液体培地で培養し、どちらも 37°C で 12 時間培養しました。 5% の接種量 (vol/vol) を導入し、3 世代連続して培養しました。その後、10% の接種量 (vol/vol) を培地に移し、さらなる実験を行いました。 |
4.10.尿酸分解速度の測定 |
| 実験手順は、以前説明したものと同じ方法論に従いました (Fu et al., 2024)。尿酸溶液は、40 mg の 尿酸 (0.4 g/l) を 100 mL の K3PO4 溶液 (10 mmol/l、pH 7.0) に溶解して調製しました。標準曲線 (0.4、0.2、0.1、0.05、および 0.025 g/l、濃度 -ピーク面積) は、外部標準法を使用して生成されました。次に、20 時間細菌培養液 2 ml を遠心分離しました (n = 3、6000 × g、4°C、10 分)。ペレットは、1 ml の滅菌リン酸緩衝生理食塩水で 2 回洗浄した後、750 μl の 尿酸溶液に再懸濁しました。この混合物を24時間(n = 3、37°C、120 r/min)インキュベートした。 |
| 4.11.ヌクレオシド分解速度の測定 |
| 実験手順は、以前に記載されたものと同じ方法論に従いました (Fu et al., 2024)。ヌクレオシド溶液は、イノシン 20 mg (0.2 g/l) とグアノシン 20 mg (0.2 g/l) を K3PO4 溶液 (10 mmol/l、pH 7.0) 100 ml に溶解して調製しました。外部標準法を使用して、標準曲線 (0.2、0.1、0.05、0.025、および 0.0125 g/l、濃度 - ピーク面積) を作成しました。その後、20 時間培養した細菌培養液 2 ml を遠心分離しました (n = 3、6000 × g、4°C、10 分)。ペレットを1mlの滅菌リン酸緩衝生理食塩水で2回洗浄した後、750μlのヌクレオシド溶液に再懸濁し、1、3、6時間(n = 3、37°C、120 r/min)インキュベートした。 |
| 4.12.高速液体クロマトグラフィーによる測定 |
| 実験手順は、以前に記載されたものと同じ方法論に従いました (Fu et al., 2024)。溶液を遠心分離しました (4000 × g、4°C、10 分)。次に、上清 720 μl を 80 μl の HClO4 (9:1、0.1 mol/l) と混合しました。膜 (0.22 μm) で濾過した後、混合物 20 μl を高速液体クロマトグラフィー (HPLC) システムに注入しました。高速液体クロマトグラフィーでは、C18 逆相カラム (spursil EP、250 mm × 4.6 mm、5 μm) を使用しました。移動相は、1% メタノールを含む 20 mmol/l リン酸二水素カリウム溶液 (pH 3.0) でした。流量は 1 ml/分に設定し、カラム温度は 25°C に維持しました。検出波長は254 nm、溶出時間は30分であった。 |
| 4.13.異種発現および遺伝子ノックアウト |
| オリゴヌクレオチドプライマーは DynaScience (Qingdao, China) によって合成され、シーケンシングサービスは Huada (Shenzhen, China) によって提供されました。異種発現プラスミド p15A-cm-Pgenta-iunH および遺伝子ノックアウトプラスミド p15A-cm-HA-G-iunH-erm-sacB は、以前に説明したように準備されました (Fu et al., 2024)。この研究で使用したすべての株、プラスミド、変異体、およびプライマーの詳細は、補足ファイル 1 に記載されています。 |
| 4.14.非標的メタボロミクス分析 |
| 実験手順は、以前説明したものと同じ方法論に準拠しました (Fu et al., 2024)。代謝物は、メタノール、アセトニトリル、水を 2:2:1 の比率で混合した抽出溶液 (総量 500 μl) を使用して抽出し、同位体標識内部標準混合物を組み込みました。得られた上清を LC-MS/MS 分析に使用しました。これらの分析は、UPLC BEH Amide カラム (2.1 mm × 100 mm、1.7 μm) と Q Exactive HFX 質量分析計 (Orbitrap MS、Thermo) を組み合わせた UHPLC システム (Vanquish、Thermo Fisher Scientific) を使用して実施しました。使用した移動相は、25 mmol/l 酢酸アンモニウムと 25 mmol/l 水酸化アンモニウム溶液 (pH 9.75、A) およびアセトニトリル (B) でした。 QE HFX 質量分析計は、Xcalibur ソフトウェア (Thermo) によって管理される情報依存取得モードで動作しました。生データは ProteoWizard を使用して mzXML 形式に変換され、XCMS でピーク検出、抽出、アラインメント、統合のために分析されました。その後、代謝物の注釈付けは、カットオフ注釈しきい値 0.3 の MS2 データベース (Biotree、Shanghai, China) を使用して実行されました。 |
| 4.15.統計分析 |
| 特に指定がない限り、すべてのデータは平均値±平均値の標準誤差として提示されます。統計分析は SAS 9.2 (SAS Inst. Inc、Cary, NC) を使用して実施しました。2 つのグループ間の比較は、対応のない Student t 検定または Mann–Whitney U 検定を使用して実施し、2 つ以上のグループ間の比較には Bonferroni の多重比較検定による一元配置分散分析を使用しました。図中の p 値は、次のように示されています: 有意ではない [ns]、p < 0.05、*、p < 0.05、**、p < 0.01、***、p < 0.001、****、p < 0.0001。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、eLife. 2024 Nov 7;13:e100068.に掲載されたHost-derived Lactobacillus plantarum alleviates hyperuricemia by improving gut microbial community and hydrolase-mediated degradation of purine nucleosides. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


