ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
皮膚の健康および関連する腸-皮膚軸におけるプロバイオティクスの役割: レビュー |
Ting Gao, Xiaoyu Wang, Yixuan Li, and Fazheng Ren |
|
|
| 要約 |
皮膚の老化、しわ、色素沈着、乾燥は人々を悩ませる問題であり、研究者たちはそれらの解決に取り組んでいます。 最近の研究では、腸内細菌叢の恒常性が皮膚の健康に影響を与える可能性があることが示されており、腸-皮膚軸の存在が実証されています。 最近、プロバイオティクスの介入を通じて皮膚の健康を改善することが提案され、マイクロエコロジースキンケアが一般的な概念になりつつあります。 プロバイオティクスは、皮膚の健康と腸-皮膚軸の相互作用を調節することで、酸化ストレスの軽減、炎症反応の抑制、免疫効果の維持など、さまざまな方法で皮膚疾患を抑制および改善するための潜在的な管理ツールとして使用できます。 この論文の目的は、スキンケアにおけるプロバイオティクスを介した腸内細菌叢の恒常性の応用とメカニズムを包括的にレビューし、スキンケアにおけるプロバイオティクスの応用に対する理論的基礎を提供することです。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. プロバイオティクスの皮膚に対するさまざまな効果 |
| 2.1. 肌の白化 |
| 2.2. 肌の保湿 |
| 2.3. 皮膚バリアの完全性 |
| 2.4. 老化防止 |
| 2.4.1. 経年老化防止 |
| 2.4.2. 光老化防止 |
| 2.5. 抗しわ |
| 3. 腸-皮膚軸の提示 |
| 3.1. プロバイオティクスによる腸の恒常性の改善 |
| 3.1.1. バリア機能の強化 |
| 3.1.2. 病原菌の抑制 |
| 3.2. 皮膚の状態を調節するプロバイオティクスを介した腸内細菌叢の経路 |
| 3.2.1. 免疫経路 |
| 3.2.2. 代謝物経路 |
| 3.2.3. 神経内分泌経路 |
| 4. プロバイオティクス - 腸内細菌叢を媒介して皮膚疾患を改善する |
| 4.1. ニキビ |
| 4.2. アトピー性皮膚炎 |
| 4.3. 乾癬 |
| 4.4. 脂漏性皮膚炎 |
| 4.5. 酒さ様皮膚炎 |
| 5. 皮膚の生理機能を調節するプロバイオティクス |
| 5.1. Nitrobacter |
| 5.2. Lactobacillus |
| 5.3. Bifidobacterium |
| 6. 腸-皮膚軸によるプロバイオティクスを介した皮膚状態の調節の潜在的なメカニズム |
| 6.1. 酸化ストレスレベルの低下 |
| 6.2. 炎症反応の抑制 |
| 6.3. 免疫恒常性の維持 |
| 6.4. 細胞外マトリックス改造抑制 |
| 7. 結論 |
本文 |
| 1.はじめに |
| 皮膚は成人の総体重の約 15% を占め、平均表面積は 1.5 ~ 2 m2 です [1]。 皮膚の主な機能の 1 つは、病気の原因となる微生物や有害物質に対する機械的バリアとしての役割です。 実際、これは自然免疫系および適応免疫系と同様に、感染に対する宿主の重要な防御の 1 つとみなすことができます [2]。 その他の重要な特徴には、経皮的水分損失 (TEWL) の抑制、体温調節、構造的サポート、ビタミン合成などが含まれ、これらはすべて健康な宿主の維持に役立ちます [2,3,4]。 |
| 美への探求に終わりはありません。 皮膚の色素沈着、しわ、皮膚の老化、皮膚の脱水などの皮膚の問題が、外部要因によるものなのか内部の変化によるものなのかを知るのは難しいことがよくあります。 皮膚の問題にはさまざまな原因があり、研究者は皮膚の問題に対処するための安全で効率的な皮膚治療製品を継続的に研究しています。 現在、さまざまな化粧品には二酸化チタンなどの化学物質が含まれており、多かれ少なかれ毒性があり、個人の健康に害を及ぼす可能性があります[5]。 漢方薬から抽出した原料を皮膚治療薬の重要な成分として使用する研究者もさまざまです。 ハーブ成分の複雑さにより一定の結果は得られますが、その影響は期待に応えられない場合があり、その品質は依然として改善の必要があります[6,7]。 したがって、皮膚の問題に効果的に対処できる皮膚治療製品の安全で効率的な成分を探索することが緊急に必要とされています。 最近、研究者らは、プロバイオティクスを化粧品の有効成分として使用して、上記の皮膚の問題により良い効果をもたらすことができると示唆しています。 さらに、実験研究では、プロバイオティクスは宿主に対して毒性の影響をまったく及ぼさないか、ほとんど及ぼさず、皮膚治療薬の開発に有効に使用できることが示されています。 |
| 最近、多くの分野でプロバイオティクスの強力な効果がますます認識されるようになり、スキンケアにおけるプロバイオティクスの効果について研究者によって研究され、議論されることが増えています。 プロバイオティクスはさまざまなメカニズムを通じて作用します (図 1)。 |
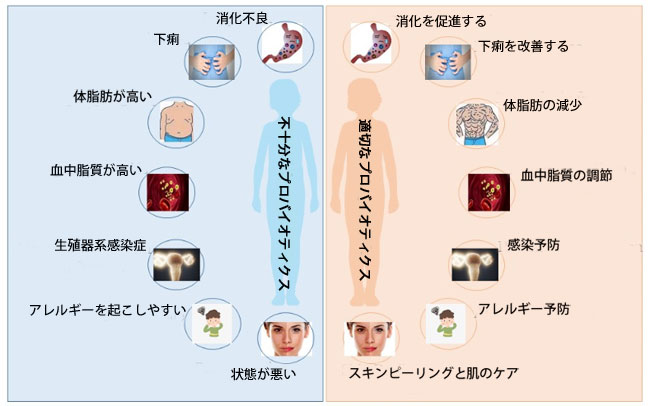 |
| 図 1 プロバイオティクスの生体に対する有益な効果 |
| 生体内のプロバイオティクスの量が不十分な場合、生体は次の問題に悩まされます:消化不良、下痢、高体脂肪、高血中脂質、生殖器系感染症、アレルギー傾向、皮膚状態不良(左の写真)。生体内のプロバイオティクスが十分に存在する場合、生体は次のように作用します: 消化の促進、下痢の改善、体脂肪の低下、血中脂質の調節、生殖器系感染症の予防、アレルギーの予防、皮膚の剥離とスキンケア (右の写真)。 |
| この論文では、美白、肌の保湿、肌の老化防止、しわ防止、体臭の除去などのスキンケアにおけるプロバイオティクスの応用とそのメカニズムを概説します。 これは、将来のスキンケアにおけるプロバイオティクスのさらなる応用のための理論的根拠を提供します。 |
| 外用生物学的療法の応用は、Lactobacillus bulgaricus の外用使用がニキビや脂漏などの皮膚問題を改善した1912年に遡りますが、スキンケア業界では最近、微生物を含む外用製剤の急増を目の当たりにしています[8]。 表 1 は、世界中で販売されているプロバイオティクスを含むスキンケア製品のリストです。 |
| 表1 プロバイオティクスを添加したスキンケア製品とその効果 |
 |
 |
| しかし、外用プロバイオティクスにはまだ解決されていない多くの問題があります。 社外品は無菌状態で製造できないため、無菌試験は必要ありません。 これらのメーカーには通常、微生物の増殖を制御する防腐剤が含まれています。 これらの防腐剤はプロバイオティクス株の生存率に影響を与え、受容体の微生物叢を誤って変化させる可能性もあります[8]。 プロバイオティクスを含む外用製剤はまだパーソナルケア製品のカテゴリーの外に出ていません。 コロニー形成単位の高負荷を評価するため、そのような製剤は微生物叢負荷に関する米国食品医薬品局 (USFDA) の調節規定を通過することが困難です。 防腐効果試験は、これらの用途を測定する上で重要な障壁となります。 米国薬局方 (USP) によると、ニキビ治療用の外用プロバイオティクス製剤の微生物叢数が検査されました。 研究によると、外用用製品には「望ましくない」量の生きた微生物が含まれていないため、米国薬局方によれば、1000 コロニー形成単位 (CFU) 未満は必要ありません[9]。 一方、角質層は皮膚の厳密な自然保護バリア機能を維持し、皮膚の深層への有効な物質の吸収を調節するため、治療法の選択も制限されます[10]。 生きた微生物を含む外用適用のための調製要件は、微生物の安定性を維持する必要から生じるより小さな分子のみを含む製品の調製要件とは大きく異なります。 微生物制御に必要な重要な要素は、保管環境の温度と湿度レベルだけでなく、pH と浸透圧濃度です [11]。 |
| 外用プロバイオティクスは、20 世紀初頭から皮膚の健康を維持するために使用されており、過去 10 年間で市販の外用プロバイオティクスが劇的に増加しました [12]。 これらの外用製品の人気が高まり、その臨床効果を確立するための臨床試験や有効性研究が不足しているため、我々は皮膚疾患の治療における体内プロバイオティクスに徐々に焦点を当てています。 体内のプロバイオティクスは最初に腸管に入り、腸の恒常性に影響を与えることで必然的に皮膚の状態に干渉するため、この記事では、適切な皮膚介入を見つけるための潜在的な解決策と臨床的価値を提供することを目的として、プロバイオティクス、腸、皮膚の関係について詳しく説明します。 |
| 2. プロバイオティクスの皮膚に対するさまざまな効果 (図2) |
| 2.1. 肌の白化 |
| 最近、皮膚の美白に対する関心が高まっており、美白製品の焦点は、メラニン含有量を減少させ、過剰な色素沈着を抑制することにある[13]。 メラニンは光保護作用があり、紫外線 (UV) 放射から皮膚を保護しますが、色素沈着の過剰発現は肌の色調に影響を与え、そばかすや肝斑などのさまざまな皮膚疾患を引き起こす可能性さえあります [14、15、16]。 メラニン生成のプロセスには、さまざまな酵素と化学触媒反応が関与します [17、18]。 メラニン生成に関連する主要な酵素は、チロシナーゼ、チロシナーゼ関連タンパク質 1 (TYRP-1)、およびチロシナーゼ関連タンパク質 2 (TYRP-2) を含む 3 つであり、チロシナーゼは不可欠な主要酵素です [19]。 多くの美白化粧品はチロシナーゼ活性を的確に抑制することで、メラニン含有量を減少させ、美白効果を実現します。 最近、プロバイオティクスは美白製品にますます使用されていますが、これはチロシナーゼに対する大きな拮抗作用と密接に関係しています (図 2)。 |
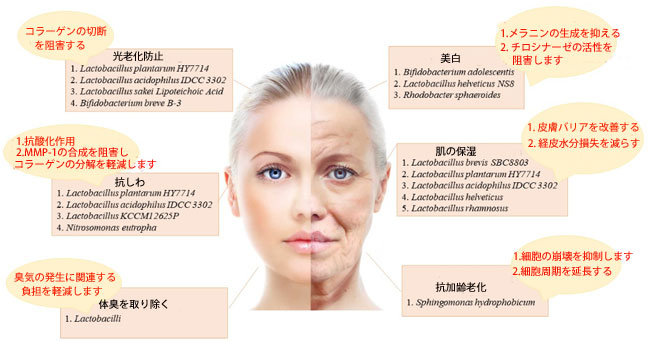 |
| 図2 プロバイオティクスの肌改善効果とそのメカニズム |
| プロバイオティクスの皮膚改善効果には次のようなものがあります。 抗光老化(コラーゲンの切断を阻害)、 皮膚の白化(メラニンの生成を阻害し、チロシナーゼ、チロシナーゼ関連タンパク質 1 およびチロシナーゼ関連タンパク質 2の活性を阻害)、 抗シワ(抗酸化作用とマトリックスメタロプロテイナーゼ-1(MMP-1)の合成を阻害してコラーゲンの分解を減らす)、 皮膚の保湿(皮膚バリアを改善し、経皮的水分損失を低下させます)、 体臭の除去(臭いの発生に関連する負担を軽減)、 抗慢性老化(細胞の崩壊を抑制し、細胞周期を延長します)。 |
| 研究では、キノコのチロシナーゼおよびチロシナーゼ活性に対するBifidobacterium adolescentis 培養濾液の拮抗的影響が含有量の増加とともに強化され、それによってB16F10細胞のメラニンレベルが低下することが示唆されました[20]。 これらの研究によると、Bifidobacterium adolescentis 培養濾液は、その抗酸化作用によりチロシナーゼ活性を調節し、それによってメラニン含有量を減少させ、美白の目的を達成することができた。 さらに、彼らは、Lactobacillus の乳酸がチロシナーゼ活性を下方制御することによってメラニン合成を直接抑制し、またチロシナーゼ発現またはチロシナーゼ、チロシナーゼ関連タンパク質-1 およびチロシナーゼ関連タンパク質 2に影響を与えて美白効果を発揮することによってメラニン合成を制御できることも明らかにした[21]。 |
| プロバイオティクスは、チロシナーゼ活性を調節するだけでなく、美白効果を達成するための他の手段によってもメラニン含有量を減少させることができます。 Jingjing Rong らは、プロバイオティクスは、チロシナーゼ活性を調節するだけでなく、美白効果を達成するための他の手段によってもメラニン含有量を減少させることができます。 Jingjing Rong らは、Lactobacillus helveticus NS8 発酵乳上清 (NS8-FS) の美白効果を示しました [22]。 データは、Lactobacillus helveticus NS8 発酵乳上清がチロシナーゼおよびチロシナーゼ発現に関連するタンパク質の活性を抑制することにより、B16F10細胞のメラニンレベルを減少させることを実証しました。 さらに、モルモットにおける紫外線誘発性色素沈着モデルが確立されました。 マッソン・フォンタナ染色およびチロシナーゼ染色試験により、Bifidobacterium adolescentis 培養濾液 が皮膚の色素沈着を改善することが確認されました。 Bifidobacterium adolescentis 培養濾液が皮膚の色素沈着を改善する潜在的なメカニズムは、UV 媒介酸化ストレス下でメラノサイトのメラニン生成を促進する Nrf2 活性の調節です [23]。 Liu らは、メラニン合成に対する Rhodobacter spheroides (Lysogen™) の阻害効果を調査しました [24]。 研究により、B16F10 細胞のメラニン含有量は、α-MSH 補給後に上方制御され、Lysogen™ 処理後に用量依存的に下方制御されることが実証されましたLactobacillus helveticus NS8 発酵乳上清 (NS8-FS) の美白効果を示しました [22]。 データは、Lactobacillus helveticus NS8 発酵乳上清がチロシナーゼおよびチロシナーゼ発現に関連するタンパク質の活性を抑制することにより、B16F10細胞のメラニンレベルを減少させることを実証しました。 さらに、モルモットにおける紫外線誘発性色素沈着モデルが確立されました。 マッソン・フォンタナ染色およびチロシナーゼ染色試験により、Bifidobacterium adolescentis 培養濾液 が皮膚の色素沈着を改善することが確認されました。 Bifidobacterium adolescentis 培養濾液が皮膚の色素沈着を改善する潜在的なメカニズムは、UV 媒介酸化ストレス下でメラノサイトのメラニン生成を促進する Nrf2 活性の調節です [23]。 Liu らは、メラニン合成に対する Rhodobacter spheroides (Lysogen™) の阻害効果を調査しました [24]。 研究により、B16F10 細胞のメラニン含有量は、α-MSH 補給後に上方制御され、Lysogen™ 処理後に用量依存的に下方制御されることが実証されました。 |
| 2.2. 肌の保湿 |
| 乾燥肌には、季節の変化、皮膚バリアの損傷、無秩序な剥離など、さまざまな理由があります[25]。 肌の潤いは健康と美容にとって重要であり、体の活動性や美しさを維持するのに重要な効果を発揮します。 したがって、私たちは肌の潤いを維持するために有益な分子を継続的に探索しています。 プロバイオティクスは経皮的水分損失を減少させ、皮膚の乾燥を改善することができ、乾燥肌の調節に使用できます。 さらに、プロバイオティクスは皮膚バリア機能を調節することで皮膚の水分損失を軽減し、優れた皮膚保湿剤でもあります [26]。 |
| 研究では、Lactobacillus plantarum HY7714 の経口摂取により、セリン パルミトイルトランスフェラーゼ (SPT) mRNA 発現が上昇し、セラミダーゼ mRNA 発現が減少することにより、セラミド レベルが増加することが確認されました [27]。 セラミドは、表皮バリアの構造的支持と表皮の水分補給に重要な効果を発揮します [28,29]。 セラミド含有量が増加すると、経皮的水分損失値が低下し、水分補給が上方制御されます。 研究ではELISAを使用してヒアルロン酸(HA)含有量を検出し、好酸性乳酸IDCC 3302の使用が皮膚の水分補給に有益な効果を発揮することが判明しました[30、31]。 結論として、Lactobacillus acidophilus IDCC 3302 の治療により、皮膚の乾燥が改善され、経皮的水分損失が減少し、それによって皮膚の水分補給が上方制御されました。 Hidoko BABA らは、Lactobacillus helveticus発酵乳ホエイ (LHMW) の投与により、無傷の皮膚の経皮的水分損失が明らかに減少し、皮膚の水分量が増加することを示し、Lactobacillus helveticus発酵乳ホエイミルクには保湿効果があり、化粧品に使用されていることが証明されました[32]。 |
| 2.3. 皮膚バリアの完全性 |
| 皮膚のバリア機能が損傷すると、皮膚表面の水分バランスが崩れ、皮膚に悪影響を及ぼす可能性があります[33]。 Ye-On Jungらは、Lactobacillus rhamnosus (LR)が皮膚バリアを効果的に改善でき、保湿スキンケア製品とみなせることを実験的に実証しました[34]。 彼らは、免疫蛍光染色を使用して、強く結合した2つの分子であるClaudin-1とOccludinの上方制御された発現レベルを特定し、Lactobacillus rhamnosus溶解物で処理した組織の角質層がより緊密でより組織化されていることを示しました。 さらに、qPCR の結果は、皮膚のバリア機能の回復に重要な影響を与えるロリクリンとフィラグリンの発現レベルの上昇を示唆しました [35]。 さらに、ドデシル硫酸ナトリウム(SLS)誘発性の細胞毒性を軽減し、皮膚透過性を低下させることにより、皮膚バリア機能の強化がさらに示唆されました。 |
| 2.4. 老化防止 |
| 経年老化と光老化は、皮膚老化の 2 つの主要な形態です [36]。 経年老化は主に内部要素の影響を受けるのに対し、光老化は主に外部要素の影響を受ける[37]。 これらの影響は異なりますが、同様の制御メカニズムを持っています。プロバイオティクスは両方の形態の皮膚老化に有益な効果をもたらします。 |
| 2.4.1. 経年老化防止 |
| 経年老化は主に遺伝的要素に関連しており、人体の定期的な生理学的プロセスです。 年齢を重ねると体も老化し、皮膚も老化し、薄くなって乾燥するのが特徴です[38]。 プロバイオティクスは、主に細胞の崩壊を抑制し、細胞周期を延長することによって老化防止を実現します。 Sandie Gervason らは、免疫組織学的実験を用いて、Sphingomonas hybridum (SH) を除外すると、P16 や P21 などの老化に関連するタンパク質の産生を抑制できることを示しました。 P16 および P21 は細胞周期アンタゴニストであり、細胞周期を抑制し、細胞の老化を引き起こします [39,40]。 実験グループにおける P16 および P21 の生産レベルは、Sphingomonas hybridum抽出物なしの対照グループと比較して明らかに下方制御されました。 Sphingomonas hybridum抽出物は、老化に関連する SA-β-ガラクトシダーゼ レベルを抑制し、細胞老化を改善することも実証されました。 さらに、フィブリリン-1 とバーシカンのレベルは、Sphingomonas hybridum抽出物の補給後に上方制御されました。 以前の研究では、フィブリリン-1が弾性皮膚線維の生成に関与していること[41]、上方制御されたVersicanレベルが線維芽細胞のアポトーシス反応を阻害できることが示され[42]、どちらも細胞の老化を遅らせる可能性がある。 Sphingomonas hybridum抽出物の場合、アンチエイジングスキンケア製品としてご使用いただけます。 |
| 2.4.2. 光老化防止 |
| 光老化は主に、紫外線や毒素などの外部環境要素の影響を受けます。 これらの外部要素は皮膚の損傷を誘発し、皮膚の弾力性を失い、水分を失い、厚くなり、荒れて鈍くなります[43]。 プロバイオティクスは、主にコラーゲンの分裂を抑制することによって光老化の治療に大きな影響を与えます。 |
| 研究では、Lactobacillus plantarum HY7714を摂取している患者は、表皮の水分損失が減少し、しわの深さが減少し、皮膚の光沢と弾力性が改善されたことが示されました[44]。 研究では、tyndallized(訳者注:チンダル化は加熱殺菌のこと)Lactobacillus acidophilus IDCC 3302 が、ウェスタンブロット分析による 紫外線照射後のコラーゲン発現の減少を回復できることが実証されました [45]。 一方、加熱殺菌Lactobacillus acidophilus IDCC 3302は、HaCaT中のマトリックスメタロプロテイナーゼ-1、マトリックスメタロプロテイナーゼ-2、およびマトリックスメタロプロテイナーゼ-9の含有量を明らかに減少させることができることが示された。 これらは、主にMAPK(訳者注:MAPK(Mitogen-activated Protein Kinase; MAP キナーゼ; 分裂促進因子活性化プロテインキナーゼ)は、代謝、増殖、分裂、運動、アポトーシスなど、細胞のさまざまな機能に関与するセリン/トレオニン・キナーゼ(Ser/Thr kinase)です)シグナル伝達経路を抑制することにより、紫外線への曝露により上方制御されました。 さらに、加熱殺菌Lactobacillus acidophilus IDCC 3302 は、IL-1β、IL-8、TNF-α などの炎症誘発性サイトカインのレベルを低下させることにより、炎症反応を改善できます。 上記のデータは、加熱殺菌Lactobacillus acidophilus IDCC 3302 が光老化を抑制し、紫外線照射によって誘発される炎症反応を改善できることを示しました。 Youらは、Lactobacillus Sakei リポテイコ酸(sLTA)が宿主が紫外線に曝露されたときにMAPKのリン酸化を抑制し、マトリックスメタロプロテイナーゼ-1合成をさらにブロックできる可能性があることを示唆しました[46]。 |
| 2.5. 抗しわ |
| しわは、皮膚の萎縮とその下の顔の筋肉の繰り返しの収縮によって引き起こされます[47]。 プロバイオティクスの使用は顔のしわを調節することが証明されています。 プロバイオティクスの抗酸化活性は、その抗シワ特性と密接に関連しています。 さらに、マトリックスメタロプロテイナーゼ-1合成は線維芽細胞によって生成されるコラーゲンの分解を活性化し、その結果人間の皮膚の表面にしわが生じます [48]。 プロバイオティクスはマトリックスメタロプロテイナーゼ-1合成を抑制し、コラーゲン分解を減少させ、その結果抗シワ特性をもたらす可能性があります。 |
| 研究者らは、加熱殺菌Lactobacillus KCCM12625P (AL) が マトリックスメタロプロテイナーゼ-1合成を抑制し、しわの形成を防ぐことができることを発見しました。 加熱殺菌Lactobacillus KCCM12625Pは、主に上記 2 つの側面を通じて顔のしわの形成を効果的に抑制し、抗しわとして作用します。 |
| Hyun Mee Kimらは、ウェスタンブロットにより、Lactobacillus plantarum HY7714が紫外線誘導マトリックスメタロプロテイナーゼ1に対して強力なブロック機能を有することを発見した[49]。 さらに、Lactobacillus plantarum HY7714はマトリックスメタロプロテイナーゼ-1の発現とマトリックスメタロプロテイナーゼ-2およびマトリックスメタロプロテイナーゼ-9の活性を阻害し、しわの面積と深さを効果的に改善し、しわの解消に重要な効果を発揮しました。 研究では、加熱殺菌Lactobacillus acidophilus IDCC 3302 が、ELISA で測定した 紫外線曝露された ケラチノサイト細胞中のマトリックスメタロプロテイナーゼ-1、マトリックスメタロプロテイナーゼ-2、および マトリックスメタロプロテイナーゼ-9含有量を効果的に減少させる可能性があることが示されました。 したがって、加熱殺菌Lactobacillus acidophilus IDCC 3302は、マトリックスメタロプロテイナーゼを抑制することによってしわを減少させる可能性がある。 |
| 3. 腸-皮膚軸の提示 |
| 腸の微生物叢は皮膚の微生物叢と似ています。 さまざまな研究により、皮膚の炎症状態と腸内細菌叢の障害が関連付けられています。 腸内細菌叢は体の免疫機能に影響を与えます。 免疫システムは外部の病原性細菌から身を守ります。 腸内細菌叢のバランスが崩れると、腸内細菌叢の変化により、腸だけでなく皮膚などの遠隔臓器でも自己免疫や炎症状態が引き起こされる可能性があります[50]。 腸内細菌叢の障害が、ニキビ[51,52]、アトピー性皮膚炎[53]、乾癬[54]、酒さ(訳者注:顔に赤みやほてりが生じる病気)[55]などの皮膚疾患の一因となる可能性があるという考えは、さまざまな研究で証明されています。 免疫系は皮膚と腸の間の接続を仲介しているようです。 微生物と宿主免疫系との相互作用は、皮膚の恒常性を維持するために重要である[56]。 したがって、皮膚と腸のバランスを保つことは、多くの皮膚疾患を治療するための論理的な方法です。 プロバイオティクスは微生物叢の改善に重要な効果を発揮し、炎症性皮膚疾患の治療に不可欠な治療法です[50]。 |
| 腸-皮膚軸は、腸内細菌叢の免疫特性が皮膚の健康にも影響を与える可能性があるという関係を示唆しています。 経口プロバイオティクスによる皮膚または腸内細菌叢の積極的な調節は、皮膚の光老化を防ぐ潜在的な臨床アプローチとみなされています。 経口プロバイオティクスは、腸内細菌を改変する一種の生きた微生物叢であり、免疫応答や炎症因子の調節を介して特殊な皮膚細胞に直接光防御作用を及ぼすことができます。 さらに、血清中の短鎖脂肪酸 (SCFA) 含有量を増加させることができ、これによりさまざまな免疫反応や炎症反応が誘発されます。 経口プロバイオティクスは、腸内細菌叢を直接改善して皮膚の光老化を抑制および治療する手段として研究されてきました。 さらに、経口プロバイオティクスは、皮膚微生物叢と腸-皮膚軸を調節することにより、アトピー性皮膚炎、ニキビ、酒さ、乾癬などの他の皮膚疾患の治療にも使用されています[57、58、59、60、61]。 このセクションでは、光老化における経口プロバイオティクスの効果とその関連メカニズムについて説明します。 |
| 3.1. プロバイオティクスによる腸の恒常性の改善 |
| 3.1.1. バリア機能の強化 |
| プロバイオティクスは、さまざまな潜在的なメカニズムを通じて腸管バリア機能不全を改善します。 これらのメカニズムには、ムチン型糖タンパク質 (MUC)1、ムチン型糖タンパク質(MUC)2、および ムチン型糖タンパク質(MUC)3 を含むムチンタンパク質の発現の上方制御が含まれており、これらは粘液内の細菌の移動を制限し、細胞増殖を防ぐための抗菌ペプチドおよび密着結合タンパク質(α-ディフェンシン、β-ディフェンシン、閉塞バンド(ZO)など)の分泌と発現の上方制御します[62]。 |
| 3.1.2. 病原菌の抑制 |
| プロバイオティクスは、病原性細菌または共生生物と競合してムチンまたは上皮細胞と結合し、潜在的な病原性細菌の過剰増殖を防ぎます。 さらに、プロバイオティクスは、病原性細菌の阻害または死滅に関連する抗菌ペプチド、短鎖脂肪酸、バクテリオシンなどの抗菌成分を提供します。 さらに、酪酸などの 短鎖脂肪酸は、オクルディンと 閉塞バンドの発現の調節に役立ち、どちらも上皮バリアの完全性の改善に関連しています [63]。 |
| プロバイオティクスはまた、宿主の胃腸 (GI) 管における IgA の産生を上方制御します。 分泌型 IgA は、病原性抗原または共生抗原の結紮を介して腸上皮を定着および/または浸潤から防御し、樹状細胞 (DC) への抗原の逆転写輸送を誘導し、炎症促進因子を減少させます [64]。 |
| 3.2. 皮膚の状態を調節するプロバイオティクスを介した腸内細菌叢の経路 (図 3) |
| 3.2.1. 免疫経路 |
| アトピー性皮膚炎(AD)に影響を与える最も一般的な細菌株であるStaphylococcus aureus(黄色ブドウ球菌)に対する免疫の観点からは、腸と皮膚との関連性が示されています。 Staphylococcus aureusは、アトピー性皮膚炎患者の皮膚に存在する最も一般的な病原性細菌です。 対照的に、新しい出生コホート研究では、他の皮膚株と同様に、Staphylococcus aureusに対する早期反応が乳児の免疫系の成熟を促進するため、Staphylococcus aureusの定着が乳児期のアトピー性皮膚炎の発症予防に極めて重要な効果を発揮することが示された。 粘膜上のStaphylococcus aureusは、免疫刺激を通じて保護的な役割を果たすことができます[65]。 この研究は、腸と皮膚が腸内細菌叢を通じて免疫環境を制御しているという推測を裏付けています (図 3)。 |
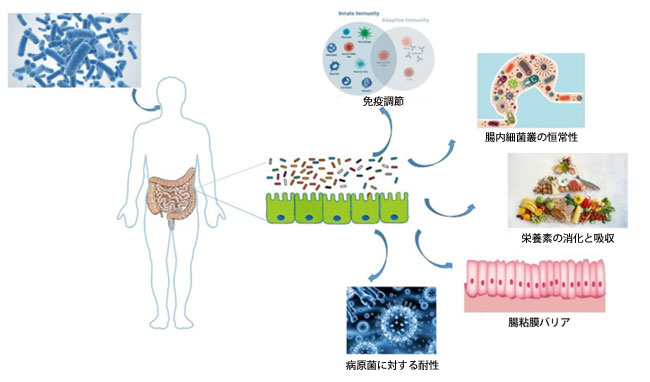 |
| 図3 経口プロバイオティクスは、微生物に対する腸の恒常性の有益な効果を仲介します |
| 宿主が経口経路でプロバイオティクスを摂取した後、プロバイオティクスは腸管に入り、主に免疫調節、腸内細菌叢の恒常性、栄養素の消化と吸収、腸粘膜バリアとして現れる腸の恒常性を改善する役割を果たします。 |
| Bacteroides fragilis、Facecalibacterium prausnitzii、Clostridiumグループ IV および XI に属する細菌種から分離されたレチノイン酸および多糖類A などの特定の腸内細菌叢とその代謝産物は、抗炎症反応を活性化する Treg およびリンパ球の蓄積を促進します。 さらに、一部の 短鎖脂肪酸、特に酪酸塩は、免疫細胞の活性化とアポトーシスを調節する可能性があります [66]。 |
| 腸内細菌叢は、プロバイオティクスを介した皮膚疾患の免疫経路に重要な寄与因子として研究されています。 経口投与されたプロバイオティクスは、免疫細胞の 70% 以上が存在する胃腸粘膜および腸管関連リンパ組織 (GALT) と相互作用する可能性があります [67]。 プロバイオティクスは、上皮細胞、粘膜 樹状細胞、およびマクロファージとさまざまな方法で相互作用します。 プロバイオティクス株に応じて、それらは、IL-12、IL-18、および TNF-α を産生することによって免疫活性化シグナル伝達を誘導するか、IL-10 や TGF-β などの抗炎症性サイトカインを刺激することによって寛容シグナル伝達を引き起こすことができます [68, 69]。 IL-10/TGF-βが豊富なサイトカイン環境では、樹状細胞およびマクロファージは、エフェクター細胞とTreg細胞の比率のバランスをとることで末梢免疫寛容の維持に重要な役割を果たす誘導Treg細胞の生成を促進できます。 プロバイオティクスとは別に、腸内細菌叢の変化は、特にアトピー性皮膚炎の乳児において、腸内細菌叢遺伝子の違いを通じて宿主免疫細胞の機能の発達に影響を与える可能性がある[70]。 |
| 3.2.2. 代謝物経路 |
| 短鎖脂肪酸を含む腸内細菌叢に由来する代謝物、または経口投与によってさらに補充される代謝物も、微生物叢を介して腸と皮膚の間のつながりを解決します。 Akkermansia muciniphilaを含む腸内細菌叢によって産生される安佐脂肪酸は、アトピー性皮膚炎の病理および病因に重要な影響を及ぼし、これが皮膚免疫系との相関関係を説明する可能性がある。 研究では、リノール酸と10-ヒドロキシ-シス-12-オクタデセン酸がアトピー性皮膚炎を軽減し、マウスの腸内細菌叢を制御することが示されました[71]。 さらに、新生児腸内細菌叢の 3 つの異なるサブグループ (NGM1-3) とその代謝産物が、初期のアレルギー感作に役割を果たすことが示されています [72]。 これら 3 つのサブグループのうち、NGM3 は複数のアレルギー感作に関連しており、Bifidobacterium, Ackermannia および Fasciolaでは含有量が比較的低いことが判明しました [65]。 例えば、12,13-ジヒドロキシ-9ゾクタデセン酸(12,13-DiHome)は、invitro免疫制御に対して炎症作用を有する代謝産物であり、NGM3に豊富に含まれていました。 さらに、12,13-DiHome は、新生児の宿主の皮膚上の白いワックス状のコーティングであるカゼインの保護層でアップレギュレートされました。 これらの結果は、腸-皮膚軸における代謝産物経路の存在を示唆している可能性がある[65]。 |
| 3.2.3. 神経内分泌経路 |
| 皮膚と同様に、胃腸の内壁は食物や微生物などの外部環境と直接接触しています。 皮膚と腸の重要な役割の 1 つは、病原性細菌の侵入を抑制することであり、両方の器官の微生物は免疫機能を通じてこれらの病原性細菌の除去に有益であるため、バランスの取れた腸内細菌叢を確立することが不可欠です。 両方の組織で適切なバランスを保ち、健康を維持します。 さらに、これら 2 つの細菌叢は、神経内分泌シグナル伝達を介して相互作用することができます。 この影響は、直接と間接の 2 つの経路を通じて発生する可能性があります [65]。 アトピー性皮膚炎患者の皮膚のかゆみを引き起こす腸内細菌によるトリプトファンの生成は、直接的なシグナルの一例です。 逆に、腸内の Lactobacillus やBifidobacteriumから生成されるγ-アミノ酪酸は皮膚のかゆみを抑制します[65,73]。 |
| 間接的な経路により、腸内細菌は血液中のIL-10やIFN-γなどのサイトカインの含有量を制御し、その結果、脳機能に異常な変化が生じ、不安やストレスを引き起こす可能性がある[65]。 コルチゾールは、腸内細菌の組成を変化させることによって腸上皮の透過性とバリア機能を変化させることができる、宿主における代表的なストレスホルモンである[74]。 コルチゾールはまた、トリプタミン、トリメチルアミン、5-ヒドロキシトリプタミンなどの循環神経内分泌分子の内容を変化させ、皮膚バリアと免疫機能をさらに強化します[75]。 |
| 4. プロバイオティクス - 腸内細菌叢を媒介して皮膚疾患を改善する (図 4) |
| 4.1. ニキビ |
| ニキビ患者は特殊な皮膚微生物を持っています。 利用可能なニキビ治療法には、皮膚の機械的バリアを損傷し、それによって乾燥させたり刺激を与えたりするため、さまざまな課題があります。 ニキビにおける皮膚と腸の軸の関係を調査した研究では、プロバイオティクスによる治療が腸を越えて免疫反応を改善し、皮膚にまで拡大できることが示されています[61]。 外用プロバイオティクスも皮膚の機械的バリアを調節し、抗菌ペプチドの二次的なアップレギュレーションを生成するという証拠が増えています。 たとえば、乳酸菌Streptococcus thermophilesは、クリームとして使用するとセラミド合成を促進し、in vitroおよびin vivoで1週間効果が持続しました[76、77、78]。 セラミドは皮膚に水分を閉じ込めることができ、スフィンゴミエリンを含む特定のセラミド スフィンゴ脂質にはCutibacterium acnesに対する抗菌活性があり、ニキビをさらに回復させます。 セラミドの生成を通じて、プロバイオティクスは皮膚の機械的バリアを強化するために使用され、セラミドが炎症を起こした皮膚を落ち着かせるため、ニキビの影響を受けた皮膚に役立ちます[79]。 |
| したがって、プロバイオティクスは、ニキビ患者の保護バリアを強化し、ニキビの原因となる細菌を抑制し、膿疱を減らし、皮膚の炎症を軽減するために使用できる可能性があります(図4)。 |
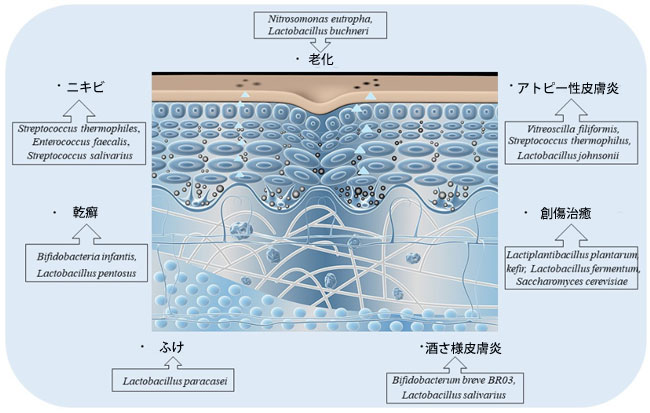 |
| 図4 プロバイオティクスは皮膚疾患を治療できます |
| さまざまなプロバイオティクスがさまざまな皮膚疾患を治療できます。たとえば、Nitrosomonas eutropha やLactobacillus buchneriは皮膚の老化を改善します。 Streptococcus thermophiles, Enterococcus faecalis や Streptococcus salivariusはニキビを改善します。 Vitreoscilla filiformis, Streptococcus thermophilus やLactobacillus johnsoniiはアトピー性皮膚炎を改善し、Bifidobacteria infantis と Lactobacillus pentosusは乾癬を改善します。 Lactiplantibacillus plantarum 、kefir、Lactobacillus fermentum、Saccharomyces cerevisiae は創傷治癒を改善します。 Lactobacillus paracaseiはフケを改善します。 Bifidobacterum breveBR03 とLactobacillus salivariusは酒さを改善します。 |
| 4.2. アトピー性皮膚炎 |
| アトピー性皮膚炎は主に微生物の多様性の減少によって引き起こされます。 上で述べたように、アトピー性皮膚炎患者の主な微生物はStaphylococcus aureusです。 さまざまな研究は、経口プロバイオティクスがその治療のためのより良い選択肢として使用される可能性があることを示唆しています[80]。 ある研究では、Streptococcus thermophilus がアトピー性皮膚炎に関連する湿疹を明らかに減少させ、症状の重症度も軽減することが示されました[78]。 別の研究では、皮膚内のセラミドレベルを増加させることにより、角質層上の乳酸菌Streptococcus thermophilus の有効性が示唆されています[77]。 |
| アトピー性皮膚炎患者を対象とした無作為二重盲検実験で、研究者らはLactobaciilusが生成する皮膚軟化剤の使用と通常の皮膚軟化剤の使用を比較した。 Lactobaciilusを含む皮膚軟化剤は、Staphylococcus aureuの伸長を抑制し、機械的バリアを提供し、アトピー性皮膚炎患者の症状を回復させた[81]。 加熱処理したプロバイオティクス株Lactobacillus johnsonii NCCを含むローションがStaphylococcus aureuの定着に及ぼす影響を調査した実験では、アトピー性皮膚炎患者の臨床症状に有用な効果が示されました。 |
| 同様に、サプリメントによるRoseomonas mucosa粘膜の治療を研究する他の実験では、疾患の重症度、外用ステロイドの必要性、およびStaphylococcus aureuの負担が明らかに減少することが実証されました。 この試験では副作用や合併症は報告されませんでした[82]。 これまでに実施された試験のほとんどは、プロバイオティクスがアトピー性皮膚炎患者にプラスの効果をもたらすことを示しています。 |
| 4.3. 乾癬 |
| 乾癬は自己免疫性の慢性皮膚疾患であり、通常は外用皮膚軟化剤と経口免疫抑制剤で治療されます。 乾癬の治療法として外用的なプロバイオティクスを取り入れた研究はほとんどありません。 研究では、皮膚微生物叢の変化が乾癬の症状の制御に役立つ可能性があることが示されていますが、経口プロバイオティクスは一部の個人の臨床症状に治療効果を示しています。 しかし、経口プロバイオティクスの利点を臨床的に実証するには、乾癬患者における経口プロバイオティクスの有効性に関する研究が必要である[60]。 |
| 4.4. 脂漏性皮膚炎 |
| 頭皮での酵母菌の異常増殖と微生物叢の多様性の減少は、フケや脂漏性皮膚炎を引き起こします。 これに関連して、プロバイオティクスの治療を評価するために多くの研究が行われてきました。 60人の患者を対象とした研究では、糸状Staphylococciの外用適用後に紅斑、落屑、そう痒症が減少したことが示された[78,83]。 別の研究では、Vitreoscilla filiformis溶解物が樹状細胞によるIL-10産生を通じてTreg活性を誘導することが明らかになった[84]。 フケ、脂漏性皮膚炎、および頭皮関連疾患は、 Lactobacillus paracasei.の経口摂取後に有益な効果を示しました。 この疾患の治療におけるプロバイオティクスの外用的有効性については、さらなる研究が必要である[85]。 |
| 4.5. 酒さ様皮膚炎 |
| TLR2受容体誘発性の酒さの過剰発現が起こり、炎症反応と皮膚微生物叢の変化を引き起こします[86、87]。 抗生物質としてのドキシサイクリンに加えて、経口プロバイオティクスが頭皮酒さを治療するために使用されます。 しかし、酒さの治療における外用プロバイオティクスの使用は検討されていない[88]。 |
| 5. 皮膚の生理機能を調節するプロバイオティクス (図 5) |
| 5.1. Nitrobacter |
| Nitrobacterは、皮膚に含まれる硝酸塩(宿主にプラスの影響を与える可能性のある分子)を生成する硝化細菌です。 研究によると、緑葉野菜などの食事から硝酸塩を摂取すると、運動中の骨格筋への血流の増加、運動時の酸素要求量の減少、末梢動脈疾患患者の運動耐量の増加、血圧の低下などのプラスの効果があることが示されています。 研究では、硝酸塩欠乏のこれらの影響は主にNO合成のNOS非依存性増加の結果であることが示されており、健康な宿主ではNOS非依存性のメカニズムを通じて皮膚反射血管拡張を増加させることが示されている[89]。 Nitrobacter spp.の抗真菌活性 皮膚糸状菌 [90] や、多くの皮膚感染症を誘発する可能性がある微生物叢であるStaphylococcus aureus [91] から皮膚を守ることがわかっています。 Nitrobacterが硝酸塩を生成する能力は、皮膚に硝酸塩を提供する可能性もあり、これにより皮膚の前駆細胞が紫外線損傷から保護されることが証明されている[92,93]。 |
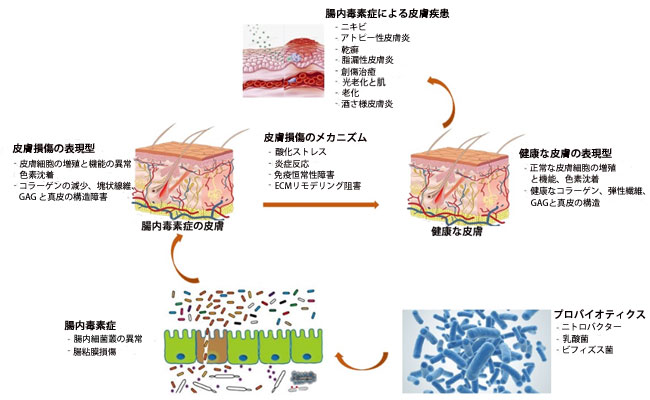 |
| 図5 プロバイオティクスが皮膚疾患を改善するメカニズム |
| Nitrobacter, Lactobacillus や Bifidobacterium,などのプロバイオティクスは、腸内細菌叢の障害を改善し、腸粘膜の損傷を修復することで腸の恒常性を回復し、皮膚細胞の増殖と機能の異常、色素沈着、コラーゲンの減少、弾性線維、グリコサミノグリカン(GAG)などの皮膚損傷の表現型を治療します。酸化ストレス、炎症反応、免疫恒常性、細胞外マトリックス(ECM)リモデリング阻害を阻害することにより、真皮の構造障害を抑制し、最終的には皮膚疾患(ニキビ、アトピー性皮膚炎、乾癬、脂漏性皮膚炎、創傷治癒、光老化、皮膚の老化、酒さ)を治療します。 |
| 5.2. Lactobacillus |
| Lactobacillusは、乳酸菌の中で最も豊富で多様な属である[94]。 Lactobacillus株は宿主のケラチノサイトに対して抗炎症活性を持ち、in vitro でのStaphylococcus epidermidisの増殖に対して特異的な刺激効果を持っています [95]。 Lactobacillusはまた、サブスタンス P によって引き起こされる皮膚の炎症反応を抑制し、皮膚のバリア機能の回復を促進します [96]。 臨床実験では、6週間の経口Lactobacillus johnsonii 介入レジメンが、紫外線による免疫抑制における皮膚免疫機能の回復を促進することが示唆された[97]。 Fabrocciniらは、成人20名を対象としたランダム化二重盲検プラセボ対照実験プログラムにおいて、Lactobacillus rhamnosus,を含む液体介入により、インスリンシグナル伝達関連遺伝子の皮膚発現が正常化され、成人ニキビが改善されることを発見した[98]。 この研究では、経口プロバイオティクスである加熱殺菌Lactobacillus acidophilusが、マウスの紫外線照射に起因するしわの形成を抑制することが示された[99]。 |
| これらの有益な影響は、マトリックスメタロプロテイナーゼの減少によるものでした。 さらに、Park と Bae は、Lactobacillus と Bifidobacteriumの発酵を組み合わせて A. koreanum 抽出物を発酵させると、皮膚線維芽細胞の老化表現型が阻害されることを in vitro 研究で示しました [100]。 老化状態は 紫外線または過酸化水素によって引き起こされますが、老化の保護は マトリックスメタロプロテイナーゼ-1 の推論によって部分的に媒介されます (図 5)。 |
| 5.3. Bifidobacterium |
| その結果、Bifidobacterium breve B-3 を経口摂取すると、マウスの過剰な 紫外線照射下で経皮的水分損失、皮膚の乾燥、表皮肥厚の変化が明らかに阻害され、密着結合構造と基底膜の損傷が改善されることが示されました。 Bifidobacterium breve B-3 の補給も、紫外線による皮膚での IL-1β の産生を抑制しました [101]。 |
| カプセルに入った凍結乾燥粉末としてのBifidobacteriumと Lactobacillus は、一般的な食物アレルゲンに対するアトピー性感作を抑制し、幼児期のアトピー性湿疹の有病率を減少させます[102]。 アトピー性皮膚炎の成人患者において、経口サプリメントとしてのBifidobacterium bifidum は、鎮痒および鎮痛の代謝物アセトニドのレベルの上昇に関連した鎮痒作用を有する[103]。 二重盲検、プラセボ対照、無作為化試験では、Bifidobacterium breveとガラクトオリゴ糖を含む発酵乳の摂取により、角質層の水和レベルの低下が抑制され、ヒストン I 様プロテアーゼ活性の増加が抑制されました。 健康な成人女性ボランティアでは血清および尿中のフェノール含有量が減少した[104]。 |
| 6. 腸-皮膚軸によるプロバイオティクスを介した皮膚状態の調節の潜在的なメカニズム |
| 6.1. 酸化ストレスレベルの低下 |
| 皮膚の光老化の病理学的生理機能は、MAPK および NF-κB ループの活性化、マトリックスメタロプロテイナーゼレベルの低下、およびコラーゲン含有量を含む 活性酸素による損傷と密接に関連しており、皮膚の光老化を引き起こします。 研究では、プロバイオティックLactobacillusを使用したアガスタシュ・ハマナス発酵抽出物(ARE-F)の部分発酵が、紫外線治療を受けたヒトケラチノサイト細胞 (HaCaT)の紫外線に起因する総グルタチオン濃度とスーパーオキシドジスムターゼ活性を促進し、同時に紫外線に起因する活性酸素およびマトリックスメタロプロテイナーゼのレベルを下方制御することを示唆しました [105]。 研究では、部分的なLactobacillus acidophilus IDCC 3302が、皮膚の抗酸化能力を促進し、サイトカインに潤いを与え、MAPK ループの抑制を介して マトリックスメタロプロテイナーゼ合成を阻害することにより、皮膚表皮における紫外線による光損傷を防御することが示されました [45]。 |
| 別の研究では、Lactobacillus acidophilus KCCM12625が優れた抗酸化機能を有し、紫外線照射後にin vitroで上方制御された活性酸素含有量を明らかに減少させ、酸化傷害によって誘発される光損傷を改善することが示唆された[22]。 研究では、Bifidobacterium breve Yakultの経口摂取により、活性酸素含有量が抑制され、in vivo での紫外線による皮膚の機械的バリア損傷と酸化ストレスが改善されることが示唆されました [106]。 研究では、Lactobacillus buchneriで発酵させた植物抽出物が、I型プロコラーゲン含有量をアップレギュレートし、エラスターゼ合成を抑制することにより、in vitroでの紫外線による皮膚の光老化における酸化損傷の影響を改善することが示されました。 そして、ケラチノサイト細胞および真皮線維芽細胞上の紫外線によって引き起こされるマトリックスメタロプロテイナーゼのレベルを上方制御する[107]。 研究では、Limosilactobacillus fermentum XJC60 がミトコンドリアの能力を強化し、紫外線で損傷した皮膚細胞の活性酸素含有量を減少させ、したがって皮膚の状態を維持できることが示唆されました [108]。 さらに、新しい研究では、Lacticaseibacillus rhamnosus GG (ATCC 53103、LGG) [109] およびLacticaseibacillus casei strain Shirotaが皮膚の光老化を改善する主要な経路として抗酸化作用が示されています [110]。 |
| 6.2. 炎症反応の抑制 |
| 上方制御された皮膚炎症要素は、バリア機能の機能不全、経皮的水分損失、表皮の透過性の増加、および急速な皮膚の光老化を引き起こします。 研究では、Bifidobacterium breve B-3 の経口摂取が、紫外線照射マウスの皮膚における 紫外線原因の IL-1β 含有量の減少に効果的であることが示唆されました。 その結果、経皮的水分損失、皮膚の乾燥、表皮の肥厚が抑制されました [111,112]。 Lactobacillus acidophilus IDCC3302 は、その抗酸化作用に加えて、MAPK シグナル伝達経路を介した炎症促進因子の産生を抑制し、紫外線誘発性の皮膚炎症を軽減しました [45]。 皮膚の光老化を改善するために、Lactobacillus reuteri DSM 17938 を経口投与すると、紫外線誘発性の IL-6 および IL-8 に抵抗する抗炎症効果が示されたことが研究で示されました [113]。 |
| Keshari らは、プロバイオティクスStaphylococcus epidermidisの新たな生産物から得られる酪酸が、短鎖脂肪酸受容体を使用して 紫外線によって引き起こされる炎症促進因子 IL-6 因子を減少させる可能性があることを示唆しました [114]。 研究では、経口オリゴ糖が紫外線誘発性の炎症性免疫反応を調節し、経皮的水分損失と日焼けによる紅斑を軽減し、したがって皮膚の光老化を抑制することが示されました[115]。 |
| 6.3. 免疫恒常性の維持 |
| Lactobacillus paracaseiなどの多くの特定のプロバイオティクスは、免疫応答を調節して病原体を阻害する[116]。 さらに、望ましくない免疫効果を抑制して、慢性炎症疾患に対する免疫恒常性を維持します。 それは、プロバイオティクスによるTreg数の調節によるものである可能性があります。 Treg は、皮膚の光老化によって引き起こされる免疫抑制に重要な影響を及ぼします。 Lactobacillus johnsonii は、紫外線による表皮ランゲルハンス細胞密度の減少を抑制し、紫外線による免疫抑制後の皮膚免疫恒常性の回復を促進しました。 さらに、プロバイオティクスは、免疫状態が異なると異なる効果を発揮します。 生理学的状態では、プロバイオティクスは皮膚に対する細胞傷害性 T 細胞の攻撃を減少させ、CD8+ T 細胞への機能的損傷の誘導を上方制御し、静止樹状細胞の活性化とすべての制御性 T 細胞サブセットの活性化と機能を引き起こします。 ある研究では、Lactobacillus johnsoniiや栄養性カロテノイドを含む栄養補助食品(DS)が紫外線によって引き起こされる初期の皮膚損傷に及ぼす影響を分析するために3つの臨床実験を実施した[117]。 これらの結果は、変性脊椎すべり症の摂取が紫外線曝露の長期的かつ反復的な影響に有益な影響を及ぼし、光老化により特異的であることを示唆しています。 データは、Bifidobacterium longumやガラクトオリゴ糖を含む経口介入が紫外線による光老化から皮膚を守り、抗炎症効果と抗酸化効果をもたらすことを示しました[118]。 さらに、それらは短鎖脂肪酸および酢酸塩の血清レベルを上方制御し、これらはヒストンアセチル化依存性の皮膚常在tregを上方制御して活性化することが示されている。 |
| 6.4. 細胞外マトリックス改造抑制 |
| 活性酸素含有量は 紫外線曝露後に上方制御され、マトリックスメタロプロテイナーゼ含有量の増加、皮膚のコラーゲンタンパク質とエラスチンタンパク質の分解、および肌の荒れ、乾燥、たるみを引き起こしました。 プロバイオティクスは、活性酸素含有量を直接減少させるだけでなく、皮膚内の マトリックスメタロプロテイナーゼレベルを間接的に調節し、紫外線曝露後のコラーゲンとエラスチンタンパク質の分解を減少させることができます [119]。 経口Lactobacillus acidophilus KCCM12625は、真皮におけるプロコラーゲンレベルを上方制御し、コラーゲンタンパク質の損失を下方制御しながら、皮膚のAP-1ループに損傷を与えることにより、皮膚の光老化後のマトリックスメタロプロテイナーゼのmRNAレベルを低下させる可能性がある[22]。 研究では、経口Lactobacillus plantarum HY7714が、JNK/AP-1ループの活性化を抑制することにより、紫外線誘発細胞傷害におけるマトリックスメタロプロテイナーゼ-13含有量の過剰産生とマトリックスメタロプロテイナーゼ-2およびマトリックスメタロプロテイナーゼ-9の活性を減少させることが示されました[49]。 研究では、経口Lactobacillus sakei がMAPKループを阻害することでAP-1発現を抑制し、真皮のコラーゲンを上方制御し、皮膚の光老化を改善できることが示唆された[46]。 別の研究では、細胞外乳酸菌多糖類(LEPS)がマトリックスメタロプロテイナーゼレベルを低下させ、TIMPを増加させる可能性があることが実証されました[120]。 データは、ラクトバチルス・カゼイ由来のB9-1の細胞外乳酸菌多糖類が皮膚の抗コラゲナーゼおよび抗エラスターゼ機能を強化し、紫外線照射後のコラーゲンの分解を効果的に減少させることができることを示しました。 ある研究では、キムチに含まれるLactobacillus brucei 発酵植物由来の外用抽出物が、紫外線誘発エラスターゼ活性とマトリックスメタロプロテイナーゼの発現を大幅に抑制し、I型プロコラーゲンの合成を促進できることが実証されました。 Negariらは、局外用プロバイオティクスであるStaphylococcus epidermidisのイソノナン酸セテアリル(CIN)の代謝物が潜在的な炭素源として損傷したコラーゲンを修復し、リン酸化細胞外シグナル制御キナーゼ(p-ERK)の活性化を通じてコラーゲンの合成を引き起こす可能性があることを示した。 それにより皮膚の光老化を抑制します[121]。 |
| 7. 結論 |
| 近年、皮膚のプロバイオティクスの組成と、腸内細菌叢の異常が皮膚の健康にどのように影響するかについての理解が大幅に進歩しました。 さまざまな皮膚科用製剤の形での外用および体内用プロバイオティクスは、皮膚疾患の治療の重要な部分です。 外用プロバイオティクスの機能と保護的性質は皮膚の恒常性を維持しますが、その欠点と限界により、外用プロバイオティクスでは完全に治すのが難しい炎症性皮膚状態が引き起こされます。 アトピー性皮膚炎、ニキビ、乾癬、創傷治癒、その他多くの皮膚の問題などの症状の治療における、内用プロバイオティクス製剤の有効性と副作用を研究するために、いくつかの臨床試験が実施されています。 私たちは、このレビューが皮膚疾患の治療のための新しい治療法として体内プロバイオティクスの分野における研究活動の強化に貢献することを願っています。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Nutrients. 2023 Jul; 15(14): 3123.に掲載されたThe Role of Probiotics in Skin Health and Related Gut–Skin Axis: A Review. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


