ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
Lactiplantibacillus plantarum NKK20は腸内酪酸生成を増加させ、 PI3K/Akt経路を介して2型糖尿病性腎障害を阻害する |
Xiaohong Sun, Yue Xi, et al., |
|
|
| 要約 |
腎障害損傷は、糖尿病患者に観察される一般的な合併症であり、末期腎疾患の顕著な原因となっており、終末糖化生成物は糖尿病患者の腎損傷を誘発する重要な因子です。 この症状に対処することは、臨床現場において依然として困難な側面です。 この研究の目的は、動物および細胞モデルに基づいて糖尿病性腎疾患を防ぐ Lactiplantibacillus plantarum NKK20 株の効果を調査することでした。 結果は、Lactiplantibacillus plantarum NKK20が糖尿病マウスの腎炎症反応、血清酸化ストレス反応、終末糖化生成物濃度を有意に低下させることができることを示しました。 Lactiplantibacillus plantarum NKK20による治療後、糖尿病マウスの腎臓障害は大幅に改善され、さらに重要なことに、糖尿病マウスの便中の腸内細菌叢の特定の抗炎症代謝産物である酪酸濃度が大幅に増加した。 さらに、非標的メタボロミクス解析により、Lactiplantibacillus plantarum NKK20投与群と腎症損傷群のマウス血清含有量に有意な差が認められ、Lactiplantibacillus plantarum NKK20により顕著な影響を受ける合計24種類の代謝物が観察されました。 代謝物は主にグリセロリン脂質代謝とアラキドン酸代謝に関与していました。 また、終末糖化生成物によって刺激されたヒト腎臓-2 細胞に酪酸を投与すると、ZO-1、オクルディン、および E-カドヘリンの遺伝子発現が大幅に上方制御され、α-SMA 遺伝子発現が下方制御されました。 これは、酪酸が ヒト腎臓-2 細胞の密着結合構造を維持し、線維化を抑制できることを意味します。 酪酸塩は、PI3K/Akt 経路(訳者注:Akt経路またはPI3K-Akt経路は、タンパク質合成、増殖および生存を含む基本的な細胞プロセスに関与する。 この経路は、受容体チロシンキナーゼ、Gタンパク質共役受容体、サイトカイン受容体などの同族受容体に結合するホルモン、成長因子および細胞外基質の成分を含む様々なシグナルによって活性化される)の活性化も有意に阻害しました。 これらの結果は、Lactiplantibacillus plantarum NKK20が血糖と終末糖化生成物濃度を低下させ、腸内の酪酸生成を増加させることにより、糖尿病マウスの腎損傷を治療できることを示しています。 酪酸は、ヒト腎臓-2細胞における PI3K 経路の活性化を阻害することにより、尿細管上皮細胞の密着結合構造を維持し、腎組織の線維化を阻害します。 これらの結果は、Lactiplantibacillus plantarum NKK20が糖尿病性腎障害の発生と悪化の予防と治療に役立つことを示唆しています。 |
| 目次(クリックして記事にアクセスできます) |
| 1. 背景 |
| 2. 材料と方法 |
| 2.1. 動物および糖尿病性腎疾患モデル |
| 2.2. ヒト腎臓-2 細胞の培養と処理 |
| 2.3. qRT-PCR分析 |
| 2.4. ウェスタンブロッティング分析 |
| 2.5. ヘマトキシリン・エオシンおよびマッソン染色 |
| 2.6. ELISA分析と酵素活性の検出 |
| 2.7. 非標的メタボロミクス解析 |
| 2.8. 酪酸の GC-MS 検出 |
| 2.9. 統計分析 |
| 3. 結果 |
| 3.1. 糖尿病性腎疾患マウスの体重および血糖に対するLactiplantibacillus plantarum NKK20の影響 |
| 3.2. 糖尿病マウスの炎症反応に対するLactiplantibacillus plantarum NKK20の効果 |
| 3.3. 糖尿病マウスのスーパーオキシドジスムターゼ、マロンジアルデヒド、終末糖化生成物、酪酸レベルに対するLactiplantibacillus plantarum NKK20の影響 |
| 3.4. 糖尿病マウスの腎損傷に対するLactiplantibacillus plantarum NKK20の効果 |
| 3.5. 糖尿病マウスの血清内因性代謝物に対するLactiplantibacillus plantarum NKK20の効果 |
| 3.6. 酪酸ナトリウムはタイトジャンクションタンパク質の発現を上方制御し、ヒト腎臓-2細胞の線維化を抑制します |
| 3.7. 酪酸ナトリウムは ヒト腎臓-2 細胞におけるPI3K- Akt シグナル伝達経路の活性化を阻害します |
| 4. 討議 |
| 5. 結論 |
本文 |
| 1. 背景 |
| 糖尿病性腎疾患 (DKD) は、末期腎症の主な原因の 1 つです [1]。 糖尿病は世界で最も一般的な代謝性疾患であり、その罹患率は依然として年々増加しており、若年化が顕著な傾向にあります[2]。 糖尿病性腎疾患は、糖尿病に関連する主な合併症を表します。 現在、糖尿病性腎疾患に罹患している人々は世界中にかなりの数存在しており、そのためこの症状の予防と治療は困難な課題となっています。 糖尿病性腎疾患の病因は複雑で、最近の研究では、糖尿病患者の血流中の終末糖化産物 (AGE) の増加が、この腎合併症の発症に重要な役割を果たしていることが明らかになりました [3]。 終末糖化産物は、還元糖と、タンパク質のアルギニンおよびリジン残基、リン脂質のアミノ基、DNA のグアニル酸などのさまざまな基質のグループとの間の酵素分解に依存しない反応によって生成される不可逆的なグリコシル化最終生成物です [4]。 さらに、生体内での終末糖化産物は、グルコース分解または糖新生のプロセス中の自動酸化反応からも生じる可能性があります [5]。 通常の状況下では、終末糖化産物は体内でゆっくりと形成され、腎臓によって除去されます [6]。 しかし、高血糖の状況では、体内の終末糖化産物の合成速度が大幅に上昇し、腎臓のクリアランス能力を超え、それによって終末糖化産物の実質的な蓄積につながります [7]。 体内の 終末糖化産物濃度が高いと、さまざまな臓器で炎症を引き起こす可能性があります [8]。 終末糖化産物が腎臓に大量に蓄積すると、腎臓の構造に損傷を与え、機能を喪失し、糖尿病性腎疾患やさらには尿毒症を引き起こします [9]。 したがって、終末糖化産物は現在、腎臓損傷の潜在的な指標として認識されています。 |
| 臨床研究では、短鎖脂肪酸 (SCFA) が 2 型糖尿病 (T2DM) の症状および合併症の改善と高い相関があることも示されています [10-12]。 短鎖脂肪酸は、結腸内に存在する特定の嫌気性細菌による難消化性食物繊維の発酵プロセスを通じて生成されます。 これらの 短鎖脂肪酸は、主に酢酸、プロピオン酸、酪酸と、炭素原子数が 6 個未満の他の有機酸で構成されています [13]。 短鎖脂肪酸である酪酸塩は、主に消化管内で食物繊維の発酵によって生成されます。 その主な起源は腸ですが、血流にも侵入し、炎症性腸疾患、喘息、関節炎などの炎症と免疫に関連する疾患の発症に寄与する可能性があります[14-16]。 以前の実験では、酪酸ナトリウム (NaB) が細胞代謝を調節することにより、終末糖化産物によって引き起こされる酸化ストレスと炎症を軽減できることが明らかになりました [17]。 したがって、酪酸塩は糖尿病性腎疾患の改善に重要な役割を果たす可能性があります。 |
| 既存の臨床研究では、さまざまなプロバイオティクスが糖尿病患者の炎症反応を効果的に阻害し、高齢の糖尿病患者の腎損傷のリスクを大幅に軽減できることが確認されています[18、19]。 いくつかの臨床研究では、Lactiplantibacillus plantarumを含む豆乳が腎症を伴う2 型糖尿病患者の腎機能を改善できることが示されています[20、21]。 最近の研究では、酪酸を生成する Lactiplantibacillus plantarum が、ストレプトゾトシン誘発糖尿病マウスの高血糖を改善できることがわかりました [22]。 Lactiplantibacillus plantarum NKK20 株は、健康なヒトの腸から新たに単離された株であり、保存番号 CCTCC NO: M2020596 で中国典型文化保存センターに寄託されています。以前の研究では、このLactiplantibacillus plantarum NKK20株が結腸内容物中で酪酸を含む短鎖脂肪酸の産生を促進する能力があり、強力な脂質低下効果と抗炎症効果を与えることが示されています[23]。 これらの結果は、酪酸生成Lactiplantibacillus plantarum NKK20が糖尿病性腎疾患を改善するための効果的な食事手段である可能性を示唆しています。 それにもかかわらず、糖尿病性腎疾患における腎損傷に対するLactiplantibacillus plantarum NKK20の保護効果は不明のままです。 Lactiplantibacillus plantarum NKK20が糖尿病性腎疾患の腎障害を改善する経路は明らかになっていない。 |
| 我々は、糖尿病性腎損傷のマウスモデルに基づいて、血糖値、終末糖化生成物レベル、および腎損傷の改善に対するLactiplantibacillus plantarum NKK20の効果を評価しました。 ヒト腎臓(HK-)2細胞モデルに基づいて、酪酸による 終末糖化生成物誘発腎損傷の治療メカニズムを研究しました。 これらの研究は、糖尿病性腎疾患患者におけるプロバイオティクス療法の理論的裏付けを提供することができます。 |
| 2.材料と方法 |
| 2.1. 動物および糖尿病性腎疾患モデル |
| 30 匹の 6 週齢雄 ICR マウスを Wukong Biological Company (Nanjing, China) から購入し、バリア システムを備えた江蘇大学動物実験センターで飼育しました。 従来のマウス飼料および高脂肪飼料 (HFD) は、Jiangsu Xietong Research and Bio-Engineering Co., Ltd. (Nanjing, China) から購入しました。 ICR マウスを、対照群 (NC)、糖尿病性腎疾患モデル群 (DKD)、高脂肪飼料プラスLactiplantibacillus plantarum NKK20群 (NKK20) の 3 群にランダムに分け、各群 10 匹ずつに分けました。 対照群のマウスには、実験が終了するまで従来の飼料を与えました。 糖尿病性腎疾患モデル群と高脂肪飼料プラスLactiplantibacillus plantarum NKK20群のマウスに高脂肪飼料を与え、5 週目から 5 日間連続でストレプトゾトシン (50 mg/kg) の腹腔内注射により糖尿病性腎症を誘発させました。実験の開始時に、高脂肪飼料プラスLactiplantibacillus plantarum NKK20群のマウスは 各群にはLactiplantibacillus plantarum NKK20を経口投与し、各マウスには1日あたり1×107個の生菌を与えた。 マウスの絶食状態における尾静脈の血糖濃度を3日間連続して検出し、空腹時血糖値(FBG)レベルが11.1 mmol/L以上の場合に糖尿病性腎症モデルが成功したとみなした。 高脂肪飼料は 6 週間継続され、実験中は体重と空腹時血糖値がモニタリングされました。 マウスは9週目の終わりに屠殺し、追跡調査のために血清と腎臓皮質を採取した。 |
| 2.2. ヒト腎臓-2 細胞の培養と処理 |
| ヒト腎臓(HK-) 2 細胞 (ATCC® CRL-2190™、Rockville, MD, USA、江蘇大学医学部の Hui Qian 教授からのご厚意により寄贈) を、10% ウシ胎児血清を含む RPMI 1640 培地でCO2 5%、 37°C で培養しました。実験のために、ヒト腎臓-2 細胞を 1 × 106 細胞の密度で 6 ウェル細胞培養プレートに 24 時間播種しました。 細胞実験は正常対照群(NC)、終末糖化生成物刺激群(AGEs)、終末糖化生成物+低用量酪酸ナトリウム(100 μmol/L)群(L-NaB)、終末糖化生成物+中用量酪酸ナトリウム(200 μmol/L)群(M-NaB)、および終末糖化生成物+高用量酪酸ナトリウム(400 μmol/L)群(H-NaB)の5つのグループに分けられます。 正常対照群の細胞は、酪酸ナトリウムと 終末糖化生成物を添加せずに従来の細胞培養培地で培養しました。 酪酸ナトリウム介入群では、さまざまな濃度の酪酸ナトリウムを事前に24 時間インキュベートした後、終末糖化生成物群と酪酸ナトリウム群の細胞を400 μg/mLの終末糖化生成物で処理して24 時間炎症反応を誘導しました。 総RNA抽出およびウェスタンブロッティング分析のために、実験の最後に細胞培養物を収集しました。 |
| 2.3. qRT-PCR分析 |
| マウス腎臓組織および ヒト腎臓-2 細胞の全 RNA を、qRT-PCR 実験において RNA-easy 単離試薬 (Vazyme Biotech Co., Ltd.、Nanjing, China) によって抽出しました。 HiScript III 1st strand cDNA 合成キット (+ gDNA ワイパー) (Vazyme Biotech Co., Ltd.、Nanjing, China) により、マウスの腎臓および ヒト腎臓-2 細胞における関連遺伝子の発現が AceQ Universal SYBR qPCR Master Mix によって検出されました。 (Vazyme Biotech Co., Ltd.、Nanjing, China)。 PCR プライマーは GENEWIZ (Suzhou, China) によって合成されました。 qPCR の反応条件は次のとおりです: 95°C で 30 秒、95°C で 5 秒、60°C で 30 秒、合計 40 サイクル。 qPCRの結果をCt値で表し、GAPDH遺伝子を内部標準として使用し、遺伝子mRNAの相対発現を2-ΔΔCt計算法により計算した。 プライマー配列を表 1 に示します。 |
| 表 1 qRT-PCR プライマー配列 |
 |
| 2.4. ウェスタンブロッティング分析 |
| 実験の最後に、ヒト腎臓-2細胞を収集し、細胞培養培地を廃棄し、氷上で予め冷却したリン酸緩衝液で3回洗浄することによって残留細胞培養培地を除去した。 RAPI ライセート (Beyotime、Nanjing, China) を細胞に添加し、氷上で 30 分間溶解しました。 溶解上清中の全タンパク質を収集し、BCAタンパク質定量キット(Beyotime、Nanjing, China)によってタンパク質濃度を検出した。 すべてのサンプルは SDS-PAGE 電気泳動によって分離されました。 電気泳動後、定常電気泳動モデルをポリフッ化ビニリデン (PVDF) に転写しました。 移したポリフッ化ビニリデンメンブレンを 5% 脱脂粉乳 (Boster Biological Technology Co., Ltd.、Wuhan, China) に 2 時間浸して密封し、その後、適度に希釈したさまざまな抗体と組み合わせて一晩インキュベートしました (ABclonal Technology Co., Ltd. Wuhan, China)。 これらには、α-SMA (1 : 2000)、E-カドヘリン (1 : 2000)、AkT (1 : 1000)、p-AkT (1 : 500)、PI3K (1 : 1000)、p-PI3K (1 : 500) 、アクチン (1 : 10000)が含まれます。 インキュベーション後、TBST バッファー (Vazyme Biotech Co., Ltd.、Nanjing, China で 3 回洗浄することによって未結合の抗体を除去し、次に HRP 標識ヤギ抗ウサギ IgG (Boster Biological Technology Co., Ltd. Wuhan, China) と室温で1 時間インキュベートしました。 抗体のインキュベーションが完了した後、ECL 発色溶液 (Vazyme Biotech Co., Ltd.、Nanjing, China) を加えて露光しました。 |
| 2.5. ヘマトキシリン・エオシンおよびマッソン染色 |
| マウス腎実質組織を 4% パラホルムアルデヒドに浸漬し、染色前に 48 時間固定しました。 マウス腎実質組織をパラフィン包埋によりスライスし、脱蝋し、濃度勾配を有するエタノール中で脱水し、最後に染色に使用した。 ヘマトキシリン・エオシン(H&E) 染色を使用して腎実質の細胞形態を観察しました。 腎実質の線維化の程度はマッソン染色により観察した。 糖尿病性腎症では、腎臓の線維芽細胞が活性化して筋線維細胞に変化し、さらに分解されにくいコラーゲン線維が大量に合成・分泌され、最終的には細胞外マトリックスの蓄積を引き起こし、腎間質線維化を引き起こします。 マッソン染色後、筋原線維は赤色、コラーゲン線維は緑色でした。 Image-Pro Plus 6.0 ソフトウェアを使用してマッソン染色結果をスキャンし、緑色領域のサイズに従ってスコアを付けました。 |
| 2.6. ELISA分析と酵素活性の検出 |
| マウスの血清中のAGE濃度はELISAキット(ZCI Bio、Shanghai, China)によって検出されました。 スーパーオキシドジスムターゼ (SOD) 活性分析 キットおよびマロンジアルデヒド (MDA) 含有量分析キットは、Jiancheng Institute of Bioengineering (Nanjing, China) から購入しました。 試験手順はキットの操作説明書に従って実行されます。 |
| 2.7. 非標的メタボロミクス解析 |
| マウス血清サンプルを 4°C で解凍し、60 μL の血清を取得し、アセトニトリルを体積比 1 : 4 で添加してタンパク質を除去しました。 次に、混合物を 1 分間激しく振盪し、4℃、13500 rpmで15 分間遠心分離しました。 上清を孔径 0.22 μm の濾過遠心管で濾過して粒子状物質を除去し、濾過したサンプル 200 μL を Wekemo Tech Group Co., Ltd(Shenzhen, China) の UPLC-Q-TOF-MS による非標的メタボロミクス分析に使用しました。 移動相は、流速 0.3 mL min-1 の 0.1% ギ酸を含む水 (A 相) および 0.1% ギ酸を含むアセトニトリル (B 相) でした。 勾配溶出条件は 0-7 min、55% B でした。 7-9 分、55%-80% B; 質量スペクトル条件は次のとおりです: ESI イオン化源を使用、イオン源温度は 120°C、乾燥温度は 225°C、流量は 5 L min −1、アトマイザー圧力は20 psi、シース温度は400℃、シースガス流量は12 L min−1、ノズル電圧は500 Vでした。スキャン範囲は正でm/z 20−1 700でした。 キャピラリー電圧 3 500 V のイオン モードとキャピラリー電圧 4 000 V のマイナスイオン モード 各グループの血清サンプルのクロマトグラムは、Markerview 2.1 (AB SCIEX、Massachusetts, USA) ソフトウェアによって実行されました。 クロマトグラフィーのピークを抽出し、ピーク面積を正規化しました。 正規化されたデータを主成分分析 (PCA) によって分析し、マウスの各グループの代謝プロファイルの変化を観察しました。 SIMCA-P v11.5 (Umetrics、Umea, Sweden) ソフトウェアを使用して、検出された化合物の内容結果を直交部分最小二乗判別分析 (OPLS-DA) によって分析し、群間の寄与率を反映できる VIP プロットが得られました。 直交部分最小二乗判別分析モデル変数に基づいて、VIP > 1 および P < 0.05 ルールに従って差次的代謝産物をスクリーニングしました。 得られた示差代謝産物の経路解析にはMetaboAnalyst 3.0(http://www.metaboanalyst.ca/)を使用し、HDMBデータベースとKEGGデータベースを組み合わせて示差代謝産物の生物学的重要性をさらに解析しました。 最後に、糖尿病性腎損傷の治療における Lactiplantibacillus plantarum NKK20に関連する潜在的なバイオマーカーと関連代謝経路が同定されました。 |
| 2.8. 酪酸の GC-MS 検出 |
| マウスの糞便中の酪酸濃度は、Wekemo Tech Group Co., Ltd. (Shenzhen, China) によって測定されました。 酪酸の濃度はガスクロマトグラフィーにより測定した。 具体的な方法は次のとおりです。0.1 gのマウス糞便サンプルを1 200 μLの滅菌蒸留水とよく混合し、その後50 μL(50%)の濃硫酸を加えて酸性化します。 酪酸の濃度は、内部標準としてジエチル酪酸を使用するガスクロマトグラフによって測定した。 |
| 2.9. 統計分析 |
| データ分析には統計ソフトウェア SPSS 20.0 を使用しました。 測定データは平均値±標準偏差で表されます。 複数グループの比較には一元配置分散分析を使用し、ペア対グループの比較には LSD 法を使用しました。 P < 0.05 は統計的に有意であるとみなされました。 |
| 3. 結果 |
| 3.1. 糖尿病性腎疾患マウスの体重および血糖に対するLactiplantibacillus plantarum NKK20の影響 |
| 図1(a)からわかるように、糖尿病性腎疾患モデル群(DKD)および高脂肪飼料プラスLactiplantibacillus plantarum NKK20群(NKK20)のマウスの体重は、5週目から対照群(NC)のマウスの体重よりも有意に高かった(P<0.05)が、糖尿病性腎疾患モデル群(DKD)と高脂肪飼料プラスLactiplantibacillus plantarum NKK20群(NKK20)の間に体重には有意差はなかった(P > 0.05)。 図1(b)に示すように、実験を中止すると、糖尿病性腎疾患モデル群(KDK)および高脂肪飼料プラスLactiplantibacillus plantarum NKK20群(NKK20)のマウスの空腹時血糖値(FBG)は対照群(NC)に比べて有意に高く、糖尿病性腎疾患モデル群(DKD)の空腹時血糖値は 高脂肪飼料プラスLactiplantibacillus plantarum NKK20群(NKK20)よりも有意に高かった(P < 0.05)。 |
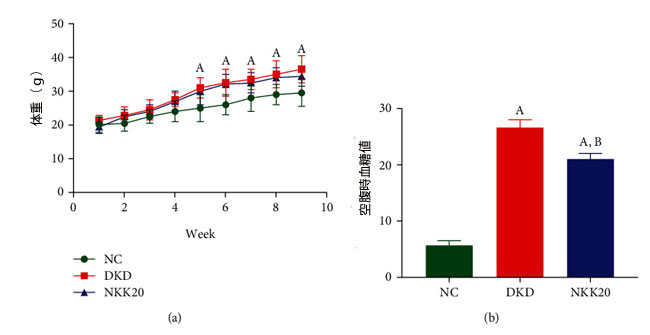 |
図1 マウスの体重と血糖値 (a) 体重の変化。 (b) 空腹時血糖値。 (A) 対照群と比較して、P > 0.05。 (B) 糖尿病性腎疾患モデル群と比較して、P > 0.05。 NC:対照群、DKD:糖尿病性腎疾患モデル群、NKK20:高脂肪飼料プラスLactiplantibacillus plantarum NKK20群 |
| 3.2. 糖尿病マウスの炎症反応に対するLactiplantibacillus plantarum NKK20の効果 |
| qPCR分析の結果は、糖尿病性腎疾患モデル群(DKD)マウスの腎臓組織における NACHT、LRR、および PYD ドメイン含有タンパク質 3 (NLRP3)、カスパーゼ 1、およびインターロイキン 1 ベータ (IL-1β) の発現が、対照群(NC)マウスよりも有意に高いことを示しました。 一方、高脂肪飼料プラスLactiplantibacillus plantarum NKK20群(NKK20)の経口投与後のこれらの発現は有意に減少しました(P < 0.05)(図2(a)〜2(c))。対照群(NC)と比較して、糖尿病性腎疾患モデル群(DKD)の腎臓組織における炎症誘発性サイトカイン腫瘍壊死因子アルファ (TNF-α) は有意に増加しましたが (P < 0.05)、抗炎症性サイトカイン インターロイキン 10 (IL-10)は有意に減少しました(P < 0.05)(図 2(d)および 2(e))。 糖尿病性腎疾患モデル群(DKD)と比較して、高脂肪飼料プラスLactiplantibacillus plantarum NKK20群(NKK20)では TNF-α 発現が有意に減少しました (P < 0.05)。一方、IL-10 発現は有意に増加しました (P < 0.05)。 |
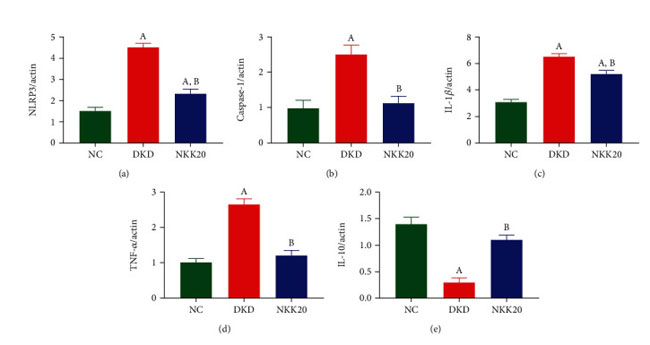 |
図2 マウスの脾臓における炎症因子の発現は、qPCR アッセイによって検出されました。 (a) NLRP3、(b) カスパーゼ-1、(c) IL-1β、(d) TNF-α、および (e) IL-10。 (A) 対照群と比較して、P < 0.05。 (B) 糖尿病性腎疾患モデル群と比較して、P < 0.05。 NC:対照群、DKD:糖尿病性腎疾患モデル群、NKK20:高脂肪飼料プラスLactiplantibacillus plantarum NKK20群 |
| 3.3. 糖尿病マウスのスーパーオキシドジスムターゼ、マロンジアルデヒド、終末糖化生成物、酪酸レベルに対するLactiplantibacillus plantarum NKK20の影響 |
| 糖尿病性腎疾患マウスの血清中の スーパーオキシドジスムターゼ(SOD)含有量は 対照群より有意に低く、糖尿病性腎疾患マウスの血清中の マロンジアルデヒド (MDA)含有量は 対照群より有意に高かった (P < 0.05)。 糖尿病性腎疾患群と比較して、高脂肪飼料プラスLactiplantibacillus plantarum NKK20群の スーパーオキシドジスムターゼ含有量は有意に増加し、マロンジアルデヒド濃度は有意に減少しました(P < 0.05)(図 3(a)および 3(b))。 糖尿病性腎疾患マウスの血清終末糖化生成物濃度は、対照群と比較して有意に高いことが判明しました。 逆に、Lactiplantibacillus plantarum NKK20を経口投与したマウスの血清終末糖化生成物濃度は、糖尿病性腎疾患モデル群と比較して有意な減少を示した(図3(c))。 GC-MS 分析の結果は、糖尿病性腎疾患マウスの糞便酪酸濃度が 対照群よりも有意に低いことを示しましたが、糖尿病性腎疾患マウスの糞便酪酸濃度は、Lactiplantibacillus plantarum NKK20の経口投与後に有意に高かった (P < 0.05) (図 3(d) ) |
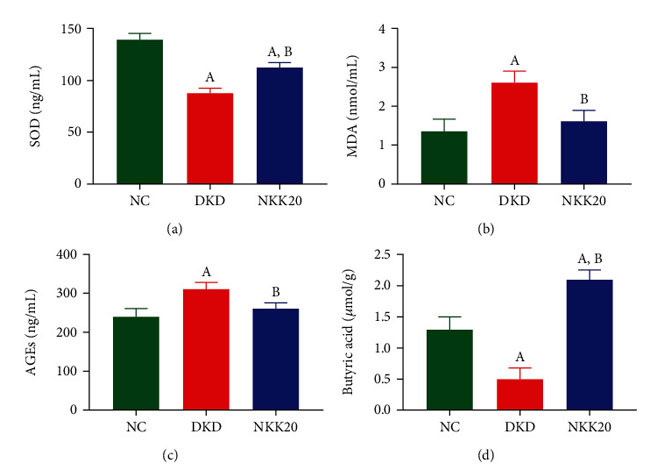 |
図3 糖尿病マウスの血清中の スーパーオキシドジスムターゼ、マロンジアルデヒド、および 終末糖化生成物のレベルと便中の酪酸濃度。 (a) スーパーオキシドジスムターゼ(SOD)含有量、(b) マロンジアルデヒド(MDA)含有量、(c) 終末糖化生成物レベル(AGEs)、(d) 酪酸含有量。 (A) 対照群と比較して、P < 0.05。 (B) 糖尿病性腎疾患モデル群と比較して、P < 0.05。 NC:対照群、DKD:糖尿病性腎疾患モデル群、NKK20:高脂肪飼料プラスLactiplantibacillus plantarum NKK20群 |
| 3.4. 糖尿病マウスの腎損傷に対するLactiplantibacillus plantarum NKK20の効果 |
| ヘマトキシリン・エオシン (H&E) 染色により、対照群のマウスの糸球体と尿細管の形状が規則的であることが示されました。 そして、尿細管の上皮細胞は整然と配置され、完全な形態と均一な細胞質を備えていました。 糖尿病性腎疾患モデル群では、腎尿細管は局所的な変性と萎縮を示し、糸球体基底膜のわずかな肥厚とメサンギウム過形成を伴いました (図 4(a) ~ 4(c))。 重要なのは、Lactiplantibacillus plantarum NKK20介入群では上記の病態が大幅に改善されたことである。 腎臓組織内のコラーゲン線維は、マッソン染色後に青色の色合いを示しました。 特に、糖尿病性腎疾患モデル群は、対照群と比較して、メサンギウム領域および基底膜内の青色領域の大幅な増加を示しました。 逆に、高脂肪飼料プラスLactiplantibacillus plantarum NKK20群は、糖尿病性腎疾患モデル群0時間と比較して、糸球体および尿細管間質内の青色コラーゲンの面積の減少を示しました(P < 0.05)(図4(d)〜4(f))。 |
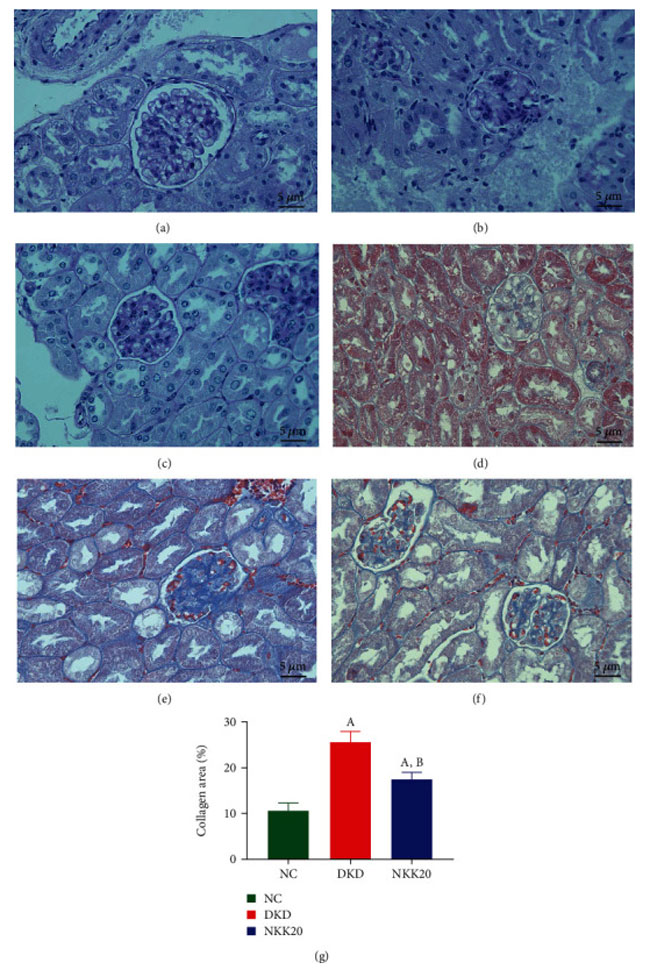 |
| 図4 マウス腎臓組織のヘマトキシリン・エオシン染色 (a ~ c) およびマッソン染色 (d ~ f)。 (a) 対照群、(b) 糖尿病性腎疾患モデル群、(c) 高脂肪飼料プラスLactiplantibacillus plantarum NKK20群、(d) 対照群、(e) 糖尿病性腎疾患モデル群、(f) 高脂肪飼料プラスLactiplantibacillus plantarum NKK20群。 (g) 対照群と比較して、P < 0.05 (A)。 糖尿病性腎疾患モデル群と比較して、P < 0.05 (B)。 NC:対照群、DKD:糖尿病性腎疾患モデル群、NKK20:高脂肪飼料プラスLactiplantibacillus plantarum NKK20群 |
| 3.5. 糖尿病マウスの血清内因性代謝物に対するLactiplantibacillus plantarum NKK20の効果 |
| 各群の血清代謝物を UPLC-Q-TOF-MS で分析し、血清サンプルをネガティブモード (ESI-) でスキャンしたところ、各グループの代謝物含有量に若干の違いが示されました。 各群間の代謝の違いを得るために、多変量統計分析が実行されました。 管理しないで 主成分分析スコアマップは、対照群と 糖尿病性腎疾患モデル群が 2 つのカテゴリーに有意にクラスター化していることを示し (図 5(a))、2 つのグループ間の血清内因性代謝産物に有意な差があることを示しています。 糖尿病性腎疾患モデル群の治療におけるLactiplantibacillus plantarum NKK20の有効性をさらに評価するために、各群で管理して直交部分最小二乗判別分析を行ったところ、マウスの血清代謝プロファイルが対象群と糖尿病性腎疾患モデル群間、およびで高脂肪飼料プラスLactiplantibacillus plantarum NKK20群で大きく分離されていることが判明した。さらに、対照群と高脂肪飼料プラスLactiplantibacillus plantarum NKK20群のマウスの血清のサンプル ポイントは互いに近かったため、Lactiplantibacillus plantarum NKK20が糖尿病性腎疾患モデル群マウスの血清代謝プロファイルに影響を及ぼし、正常なマウスに影響を与える傾向があることが示されました (図 5(b)-5(d) ))。 直交部分最小二乗判別分析は管理された予測モデルです。 ネガティブモードでは、R2X = 0.444、R2Y = 0.915、および Q2 = 0.817 であり、モデルが優れた予測能力を持っていることを示しています。 |
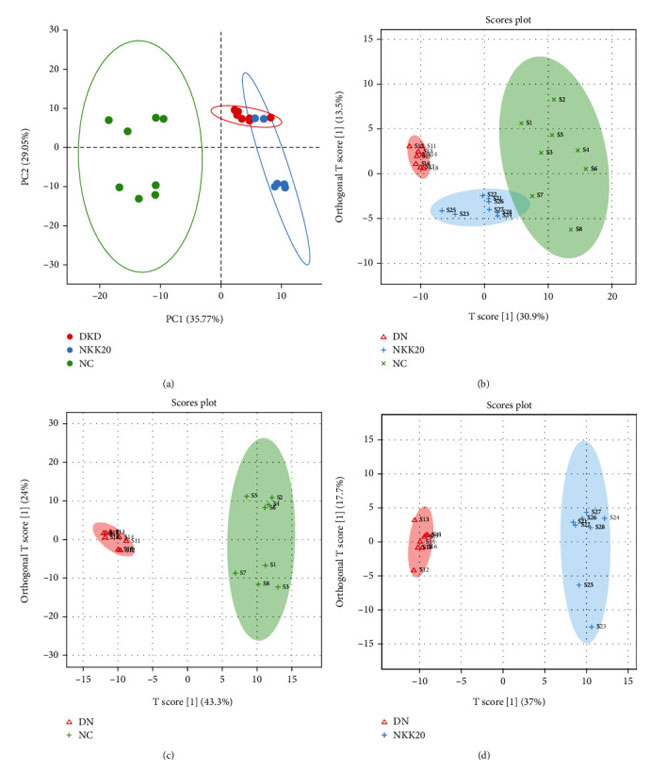 |
図 5 血清の非標的メタボロミクスを主成分分析および直交部分最小二乗判別分析によって分析しました。 (a) 主成分分析および (b–d) 直交部分最小二乗判別分析。 |
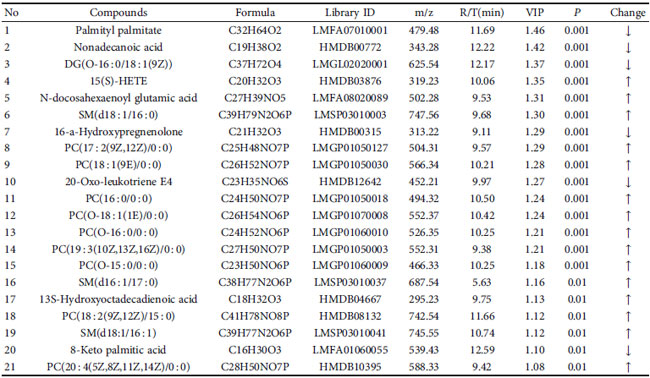
| 潜在的な示差代謝物は、VIP > 1 および P < 0.05 のルール、一次質量分析による正確な m/z、マス プロファイラー プロフェッショナル ソフトウェア ID ブラウザー識別機能および METLIN 代謝物データベースを使用したマッチングを使用してスクリーニングされ、考えられる構造式を探しました。 Human Metabolome Database (http://www.hmdb.ca/) や KEGG (https://www.kegg.jp/kegg/) などのオンラインデータベースとの分子式マッチングも可能です。 次に、二次断片化情報を、MassBank (http://www.massbank.jp/) および ChemSpider (https://www.chemspider.com/) データベースの断片化情報および文献と比較し、代謝物を同定しました。 最後に、対照群と糖尿病性腎疾患モデル群の間で 16 個の血清潜在的バイオマーカーが選択され (表 2)、糖尿病性腎疾患モデル群と高脂肪飼料プラスLactiplantibacillus plantarum NKK20群間で 24 個の血清潜在的バイオマーカーが選択されました (表 3 および図 6)。 MetPAを使用した代謝経路の分析 (https://www.metaboanalyst.ca/) MetPA は主に KEGG 代謝経路と HMDB データベースに基づいており、経路強化分析とトポロジー分析の結果と組み合わせて、実験に最も関連性の高い代謝経路を選択します。MetPA を使用して、グリセロリン脂質代謝経路、アラキドン酸代謝経路、リノール酸代謝経路を含む合計 3 つの関連代謝経路が選択されました (図 7)。 |
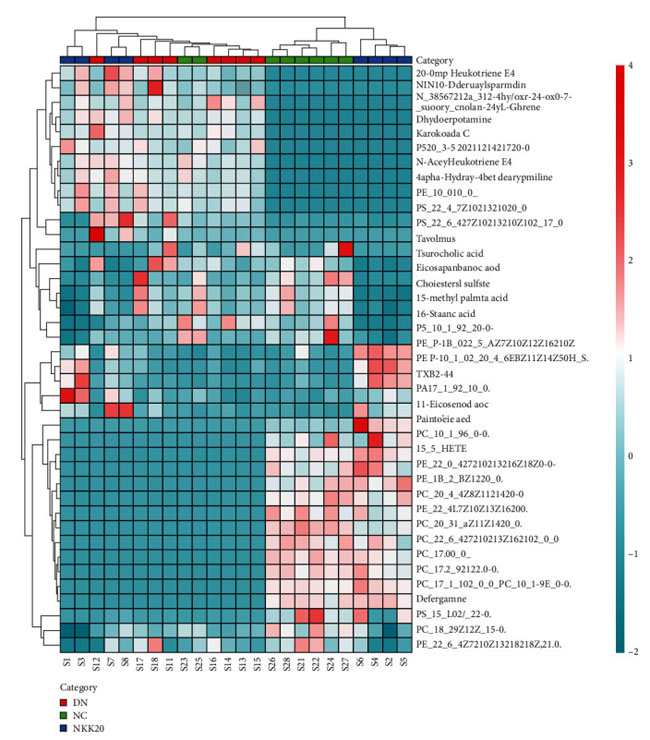 |
図 6 マウス血清代謝物クラスターのヒート マップ。 NC:対照群、DN:糖尿病性腎疾患モデル群、NKK20:高脂肪飼料プラスLactiplantibacillus plantarum NKK20群 |
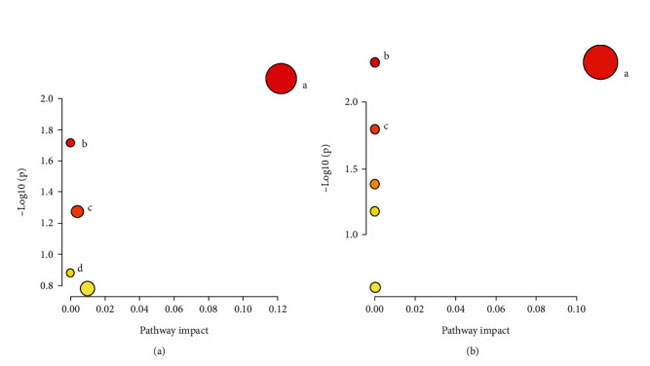 |
図 7 代謝経路の濃縮マップ。 (a) 対照群 vs. 糖尿病性腎疾患モデル群。 (b) 糖尿病性腎疾患モデル群vs. 高脂肪飼料プラスLactiplantibacillus plantarum NKK20群。 (a) グリセロールリン脂質代謝経路 (A); リノール酸代謝経路 (B); グリコシルホスファチジルイノシトール (GPI) アンカー生合成経路 (C); アラキドン酸代謝経路 (D)。 (b) グリセロールリン脂質代謝経路 (A)。 アラキドン酸代謝経路 (B); リノール酸代謝経路 (C)。 |
| 表 2 対照群と 糖尿病性腎疾患モデル群間の潜在的な差動代謝物 |
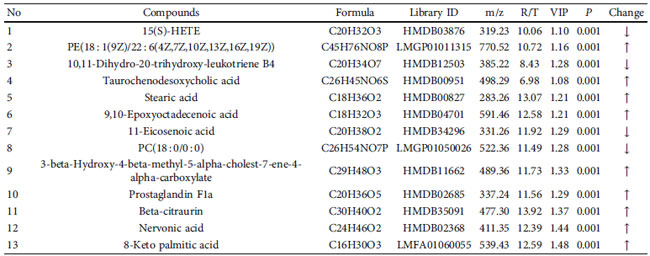 |
| 表 3 糖尿病性腎疾患モデル群と高脂肪飼料プラスLactiplantibacillus plantarum NKK20群間の潜在的な差次的代謝物 |
 |
| 3.6. 酪酸ナトリウムはタイトジャンクションタンパク質の発現を上方制御し、ヒト腎臓-2 細胞の線維化を抑制します |
| ヒト腎臓-2 細胞における密着結合タンパク質 ZO-1 およびオクルディンの mRNA 発現を qPCR によって測定しました。 対照群と比較して、終末糖化生成物群では ZO-1 とオクルディンの mRNA 発現が有意に減少しました (P < 0.05)。 そして、3つの濃度の酪酸ナトリウムでの処理後、ZO-1およびオクルディンのmRNA発現は、終末糖化生成物群と比較して有意に高かった(P<0.05)(図8)。 α-SMA および E-カドヘリンの発現は、ヒト腎臓-2 細胞におけるウェスタンブロッティングによって測定されました。 対照群と比較して、終末糖化生成物刺激により α-SMA 発現が有意に増加し、E-カドヘリン発現が減少しました (P < 0.05)。 終末糖化生成物群と比較して、酪酸ナトリウム処理の 3 つの濃度すべてが α-SMA 発現を有意に阻害し (P < 0.05)、終末糖化生成物+高用量酪酸ナトリウム(400 μmol/L)群の細胞のみが E-カドヘリン発現を有意に増加させました (P < 0.05) (図 9)。 |
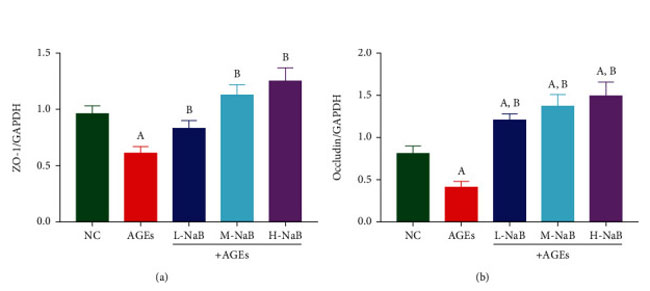 |
図8 ヒト細胞-2細胞におけるZO-1およびオクルディンの発現をqPCRによって測定した。 (a) ZO1 mRNA レベル。 (b) オクルディン mRNA レベル。 (A) 対照群と比較して、P < 0.05; (B) 終末糖化生成群と比較した場合、P < 0.05。 NC::対照群、AGEs:終末糖化生成物、L-NaB:低用量酪酸ナトリウム(100 μmol/L)群、M-NaB:中用量酪酸ナトリウム(200 μmol/L)群、H-NaB:高用量酪酸ナトリウム(400 μmol/L)群 |
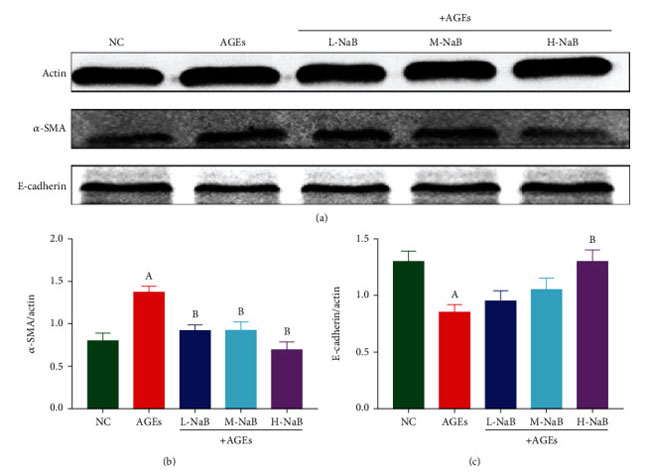 |
図9 ヒト腎臓-2細胞におけるα-SMAおよびE-カドヘリンの発現をウエスタンブロッティングアッセイにより測定した。 (a) タンパク質の変化。 (b) α-SMA。 (c) E-カドヘリン。 (A) 対照群と比較して、P < 0.05; (B) 終末糖化生成物群と比較した場合、P < 0.05。 NC::対照群、AGEs:終末糖化生成物、L-NaB:低用量酪酸ナトリウム(100 μmol/L)群、M-NaB:中用量酪酸ナトリウム(200 μmol/L)群、H-NaB:高用量酪酸ナトリウム(400 μmol/L)群 |
| 3.7. 酪酸ナトリウムは ヒト腎臓-2 細胞におけるPI3K- Akt シグナル伝達経路の活性化を阻害します |
| PI3K- Akt シグナル伝達経路のリン酸化は、ウェスタンブロッティング アッセイによって検出されました。 対照群と比較して、終末糖化生成物群では p-Akt のタンパク質発現が有意に増加しました (P < 0.05)。 そして、高用量酪酸ナトリウム(400 μmol/L)での処理後、p-Aktのタンパク質発現は、終末糖化生成物群と比較して有意に低かった(P<0.05)(図10(a)及び10(b))。 対照群と比較して、p-PI3K のタンパク質発現は終末糖化生成物群で有意に増加しました (P < 0.05)。 そして、高用量酪酸ナトリウム(400 μmol/L)での処理後、p-PI3Kのタンパク質発現は、終末糖化生成物群と比較して有意に低かった(P < 0.05)(図10(a)及び10(c))。 |
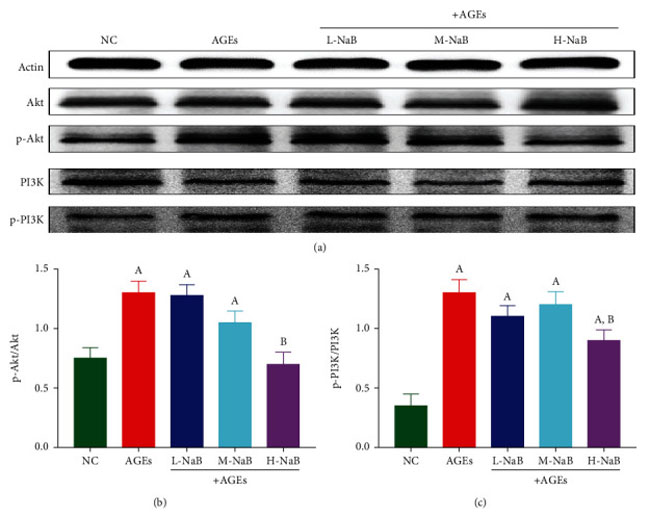 |
図10 ヒト腎臓-2細胞におけるPI3K- Aktシグナル伝達経路の発現をウエスタンブロッティング分析によって測定した。 (a) タンパク質の変化。 (b) p-Akt/Akt。 (c) p-PI3K/PI3K。 (A) 対照群と比較して、P < 0.05; (B) 終末糖化生成物群と比較した場合、P < 0.05。 NC::対照群、AGEs:終末糖化生成物、L-NaB:低用量酪酸ナトリウム(100 μmol/L)群、M-NaB:中用量酪酸ナトリウム(200 μmol/L)群、H-NaB:高用量酪酸ナトリウム(400 μmol/L)群 |
| 4.討議 |
| 糖尿病性腎疾患は糖尿病性微小血管合併症の 1 つです。 糖尿病患者の体内の持続的な高血糖は、一部の組織や器官の代謝異常を引き起こし、機能不全や形態学的変化を引き起こし、糖尿病の最も一般的な合併症の 1 つである糖尿病の慢性合併症を引き起こす可能性があります [24、25]。 現在、比較的受け入れられている糖尿病性腎症の病因仮説は、非酵素的糖化学です。つまり、長期の高血糖下では、グルコース分子が生体内でタンパク質と非酵素的グリコシル化反応を起こし、不可逆的な終末糖化生成物を形成し、これが腎障害の発生につながります [26] -28]。 同時に、グリコシル化プロセスを阻害することで糖尿病性腎症などの合併症の進行を大幅に抑制できることも研究で確認されています[29-31]。 |
| 腸内細菌叢の不均衡は、肥満、インスリン抵抗性、糖尿病、腸疾患、心血管代謝性疾患の直接の原因です[32-34]。 最近、腸内細菌叢の変化も 糖尿病性腎疾患の発症に重要な役割を果たしている可能性があることが認識されていますが、具体的なメカニズムは解明されておらず、腸内細菌叢を標的とした治療法は 糖尿病性腎疾患に対する戦略の新しいアプローチと考えられています [35] 。 臨床研究では、食物繊維の摂取不足と加工炭水化物の多量摂取が糖尿病の主な危険因子であり、食物繊維の摂取は糖尿病のリスクと負の相関があることが示されています[36、37]。 ヒトを対象とした介入研究では、食物繊維と全粒穀物の摂取量を増やすと腸内微生物の多様性が強化され、宿主の免疫反応と恒常性の調節に役立つだけでなく、エネルギー代謝にも関与することが示されている[38]。 人体によって消化できない食物繊維は、結腸内の特定の嫌気性微生物によって発酵させることができ、短鎖脂肪酸は主な発酵産物です [39]。 短鎖脂肪酸は炭素原子数が 6 未満の脂肪酸の一種で、ギ酸 (C1)、酢酸 (C2)、プロピオン酸 (C3)、酪酸 (C4)、吉草酸 (C5) が含まれますが、その総量は 腸内の酢酸、プロピオン酸、酪酸は全短鎖脂肪酸の 95% 以上を占め、その中で酪酸が最も強い抗炎症作用を持っています。 酢酸はアセチル-CoA経路を介してピルビン酸から形成され、プロピオン酸は主にコハク酸経路を介してコハク酸から、またはアクリル酸経路を介して乳酸から形成され、酢酸塩と乳酸塩と同様に酪酸は主にアセチル-CoAとブチリル-CoAから形成されます [40, 41]。 |
| 酪酸塩は、胚性幹細胞の膵臓の初期発達を調節する遺伝子を活性化し、島β細胞(訳者注:ベータ細胞は、血液中のグルコースのレベルを制御するホルモンであるインスリンを生成する細胞)の分化を促進します。 インスリンコード遺伝子の発現は、膵島β細胞の分化を促進します。インスリンコード遺伝子の発現は、膵島β細胞のアポトーシスを阻害し、p38/ERK MAPK シグナル伝達経路を通じて糖尿病ラットのグルコース恒常性を改善します [42、43]。 一部の学者は、酪酸塩が2 型糖尿病の治療に最も有望な化学物質である可能性があると信じています [44]。 私たちの研究では、Lactiplantibacillus plantarum NKK20がマウスの便中の酪酸濃度を大幅に増加させ、マウスの脾臓におけるNLRP3インフラマソームの活性化とTNF-αおよび他の炎症誘発性サイトカインの分泌を大幅に阻害し、マウスの酸化ストレス反応、糖尿病マウスと腎臓組織の炎症性損傷および線維化を阻害する可能性があることが示されました。 酪酸塩は不快な臭いがあるため、人間の食事に添加することはできませんが、Lactiplantibacillus plantarum を経口投与することで腸内での酪酸塩の生成を増加させることは完全に可能です。 |
| さらなるメタボロミクス研究により、Lactiplantibacillus plantarum NKK20がグリセリンリン脂質代謝とアラキドン酸代謝を調節することにより糖尿病性腎障害を抑制できることが示されました。 糖尿病性腎症の本質は慢性炎症です[45、46]。 グリセロリン脂質の代謝とアラキドン酸の代謝は炎症と密接に関係しています[47-50]。 炎症は人間のあらゆる種類の病気において最も一般的な病理学的プロセスの 1 つであり、炎症は脂質代謝障害を引き起こす可能性があります [51、52]。 脂質は生物のエネルギー供給者であり、多くの生命活動に関与し、細胞膜構造の維持、エネルギー貯蔵、シグナル伝達、キャリアなどの非常に重要な生理学的機能を持っています[53、54]。 グリセリンリン脂質は細胞膜リン脂質の主要物質であり、脂質分子の約60%を占めます。 これらはさまざまな生物学的機能を有しており、その代謝ネットワークの障害は、冠状動脈性心疾患、アテローム性動脈硬化症、糖尿病、肥満、癌、脳損傷、痛みと炎症、アルツハイマー病などのさまざまな病気を引き起こす可能性があります[55]。 グリセロリン脂質の分子組成の動的な変化を系統的に研究することは、疾患発症の分子機構を説明するのに役立ちます [56、57]。 アラキドン酸は、脂質物質中のグリセロールリン脂質の代謝に由来する脂肪酸脂質成分です。 炎症や腫瘍などの病理学的条件下では、膜リン脂質はホスホリパーゼ A2 の作用によりアラキドン酸の放出を促進します [58]。 体内のグリセロリン脂質が過剰になると、インスリン抵抗性や2 型糖尿病に関連する ER ストレス(訳者注:小胞体(Endoplasmic Reticulum:ER)ストレスは、変性タンパク質やミスフォールドタンパク質が小胞体に蓄積し、これをPERK、IRE1、およびATF6などの様々なセンサータンパク質が検出することによって起こります)が誘発される可能性があります [59]。 体内で過剰なグリセロリン脂質がグリコシル化されると、高血糖状態での酸化感受性が高まり、活性酸素種の生成が増加し、体内で炎症や糖尿病性腎症がさらに誘発されます[58]。 この研究では、Lactiplantibacillus plantarum NKK20が血清中のさまざまなグリセロ脂質の含有量を大幅に減少させることができ、これが糖尿病性腎障害の改善に関連している可能性があることを発見しました。 |
| Lactiplantibacillus plantarum NKK20株の経口投与により、糖尿病性腎症マウスの結腸における酪酸の産生が有意に増加したという事実に基づいて、我々はさらにin vitroでヒト腎臓-2細胞を培養し、酪酸による腎障害と線維化の抑制機構を調べた。 私たちの結果は、酪酸が密着結合タンパク質 ZO-1 およびオクルディンの発現を増加させ、ヒト腎臓-2 細胞の線維化レベルを改善し、PI3K/Akt シグナル伝達経路のリン酸化を阻害する可能性があることを示しています。 脂質キナーゼとしても知られる PI3K は、原形質膜へのセカンドメッセンジャーとしての Akt の移行を制御するために PIP3 を生成します [60]。 PI3K/Akt シグナル伝達経路は、糖尿病性腎症の発生と発症において重要な制御的役割を果たしており、PI3K/Akt 経路は糖尿病状態下の尿細管細胞で活性化される [61]。 我々は、PI3K/Aktシグナル伝達経路の活性化の阻害が、酪酸塩が糖尿病性腎障害を改善するメカニズムの1つである可能性があると推測しているが、これについてはさらなる研究が必要である。 |
| 本研究の限界は、マウスモデルにおけるLactiplantibacillus plantarum NKK20の糖尿病性腎疾患の改善に関与する酪酸が同定されていないことである。 したがって、糖尿病性腎疾患に対する酪酸の決定的な役割には、さらなる研究が必要です。 パターン認識受容体としてのトール様受容体(TLR)は、炎症誘発プロセスにおいて重要な役割を果たしており、IL-1βおよびTNF-αはトール様受容体シグナル伝達の主な下流標的である[62、63]。 酪酸産生Lactiplantibacillus plantarum NKK20によるトール様受容体不活性化は、糖尿病性腎疾患の改善に起因すると考えられます。 ただし、この仮説にはさらなる調査が必要です。 |
| 5.結論 |
| 要約すると、Lactiplantibacillus plantarum NKK20は、糖尿病性腎疾患マウスモデルにおいて腎損傷と線維症、酸化ストレス、炎症反応を軽減しました。 さらに、グリセロリン脂質の代謝とアラキドン酸の代謝が変化し、酪酸濃度が増加しました。 さらに、終末糖化生成物刺激 ヒト腎臓-2 細胞モデルでは、酪酸はタイトジャンクションを維持し、終末糖化生成物によって誘導される腎細胞線維症と PI3K-Akt 活性化を阻害します。 私たちの研究は、Lactiplantibacillus plantarum NKK20によって引き起こされる酪酸の増加が糖尿病性腎疾患の発症を軽減するための重要なメカニズムである可能性があり、Lactiplantibacillus plantarum NKK20が糖尿病性腎疾患の治療と予防のための潜在的なプロバイオティクスとして使用できる可能性があることを示しています。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、J Diabetes Res. 2023; 2023: 8810106.に掲載されたLactiplantibacillus plantarum NKK20 Increases Intestinal Butyrate Production and Inhibits Type 2 Diabetic Kidney Injury through PI3K/Akt Pathway. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


