ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
心血管疾患に対する潜在的なプロバイオティクス Lactiplantibacillus plantarumのメカニズムとその発酵食品の最近の発展 |
Zhe Wang, et al., |
|
|
| 要約 |
心血管疾患(CVD)は世界中で主な死因となっています。 最近の多くの研究では、Lactiplantibacillus plantarum (Lb. plantarum) には心血管疾患のリスクを軽減する大きな可能性があることが指摘されています。 Lb. plantarumは、発酵食品や人間の腸管に広く分布している乳酸菌の一種で、その一部の菌株は人間の健康に重要な影響を及ぼし、プロバイオティクスに発展する可能性がある。 このレビューでは、Lb. plantarumの潜在的なプロバイオティクス株の心血管疾患に対するメカニズムを要約します。 分子レベル、細胞レベル、集団レベルで体の代謝を調節し、それによって血糖値と血中脂質を低下させ、血圧を調節し、最終的には心血管疾患の発生率を減らすことができます。 さらに、Lb. plantarum は食品業界で広く利用されており、心血管疾患と戦うための発酵食品における最も重要な新開発のいくつかに焦点を当てます。 これらの発酵食品についての洞察を提供することは、科学者がこれらの食品の品質を改善し、患者の心血管疾患症状を軽減するのに役立ちます。 将来的には、Lb. plantarumで発酵させた機能性食品が開発され、毎日の食事に取り入れられ、薬物による心血管疾患のある程度の軽減と健康維持に役立つことを期待しています。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. Lb. plantarumのプロバイオティクスの可能性とそれを発酵させた食品 |
| 3. 心血管疾患に対するLb. plantarumの考えられるメカニズム |
| 3.1. Lb. plantarumによる抗酸化能力のメカニズム |
| 3.2. Lb. plantarumによる血圧低下のメカニズム |
| 3.3. Lb. plantarumによる脂質低下のメカニズム |
| 3.3.1. シグナル伝達経路を介してコレステロールを下げる |
| 3.3.2. 胆汁酸を通じてコレステロールを下げる |
| 3.3.3. 腸内細菌叢を通じてコレステロールを下げる |
| 3.3.4. 共役リノール酸イソメラーゼによるコレステロールの低下 |
| 3.4. Lb. plantarumによる血糖低下のメカニズム |
| 4. Lb. plantarum発酵食品の最近の発展 |
| 4.1. 抗酸化機能のある発酵食品 |
| 4.2. コレステロールを下げる機能のある発酵食品 |
| 4.3. 血圧を下げる機能のある発酵食品 |
| 4.4. 血糖降下作用のある発酵食品 |
| 4.5. Lb. plantarumのその他の用途 |
| 5.結論 |
本文 |
| 1.はじめに |
| 現代社会の発展に伴い、心血管疾患はさらに蔓延し、複雑化しています。 心血管疾患は慢性疾患の最大の原因の 1 つであり、2019 年には世界で推定 1,790 万人が心血管疾患により死亡しています [1]。 また、心血管疾患は2018年の中国の主な死因であり、農村部と都市部ではそれぞれ全死亡者の46.66%と43.81%を占めていたと報告されている[2]。 また、50 歳以上の成人では心血管疾患の発生率が低下しているにもかかわらず、過去 20 年間、西欧諸国の若年成人 (18 ~ 50 歳) では心血管疾患の発生率が安定しているか増加しています [3]。 したがって、高齢者だけでなく若者も心臓血管の健康を重視する必要があります。 |
| 図 1 に示すように、心臓血管の健康に影響を与える要因は複雑かつ複数です。 病気、症候群、個人のライフスタイル、生活条件はすべて、心臓血管の健康に影響を与えます。 心血管疾患は、糖尿病などの特定の病気で最も一般的な合併症であり、現在では糖尿病患者の主な死因となっています [4]。 一方、2022 年の再検討研究 [5] によると、高血圧や脂質異常症などの症候群は人々にとって重要な心血管疾患危険因子です。 さらに、定期的な果物の摂取、飲酒量の減少、禁煙などの健康的なライフスタイルを遵守することで、心血管疾患の全体的な発生率を統計的に有意に 66% 減少させる可能性があります [6]。 差別、社会的孤立、社会経済的地位の低さなど、さまざまな種類の環境ストレス要因は、神経造血軸やエピジェネティックな修飾など、さまざまな経路を通じて個人の生物学を変化させる可能性があります。 これは慢性炎症を引き起こし、最終的には心血管疾患の発症と進行をもたらします [7]。 科学者たちはまた、有害廃棄物に継続的にさらされている人々は高血圧になる傾向があることも発見しています[8]。 その結果、心血管疾患のリスクを軽減する方法を見つけることは、今日の現代人の生活における健康関連の重要なテーマとなっています。 |
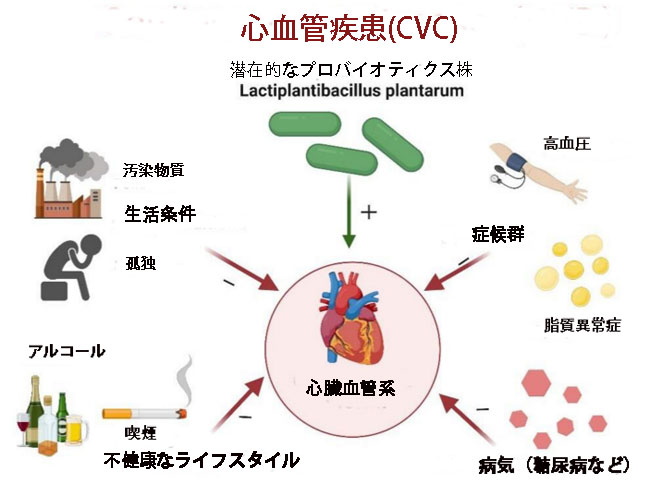 |
| 図 1 心血管の健康に対するさまざまな要因の影響 |
| 心血管疾患を引き起こす原因は主に多くありますが、乳酸菌の一種であるLactiplantibacillus plantarum(Lb. plantarum)の潜在的なプロバイオティクス株には、心血管系を保護する能力がある可能性があります。 (「−」はこの因子が心血管系の健康に有害であることを意味し、「+」はこの因子が心血管系の健康を促進することを意味します) (Biorender.com で作成)。 |
| このような状況では、新たな効果的な医薬品の緊急の必要性に加えて、プロバイオティクスおよびプロバイオティクス食品の開発も、心血管疾患から人々を守る潜在的な方法となっています。 プロバイオティクスは、「適切な量で投与すると宿主に健康上の利益をもたらす生きた微生物」と定義されています[9]。 Lactobacillus spp は、その一般的なプロバイオティクス特性のため、プロバイオティクスであると広く考えられています [10]。 Lactiplantibacillus plantarum (Lb. plantarum) は、Lactobacillus spp.の種の一種であり、潜在的にプロバイオティクス株であると考えられています。 一部の Lb. plantarum 株は、血糖、脂質、血圧のバランスを維持し、代謝障害を調節するのに役立ち [11]、抗心血管作用を持っています。 プロバイオティクスを人間の胃腸管に入れるには、通常カプセルや食品を含む担体の使用が必要ですが、後者の方がカプセル化技術よりも受け入れられやすく、マーケティングも容易です。 発酵はプロバイオティクス食品を生産する効果的な方法です。 プロバイオティクスの可能性を秘めたLb. plantarumは、乳製品、肉製品、野菜や果物、シリアルなどのさまざまな食品の発酵菌株として使用できます。 いくつかの研究では、Lb .plantarumで発酵させた食品には、より優れた抗酸化能力やより高い活性物質含有量など、より高い健康上の利点があることが示されています [12,13]。 さらに、科学者らは、Lb .plantarum発酵食品にも特定のプロバイオティクス効果が備わっている可能性があり、毎日の栄養補助食品を通じて人間の健康に役立つプロバイオティクス機能性食品に開発される可能性があることも発見しました。 |
| このレビューは、Lb. plantarumのプロバイオティクスの可能性を示し、Lb .plantarumが心血管疾患の状態を予防または改善できる可能性のあるメカニズムを分析します。さらに、このレビューは、Lb. plantarum発酵食品がプロバイオティクス機能性食品として開発される大きな可能性に特に焦点を当てており、これらの発酵食品が科学者たちの品質向上と最終的には患者の心血管疾患 症状の軽減にどのように役立つかについての洞察を提供します。 |
| 2. Lb. plantarumのプロバイオティクスの可能性とそれを発酵させた食品 |
| Lb. plantarumは、プロバイオティクスであると広く考えられているLactobacillus属に属しており、種の分析からプロバイオティクスの可能性がある可能性があります。 しかし、プロバイオティクスが宿主の胃腸管内で機能するための前提条件は、胃酸、胆汁酸塩、分解酵素などの好ましくない因子に対する良好な耐性と、胃腸管内で完全に定着する能力である[14]。 したがって、Lb. plantarumは、プロバイオティクスとしての開発の基本要件を満たすために、高い胃腸生存率を持っていなければなりません。 Kriti Ghatani と Buddhiman Tamang [15] は、発酵ヤク乳製品から Lb. plantarum株を単離し、MRS ブロスにコレステロールと胆汁酸塩を添加して、選択した株の耐性を測定しました。 耐酸性、胆汁酸塩ヒドロラーゼ活性、および細胞表面疎水性と組み合わせることで、このLb .plantarum株がヒトにおける胃酸および胆汁の腐食性および毒性作用に耐性があり、宿主細胞に接着してコロニー形成を完了できることが確認されました。 Wang, G.Q. Chen, Y.ら[16]は、Lb. plantarumの経口投与後のさまざまな時点でマウスの腸の画像を記録し、Lb. plantarum AR17-1が腸管に定着して役割を果たすことができることを確認し、Lb.plantarumが潜在的プロバイオティクスを持っていることを示唆しています。 |
| Lb .plantarumが人体に入るキャリアとして、生存数が多いLb .plantarum発酵食品は、人体内で健康的な役割を果たすことができるプロバイオティクス食品に開発される可能性があります。 しかし、これらの発酵食品がプロバイオティクス食品として機能するかどうかは、食品中のプロバイオティクス細菌の胃腸内での生存にも依存します。 異なる食物マトリックスも、Lb .plantarumの胃腸生存率に大きな影響を与えます。 最も広く使用されているマトリックスは、ヨーグルト、チーズなどの乳製品です。 乳製品に含まれる脂肪とホエータンパク質の含有量が高いと、胃酸に対する緩衝能力が向上し、プロバイオティクスの胃腸生存率が向上する可能性があります[17,18]。 さらに、果物や野菜のジュース、オーツ麦やシリアル、肉製品などの他の発酵食品も、人間の胃腸管にプロバイオティクスをもたらす発酵食品を作るための食品マトリックスとして一般的に使用されています。 肉製品に含まれる脂肪は、低 pH や胆汁酸塩からプロバイオティクスを保護します [18]。 穀物の糖分が多いと、プロバイオティクスが腸の状態によく耐えることができます[19]。 また、果物や野菜のジュースは消化時間が比較的短いため、プロバイオティクスに対する胃内環境の悪影響を大幅に軽減できます[20、21]。 プロバイオティクスの可能性がある現在のLb .plantarum発酵食品には、乳製品、肉製品、大豆製品、果物と野菜、シリアルが含まれます。 ここでは、Lb .plantarumの胃腸での生存率が高い。 しかし、プロバイオティクスの胃腸生存率に対する食品マトリックスの影響に関する研究はまだ比較的少なく、将来的にはこれに焦点を当てた研究が増えることが期待されています。 |
| 3. 心血管疾患に対するLb. plantarumの考えられるメカニズム |
| 3.1. Lb. plantarumによる抗酸化能力のメカニズム |
| 研究では、フリーラジカルの生成が心血管疾患の発症に関連付けられています。 Lb.plantarumのいくつかの菌株は、フリーラジカルを除去することによって抗酸化能力を達成することが実証されています。 したがって、抗酸化能力を持つ Lb. plantarum 株には心血管疾患を軽減する可能性があると我々は推測しています [22]。 |
| Lb. plantarumの抗酸化メカニズムは複雑かつ多様です。 例えば、Lb. plantarum JM113 は、Nrf2 (内因性抗酸化システムを制御するタンパク質) とその対応する下流 HO-1 遺伝子 (HO-1、主にヘムから第一鉄、一酸化炭素、 および胆汁緑)抗酸化を達成します[23]。 Lb .plantarum KCCP11226は、抗酸化能力を持つC-30カロテノイド4,4'-ジアポニューロスポレンを生成できます[24,25,26]。 Lb. plantarum DM5は、スーパーオキシドアニオンラジカル、ヒドロキシルラジカル、DPPHラジカルを直接除去することが報告されています[27,28]。 Lb. plantarumの抗酸化活性のさらなるメカニズムを表1に示します。 |
 |
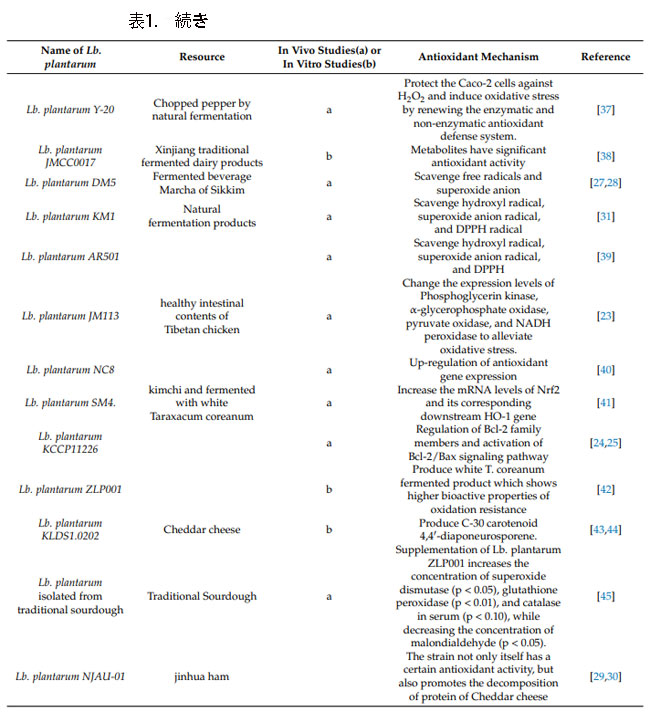 |
| 一方、単一のLb. plantarumには、いくつかの異なる抗酸化メカニズムがある可能性があります。 例えば、Lb. plantarum NJAU-01は、代謝経路におけるタンパク質発現を調節することにより酸化ストレスを軽減し、酸化ストレスから身体を保護するだけでなく、腸内細菌叢の組成も調節します。 さらに、その抽出物は強力な抗酸化能力も示しています[29,30]。 |
| さらに、Lb. plantarumの抗酸化能力と抗酸化メカニズムは、いくつかの環境条件や他の菌株との相互作用によって影響を受ける可能性があります。 例えば、過酸化水素 (H2O2) は腸内細菌叢の組成を調節する拮抗因子の 1 つであり、H2O2 によって刺激されると、Lb. plantarum KM1の酸化還元バランスが破壊され、その結果、α-グリセロリン酸オキシダーゼとピルビン酸オキシダーゼの発現が下方制御されます。 細菌内での H2O2 生成が減少し、抗酸化効果が得られます [31]。 |
| Lb. plantarumの抗酸化機能は動物実験で証明されており、Lb. plantarumのいくつかの株がマウスで安定した抗酸化作用を発揮します[32、33]。 例えば、Yan, L.ら[34]の実験では、特定の用量のLb. plantarum FEED8溶液と対応する用量のスキムミルクが2つのグループのマウスに胃内投与された。 抗酸化効果は、マウスの血清、脳、肝臓中のスーパーオキシドジスムターゼ(SOD)活性、グルタチオンペルオキシダーゼ(GSH-Px)活性、総抗酸化能力(T-AOC)含有量、およびマロンアルデヒド(MDA)含有量を検出することによって評価されました。 その結果、対照群と比較して、中用量および高用量のLb. plantarum FEED8群のマウスの血清、脳、および肝臓中のスーパーオキシドジスムターゼ活性、グルタチオンペルオキシダーゼ活性、および総抗酸化能力有量が有意に増加し、マロンアルデヒド含有量は大幅に減少したことが示されました。 この差は、Lb. plantarum FEED8 の濃度が増加するにつれて増大しました。 Lb. plantarum FEED8はマウスに対して優れた抗酸化効果があると結論付けることができます。 これは、Lb. plantarumが人間に対して抗酸化作用を発揮できるかどうかを示すものです。 |
| 3.2. Lb. plantarumによる血圧低下のメカニズム |
| 高血圧は、収縮期血圧 (BP) ≥130 mmHg および/または拡張期血圧 ≥80 mmHg [46] として定義され、近年さらに蔓延しています。 高ナトリウム食、低カリウム摂取、アルコール摂取、過体重状態、運動不足などの不健康なライフスタイルの増加により、高血圧は現在、心血管疾患の主な原因となっている[47]。 M. H. Forouzanfarら[48]が作成した統計によると、2015年には高血圧が原因で780万人(全死亡者の14.0%)が死亡した。 アンジオテンシン変換酵素 (ACE) は血圧の調節に大きく貢献します。 2002 年に Eriksson が行った研究 [49] によると、アンジオテンシン変換酵素は血管収縮を引き起こす可能性があるアンジオテンシンの産生を促進するため、アンジオテンシン変換酵素活性の上昇に伴い血圧が上昇します。 最近、Lb. plantarumで発酵させた食品が患者の血圧を下げるのに役立つ可能性があることがいくつかの研究で示されています。 システマティックレビューとメタアナリシスの結果、著者らは高血圧患者がLb. plantarumサプリメントを摂取すると、拡張期血圧が正常な人と比べて大幅に低下したことを発見した[50]。 Chen et al [51] によると、L. plantarum 69 で発酵させたヤギミルクはアンジオテンシン変換酵素活性を阻害する可能性があり、阻害率の計算値は 88.91% に達しました。 これらの機能性食品のアンジオテンシン変換酵素活性に対する阻害能力に関するその他の知見を表 2 に示します。 |
 |
| 潜在的にプロバイオティクスであるLb. plantarum株の特異的なタンパク質分解システムが、アンジオテンシン変換酵素活性の阻害の主な理由である可能性がある[52]。 Fabiola Sanchez-Lopez et al [53] によると、Lb. plantarum によるアマランサスタンパク質の 8 時間の加水分解後に得られた生成物は、良好な アンジオテンシン変換酵素阻害 (ACEI) 活性を示しました。 これらの加水分解物は、その化学的本質が主にペプチドであり、Zn2+ をキレート化して、最終的に アンジオテンシン変換酵素の活性を低下させる可能性があります。 さらに、Yi-Yen Liuら[54]は、豆乳から抽出されたある種の生理活性アンジオテンシン変換酵素阻害ペプチドが、Lb .plantarum TWK10で発酵させた後、一酸化窒素の生成を促進できる可能性があると報告した。 細胞内の一酸化窒素レベルが増加すると、血管が弛緩し、高血圧のさらなる改善に貢献します。 Nahariah, N.ら[55]は、Lb. plantarum FNCC 0027で18時間発酵させた卵白にはアンジオテンシン変換酵素阻害ペプチドが豊富に含まれていることを報告した。 しかし、発酵期間が長くなると (24、30、および 36 時間)、発酵卵白中のアンジオテンシン変換酵素阻害ペプチドの活性が低下しました。 さらに、Shu, Guowei [56] は、ある種の牛乳が発酵してアンジオテンシン変換酵素阻害ペプチド活性を誘導するのに最適な温度は 35 °C であると報告しました。 一方、これらの機能性食品には消化酵素も大きな影響を与えています。 ペプシンやキモトリプシンなどの消化酵素がこれらのアンジオテンシン変換酵素阻害ペプチドを破壊する可能性がある場合、これらの機能性食品の利点はほとんどありません。 Yanan Xiaら[57]によると、Lb.plantarum QS670で発酵させた牛乳の乳清タンパク質から単離されたアンジオテンシン変換酵素阻害ペプチドは、キモトリプシン、ペプシン、およびトリプシンに対して安定性を示しました。 これは、発酵乳が高血圧の症状を軽減する機能性食品として使用できる可能性があることを意味します。Lb. plantarumがアンジオテンシン変換酵素活性を低下させ、血圧を下げるメカニズムを図2に示します。 ただし、消化酵素の影響は、in vitro 試験では研究者によって見落とされる場合があるため、この種の実験の結果の一部は in vivo 試験を通じてさらに詳しく説明される予定です。 |
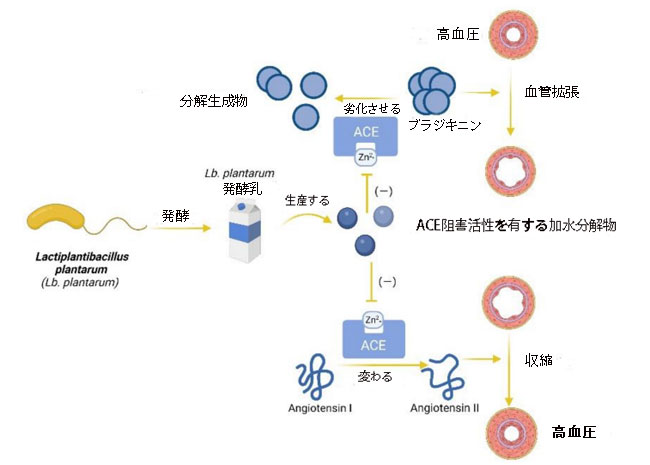 |
| 図2 Lactiplantibacillus plantarum発酵食品による血圧降下メカニズム。 Lactiplantibacillus plantarum (Lb. plantarum) 発酵食品は、アンジオテンシン変換酵素 (ACE) 阻害剤を生成することができ、ブラジキニンの分解とアンジオテンシン I の変換を防ぎ、高血圧の症状を緩和します。 (「−」は阻害を意味します) (Biorender.com で作成)。 |
| 一方、非タンパク質アミノ酸であるγ-アミノ酪酸 (GABA) は降圧剤として作用します。 いくつかの研究では、γ-アミノ酪酸が動物と人間の両方で高血圧を軽減できることが示されています [58]。 GAD 酵素 (GABA を合成するための重要な酵素) は 乳酸菌細胞内で非常に活性が高いため、高い γ-アミノ酪酸産生を示します。 Mohsen Zareianら[59]は、Lb. plantarum MNZを使用してボウル一杯の小麦ベースの米(ドーサ)を120時間発酵させると、ドーサのγ-アミノ酪酸含有量(約143 mg/kg)を高めることができると報告した。 γ-アミノ酪酸は、牛乳 [60] やレンズ豆 [61] の発酵にさまざまな種類の Lb. plantarumが使用された場合にも検出される可能性があります。 |
| アンジオテンシン変換酵素阻害ペプチドや γ-アミノ酪酸とは別に、特定の種類のフェノール酸も血圧の低下に寄与する可能性があります。 Irini Lazou Ahrén ら[62]によると、Lb. plantarum DSM 15313によって発酵されたブルーベリーは、3種類のフェノール酸(ヒドロキシフェニル乳酸、3,4-ジキシドロキシフェニルプロピオン酸、およびフェニル乳酸)を生成することができます。 彼らはラットを6つのグループに分けた。 3つのグループには血圧が正常で、標準的な固形飼料、低濃度のフェノール酸を含む発酵ブルーベリー製品(製品A)、および高濃度のフェノール酸を含む製品(製品B)を与えられました。 別の 3 つのグループには高血圧を誘発し、同じ 3 種類の食品を与えました。 著者らは、正常なラットに製品Aを4週間与えた後、血圧が他の2つのグループよりも明らかに低下したことを発見した。 それにもかかわらず、製品 B は製品 A と比較して高血圧ラットの血圧を大幅に低下させることができます。 結論は、フェノール酸には血圧を下げる能力があるということでしたが、高濃度のフェノール酸が高血圧ラットよりも正常ラットに大きな影響を与える理由はまだ調査されていません。 |
| 研究者らは、Lb. plantarumが発酵食品中で生成できる生理活性物質に加えて、薬物の吸収促進にも役立つことを発見しました。 Febrina A. Saputri et al [63] は、オスのニュージーランドウサギにLb. plantarumを 14 日間与えると、高血圧の治療に使用できるアムロジピンの吸収を促進できると報告しました。 |
| Lb. plantarum IS-10506群のアムロジピンの血中濃度は、対照群に比べて高かった。 この調査は、動物に Lb. plantarum IS-10506 を補給すると、血流が促進され、アムロジピンの吸収が増加する可能性があることを示唆しています。 |
| 腸内細菌叢の腸内毒素症(dysbiosis)も高血圧に関連するもう一つの要因です。 Yang T.らによると、自然発症高血圧ラットでは微生物の豊富さと多様性が大幅に減少した[64]。 さらに、この研究では一部のヒトの高血圧患者の糞便サンプルも検査され、同様の腸内毒素症パターンが見つかりました。 この関係のメカニズムは完全には解明されていません。 Robles-Veraらによると、一部の乳酸菌株は短鎖脂肪酸やリポ多糖類などの生成物を合成できるという[65]。 これらの生成物は宿主細胞の生理機能に影響を与える可能性があります。 それでも、この分野ではさらなる科学的研究が必要です。 |
| 3.3. Lb. plantarumによる脂質低下のメカニズム |
| 高コレステロールは 心血管疾患の危険因子の 1 つでもあり、心血管疾患はアテローム性動脈硬化症や高脂血症などのさまざまな死亡率の高い疾患を引き起こす可能性があります。 アテローム性動脈硬化症は慢性炎症性疾患であり、多くの場合、内皮機能不全、子宮内膜脂質沈着、平滑筋細胞増殖、アポトーシス、壊死のほか、自然免疫および獲得免疫の関与による局所的および全身的炎症を伴う[76]。 高コレステロール血症は、総コレステロール(TC)、トリグリセリド(TG)、低密度リポタンパク質(LDL)の濃度が基準を超え、高密度リポタンパク質(HDL)の濃度が基準より低いことで臨床的に診断される病態です [77]。 これらの病気の主な原因の 1 つは、動脈内のコレステロールの蓄積です。 研究によると、血清コレステロール濃度を 1% 低下させると、特に LDL コレステロール値が低下し、HDL コレステロール値が上昇した場合、心血管疾患の発生率が 2% ~ 3% 低下することが示されています。 アテローム性動脈硬化症患者の場合、低密度リポタンパク質コレステロール (LDL-C) の目標は 1.8 mmol/L (<70 mg/dL) 未満、またはベースライン レベルが 1.8 ~ 3.5 mmol/L(70 および 135 mg/dL) の場合は少なくとも 50% の低下です[78]。 |
| したがって、現代医学では、血中および肝臓中の脂質レベルを低下させる薬を見つけることが心血管疾患を予防する効果的な方法であると考えています。 これまでのところ、スタチン、3-ヒドロキシ-3-メチルグルタリル CoA (HMG CoA) レダクターゼ阻害剤などの薬物療法が、コレステロール、特に低密度リポタンパク質コレステロールを効果的に低下させるために最も広く使用されている治療法です。 しかし、これらの薬は高価であり、肝酵素異常や横紋筋融解症などの有害な副作用があります[79]。 したがって、科学者たちは、薬物の代替品として天然由来の安全な物質が見つかることを期待しています。 食品や腸から分離されたプロバイオティクスには、優れた有益な特性があり、多くの病気の治療や予防に機能性菌株として使用できます。 さらに、ほとんどの乳酸菌は安全に使用されてきた長い歴史があり、医薬品に比べて安全性が高く、副作用が少ない GRAS (General Recognized as Safe) 株とみなされています。 [80]。 その 1 つとして、Lb. plantarum は生体内および試験管内で高いコレステロール低下能力を有し、血清コレステロール値を大幅に改善し、病気のリスクを軽減することができます [81,82,83,84,85,86,87,88] 。 |
|
インビトロでの Lb. plantarum のコレステロール低下能力は広く報告されており、 そしてその考えられるメカニズムは、胆汁酸の酵素的脱結合、胆汁酸塩加水分解酵素(BSH)による、プロバイオティクスによるコレステロールの同化、脱結合胆汁とのコレステロールの共沈殿、増殖中のプロバイオティクスの細胞膜へのコレステロールの取り込み、コレステロールレダクターゼによるコレステロールのコプロスタノールへの変換、および発酵時の短鎖脂肪酸の生成を含む実験によって検証されています[89,90]。 しかし、生体内での脂質低下のメカニズムは完全には解明されていません。 考えられるメカニズムを次のように要約します。 (1) シグナル伝達経路を介した脂質代謝の調節。 (2) 胆汁酸によるコレステロールの減少。 (3) 腸内細菌叢による脂質代謝の調節。 (4) 共役リノール酸 (CLA) イソメラーゼによるコレステロールの減少。 |
| 3.3.1. シグナル伝達経路を介してコレステロールを下げる |
| Lb. plantarumの潜在的なプロバイオティクス株は、シグナル経路を通じて脂質代謝を調節することができ、アデノシン 5'-一リン酸 (AMP) 活性化プロテインキナーゼ (AMPK)シグナル伝達経路は古典的経路の1つである[91]。 Lb. plantarum は、アデノシン 5'-一リン酸 (AMP) 活性化プロテインキナーゼ (AMPK) を活性化し、下流のタンパク質の発現を変化させ、それによってコレステロールと脂肪酸の合成を調節します。 以前の研究で、Lee、Choiら[92]は、Lb. plantarumがアデノシン 5'-一リン酸経路を活性化する方法は、アデノシン 5'-一リン酸活性化プロテインキナーゼ mRNAの発現に影響を与えるのではなく、共有結合修飾によるものであることを発見した。 共有結合修飾により、Lb. plantarumはアデノシン 5'-一リン酸活性化プロテインキナーゼのリン酸化レベルを増加させ、アデノシン 5'-一リン酸活性化プロテインキナーゼを活性化することができました。 アセチル-CoA カルボキシラーゼ (ACC) は、アデノシン 5'-一リン酸活性化プロテインキナーゼの受容体タンパク質であるだけでなく、脂肪酸合成における重要な酵素でもあり、活性化された アデノシン 5'-一リン酸活性化プロテインキナーゼによって阻害されるため、脂質合成が阻害されます。 さらに、活性化されたアデノシン 5'-一リン酸活性化プロテインキナーゼシグナル伝達は、ペルオキシソーム増殖活性化受容体アルファ(PPARα)の発現を増加させることによって脂肪酸の酸化を促進し、トリグリセリドの形態での脂肪酸の蓄積を回避することができる[93]。 科学者らはまた、Lb. plantarumがステロール調節エレメント結合タンパク質1c(SREBP-1c)やステアロイルCoAデサチュラーゼ1(SCD-1)などの肝臓組織における脂肪生成タンパク質の発現を大幅に下方制御できることも発見した[94]。 これらすべては、Lb. plantarumがアデノシン 5'-一リン酸活性化プロテインキナーゼ経路を通じて肝臓の脂質代謝をある程度調節し、脂質生合成を減少させながら脂肪酸の酸化を増加させることができることを示唆しています。 |
| このメカニズムは、Lb. plantarumの多くの種で確認されています。 Yue Tengら[95]は、キムチから単離されたLb. plantarum LP104を使用して実験を実施した。 研究者らは、マウスを通常脂肪食 (NFD) グループ、高脂肪食 (HFD) グループ、および 高脂肪食+ Lb. plantarum LP104 グループにランダムに分けました。 彼らは、高脂肪食 + Lb. plantarum 104 グループでは、高脂肪食グループと比較して、アデノシン 5'-一リン酸活性化プロテインキナーゼのリン酸化レベルが増加し、アセチル-CoA カルボキシラーゼのレベルが低下していることを発見しました。 さらに、脂質生成タンパク質であるステロール調節エレメント結合タンパク質1cおよびステアロイルCoAデサチュラーゼ1の発現は下方制御され、一方、ペルオキシソーム増殖活性化受容体アルファの発現は大幅に増加しました。 一方、実験データは、Lb. plantarum LP104の補給により、高脂肪食によって引き起こされる総コレステロール(TC)、トリグリセリド(TG)、低密度リポタンパク質(LDL)レベルの上昇が有意に低下することを示しました。 同じ結果が、Lb. plantarum NCU116 [96]、Lb. plantarum NA136 [97]、およびLb. plantarum S58 [94]でも見られました。 |
| 3.3.2. 胆汁酸を通じてコレステロールを下げる |
| Lb. plantarumは、胆汁酸を通じて血清コレステロール値を下げることもできます。 胆汁酸は胆汁の成分の一つで、アルカリ性胆汁中にはカリウム塩やナトリウム塩として存在することが多いため、胆汁酸塩と呼ばれています。 胆汁酸塩は体内のコレステロールのバランスと密接に関係しています。 臨床研究では、高脂血症、非アルコール性脂肪性肝炎、脂肪肝の患者では胆汁酸レベルが正常な人よりも著しく高いことが示されています[98]。 そして、コレステロールは胆汁酸塩の新規合成の前駆体であるため[99]、胆汁酸塩の異化作用を促進することがコレステロールを低下させる効果的な方法である可能性がある。 |
| Sridevi と Prabhune による 2009 年の研究 [100] では、多くの Lb. plantarum が高い胆汁酸塩ヒドロラーゼ (BSH) 活性を有し、胆汁酸代謝を調節し、コレステロール値を下げることができることが実証されました。 胆汁酸塩ヒドロラーゼは、抱合胆汁酸塩の遊離胆汁酸塩およびアミノ酸への変換を触媒する、クログリシン加水分解酵素ファミリー (EC 3.5.1.11) に属する生物学的に重要な酵素です。 抱合胆汁酸塩は非常に可溶性が高く、そのほとんどは腸肝循環を通じて再吸収されます。 対照的に、結合していない胆汁酸塩または遊離胆汁酸塩は不溶性であり、再吸収効率が低いため、糞便とともに排泄されます[101]。 胆汁酸塩ヒドロラーゼ触媒作用の後、体内の胆汁酸含有量は減少し、胆汁酸塩を形成するにはより多くのコレステロールが必要になります。 胆汁酸塩ヒドロラーゼの高い活性により、Lb. plantarumは胆汁酸の消費を増加させ、コレステロールから胆汁酸への新たな合成を促進し、最終的に体内のコレステロールレベルを低下させることができます。 |
| このプロセスは、ファルネソイド X 受容体 (FXR)、肝臓 X 受容体 (LXR)、コレステロール 7α-ヒドロキシラーゼ (CYP7A1) などのさまざまなタンパク質の発現によって調整されます。 Wang Huangら[102]は、胆汁酸塩ヒドロラーゼ活性が高いLb. plantarum AR113をマウスに与えた。 彼らは、対照群のマウスと比較して、Lb. plantarum AR113群では血清総コレステロールおよび低密度コレステロール(LDL-C)レベルが有意に減少し、血清高密度コレステロール(HDL-C)レベルが増加していることを発見した。 一方、Lb. plantarum AR113グループではファルネソイド X 受容体 (FXR)のmRNAレベルが大幅に下方制御され、コレステロール 7α-ヒドロキシラーゼ (CYP7A1)と肝臓 X 受容体 (LXR)のmRNA発現が大幅に上方制御されていた。これは、Lb. plantarum AR113が胆汁酸の代謝を制御してコレステロール含有量に影響を与えることができることを意味する。 他の研究では、胆汁酸塩ヒドロラーゼ活性が高い他のLb. plantarumでも同様の所見が得られている[103,104]。 |
| 高い胆汁酸塩ヒドロラーゼ活性を通じて胆汁酸代謝を調節することに加えて、Lb. plantarumは、遊離胆汁酸塩とコレステロールの結合を促進して吸収されにくい沈殿を形成することにより、血清コレステロールレベルを低下させることができます。 Aarti [105] は、母乳で育てられた乳児の糞便からいくつかの菌株を分離し、グリシンアミドナトリウムとタウロコール酸ナトリウムを添加した MRS ブロスで培養しました。 次いで、共役胆汁酸ナトリウムグリシンアミドおよびタウロコール酸ナトリウムから放出される胆汁酸の含有量を、さまざまな菌株のコレステロール除去能力を決定するための基準として利用した。 Walker と Gilliland によって記載された方法はコール酸レベルを検出するために使用され、比色分析はコレステロール レベルを検出するために使用されました。 実験結果は、これらすべての株の中で、Lb. plantarum GD2がコレステロールを沈殿させる最高の能力を持っていることを証明しました。 一方、それは低いPHおよび高い胆汁濃度でも生存することができ、これはLb. plantarum GD2がコレステロールを除去する優れた能力を持っていることを示しています。 正確なメカニズムは、さらなる研究によってまだ解明される必要があります。 |
| Lb. plantarumが胆汁酸レベルを調節し、コレステロールを低下させる 2 つの方法を図 3 に示します。 これらの発見は、Lb. plantarum は、胆汁酸塩ヒドロラーゼを通じて胆汁酸代謝を調節し、遊離胆汁酸塩とコレステロールの結合を促進して脂質を減らすことができます。 したがって、胆汁酸によるコレステロール低下は、心血管疾患の治療における Lb. plantarum の使用に対する有望なアプローチである可能性があります。 |
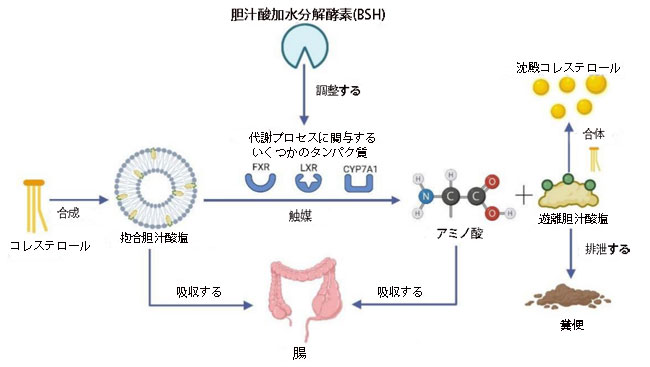 |
図 3 Lactiplantibacillus plantarum による胆汁酸を介したコレステロール低下のメカニズム。 Lactiplantibacillus plantarum は、コレステロールを消費する胆汁酸の代謝を調節し、胆汁酸とコレステロールの沈殿物への結合を促進することにより、コレステロールを減少させます。 (FXR - ファルネソイド X 受容体、LXR - 肝臓 X 受容体、CYP7A1 - コレステロール 7α-ヒドロキシラーゼ) (Biorender.com で作成)。 |
| 3.3.3. 腸内細菌叢を通じてコレステロールを下げる |
| 高脂肪食によって引き起こされる腸内毒素症が、高コレステロール血症、肥満、その他のメタボリックシンドロームの発症を促進することを示唆する証拠が蓄積されています。 最近の研究では、宿主の健康と病気の調節における胃腸微生物叢の重要性が強調されている[106]。 科学者らは、有益な微生物の増加と病原性細菌の減少によって証明されるように、Lb. plantarumが腸内細菌叢の種の豊富さと生物多様性を増加させる可能性があると示唆しています。 Shao, Y.、Huo, D.、Peng, Q.ら[107]は、メタゲノムアプローチを適用して、プロバイオティクスの摂取が高脂血症患者の腸内細菌構造を調節できることを示した。彼らの研究では、Bifidobacterium, Lactobacillus, Akkermansia, および Faecalibacterium がLb. plantarumを与えられたグループで有意に増加し、一方、Clostridium, Natranaerovirga, Fervidicella, Roseburia, Gemella, Escherichia/Shigella, および Odoribacter属が高脂血症グループでは有意に増加したことが示された。 腸内細菌叢による脂質低下の固有のメカニズムは、現在の研究の注目点ではありますが、完全には解明されていません。今後の最新の研究成果に期待します。 |
| 3.3.4. 共役リノール酸イソメラーゼによるコレステロールの低下 |
| 上記のメカニズムに加えて、Lb .plantarumは合成共役リノール酸(CLA)への共役リノール酸イソメラーゼを生成することができるため、コレステロールを低下させ、高脂血症を治療することができます。 |
| 共役リノール酸は単一種類のリノール酸ではなく、一連のリノール酸異性体であり、その機能は複数の共役リノール酸異性体による代謝経路の協調制御によって引き起こされます。 cis-9、trans-11、trans-10、cis-12 など、脂肪の取り込みと脂質代謝において重要な役割を果たします。 しかし、リノール酸の化学合成の要件は複雑であり、多くの副生成物が発生します。 したがって、微生物によるリノール酸イソメラーゼの生合成は、優れた代替アプローチであると考えられています。 一部の細菌、特に中国の伝統食品の漬物からスクリーニングされたLb. plantarum ZS2058は、高いリノール酸イソメラーゼ活性を有し、最も効率的な乳酸菌株であることが証明されている。 リノール酸イソメラーゼの局在化と精製を通じて、共役リノール酸イソメラーゼが微生物細胞内の水和反応を触媒して 共役リノール酸合成の中間体である 10-HOE を形成し、多段階の反応後に生物学的活性を持つ共役リノール酸を生成したことが判明した [108] 。 |
| 同じ形質転換機構が Lb.plantarum AKU1009A にも存在します [109]。 さらに、L. plantarum CGMCC8198の研究により、L .plantarum ZS2058のイソメラーゼ遺伝子と相同な配列を有し、マンシュウイタヤの種子油による発酵によりリノール酸異性体を生成できることが示された。 これは、Lb. plantarumの微生物生産のための一定の基礎を築いた[110]。 Chen L. らの実験 [111] では、結合型共役リノール酸を栄養補助食品として摂取すると、脂質代謝関連細菌の存在量が増加し、マウスの脂肪沈着が大幅に減少する可能性があり、そのコレステロール低下効果のさらなる証拠となっています。 |
| 3.4. Lb. plantarumによる血糖低下のメカニズム |
| 血液中のブドウ糖の濃度を血清血糖値といいます。 正常な血清グルコースレベルは、人体の代謝とすべての臓器の基本的な機能を維持する上で重要な役割を果たします。 したがって、血糖値が高すぎたり低すぎたりすると、人々の健康に害を及ぼす可能性があります。 高血糖は糖尿病のリスクを高め、免疫力の低下につながり、心血管疾患を引き起こす可能性があります。 一方、グルコースが体内で適時に利用されないと、エネルギー供給の低下、倦怠感、うつ病につながる可能性があります。 |
| Lb. plantarumは、血清グルコースレベルを調節し、糖尿病を抑制することができる[112]。 Ahtesham Hussain [113]は、Lb. plantarum LB818をマウスに給餌するために使用し、高脂肪食(HFD)マウスはLb.plantarum LB818で処置すると血清グルコースレベルが低下することを発見した。 総コレステロール(TC)、トリグリセリド(TG)、高密度リポタンパク質(HDL)アラニンアミノトランスフェラーゼ(ALT)、アスパラギン酸アミノトランスフェラーゼ(AST)の変化を考慮すると、MLb. plantarum LB818は、体重増加を防ぎ、脂肪を減らし、グルコースレベルのバランスをとることによって抗糖尿病効果を示すことができると結論付けることができます。 U. Andersson らによって実施された研究でも同様の結果が得られました [114]。 彼らは、Lb. plantarum DSM 15313を給餌すると、マウスのグルコース排泄とインスリン反応を強化できることを発見しました。 さらに、別の報告では、ラットは Lb. plantarum 49 および Lb. plantarum 201 を 28 日間摂取した後に血清グルコースレベルの低下を示しました [115]。 |
| Lb. plantarumの血糖降下効果を検証し、Lb. plantarumの根底にあるメカニズムを調査するために、多数の関連実験が実施されました。 血糖降下メカニズムはまだ解明されていませんが、最も可能性の高い説明は腸内細菌叢に関連していると考えられています。 Sen Lin [116] は、Lb. plantarumを与えられた子豚のグルコース濃度の変化を検出し、糞便サンプル中の微生物叢プロファイルを分析しました。 この結果に基づいて、彼らは、Lb. plantarumがグルコース恒常性に影響を与える方法が、腸内微生物属の相対存在量の調節に関連しているのではないかと推測した。 Lb. plantarumは宿主の腸内細菌叢を変化させ、特定のグルコースの上方制御を引き起こす可能性があります。これは、グルコース再吸収の減少、空腹時グルコースおよび糖化ヘモグロビン (HbA1c) レベルの減少を意味します。 さらに、耐糖能が高くなると、プロテインキナーゼ B (Akt) と アデノシン 5'-一リン酸 (AMP) 活性化プロテインキナーゼ (AMPK)のリン酸化、ホスホエノールピルビン酸カルボキシキナーゼ (PEPCK) とグルコース 6 ホスファターゼ (G6Pase) の mRNA 発現レベルが変化します。 その結果、グルコース生成が減少します。 腸内細菌叢がグルコース代謝に影響を与える考えられるメカニズムを図 4 に示します。 |
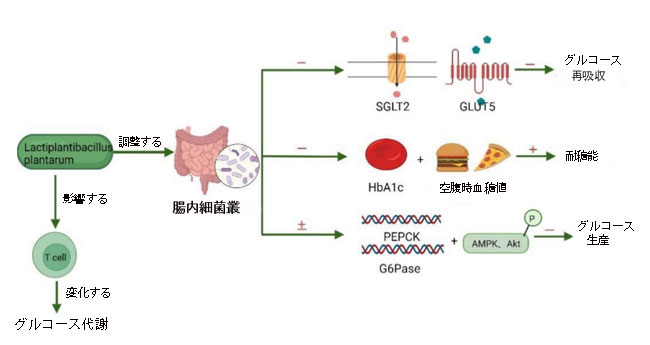 |
図4 Lactiplantibacillus plantarumの血糖降下機構。 Lactiplantibacillus plantarum は、腸内細菌叢を通じて血糖値を低下させ、ホスホエノールピルビン酸カルボキシキナーゼ (PEPCK) の発現を調節することができます。 グルコース-6-ホスファターゼ(G6Pase)、およびアデノシン 5'-一リン酸活性化プロテインキナーゼ(AMPK)/プロテインキナーゼ B(Akt)シグナル伝達経路を制御しながら、トランスポーター SGLT2、GLUT5、糖化ヘモグロビン(HbA1c)および空腹時血糖のレベルを低下させます。 免疫細胞の機能がメカニズムの可能性があると考えられていますが、さらなる研究が必要です。 (「+」はアップレギュレーション、「-」はダウンレギュレーション、「±」はアップレギュレーションまたはダウンレギュレーションを意味します) (Biorender.com で作成)。 |
| さらに、研究では、Lb. plantarum が腸内細菌叢を介してシグナル経路を調節できることが示されています [117,118,119]。 Lb. plantarum HAC01を与えられたマウスは空腹時血糖値と糖化ヘモグロビン(HbA1c)レベルが低く、経口ブドウ糖負荷試験(OGTT)の成績が良好であったことが報告されています。 これは、この菌株の抗高血糖効果を示唆しており、耐糖能異常を改善できることを示唆しています。 科学者たちは、肝臓におけるグルコース代謝に関連する遺伝子とタンパク質の発現の研究を通じて、肝臓におけるプロテインキナーゼ B(Akt)およびデノシン 5'-一リン酸活性化プロテインキナーゼ(AMPK)リン酸化を増加させ、ホスホエノールピルビン酸カルボキシキナーゼ (PEPCK)およびグルコース-6-ホスファターゼ(G6Pase)mRNA発現レベルを低下させ、したがって肝臓における内因性グルコース生成に影響を与えることができることを発見しました。 [120]。 一部の研究者は、Lb.plantarumがグルコースの利用を改善できることを証明しました。 高フルクトース食を与えられたラットは、特定のグルコース トランスポーター SGLT2 および特定のフルクトース トランスポーター GLUT5 の上方制御を示し、これがラットの血液および腎臓中のフルクトース レベルの上昇につながる可能性があります。 Lb. plantarumのサプリメントは、グルコースの再吸収を制限する可能性があります[121]。 グルコースの利用とは別に、Lb. plantarumはグルコースが制限された条件にも適応できます。 長期(3年間)のグルコース制限に応答したLb. plantarum P-8の遺伝子型およびプロテオーム変化の研究では、生存のためのさまざまなメカニズムが調査されました。 これは、細胞エンベロープの変更、ホスホトランスフェラーゼ系の活性化、アミノ酸の蓄積と消費、グルコース摂取量の減少、グルコース飢餓に応答したグルコースまたはATPの生成の増加で構成されます[122]。 |
| それとは別に、Lb. plantarum OLL2712は体重を減らすことなくグルコース代謝を調節することができ、この効果はT細胞などの免疫細胞の機能と関連している可能性があります。 しかし、免疫細胞がグルコース代謝を変化させることができるかどうかは、さらなる研究が必要である[123]。 |
| 4. Lb. plantarum発酵食品の最近の発展 |
| 上で述べたように、Lb .plantarumは、その優れた抗心血管特性と、人間の健康にとって重要である胃腸管での良好な耐性のため、プロバイオティクスとして開発される可能性があります。 さらに、いくつかの研究では、それを使って発酵させた食品は発酵前よりも健康上の利点があり、プロバイオティクス機能性食品に開発される可能性があることが実証されています。 さまざまな種類の食品における Lb .plantarumの応用と、その発酵食品の対応する効果を図 5 と表 3 に示します。 |
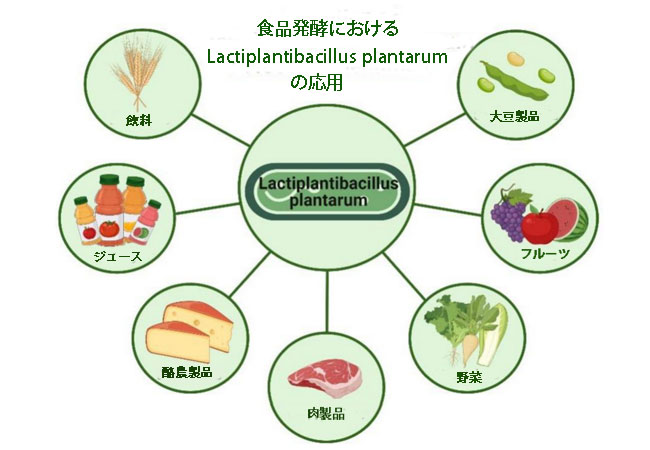 |
図 5 いくつかの異なる種類の食品における Lactiplantibacillus plantarum の応用。 Lactiplantibacillus plantarum は、幅広い発酵食品の製造における発酵菌株として広く使用されています。 (Biorender.com で作成)。 |
 |
 |
| 4.1. 抗酸化機能のある発酵食品 |
| 果物や野菜には、優れた抗酸化作用があるフェノール物質、カロテノイド、フラボノイド、ビタミンCが豊富に含まれています。 したがって、科学者たちは、果物や野菜のジュースをベースにした機能性飲料を開発し、発酵によって抗酸化能力を向上させることを望んでいます。 以前の研究では、リンゴ、オレンジ、ナツメ、ココナッツ ジュースなど、抗酸化機能を持ついくつかの発酵ジュースが製造され、フリーラジカルを除去する能力が優れていることが証明されています。 近年では、Lb. plantarumを発酵させた抗酸化機能性ジュースについても多くの報告がなされています。 Wu、Liら[143]は、ABTS法に基づいて発酵前後のブルーベリージュースとブラックベリージュースの抗酸化活性を比較し、次のことを発見した。 Lactobacillus plantarumで発酵させたブラックベリージュースとブルーベリージュースのABTSラジカル消去活性は、発酵前のジュースと比較して、それぞれ53.3%と64.0%増加した。 同じ結果が発酵野菜ジュースでも報告されました。 Zhang、Duanら[144]は、Lb. plantarum WZ-01による72時間発酵後のニンジンジュースのDPPHラジカル消去率およびABTSフリーラジカル消去率が、発酵前の状態と比較してある程度増加していることも発見した。 これらの結果は、Lb.plantarumによる発酵がジュースのフリーラジカル消去活性を効果的に高めることができ、発酵した果物や野菜のジュースが優れた抗酸化機能性飲料として開発できることを示唆しています。 |
| 果物や野菜のジュースに加えて、乳製品 [132]、大豆製品 [129]、発酵ソーセージ [139] など、他の種類の食品の発酵における Lb.plantarumの応用に関する報告もあります。 これらすべての種類の発酵食品は、発酵前と比較して、試験管内でより優れた抗酸化能力を示します。 |
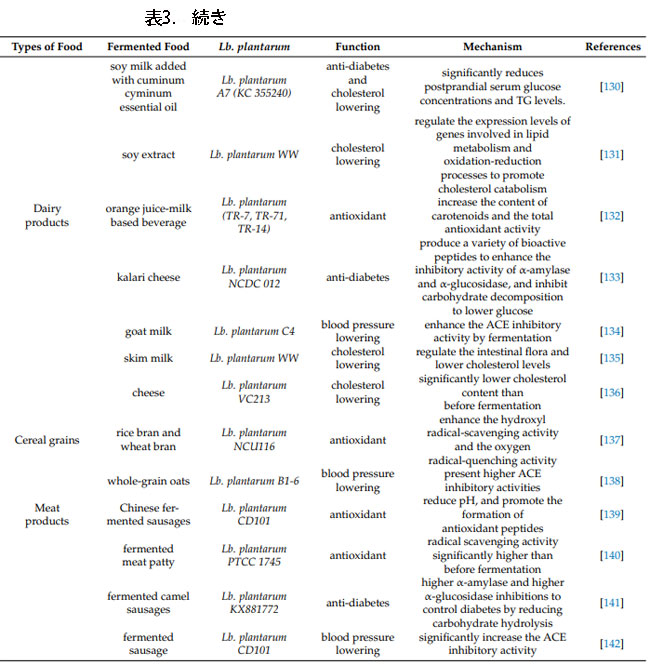
| 4.2. コレステロールを下げる機能のある発酵食品 |
| コレステロール低下効果のあるLb.plantarum発酵食品の開発は、乳製品、大豆製品、果物や野菜、水産物などで一定の成果を上げています。 早くも2015年に、Jeon、Leeら[145]は、Lb. plantarum EMと名付けられた、インビトロでコレステロールを低下させることができる乳酸菌株をキムチから単離した。 4年後、彼らは、高コレステロール食ラットに対する発酵ジュースの健康増進効果を調査するために、キャベツ・リンゴジュースの発酵株としてLb. plantarum EMを利用した。 未発酵ジュースと比較して、発酵ジュースを与えられたラットでは、総コレステロール(TC)、トリグリセリド(TG)、および低密度リポタンパク質コレステロール(LDL-C) の血清レベルが大幅に低下し、高密度リポタンパク質コレステロール(HDL-C )レベルが増加することが判明しました。 多くの科学者が、さまざまな種類の発酵食品で同様の結果を得ています。 Cao、Wuら[131]は、Lb. plantarumによって発酵された大豆抽出物がシグナル伝達経路を通じて脂質代謝を調節し、それによってコレステロールを低下させる可能性があると指摘した。 Li、Wuら[135]は、ラットの糞便の微生物多様性を分析し、Lb. plantarum WWで発酵させたスキムミルクが腸内細菌叢を調節し、コレステロール値を低下させる可能性があることを発見した。 Hu、Zhengら[128]は、Lb. plantarum FZU3013で発酵させたラミナリア・ジャポニカが、ラットの脂質代謝および胆汁酸恒常性に関与する遺伝子の発現に影響を与える可能性があることを発見した |
| 4.3. 血圧を下げる機能のある発酵食品 |
| Lb. plantarum発酵食品の血圧降下作用に関する報告はほとんどなく、その多くは ACE 活性を阻害する可能性のある発酵食品、主に発酵乳製品に焦点を当てたものでした。 いくつかの研究結果を上の表 2 に示します。 乳製品に加えて、豆乳 [71]、発酵ソーセージ [146]、グアバのような果物 [147] など、他の発酵食品でも同様の結果が報告されています。 しかし、関連する研究が不足しているため、発酵食品が生体内実験で有効であるかどうかを確認することはできません。 |
| 4.4. 血糖降下作用のある発酵食品 |
| いくつかの研究で、Lb. plantarum発酵食品の血糖降下効果が確認されています。 Zhong, Abdullahら [126] は発酵基質としてブルーベリーを使用しました。 ブルーベリーには優れた抗糖尿病作用があり、初期段階の糖尿病を治療する可能性があると広く考えられています。 彼らの研究では、非発酵のブルーベリージュースと比較して、Lb. plantarumで発酵させたブルーベリージュースのフマル酸塩含有量が大幅に増加し、グルコース恒常性を維持できることがわかりました。 さらに、発酵によりブルーベリージュース中のフェノール化合物の濃度が変化し、グルコースの消費が促進されました。 彼らは、発酵ジュースが細胞のグルコース消費を大幅に強化することを確認するモデルとして HepG2 細胞株を採用しました [148]。 これに加えて、Lb. plantarum発酵はまた、α-アミラーゼおよびα-グルコシダーゼの阻害活性を増加させるため、糖尿病の効果的な制御のために炭水化物の加水分解を減少させます[149]。 |
| 4.5. Lb. plantarumのその他の用途 |
| 結論として、Lb. plantarum発酵食品は in vitro 実験で良好な効果を示し、プロバイオティクス製品として開発される可能性があることがわかります。 さらに、食品に追加の機能的特徴を与えることに加えて、Lb. plantarum発酵は伝統的な発酵食品の特性を改善する可能性があります。 未発酵食品と比較して、発酵食品は優れた抗菌特性と長期の保存期間を備えたバクテリオシンを生成できます [150]。 安定性も向上する可能性があり [151]、消費者の要求に合わせて風味も改善されます [124]。 現在、乳製品、果物、野菜、肉製品、大豆、穀類など、基本的な食生活をカバーするさまざまな種類の機能性発酵食品が報告されています。 これらの要因を総合すると、Lb. plantarum発酵食品を開発し、これらの食品を日常生活で補うことが人間の健康にとって非常に重要である可能性があることがわかります。 |
| 5.結論 |
| 世界中で心血管疾患発生率が高い状況において、一般的な薬物療法に加えて、プロバイオティクスおよびプロバイオティクス機能性食品が、そのような疾患を予防および軽減するための重要な手段となっています。 Lb. plantarumは心血管疾患の予防と治療において大きな可能性を秘めており、人体で健康的な役割を果たすプロバイオティクスとして開発される可能性があります。 そのメカニズムには、抗酸化物質レベルの増加、血糖、血中脂質、血圧のバランスの維持が含まれます。 同時に、研究により、Lb. plantarumは飲料やチーズなどの発酵食品に幅広い用途があることがわかっています。 さまざまな発酵食品には心血管疾患の予防・軽減効果があります。 Lb. plantarum発酵食品の組成、技術、特性、およびその他の関連特性の研究と最適化は、科学者がこれらの食品の品質とプロバイオティクス活性を改善し、最終的に患者の 心血管疾患症状を軽減するのに役立ちます。 したがって、Lb. plantarumの機能性発酵食品は、心血管疾患のリスク軽減とその治療において幅広い応用の可能性を秘めています。 将来的には、Lb. plantarum発酵食品を毎日の食事に補うことで、心血管疾患のリスクを軽減し、心血管疾患を軽減することができます。 しかし、Lb. plantarum発酵食品の心血管疾患 に対する治療効果は臨床的に検証されておらず、実際の製造における Lb. plantarumの機能は、温度、pH 値、食品組成、およびその他の食品微生物の影響を受けます。 したがって、機能性食品をより良く開発するには、最適な製造条件をさらに探求する必要があります。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Foods. 2022 Sep; 11(17): 2549.に掲載されたThe Mechanisms of the Potential Probiotic Lactiplantibacillus plantarum against Cardiovascular Disease and the Recent Developments in its Fermented Foods.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


