ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
アルツハイマー型認知症患者における脳由来神経栄養因子、炎症性バイオマーカー、酸化ストレスおよび認知機能に対するプロバイオティクスサプリメントの有効性: 12週間のランダム化二重盲検実薬対照研究 |
Yu-Chieh Hsu et al., |
|
|
| 要約 |
アルツハイマー病 (AD) の病因における神経栄養因子、酸化ストレス、炎症の役割が研究されています。 動物実験では、これらの要因に対するプロバイオティクスのプラスの効果が報告されています。 一部の臨床研究では、高齢者の腸-脳軸を介した認知機能の改善におけるプロバイオティクスの潜在的な役割も支持しています。 しかし、特にアルツハイマー病患者における、神経栄養因子および炎症性バイオマーカーを標的としたプロバイオティクスの有効性を評価する臨床実験研究は、依然として非常に限られている。 このランダム化二重盲検実薬対照試験では、Bifidobacterium longum subsp. infantis BLI-02、B. breve Bv-889, B. animalis subsp. lactis CP-9, B. bifidum VDD088, およびLactobacillus plantarum PL-02 を介入として使用しました。 参加者は、アクティブコントロールグループ(1日あたり5×107コロニー形成単位を含むプロバイオティクスサプリメントを摂取、CFU/日)と治療グループ(1×1010CFU/日)に分けられました。 スチューデントの t 検定が統計分析の主な方法として適用されました。 12 週間の介入後、治療グループは血清脳由来神経栄養因子 (BDNF) の 36% 増加(* p = 0.005)、IL-1βの減少(* p = 0.041)、および抗酸化スーパーオキシドジスムターゼ(SOD)の増加(* p = 0.012)を示しました。 アクティブコントロールグループでは有意な変化は見つかりませんでした。 認知機能の低下が少なくなる傾向が観察されましたが、統計的に有意ではありませんでした。 結論として、この研究は、アルツハイマー病患者における脳由来神経栄養因子の増強、炎症および酸化ストレスの改善における多菌株プロバイオティクスの利点を裏付ける証拠を提示しています。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2.材料と方法 |
| 2.1. 参加者 |
| 2.2. プロバイオティクス株 |
| 2.3. 介入と測定 |
| 2.3.1. 生化学的パラメーターの評価 |
| 2.3.2. 認知機能および日常生活機能の評価 |
| 2.3.3. 糞便 DNA 抽出と次世代シーケンス分析 |
| 2.4. 統計分析 |
| 3. 結果 |
| 3.1. 参加者募集 |
| 3.2. 脳由来神経栄養因子レベル |
| 3.3. 炎症性バイオマーカー、コルチゾールレベル、および抗酸化能力 |
| 3.4. 認知機能 |
| 3.5. 腸内細菌叢の構成の変化 |
| 4.討議 |
| 5.結論 |
本文 |
| 1.はじめに |
| 人口高齢化は世界的な懸念事項です。 国連の推計によると、世界の65歳以上の人口は2019年の7億人から2050年までに15億人に倍増するとされています。老化は神経系に影響を及ぼし、認知機能障害を引き起こし、認知症を引き起こす可能性があります。 アルツハイマー病 (AD) は認知症の最も一般的な形態であり、症例の 60 ~ 70% に寄与している可能性があります [1]。 アルツハイマー病は不可逆的な神経変性障害であり、認知障害、記憶喪失、脳機能の障害を引き起こし、最終的には日常生活に影響を及ぼします [2]。 これは、アミロイド斑の沈着、脳内のTAU (チューブリン関連ユニット) タンパク質の異常なリン酸化、およびニューロンの変性を特徴とします [3]。 アルツハイマー病は65歳以上の人の死亡原因の第5位であるため、アルツハイマー病患者の治療と介護の経済的負担は相当なものになると予測されています。 2022 年までに、米国における アルツハイマー病およびその他の認知症の治療とケアにかかる費用は、3,395 億米ドルに達すると推定されています [4]。 アルツハイマー病の医療分野で一般的に使用される薬剤には、アセチルコリンエステラーゼ阻害剤 (ドネペジル、リバスチグミン、ガランタミン、タクリン) [5] および脳内のグルタミン酸活性の調節に役立つ N-メチル-D-アスパラギン酸受容体拮抗薬メマンチン (単独またはドネペジルと組み合わせて使用) [6] が含まれます。 これらの薬剤は一時的に記憶力を改善しますが、アルツハイマー病の進行を変えることはありません [7]。 |
| 近年、多くの研究でヒトの腸内細菌叢と神経変性疾患との関係が強調されています[8、9、10]。 腸内細菌叢と中枢神経系の間のこの複雑な関係は、一般に腸-脳軸と呼ばれます。 腸内細菌叢の異常(dysbiosis)、腸内微生物群集の不均衡、微生物叢 - 腸 - 脳軸の破壊が、アルツハイマー病の発症と進行に寄与すると考えられています [11]。 プロバイオティクスは、十分な量を摂取すると有益な細菌株であり、健康な腸内細菌叢を促進する可能性があるとして注目を集めています[12]。 プロバイオティクスは腸内微生物叢の恒常性を回復することができ、特に炎症や酸化ストレスにおけるアルツハイマー病の進行を遅延させ、それによって認知機能の低下を改善する可能性があることが研究で示されており、その効果は消化器官の健康を超えて広がっています[13]。 神経栄養タンパク質である脳由来神経栄養因子 (BDNF) は、アルツハイマー病における変性ニューロンの機能において重要な役割を果たします。 アルツハイマー病患者は、健常人に比べて血清脳由来神経栄養因子レベルが著しく低い[14]。 研究では、乳酸菌とビフィズス菌の組み合わせが、神経障害を持つ個人の脳由来神経栄養因子レベルを効果的に増加させることができることを示唆しています[15]。 二重盲検臨床試験では、乳酸菌とビフィズス菌株を含むプロバイオティクスブレンドが、プラセボ群と比較してアルツハイマー病患者の認知スコアを有意に改善することが実証されました[16]。 |
| 脳由来神経栄養因子に対する効果に加えて、プロバイオティクスは脳変性の一因となる炎症や酸化ストレスに関して他の有益な効果ももたらす可能性があります。 私たちの以前の研究では、ビフィズス菌と乳酸菌の複数の菌株が腸内細菌叢を積極的に調節し、中年マウスの血清中の短鎖脂肪酸(SCFA)のレベルを増加させ、抗酸化活性の向上につながる可能性があることを示しました。 さらに、この発見により、中年マウスの脳、肝臓、心臓、腎臓における抗酸化活性の増強における生きたプロバイオティクス株とその代謝物の相乗効果が確認されました[17]。 |
| 介入としてプロバイオティクスを用いたこれまでのランダム化比較試験のほとんどは、臨床的にアルツハイマー病と診断された人々に特に焦点を当てておらず、地域在住の高齢者、または軽度認知障害および認知症のある被験者を対象に実施された[18,19,20,21,22,23]。 認知症は、脳損傷、脳卒中、薬物、感染症など、さまざまな病因によって引き起こされる可能性があります。 これらの脳損傷の病因はアルツハイマー病とはまったく異なるため、あらゆる種類の認知症に対するプロバイオティクスサプリメントの有効性の根底にあるメカニズムを説明することが困難になっています。 さらに、アルツハイマー病患者を対象とした実験研究デザインを使用して、脳由来神経栄養因子、酸化ストレス、抗酸化バイオマーカーに対するプロバイオティクスの有効性の証拠を調査する研究は非常に限られている[24,25]。 |
| 前述の証拠と以前の研究に基づいて、我々は複数株のプロバイオティクスである B. longum subsp. infantis BLI-02, B. breve Bv-889, B. animalis subsp. lactis CP-9, B. bifidum VDD088, および L. plantarum PL-02は、私たちの研究介入処方の一部として使用されており、動物実験で示されているように、人間の老化を遅らせ、酸化ストレスを軽減する能力がある可能性があります[17]。 この研究の目的は、臨床的に診断されたアルツハイマー病患者の脳由来神経栄養因子レベル、酸化ストレスと炎症のバイオマーカー、認知機能に対するこれらのプロバイオティクスの有効性を評価することでした。 さらに、12週間の介入期間の前後での腸内細菌叢の変化を分析しました。 |
| 2.材料と方法 |
| 2020年から2022年に実施されたこの研究は、アルツハイマー病患者における多菌株プロバイオティクス介入の効果を評価する二重盲検、無作為化、実薬対照試験であった。 この臨床試験は、En Chu Kong 病院の治験審査委員会 (ECKIRB1080701) から承認を受け、NCT05145881 として米国の臨床試験 Web サイトに登録されました。 すべての患者またはその家族は、参加する前に署名されたインフォームドコンセントを提出しました。 |
| 2.1. 参加者 |
| 参加資格を得るには、参加者の年齢は50歳から90歳であり、以下のいずれかに基づく臨床基準を満たす必要がありました。 精神障害の診断と統計マニュアル、第 5 版の基準 (DSM-V) [26]。 国立神経・コミュニケーション障害・脳卒中研究所およびアルツハイマー病および関連障害協会(NINCDS-ADRDA アルツハイマー病基準)[27]。 国立老化・アルツハイマー病協会基準 (NI-AAA) (2011) [28]。 台湾のミニ精神状態検査(MMSE)スコアが10から25、臨床認知症評価(CDR)スコアが0.5、1、または2などの精神検査を受けた軽度から中等度の認知症患者が登録された。 アルツハイマー病以外の認知症の原因を除外するために、いくつかの基準が適用されました。 ビタミンB12欠乏症、甲状腺機能異常、血清梅毒検査陽性、血液検査で評価された重度の代謝機能障害、肝臓機能障害、腎臓機能障害のある患者は除外された。 さらに、重度の脳外傷、脳腫瘍、てんかん、または中枢神経系感染症の病歴など、認知症の他の潜在的な原因を持つ個人は含まれていませんでした。 過去2週間以内に免疫抑制剤、ステロイド、抗生物質を服用した患者、または化学療法を受けた患者も除外された。 さらに、精神障害や重度のうつ病のある人、パーキンソン病、アルコール依存症、薬物乱用と診断された人、過去 1 か月以内にプロバイオティクス製品を摂取した人は含まれていませんでした。 血管性認知症、水頭症、その他の脳損傷などの認知症の他の原因を除外するために、参加者全員が脳のコンピューター断層撮影スキャンまたは磁気共鳴画像検査を受けました。 |
| 2.2. プロバイオティクス株 |
| この研究で利用されたすべてのプロバイオティクス株は、Glac Biotech Co., Ltd. (Tainan, Taiwan) から供給されました。 B. longum subsp. infantis BLI-02, B. breve Bv-889, とB. animalis subsp. lactis CP-9 を含むプロバイオティクス株が母乳から分離されました。 B. bifidum VDD088 は健康な乳児の腸から分離されました。 さらに、L. plantarum PL-02 は、2008 年オリンピック女子重量挙げの有名な金メダリスト、Wei-Ling Chenの糞便サンプルから分離されました。 |
| 2.3. 介入と測定 |
| すべての参加者は、アクティブコントロールグループまたは治療グループのいずれかにランダムに割り当てられました。 各グループには 20 人の参加者が登録され、プロバイオティクス カプセルを冷蔵条件で保管し、12 週間毎日 1 カプセル摂取するよう指示されました。 治療の遵守を確実にするために、研究期間中に遵守評価が 2 回実施されました。 治療グループのプロバイオティクス カプセルには 1 × 1010 CFU/カプセルが含まれていましたが、アクティブ コントロール グループのプロバイオティクス カプセルには 5 × 107 CFU/カプセルが含まれていました。 各カプセルは、B. longum subsp、 infantis BLI-02、B. breve Bv-889、B. animalis subsp. lactis CP-9 、B. bifidum VDD088およびL. plantarum PL-02の5つのプロバイオティクス株を等しい割合(1:1:1:1:1)で混合した組み合わせで構成されています。 ベースライン評価では、参加者は人口統計情報、人体計測データ、臨床アンケート、血液評価、および便サンプリングを含む包括的な評価を受けました。 12週間の介入期間の後、参加者は以前と同じ一連の検査を受けました。 |
| 研究では、脳由来神経栄養因子の変化や、サイトカイン、コルチゾール、抗酸化酵素、過酸化物などのさまざまな血液評価が測定に含まれた。 さらに、この研究では、認知評価の一部として、ミニ精神状態検査(MMSE)、アルツハイマー病評価スケール認知サブスケール(ADAS-Cog)、臨床認知症評価(CDR)、日常生活活動スケール(ADL)などのアンケートの使用が含まれていました。 さらに、次世代シーケンス (NGS) を利用して腸内細菌叢の組成の変化を分析しました。 |
| 公平な評価を確保するために、評価結果と有害事象は、患者に割り当てられた研究グループを知らされていない独立した医師によって評価されました。 |
| 2.3.1. 生化学的パラメーターの評価 |
| アルツハイマー病患者から血液サンプルを採取し、12週間のプロバイオティクス介入の前後に、脳由来神経栄養因子、サイトカインレベル(IL-1βおよびIL-10)、コルチゾール、酸化活性(スーパーオキシドジスムターゼ(SOD)、マロンジアルデヒド(MDA)、タンパク質カルボニル化含量(PCC))を分析するために使用しました。 血清脳由来神経栄養因子、IL-1β、および IL-10 の定量は、酵素結合免疫吸着検定法 (ELISA) キット (BioLegend, Inc.、San Diego, CA, USA) を使用して達成されました。 血清コルチゾールレベルは、ROCHE Cobas E601/Beckman DxC 800 (Beckman Coulter Inc.、 Brea, CA, USA) を使用して測定しました。 さらに、スーパーオキシドジスムターゼ(SOD)、マロンジアルデヒドおよび タンパク質カルボニル化含量の血清レベルは、Cayman Chemical (Ann Arbor, MI, USA) によって概説されたプロトコールに従って、アッセイキットを使用して測定されました。 続いて、酵素結合免疫吸着検定法 (ELISA)リーダー (CLARIOstar® Plus、BMG Labtech、Ortenberg、Germany) を使用してサンプルを測定しました。 |
| 2.3.2. 認知機能および日常生活機能の評価 |
| ミニ精神状態検査(MMSE)は、時間に対する見当識、場所に対する見当識、登録、注意と計算、想起、言語、反復、および複雑な指示の理解を評価し、0 から 30 の範囲の合計スコアを提供し、スコアが高いほど認知機能が良好であることを示します [29] ]。 臨床認知症評価(CDR)は、参加者の家族または主な介護者との面接を通じて決定されます。臨床認知症評価には、記憶力、見当識能力、判断力と問題解決、地域社会の事情、家庭と趣味、パーソナルケアを評価するための 6 つの領域が含まれています。 臨床認知症評価スコアの範囲は 0 (認知症なし) から 3 (重度の認知症) です [30]。 アルツハイマー病評価スケール認知サブスケール(ADAS-Cog)は、単語の想起、物体や指の名前付け、コマンドに従うこと、構造的な練習、観念的な練習、見当識、単語認識タスク、テストの指示の記憶、話し言葉、理解、単語の検索など、いくつかの領域をカバーする包括的な評価を提供します。アルツハイマー病評価スケール認知サブスケールは 0 から 70 の範囲の合計スコアを生成し、スコアが高いほど認知機能が低下していることを示します [31]。 日常生活活動スケール(ADL)検査は、日常生活動作に必要な基本的な動作を6項目の基本的日常生活動作項目と17項目の手段的日常生活項目の計23項目で評価します。 このスケールは 0 から 78 の範囲の合計スコアを生成し、スコアが低いほど依存性と日常生活の困難が増大していることを示します [32]。 これらの評価は、介入の前後に認定臨床心理士によって行われました。 |
| 2.3.3. 糞便 DNA 抽出と次世代シーケンス (NGS)分析 |
| 0 週目と 12 週目に糞便採取チューブを使用して参加者から糞便サンプルを収集し、すぐに -80 °C で保存しました。 標準プロトコールに一部変更を加えた QIAamp Fast DNA Stool Mini Kit (Qiagen、Hilden、Germany) を使用して、室温まで温めた糞便サンプルから細菌 DNA を抽出しました。 糞便サンプルを 13,200 rpm で 10 分間遠心分離して保存バッファーを除去し、続いて Inhibit EX バッファーを使用して溶解しました。 ホモジナイズ後、プロテイナーゼ K とエタノールをサンプルに添加し、処理された上清を得ました。 続いて、上清をQIAampスピンカラムで洗浄し、溶出バッファーで溶出した。 抽出された DNA の濃度は、NanoDrop 2000 (Thermo Fisher Scientific Inc.、Waltham, MA, USA) を使用して評価し、溶出バッファーで 10 倍の希釈を実行しました。 |
| 腸内マイクロバイオーム ライブラリは、16S rRNA 遺伝子の標準的な V3 ~ V4 領域を使用して生成されました。 ポリメラーゼ連鎖反応 (PCR) 増幅は、KAPA HiFi HotStart ReadyMix (Roche、Basel, Switzerland) を使用して実行され、得られたポリメラーゼ連鎖反応 (PCR)産物は、AMPure XP 磁気ビーズ (Beckman Coulter Inc.、Brea, CA, USA) を使用して精製されました。 増幅されたポリメラーゼ連鎖反応 (PCR)産物の質と量は、それぞれ Fragment Analyzer (Advanced Analytical、Orangeburg, NY, USA) と Qubit 3.0 蛍光光度計 (Thermo Fisher Scientific Inc.、Waltham, MA, USA) を使用して評価されました。 続いて、構築したライブラリーを MiSeq プラットフォーム (Illumina、San Diego, CA, USA) でペアエンドリード (2 × 301 nt) で配列決定しました。 各サンプルは少なくとも 100,000 のリードを生成するようにシーケンスされました。 |
| データ取得後、生のペアエンド読み取りは、GreenGene データベース バージョン 13.8 に従ってトリミングを受けました。 その後、品質フィルターを正常に満たしたリードが、97% の類似性しきい値に基づいて運用分類単位 (OTU) に割り当てられました。 シングルトンとして表示されたシーケンス、またはデータベースへのマッピングに失敗したシーケンスは、データセットから削除されました。 次に、運用分類単位 (OTU)の注釈に続いて分類学的分類が実行されました。 アルファ多様性、ベータ多様性、および上位 7 門が使用されました。 アルファ多様性 (Chao1) 分析は各サンプル内の種の複雑さを評価し、ベータ多様性 (Bray-Curtis) 分析は微生物群集間の区別を評価しました。 |
| 2.4. 統計分析 |
| 数字で示される性別分布は、ピアソンのカイ二乗検定を使用して分析されました。 連続変数は、95% 信頼区間の平均 ± 標準偏差またはオッズ比 (OR) として表され、IBM SPSS Statistics バージョン 22.0 (IBM Co.、Armonk, NY, USA) による Student の t 検定を使用して評価されました。 統計的有意性は、0.05 未満の p 値として定義されました。 |
| 3. 結果 |
| 3.1. 参加者募集 |
| スクリーニングを受けたアルツハイマー病の参加者合計 40 人が、En Chu Kong 病院でこの研究に登録されました。 参加者全員は、アルツハイマー病の標準治療法として、アセチルコリンエステラーゼ阻害剤(ドネペジルまたはリバスチグミン)および/またはN-メチル-D-アスパラギン酸受容体拮抗薬メマンチンなどの薬剤を併用しています。 それらはすべて、割り当て段階でアクティブコントロールグループ(N = 20)または治療グループ(N = 20)のいずれかにランダムに割り当てられました。 各グループでは、治療の拒否/同意の撤回 (患者 2 人)、管理/その他 (患者 1 人)、およびプロトコール違反 (患者 1 人) により追跡調査ができなくなった参加者 4 人が含まれ、結果として各グループは成功した 16 人の参加者で構成されました。 試験を完了し、分析用の完全なデータを取得しました (図 1)。 アクティブコントロールグループと治療グループの平均年齢は、それぞれ75.8±7.3歳と75.4±8.0歳でした(p=0.872)、男女比(女性/男性)はアクティブコントロールグループ8/8、治療グループ12/4(p=0.144)でした。 年齢と性別は、アクティブコントロールグループと治療グループの間で統計的に有意な差を示さなかった。 |
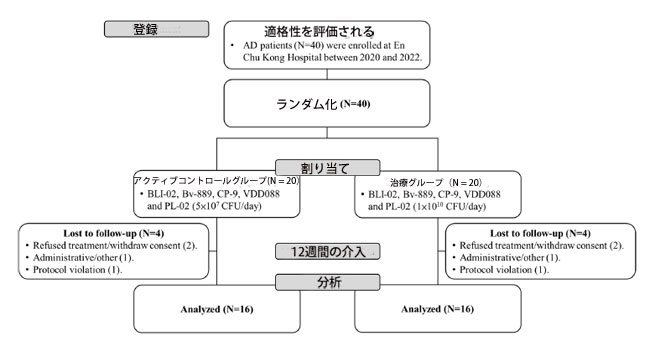 |
| 図1 アルツハイマー病患者登録の臨床フローチャート |
| 3.2. 脳由来神経栄養因子レベル |
| アルツハイマー病は多面的な症状であり、脳由来神経栄養因子はそのレベルが アルツハイマー病の発症に関連する可能性があるいくつかの要因のうちの 1 つにすぎません。 アルツハイマー病患者の血清脳由来神経栄養因子レベルは、健康な人よりも低いことが判明した[14、33]。 12週間の介入後、アクティブコントロールグループの脳由来神経栄養因子レベルは有意な変化を示さなかった。 ただし、治療グループの脳由来神経栄養因子レベルはベースライン値 7115.1 ± 4461.9 pg/mL からエンドポイントの 9678.5 ± 6652.9 pg/mL まで有意に増加したことが観察されました (** p = 0.005)。 さらに、治療グループの脳由来神経栄養因子 レベルの変化倍数は、アクティブコントロールグループと比較して有意な増加を示しました (136.3% 対 98.5%、* p = 0.049、図 2)。 |
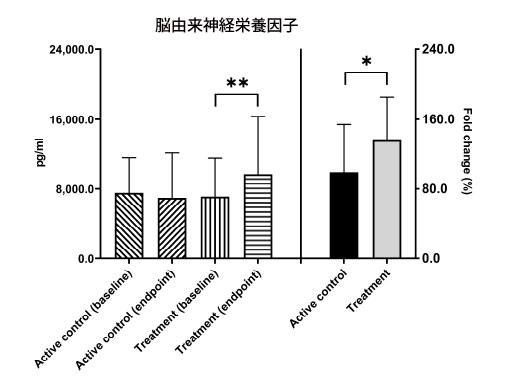 |
図2 ベースライン時と、アルツハイマー病患者のアクティブコントロールグループおよび治療グループにおけるプロバイオティクス介入の12週間後に、血清脳由来神経栄養因子レベルを分析した。 BDNF = 脳由来神経栄養因子。 * p < 0.05、** p < 0.01、グループ内またはグループ間の有意差を示します。 |
| 3.3. 炎症性バイオマーカー、コルチゾールレベル、および抗酸化能力 |
| 神経変性疾患の病理学的メカニズムにおいて、炎症過程はアルツハイマー病の重要な因子として認識されている[34]。 IL-1βは炎症促進性サイトカインとして機能し、IL-10は炎症性サイトカインの産生を効果的に抑制します。 図 3A では、治療グループの IL-1β レベルが 12 週間の介入後に有意に減少したことが示されています (2.7 ± 1.2 から 2.5 ± 1.2 pg/mL、* p = 0.041)。 アクティブコントロールグループには大きな変化はありませんでした。 IL-1β の変化倍数に関しては、これら 2 つのグループ間で有意な差が見つかりました。 (106.1% 対 90.7%、* p = 0.043)。 図 3B では、IL-10 のレベルは、アクティブコントロールグループと治療グループの両方でベースラインとエンドポイントを比較したときに有意な変化を示さず、レベルの変化倍数に基づいても、これら 2 つのグループ間に有意差は見られませんでした。 さらに、コルチゾールは海馬に対する炎症促進性サイトカインの毒性作用を増強し、それによってアルツハイマー病の病理学的進行を促進する可能性がある[35]。 介入後のコルチゾールレベルの有意な変化は、実薬対照群と治療群の両方で観察されませんでした。 コルチゾール減少の倍率変化は、アクティブコントロールグループと比較して治療グループで有意に大きかった (119.4% 対 94.3%、* p = 0.039、図 3C)。 マロンジアルデヒドおよび タンパク質カルボニル化含量活性に対する研究プロバイオティクスの有効性に関しても、同様の所見が見つかりました。 脂質過酸化の副産物であるマロンジアルデヒドとタンパク質酸化の指標であるタンパク質カルボニル化含量は、どちらも老化とアルツハイマー病に関連していることが確立されています [36,37]。 ベースラインとエンドポイントの血清レベルの比較では、これらの酸化バイオマーカーの有意な減少は見られませんでしたが、コルチゾール減少の倍率変化は、アクティブコントロールグループよりも治療グループで有意に大きかった (マロンジアルデヒド、120.4% 対 89.8%、* p = 0.046、図 3D、タンパク質カルボニル化含量、115.0% 対 85.9%、* p = 0.043、図 3E)。 活性酸素種 (ROS) と抗酸化物質の間の不均衡によって引き起こされる酸化ストレスは、アルツハイマー病の進行において極めて重要な役割を果たしました [36]。 図 3F では、治療グループの抗酸化スーパーオキシドジスムターゼ(SOD)活性は、介入後にベースラインの 1.3 ± 0.3 から 1.6 ± 0.6 U/mL (* p = 0.012) まで有意に増加しました。 さらに、スーパーオキシドジスムターゼ活性の変化倍数は、アクティブコントロールグループと比較して、治療グループの方が有意に高かった (100.6% 対 126.1%、* p = 0.040)。 |
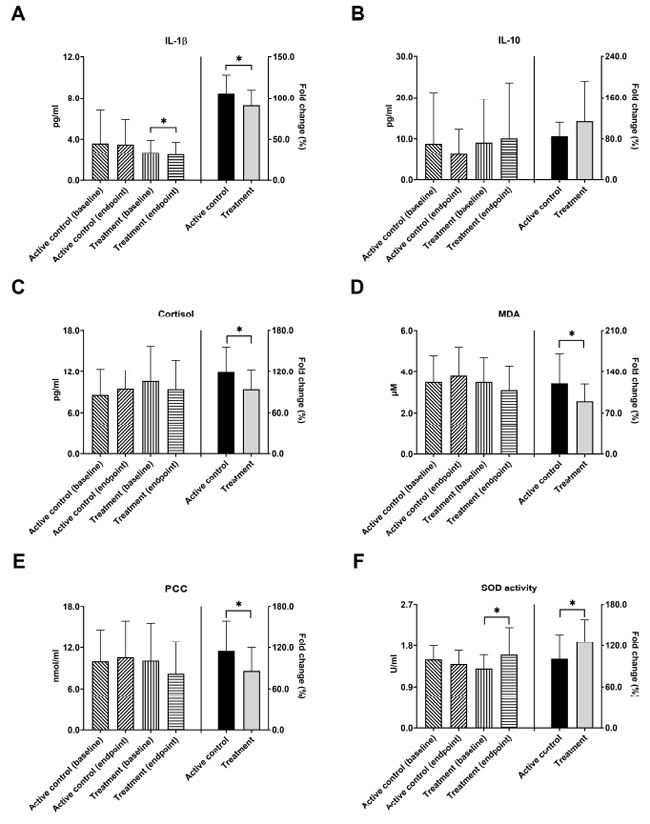 |
図3 プロバイオティクスのサプリメントは、アルツハイマー病患者の炎症、コルチゾール、酸化ストレスを調節しました。 アクティブコントロールグループおよび治療グループのアルツハイマー病患者の(A) IL-1β、(B) IL-10、(C) コルチゾール、(D) マロンジアルデヒド、(E) タンパク質のカルボニル含有量、および (F) スーパーオキシドジスムターゼ活性の血清レベルをベースライン時とプロバイオティクス介入 12 週間後に分析しました。 介入前後の値は左側の Y 軸にプロットされ、倍率変化は右側の Y 軸にプロットされました。 IL-1β= インターロイキン 1 ベータ。 IL-10 = インターロイキン-10; SOD = スーパーオキシドジスムターゼ。 MDA = マロンジアルデヒド; PCC = タンパク質のカルボニル含有量。 * p < 0.05 は、グループ内またはグループ間の有意差を示します。 |
| 3.4. 認知機能 |
| 介入中のアクティブコントロールグループと治療グループの認知テストスコア(アルツハイマー病評価スケール - 認知サブスケール、ミニ精神状態検査、日常生活動作、臨床認知症評価)を表1に示しました。 グループ内では、ベースラインから 12 週間の介入終了まで、これら 4 つの評価スケールに有意差はありませんでした。 さらに、スコアの倍率変化では、アクティブ コントロール グループとプロバイオティクス グループで有意差は示されませんでした (データは示されていません)。 アルツハイマー病評価スケール - 認知サブスケール(105.4 ± 23.7 対 105.5 ± 27.5、p = 0.988); ミニ精神状態検査(101.8 ± 11.9 対 101.1 ± 12.9、p = 0.807); 日常生活動作 (101.2 ± 11.6 対 95.8 ± 22.5、p = 0.400); 臨床認知症評価 (112.5 ± 46.5 対 100.0 ± 31.6、p = 0.381)。 アルツハイマー病進行に対するプロバイオティクスサプリメントの効果に対する年齢と性別の潜在的な影響を評価するために、セグメント分析が実施されました。 非悪化は、介入後のミニ精神状態検査および日常生活動作のスコアの増加または維持、またはアルツハイマー病評価スケール - 認知サブスケールおよび臨床認知症評価のスコアの減少または維持として定義されました。 アルツハイマー病評価スケール - 認知サブスケールの年齢および性別を調整した オッズ比(オッズ比 = 0.9、95% CI = 0.2 ~ 4.1、p = 0.846)、ミニ精神状態検査(オッズ比= 1.1、95% CI = 0.2 ~ 5.0、p = 0.910)、日常生活動作 (オッズ比= 2.3、95% CI = 0.4 ~ 12.8、p = 0.330)、および 臨床認知症評価 (オッズ比= 6.0、95% CI = 0.5 ~ 76.9、p = 0.169) を図 4 に示します。 各評価スケールにおいて、オッズ比に有意差はありませんでしたが、治療グループは アルツハイマー病患者の非悪化を優先しました。 |
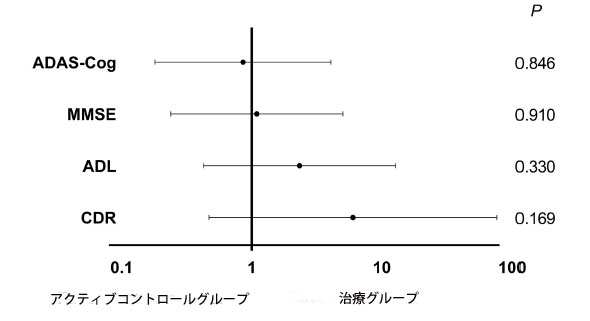 |
図4 アルツハイマー病評価スケールにおけるプロバイオティクスサプリメントによる12週間の介入における、アクティブコントロールグループまたは治療グループの95%信頼区間(95%CI)のオッズ比が決定されました。 95% CI のこれらの オッズ比は、介入前後のスコアを比較する際に悪化があったかどうかを評価するための二分変数として使用されました。 OR = オッズ比。 ADAS-Cog = アルツハイマー病評価スケール - 認知サブスケール。 MMSE = ミニ精神状態検査。 ADL = 日常生活動作。 CDR = 臨床認知症評価。 |
| 表 1 アルツハイマー病患者の年齢、性別、ベースラインおよびエンドポイントの認知機能を調べた |
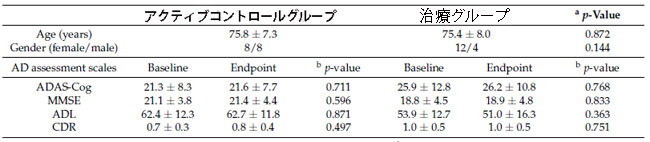 |
データは平均±標準偏差として表されます。 a: 実薬対照群と治療群の差。 b: ベースラインとエンドポイントの差。 略語: ADAS-Cog = アルツハイマー病評価スケール - 認知サブスケール。 MMSE = ミニ精神状態検査。 ADL = 日常生活動作。 CDR = 臨床認知症評価。 |
| 3.5. 腸内細菌叢の構成の変化 |
| プロバイオティクスの補給がアルツハイマー病患者の腸内細菌叢の組成に影響を与えるかどうかを解明するために、細菌存在量指数 Chao1 (α 多様性指数) と、Bray-Curtis を使用して評価されたクラスター類似性 (β 多様性指数) をベースライン時と 12 週間の介入後に分析しました。 ただし、Chao1 指数 (図 5A、p = 0.530) およびブレイ・カーティス (図 5B、p = 0.607) の類似性には、アクティブコントロールグループと治療グループの両方で有意差は観察されませんでした。 介入前後のアルツハイマー病患者において、最も豊富な上位 7 門の細菌組成を比較しました (図 5C)。 12 週間の介入後、治療グループではBifidobacterium (1.3% ~ 3.9%、p = 0.317)、Lactobacillus (0.1% ~ 0.3%、p = 0.354)、Ruminococcus (2.9% ~ 4.8%、p = 0.286)、属レベルではClostridium (4.6% ~ 6.4%、p = 0.321)、およびAkkermansia (0.9% ~ 1.0%、p = 0.934) の存在量が増加しました。 逆に、治療グループではMegamonasの存在 (4.8% ~ 1.5%、p = 0.213) が減少しました。 |
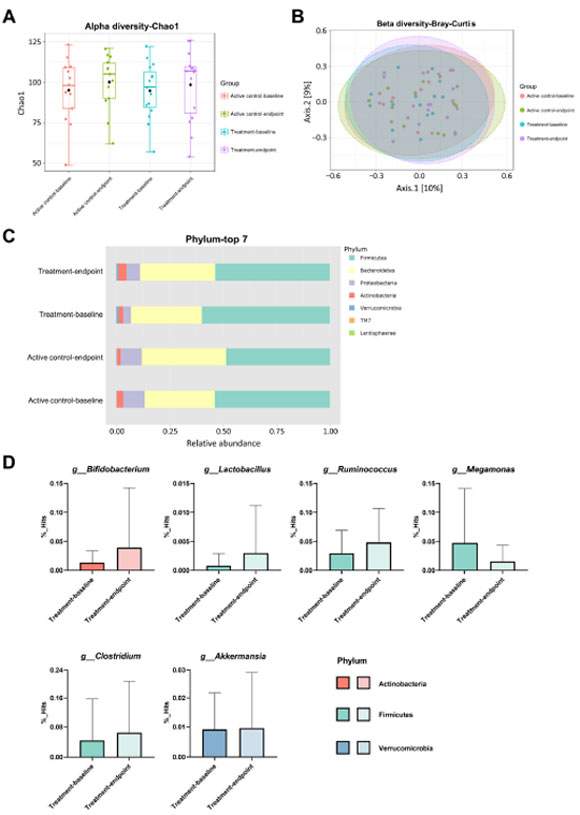 |
図5 アルツハイマー病患者に対する12週間のプロバイオティクス介入後の腸内細菌叢の多様性、上位7門、および変化した属が分析されました。 (A) アルファ多様性、(B) ベータ多様性、(C) 最も豊富な上位 7 門の組成、および (D) 治療グループにおける変化した属を調べました。 |
| 4.討議 |
| アルツハイマー病は認知機能の低下を引き起こす神経変性疾患であり、現時点では根治療法はありません [38]。 この研究では、アルツハイマー病患者に対する12週間の介入後の治療グループにおいて、血清脳由来神経栄養因子レベルの有意な増加、炎症性サイトカインIL-1βレベルの低下、および抗酸化スーパーオキシドジスムターゼ活性の増加が観察されました。 さらに、低用量のグループよりも、高用量のプロバイオティクスサプリメントを摂取したグループの方が、より大きな利益が得られたことがわかりました。 私たちの知る限り、これはプロバイオティクスサプリメントの有効性に関する最初の無作為化、二重盲検、実薬対照試験であり、特に脳由来神経栄養因子およびさまざまな炎症性および抗酸化性バイオマーカーに焦点を当てています。 すでに臨床的にアルツハイマー型認知症と診断されている対象者が対象です。 |
| 脳由来神経栄養因子は、シナプス伝達の調節、ニューロンの可塑性の促進、神経炎症とニューロンのアポトーシスの防止において極めて重要な役割を果たします。 血清脳由来神経栄養因子は、高齢者の認知機能の生物学的指標です [39]。 アルツハイマー病患者の血清脳由来神経栄養因子レベルは、健康な人の血清脳由来神経栄養因子レベルよりも低いことが判明しました [14]。 Leyhe らは、ドネペジルによる 15 か月の治療後、アルツハイマー病患者の血清脳由来神経栄養因子レベルが上方制御され、健常者と比較して有意差が見られないと報告しました [40]。 Kangらは、老化の初期段階にある高齢女性の一貫した水中運動が脳由来神経栄養因子の発現を上昇させ、認知機能の維持と改善に寄与する可能性があると指摘した。 これは、神経栄養因子の産生を促進するための早期の老化防止対策と運動の重要性を明らかにしています[41]。 プロバイオティクスは、食品添加物として利用されるか発酵微生物として利用されるかにかかわらず、徐々に人々の生活と医療にとって一般的なサプリメントになってきました。 Lactobacillus plantarum DW2009 の経口摂取により血清中の脳由来神経栄養因子レベルが上昇し、認知機能の改善に寄与することが報告されています [42]。 偶然にも、地域の高齢者に焦点を当てた臨床研究でも、12週間のプロバイオティクス摂取後に血清脳由来神経栄養因子の有意な増加が明らかであることが確認されている[43]。 この研究では、12週間の介入後に治療グループの血清脳由来神経栄養因子レベルの有意な増加が観察され、脳由来神経栄養因子の変化倍数はアクティブコントロールグループよりも高かった。 これは、プロバイオティクスサプリメントが脳由来神経栄養因子発現を改善し、アルツハイマー病患者の認知機能を強化する可能性があることを示唆しています。 |
| 炎症誘発性サイトカインは、アルツハイマー病を含む中枢神経系損傷および神経変性疾患において重要な役割を果たしています [44、45、46]。 免疫系の炎症プロセスは、チューブリン関連ユニットタンパク質の過剰なリン酸化を通じて神経変性疾患の発症につながる可能性があります [47]。 研究では、脳由来神経栄養因子の発現と神経炎症の制御の間には双方向の関係があり、IL-1β は PI3-K 経路を通じて脳由来神経栄養因子の活性を低下させ、それによって 脳由来神経栄養因子の神経保護能力を低下させる可能性があることが示されています [48]。 アルツハイマー病患者の脳では、炎症誘発性サイトカインIL-1βのレベルの上昇が観察されている[49]。 私たちのデータは、プロバイオティクスサプリメントがアクティブコントロールグループと比較してIL-1βを下方制御することが示されたことを示しています。 プロバイオティクスが炎症因子 IL-1β を調節し、血清脳由来神経栄養因子の上方制御につながる可能性があることが示唆されています。 |
| コルチゾールは慢性ストレスを調節すると考えられているホルモンであり、アルツハイマー病患者ではコルチゾールレベルが高く、これが認知変性の危険因子である可能性があることが知られています[50、51、52]。 乳酸菌とビフィズス菌のプロバイオティクス混合物は、高齢のラットのコルチゾールレベルを効果的に低下させ、脳の代謝物を変化させることができます[53]。 この研究では、介入中にコルチゾールレベルに大きな変化は見られませんでしたが、治療グループのコルチゾール減少の倍率変化はアクティブコントロールグループよりも大きかった。 |
| 酸化ストレスは、アルツハイマー病の病因の特徴である β-アミロイド (Aβ) タンパク質の蓄積を促進するため、アルツハイマー病と密接に関連しています [45、54、55、56、57]。 活性酸素種はまた、神経脂質分子を変化させ、膜特性の変化や、4-ヒドロキシノネナールやマロンジアルデヒドなどの脂質過酸化副産物の形成を引き起こします。 酸化プロセスは、カルボニル基を追加することによってタンパク質にも影響を与えます [55]。 アルツハイマー病患者は脂質過酸化とタンパク質カルボニルのレベルの上昇を示すことが多く、これは酸化ストレスの増加を示しています [58]。 プロバイオティクスのサプリメントは、炎症を軽減し、スーパーオキシドジスムターゼを増加させ、酸化ストレスを低下させることが示されています[59]。 KaushalとKansalは、Lactobacillus acidophilus とBifidobacterium bifidum を含むプロバイオティクスDahiを4ヶ月間投与すると、生後12ヶ月のマウスの血漿タンパク質のカルボニル含有量が大幅に減少したことに注目した[60]。 同様に、私たちの以前の研究では、プロバイオティクスのサプリメントが老化マウスモデルの脳内のマロンジアルデヒドレベルを低下させることが示されました[17]。 これらの発見を考慮すると、特定のプロバイオティクスは強力で効果的な抗酸化能力を示しています。B. longum subsp. infantis BLI-02、B. breve Bv-889、B. animalis subsp. lactis CP-9、 B. bifidum VDD088およびL. plantarum PL-02を含む複数株のプロバイオティクスが、包括的な抗酸化プロバイオティクスの組み合わせであることが確認されました。 本研究の結果は、アルツハイマー病患者に対する12週間の介入後にプロバイオティクスがスーパーオキシドジスムターゼ活性を高め、マロンジアルデヒドやタンパク質のカルボニル含有量などの過酸化マーカーを減少させるという証拠を裏付けるものである。 |
| 研究では、Bifidobacterium breve MCC1274 を 24 週間摂取すると、軽度認知障害 (MCI) の高齢患者の認知機能を強化し、脳萎縮の進行を抑制できることが示されています [61]。 この研究では、12週間の介入後にアルツハイマー病評価スケール - 認知サブスケール、ミニ精神状態検査、日常生活動作、臨床認知症評価によって評価された認知機能に有意な改善は見られなかったが、治療グループのスコアはアルツハイマー病症状の悪化率を低下させる傾向を示した 。 おそらく、介入期間が短く、サンプルサイズが小さいことが、臨床的に有意ではない結果の理由の一部であると考えられます。 アルツハイマー病患者に対するプロバイオティクスサプリメントの効果を確認するには、投与時間を延長したさらなるランダム化比較試験が必要である。 |
| 腸内細菌叢とアルツハイマー病との関係は完全には理解されていません。 腸内細菌叢の不均衡は、海馬および皮質中脳の脳由来神経栄養因子レベルの低下につながり、腸-脳軸を介して認知障害を引き起こす可能性がある[62]。 複数の報告により、アルツハイマー病患者では細菌の多様性が低下し、Firmicutes と Bifidobacteriumが減少し、Bacteroidetesが増加していることが示されている[63,64]。 さらに、 Actinobacteria の増加も観察されています[65]。 研究では、Clostridiumのレベルが高いほど認知能力が向上することが示唆されています[66]。 Ruminococcus やClostridiumなどの酪酸生成細菌は、未処理の炭水化物を代謝し、腸内で短鎖脂肪酸と乳酸を生成することが確認されています[67]。 短鎖脂肪酸は、中枢神経系における脳由来神経栄養因子の効果を調節するとも考えられています [68]。 この代謝プロセスは、Lactobacillus やBifidobacteriumの増殖をサポートします[67]。 別の研究では、Akkermansia がアルツハイマー病モデルマウスの脳の病理学的変化を遅らせ、空間学習と記憶障害を軽減することが示された[69]。 私たちの以前の研究では、プロバイオティクスサプリメントが高齢マウスの腸内細菌叢のBifidobacterium, Lactobacillus, や Akkermansiaを増加させることを観察しました[17]。 今回の研究では、治療グループの腸内細菌叢は、属レベルでBifidobacterium, Lactobacillus, Ruminococcus, Clostridium, とAkkermansiaにわずかな変化を示し、これらすべてが増加する一方、Megamonas は減少したことが明らかになった。 しかし、門および属レベルでのこれらの変化は、12 週間の介入後も有意な差はなく、介入後のアクティブ コントロール グループと治療グループ間のアルファおよびベータの多様性には有意な差は示されませんでした。 食事、環境、投薬、気分など、いくつかの要因がヒトの微生物叢に影響を与える可能性があります。 参加者の数が少ないことも、この短期間の介入では重要ではない結果につながる可能性があります。 |
| 本研究には限界がないわけではない。 まず、参加者のアルツハイマー病の診断は、アルツハイマー病バイオマーカーの確認なしに、精神障害の診断と統計マニュアル、第 5 版の基準、国立神経・コミュニケーション障害・脳卒中研究所およびアルツハイマー病および関連障害協会(アルツハイマー病基準)または 2011 年の国立老化・アルツハイマー病協会基準ガイドラインに基づいていました。 2018 年に更新された 国立老化・アルツハイマー病協会基準ガイドライン [70] によると、近年、アルツハイマー病の診断は生物学的定義に向けて行われています。 陽電子放射断層撮影画像法や脳脊髄液や血液の検査によって発見された、異常なタンパク質アミロイド斑またはチューブリン関連ユニットを伴う脳沈着物の証拠がある人は、アルツハイマー病と診断できます。 前臨床的であろうと症候性であろうと、アルツハイマー病は認知障害の存在に基づいています。 2020年にこの研究で患者の登録が開始されたとき、この研究の参加者全員が以前に包括的な医学的評価を受けていたにもかかわらず、診断を行うためにこれらのアルツハイマー病バイオマーカーは使用されませんでした。 典型的な臨床症状、精神検査、血液検査、および他の認知症疾患を除外するための神経画像検査が含まれます。 アルツハイマー病バイオマーカー (画像または体液) が確認されないまま、アルツハイマー病の診断は前述の基準に従って神経科医を調査することによって行われましたが、この基準は更新された 2018 国立老化・アルツハイマー病協会基準ガイドラインを完全には満たしていませんでした。 第二に、最後の評価は、参加者が研究用プロバイオティクスの摂取を中止した後の微生物のその後の変化を追跡調査することなく、12週目に実施されました。 これらのプロバイオティクスサプリメントの有効性をより詳しく調査するには、将来的には、より長期間の追跡調査と、患者がサプリメントの摂取を完了した後の糞便微生物の繰り返し評価を行う研究が必要です。 |
| 5.結論 |
| この臨床試験の結果は、対象集団のサンプルサイズが小さく、短期間の介入であっても、アルツハイマー病患者におけるプロバイオティクスのプラスの影響の証拠を提供します。 我々は、十分な用量と適切なプロバイオティクスサプリメントの配合により、すでに臨床的にアルツハイマー病と診断されている認知症患者において、酸化ストレスの減少と抗酸化物質の増加とともに血清脳由来神経栄養因子を強化できると結論づけた。 プロバイオティクスには、症候性アルツハイマー病患者の認知機能の低下を遅らせる潜在的な利点がある可能性があります。 プロバイオティクスの臨床上の利点を確認するには、より大きなサンプルサイズとより長い介入期間を用いたさらなる研究が必要です。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Nutrients. 2024 Jan; 16(1): 16に掲載されたEfficacy of Probiotic Supplements on Brain-Derived Neurotrophic Factor, Inflammatory Biomarkers, Oxidative Stress and Cognitive Function in Patients with Alzheimer's Dementia: A 12-Week Randomized, Double-Blind Active-Controlled Study. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


