ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
乳酸菌胃食道逆流症の実験モデルにおける 胆汁誘発性活性酸素種によって引き起こされるDNA損傷の修復を促進する |
Joshua N. Bernard et al., |
|
|
| 要約 |
胃食道逆流症(GERD)は、胆汁誘発性の活性酸素種と酸化ストレスを食道組織に蓄積させ、炎症と DNA 損傷を引き起こします。 健康な食道から胃食道逆流症、そして最終的にはがんへと進行するシーケンスは、マイクロバイオームの変化と関連しています。 乳酸菌は、健康な食道におけるプロバイオティクスと抗酸化物質の特性で知られる共生生物です。 このことから、胃食道逆流症の際に胆汁が豊富な環境で乳酸菌がどのように生存するかを調査し、胆汁で損傷した食道細胞との相互作用を特定することができました。 人間の逆流状態をモデル化するために、我々は 3 つの乳酸菌 (L. acidophilus, L. plantarumおよびL. fermentum) を胆汁に曝露しました。 すべての種は胆汁に耐性があり、おそらく胃食道逆流症条件下で食道上皮に定着できる可能性があります。 次に、乳酸菌の抗酸化能力と胆汁損傷修復における役割を評価しました。 私たちは、活性酸素種(ROS)マーカー 8-オキソ グアニンと COMET アッセイを使用して、胆汁誘発 DNA 損傷を測定しました。 胆汁損傷後に乳酸菌を添加すると、pH2AX/RAD51の動員を通じて胆汁誘発性DNA損傷の修復が促進され、食道細胞におけるNFκB関連炎症が減少した。 この研究は、乳酸菌の抗遺伝毒性および抗炎症効果を実証し、胃食道逆流症患者におけるバレット食道および食道腺がんの予防において乳酸菌が大きな関心を集めているものとなっています。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.材料と方法 |
| 2.1. 細胞株 |
| 2.2. 細菌培養 |
| 2.3. 適応アッセイ |
| 2.4. 細菌の増殖曲線 |
| 2.5. バイオフィルム |
| 2.6. 疎水性 |
| 2.7. 胆汁および/または乳酸菌による食道上皮細胞の治療 |
| 2.8. COMET アッセイ |
| 2.9. 免疫蛍光 |
| 2.10. 統計分析 |
| 3. 結果 |
| 3.1. 乳酸菌はコール酸塩/デオキシコール酸塩胆汁酸塩攻撃に適応する |
| 3.2. 胆汁への曝露はストレス反応を誘発せずに指数関数的な成長を遅らせる |
| 3.3. 逆流液の生理学的モデルとしての牛胆汁は、乳酸菌の増殖において用量依存的な効果を示し、完全に回復し、バイオフィルム形成には変化がありません |
| 3.4. 胆汁誘導性NFκBシグナル伝達において乳酸菌は抗炎症能力を示す |
| 3.5. 乳酸菌は抗酸化作用を示す |
| 3.6. 胆汁にさらされた後の食道細胞に乳酸菌を添加するとDNA損傷が軽減される |
| 3.7. 乳酸菌の添加によりDNA二本鎖切断修復が加速される |
| 4.討議 |
| 4.1. 活性酸素種誘発炎症およびDNA損傷時の乳酸菌の抗酸化機能 |
| 4.2. DNA損傷の修復 |
| 5.結論 |
本文 |
| 1.はじめに |
| 胃内容物が食道へ逆流する状態である胃食道逆流症(GERD)に苦しむ患者の数は増加しています。 2019 年には、世界で 7 億 8,500 万件の胃食道逆流症の症例が報告され、これは 1990 年と比べて約 75% という驚異的な増加です [1]。 米国内では、最も診断されている消化管疾患の 1 つです。 約 20% の有病率は、胃食道逆流症に苦しむ人々の生活の質に悪影響を与えるだけでなく、経済的および医療上の大きな負担となります [2]。 胃酸や胆汁酸塩を含む胃逆流液に食道がさらされると、細胞や DNA に損傷が生じ、炎症が引き起こされることが知られています。 この状態が続くと、前がん状態であるバレット食道に移行し、食道腺がんの主な危険因子となります[3、4、5]。 低 pH および胆汁酸への短時間の曝露であっても、酸化ストレスおよび酸化 DNA 損傷との関連性は初期に認識されていました [5]。 胆汁への曝露による反復的な DNA 損傷は、腫瘍抑制遺伝子やがん遺伝子の変異などの変異率を増加させると考えられています [6]。 |
| 最近では、プロバイオティクスががん予防の代替治療法として提案されました。 特にプロバイオティック乳酸菌は、抗発がん作用を持つ重要な微生物であると考えられています[7]。 さまざまな乳酸菌が、in vitroおよびin vivoで抗増殖特性を示します[8]。 乳酸菌は重要な共生生物であり、ほとんどの菌株は酸耐性があるため、酸に長時間さらされて増殖阻害や細胞死を引き起こさない限り、胃腸管などの特定のニッチ環境に定着することができます[9]。 我々は、胃食道逆流症の食道環境を模倣する胆汁酸塩曝露条件下でのさまざまな乳酸菌の適応を評価することを目的としました。 胆汁は脂質の乳化剤として機能し、細菌の膜を溶解することもできるため、抗菌活性を与えることができます[10]。 コール酸やデオキシコール酸などの一次胆汁酸は肝臓で合成され、溶解性を高めるために分泌前にグリシンまたはタウリンと結合します。 脱結合は、いくつかの乳酸菌によって発現される胆汁酸塩加水分解酵素によって触媒され、アミド結合を加水分解し、グリシンまたはタウリンを分離します[10]。 したがって、胆汁酸塩加水分解酵素活性を持つ細菌株は胃腸管で見つかる可能性があり、我々は、抱合胆汁酸と非抱合胆汁酸が豊富な胃食道逆流症条件下で、それらの細菌株が食道に定着する可能性があると仮説を立てました。 正常な扁平上皮食道から胃食道逆流症およびバレット食道(BE)(訳者注:バレット食道は、食道下部の粘膜が、胃から連続して同じ円柱上皮に置き換えられている状態をいいます。 さらに80%は、食道がんの発生に関係する腸上皮化生(ちょうじょうひかせい) を含んでいて、食道がんに対してリスクが高い病気です)への進行は、主に常在グラム陽性菌からグラム陰性菌で構成されるコミュニティへのマイクロバイオームの変化と相関しています[11]。 興味深いことに、乳酸菌は胃腸管ではそれほど頻繁ではないようですが[12]、病気の食道が乳酸菌に特定のニッチを提供している可能性があると提案しました。 16S リボソーム RNA 配列分析により、食道腺がんの進行に伴って乳酸菌の存在量が増加することが示されました [13]。 とりわけヒドロキシルラジカルやスーパーオキシド分解を除去することによる抗酸化作用を考慮して[14]、我々は、胆汁損傷に関連する活性酸素種によって誘発されるDNA損傷の修復に対する乳酸菌の寄与を決定するために、食道細胞と乳酸菌の相互作用の効果を調査した。 |
| この研究では、L. acidophilus, L. plantarum, L. fermentumの3種の乳酸菌を利用し、2つの非抱合胆汁酸塩(コール酸ナトリウムとデオキシコール酸ナトリウム)および牛胆汁に対するそれらの適応を示しました。 我々は、in vitroでの胃食道逆流症関連遺伝毒性環境、すなわち胆汁曝露における乳酸菌と食道細胞の相互作用を評価し、酸化ストレスとDNA損傷がプロバイオティクス細菌によって修復できるかどうかを調査した。 8-オキソ-グアニンの存在とCOMETアッセイで示されるように、胆汁損傷とそれに続くDNA損傷後に乳酸菌を添加すると、NFκB媒介炎症が軽減されることがわかりました。 これらはまた、核 pH2AX や RAD51 などの二本鎖 DNA 修復タンパク質の動員を促進する可能性があり、乳酸菌の存在下で DNA 損傷反応が促進されることを示しています。 |
| 2.材料と方法 |
| 2.1. 細胞株 |
| 以前に記載されているように [15]、ヒト扁平上皮細胞 (STR) はケラチノサイト無血清培地 (GibcoTM Life Technologies Co.、カタログ番号 #10724-011、Grand Island, NY, USA) で培養されました。 上皮成長因子 (1 ng/mL)、ウシ下垂体抽出物 (0.05 mg/mL)、および 1% ペニシリン/ストレプトマイシン (GibcoTM Life Technologies Co.、#15140-122、Carlsbad, CA, USA) を添加しました。 細胞を37℃、5% CO2下で培養しました。 |
| 2.2. 細菌培養 |
| Lactobacillus acidophilus (#4356), Lactobacillus plantarum (#14917), および Lactobacillus fermentum (#14931, すべてAmerican Type Culture Collection, ATCC, Manassas, VA, USA)はすべて、De Man、Rogosa、およびSharpeブロス(MRS; Becton Dickinson、#288130、Sparks, MD, USA)37 °C、5% CO2で培養しました。 標準的な段階希釈プレーティングでは、細菌を MRS プレート上で増殖させました。 細菌を独立したコロニーから MRS で継代培養し、指数関数的増殖期に液体窒素中で 30 分間瞬間凍結し、-80 °C で保存しました。 CFU/mL を決定するために、細菌を PBS で段階希釈し、MRS プレートにスポットプレーティング (10 μL) しました。 |
| 2.3. 適応アッセイ |
| 胆汁に対する乳酸菌の適応能力を決定するために、Begley [16] によって以前に記載されているようにわずかに変更を加えた適応アッセイを実行しました。 乳酸菌を、コール酸ナトリウム/デオキシコール酸ナトリウム (CA/DCA) (Sigma-Aldrich、#B8756、St. Louis, MO, USA) 1:1 比の胆汁酸塩に、1% (陽性対照)、0.30% で曝露しました。 [16] に示されているように、30 秒間の指数関数的増殖期中の濃度は 0.08% (「致死量」) および 0.08% (「亜致死量」) です。 適応のために、乳酸菌を0.08%の「致死量未満」で5秒、30秒、5分間、または30分間処理して適応させた後、さらに30秒間0.30%の「致死量」に曝露した。 次いで、培養物をPBSで連続希釈し、MRSプレート上にスポットプレーティング(10μL)し、CFU/mLを取得した。 |
| 2.4. 細菌の増殖曲線 |
| 一晩培養したものを MRS で 1:10 に希釈し、96 ウェル プレートにロードしました (ウェルあたり 100 μL)。 コール酸塩/デオキシコール酸塩細菌をコール酸塩/デオキシコール酸塩胆汁に30秒間事前曝露し、MRSに接種する前にPBSで3回洗浄した。 牛胆汁(Sigma-Aldrich、#70168、St. Louis, MO, USA)を使用した実験では、細菌細胞をさまざまな濃度で前処理したMRSに接種しました。 次に、96 ウェル プレートを Biotek Synergy プレート リーダー (Agilent、Santa Clara, CA, USA) で 37 °C で 24 時間インキュベートしました。 このインキュベーション中、光学密度 (600 nm) を 5 分ごとに測定しました。 増殖曲線データは、GraphPad (Prism 8) 上でプロットおよび分析されました。 これらの実験は技術的に 3 回繰り返して実行され、2 回繰り返されました。 |
| 2.5. バイオフィルム |
| 一晩培養物を1:10に希釈し、96ウェルプレート(ウェルあたり100μL)中で24時間インキュベートした。 細菌細胞を、コール酸塩/デオキシコール酸塩または牛胆汁のいずれかを補充した前処理したMRSに接種した。 24 時間のインキュベーション後、プレートを脱イオン水で洗浄し、37 °C で 20 分間風乾しました。 バイオフィルムを染色するために、Millipore Sigma (Darmstadt, Germany) から購入したサフラニン #65092B-95 を調製し (6.04 g/L サフラニン、19% エタノール、および 1% メタノールを含む 125 mL、水で希釈)、ウェルに加えました。 室温で 20 分間インキュベートした後、サフラニンを廃棄し、ウェルを脱イオン水で洗浄し、37 °C で風乾しました。 染色されたバイオフィルムは、エタノールとアセトンの混合物 (80:20) に再懸濁することで解離されました。 Biotek Synergy プレートリーダー (Agilent、Santa Clara, CA, USA) で OD490 nm で吸光度を読みました。 結果は、培地のみを含むブランクに対して正規化され、グラフ化され、GraphPad Prism (Prism 8) を使用して分析されました。 実験は技術的には 3 回繰り返し、生物学的には 3 回繰り返して行われました。 |
| 2.6. 疎水性 |
| 細菌表面の疎水性を測定するために、セレブリャコバの方法をわずかに修正して採用しました [17]。 定常相での胆汁曝露後の細菌培養物(2 mL)をクロロホルム(500 mL)と混合し、2分間ボルテックスした後、37℃で15分間インキュベートして、水相と疎水相を分離しました。 この分離中に、疎水性細菌がクロロホルム (疎水性) 相に移動するにつれて、水 (親水性) 相の光学密度が減少します。 水層(Aa)を採取し、OD600 nmを測定した。 一晩培養物の OD600 nm (At) を測定して、相分離前の総細菌数を計算しました。 疎水性パーセントは次のように計算されました。 |
| 疎水性% = [(At − Aa/At)] × 100 |
| 2.7. 胆汁および/または乳酸菌による食道上皮細胞の治療 |
| 胆汁逆流を模倣するために、牛胆汁(脱水および精製)(Sigma-Aldrich、#70168、St. Louis, MO, USA)およびコール酸ナトリウム/デオキシコール酸ナトリウム塩の 1:1 混合物(Sigma-Aldrich、#B8756、St. Louis, MO, USA)の2 つの異なる胆汁曝露が使用されました。 15% 牛胆汁ストックは、ペニシリン/ストレプトマイシンを添加せずにケラチノサイト無血清培地 (Life Technologies Co.、10724-011、Grand Island, NY, USA) を使用して調製し、10%コール酸塩/デオキシコール酸塩ストックは 同じメディアです。 胆汁処理中、逆流をシミュレートするために、上皮細胞を 0.30% 牛胆汁または 0.08% コール酸塩/デオキシコール酸塩に 30 秒間曝露しました。 次いで、細胞をPBSで3回洗浄し、新しいケラチノサイト無血清培地を添加した。 「回復」条件では、上皮細胞を牛胆汁またはコール酸塩/デオキシコール酸塩胆汁に30秒間曝露した後、感染多重度(MOI)1で未曝露の乳酸菌を上皮細胞に添加した。 次に、COMET アッセイまたは免疫蛍光染色による分析の前に、処理後の細胞を培地 (細菌または培地のみの対照) で 30 分間「回復」してインキュベートしました。 |
| 2.8. COMET アッセイ |
| メーカーの指示に従って、中性条件用の TBE 電気泳動泳動溶液を利用して、DNA 損傷を測定する COMET アッセイ (Abcam、Waltham, MA, USA) を実施しました。 上で説明したように(セクション 2.7)、上皮細胞を胆汁、乳酸菌、またはその両方で処理しました。 COMET の長さは、頭の中央から尾の端までを測定することによって決定されました。 |
| 2.9. 免疫蛍光 |
| ヒト上皮細胞をチャンバースライド (Nalge Nunc International、#154526、Rochester, NY, USA) に播種し (50,000 細胞/ウェル)、上記で説明したように胆汁、乳酸菌、またはその両方で処理しました (セクション 2.7)。 処理後、細胞を30分間インキュベートした。 次に、細胞を PBS で洗浄し、メタノール/アセトン (1:1) で室温で 10 分間固定しました。 固定後、細胞を 0.5% Triton X-100 で 20 分間透過処理し、1% BSA で 1 時間ブロックしました。 スライドを一次抗体とともに 4 °C で一晩インキュベートしました (pH2A-X 1: 400; NFκB 1: 400; どちらも Cell Signaling Technology (Danvers, MA, USA); RAD51 (Abcam, Waltham, MA, USA) から購入) : 200; 8-オキソグアニン (Millipore、1: 250)、PBS で洗浄、 対応する二次抗体(Alexa Fluor 488 ヤギ抗マウス、Invitrogen by ThermoFisher A11001、Eugene, OR, USA; Alexa Fluor 594 ヤギ抗マウス、Invitrogen by ThermoFisher A11001、Eugene, OR, USA)と 4 °C で一晩インキュベートしました。 スライドをDAPI (Southern Biotech 0100-20、Roskilde, Denmark)でマウントした。 |
| 2.10. 統計分析 |
| 実験は生物学的複製で行われ、それぞれが少なくとも 3 つの技術的複製で構成されました。 データは、平均値±平均値の標準誤差として表示されます (SEM; n = 3)。 2 つの条件のみを相互に比較する場合、スチューデントの t 検定 (ウェルチの補正) を使用して統計的有意差を分析しました。 * p < 0.05、** p < 0.01、*** p < 0.001、**** p < 0.0001 の場合、統計的有意性が考慮されました。 複数の条件を比較する場合は、一元配置分散分析を使用しました。 統計的に有意な ANOVA の後にダネット補正が行われ、複数のグループが対照と比較されました。 * p < 0.05、** p < 0.01、*** p < 0.001、**** p < 0.0001 の場合、ダネット補正による統計的有意性が考慮されました。 |
| 3. 結果 |
| 3.1. 乳酸菌はコール酸塩/デオキシコール酸塩胆汁酸塩攻撃に適応する |
| 腸内細菌は、Salmonella sp., Escherichia coli, Bacillus cereus, やListeria monocytogenesに見られるように、胃腸管全体で遭遇する高濃度の胆汁に抵抗することができます[18]。 グラム陰性菌の胆汁耐性についてはほとんど情報がありませんが、本質的にグラム陽性菌よりも胆汁に対する耐性が高いと考えられています。 したがって、胆汁酸塩は、マッコンキー寒天培地などの実験室培養条件でのグラム陰性菌の選択によく使用されます [19]。 |
| デオキシコール酸は、コール酸を利用する腸内細菌の代謝産物であり、その疎水性により特に有毒であると考えられています。 3種すべてを死滅させるための対照として使用した1%用量と比較して、0.30%ではL. plantarum と L. fermentum の細菌細胞死が誘導され、L. acidophilusの細胞生存率が大幅に低下したことが観察されました(図1a〜c)。 これらの濃度では、乳酸菌の胆汁に対する耐性は限定的であることがわかります。 ただし、0.08%への曝露は、L. acidophilusとL. fermentum でCFU/mLの減少が認められたにもかかわらず、1ミリリットルあたりのコロニー形成単位(CFU/mL)で測定した生存率にはほとんど影響を与えませんでした(図1a〜c)。 Listeriaを使用した研究 [16] では、「致死量未満」の用量 0.08% に事前曝露された場合、0.30% の胆汁酸塩への適応の可能性が実証されました。 したがって、我々は、乳酸菌をコール酸塩/デオキシコール酸塩に適応させ、生存を促進する実験を計画しました。 細菌を0.08%胆汁で5秒、30秒、5分間、または30分間処理した後、0.30%の致死胆汁濃度に30秒間曝露した。 L. acidophilusと L. fermentum を適応させるには5秒の前曝露で十分でしたが、L. plantarum のコール酸塩/デオキシコール酸塩への適応を確実にするには0.08%の30秒が必要でした(図1d–f)。 これらのデータは、より低濃度の胆汁に曝露されると耐性が獲得できることを示しました。 |
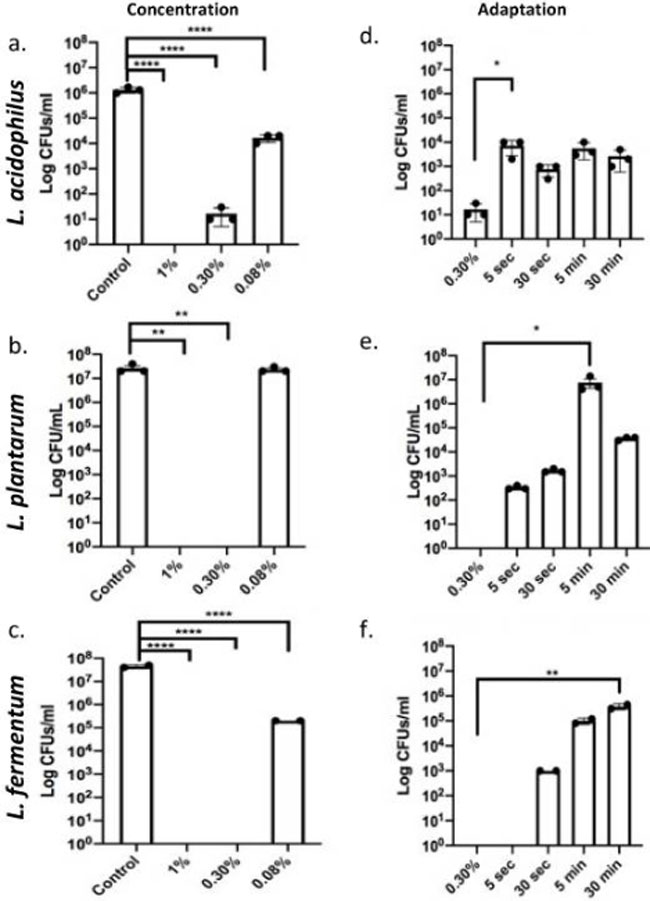 |
図1 乳酸菌はコール酸塩/デオキシコール酸胆汁酸塩の攻撃に適応します。 (a〜c)乳酸菌は、指数関数期中に30秒間、1%(死滅の陽性対照)、0.30%(「致死量」)、および0.08%(「亜致死量」)に曝露されました。 L. fermentum と L. plantarum は 0.08% の胆汁にのみ耐性があり、L. acidophilusは 0.30% の胆汁曝露後に増殖の低下を示しましたが、0.08% には耐性がありました。 **** p < 0.0001。 (d–f) すべての乳酸菌は、0.08%の「亜致死量」に5秒、30秒、5分、または30分間事前曝露された後、さらに30秒間0.30%の「致死量」に曝露されました。 合計 0.30% の非適応乳酸菌を比較のための対照として使用します。 亜致死量曝露時の CFU/mL の増加は適応を示します。 L. acidophilusおよびL. plantarumは、5秒の前曝露後でも適応し、致死量の0.03%胆汁にも耐えました。 L. fermentum には 30 秒間の事前曝露が必要でした * p < 0.05、** p < 0.01、**** p < 0.0001。 |
| 3.2. 胆汁への曝露はストレス反応を誘発せずに指数関数的な成長を遅らせる |
| 次に、曝露前 30 秒における 0.08% コール酸塩/デオキシコール酸塩 (CA/DCA) が 24 時間にわたる細菌増殖の回復に及ぼす影響を測定しました。 3 つの乳酸菌すべてで対数期への移行の遅れを測定しましたが、全体的な増殖曲線は変化せず、3 つの乳酸菌すべてが未処理の対照と同等の定常期に到達しました (図 2a)。 コール酸塩/デオキシコール酸塩への曝露がストレス反応を誘発するかどうかを評価するために、細菌が相互に付着するか表面に付着することによってクラスター化するバイオフィルム形成アッセイを実施しました。 細菌バイオフィルムは、多くの場合、自己生成マトリックス中の細菌で構成され、多様な環境ニッチにおける細菌の生存を助けます[20]。 細菌培地への 0.08%コール酸塩/デオキシコール酸塩補給の 24 時間では、ストレス誘発性バイオフィルムは測定されませんでした (図 2b)。 バイオフィルムの形成は、ヒト宿主における細菌の病原性定着における重要なステップでもあります[20]。 細胞表面の疎水性は、細菌が生物および非生物の表面に付着したり、宿主組織に浸透したりできるようにするもう 1 つの重要な特性です [21]。 表面への付着は細胞の疎水性だけに依存するわけではありませんが、疎水性は凝集とコロニー形成のもう 1 つの指標です [22]。 L. acidophilusでは疎水性の変化は見られませんでしたが、L. plantarumとL. fermentumはコール酸塩/デオキシコール酸塩曝露により統計的に有意な疎水性の増加を示し(図2c)、宿主に付着してコロニーを形成する能力が潜在的に増加していることを示しています。 |
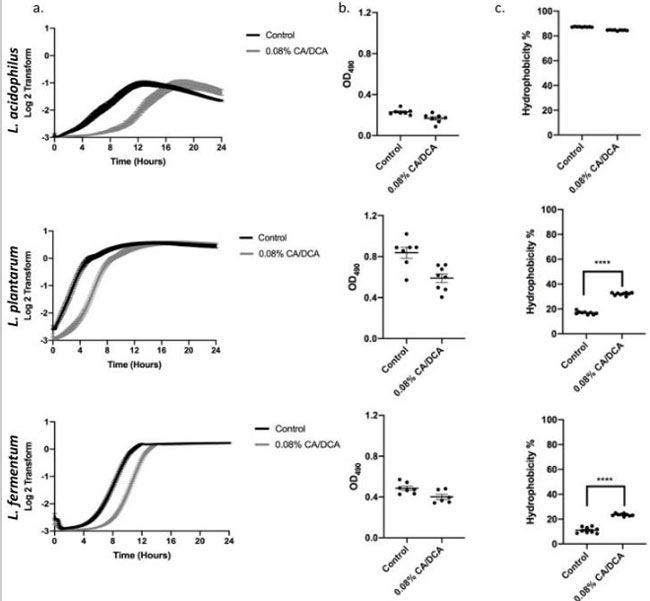 |
図2 非致死性コール酸塩/デオキシコール酸塩 (CA/DCA) への曝露は、ストレス反応を誘発することなく、指数関数的な成長期への移行を遅らせます。 (a) 3 つの乳酸菌株の増殖曲線は、0.08%コール酸塩/デオキシコール酸塩に 30 秒間前曝露した後に測定されました。 コール酸塩/デオキシコール酸塩の前曝露は、回復中の最初の乳酸菌の増殖を遅らせますが、3 つの乳酸菌はすべて、未処理の対照と同等の定常期に達しました。 (b) 0.08%コール酸塩/デオキシコール酸塩への 24 時間の曝露では、バイオフィルムの形成は増加しません。 (c) コール酸塩/デオキシコール酸塩曝露後、L. acidophilusの疎水性は高いままでしたが、L. plantarumとL. fermentumは増加しました。 **** p < 0.0001。 |
| 3.3. 逆流液の生理学的モデルとしての牛胆汁は、乳酸菌の増殖において用量依存的な効果を示し、完全に回復し、バイオフィルム形成には変化がありません |
| 腸内の胆汁の生理学的組成と胃食道逆流液には、両方とも、異なる抱合胆汁塩と非抱合胆汁塩の複雑な混合物が含まれています[23、24]。 人間の腸内の胆汁酸濃度の範囲は 0.2 ~ 2% です [25]。 牛胆汁とヒト胆汁は同様の胆汁酸組成を持っているため、濃度 0.30% (w/v) の牛胆汁を使用してプロバイオティクス細菌の胆汁耐性を測定しました [26]。 したがって、0.30% (w/v) 牛胆汁を利用して、増殖 (図 3a)、バイオフィルム形成 (図 3b)、および疎水性 (図 3c) を調査するデータを再現しました。 増殖動態は、L. acidophilusについては8時間、L. plantarumについては5時間の遅滞期を示した。 3 つの乳酸菌はすべて、未処理の対照と同等の定常期に達しました。 さらに、コール酸塩/デオキシコール酸塩を用いた実験と一致して、バイオフィルム誘導については有意差は観察されず、L. plantarumのみが牛胆汁への曝露に対して疎水性の有意な増加に応答した。 |
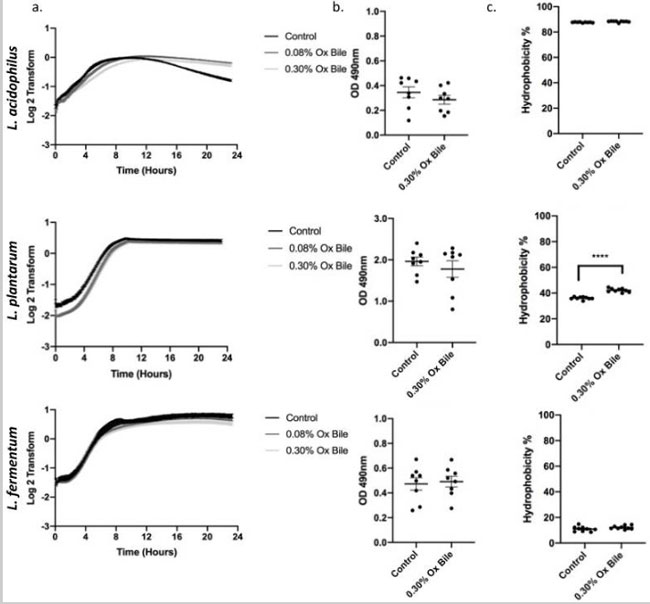 |
図3 逆流液の生理学的モデルとしての牛胆汁は、ストレス応答なしで乳酸菌の増殖が遅延することを示しています。 (a) 3 つの乳酸菌属の増殖曲線。 0.30% および 0.08% の牛胆汁に常時曝露しながら 24 時間測定しました。 L. acidophilusとL. plantarumは、回復して定常期に入るまでに成長に遅れがあります。 (b) 細菌を 0.30% 牛胆汁の存在下で 24 時間増殖させ、サフラニンで染色してバイオフィルム形成を検出しました。 バイオフィルム関連のストレス応答については有意差は検出されませんでした。 (c) L. plantarumの疎水性は牛胆汁暴露後に大幅に増加します。 一方、L. acidophilusとL. fermentumは変化しません。 **** p < 0.0001。 |
| 3.4. 胆汁誘導性NFκBシグナル伝達において乳酸菌は抗炎症能力を示す |
| 胃食道逆流症と炎症との関連性は、重要な転写因子である核因子カッパB(NFκB)(訳者注:NF-κBは、サイトカインやストレスなどの刺激に対する細胞応答に関与する転写因子で、感染に対する免疫応答の調節に重要な役割を果たしています)によってもたらされ、ヒト細胞内の胆汁酸によって活性化され、食道がんの進行に寄与すると報告されている[27、28、29、30、31]。 ]。 さらに、NFκB シグナル伝達の活性化は、デオキシコール酸誘導性の DNA 損傷に応答してアポトーシス耐性を与えます [32]。 胆汁酸は一般に DNA 損傷を誘発しますが、親水性ウルソデオキシコール酸 (UDCA) などの一部の胆汁酸は、酸や胆汁酸塩にさらされたバレット細胞の酸化ストレスから保護することができます。 親水性ウルソデオキシコール酸 (UDCA)による前処理は、酸化ストレス、DNA 損傷、NFκB 活性化を減少させます [33]。 したがって、我々は、不死化ヒト食道上皮細胞に対するコール酸塩/デオキシコール酸塩および牛胆汁による治療プロトコルを決定しました(補足図S1)。 細胞生存率を低下させることなく、0.30% 牛胆汁に対して最大 30 分間、0.08% コール酸塩/デオキシコール酸塩に対して 30 秒間耐性を示しています。 その後の実験では、30 分間の回復期間の前に、食道上皮細胞を胃食道逆流症の生理機能に関連する 0.08%コール酸塩/デオキシコール酸塩および 0.30% 牛胆汁に 30 秒間曝露しました。 抗酸化特性で知られるL. acidophilus、L. plantarum、およびL. fermentumを、30秒間の胆汁曝露後の30分間の回復中に追加しました。 そして、シグナル伝達経路の活性化を示す、NFκB のシグナルと核への移行を評価しました。 我々のデータは、コール酸塩/デオキシコール酸塩(図4a)および牛胆汁(図4b)への曝露がNFκB陽性ヒト食道上皮細胞の増加を誘導し、以前に報告されたように炎症を示すことを実証している[27、28、29、30、31]。 回収中に未曝露のL. acidophilus、L. plantarum、およびL. fermentumを添加すると、NFκB 陽性細胞の数が細菌単独および対照細胞とほぼ同じレベルに減少しました (図 4)。 |
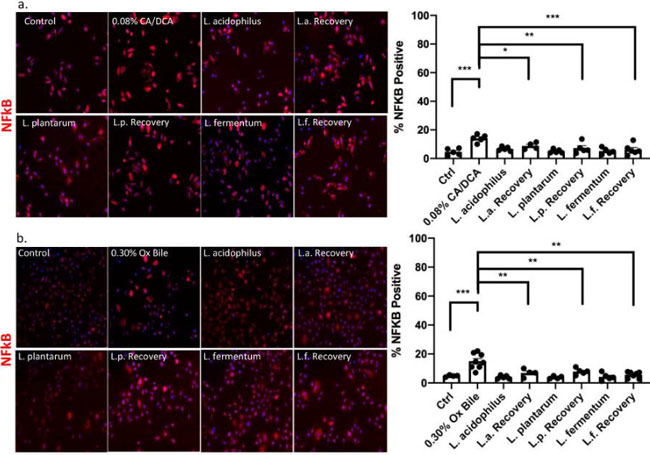 |
図4 乳酸菌は、胆汁にさらされると抗炎症反応を仲介します。 食道上皮細胞を、乳酸菌の非存在下および存在下で、30分間の回復期間の前に、(a) コール酸塩/デオキシコール酸塩および(b) 牛胆汁に30秒間曝露した。 NFkB シグナルは Alexa 594 二次抗体 (赤色) で検出され、各条件について定量化されました。 グラフは、フィールドごとの陽性細胞の数を示します。 食道上皮細胞を乳酸菌と共培養すると、単一培養と比較して回復中にNFkBシグナルが減少した。 * p < 0.05、** p < 0.01、*** p < 0.001。 |
| 3.5. 乳酸菌は抗酸化作用を示す |
| 活性酸素種 (ROS) は、さまざまな修飾された DNA 塩基を生成します。 8-オキソ-7,8-ジヒドログアニン (8-オキソ-G) は、グアニンを修飾する活性酸素種から生じる最も豊富で安定した生成物の 1 つであり、修復されない場合にアデニンと対になるため、非常に変異原性が高くなります [34]。 活性酸素種のマーカーとして広く使用されています [35]。 特に、活性酸素種の蓄積は胃食道逆流症-バレット食道-食道腺がん(GERD-BE-EAC)配列の腫瘍性進行に寄与することが示された[36]。 コール酸塩/デオキシコール酸塩および牛胆汁に30秒曝露して30分後の免疫蛍光顕微鏡による検出を使用して、8-オキソ-Gの生成を確認しました(それぞれ図5a、b)。 データは、未処理の対照条件では細胞の 10 ~ 20% と比較して、処理すると約 40% の細胞が 8-oxo-G 陽性になることを示しています。 胆汁傷害からの回復中に非曝露のL. acidophilus、L. plantarum、およびL. fermentumを添加すると、8-オキソ-G陽性細胞のレベルは、未処理の対照細胞および細菌処理細胞に匹敵するレベルに戻る 。 これらの観察は、乳酸菌媒介の保護機構による 活性酸素種媒介の DNA 損傷の減少を示しました。 |
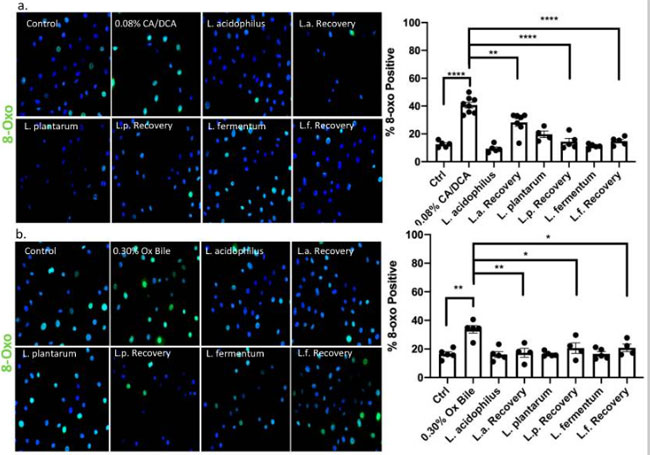 |
図5 胆汁酸媒介の DNA 損傷の直接的な尺度である 8-オキソ グアニン シグナルは、乳酸菌の存在下で減少します。 食道上皮細胞を、活性酸素種を誘導することが知られている (a) コール酸塩/デオキシコール酸塩または (b) 牛胆汁に曝露しました。 Alexa488結合二次抗体(緑色)を使用して8-オキソグアニン(8-オキソ-G)陽性細胞を検出する抗体による免疫蛍光染色で示されるように、胆汁は上皮細胞単独で活性酸素種を介して8-オキソグアニンDNA損傷を誘発しますが、 回復時間中の乳酸菌は DNA 修復の促進を示します。 * p < 0.05、** p < 0.01、**** p < 0.0001。 |
| 3.6. 胆汁にさらされた後の食道細胞に乳酸菌を添加するとDNA損傷が軽減される |
| 食道細胞が酸性胆汁酸塩に曝露されると、スーパーオキシドラジカルと過酸化水素が生成され、重大な DNA 損傷が生じることが報告されています [37]。 このような DNA 損傷は、バレット食道から食道腺がんへの進行の根底にあるメカニズムである可能性があります。 分子レベルでは、胆汁酸などの遺伝毒性傷害による DNA 損傷は、広範な鎖切断を伴う DNA がCOMETのようなパターンを生成する核のゲル電気泳動の方法である COMET アッセイを通じて視覚化できます [38]。 コール酸塩/デオキシコール酸塩または牛胆汁に30秒曝露した30分後にCOMETアッセイを実行し、電気泳動中に核様体を含む損傷を受けていないDNAから移動する重度の損傷を受けたDNAの程度を測定しました。 我々は、COMETの頭部と尾部の間の距離、損傷を受けていないDNA核様体部分、およびその後の損傷を受けたDNA線条をそれぞれ定量化した。 我々は、コール酸塩/デオキシコール酸塩(図6a)および牛胆汁(図6b)への曝露が、未処理の対照と比較してCOMETの増加を誘発することを示しました。 回復中に曝露されていない L. acidophilus、L. plantarum、およびL. fermentumが存在する場合、COMET は未処理の対照および細菌単独とサイズが同等でした。 |
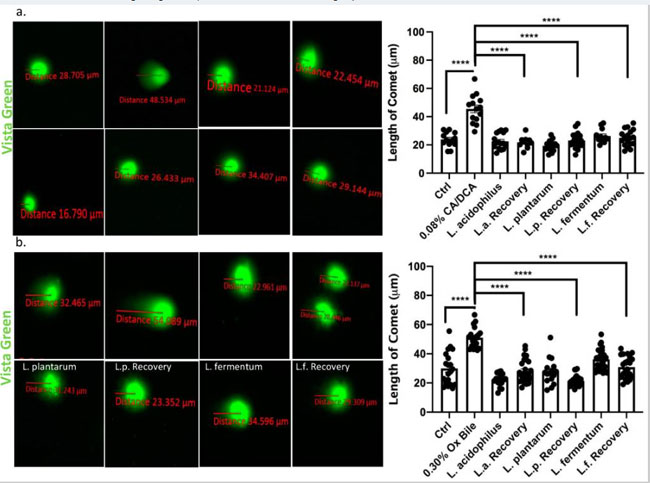 |
図6 乳酸菌は、食道上皮細胞の胆汁に反応して DNA 損傷の修復を促進します。 Vista Green Dye を使用して、30 秒間の コール酸塩/デオキシコール酸塩 (a) または牛胆汁 (b) 曝露後の不死化扁平食道上皮細胞の断片化 DNA を評価しました。 COMET の頭部と尾部の間の距離は、示されているように測定されました。 回復時間中に乳酸菌と共培養された上皮細胞は、COMETの長さが短いことから明らかなように、DNA修復の促進を示します。 **** p < 0.0001。 |
| 3.7. 乳酸菌の添加によりDNA二本鎖切断修復が加速される |
| 8-オキソ g などの DNA 損傷は、OGG1 などの DNA N-グリコシラーゼによる塩基除去修復によって修復されますが [39]、胆汁酸塩によって誘発される二本鎖切断の DNA 損傷に対する応答には、標準的な非相同末端結合または相同修復が関与します。 胃食道逆流症の文脈では、胆汁酸への曝露が核pH2AXの上方制御を引き起こすことが報告されている[40]。 したがって、我々は、修復切開ヌクレアーゼによって引き起こされるDNA鎖切断を評価するためにpH2AXを使用し、相同組換えによる修復の活性を同定するためにRAD51を使用した。 コール酸塩/デオキシコール酸塩(a) または牛胆汁 (b) 処理の 30 秒後、乳酸菌の存在下または非存在下で細胞を 30 分間回復させた後、H2AX (pH2AX) および RAD51 シグナルのリン酸化を評価しました。 pH2AX の補充は急速であると記載されています。 H2AX 上のセリン 139 のリン酸化は、二本鎖切断の発生後数分以内に完了します [41]。 活性酸素種誘導の文脈では、このプロセスはネオカルチノスタチン治療後など、20 分以内に起こります [42]。 |
| 免疫蛍光を使用して、未処理の対照(図7bおよび図8b)と比較して、コール酸塩/デオキシコール酸塩(図7aおよび図8a)および牛胆汁処理により両方のDNA修復マーカーが上昇したことを決定しました。 30 秒間の胆汁媒介 DNA 損傷誘導後の回復段階でL. acidophilus、L. plantarum、およびL. fermentumを添加すると、pH2AX および RAD51 陽性細胞の数が大幅に減少し、未処理の対照と同等でした。 細菌のみで処理された細胞は、修復反応の促進を示しています。 DNA損傷誘導後のpH2AX活性化の時間経過を表すサンプルのウェスタンブロット分析は、牛胆汁単独と比較して、未曝露のL. acidophilusの存在下で胆汁誘発性DNA損傷から15分後のpH2AXのより強いシグナルを強調しました(補足図S2)。 これは、pH2AX の増加が示唆されています。 これらの発見は、プロバイオティック乳酸菌の抗原毒性機能を示している可能性があると我々は考えています。 |
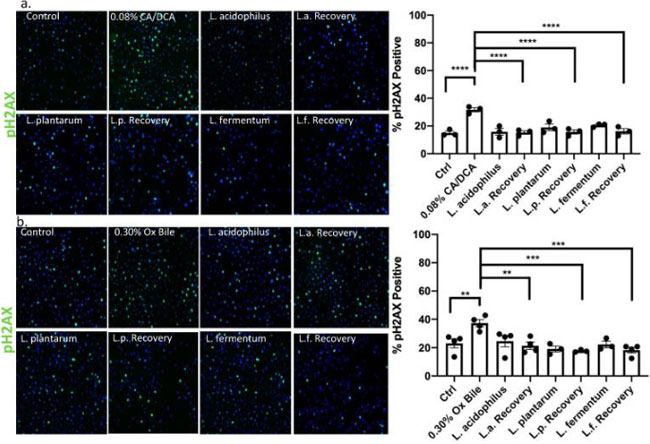 |
図7 乳酸菌は、食道上皮細胞の胆汁に応答して pH2AX を活性化することにより DNA 損傷修復を誘導します。 (a) コール酸塩/デオキシコール酸塩または (b) 牛胆汁に 30 秒曝露した後の食道上皮細胞は、pH2AX 抗体および Alexa488 結合二次抗体 (緑色) を使用した免疫蛍光によって示されるように、30 分間の回復後にリン酸化 H2AX (pH2AX) のシグナルを示します。 回復時間中に乳酸菌と共培養した上皮細胞は DNA 修復の促進を示し、pH2AX に対して未処理のコントロールと同等のシグナルを示します。 ** p < 0.01、*** p < 0.001、**** p < 0.0001。 |
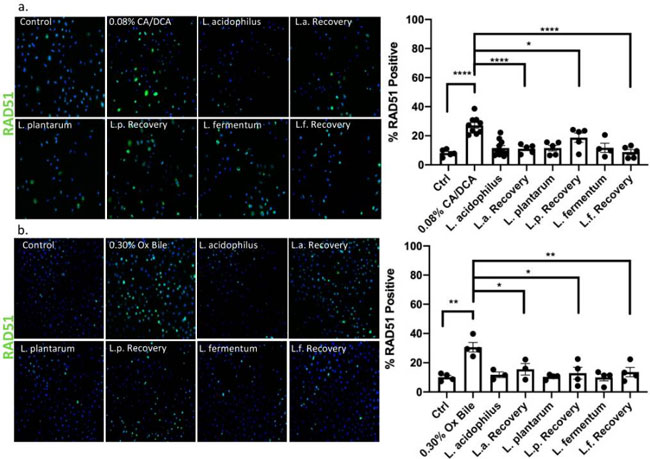 |
図8 乳酸菌は、RAD51 の核局在化と相同修復機能の補助を発揮します。 (a) コール酸塩/デオキシコール酸塩または (b) 牛胆汁に 30 秒曝露した 30 分後の RAD51 特異的抗体および Alexa488 結合二次抗体 (緑色) による免疫蛍光では、陽性食道上皮細胞の増加が示されています。 回復時間中に乳酸菌と共培養された上皮細胞は、未処理のコントロールと同様の RAD51 陽性シグナルを示します。 * p < 0.05、** p < 0.01、**** p < 0.0001。 |
| 4.討議 |
| 現在の胃食道逆流症に対する既存の治療法は、主にプロトンポンプ阻害剤(PPI)などの酸の生成を抑制することを目的とした薬剤を指します。 プロトンポンプ阻害剤は症状を長期的に軽減しますが、この治療は食道腺がんの予防には限定的な効果しかない可能性があります。 プロトンポンプ阻害剤はバレット食道の根本的な逆流損傷を矯正せず、プロトンポンプ阻害剤治療中の弱酸性物質であっても胃食道逆流には依然として胆汁酸塩が含まれています [43,44]。 胆汁酸塩または胆汁酸が食道のバレット化生の中心にあるのかどうかという疑問が提起された[45、46、47]。 胆汁酸塩は、コール酸やケノデオキシコール酸などの一次胆汁酸とタウリンやグリシンの結合によって肝臓で形成され、これはその生理学的特性と負電荷に影響を与えます[48]。 デオキシコール酸を含む二次胆汁酸は、バレット食道で見られるように、腸上皮化生のより強力な誘発物質であり、DNA 損傷の原因となります [32]。 |
| 4.1. 活性酸素種誘発炎症およびDNA損傷時の乳酸菌の抗酸化機能 |
| 酸性胆汁酸塩は、食道細胞において高レベルの活性酸素種、酸化ストレス、および関連する DNA 損傷 (二本鎖切断など) を引き起こすことが以前に報告されています [5、49、50]。 したがって、我々は、プロバイオティック乳酸菌治療がこれらの事象の調節と遺伝毒性損傷の修復に役割を果たすかどうかを調査した。 細胞モデルとして、hTERTで不死化した正常な食道細胞を使用し、乳酸菌との相互作用、および乳酸菌の存在下および非存在下での胆汁酸塩に対する反応を研究しました。 DNA 損傷は胃食道逆流症患者で観察され、バレット食道細胞を用いた in vitro 研究で実験的な胆汁酸塩逆流によって誘発され、胆汁の短時間曝露によって逆流のエピソードが再現されたと記載されている [51]。 バレット食道腫瘍形成の病因における既知の役割のため、我々は研究のためにコール酸とデオキシコール酸、および牛胆汁から収集した胆汁酸の生理学的混合物を選択しました。 これらの状態は、NFκB 媒介炎症、活性酸素種、および DNA 損傷の活性化を示しました。 |
| 活性酸素種は、8-オキソ-7,8-ジヒドロ-2'-デオキシグアノシン (8-オキソ-G) の形成などの DNA 損傷を引き起こす可能性があります。 酸化還元電位が最も低いグアニンは、最も酸化を受けやすい DNA 塩基であることが示され、8-オキソ-G などの生成物が生成されます。 8-オキソ-Gは変異原性があり、複製DNAポリメラーゼによって病変の反対側にdAMPが取り込まれるとGCからTAへの変換を引き起こすことが示されている。 バレット食道の進行中に、8-オキソ-G レベルの増加が観察されました [52,53]。 我々は、食道細胞の胆汁酸塩曝露によって引き起こされる 8-oxo-G の増加と、乳酸菌とのインキュベーション後の減少を示しました。 8-オキソ-Gは主に、OGG1などのDNA N-グリコシラーゼによって開始される塩基除去修復経路によって修復されます。 8-オキソ-G DNA グリコシラーゼ-1 などの DNA 修復に関与するタンパク質は、NFκB を介した炎症誘発性遺伝子の転写を促進し [54,55,56,57]、DNA 損傷と炎症の間に悪循環を引き起こす可能性があります。 これは、慢性炎症が DNA 損傷を永続させるバレット食道についても説明されています [58]。 胃食道逆流症は、酸性胆汁酸塩への曝露による直接的な身体的損傷だけでなく、サイトカインの放出に関連する炎症の結果であると報告されている[59]。 酸と胆汁は、バレット食道におけるNFκBの活性化を通じて、サイトカインIL-8およびIL-1を介して炎症促進性シグナル伝達を誘導することが記載されている[60,61]。 胆汁酸塩によって引き起こされる DNA 損傷は、NFκB [62] や慢性炎症を引き起こすさまざまなインターロイキンなどの炎症促進性シグナル伝達の活性化にも関連しています。 |
| 活性酸素種は細胞シグナル伝達において重要な役割を果たし、酸化ストレスを誘発して細胞損傷を引き起こす可能性があります。 酸化ストレスから保護するメカニズムの中には、グルタチオンペルオキシダーゼ (GPX) およびグルタチオンレダクターゼ、またはグルタチオンによって触媒される酵素反応があります [63、64、65]。 グルタチオンペルオキシダーゼは、食道細胞を酸性胆汁酸塩に曝露した後の 過酸化水素、細胞内活性酸素種、酸化的 DNA 損傷、および二本鎖切断を低下させます。 たとえば、GPX7 は食道腺がんで頻繁に抑制されており、活性酸素種および酸化的 DNA 損傷の制御能力に影響を与えます [49]。 さらに、GPX7 の喪失は、バレット病の進行中に炎症促進性シグナル伝達における TNF(訳者注:サイトカインの一種で、不要な細胞を排除するほか、感染防御・抗腫瘍作用を持つ物質である)を介した NFκB の活性化を促進します [66,67]。 |
| バレットの腫瘍形成に関連する他の酸化還元分子が調査されました。 非プリン性/アピリミジン性エンドヌクレアーゼ 1 (APE1) タンパク質は、酸性胆汁酸塩によって誘発される DNA 損傷の致死効果を中和することにより、食道がん細胞の生存を促進する上で重要な役割を果たしています [68]。 そしてChenらは、アピリミジン性エンドヌクレアーゼ 1の酸化還元機能、逆流誘発炎症、NFκBを介したNotchシグナル伝達の上方制御の間の新規クロストークを発見し、その結果、逆流条件に応答してがん細胞の幹様特性が促進されることを発見した[69]。 アポシニンなどの天然の抗酸化物質は、酸性胆汁酸塩によって誘発される活性酸素種およびDNA損傷から食道細胞を保護するのに効果的であると報告されている[37]。 アピリミジン性エンドヌクレアーゼ 1酸化還元依存性機能は、乳酸菌治療におけるメカニズムである可能性があり、今後の研究が必要である。 |
| プロバイオティクスは、酸化ストレスに関連する DNA 損傷において重要な役割を果たしている可能性があります。 乳酸菌では、NADH オキシダーゼ、グルタチオン レダクターゼ、グルタチオン S-トランスフェラーゼ、カタラーゼ、グルタチオン ペルオキシダーゼ、フェルロイル エステラーゼなどの抗酸化酵素が酸化ストレスに対抗します [70,71]。 これに関連して、一部の乳酸菌とビフィズス菌は、抗酸化酵素の活性増加を誘導したり、シグナル伝達を調節したりして、酸化ストレスから保護することが報告されている[72]。 私たちの研究にとって重要なことは、乳酸菌などの細菌も、主要な細胞の非酵素的抗酸化物質であるグルタチオン自体の生成を放出し、促進することである[73,74]。 観察された抗炎症および抗酸化機能が乳酸菌分泌因子によって直接媒介されるのか、それともそれらが宿主の抗酸化反応を誘導するのかはまだ調査されていません。 しかし、最近の研究では、乳酸菌やビフィズス菌などのプロバイオティクス細菌は、BSHなどを介して胆汁酸の活性を調節するだけではなく、損傷を受けた際の自身の細菌 DNA の修復など、胆汁の悪影響に対抗することもできます [75]。 乳酸菌属を含む一部の細菌は、胆汁の存在下で解糖系を活性化して代謝を適応させる可能性さえある[76]。 |
| 4.2. DNA損傷の修復 |
| 8-oxo-G 形成などの変異原性損傷の結果として、DNA 損傷応答シグナル伝達が活性化され、DNA 損傷の修復を目的とします [77]。 胆汁酸塩は二本鎖切断を誘導することができ、これは修復のためのpH2AX、および相同組換え中のRAD51によってマークされますが、胆汁酸塩によって誘導されたDNA二本鎖切断後に乳酸菌の存在下でRAD51が動員され、促進されることが実証されました。 |
| DNA 二本鎖切断は、標準的な非相同末端結合または相同組換え (HR) によって修復されます [78,79]。 標準的な非相同末端結合による二本鎖切断修復は細胞周期全体を通じて発生しますが、相同組換え経路は S 期と G2 期中にのみ機能します。 DNA合成依存性修復の鋳型として機能するには、姉妹染色分体からの相同DNA配列が必要であるため[80] そしてそれには大規模な DNA 末端処理が含まれます。 したがって、それは非常に正確であると考えられています[81]。 |
| 我々はまだ、乳酸菌の存在下および非存在下での宿主細胞周期の開始を分析して、それらがDNA修復調整において果たす役割を特定する必要がある。 しかし、二本鎖切断が発生すると、ATM などのキナーゼが直ちに活性化され、二本鎖切断部位でヒストン H2AX がリン酸化されます [82,83]。 pH2AX 病巣の形成は、エフェクタータンパク質を間接的または直接的に保持する機構 [85] を介して、非相同末端結合修復と HR [84] の両方のチェックポイントとして機能します。 ヒストン H2A ファミリーのメンバーの 1 つである H2AX は、DNA 損傷から数分以内に広範囲にリン酸化され、切断部位に病巣を形成します。 pH2AX は、RAD51 などの他の因子を DNA 損傷部位に補充するために必要です [86]。 pH2AX を使用して修復切開ヌクレアーゼによって引き起こされる DNA 鎖切断を評価し、RAD51 を使用して修復における相同組換えの活性を測定しました。 我々は、pH2AX のシグナルがタンパク質サンプルで 15 分以内に増加し、胆汁損傷状態ではシグナルがより強くなり、30 分までに減少することを観察しました。 免疫蛍光による検出により、胆汁損傷細胞への乳酸菌補給後 30 分以内にタンパク質シグナル強度と pH2AX および RAD51 病巣の数が減少することが示されました。 これらの発見は、修復が進行するにつれて pH2AX の段階的な脱リン酸化が起こるため、二本鎖切断修復が進行中であることを示しています [87]。 RAD51は二本鎖DNAへの鎖侵入を含む相同組換えの中心反応を触媒するため、相同DNA鎖の対形成により鎖交換が可能になり[88]、これは乳酸菌の存在下で好まれる相同組換え修復プロセスである可能性が高い。 |
| pH2AX は、胃食道逆流症患者において酸性胆汁酸塩によって誘導されること、および酸性胆汁酸塩に曝露されたバレット食道細胞株を使用した in vitro で誘導されることが示されました。 これらの発見は、アルカリ COMET アッセイで測定された DNA 損傷の増加と相関していました [89]。 我々は、実験モデルにおける胆汁が、8-oxo-G および COMET アッセイによって測定される DNA 損傷、ならびに pH2AX および RAD51 の誘導を誘導したことを報告しました。 |
| 注目すべきことに、一部のグラム陰性細菌は、細菌が分泌する毒素や代謝産物を通じて宿主の DNA 損傷を誘発する可能性があることが示されました。 さらに、大腸菌が宿主細胞でDNA損傷反応を誘導すると、不完全なDNA修復が起こり、後期ブリッジや染色体異常を引き起こす可能性があることが示されている[90、91]。 最終的には、これらは遺伝子変異や悪性形質転換を引き起こす可能性があります。 現時点では、私たちは加速修理の成果をさらに評価していませんが、これが将来の重要な方向性であることは認識しています。 しかし、RAD51は、複製ストレス後の細胞生存を促進する複製に関連した二本鎖切断の蓄積とゲノム不安定性を防止することが示され[92]、修復の促進が食道細胞に悪影響を及ぼさない可能性があることが示唆されている。 |
| 乳酸菌が DNA 損傷の修復と回復を強化する直接的なメカニズムは特定できませんでしたが、抗酸化効果の媒介には複数の細菌経路が関与している可能性があります。 最近の研究では、バレット食道および 食道腺がん(EAC) 患者における特定の食道マイクロバイオームの特徴が特定されました [93]。 興味深いことに、バレット食道に関連する微生物叢は、複製と修復の可能性の高さ、遺伝情報処理、補因子やビタミンの代謝などのカテゴリーに分類された遺伝子特徴によって特徴付けられていました。 |
| 特にビフィズス菌は、胃腸管において有益な機能を有することがすでに実証されている[94,95]。 さらに、乳酸菌に関する報告は消化不良を治療することが示されており、臨床的背景を提供している[96,97]。 乳酸桿菌やビフィズス菌などのプロバイオティクスは、抗がん作用があるため注目されています。 食道がんに関しては、プロバイオティクスを含む発酵食品の摂取量の増加ががんリスクを軽減することが示されている[98]。 これは、病気が進行している場合でもそれらの潜在的な機能を強調しています。 |
| 要約すると、我々の結果は、乳酸桿菌が酸化ストレスと遺伝毒性事象の制御に重要な役割を果たしており、治療として利用した場合、逆流状態に対するDNA損傷反応を促進できることを示しています。 |
| 5.結論 |
| 我々は、乳酸菌は胃食道逆流症を模倣した胆汁濃度に耐性または適応できると結論付けています。 胆汁で損傷した食道上皮に乳酸菌を補給すると、抗炎症作用と抗酸化作用があります。 この活性は、NFkB の抑制と pH2AX および RAD51 の急速な活性化によって実証されました。 したがって、プロバイオティック乳酸菌は胃食道逆流症に有益な役割を果たす可能性があります。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Antioxidants (Basel). 2023 Jul; 12(7): 1314.に掲載されたLactobacillus sp. Facilitate the Repair of DNA Damage Caused by Bile-Induced Reactive Oxygen Species in Experimental Models of Gastroesophageal Reflux Disease. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


