ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
加齢に伴う骨格筋の健康に対する統合的アプローチ |
Deborah Agostini et al., |
|
|
| 概要 |
筋肉量と機能の低下は、加齢に伴う最も問題のある変化の 1 つであり、自律性と生活の質に劇的な影響を与えます。 ミトコンドリアやオートファジーの機能不全、サテライト細胞の再生能力の欠如など、いくつかの要因がサルコペニアの容赦ないプロセスに寄与しています。 加齢に伴う筋肉量と運動ニューロン機能の生理学的低下は、高齢者に伴う座りっぱなしのライフスタイルによってさらに悪化します。 定期的な身体活動はほとんどの人にとって有益ですが、高齢者には筋肉量を向上させ、その結果として機能的能力と生活の質の両方を向上させる、綿密に設計され慎重に管理されたトレーニング プログラムが必要です。 加齢はまた、サルコペニアに関連する腸内微生物叢の組成の変化を引き起こし、研究の進歩により、腸内微生物叢と筋肉の軸を介した介入がサルコペニアの表現型を改善する可能性があることが明らかになりました。 ビタミン D 欠乏症に関連する筋肉機能の低下によって示されるように、ビタミン D 筋萎縮の保護にはいくつかのメカニズムが関与しています。 栄養失調、慢性炎症、ビタミン欠乏、筋-腸軸の不均衡は、サルコペニアを引き起こす可能性のある要因のほんの一部です。 抗酸化物質、多価不飽和脂肪酸、ビタミン、プロバイオティクス、プレバイオティクス、タンパク質、ケフィア、短鎖脂肪酸を食事に補給することは、サルコペニアに対する栄養療法となる可能性があります。 最後に、このレビューでは、サルコペニアに対抗し、骨格筋の健康を維持するための個別化された統合戦略が提案されています。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2. 運動と筋肉の健康 |
| 3. 微生物叢と筋肉の健康 |
| 4. 栄養とサプリメント |
| 4.1. ビタミンD |
| 4.2. 酸化防止剤 |
| 4.3. オメガ-3脂肪酸 |
| 4.4. プロバイオティクス |
| 4.5. プレバイオティクス |
| 4.6. タンパク質 |
| 4.7. 短鎖脂肪酸 |
| 5. サルコペニアに対する非薬理学的統合アプローチ |
| 6.結論 |
レビュー |
| 1.はじめに |
| 筋肉量と機能の低下は、加齢に伴って発生する最も問題のある変化の 1 つであり、被験者の自律能力と生活の質に劇的な影響を及ぼします [1]。 加齢に伴う筋肉の減少は 1970 年代初頭から研究されてきました [2]。 最近の前向き研究では、二重エネルギー X 線吸光光度法 (DXA) を使用して、年間の骨格筋損失のより正確な推定値が得られ、高齢男性では 0.65% ~ 1.39%、高齢女性では 0.61% ~ 0.80% と推定されています。 [3]。 加齢に伴う筋肉量、筋力、機能の低下は、1989 年に Irvin Rosenbergによって初めて「サルコペニア」と命名され、特に世界中の高齢者人口の指数関数的な増加の結果として、世界的な健康上の大きな懸念となっています [4]。 |
| 2010 年にヨーロッパ高齢者のサルコペニア作業グループ (EWGSOP) によって与えられたサルコペニアの運用上の定義 [5] は、過去に確立されたものから進化しており、低レベルのサルコペニアの存在だけではなくサルコペニアの診断のためのアルゴリズムを提案しています。 筋肉量はあるが、筋機能(筋力や筋力)が低い。 2018 年のアップデート (EWGSOP2) では、筋力の低下が、サルコペニアになる前の状態、サルコペニア、重度のサルコペニアを識別するための主なパラメーターとして示されました [6]。 2016年、サルコペニアは筋肉の状態/疾患として認識され、ICD-10-CM(国際疾病分類-10-臨床修正)コード(M62.84)を取得しました。 これは、サルコペニアを病気として認識する上で大きな進歩をもたらしました[7]。 |
| 骨格筋は、代謝、繊維組成、サイズの変化を通じて、病的なストレスを含むさまざまなストレスに適応できます [8]。 このような適応、または特に加齢による適応の欠如は、萎縮または筋肉量の大幅な減少を引き起こし、結果として高齢者の健康に問題を引き起こす可能性があります。 さまざまな生物学的メカニズムの関与を提案することで、サルコペニアの発症を説明する試みが行われています[9]。 |
| ミトコンドリアの機能不全は、げっ歯類とヒトの両方において、筋肉の老化プロセスにおいて重要な役割を果たしています[10、11]。 筋肉内のミトコンドリア含有量は、さまざまな刺激によって活性化される合成 (生合成) 経路と分解 (マイトファジー) 経路の変化の結果です [12]。 これらの細胞小器官は、活性酸素種 (ROS) の生成を通じて細胞シグナル伝達経路に関与するとともに [13]、アポトーシスのメディエーターでもあります [14,15]。 |
| ミトコンドリアの機能不全は、加齢に伴う 3 つの主な変化を引き起こします。 ATPを生成する能力が低下するため、細胞のエネルギーが減少[16]。 アポトーシスに対する感受性の増加[17,18]。 そして 活性酸素種の生成が増加 [19,20]を生じます。 |
| 酸化ストレスはサルコペニアの原因の 1 つであり [21]、老化は細胞のミトコンドリアを損傷することによって活性酸素種の産生を増加させ [22]、筋肉や神経細胞の抗酸化酵素のレベルを低下させます [23]。 生成源に関係なく、過剰な活性酸素種は損傷した機能不全のミトコンドリアの生成に寄与し、ミトコンドリアタンパク質のサイトゾルへの放出につながります [25]。 これによりシグナル伝達カスケードが開始され、骨格筋細胞のアポトーシスが引き起こされる可能性があります[26、27、28、29]。 |
| 筋肉の質と量を維持するには、オートファジーが良好に機能することが必要であることもわかっています[30]。 実際、オートファジー関連タンパク質ATG7やATG5などの一部の調節因子の遺伝的阻害は、筋肉量の減少と低品質のミトコンドリアの蓄積を引き起こします[30,31]。 いくつかの研究では、ユビキチン - プロテアソーム システム (UPS) の活性化がタンパク質分解の増加につながり、サルコペニアに関与していることが示されています [32]。 筋肉消耗関連タンパク質 MuRF-1 と Atrogin-1 は両方ともユビキチン - プロテアソーム システムE3 リガーゼであり、筋肉消耗プロセス中に活性化されます [33,34]。 |
| 衛星細胞(または筋幹細胞)は、筋線維の修復と維持において特に重要です。 衛星細胞は筋肉の修復や肥大を実行したり、不活性状態に戻ることができます[35]。 成人の筋肉では、衛星細胞 (SC) の数は常にほぼ一定のままであり [36]、必要に応じて利用できる安全な貯蔵庫を作り出しています。 衛星細胞は、強力な筋原性前駆細胞であることに加えて、自己複製してその数を一定に保つことができ、必要に応じてその数を増やすことさえできます[37]。 筋肉の再生に不可欠なもう 1 つの要素は、成長因子であるインスリン様成長因子 1 (IGF-1) の存在です。 これは再生のすべての段階に関連しており、複数の経路に作用して衛星細胞の増殖、分化、生存を促進します[38]。 非常に古い齧歯動物では、やはり 活性酸素種の増加により、一部の衛星細胞が正常な静止状態 (通常は可逆的) の喪失とともに不可逆的な前老化状態を発症することが観察されています。 この状態は、自己再生する固有の能力、および損傷した場合に自らを活性化して修復を起こす能力に決定的な影響を与えます[39]。 サルコペニア筋の再生能力の欠如は、老化の特徴であることに加えて、高齢者の自立性を失う主な原因の1つである[40、41、42]。 |
| 高齢者は、加齢に伴う座りっぱなしの生活習慣が強いため、正常な脂肪沈着部位だけでなく、臓器の組織(異所性脂肪)や骨格筋内(筋間脂肪組織(IMAT))にも脂肪が蓄積しやすくなります[43]。 。 老年期には、筋間脂肪組織は炎症や代謝の問題 [44] を引き起こし、さらにミトコンドリアの機能不全を引き起こし、脂肪酸酸化能力の低下 [45] や酸化ストレスとインスリン抵抗性 (IR) の増加 [46] を引き起こします。 その結果、筋肉量の量と質が減少します[47]。 筋肉量の減少に加えて、運動ニューロンの機能や神経伝達も低下します。 この複雑なシナリオでは、この病気の予防と改善に役立つさまざまな薬理学的および非薬理学的戦略があります。 |
| このレビューでは、筋骨格系の健康を維持し、改善することを目的とした、個別化された統合的なアプローチを提案するために、運動、微生物叢の調整、栄養の調整、抗酸化物質、多価不飽和脂肪酸(PUFA)、ビタミン、プロバイオティクス、プレバイオティクス、タンパク質、ケフィア、短鎖脂肪酸の補給など、いくつかの非薬理学的介入を分析します。 |
| 2. 運動と筋肉の健康 |
| 身体活動レベルの低下は、中年期に始まる筋線維の減少とともに、サルコペニアの主な危険因子の一つです[48,49]。 これは、通常の日常生活活動を行うために必要な筋力と運動能力の低下につながるため、臨床の観点から重要です。 この骨格筋量の減少は 60 歳から 80 歳にかけて加速し、年齢、BMI、ライフスタイル、身体能力、健康状態、体組成に関係なく、全死亡率を予測します [50]。 |
| 文献によると、加齢に伴う筋肉量の減少は、運動ニューロンの劣化を決定する一連の複雑な要因によって引き起こされ、運動単位の完全な萎縮につながると考えられています。 具体的には、運動終板の変性プロセスにより神経伝達が遅くなり、神経伝達が低下し、続いて除神経が起こり、筋細胞の萎縮と相まって横紋筋組織に永久的な損傷を引き起こす[51]。 |
| 一方で、運動には、これらのプロセスを妨げる治療効果があるようです。 哺乳類に関する研究では、4か月の持久運動により、高齢動物の核膜孔複合体タンパク質の損失が劇的に遅くなり、同時に神経筋接合部の完全性が維持され、特に運動ニューロンの損失が遅れることが示された[52]。 特に、重要な神経栄養因子であるニューロトロフィン 4 (NT-4) と脳由来神経栄養因子 (BDNF) は、どちらも神経筋シナプスの修飾と維持に役割を果たしており、運動後の骨格筋で上方制御されます。脳由来神経栄養因子の産生の増加、および定期的な運動および/またはサプリメントによるその調節は、酸化還元感受性経路および酸化ストレス状態に依存している[53,54]。 |
| 筋肉および運動ニューロンレベルでのこのような利点は、運動が細胞の健康と神経筋接合部の維持の両方に関連していることを示唆しています[55、56、57]。 |
| さらに、加齢に伴い、線維の再神経支配の結果として、より高い伝導速度の線維(タイプ 2 速筋線維)がより小さな運動ニューロンによって神経支配される可能性があり、高齢者の筋肉疲労の増加につながる可能性があります [58,59]。 ただし、この場合、身体活動も重要な役割を果たし、新しい線維の神経支配を刺激することで問題を最小限に抑えることができます。 これに関して、Mosole らの発見 [60,61] では、長期にわたる激しい運動は筋線維の再神経支配を促進し、筋肉の構造と機能にプラスの効果をもたらし、最終的には可動性の低下の遅延につながることが示されました。 |
| 加齢による筋肉量の減少を示すもう 1 つの重要な指標は、運動ニューロンへのモノアミン作動性入力の欠如であるようです [62]。 この入力の欠如または減少により、運動ニューロンの樹状突起および体細胞に位置する電位依存性持続性 Na+ および Ca2+ チャネルの持続内向き電流 (PIC) が減少し、運動ニューロンをオンにするための発火閾値が上昇し、その結果、高齢者の筋力低下が引き起こされる可能性があります。 [63,64]。 しかし、Vila-Cha らの証拠 [65] は、運動ニューロンの発火率が 6 週間の筋力トレーニング後に増加し、持久力トレーニング後に減少することを示しました。 |
| 加齢に伴う筋肉量の容赦ない減少の原因となる、おそらく最も重要なもう 1 つの要因は、高齢者では成人骨格筋幹細胞 (SMSC) の存在が著しく少ないことです。 しかし、この成人骨格筋幹細胞の減少が細胞内の老化という固有のメカニズムによるものなのか、それとも外部環境の変化によるものなのかは不明です。 ホルモンの免疫学的問題と代謝の問題は、加齢に関連する環境変数として頻繁に発生し、幹細胞の機能に重大な影響を与えると考えられています[66,67]。 加齢に伴う幹細胞活性の変化は、加齢に応じたこれらの微小環境変数の変化によって引き起こされると考えられている[68]。 実際、内分泌腺の老化によってもたらされるホルモン異常は、幹細胞の活性および/または分化の変化と関連している[69]。 ホルモンの変化、特にエストロゲンレベルの変化は、人間が加齢に伴って起こる主な変化であるようです。 さらに、エストロゲン欠乏により、成人骨格筋幹細胞 は骨芽細胞ではなく脂肪細胞に優先的に分化します [66、70、71]。 成人骨格筋幹細胞 分化異常は、インターロイキン 6 (IL-6) や腫瘍壊死因子 (TNF-α) など、加齢に関連する炎症促進性メディエーターの循環量の増加によっても生じる可能性があります [72,73]。成長ホルモン (GH)、インスリン様成長因子 (IGF-1)、骨格筋の成長と発達の調節を助けるアンドロゲンなどの他の要素は、年齢とともに減少するようです[69]。 |
| 身体活動が果たせる役割はまさに、筋肉の老化プロセスを遅らせる抗炎症因子、ホルモン因子、および神経内分泌因子の産生を刺激することによって、この微小環境を可能な限り効率的に維持することである[74]。 ただし、身体活動の推奨事項 (IPAR) はサルコペニアに関連するプロセスをわずかに遅らせる可能性がありますが、最近のメタ分析 [75] では、低強度のレジスタンス トレーニング (≤50% 1RM) では筋力の向上を誘導するには不十分であることが示されており、著者らは 高強度のレジスタンス トレーニング プログラム (つまり、80% 1RM) とマルチモーダルな運動アプローチを推奨します。 実際、定期的な身体活動はほとんどの人にとって有益ですが、高齢者は、それぞれのニーズや能力に合わせた方法で運動する必要があります。 いくつかの異なる種類の運動は、サルコペニア発症のリスクを軽減し、筋力を向上させることが示されています[76,77]。 高齢者向けのエクササイズを選択するときは、レジスタンストレーニングと持久力トレーニングの相互関係、適切な種類のトレーニングと筋肉量への影響を検討することが重要です。 レジスタンストレーニングは筋肉量を増加させます[78,79]が、持久力トレーニングは筋肉量を減少させることがあります[80]。 マスターズアスリート [81] とこれまで座りがちだった高齢者の両方にとって成功の鍵は、筋肉量を改善し、その結果として機能的能力と生活の質の両方を改善する、よく設計され慎重に管理されたトレーニング プログラム [49,82] を採用することです [83] 。 グループ介入の利点や専門家が介入を行うことで起こり得る利点に関する研究が不足しているなど、研究には重要なギャップが残っている[77]。 この目的を達成するために、抵抗と持久力トレーニングの強度と最適な量をカスタマイズできる専門家によって開発および構築されたトレーニング プロトコルが推奨されます。 このようなプロトコルには、柔軟性と固有受容訓練を含めるべきである[77]。 |
| 3. 微生物叢と筋肉の健康 |
| 人間の腸には多数の微生物が定着しており、腸粘膜の完全性の維持、宿主免疫の調節、代謝の健康維持など、多くの生理学的機能を適切に遂行するために重要であると考えられている[84]。 腸内微生物叢は通常、幼児期に形成され、微生物の組成と代謝は食事、薬物、運動、社会環境などのいくつかの要因によって常に影響を受けます[85]。 |
| 健康な人では、Firmicutes と Bacteroidetes,という 2 つの主要な細菌門が結腸内の微生物種の約 99% を占めます。 しかし、腸内細菌叢の組成は加齢や病気の際に変化することがわかっている[85]。 |
| 粘膜表面および胃腸管腔内の微生物集団は宿主の免疫系と相互作用し、食物の代謝効果の影響を受けるため、マイクロバイオームの組成と特性はその位置に依存する可能性がある[86]。 腸内マイクロバイオームは、病原体の定着の防止、免疫グロブリン A 産生の刺激、抗炎症性サイトカインの上方制御、および T リンパ球細胞の制御を通じて、免疫系の形成と成熟において重要な役割を果たしています。 たとえば、Faecalibacterium prausnitzii とBifidobacterium infantisは、抗炎症性サイトカイン インターロイキン-10 (IL-10) の産生を誘発することができます。 そして、活性化B細胞(NF-κB)炎症経路の病原体刺激核因子κ軽鎖エンハンサーに対してT細胞の活性化を調節する[87]。 他の種も、インターロイキン 17 (IL-17) の発現を通じて炎症レベルの低下を誘導し、有害な病原体から宿主を守る免疫系を助けることができます。 さらに、腸内細菌叢は、胆汁酸だけでなく、ビタミンB12、葉酸、ビタミンK、ニコチン酸、ピリドキシンなどの必須ビタミンの新規合成にも重要です。 胆汁酸とビタミンの共代謝障害は、肥満や2型糖尿病などの代謝性疾患の発症に関連している[88]。 ヒトの腸内微生物叢のすべての機能的能力のリストでは、さまざまな地理的起源 (ヨーロッパ、米国、中国) および多様な健康状態 (健康、肥満、糖尿病、炎症性腸疾患など) の個人から採取した 1,267 個の便サンプルにわたる 9,879,896 個の遺伝子が定量化されました。 これは、腸内細菌叢の構成が宿主の遺伝学、食事、健康状態、老化、抗生物質投与などの複数の要因によって影響を受けることを示唆している[89]。 これらの刺激に応答して、微生物群集は適応し、人間の生物の生涯を通じてその細菌の組成と機能を変化させます。 |
| いくつかの科学的証拠は、腸内微生物叢のプロファイルが筋肉量の変化と相関していることを示しています[90]。 この関係を研究するために「腸-筋肉軸」という概念が提唱されました[91]。 Baeckhedらは、腸内細菌叢 - 筋肉軸の存在を最初に仮説化し、無菌(GF)マウスが筋肉における脂肪酸異化の増加につながる2つの機構によって食餌誘発性肥満から保護されていることを実証した[92]。 |
| この全体重量の増加は、少なくとも部分的には、これらの無菌マウスの虫垂の重量の増加に起因すると考えられます。 無菌 マウスは、インスリン様成長因子、アミノ酸のアラニン、グリシンなどの筋成長因子の減少、およびミトコンドリア機能の低下を伴う骨格筋の萎縮を示します[93]。 |
| 筋肉の生理機能は、リノール酸、酢酸、胆汁酸などの腸内細菌叢によって生成される代謝産物や、炎症誘発性サイトカインの生成を調節できる微生物分子によって影響を受ける可能性があります[94]。 |
| 人間の骨格筋におけるエネルギー消費の増加と筋肉脂肪沈着の減少は、胆汁酸による核ファルネソイド X 受容体の活性化 [95]、および G タンパク質共役受容体である TGR5 を介した細胞内甲状腺ホルモン活性化の促進によって促進されます [96]。 |
| 抗生物質で治療したマウスは疲労の増加と持久力運動能力の低下を示した[97]。 |
| Scheimanらは、マラソンランナーの便サンプルからマウスにVeillonella atypicaを接種すると、トレッドミルの徹底的な走行時間が大幅に増加したと報告した。 Veillonella種は、メチルマロニル-CoA 経路を介して乳酸を酢酸とプロピオン酸に代謝します。 Veillonella属と乳酸をプロピオン酸に変換するその代謝経路は、運動後のアスリートに豊富に含まれています。 プロピオン酸塩の直腸内点滴は、V. atypica の強制経口投与で観察されたトレッドミル実行時間のパフォーマンスの向上を再現するのに十分であり、それによって運動パフォーマンスを向上させる、マイクロバイオームにコードされた天然の酵素プロセスが特定された[98]。 |
| Lahiriらは、腸内微生物叢がインスリン様成長因子やミトコンドリアなどの筋肉の機能に関与する因子に影響を与える可能性があることを実証し、筋肉の機能への影響と維持における微生物叢の中心的な役割の仮説を立てた[93]。 |
| 高機能高齢者の微生物叢が定着したマウスの筋力は増加します。 これは、Prevotellaceae 科、Barnesiella 属と Prevotella 属、および Barnesiella intestinihominis 種が高齢者の筋力の維持に関連するメカニズムに関与していることを示唆しています [99]。 |
| 仮説的には、Toll 様受容体 (TLR)/NF-κB シグナル伝達経路が腸内細菌叢-筋肉軸に関与している可能性があります。 転写因子 NF-κB の筋肉特異的な活性化は、筋肉の消耗を引き起こします [100]。 NF-κB は、さまざまな病原体関連分子パターン (PAMP) を認識するToll 様受容体 の重要な下流標的です。 特に、筋細胞はTLR-2、TLR-4、およびTLR-5リガンドに応答します[101]。 興味深いことに、TLR4 は、LPS 注射によって誘発される筋萎縮を媒介します [102]。 筋萎縮におけるTLR2とTLR5の関与を調査する必要があります。 |
| 最後に、微生物叢に関連した炎症は、いくつかの悪液質疾患や栄養失調で起こると考えられます [103,104]。 これらの病状は腸管バリア機能の変化と関連している可能性があり[105]、その結果、炎症や筋萎縮を誘発しやすい病原体関連分子パターンの転座の増加につながる可能性がある。 同様のプロセス、すなわちリポ多糖転座の増加が、肥満および2型糖尿病に関連する炎症の要因として提案されている[106]。 |
| 加齢は、サルコペニアに関連するタンパク質分解性微生物の増加や糖分解性細菌の減少など、腸の細菌組成の変化を引き起こします[107]。 |
| 最近の進歩により、軸を介した介入がサルコペニアの表現型を逆転させる可能性があることが明らかになった[108]。 |
| さまざまな年齢(8、18、および24か月)の雄ラットの腸内細菌の多様性と筋肉量から、加齢に伴う腸内細菌叢の変化が高齢マウスの筋肉量と機能の低下につながることが示されました[109]。 |
| Lactobacillus reuteriによる治療は、悪液質現象を介して加齢やがんによって誘発された失われた筋肉量の回復につながり、腸内細菌叢の変化がサルコペニアを補ったり、対抗したりするのに役立つ可能性があることを示唆している[110]。 |
| さらに、L.casei LC122 または B. longumを 12 週間摂取すると、高齢マウスの筋肉機能、持久力、脂質代謝が改善され、炎症と酸化ストレスが軽減されました [111]。 これらの結果は、学習能力と記憶能力の向上、および海馬における神経変性因子および神経栄養因子の発現の上方制御と関連しており、腸と脳のコミュニケーションの中心的な役割が強調されています。 |
| 腸内微生物叢と脳が継続的な双方向通信を介して情報を交換できるメカニズムは数多くあります。 腸から神経系への情報の検出と伝達には、神経、内分泌、炎症のメカニズムが関与しています[112]。 |
| 高齢者や慢性疾患患者の栄養失調は腸内微生物叢の変化を引き起こす主な引き金であり、食事の調節は微生物叢の再構築に重要な役割を果たします。 そして腸内細菌叢由来の微量栄養素と代謝産物は、腸関門を通過して筋肉に到達し、筋肉に影響を与える可能性がある[108]。 たとえば、リポ多糖類 (LPS) やトリメチルアミン N-オキシドは炎症誘発性状態を誘発するのに対し、短鎖脂肪酸 (SCFA) や胆汁酸は宿主の代謝を調節します [113]。 |
| さらに、腸内細菌叢の組成の変化は、より一般的に若い成人に見られる変化と比較して、65歳以上の人々で観察された[114,115]。 |
| Bifidobacterium と Lactobacillusは微生物の多様性の増加につながり、より効率的な栄養素の摂取とアミノ酸合成を促進できる一方、過剰な栄養素の摂取と貯蔵、およびFirmicutes/Bacteroidetes比の増加は微生物の多様性の低さと関連している [116,117]。 |
| 肥満およびインスリン抵抗性のヒトおよび動物の腸内細菌叢では、Bacteroidetes濃度と比較してFirmicutes属の存在量の増加が見られる[118,119]。 |
| 興味深いことに、加齢によりBifidobacterium レベルが減少しますが、これはリポ多糖 の循環レベルの増加に関連しています。 肥満および糖尿病の個人では、リポ多糖エンドトキシンレベルが大幅に上昇し、腸内細菌叢の異常、腸透過性の増加、骨格筋のインスリン抵抗性を引き起こします[120、121、122、123、124] |
| インスリンに対する筋骨格抵抗性の促進は、内毒素血症のマーカーであるリポ多糖の存在によるものです。 これは、Toll 様受容体 4 (TLR-4) 経路の活性化を通じて、TNF-α、インターロイキン 1 (IL-1)、インターロイキン 2 (IL-2) および IL-6などの炎症誘発性サイトカインの最終発現につながります [125,126]。 |
| これは、加齢に伴う腸内微生物叢(Bifidobacterium など)の減少が、骨格筋の耐糖能の低下を通じてサルコペニア性肥満の発症にどのように影響する可能性があるかを浮き彫りにしている[117,126,127,128]。 |
| したがって、炎症性サイトカインの産生は、筋タンパク質の合成と分解(MPS:MPB)の不均衡を通じてタンパク質合成の抑制をもたらし、その結果、筋肉量と身体機能が低下しました[129、130、131、132]。 さらに、高齢者の血清リポ多糖およびTLR4レベルは、若年者よりもインスリン感受性が低いことに関連しており、加齢に関連したリポ多糖レベルが加齢に伴うインスリン抵抗性の発生率を増加させる可能性があることが示されている[133,134]。 |
| したがって、微生物の多様性と機能の低下は、骨格筋に直接影響を与える可能性があります[132、135、136]。 しかし、重要な問題は、腸内細菌叢が老化の結果の原因であるのか、それとも微生物の多様性の変化が老化によって引き起こされるのかということである[137,138]。 |
| 4. 栄養とサプリメント |
| バランスの取れた食事は、エネルギー、主要栄養素、ビタミン、ミネラルを供給するため、筋骨格系の健康にとって重要です。 しかし、高齢者はより高い栄養ニーズがあるにもかかわらず、若い人よりもエネルギーとタンパク質の消費量が少ない[139]。 |
| 抗酸化栄養素やその他の植物生理活性化合物などの微量栄養素の摂取量の増加は、果物、野菜、植物性食品(豆類、ナッツ、種子)の多量摂取オリーブオイルの使用、肉や乳製品の摂取量の削減を特徴とする地中海食パターンによってもたらされます。 このパターンの遵守は、腸内微生物叢の状態の改善を含む多くの健康上の利点にも関連している可能性があり、これらは高齢者集団における筋肉量の維持と身体パフォーマンスの向上に密接に関連している[140]。 |
| サルコペニアの病因/病態生理学における炎症の重要性により、クローン病(CD)患者のサルコペニア関連炎症における食事の役割は非常に重要である[141]。 |
| 腸内微生物叢に関連する炎症促進プロセスは、最近の NOVA 分類システムに従って定義された超加工食品 (UPF) の摂取によって引き起こされます [142]。 |
| 高度に加工された食品には、工業的に加工されたペストリー、肉や乳製品、風味豊かなスナック食品、砂糖入りの飲料などが含まれ、通常はエネルギー密度が高く、栄養素含有量が低いです。 しかし、残念なことに、その非常に嗜好性の高い性質が過剰摂取を促進します。 これらの食品はしばしば悪い食習慣を表し、全死亡率、心血管疾患、メタボリックシンドローム、がん、その他の病理学的状態を含む健康に悪影響を及ぼします[143]。 これらの病気は酸化ストレスや炎症とも関連しており、腸内微生物叢の組成、多様性、豊かさを変化させる可能性がある[144]。 食事パターンの短期的な変更は腸内微生物叢の種類と組成に影響を与える可能性があるため、栄養は細菌の恒常性において基本的な役割を果たします。 |
| n-3 脂肪酸などの抗炎症作用のある特定の食事成分は、保護効果があることが実証されています [145]。 |
| 一方で、悪い食習慣は腸内微生物叢の大幅な変化により肥満を引き起こす可能性があります。 その結果、腸-筋肉軸の変化により、肥満がサルコペニアの重要な潜在的原因となる[146]。 |
| 栄養失調、慢性炎症、筋-腸軸の不均衡を直接結び付ける証拠の増加に伴い、サルコペニアに対する統合療法の可能性としていくつかの栄養補助食品が登場しています(表 1)。 たとえば、ビタミン D レベルが低いと、高齢者のサルコペニアのリスクが高まることが予測されており [147]、ビタミン D の補給は大いに役立ちます。 |
| 表1 筋骨格系の健康を維持できる特定の用量を通じて効果を実証するサプリメント |
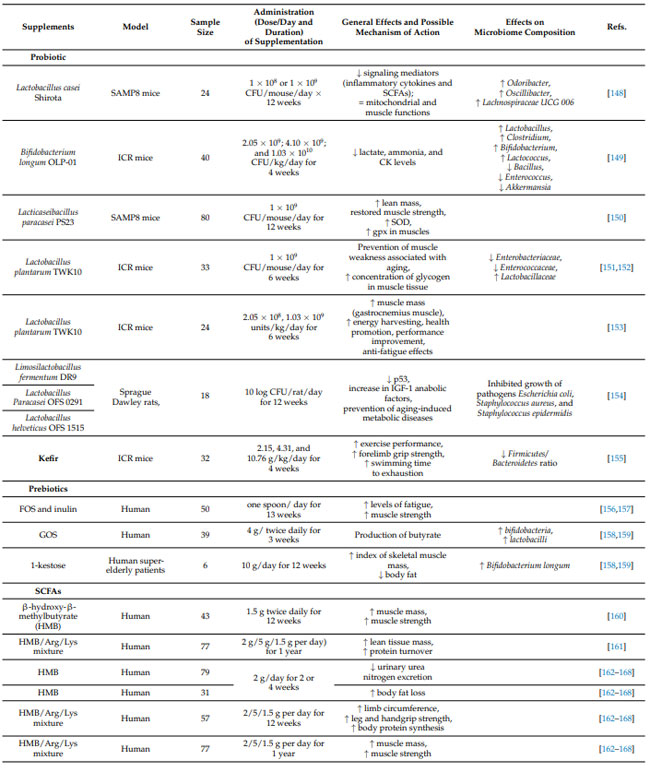 |
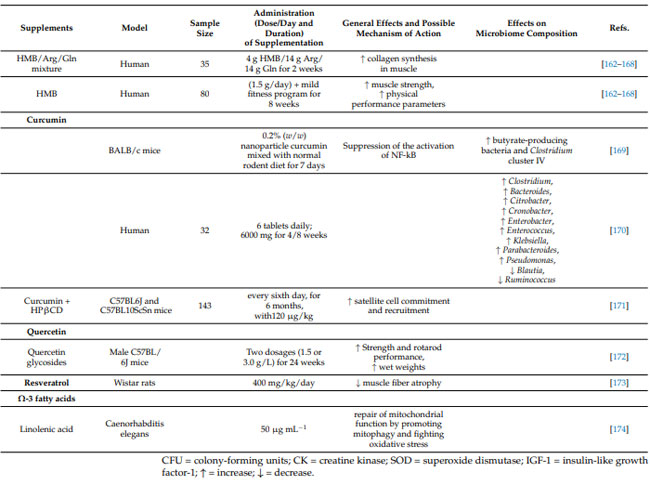 |
| 私たちは、老化における筋骨格の健康を予防しサポートするための統合的なアプローチを提案することを目的として、抗酸化物質、多価不飽和脂肪酸、ビタミン、プロバイオティクス、プレバイオティクス、タンパク質、ケフィア、および 短鎖脂肪酸の予防および治療特性について説明します。 |
| 4.1. ビタミンD |
| ビタミン Dレベルは、がん、心血管障害、肥満、サルコペニアなどの多くの病気のリスクと負の相関があります。 ビタミンDと高齢者におけるサルコペニアのリスク上昇との関連性を裏付ける疫学データは、Remelliらによって評価された[147]。 ビタミン D の約 80% は、紫外線 B (UVB) の照射によって生成されます。7-デヒドロコレステロールから始まり、プレビタミン D3 に変換され、その後ビタミン D3 (コレカルシフェロール) に変換されます。 残りは D3 またはエルゴカルシフェロール (D2) として導入されます。 これらの値は、民族、日照時間、季節などの要因に基づいて変化する可能性があります [175]。 肝臓のチトクロム P450 では、ファミリー 2 サブファミリー R メンバー 1 (CYP2R1) またはファミリー 27 サブファミリー A メンバー 1 (CYP27A1) が C25 部位でビタミン D を水酸化し、25-ヒドロキシビタミン D (25(OH)D) を生成します。 腎臓では、CYP27B1 が C1 部位の25-ヒドロキシビタミン Dを水酸化して 1,25-ジヒドロキシビタミン D (1,25(OH)2D) を形成します。 次に、1,25-ジヒドロキシビタミン Dは、ビタミン D 受容体(VDR) 標的遺伝子の発現を調節する核リガンド依存性転写因子である ビタミン D 受容体に結合し、いくつかの生理学的反応を引き起こします。 CYP27B1は腎臓で発現するだけでなく、腎臓の外側でも広く発現し[176]、局所的な部位特異的な1,25-ジヒドロキシビタミン D濃度を増加させ、同じ組織内の内因性ビタミンD受容体と相互作用することができる [177]。 複数の腎外臓器における1,25-ジヒドロキシビタミン D -ビタミンD受容体媒介の遺伝子転写調節の主な機構は、この 1,25-ジヒドロキシビタミン Dの分泌内合成であると考えられます。 25-ヒドロキシビタミン Dおよび 1,25-ジヒドロキシビタミン Dは代謝され、不活化され、尿または胆汁中に部分的に除去されます。 |
| ビタミン D 欠乏、筋機能の低下、サルコペニアの発生率の増加はすべて、多数の人体研究で関連付けられています [178]。 世界中で約10億人がビタミンD欠乏症であると考えられている[179]。 |
| 年齢は、不適切な食事、皮膚のビタミンD合成障害の減少、またはビタミンD代謝酵素の発現の変化と骨格筋におけるビタミンD受容体発現の減少に起因する、ビタミンD欠乏症および異常なビタミンD機能のリスクを高める[180]。 |
| ビタミン D は、カルシウムの恒常性と骨の健康を調節する役割で最もよく知られていますが、ビタミン D 筋萎縮の保護にはいくつかのメカニズムが関与しています。 ユビキチンプロテアソーム経路は萎縮において上方制御され、2つのE3ユビキチンリガーゼであるアトロジン-1と筋肉RINGフィンガータンパク質-1(MuRF1)の発現増加は悪液質のマーカーと考えられている[181]。 分化したヒト筋管およびストレスのC2C12モデルでは、ビタミンDによる治療はアトロジン-1および筋肉RINGフィンガータンパク質-1の発現を抑制する[182,183]。 加齢に伴うAMPK(訳者注:AMPKは細胞内のエネルギーが不足すると活性化し、代謝を制御する分子です)の喪失は、細胞が代謝調節異常の状態に反応できなくなり、酸化ストレスの増加につながる可能性があるため有害です。1,25-ジヒドロキシビタミン D療法は、細胞萎縮およびストレスモデルにおいてAMPK活性を高め、重要なAMPK活性化因子であるサーチュイン-1(SIRT1)の発現を改善すると考えられる[184]。 |
| 最近の研究では、ビタミン D が骨格筋肥大を引き起こし、mTOR Complex 1 (mTORC1) シグナル伝達経路を介してタンパク質合成を促進する可能性があることが示唆されました。 ラットでビタミンD受容体を過剰発現させると、筋断面積の増加によって示される筋肥大が引き起こされ、同化シグナル伝達と翻訳効果が向上し、リン酸化mTORと下流標的の増加につながった[185]。 |
| 老化は細胞増殖の重要な制御手段ですが、老化細胞は老化関連分泌表現型 (SASP) として知られる炎症誘発性環境を作り出します。ビタミンD欠損マウスは細胞老化と老化関連分泌表現型成分の産生増加を示します [186]。 さらに、25-ヒドロキシビタミン Dレベルの低さと脂肪量との関連性を示す豊富なデータがあり、過体重で欠乏している人は筋肉量と機能の低下を経験する可能性が高くなります [187]。 |
| ビタミンDはミトコンドリアの機能にも重要な役割を果たします。 1,25-ジヒドロキシビタミン D は、in vitroモデルにおけるヒト骨格筋細胞のミトコンドリア生体エネルギーを増強し[188]、酸素消費速度と核分裂/融合ダイナミクスを増加させた[189]が、動物における食事誘発性25(OH)D3欠乏症は障害を引き起こした。 ミトコンドリアタンパク質含有量に変化を与えないミトコンドリア機能[190]。 Ryan らは、1,25-ジヒドロキシビタミン Dとビタミン D3 の投与では酸素消費率が増加するが、25-ヒドロキシビタミン Dでは増加しないことを実証しました。 VDR発現とさまざまなビタミンD類似体および投与量がミトコンドリア動態に及ぼす影響を明らかにするために、今後の研究の必要性が強調されている[189]。 Vit D 欠乏は筋萎縮を引き起こす可能性があり、ミトコンドリア 活性酸素種生成も増加し、ミトコンドリア ATP 合成も減少します [191]。 ビタミン D の欠乏は、骨格筋タンパク質と脂質の過酸化を促進し [192,193]、抗酸化酵素の活性障害を引き起こします [192,194]。 |
| ミトコンドリアは、衛星細胞 (SC) 活性の制御にも重要な役割を果たします。 静止状態の衛星細胞は活性状態の衛星細胞に比べてミトコンドリアの量が少なく、酸化能力が低く、活性酸素種の生成は対称分裂と最終分化を刺激することが知られており、衛星細胞の活性に影響を与えるミトコンドリアの役割を裏付けている[195]。 ビタミン D による増殖の減少は、衛星細胞の静止状態を維持し、その結果として筋肉内の幹細胞集団を維持するのに役立つ可能性があります。 一方で、分化と成熟筋管の生成に伴う代謝機械合成の増加は、おそらくミトコンドリアの酸素消費率の増加によって促進されている[196]。 |
| ビタミン D 欠乏は 20 ng/mL 以下の値で示され、その不足は 30 ng/mL の濃度で示されます [197]。 |
| 加齢に伴う血中25-ヒドロキシビタミン D濃度の低下は骨密度の減少につながり、骨折や転倒のリスクが高まります。 Okunoらによる研究では、65歳以上の日本人高齢女性80人のサンプルの89%でビタミンDが欠乏し、28%で欠乏していることが判明した[198]。 ビタミン D レベルが低いか欠乏している人の合計 56.3% が、3 か月のモニタリング期間中に低下しました。 加齢に伴う屋外活動の減少は、体のビタミンD合成能力の低下を引き起こすだけでなく、皮膚によるプレビタミンDの生成も2分の1に減少する[199]。 さらに、加齢に伴い腎臓の 1,25-ジヒドロキシビタミン D 生成能力が低下することが実証されています [200]。 ビタミン D の補給は、高齢者によく見られる血清 25-ヒドロキシビタミン D レベルが低い場合により有益であり [201]、ビタミン D 過剰症(腎石灰沈着症、高カルシウム血症、 腎不全)、長期間にわたる過剰なビタミン D 摂取が必要です。 |
| ビタミンD補給に関するメタ分析では、1日700~1000 IUの用量では高齢者の転倒リスクが19%減少するが、より低い用量ではそうではない可能性がある[202]。 |
| Houston らは、50 nmol/L (20 ng/mL) を超える25-ヒドロキシビタミン D 値が骨の健康を促進するのに十分であるとみなされると報告しました [203]。 さらに、Ginde らは、ビタミン D が必要なときに放出される副甲状腺ホルモンの完全な抑制は、濃度 > 40 ng/mL で起こると報告しました [204]。 複数の研究で、血中 25-ヒドロキシビタミン D 3 レベルが最も低い四分位と最も高い四分位の両方を持つ人は筋力が低下し、骨折や虚弱のリスクが高いことが示されています。 このため、U 字型曲線の形での用量依存性の反応が仮定されています [205,206]。 食事摂取基準(2020年)によれば、日本のビタミンDの適切な摂取量(AI)は8.5μg/日(340IU)である[207]。 米国とカナダにおけるビタミンDの1日あたりの推奨摂取量(AI)は、70歳未満の場合は15μg(600IU)、71歳以上の場合は20μg(800IU)である[208]。 国際骨粗鬆症財団は、高齢女性が転倒や骨折を避けるためには、20~25μg/日(800~1000IU/日)のビタミンD摂取が必要であると述べている[209]。 |
| たとえビタミン D との統合が、特に高齢者にとって有用であるとしても、1 日あたりの理想的なビタミン D 量に関するコンセンサスはまだ得られていません。 |
| ナノエマルジョン技術を使用してビタミンDを補充した機能性食品やビタミンDを強化した食品の作成に関する将来の研究は、高齢者におけるビタミンDの生物学的利用能を大幅に高め、ビタミンD欠乏症治療の改善につながる可能性があります。 |
| 4.2. 酸化防止剤 |
| 栄養失調、慢性炎症、ビタミン欠乏、筋-腸軸の不均衡は、サルコペニアを引き起こす可能性のある要因のほんの一部です。 |
| メタアナリシスの結果、腸内毒素症の患者にはサルコペニアが多く見られ、サルコペニアと腸内毒素症の発症は両方とも酸化ストレスと炎症状態に起因することが明らかになりました。 |
| フリーラジカルと炎症性メディエーターは胃腸管の粘膜バリアを損傷し、細菌の侵入と腸内細菌叢の異常を引き起こします。 腸内微生物叢の細菌の量と多様性が減少した状態では、腸の透過性の増加により、腸-筋肉軸を介して筋肉内のミオスタチンが上昇し、サルコペニアを誘発します[210、211、212]。 |
| in vitro で証明されているように、抗酸化物質を食事に補給すると酸化ストレスを軽減できます [213]。 |
| 抗酸化物質には、1 つ以上のフェノール環を持つ化合物の幅広いファミリーであるポリフェノールが含まれ、野菜、ワイン、緑茶、ブドウ、赤い果物、コーヒーなどの多くの食品源に天然に含まれています [214]。 |
| ポリフェノールは通常、フェノール酸、フラボノイド、スチルベン、リグナンの 4 つのグループに分類されます。 これらの化合物は、その構造内のフェノール環の数と、環を結合する構造の部分に基づいています [215]。 |
| ポリフェノールは、抗酸化作用、抗炎症作用、免疫調節作用、アポトーシス作用など、病気の予防において多くの潜在的な作用機序を示します。 |
| さらに、これらの化合物は、炎症関連遺伝子(NF-κB、核因子赤血球 2 関連因子 2(Nrf2)、ヤヌスキナーゼ/シグナル伝達物質および転写活性化因子(Jak/STAT)など)の発現を変化させます。 下流のサイトカイン(IL-8、IL-1β、TNF-αなど)の形成を抑制することにより、マイトジェン活性化プロテインキナーゼ(MAPK))を抑制します。 細胞内抗酸化物質(ヘムオキシダーゼ-1(HO-1)、スーパーオキシドジスムターゼ(SOD)、グルタチオンペルオキシダーゼ 1(GPx)など)の活性を増加させます。 |
| さらに、プレバイオティクスとして、健康な微生物叢の維持、短鎖脂肪酸の形成、密着結合の安定化による腸管透過性の低下を促進します。 |
| ポリフェノールは、抗酸化作用と抗炎症作用により、筋肉の炎症を軽減し、加齢に関連する転写因子を調節することができます[212,216]。 |
| クルクミンは、抗酸化作用、抗炎症作用、抗変異原作用、抗菌作用、抗アテローム性動脈硬化作用(心臓保護作用)、脂質修飾作用、および抗腫瘍作用を持つ別の分子である [215,217]。 |
| クルクミンの多標的作用は、NF-kB、STAT3、Nrf2、活性酸素種、COX-2などのいくつかの細胞シグナル伝達経路を阻害することによって媒介されることが証明されている[169]。 |
| クルクミンはショウガ科の根茎性草本多年草植物(Curcumalonga)に含まれており、クルクミンはCurcumalonga(ターメリック)および他のCurcuma属の根茎に含まれる主要な天然ポリフェノールです。 [218,219]。 |
| 国連食糧農業機関 (FAO)/世界保健機関 (WHO) 食品添加物専門家委員会 (JECFA) および欧州食品安全機関 (EFSA) によって決定されたクルクミンの 1 日あたりの許容摂取量は、0 ~ 3 mg/体重kg です [220]。 |
| クルクミンはさまざまな生物学的機能を示すにもかかわらず、経口投与後の吸収性が低いため、臨床応用は限られています。 このため、経口投与用の革新的な医薬製剤が開発されています。 |
| さまざまな送達システムを使用したいくつかの予備研究の後、クルクミン調製物へのナノテクノロジーの適用により、その経口バイオアベイラビリティが大幅に改善されました。 ナノ粒子は、ラットとヒトの両方でクルクミンの吸収を 30 倍高めました。 |
| BALB/c マウス (6 ~ 8 週齢の雌) を、デキストラン硫酸ナトリウム (DSS) 誘発大腸炎投与、デキストラン硫酸ナトリウムとナノ粒子クルクミン、またはナノ粒子クルクミンで治療しました。 疾患活動性指数は、デキストラン硫酸ナトリウムとナノ粒子クルクミンのグループよりも デキストラン硫酸ナトリウムグループの方が著しく高かった [169]。 |
| クルクミンは、いくつかの炎症性遺伝子の発現を誘導するNF-κB活性化の強力な阻害剤であることが報告されている[221]。 |
| [169]の研究結果は、NF-kBp65の核への移行が、デキストラン硫酸ナトリウム+ナノ粒子クルクミン群の方がデキストラン硫酸ナトリウム群よりも有意に抑制されたことを示した。 したがって、NF-κBの阻害は粘膜炎症の抑制につながります[169]。 |
| さらに、ナノ粒子クルクミンによる治療により、高酪酸生成細菌であるClostridium クラスター IV および XIVa の数が増加し、糞便酪酸レベルの増加につながることが発見されました。 酪酸は、腸の恒常性と抗炎症特性に有益な影響を与え、粘膜免疫と腸のバリアの完全性を高めることができるため、非常に重要です[222]。 |
| 別の調査研究では、Petersonらは、19歳から58歳までの成人32人を募集し、プラセボ群、ターメリック群、クルクミン錠剤群の3つのグループに無作為に割り付けた[170]。 被験者は、1日3錠の6000 mgの錠剤を1日2回、食事とともに経口摂取する必要がありました。 |
| 著者らは、治療前と治療後の各グループの細菌種の量を比較しました。 彼らは、プラセボ群では種が全体的に15%減少したことを観察しましたが、ターメリックを与えられた被験者では、観察された種の数が7%(156対167)というわずかな増加を示しました。 注目すべきことに、クルクミンを摂取した人々は、特定された種の平均69%の増加を示しました。 |
| 一方、多様性指数の ANOVA 比較では、参加者内でのばらつきが大きかったため、ターメリック錠剤群とクルクミン錠剤群の間で統計的に有意な差は明らかになりませんでした。 |
| ターメリックとその成分が微生物叢に及ぼす影響をさらに理解するには、人体での研究が必要です。 |
| さらに、Gorza et al [171] は、クルクミン治療に対する筋肉特異的な反応の可能性を示唆しました。 特に、クルクミンの慢性的な全身投与は、老化時の自然死亡率を大幅に低下させ、プレサルコペニアと効果的に闘い、サルコペニアを大幅に軽減し、サテライト細胞の関与と動員を改善しました。 これは、クルクミンの慢性的な全身投与が老化したマウスに非常に効果的であることを示唆しています。 |
| クルクミン治療により、筋肉量の減少が防止され、加齢に伴うヒラメ筋力の低下が軽減され、老齢マウスの死亡率が減少しました。 寿命に対する利点は、まだ明らかな筋肉の関与を示さない老齢の6Jマウスでも明らかであったため、骨格筋の利点とは無関係に生じているように思われた。 クルクミン療法は、老齢10ScSnマウスのタイプ1筋線維のサイズを維持し、タイプ2A筋線維の肥大を促進し、ヒラメ筋サルコペニアの発症を予防した[171]。 興味深いことに、フラボノイドのケルセチンは優れた抗酸化物質でもあり、その治療特性には抗がん作用、抗炎症作用、心血管疾患の予防などが含まれます[223,224]。 さらに、最近の研究では、ケルセチンが糖尿病と肥満に大きな影響を与えることが示されています[225]。 |
| Zhangらによる研究では、ケルセチンがin vitroで抗炎症作用と免疫調節作用を示すことが明らかになった。 そこで、ケルセチンを含むカクメン・プラティクラディをin vivo実験に選択しました。 ケルセチンとカクメン・プラティクラディを投与されたマウスは、腸構造の改善、下痢の軽減、便潜血の発生率の低下を示しました。 一般に、マウスの腸のピロトーシスと炎症は、カクメン・プラティクラディとケルセチンの水性抽出物によって大幅に軽減されました [226]。 |
| Juらによる2018年の実験研究では、食事とともにケルセチンを摂取すると、HO-1依存性経路を介してマクロファージの抗炎症効果と殺菌能力が調節され、大腸炎を部分的に緩和できることが実証された。 これは、ケルセチンが腸内マクロファージの炎症誘発性、抗炎症性、殺菌機能のバランスを再調整することで、腸内宿主と微生物の適切な関係を回復し、大腸炎を緩和する可能性があることを示唆しています。 したがって、腸マクロファージの機能を調節するケルセチンの食事投与を通じて免疫学的恒常性を回復し、腸内共生細菌叢のバランスを再調整することは、炎症性腸疾患を治療するための潜在的かつ有望なアプローチである[227]。 |
| 一方、Kanzaki et al [28] による実験的研究では、サルコペニアの治療法としてケルセチンが使用されました。 雄の C57BL/6J (B6) マウスに、飲料水に溶かしたケルセチン配糖体 (QG) を 2 つの用量 (1.5 または 3.0 g/L) で 24 週間与えました。 治療を受けたマウスでは、握力とロータロッドのパフォーマンスが大幅に改善されました。 治療を受けたマウスの筋肉形態における特定の筋肉群(大腿方形筋、腓腹筋、前脛骨筋、ヒラメ筋)の湿重量の増加により、機能上の利点が実証されました。 したがって、老化の初期段階でのケルセチン配糖体の長期経口投与は、安全かつ効果的に運動能力の特定の側面を強化し、筋肉量を増加させることができます[172]。 |
| さらに、強力な抗酸化作用、抗炎症作用、代謝調節作用があると考えられている別の化合物はレスベラトロールです[228]。 |
| レスベラトロールは、特定の微生物種の増殖を妨げたり、細菌集団に変化をもたらしたりすることにより、腸内細菌叢の組成を大幅に変更することができます[85]。 |
| 特に、レスベラトロールは腸細胞において抗炎症作用があることが示されています。 ある研究では、細菌から生成されたリポ多糖に曝露された Caco-2 細胞をさまざまな濃度 (10 ~ 50 μg/mL) で使用し、レスベラトロールの保護効果を調べました。 COX-2 発現の低下は、レスベラトロールで処理した細胞における PGE2 レベルの低下と関連していることが実証されました。 さらに、レスベラトロールは、内因性NF-κB阻害剤であるIkBの分解速度を遅くすることにより、NF-κBの活性化を防止した[229]。 |
| 別の研究では、高濃度(440 μm)のレスベラトロールがインドメタシン誘発性のミトコンドリア機能不全から Caco-2 細胞を保護することが実証されました [230,231]。 |
| さらに、いくつかの実験研究では、レスベラトロールは筋タンパク質合成を増加させ、筋タンパク質変性を減少させ、骨格筋線維萎縮を軽減することが示されています。 たとえば、毎日400 mg/kgのレスベラトロールを与えられたげっ歯類では、筋線維萎縮の有意な減少が記録された[173]。 低用量のレスベラトロール (12.5 mg/kg/日) では、衛星細胞の数や筋肉量は増加しませんでした。 しかし、運動と合わせたレスベラトロールの摂取に関する他のデータは、この天然化合物とトレーニングを組み合わせることで、運動単独よりもヒトのサルコペニアを大幅に軽減することを示しました[217]。 |
| 4.3. オメガ3脂肪酸 |
| オメガ-3(Ω-3) 脂肪酸 は多価不飽和 脂肪酸 (PUFA) です。 これらにはドコサヘキサエン酸(DHA)、エイコサペンタエン酸、ドコサペンタエン酸が含まれ、主に魚肉、卵、魚介類、植物油に含まれています[85]。 オメガ-3脂肪酸は、中年および高齢の女性の腸内微生物叢の組成と多様性の改善に関連しており、オメガ-3 脂肪酸とプロバイオティクス株の同時投与は、健康上の利点を増幅します [232]。 |
| オメガ-3 多価不飽和脂肪酸は、炎症性腸疾患(IBD )における炎症の軽減に関連しており、おそらく抗炎症性エイコサノイドを生成するための基質として機能します。 これらの化合物は、プロスタグランジンやロイコトリエンと同様の構造と特性を持っています[233]。 |
| これらの脂肪酸は、酸化ストレスを軽減し、TNF-α および炎症誘発性サイトカインを産生し、化学防御剤として働き、腸細胞における接着分子の発現を低下させることにより、疾患の発症に影響を与えます。 |
| 高レベルのオメガ-3不飽和脂肪酸を含む食事は、UCの実験ラットモデルにおける炎症と粘膜損傷を改善し、特定の脂肪酸が治療薬として使用されることが予測された[234]。 |
| タンパク質代謝を改善し、間接的な効果を通じて同化抵抗に対抗するための、オメガ-3 脂肪酸栄養補助食品の有効性についての新しい証拠が入手可能です。 研究では、魚油の長期投与により、基質(アミノおよび/またはタンパク質など)、ホルモン(インスリンなど)および/または骨格筋の身体活動からの同化刺激を増強できることが示されている[235]。 |
| さらに、いくつかの研究では、一般的な n-3 多価不飽和脂肪酸 (n-3 PUFA) であるリノレン酸がサルコペニアを改善する可能性があることが判明しています。 この研究では、Caenorhabditis elegans(線虫)の筋肉に対するリノレン酸の影響を調査するためのモデル動物としてC. elegansを使用しました。 その結果、50μg mL-1のリノレン酸が、マイトファジーを促進し、酸化ストレスと戦うことでミトコンドリア機能を修復し、サルコペニアを大幅に改善することが示された[174]。 |
| 4.4. プロバイオティクス |
| 筋機能が腸内細菌叢によって調節される可能性があるという証拠を提供する研究が増えている[148]。 いくつかの動物モデル研究は、腸-筋肉軸を介した加齢に伴う筋肉障害の発症と進行に対するプロバイオティクスの効果の証拠を提供しています。 |
| Chanらは、腸-筋肉軸を介した加齢に伴う筋肉障害の発症と進行に対するプロバイオティクスの効果の証拠を提供している[236]。 |
| 彼らの研究は、Lactobacillus casei Shirota (LcS) (1 × 108 または 1 × 109 CFU/マウス/日) を 12 週間投与された老化促進マウス Prone-8 (SAMP8) を対象に実施されました。 その後、筋肉量と酸素消費量を測定し、筋力維持脈拍と握力検査を実施した。 |
| Chenは、高齢のSAMP8マウスにLactobacillus casei Shirotaプロバイオティクスを投与すると微生物叢の組成を調節できることを実証し、特に若い筋肉の状態に関連する細菌株が調節されることが観察された。 さらに、Lactobacillus casei Shirotaの投与は、炎症性サイトカインなどの加齢に関連した腸-筋肉軸や短鎖脂肪酸に関与するシグナル伝達メディエーターのレベルを低下させた[236]。 最後に、ミトコンドリアと筋肉の機能の維持は注目に値します。 |
| 腸内細菌叢と筋肉機能との相関関係を考えると、これらの発見は、Lactobacillus casei Shirotaが腸-筋肉軸を通じて加齢に伴うサルコペニアの発症を調節できる可能性があることを示唆している[237]。 Lactobacillus casei Shirotaによってもたらされる腸内微生物叢の変化は、ミトコンドリア機能を維持する短鎖脂肪酸 [149]、サイトカイン、活性酸素種などのメディエーターの産生に変化を引き起こし、筋肉の老化の進行を遅らせます。 |
| さらに、Lee らは、抗生物質によって腸内細菌叢から B. longum OLP-01 が除去され、外部骨格筋を収縮する能力が損なわれているマウスにおける B. longum OLP-01 の補給を調査しました。 この株の連続投与は、用量依存的にマウスの握力に影響を与え、抵抗力を増加させることに成功した[150]。 |
| 12 週間のL.paracasei PS23 の補給も、非老化マウス(16 週齢)、対照(28 週齢)、および PS23(28 週齢)の 3 つのグループ(各 n = 6)に分けられた SAMP8 マウスで実施されました。 得られた主な結果は、L.paracasei PS23 が加齢によるサルコペニアの進行を軽減することを証明しました。 この効果は、加齢に伴う炎症と活性酸素種の減少によってミトコンドリアの機能が維持され、SAMP8マウスモデルでタンパク質の取り込みが維持されることによって実現された可能性がある[154]。 |
| 筋肉およびミトコンドリア生合成における酸素消費速度の増加も観察されています。 |
| Sprague Dawley ラットの早期老化モデルにおいて、12 週間にわたるいくつかの 乳酸菌株 (Limosilactobacillus fermentum DR9、L. paracasei OFS 0291、または L. helveticus OFS 1515) の補充が行われました。 この治療は、未治療のラットと比較して、トレッドミルでの疲労テスト後の運動パフォーマンスの向上につながりました[238]。 同様に、著者らは、腫瘍抑制タンパク質p53などの老化マーカーの減少と、栄養補給された高齢ラットの筋肉におけるIGF同化因子の増加が若いラットと同等であることを強調した。 |
| プレバイオティクス(非消化性繊維)とプロバイオティクスを組み合わせたシンバイオティクスも、特定種の腸内微生物叢の発達を促進する新たな栄養戦略を提供します。 さらに、シンバイオティクスは、高齢者におけるコロニー細菌の群集組成の増加を介した短鎖脂肪酸の投与を通じて、軽度の炎症を抑制することができる[151,152]。 |
| 動物モデルに関する研究は数多くありますが、ヒトに関する研究はこれまでにほとんど発表されていません。 |
| Leeらは2021年に、マウスにプロバイオティクスL. plantarum TWK10を投与すると、筋肉組織内のグリコーゲン濃度が改善され、腸内マイクロバイオームが調節されることにより、老化、骨量減少、認知機能低下に伴う筋力低下を予防できる可能性があると報告した[153]。 |
| 以前、マウスに同じサプリメントを6週間投与したところ、炎症と筋萎縮のマーカーの減少を通じて筋肉量と運動パフォーマンスが改善されたことが報告されている[239]。 |
| これと一致して、Leeらによって実施されたランダム化二重盲検臨床研究では、L. plantarum TWK10の6週間の経口投与が虚弱な高齢者の筋肉量と機能の改善につながり、サルコペニアを予防できることが示された[240]。 |
| いくつかの実験研究では、微生物の濃縮がインスリン感受性[241]、握力、および脆弱性状態の改善を伴うことを示している[242]。 さらに、短鎖脂肪酸濃度の増加[243]と炎症誘発性サイトカインの減少[244]も、若者と高齢者の両方で観察されています。 |
| 最後に、ケフィアは貴重なプロバイオティクスでもあります。 具体的には、ケフィアは、乳酸菌と酵母を含む微量のアルコールを含む酸発酵乳です。 ケフィアの有益な効果に関する研究は過去 10 年間で増加し [245]、ケフィアは複数の生物学的活性を持つ重要な機能性乳製品となっている [246]。 |
| 疲労に対するケフィアの有益な特性は、腸内細菌叢の組成の調節を分析することによってHsuらによって研究された[155]。 |
| Institute of Cancer Research (ICR) の雄マウス 8 匹からなる 4 つのグループに、毎日異なる用量のケフィアを 4 週間投与しました。 徹底した水泳時間と前肢の握力を測定することによって、さまざまな用量のケフィアが疲労と身体運動パフォーマンスに及ぼす影響を評価し、著者らは対照群と比較して追加群で有意な改善が観察された。 同様に、腸内細菌叢の構成も変化し、著者らは最終的に、サプリメントによる腸内細菌叢の変化と運動との相関関係を発見した[155]。 |
| 研究は動物モデルで行われていますが、これらの結果を考慮すると、ケフィアの補給に関連した腸内微生物叢の健康状態の改善は、サルコペニアなどの加齢に伴う筋虚弱症候群を改善するための有効な支援戦略である可能性があると推測できます。 |
| 4.5. プレバイオティクス |
| 高齢者の健康に対するプレバイオティクスの有益な効果を調査した研究はほとんどありません。 高齢者の研究で使用されるプレバイオティクスのほとんどは、天然多糖類、フラクトオリゴ糖 (FOS)、イヌリン、およびガラクトオリゴ糖 (GOS) です。 これらのプレバイオティクスの主な腸内微生物叢のターゲットは、Bifidobacterium spp. と Lactobacillus spp.です [156,247]。 |
| これまでの研究では、フラクトオリゴ糖とイヌリン摂取の結果、微生物相において健康に有益な種が増加し、同時に有害な種が減少したことが示されている[156,157]。 |
| さらに、フラクトオリゴ糖 とイヌリンによる栄養補給の 12 ~ 13 週間後には、フィットネス、栄養状態、生活の質、虚弱性も改善されました [242,248]。 |
| ガラクトオリゴ糖を10週間補給すると、腸内細菌叢と免疫反応も変化する可能性があり[249]、ガラクトオリゴ糖を3週間摂取するとBifidobacterium spp.と酪酸の生成が増加する。 これは、これが筋肉にもたらすすべての利点を強調しています[158,159]。 |
| Tomiagaらは研究で、腸内細菌叢の変化に対する1-ケストースの影響を分析し[250]、1-ケストースを12週間摂取した6人の被験者の腸内でB. longumの個体数がどのように有意に増加したかを観察した。 さらに、このサプリメントは骨格筋量の指数を増加させ、体脂肪の指数を減少させました。 プレバイオティクスの投与により、サルコペニアの超高齢患者の筋萎縮が回復した。 |
| さらに、Buiguesら[248]が65歳以上の高齢者60人を対象に実施したプラセボ対照無作為化二重盲検プロジェクトにおいて、著者らはイヌリンとフラクトオリゴ糖の混合物のプレバイオティクス化合物の有益な反応を観察した( マルトデキストリン)。 参加者は無作為に割り付けられ、プレバイオティクスまたはプラセボを毎日投与して13週間続く並行グループ手術を受けました。 |
| 結果は、プラセボ群と比較して、プレバイオティクス混合物の投与後の手の筋力に有益な効果を示し、プレバイオティクスが筋肉系に影響を与える可能性があることを示唆しています。 したがって、プレバイオティクスは、加齢に伴う症状、特に虚弱に苦しむ人々の総合的な治療プロトコルに、また一般的な予防介入として含めることができる可能性があります。 |
| 4.6. タンパク質 |
| サルコペニアに対する栄養の潜在的な治療効果を調査するいくつかの臨床研究は、細胞および動物モデル研究におけるタンパク質栄養サポートの有望な結果に触発されています。 |
| 高齢者やがんなどの消耗性疾患を患っている患者の場合、筋肉量を増やすためにクリニックでタンパク質の栄養補給と筋力トレーニングが行われるのが一般的です。 健康な女性(65歳から75歳)を対象とした研究では、対照群と比較して、タンパク質補給により筋原線維タンパク質合成が促進されました。 4.2 gのロイシンを含む15 gのホエータンパク質を摂取した人は、急性筋原線維タンパク質産生の大幅な改善を示しました[251]。 |
| 別の研究では、ホエイプロテインの補給により、老人病棟で治療を受けている高齢患者の下肢の筋力と筋機能が向上することが示されました。 この調査では明らかに下肢が焦点であったが、その影響が被験者の随意筋骨格系全体に及ぶ可能性がある[252]。 |
| 臨床的に癌のない人々、特に前立腺癌のある人々は、アンドロゲンホルモンの重大な欠乏による体重減少を頻繁に経験します。 |
| レジスタンストレーニングとプロテイン補給(ホエイプロテイン単離物50g)により、治療を受けた被験者の除脂肪体重の減少が大幅に防止されました。 |
| アルコール性肝硬変患者を対象とした臨床試験では、オートファジー、タンパク質分解、ミオスタチン媒介アナボリック抵抗性が上昇していることが判明しました。 ロイシンが豊富な分枝鎖アミノ酸混合物の投与は、対照群の個体と比較して、オートファジー関連タンパク質mTORの発現を大幅に減少させ、その後オートファジー誘発性筋タンパク質分解を逆転させた。 これらの発見は、経口栄養補助食品が病気と体重減少の割合を大幅に減少させることを示しました。 さらに、最近の研究では、循環している miR-203 が結腸直腸がん患者の筋減少症の促進に寄与していることが判明した [253]。 |
| ホエイプロテインを摂取した後、脚を固定した被験者でも miRNA レベルの変化が見られました。 miR-208b の発現が抑制され、miR-23a の発現が増加したため、不動によって引き起こされるサルコペニアを防ぐことができます。 |
| さらなる臨床試験では、総タンパク質ロイシン含有量が骨格筋の同化反応の増加に重要な役割を果たしていることが示されました。 高齢者の2つのグループに、最初のグループにはロイシン3gを含む分離ホエイプロテイン25gのサプリメントを与え、第2グループにはロイシン3gを含む分離ホエイプロテイン10gを与えました。 骨格筋タンパク質合成の維持と筋肉損失の改善に関して、同等の結果が得られました。 この研究から、総タンパク質量が同じであれば、ロイシンの濃度が高いほど、より多くの筋原線維タンパク質合成を促進できることが理解されました[254]。 |
| ブレンドされた大豆プロテインとホエイプロテインを摂取した患者は、握力と腕の筋力の向上を経験しました。 一般に、高齢者や患者は、筋肉の減少を効果的に遅らせ、筋肉の機能を高めることができるため、高タンパク質の栄養サポート、特にロイシンが豊富な食事から恩恵を受ける可能性があります。 タンパク質は、食欲抑制効果と筋肉分解(MPB)よりも筋タンパク質合成(MPS)を維持する同化作用により、肥満やサルコペニアの人の減量技術において主要な主要栄養素である[255]。 |
| ペプチド YY (PYY) とグルカゴン様ペプチド-1 (GLP-1) の分泌は、それぞれ結腸と小腸の L 細胞と G 細胞に見られるタンパク質結合 G 受容体 (GPCR) によって調節されます [256,257] ]。 タンパク質の摂取に反応して放出されるコレシストキニン(CCK)も満腹感に寄与します。 食事中の炭水化物と脂肪の摂取は、レプチンとグレリンの分泌の調節に関連していると考えられており、いくつかの研究がこれらの効果を裏付けています。 しかし、腸内細菌叢の食物タンパク質間のシグナルによって影響される食欲誘発性の反応は、アミノ酸の組成、特にロイシンなどの必須アミノ酸によって決定することができる[258]。 低タンパク質食は、高齢者における食事性タンパク質の満腹感と同化作用の効果を減少させる[259]。 高齢者は若い人よりもタンパク質を吸収して利用する能力が低いため、現在のタンパク質推奨食事摂取量(RDA)である0.8 g/kg/日では十分ではない可能性があります[160]。 |
| ロイシンの推奨摂取量は 1 食あたり約 3 ~ 4 g で、これは高品質タンパク質 25 ~ 30 g に相当し、1 日あたり 3 ~ 4 回の食事で 1.0 ~ 1.6 g/kg/日を摂取することになります[260]。 これは、高齢者のMPSのさらなる刺激を促進することを目的としています。 |
| 腸内微生物の多様性は、食事のタンパク質源とそのアミノ酸組成に影響されます。 より具体的には、植物タンパク質を食べるとBifidobacterium, Roseburia, Ruminococcus bromii, Lactobacillus, および Roseburiaのレベルが高くなることに関連しているのに対し[106]、動物性タンパク質を食べるとBacteroides, Alistipes, Bilophila, および Clostridium perfrigens のレベルが高くなることがわかっています [261]。 |
| 豊富な大豆タンパク質、緑豆、およびソバの食事は、胆汁酸変換とグルカゴン様ペプチド-1分泌の増加、 Lactobacillus と Bifidobacterium,の増加、およびFirmicutesの低下にも関連していることは注目に値する[262]。 さらに、Bacteroides fragilis と Clostridium perfingens の個体数は、Bifidobacteriaで発酵されたホエーとチーズのタンパク質により減少することが示されているが、酢酸の合成とLactobacillus とBifidobacteriumの多様性は増加することが示されている[263]。 |
| さらに、いくつかの種のLactobacillus と Bifidobacteria は、ヒトとマウスの両方において筋肉量の改善、体重の減少、肥満傾向の減少に関連している[264]。 これは、げっ歯類の研究でLactobacillus と Bifidobacteria に見られる高レベルのホエイタンパク質によって説明されます[265]。 これに関して、白身肉タンパク質の摂取はLactobacillus の数を増やすことが示されており、マウスの食事にL. plantarumを補充すると筋肉量の増加につながった[265]。 |
| 魚タンパク質を与えられたマウスでは、短鎖脂肪酸含有量の増加とProteobacteria (Helicobacter) の減少が観察された[266]。 |
| 持久系アスリートに70日間投与したところ、牛肉(25g)を含むホエイプロテインサプリメントはRoseburia, B. longum, and Blautia, を減少させ、一方でBacteroidetesの種を増加させた[267]。これは、マルトデキストリンを投与された対照群とは対照的であった。 |
| しかし、別の研究では、無菌マウス(GF)に高タンパク質牛肉を組み込むと、マイクロバイオームが変化していないマウスと比較して、両方のグループで握力の向上が示されました[132]。 このため、著者らは微生物組成が異なるマウスに高タンパク質牛肉を与えることの影響に疑問を抱くようになった。 |
| 興味深いことに、より好ましい微生物組成は、動物性タンパク質と比較して植物性タンパク質の消費量の増加と関連しており、これは部分的に短鎖脂肪酸産生細菌の割合が高いことによるものです。 |
| 4.7. 短鎖脂肪酸 |
| 微生物叢の改変による筋肉機能と筋肉量の調節における短鎖脂肪酸の役割を示唆する証拠が増えている[268]。 |
| 2022年、ランダム化二重盲検対照研究で、43人の被験者の身体組成の変化に対する経口β-ヒドロキシ-β-メチル酪酸(HMB)の12週間のサプリメント摂取の効果が調査されました。 |
| その結果、β-ヒドロキシ-β-メチル酪酸グループの握力は上昇傾向にあったことが分かりました。 これは、β-ヒドロキシ-β-メチル酪酸の補給により、一部の筋肉消耗性疾患において筋肉量と筋力が増加することを示している可能性があります。 |
| これらのデータを裏付けるために、他の研究も人間に対して行われ、Holeček によるメタ分析研究で収集されました [161]。 |
| 7件のランダム化比較試験[162,163,164,165,166,167,168]のメタアナリシスに基づいて、高齢者におけるβ-ヒドロキシ-β-メチル酪酸の補給は、脂肪量に大きな変化を引き起こすことなく除脂肪体重の減少を防ぐことができることが示されています。 これらの結果は、β-ヒドロキシ-β-メチル酪酸の補給により、加齢に伴う骨格筋量と機能の顕著な低下を軽減できる可能性があることを示唆しています。 |
| 5. サルコペニアに対する非薬理学的統合アプローチ |
| 加齢に伴う筋肉量と機能の低下であるサルコペニアは、人々の生活と社会全体に重大な悪影響を及ぼし、入院する高齢患者によく見られる症状である[269]。 サルコペニアの複雑な病因を考慮し、高齢者のこの状態を予防し、対抗することを目的とした統合的な戦略が不可欠です。 このレビューでは、高齢者の骨格筋の健康維持に対するライフスタイルと特定のサプリメントの影響に焦点を当て、その特徴を考慮しました。 記載されているアプローチは、サルコペニアを予防および改善するために相乗的に作用します (図 1)。 |
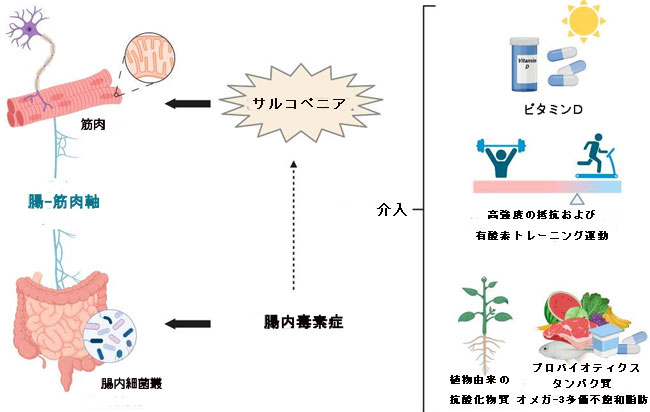 |
| 図 1 加齢に伴う筋骨格の健康を維持するための統合的介入への包括的なアプローチ |
| 高齢者は通常、年齢が上がるにつれて、「加齢による食欲不振」[272]により、栄養とエネルギーの消費量が減少する[270,271]。 さらに、炎症は、急性であろうと慢性であろうと、エネルギー需要を増加させ、「疾患に関連した栄養失調」を引き起こす可能性がある[273]。 実際、高齢者の食事にはタンパク質が少なく、アミノ酸とタンパク質の補給は骨格筋と骨の健康に影響を与えるため、サルコペニアの予防において重要な戦略となり得る[274]。 食事中のタンパク質は微生物叢の調節において基本的な役割を果たしています[132]。 ラットに関する研究では、植物性 (大豆) または動物性 (魚由来) タンパク質を与えると、ユービオシスの状態が良好になることが示されています。 同時に、多くの研究で示されているように、脂肪の多い食品で構成される食事は腸内細菌叢に悪影響を及ぼします[90]。 タンパク質ベースの栄養サポートにより、Bifidobacteria とLactobacilli,が豊富に増加し、腸の健康を維持し、過体重や肥満を予防します。 栄養サポートは腸内細菌叢の組成を効果的に回復します[275]。 低カロリー食を与えたラットでは、 Firmicutes の存在量の減少と、Bacteroidetes とProteobacteriaのレベルの増加が観察されている[276]。 ホエイプロテインダイエットなどのタンパク質栄養サポートは、Firmicutes, Bacteroidetes, およびProteobacteriaの量を調節するため、腸内細菌叢と腸の健康を維持するのに有益です[277]。 健康な腸内細菌叢を維持することを目的とした戦略は、健康的な老化の重要な助けとなります (図 1) [85]。 |
| ビタミンD欠乏はその免疫調節特性により胃腸疾患を引き起こす可能性があるため、ビタミンDと腸内細菌叢との関連性が最近提案されています。 人間と動物の両方に関する最近の研究では、ビタミン D が微生物叢の組成を調節し、腸の恒常性を維持し [278]、腸の透過性を低下させる可能性があることが明らかになりました [279]。 ビタミンDは微生物叢を変化させ、Firmicutesの減少とBacteroidetesの増加を引き起こし、Ruminococcaceae, Akkermansia, Faecalibacterium, および Coprococcusなどの有益な細菌を増加させます[280]。 |
| サルコペニアの管理と予防に不可欠なもう 1 つの要素は運動です (図 1)。 運動は微生物叢も調節し、有益な種を改善し、その多様性を増加させることが示されています。 一方、エネルギーバランスを制御し、炎症、酸化還元、水分補給状態の制御に寄与する腸内細菌叢は、運動への適応に影響を与える可能性がある[281]。 サルコペニアにおけるビタミン D と身体活動との相互作用は、Yang らによって研究された [282]。 著者らは、高齢者の筋力に対するビタミンDの効果は身体活動レベルに依存し、相乗効果を示唆していると報告した。 さまざまな栄養、サプリメント、運動、微生物叢に基づく戦略の効果と、サルコペニアに対するそれらの相乗作用についての詳細な知識があれば、組み合わせた戦略の開発が可能になります。 |
| 6. 結論 |
| 座りっぱなしのライフスタイルと不適切な食生活は、多くの高齢者を悩ませるサルコペニアの重要な危険因子です。 筋肉量を改善するように設計されたトレーニング プログラム、腸内細菌叢と一般的な健康状態を調整することを目的とした適切な栄養、そして最終的にはビタミン D 抗酸化物質、多価不飽和脂肪酸、ビタミン、プロバイオティクス、プレバイオティクス、タンパク質、ケフィア、短鎖脂肪酸の補給を含む統合的なアプローチ 酸はサルコペニアの対策に役立つ可能性があります。 特に、サルコペニアやサルコペニア状態のリスクがある高齢者など、特定の多様な集団を対象とする場合には、個別化された戦略が不可欠であることを強調することが重要です。 高齢者には、適切に設計され、注意深く管理されるトレーニング プログラムと、特定のニーズに合わせて調整されたサプリメントの有無にかかわらず食事が必要です。 |
| 現在、個人の特性に合わせた個別化医療に大きな関心が集まっています。 技術の進歩により可能となった個々の特徴への同程度の注意は、副作用を回避し利益を最大化するために、非薬理学的介入の定義にも払われるべきである。 最適な統合戦略を見つけるには、全身状態、運動性の問題、栄養習慣、ビタミン D 欠乏、微生物叢の集団を考慮した被験者の詳細な特徴付けが必要です。 さらに、最善のフォローアップ治療を確実に行うために、状況の推移を監視する必要があります。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Nutrients. 2023 Apr; 15(8): 1802.に掲載されたAn Integrated Approach to Skeletal Muscle Health in Aging.日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


