ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
腸由来の酪酸は眼表面の炎症を抑制します |
Laura Schaefer et al., |
|
|
| 概要 |
ドライアイは、涙液層の不安定性と涙液産生の低下を特徴とする一般的な眼の炎症性疾患です。 眼表面の恒常性が腸内微生物叢の影響を受けるという証拠が増えています。 私たちは、腸内微生物叢と眼球表面の間の相互作用を媒介する際に、微生物によって生成された小分子の潜在的な役割を調査することに興味があります。 そのような分子の 1 つが、食物繊維の発酵を通じて腸内微生物叢の特定のメンバーによって生成される短鎖脂肪酸 (SCFA) である酪酸です。 ここでは、短鎖脂肪酸トランスポーター( SLC5A8) が in vivo でマウスの結膜および角膜上皮に発現していることを示します。 フェニルブチレート (PBA) による in vitro 角膜上皮培養または骨髄由来樹状細胞 (BMDC) の前処理は、リポ多糖によって誘導される炎症誘発性 Tnf 発現を減少させます。短鎖脂肪酸トランスポーターノックアウト マウスから分離された角膜上皮培養物と 骨髄由来樹状細胞は、フェニルブチレートの前処理に応答できず、短鎖脂肪酸トランスポーターがフェニルブチレートの保護効果に必要であることを示唆しています。 酪酸のプロドラッグ形態である経口トリブチリンによる乾燥ストレス (DS) を受けているマウスの治療は、in vivo で眼表面の炎症を軽減し、この効果には部分的に 短鎖脂肪酸トランスポーターが必要です。 最後に、トリブチリン治療の有無にかかわらず乾燥ストレスを受けたマウスから分離された結膜組織の発現分析は、治療が I 型インターフェロン シグナル伝達に関与する遺伝子をダウンレギュレートすることを明らかにしました。 これらのデータを合わせると、腸で生成された 短鎖脂肪酸が眼球表面の恒常性の維持に関与しているという仮説が支持されます。 |
| 目次(クリックして記事にアクセスできます) |
| 序章 |
| 材料および方法 |
| 動物 |
| デジタル PCR |
| 組織学と免疫染色 |
| 角膜組織外植培養 |
| 骨髄由来樹状細胞 (BMDC) 培養 |
| RNA の分離とリアルタイム定量的 PCR |
| 乾燥ストレスとトリブチリン治療 |
| 角膜バリア機能の測定 |
| 杯細胞密度の測定 |
| 統計分析 |
| ナノストリング分析 |
| 結果 |
| メスの野生型マウスは眼球表面に短鎖脂肪酸トランスポーターを発現します |
| 酪酸は in vitro で角膜上皮および樹状細胞の リポ多糖誘発性炎症を抑制する |
| 短鎖脂肪酸トランスポーターは in vitro での角膜および樹状細胞における酪酸の保護効果に必要です |
| 乾燥ストレスを受けているマウスへのトリブチリン (TB) の投与は、角膜バリアの破壊と結膜杯細胞の損失から保護します。 |
| 経口トリブチリンは、結膜のI型インターフェロンシグナル伝達経路遺伝子を減少させます |
| 討議 |
序章 |
| ドライアイは、目が十分な量の涙を生成しないか、涙液層の安定性が損なわれる慢性的な多因子性疾患です。 主なリスク要因には、加齢、女性の性別、コンタクト レンズの使用、喫煙、低湿度環境などがあります(1)。 ドライアイの不安定で高浸透圧の涙液膜は、自然免疫細胞と獲得免疫細胞が関与する自己永続的な炎症カスケードを引き起こし、目の炎症、充血、目の疲労、視力障害を引き起こします(2,3)。 眼球表面の炎症は、結膜上皮の杯細胞アポトーシス、角膜上皮バリアの破壊、涙腺の炎症と機能不全を引き起こします( 2)。 重症の場合、これは視力を脅かす角膜上皮疾患および潰瘍を引き起こす可能性があります。 |
| 消化管に生息する共生細菌は、腸内および脳、骨、肺、腎臓、眼などのバリア臓器を含む体の末端部位で、健康と恒常性に広範囲に及ぶ影響を及ぼします(4–10)。 腸内微生物叢によって媒介される 1 つの重要な機能は、全身の粘膜バリア組織における免疫恒常性の維持です。 眼球表面は、そのようなバリア組織の 1 つです。 腸管腔バリアと同様に、角膜は環境ストレッサーや微生物病原体などの外部刺激に常にさらされており、健康な通常の条件下では、免疫寛容と免疫の間の平衡を維持しています(2)。 腸内微生物叢は、制御性 T 細胞 (Treg) や寛容原性樹状細胞の産生促進など、免疫細胞の成熟と機能を調節することで炎症反応に影響を与えます(11–13)。 無菌マウスにおける共生細菌の欠如は、未発達のリンパ組織、分泌型抗体 IgA (SIgA) および抗菌ペプチドの産生不足、および異常なサイトカイン産生をもたらします( 14–17)。 実際、腸内共生生物の存在は、涙や眼関連リンパ組織の分泌型抗体 IgAレベルを調節することが示されています。 無菌および抗生物質で処理されたマウスは眼の分泌型抗体 IgAの有意な減少を示し、特定の共生生物で再構成されたマウスは分泌型抗体 IgAの回復を示します 。 健康で正常な腸内細菌叢は、マウスの乾燥ストレスモデルにおいて、炎症性ドライアイ病理の発症に対しても保護的です(20)。 これは、細菌の不在下で飼育された無菌マウスが自然に涙腺角結膜炎を発症するという観察によって裏付けられています。 糞便微生物叢移植は、無菌マウスのドライアイ表現型を逆転させます(21)。 同様に、ドライアイ疾患を自然発生的に発症する CD25 ノックアウトマウスの眼疾患の重症度は、抗生物質治療またはマウスを無菌環境で飼育することによる微生物叢の破壊によって悪化し、その後の糞便微生物叢移植によって改善されます(22)。 |
| 共生細菌が宿主に影響を与えるメカニズムの 1 つは、宿主細胞のシグナル伝達経路と相互作用したり、宿主の遺伝子発現を調節したりできる因子の分泌によるものです。 酪酸、プロピオン酸、酢酸などの短鎖脂肪酸は、食物繊維の発酵から共生微生物叢によって腸内で生成される代謝産物です。短鎖脂肪酸は、結腸を越えて他のシステムに及ぶ抗炎症効果を発揮することが示されています。これには、獲得免疫細胞と自然免疫細胞、骨の恒常性、脳、および眼への影響が含まれます (23–29)。 腸内の短鎖脂肪酸と眼の健康との間の明確な関連性は、ブドウ膜炎のモデルで実証されています( 26,27)。 適応免疫系および先天性免疫系を介して間接的に効果を発揮することに加えて、酪酸は眼組織にも直接作用する可能性があります。 酪酸塩を目に直接塗布すると、NLRP3 インフラマソームの阻害により、アルカリ熱傷の創傷治癒と角膜混濁が改善されることが実証されています (30)。 ただし、乾燥ストレス中の酪酸の影響は完全には調査されていません。 この研究では、腸内微生物叢と眼球表面との間の相互作用を媒介する際の酪酸の潜在的な役割を調べました。 |
| 材料および方法 |
| 動物 |
| メスの野生型マウス (C57BL/6 J 系統) は、Jackson Laboratory (米国メイン州バーハーバー) から 6 ~ 8 週齢で購入しました。 短鎖脂肪酸トランスポーターノックアウト マウスは Vadivel Ganapathy 博士 (テキサス工科大学、テキサス州ラボック) から贈られたもので、もともとは Thomas Boettger 博士 (ドイツ、マックス プランク研究所) によって派生したものでした。 動物研究は、ベイラー医科大学の施設内動物管理使用委員会によって承認され、眼科および視覚研究における動物の使用に関する視覚および眼科学研究協会の声明に準拠しました。 合計 100 匹のメスの野生型マウスと 50 匹のメスの短鎖脂肪酸トランスポーターノックアウト マウスが研究の過程で使用されました。 実験ごとのマウスの数は、以下のセクションと図の凡例に示されています。 屠殺の時点で、マウスは生後 8 ~ 12 週でした。 すべての研究は、ARRIVE ガイドラインに従って報告されています。 |
| デジタルPCR |
| マウスの角膜上皮および結膜組織は、以前に公開された方法に従って野生型マウスから収集されました。 簡単に言えば、メーカーのプロトコルに従って、Qiagen RNeasy Plus Micro RNA分離キット(Qiagen、Germantown、MD、USA)で全RNAを抽出しました。 1 つのサンプルは、各動物の両眼からプールした組織に相当します。 cDNA は、Ready-To-Go First-Strand ビーズ (GE Healthcare Life Sciences、マールボロ、マサチューセッツ州、米国) およびランダム ヘキサマー (Life Technologies、グランド アイランド、ニューヨーク、米国) をテンプレートとして 1 μg の全 RNA とともに合成しました。 DNA濃度は、Qubit分光光度計(Life Technologies)で測定しました。 デジタルポリメラーゼ連鎖反応(PCR)は、短鎖脂肪酸トランスポーターTaqmanアッセイプライマーセットMm00520629_m1(Applied Biosystems、Inc. [ABI]、カリフォルニア州フォスターシティ)を使用してQuantStudio 3DデジタルPCRシステム(Life Technologies)で前述のように実行され、cDNA33の濃度によって正規化されました。 |
| 組織学と免疫染色 |
| 形態を評価するために、目と眼付属器を切除し、パラフィン ワックスに包埋し、8 μm の切片に切断しました。 切片は、ヘマトキシリンとエオシン (H & E) で染色されました。 発現分析のために、目と眼付属器を切除し、Tissue-Tek Optimal Cutting Temperature medium (OCT; Sakura Finetek、Torrance、CA、USA) ブロックに埋め込み、液体窒素で急速冷凍しました。 次に、HM 500 クライオスタット (ウォルドルフ、ドイツ) を使用して 6 μm のセクションにカットします。 少なくとも 3 匹の異なる動物の組織切片を 4% パラホルムアルデヒドで固定し、以前に公開された方法に従って、短鎖脂肪酸トランスポーターに対するウサギ ポリクローナル抗体 (Proteintech #21,433–1-AP、Rosemont、IL、USA) を用いた発色染色でタンパク質発現を可視化しました(34)。 . 別の切片を、一次抗体特異性のネガティブコントロールとしてウサギ IgG (Sigma-Aldrich、セントルイス、ミズーリ州、米国) とインキュベートしました。 抗体は、メーカーの推奨に従って、リン酸緩衝生理食塩水 (PBS) 中の 5% ヤギ血清 (Sigma-Aldrich) で希釈しました。 0.3%過酸化水素で内因性ペルオキシダーゼをクエンチし、PBSで洗浄した後、アビジン/ビオチンブロッキングキット(Vector Laboratories、カリフォルニア州バーリンゲーム)を使用して免疫組織化学用に切片を調製しました。 切片を PBS 中の 20% ヤギ血清で 1 時間ブロックし、続いて希釈した一次抗体で 1 時間インキュベートしました。 デジタルカメラ(DS-Qi1Mc; Nikon Instruments Inc、Melville、NY、USA)を備えたE400顕微鏡を使用して、ヘマトキシリンとエオシン染色切片の場合は60倍の倍率で、免疫染色切片の場合は40倍の倍率で写真を撮影しました。 |
| 角膜組織外植培養 |
| マウスの角膜は、5 μg/ml のディスパーゼ (Sigma-Aldrich) を含む氷上で補充されたホルモン表皮培地 (SHEM) に湾曲した Castroviejo ハサミを使用して外科用顕微鏡下で切除されました。 SHEM メディアが高グルコースを含むダルベッコ変法イーグル培地 (Sigma-Aldrich) と 5 ng/ml EGF を含む Ham's F-12 培地 (Sigma-Aldrich) の 1:1 培地混合物として (Thermo Fisher Scientific, Waltham, MA, USA)、 0.5 mg/ml ヒドロコルチゾン ( Sigma-Aldrich)、30 ng/ml コレラ毒素 A ( Sigma-Aldrich)、0.5% DMSO ( Sigma-Aldrich)、50 mg/ml ゲンタマイシン (Hyclone、GE Healthcare Life Sciences、Marlborough) 、マサチューセッツ州、米国)、1.25 mg/ml アムホテリシン B (Gibco BRL Products、米国ニューヨーク州グランドアイランド)、1X ITS 液体培地サプリメント (Sigma-Aldrich)、および 5% FBS (Hyclone) 準備されました。 角膜を 4 つの等しい部分に切断し、37 °C で 15 分間インキュベートし、無菌ピンセットでディスパーゼなしの SHEM 培地に移しました。 約 10 分後、上皮側を上にして 48 ウェル培養プレートのウェルに小片を移し、数分間接着させた後、200 μl の SHEM 培地で覆い、37℃、5% CO2 でインキュベートしました。 200 μl の新鮮な SHEM 培地を 3 日ごとに追加しました。 13日目に、培地をFBSを含まない300μlのSHEM培地に交換した。 14 日目に、高グルコースを含む 1:1 のダルベッコ改変イーグル培地 (Sigma-Aldrich) および Ham's F-12 培地 (Sigma- アルドリッチ) 0.5 mM の最終濃度。 他のウェルは、PBA を含まない 1:1 培地で処理しました。 2 時間後、ウェルのサブセットを 1:1 培地中の 0.3 μg リポ多糖 (LPS; Sigma-Aldrich) で処理し、プレートを 5% CO2 中 37℃ で 4 時間インキュベートした後、接着細胞を RNA 分離用に回収しました。 野生型および 短鎖脂肪酸トランスポーターノックアウトマウスをそれぞれ2〜4匹使用して、3つの別々の実験を実施しました。 最初のパイロット実験では、有効用量を特定するために、角膜培養物で 0.5 mM、1 mM、および 5 mM PBA をテストしました。 これらの 3 つの濃度で炎症反応を軽減する能力に違いは観察されませんでした。 これに基づいて、その後の in vitro 実験で最低 (0.5 mM) の濃度を使用することを選択しました。 |
| 骨髄由来樹状細胞 (BMDC) 培養 |
| 骨髄細胞は、10% FBS、50 μg/ml ゲンタマイシン、および 1.25 μg/ml アンホテリシン B を含む完全 RPMI 1640 培地 (Gibco BRL) を使用して、メスの 野生型マウスまたは 短鎖脂肪酸トランスポーターノックアウト マウスの大腿骨から細胞を洗い流すことによって得られました。 Sysmex CellTrics セルストレーナー (Sysmex、リンカンシャー、イリノイ州、米国) でろ過しました。 骨髄細胞は、マウス顆粒球-マクロファージコロニー刺激因子 (GM-CSF; 20 ng/ml) および IL-4 (5 ng/ml; PeproTech、Rocky Hill、NJ、USA)。 3日目に、GM-CSFおよびIL-4を含む新鮮な培地を添加した。 6日目に、細胞をプレートから回収し、GM-CSFおよびIL-4を含む完全RPMI 1 ml中、10 6 細胞/ウェルで24ウェルプレートに播種した。 この時点で、ウェルのサブセットに 18 μl の 5 mg/ml PBA を最終濃度 0.5 mM で加えました。 8 日目に、適切なウェルを 1 μg/ml の LPS で 4 時間処理しました。 細胞を回収し、遠心分離し、RNA 分離用のベータ-メルカプトエタノール (Sigma-Aldrich) バッファーを含む Qiagen RLT バッファー (Qiagen、Germantown、MD、USA) に再懸濁しました。 サンプルごとに 2 つのウェルを組み合わせました。 各実験では、野生型および 短鎖脂肪酸トランスポーターノックアウトマウスをそれぞれ 2 ~ 3 匹使用しました。 3つの別々の実験が行われた。 |
| RNA の分離とリアルタイム定量的 PCR |
| 培養角膜上皮細胞と 骨髄由来樹状細胞は、1 ウェルあたり 350 μl を使用してベータ メルカプトエタノール (Sigma-Aldrich) を含む Qiagen RLT バッファーで溶出し、RNA は Qiagen RNeasy Plus (Qiagen、Germantown、MD、USA) を使用して製造元のプロトコルに従って抽出しました。 単離されたRNAの濃度は、Nanodrop 2000分光光度計(Thermo Fisher Scientific)を使用して測定した。 RNA 分離後、Ready-To-Go You-Prime First-Strand ビーズ (GE Healthcare Life Sciences、Marlborough、MA、USA) を使用して cDNA を合成しました。 |
| メスの野生型マウスから採取した結膜組織を、β-メルカプトエタノールを含む Qiagen RLT バッファーに入れ、液体窒素で急速冷凍しました。 RNA を分離するために、組織を外科用ハサミで切り刻んだ後、超音波処理し、Qiagen RNeasy Plus を使用して RNA を抽出しました。 |
| リアルタイム PCR は、メーカーの推奨に従って、Quant Studio 3 リアルタイム PCR システム (ABI) で、特定の TaqMan アッセイ (TNF-α: ABI アッセイ ID Mm00443260_g1; HPRT: アッセイ ID Mm00446968_m1; 短鎖脂肪酸トランスポーター: Mm07300153_m1) と AmpErase UNG を含む TaqMan CR Universal PCR Master Mix を使用して実行されました。 (アプライド バイオシステムズ)。 定量的 PCR の結果は、比較閾値サイクル (CT) 法によって分析され、HPRT の CT によって正規化されました。 リポ多糖のみの治療群における相対的なmRNAレベルは、各実験のキャリブレーターとして使用されました。 データには、3 つの別々の実験の結果が含まれています。 |
| 乾燥ストレスとトリブチリン治療 |
| マウスは、スコポラミン臭化水素酸塩(0.5mg/ 0.2 mL; Sigma-Aldrich、セントルイス、ミズーリ州、米国)。 5 日間連続して DS を投与した後、マウスを安楽死させました。 |
| マウスは、乾燥ストレスにさらされている間、100μlの0.5 mMトリブチリン(W222305、Sigma-Aldrich)またはPBS(Corning、Manassas、VA、USA)の毎日の胃管栄養を受けました。 この用量は、さまざまな濃度のトリブチリン (ストレスのないマウスでは 0.1 mM、0.5 mM、1 mM、および 5 mM、DS マウスでは 0.5 mM および 5 mM) の経口強制経口投与後の角膜バリアへの影響を評価したパイロット研究の後に選択されました。 ストレスを受けていないマウスでは、すべての投与量が未処理のコントロールと有意な差はなく、眼表面への毒性または有害な影響がないことを示しています。 DS マウスでは、低用量が効果的だったので、0.5 mM トリブチリンを使用してその後の実験を行いました (データは示していません)。 |
| 角膜バリア機能の測定 |
| 角膜バリア機能は、以前に公開されたプロトコルにより、70 kDa のオレゴン グリーン デキストラン-488 (OGD; Invitrogen, Carlsbad, CA) に対する角膜上皮透過性を定量化することによって評価されました。 各画像は、2 人の目隠しをした観察者によって定量化されました。 左右の目の平均強度を平均した。 野生型マウスを用いた最初の実験では、実験群あたり 9 ~ 15 (18 ~ 30 眼) のマウスを使用しました。 野生型マウスと短鎖脂肪酸トランスポーターノックアウト マウスの両方を使用したその後の実験では、実験グループごとに 8 ~ 10 匹のマウス (16 ~ 20 眼) を使用しました。 |
| 杯細胞密度の測定 |
| 目と眼付属器を切除し、10% ホルマリンで固定し、パラフィンに包埋し、ミクロトーム (Microm HM 340E、Thermo Fisher Scientific) を使用して 5 μm の切片に切断しました。 切片を過ヨウ素酸シッフ (PAS) 試薬で染色して、ムチン含有杯細胞を視覚化しました。 杯細胞密度は、NIS-Elements ソフトウェアを使用して上結膜および下結膜で測定され、ミリメートルあたりの陽性細胞の数として表されました 。 各グループあたり 5 ~ 9 個の目を調べました。 各画像は、2 人の目隠しをした観察者によって定量化されました。 |
| 統計分析 |
| 統計分析は、GraphPad Prism 9.0 ソフトウェア (GraphPad Software Inc.、米国カリフォルニア州サンディエゴ) を使用して実行されました。 ペアワイズ比較は、有意と見なされるp値 ≤ 0.05のノンパラメトリックMann-Whitney U検定で行われました。 複数の実験変数を使用した実験では、Tukey の多重比較検定を使用して双方向 ANOVA で統計的比較を行いました。 0.05 を超える P 値は有意ではないと見なされました。 |
| ナノストリング分析 |
| NanoString 分析は、3 つの実験条件のいずれかで 5 日間さらされたメスの野生型マウスからの結膜 RNA を使用して実行されました: PBS の毎日の強制経口投与によるストレスなし、PBS の毎日の強制経口投与による DS、またはトリブチリンの毎日の強制経口投与による DS (n = 4 グループあたりのマウス)。 Mouse Inflammation V2 パネル (www.nanostring.com) を使用して、NanoString nCounter 多重化プラットフォームで 254 のターゲット転写産物を定量化しました。 nmRNA 転写産物の数は、6 つの参照遺伝子 (Cltc、Gapdh、Gusb、Hprt、Pgk1、Tubb5) の幾何平均を使用して正規化されました。 データは、ROSALIND® (https://rosalind.onramp.bio/) によって分析され、前述のように ROSALIND, Inc. (カリフォルニア州サンディエゴ) によって開発された HyperScale アーキテクチャが使用されました35。 ヒートマップは、GraphPad Prism 9.0 ソフトウェア (GraphPad Software Inc.、米国カリフォルニア州サンディエゴ) を使用して作成されました。 |
| 結果 |
| メスの野生型マウスは眼球表面に短鎖脂肪酸トランスポーターを発現します |
| もともと腎組織で同定されたモノカルボン酸トランスポーターは、多くの組織で広く発現しており、そのタンパク質が腸内微生物叢によって生成される短鎖脂肪酸と直接接触する先端管腔に面した膜に位置する腸で広く研究されています( 36) 。 定量的デジタル PCR を使用して、マウスの角膜上皮および結膜組織におけるトランスポーター mRNA の発現をテストすることにより、短鎖脂肪酸が眼球表面組織に直接作用できるかどうかを調べました。 短鎖脂肪酸トランスポーター転写産物は、角膜上皮と結膜の両方で検出されました(図1A)。 次に、角膜および結膜上皮におけるトランスポータータンパク質の発現を探しました。 結膜組織を含む眼および眼付属器を含む組織切片をヘマトキシリンとエオシンで染色して、野生型と比較して短鎖脂肪酸トランスポーターノックアウトマウスの角膜および結膜の全体的な形態を評価しました(図1B)。 短鎖脂肪酸トランスポーターノックアウトマウスの角膜上皮の構造と完全性は、野生型マウスのものと一致しました。 短鎖脂肪酸トランスポーターのタンパク質発現を調べるために、別々の組織切片を免疫染色し、短鎖脂肪酸トランスポーターの発色検出を行いました(図1C)。 短鎖脂肪酸トランスポータートランスポーターの強力なタンパク質発現が、角膜上皮表面および杯細胞を取り囲む結膜上皮全体で検出され、角膜上皮での発現が最も高かった。 予想通り、短鎖脂肪酸トランスポータータンパク質を欠くノックアウトマウスの同じ組織では、短鎖脂肪酸トランスポーター免疫反応性は観察されませんでした。 短鎖脂肪酸トランスポーターの存在は、短鎖脂肪酸、特に酪酸が眼のバリア組織と直接相互作用する可能性があることを示唆しています。 |
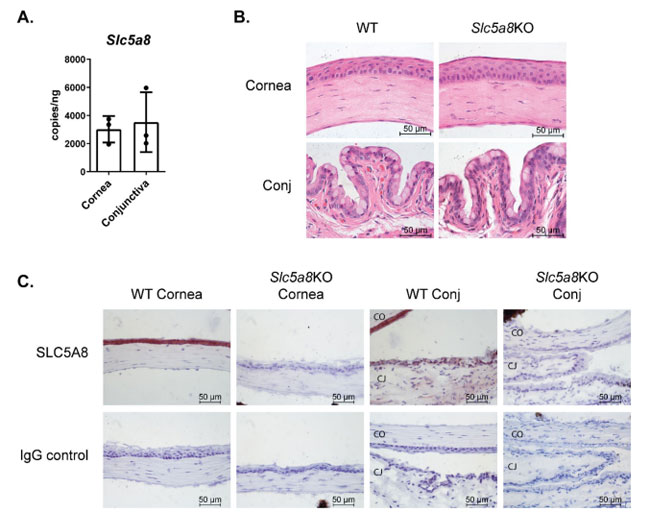 |
| Slc5a8=短鎖脂肪酸トランスポーター、Slc5a8KO=短鎖脂肪酸トランスポーターノックアウトマウス、WT=野生型マウス、Cornea=角膜、Conj=結膜。 |
| 図1 野生型マウス(C57BL/6)は、眼球表面で 短鎖脂肪酸トランスポーターの mRNA とタンパク質を発現します。 |
(A) 定量的デジタル PCR は、野生型マウス角膜上皮および結膜組織から調製された cDNA の増幅に使用されました。 各データポイントは、1 匹の動物の組織を表します。 検出された転写物の数は、DNAの濃度に対して正規化されました。 (C) 野生型 マウス(WT) C57BL/6 および 短鎖脂肪酸トランスポーターノックアウト マウスの角膜および結膜 (Conj) 切片を、発色検出 (赤褐色) を使用して抗マウス 短鎖脂肪酸トランスポーター 抗体で免疫染色しました。 核はヘマトキシリン (紫) で染色されました。 抗ウサギIgGで染色されたスライドは、陰性対照として示されています。 代表的な画像が表示されます。 |
| 註釈:Slc5a8=短鎖脂肪酸トランスポーター、Slc5a8KO=短鎖脂肪酸トランスポーターノックアウト、WT=野生型マウス、Cornea=角膜、Conj=結膜 |
| 酪酸は in vitro で角膜上皮および樹状細胞の リポ多糖誘発性炎症を抑制する |
| 酪酸は、結腸上皮細胞の炎症性刺激に対抗することが実証されています( 37–41)。 酪酸が角膜上皮の眼球表面の炎症を同様に鈍らせる可能性を調査しました。 リポ多糖は、マウス角膜に局所的に適用すると in vivo で、角膜および結膜上皮培養に添加すると in vitro で眼表面で炎症誘発性サイトカインの発現を誘導することが以前に示されています( 4,34)。 マウスの角膜外植片を in vitro で培養し、リポ多糖に曝露する前にフェニル酪酸 (PBA) でプレインキュベートしました。 フェニル酪酸は、酪酸の化学的誘導体である芳香族短鎖脂肪酸であり、酪酸と同様にヒストン脱アセチル化酵素 (HDAC )活性もあります。 フェニル酪酸は、ヒトでの使用が FDA に承認されているため、眼表面の炎症の治療の可能性のある魅力的な候補です。 予想通り、炎症性サイトカイン Tnf の誘導は、リポ多糖への曝露後の角膜上皮培養で観察されました。 フェニル酪酸による培養物の前処理は、Tnf mRNA発現の誘導を有意に減少させた(図2A)。 0.5 mM、1 mM、または 5 mM フェニル酪酸のいずれかで前処理した角膜細胞間で炎症反応の減少に統計的な差は見られませんでした (データは示していません)。 リポ多糖刺激を伴わないフェニル酪酸での培養の処理は、Tnf発現を未処理対照培養のものから変化させなかった。 |
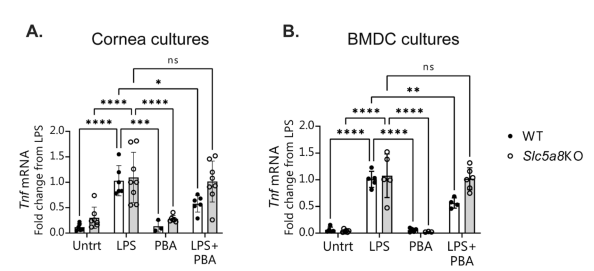
|
Cornea culture=角膜上皮細胞、BMDC=骨髄樹状細胞、Untrt=未処理、LPS=リポ多糖、PBA=フェニル酪酸、WT=野生型マウス、Slc5a8KO=短鎖脂肪酸トランスポーターノックアウトマウス、 |
| 図 2 角膜上皮細胞および骨髄由来樹状細胞のフェニル酪酸 (PBA) 処理は、in vitroで リポ多糖誘発性炎症を阻害し、この効果には酪酸トランスポーターが必要です。 |
| (A) 角膜上皮細胞および (B) 骨髄樹状細胞 (BMDC) は、野生型 (WT) および短鎖脂肪酸トランスポーター ノックアウトマウスから培養され、フェニル酪酸 (PBA) またはメディアコントロールで 1 時間前処理されました。 その後、未処理(Untrt)のままにするか、リポ多糖でチャレンジしました。 各データ ポイントは 1 つの組織外植片を含むウェルであり、各条件は各実験内で 2 重または 3 重のウェルでした。 示されているのは、各データセットが リポ多糖のみの処理条件に正規化された後の実験からの結合された qPCR データです。 3回の独立した実験の平均 ± 標準偏差。 各実験では、条件ごとに2〜3個のウェルを使用しました。 統計的比較は、Tukey の多重比較検定を使用して双方向 分散分析(ANOVA) で行われました。 0.05 を超える P 値は有意ではないと見なされました (ns)。 *P ≤ 0.5、**P ≤ 0.01、***P ≤ 0.001、****P ≤ 0.0001。 |
註釈:Cornea culture=角膜上皮細胞、BMDC culture=骨髄樹状細胞、Untrt=未処理、LPS=リポ多糖、PBA=フェニル酪酸 |
| 活性化された樹状細胞は、眼表面の炎症反応においても重要な役割を果たします( 2)。 リポ多糖にさらされた骨髄由来樹状細胞 (BMDCs) の炎症反応に対する酪酸治療の効果を調べた。 角膜上皮細胞と同様に、骨髄由来樹状細胞は 0.5 mM フェニル酪酸 による前処理に応答し、リポ多糖曝露後に Tnf の発現が 2 倍減少しました (図 2B)。 |
| 短鎖脂肪酸トランスポーターは in vitro での角膜および樹状細胞における酪酸の保護効果に必要です |
| 短鎖脂肪酸トランスポーター は、結腸における酪酸の抗炎症効果と、酪酸にさらされた樹状細胞によって媒介される腸粘膜の免疫寛容に重要です( 40,42)。 角膜上皮および骨髄由来樹状細胞におけるフェニル酪酸の保護効果に短鎖脂肪酸トランスポーターが必要かどうかを調査しました。 短鎖脂肪酸トランスポーターノックアウトマウスの角膜外植片と 骨髄由来樹状細胞を培養し、フェニル酪酸の存在下または非存在下で リポ多糖に曝露しました。 両方の細胞タイプにおいて、短鎖脂肪酸トランスポーターの非存在下では、フェニル酪酸前処理は Tnf mRNA発現を減少させることができませんでした(図2AおよびB)。 これは、酪酸が炎症性刺激に対する保護効果を発揮するためにトランスポーターが必要であることを示唆しています。 |
| 乾燥ストレスを受けているマウスへのトリブチリン (TB) の投与は、角膜バリアの破壊と結膜杯細胞の損失から保護します |
| トリブチリンを使用した腸からの投与により、酪酸が in vivo で眼表面に抗炎症効果を発揮できるかどうかを調査しました。 トリブチリンは、バターに自然に含まれる酪酸の安定で急速に吸収されるプロドラッグ形態です。 経口摂取すると、トリブチリンは膵臓および胃のリパーゼによってグリセロールと 3 つの酪酸分子に加水分解されます (43,44)。 トリブチリンは、食品医薬品局 (FDA: 21CFR184.1903) から「一般に安全と認められた」(GRAS) 分類を受けており、多くの業界で食品添加物として使用されています。 そのため、眼表面の炎症の治療の潜在的な候補です。 ドライアイの乾燥ストレス (DS) モデルでは、マウスは低湿度環境とコリン作動性遮断にさらされ、その結果、角膜バリア機能が損なわれ、結膜の杯細胞数が減少し、自然炎症経路がアップレギュレーションされます(45–47)。 ドライアイは女性でより頻繁に発生し (48,49)、オスのマウスは角膜バリアの破壊 (ドライアイの特徴) に耐性があるため( 21,50)、メスのマウスのみが使用されました。 メスの 野生マウスを、トリブチリンまたはビヒクルのいずれかを毎日強制経口投与しながら、5 日間乾燥ストレスにさらしました。 乾燥ストレスの 5 日後、マウスを犠牲にし、角膜バリアの破壊と杯細胞の損失を評価しました。 角膜透過性は、角膜表面に塗布されたオレゴングリーンデキストラン色素(OGD)を使用して調べられました。 乾燥ストレス中に 0.5 mM トリブチリンを強制経口投与されたマウスの角膜は、ビヒクル コントロールを強制経口投与されたマウスの角膜と比較して、オレゴングリーンデキストラン色素に対する透過性が有意に低かった。 これは、角膜のデジタル画像上に配置された 2 mm の円内の平均蛍光強度を測定することによって定量化されました (図 3A および B)。 |
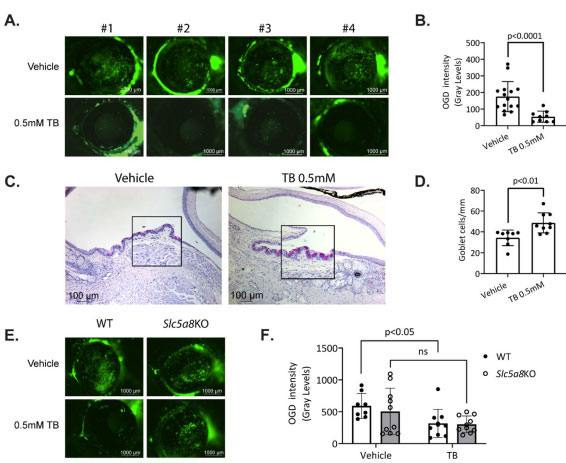 |
| WT=野生型マウス、Slc5a8KO=短鎖脂肪酸トランスポーターノックアウトマウス、TB=トリブチリン |
| 図 3 乾燥ストレスを受けているマウスへのトリブチリン (TB) の投与は、角膜バリアの破壊と結膜杯細胞の損失から保護します |
(A) 各治療群からの 4 匹の異なる動物のオレゴン グリーン デキストラン (OGD) に対する角膜透過性の代表的な画像。 (B) オレゴン グリーン デキストラン に対する角膜上皮透過性は、平均蛍光強度を測定することによって定量化されました。 各データ ポイントは、1 匹の動物の両眼からの平均値を表します (n = 8–15 動物)。 (C) トリブチリンおよびビヒクル コントロール処理 (PBS) マウスからの過ヨウ素酸シッフ( PAS )染色杯細胞 (紫-マゼンタ) を含む結膜凍結切片の代表的な画像。 四角で区切られた領域は、その下の領域の高倍率です。 (D) mm あたりの結膜杯細胞数の累積データ、n = 8–9。 (E) 各治療群の動物のオレゴン グリーン デキストラン (OGD) に対する角膜透過性の代表的な画像 .。 (F) 野生型 (WT) および 短鎖脂肪酸トランスポーターノックアウト (KO) マウスの オレゴン グリーン デキストラン(OGD )に対する角膜上皮透過性。 統計的比較は、Tukey の多重比較検定を使用した双方向分散分析( ANOVA )を使用して行われました。 0.05 を超える P 値は有意ではないと見なされました (ns)。 |
| マウスの眼における乾燥ストレスの別の結果は、結膜上皮内の杯細胞の喪失であり、これは通常、涙液膜の内層を形成するムチンを分泌します。 ストレスを5日間乾燥させた後、トリブチリンで経口投与されたマウスは、ビヒクルで処理されたマウスと比較して、結膜内の杯細胞の密度が高くなり、杯細胞のサイズはより大きく、より規則的に見えました(図3CおよびD)。 これは、腸で代謝された酪酸が生体内で眼球表面に保護効果を発揮できることを示唆しています。 |
| 次に、乾燥ストレス環境で野生型マウスと同時にトリブチリンを短鎖脂肪酸トランスポーターノックアウトマウスに投与することにより、 in vivo での酪酸の保護効果に短鎖脂肪酸トランスポーターが必要かどうかを調査しました。 野生型コホートとは異なり、トリブチリンを投与された短鎖脂肪酸トランスポーターノックアウト マウスは、ビヒクル コントロールを投与されたマウスと比較して、角膜バリアの完全性において統計的に有意な改善を示さず (図 3E および F)、in vitro の結果を裏付けています。 ただし、統計的に有意ではありませんが、トリブチリンで処理されたノックアウト マウスの オレゴン グリーン デキストラン強度の平均はビヒクルで処理されたマウスよりも低く、in vivo で酪酸が短鎖脂肪酸トランスポーターを介して部分的にのみ保護効果を発揮する可能性があることを示しています。 |
| 腸上皮細胞では、短鎖脂肪酸トランスポーター 遺伝子の発現は、プロバイオティクスの Lactobacillus plantarum によってアップレギュレートされ、炎症や結腸癌の間にダウンレギュレートされることが示されています( 36)。 無菌マウスでは、腸内での短鎖脂肪酸トランスポーター発現レベルが有意に低く、これは細菌の再定着によって回復し、共生細菌が発現を刺激することを示唆しています (52)。 乾燥ストレス中またはトリブチリン治療後に角膜上皮で短鎖脂肪酸トランスポーターの発現が変化するかどうかを判断するために、マウスから分離した角膜上皮でqPCRを実行しました。 乾燥ストレス に応答して、または 乾燥ストレス条件下でのトリブチリン処理に応答して、有意差は観察されませんでした (データは示していません)。 |
| 経口トリブチリンは、結膜のI型インターフェロンシグナル伝達経路遺伝子を減少させます |
| 眼表面に対する酪酸の保護効果のメカニズムについての洞察を得るために、トリブチリン治療の有無にかかわらずDSを受けたマウスから分離された結膜組織でNanoStringを使用して遺伝子発現分析を実行しました(グループあたりn = 4マウス)。 NanoString Inflammatory パネルでは、炎症反応および関連する経路に関与する 248 の遺伝子を調べることができます (www.nanostring.com)。 8 つの遺伝子が大幅に変化し、そのすべてがトリブチリン処理によって下方制御されました (Ifi44、Ifit1、Ifit3、Stat2、Oas2、Oas1a、Stat1、Stat2; log2 倍数変化 > 1.2、p-adj < 0.05、図 4)。 これらの遺伝子はすべて I 型インターフェロン (IFN) シグナル伝達に関与しています( 53,54)。 I 型I 型インターフェロンには、細胞内抗菌応答の活性化、自然免疫応答および適応免疫応答の調節など、いくつかの機能があります(53)。 酪酸は、他の研究で I 型インターフェロン シグナル伝達に関与する遺伝子を調節することが示されています (55,56)。 |
| 図4 経口トリブチリン治療 (Tb) が結膜における I 型インターフェロン (IFN) シグナル伝達遺伝子の発現を減少させることを示すヒートマップ |
| NanoString Mouse Inflammation パネル v2 を使用した発現解析は、ビヒクル (Veh) またはトリブチリン処理による 乾燥ストレスを受けたマウスの結膜組織で実施されました。 有意に変化したと特定されたすべての遺伝子について、log2 > 1.2 および p adj. < 0.05。 |
| 討議 |
| 腸内微生物叢は、宿主の栄養、生理学、代謝、病原体耐性など、宿主の健康において多くの重要な役割を果たしています。 共生腸内細菌の重要な機能の 1 つは、炎症反応を調節する能力です。 いくつかの研究は、健康な腸内微生物叢が眼の恒常性と耐病性を促進することを示しています。 無菌マウスは、正常な眼球表面免疫応答の欠乏により、眼のPseudomonas aeruginosa(緑膿菌)感染の影響を受けやすく、これは腸に細菌を再定着させることで元に戻すことができます(19)。 私たちのグループは、無傷の健康な微生物叢の存在が、いくつかの異なるドライアイ疾患モデルで乾性角結膜炎から保護することを示しました. 逆に、共生腸からの交差反応性抗原は、自己反応性網膜特異的 T 細胞をプライミングし、マウスの自己免疫ブドウ膜炎モデルで疾患を誘発することが示されています( 5)。 私たちの研究は、眼の炎症と、目と腸内微生物叢との関係に関する知識の蓄積に加わります。 |
| この研究では、短鎖脂肪酸トランスポーターが結膜および角膜上皮の眼球表面でmRNAレベルとタンパク質レベルの両方で発現していることを示しています。 これは、循環酪酸が眼球表面と直接相互作用する可能性があることを示唆しています。 腸と眼表面の間の相互作用の背後にある正確なメカニズムはまだ明らかではありません。 細菌が産生する低分子代謝産物である酪酸は、腸と体の他の場所の両方で炎症反応を調節することが示されているため、潜在的なメディエーターの 1 つです (12,23–29)。 短鎖脂肪酸の酢酸、プロピオン酸、および酪酸は、大腸での非消化性食物繊維の発酵を通じて細菌によって生成され、結腸上皮はシグナル伝達カスケードの一部としてこれらの分子に結合するか、細胞膜を横切ってそれらを輸送するいくつかのタンパク質を発現します。 腸内の酪酸は血流に入ることが示されています。 血清中の酪酸レベルの上昇は、酪酸とトリブチリンの経口投与後に測定できます(43,44,57-59)。 腸に由来する酪酸は、血管系を介して眼球表面に輸送され、眼球表面の細胞と直接相互作用する可能性があると仮定しています。 |
| トリブチリン治療は、乾燥ストレス条件下で発生する角膜バリアの完全性と杯細胞の損失を回復するのに役立つことを示しています。 腸内で短鎖脂肪酸を生成する共生生物を含む微生物を欠いている無菌マウスは、腸だけでなく眼でも杯細胞密度が低いことが以前に観察されています 。 腸上皮において、酪酸は、ムチンの杯細胞発現および杯細胞分化を調節することにより、腸バリアの維持を助けることが知られている (62,63)。 腸内で産生される酪酸も、結膜杯細胞の分化または維持に直接影響を与える可能性があります。 |
| 酪酸は、腸を含む上皮バリア表面で発現する FFAR2 や HCAR2 などの短鎖脂肪酸に結合する G タンパク質共役受容体のサブセットのリガンドとしても機能します。 結腸上皮および免疫細胞におけるこれらの受容体の機能については、多数の研究があります(28,64,65)。 眼では、ヒドロキシ酪酸が網膜上皮の炎症誘発性マーカーの発現を阻害する能力には、HCAR2 シグナル伝達が不可欠です( 66)。 トリブチリンを与えられた短鎖脂肪酸トランスポーターノックアウト マウスでの in vivo での結果は、短鎖脂肪酸トランスポーターが角膜バリア機能に対するトリブチリンの保護効果に部分的にしか必要とされない可能性があることを示しています。 将来の研究では、HCAR2 および FFAR2 を介した酪酸シグナル伝達の潜在的な役割に対処することが重要になります。 |
| また、フェニル酪酸の直接適用が角膜上皮細胞の炎症反応を軽減できることも示しています。フェニル酪酸で前処理された角膜培養物は、リポ多糖にさらされた場合に低レベルの炎症性サイトカインを発現し、酪酸が眼表面の炎症を直接軽減できるという仮説を支持しています。 興味深いことに、短鎖脂肪酸トランスポーター が存在しないとフェニル酪酸の効果が失われ、酪酸が細胞内に輸送されることが示唆されます。 酪酸は、ヒストン脱アセチル化酵素 (HDAC) を阻害することにより、細胞内の遺伝子発現を直接調節することができます (12,67–6)9。 酪酸が ヒストン脱アセチル化酵素阻害によって角膜上皮細胞の炎症マーカーの発現を調節する可能性があります。 これを支持して、角膜上皮細胞株を用いた in vitro 研究では、toll-like receptor 3 の活性化が、E-カドヘリンの転写を抑制する ヒストン脱アセチル化酵素1 を増加させることによってバリア破壊を引き起こすことが示されました。 このバリアの破壊は、butyrate70 でブロックできます。 特に、酢酸ではなくプロピオン酸にもヒストン脱アセチル化酵素阻害特性があり、短鎖脂肪酸トランスポーター71によって細胞に輸送される可能性があるため、短鎖脂肪酸のプロピオン酸と酢酸をモデルを使用した将来の研究でテストすることは非常に興味深いでしょう。 今後の研究では、角膜上皮の炎症反応の抑制における酪酸のヒストン脱アセチル化酵素阻害活性の潜在的な役割を調査します。 |
| 私たちの結果は、上皮細胞と抗原提示細胞の両方が、炎症性 Tnf mRNA を減少させることによって酪酸に応答したことを示しています。 角膜上皮と骨髄由来樹状細胞の両方が炎症性サイトカインを分泌することによりリポ多糖に応答することを以前に示しました 。 私たちの研究は、別の細菌の副産物が眼球表面と抗原提示細胞 (APC) に対して抗炎症効果を有することを示す文献に追加されます。 この効果が同時に起こるのか、それとも上皮細胞への効果が抗原提示細胞 への効果に続くのかは、現時点では不明です。 この問題を分析するには、さらなるテストが必要です。 |
| 私たちと他の研究者は、制御性T細胞が眼球表面を保護していること、および乾燥ストレスと加齢に伴う眼球表面疾患が機能不全の制御性 T 細胞を誘発することを以前に示しました (72,73)。 腸で生成される酪酸は、末梢の抗炎症性 Treg のレベルを増加させることにより、遠位部位で間接的に炎症に影響を与えることも示されています (11,23,24,27)。 Treg 細胞分極条件で培養したナイーブ CD4+ T 細胞に酪酸を添加すると、Foxp3 プロモーターでのヒストンアセチル化が増加し、酪酸のヒストン脱アセチル化酵素阻害活性が Foxp3 発現の増加、したがって Treg 分化のメカニズムとして関係している 11。 実際、酪酸で処理した脾臓由来の樹状細胞は、ナイーブ T 細胞の FoxP3+ Treg 細胞への分化を誘導し、炎症誘発性インターフェロン-γ + T 細胞への分化を抑制し、短鎖脂肪酸トランスポーターが必要であることが示されています 42。 実験的自己免疫ブドウ膜炎 (EAU) マウスモデルにおける酪酸ナトリウム (NaB) の経口投与は、Th17 細胞に対する抗炎症性 Treg 細胞の比率を増加させ、疾患の減少をもたらしました(27)。 興味深いことに、実験的自己免疫ブドウ膜炎モデルを使用した別の研究では、ヒストン脱アセチル化酵素阻害活性を持つ別の短鎖脂肪酸であるプロピオン酸も Treg を誘導し、T エフェクター細胞の誘導を抑制して、疾患を軽減できることが示されました (26)。 酪酸による炎症誘発性T細胞に対するTreg分化の促進は、眼表面での酪酸の保護効果にも役割を果たす可能性があります。 これらすべての以前の調査結果に基づいて、トリブチリンで処理されたマウスは眼表面で FoxP3 + Treg の数が増加していると予測し、フォローアップ研究でこれをさらに調査します。 |
| 最後に、乾燥ストレスにさらされたマウスの結膜では、I型インターフェロンシグナル伝達に関与する遺伝子のアップレギュレーションがあり、トリブチリン治療によりこれらの遺伝子の発現が減少することを示しています。 この結果は、ドライアイを伴うシェーグレン症候群 (SS) 患者と健康な対照被験者のヒト結膜細胞における遺伝子発現を比較した、以前に公開された NanoString の結果と一致しています。 シェーグレン症候群は、目と口の分泌機能障害を特徴とする自己免疫性炎症性疾患です。 目では、これにより涙液層が不安定になり、涙の生成が減少し、角膜バリアが破壊されます。 I型インターフェロン遺伝子の発現増加は、シェーグレン症候群を含む自己免疫疾患で示されており、I型インターフェロン は、ヒトシェーグレン症候群および シェーグレン症候群のマウスモデルの涙腺および唾液腺の病理学に関与しています(74-76)。 さらに、乾燥ストレスを受けているマウスから分離された涙は、インターフェロン-α77を上昇させました。 文献には、酪酸を含む微生物産物が I 型インターフェロンシグナル伝達を調節できるという証拠があります 55,56。 酪酸は、おそらく I 型 インターフェロン遺伝子発現を調節する ヒストン脱アセチル化酵素阻害活性を介して、炎症性 I 型インターフェロンシグナル伝達をダウンレギュレートするために眼表面に直接作用している可能性があります。 |
| 私たちのデータは、腸に由来する酪酸が眼表面の炎症反応を調節できることを示しています。 我々は、我々の発見と文献の他のデータに基づいて、免疫細胞の調節を介した間接的なメカニズムと、酪酸が眼の表面と直接相互作用する直接的なメカニズムという、眼表面に対する酪酸の作用の2つの可能なメカニズムを提案します(図5)。 説明したように、両方のシナリオについて文献でかなりの支持があります。 この研究では、眼球表面での短鎖脂肪酸受容体と 短鎖脂肪酸トランスポーターの発現は、循環酪酸が眼球表面上皮と直接相互作用できることを示唆しています。 これを支持して、酪酸は in vitro で角膜外植片の炎症誘発性遺伝子発現を抑制し、この効果には 短鎖脂肪酸トランスポーターが必要でした。 最後に、胃内に送達された酪酸塩は、ドライアイ疾患マウスモデルで眼表面疾患を改善します。 これらの調査結果は、腸内微生物叢と目の健康との関連性に関する知識の蓄積に貢献しています。 |
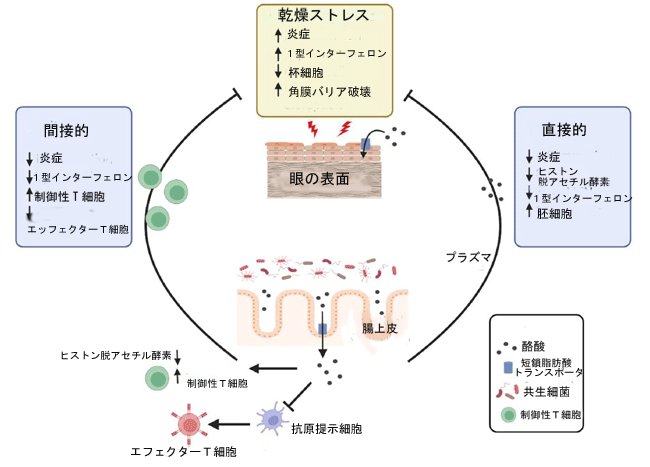 |
| 図 5 眼表面に対する酪酸の保護効果のメカニズムの提案 |
| 酪酸は、免疫細胞の調節による間接的な方法と、短鎖脂肪酸トランスポーターまたは他の短鎖脂肪酸受容体を発現する眼表面上皮との相互作用による直接的な方法と、そのヒストン脱アセチル化酵素阻害活性による遺伝子発現の調節による2つの異なる方法で眼表面に影響を与える可能性があります。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Sci Rep. 2022; 12: 4512.に掲載されたGut-derived butyrate suppresses ocular surface inflammation. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


