| 文献調査(発酵乳、腸内細菌の科学:研究の最前線)
|
神経炎症とシナプス機能不全における微生物叢:
アルツハイマー病に焦点を当てて |
Diane Bairamian et al.,
Mol Neurodegener. 2022; 17: 19..
|
|
| 概要 |
バックグラウンド |
| 健康と病気における脳機能の制御における腸内微生物叢の影響は、現在新たに浮上している新しい概念です。蓄積されたデータは、腸内微生物叢が神経炎症を調節することによって少なくとも部分的にその作用を発揮することを示唆しています。神経炎症の変化と神経細胞の活動との関連性を考えると、神経炎症の重要な役割を果たしているミクログリアに影響を与えることにより、腸内微生物叢が間接的に神経機能に影響を与える可能性があると考えられます。実際、ミクログリアとシナプス機能不全の間の相互作用には、他の要因の中でも微生物叢が関与している可能性があることを示唆する証拠が増えています。ニューロン活動に対する微生物叢のこれらの間接的なミクログリア依存性の作用に加えて、微生物叢は迷走神経の刺激によってニューロン活動にも直接影響を与える可能性があることが最近認識されています。 |
| 主なメッセージ |
| 神経活動に対する微生物叢の間接的および直接的な影響の推定メカニズムは、最も研究されている神経変性疾患の 1 つであり、世界中で認知症の主な原因であるアルツハイマー病に焦点を当てて議論されています。より具体的には、微生物叢を介したミクログリアの変化のメカニズムが、末梢および中枢の炎症クロストークの文脈で議論されています。次に、末梢免疫の液性メディエーターの調節における微生物叢の役割と、それらが迷走神経刺激に与える影響を強調します。最後に、微生物叢の摂動がシナプスの神経伝達と下流の認知機能障害に影響を与える可能性があるかどうか、またどのように影響するかについて説明します。 |
| 結論 |
| 認知機能低下の一因となるシナプス機能障害や神経炎症への影響など、アルツハイマー病の病因における腸内微生物叢の役割を支持する強力な証拠が増えています。微生物叢の調節に基づく推定上の早期介入戦略は、アルツハイマー病の治療に有望であるように見えますが、さらに調査する必要があります。 |
| |
| 目次(クリックして記事にアクセスできます) |
| 1.バックグラウンド |
| 2.微生物叢の免疫調節作用 |
| 2.1.微生物叢が末梢の炎症/免疫に与える影響 |
| 2.2.神経炎症に対する微生物叢の影響 |
| 2.2.1.末梢および中枢の免疫クロストークによる間接的な作用 |
| 2.2.2.迷走神経を介した直接作用 |
| 3.アルツハイマー病における認知機能障害と微生物叢 |
| 3.1.アルツハイマー病:神経炎症の役割 |
| 3.2.シナプス興奮性と可塑性のアルツハイマー病関連障害: LTP に注目し、神経炎症との関連 |
| 4.アルツハイマー病と腸内毒素症(dysbiosis):神経炎症とミクログリアの関与との関連 |
| 4.1ヒトおよびげっ歯類モデルにおけるアルツハイマー病 および加齢に伴う腸内毒素症の比較 |
| 4.2.腸と脳のバリアの微生物叢関連透過処理の役割 |
| 4.3.介入的アプローチと腸内毒素症/神経炎症/アルツハイマー病 の相互作用 |
| 5.微生物叢を介した免疫調節による神経活動の改善を目的とした推定介入 |
| 5.1.末梢免疫調節によるアルツハイマー病関連神経機能の回復 |
| 5.2微生物叢を標的とすることでアルツハイマー病関連の神経機能障害を回復させる? |
| 5.2.1.プロバイオティクスとプレバイオティクスのアプローチ |
| 5.2.2. 糞便微生物叢移植(FMT)アプローチ |
| 6.結論と今後の方向性 |
|
本文 |
|
| 1.バックグラウンド |
| アルツハイマー病、パーキンソン病、ハンチントン病などの神経変性疾患は加齢に伴う神経変性疾患であり、病因が始まってから数年後に臨床的に診断されます [1]。 神経炎症として知られる脳内の慢性炎症反応の発生は、これらの疾患における一般的な初期の病理学的変化です [2]。 驚くべきことに、シナプス機能障害は、発症前の段階を含め、これらの病状の初期にも発生します [3]。 しかし、神経炎症とシナプス機能障害の間の関連性は、これらの病理の発症前段階で認知症状がまだ軽度または検出できない場合に認知障害の代用として使用されますが、よく理解されていません。 |
| 腸内微生物叢は、最近、中枢神経系 (CNS) の恒常性と機能不全の重要な要因として浮上しています [4、5]。腸内微生物叢の変化は、胃腸障害との十分に確立された関連性に加えて、腸と血液-脳関門 (BBB) の両方の透過性を高める可能性があります。 これらの変化した透過性は、腸内微生物叢由来の分子 (リポ多糖類など) および代謝産物 (短鎖脂肪酸など) の脳内蓄積の促進に寄与し、続いて恒常性の炎症誘発性状態への変化をもたらす可能性があります。 したがって、パーキンソン病 (PD)、アルツハイマー病 (AD)、多発性硬化症 (MS)、筋萎縮性側索硬化症 (ALS) などの神経変性疾患の病因の枠組みを設定します [6]。 微生物叢によって引き起こされる追加の病理学的変化は、それらの代謝産物の循環レベルの増加、および末梢免疫の体液性(炎症誘発性サイトカインなど)または細胞性(単球など)のエフェクターの増加に依存している可能性があります。 この線に沿って、微生物叢は制御性 T 細胞 (Treg) の誘導 [7] と、機能的に脳常駐マクロファージに対応するミクログリアの機能 [8] を調節します。 全体として、末梢免疫系と中枢性神経炎症反応の間のこのクロストークは、一部の神経変性疾患における神経病因の一部である可能性があります [9–11]。 |
| この最近の知識に基づいて、ここ数年の間に新しい概念が出現し、微生物叢が末梢免疫応答、神経炎症、および神経変性の間の相互作用において重要な役割を果たす可能性があることを示唆しています。ただし、正確な基礎となるメカニズムはまだ明らかにされていません。このレビューでは、最初に、広範な生理学的文脈と病理学的文脈における神経活動、免疫系メディエーター、および微生物叢の間の相互作用を示すデータを提示します。微生物叢の新たな役割は、アルツハイマー病の特定のコンテキストで議論されます。次に、複数の分野 (神経科学、免疫学、微生物学) にわたる包括的な学際的な概要を提供し、さまざまな分野の幅広い読者層の読書を促進し、神経炎症のコンテキストにおけるシナプス機能に対する微生物叢の影響に関する入手可能なデータについてさらに議論します。最後の部分では、間接的(微生物叢を標的とすることによる炎症性緊張の末梢調節を介して)または直接的(迷走神経刺激を介して)のいずれかで、アルツハイマー病 関連の神経機能障害を改善するための微生物叢調節に基づく可能な戦略について説明します。最後に、アルツハイマー病の早期介入のための微生物叢調節の推定治療価値と、他の神経変性疾患への翻訳の展望について説明します。 |
| |
| 2.微生物叢の免疫調節作用 |
| 腸内微生物叢とは、脊椎動物および昆虫などの少なくとも一部の非脊椎動物の腸にコロニーを形成する細菌、古細菌、ウイルス、原生生物、および真菌 [6] を含む微生物を指します。腸内微生物叢の多様性と豊富さは宿主固有であり、遺伝的、栄養的、環境的な手がかりを含む多くの要因によって決定されます。末梢および中枢の両方の免疫応答を調節する微生物叢の能力は、ますます認識されています。新しい視点によると、神経炎症への直接的な影響に加えて、腸内微生物叢は末梢免疫の調節によっても脳の免疫恒常性に影響を与える可能性があります。このセクションでは、最初に末梢免疫応答に対する微生物叢の影響について説明し、次にそのような微生物叢を介した末梢免疫調節と神経炎症との関係を評価します。最後に、脳常駐免疫応答に対する微生物叢の直接的な影響に関する最近の証拠も提示します。 |
| |
|
| 2.1.微生物叢が末梢の炎症/免疫に与える影響 |
| 炎症は、PAMP/MAMP (病原体関連分子パターン/微生物関連分子パターン) として知られる病原性微生物分子によって、または、DAMP (損傷関連分子パターン) などの宿主細胞 (腫瘍細胞、死んだ細胞または瀕死の細胞など) によって放出される内因性分子によって引き起こされます。 これらのステレオタイプの分子パターンは、宿主の PRR (パターン認識受容体) を介して、組織に常駐する免疫細胞 (マクロファージやマスト細胞など) によって認識されます。 これは自然免疫応答を誘発し、サイトカインとケモカインの産生を増加させ、補体活性化も含まれる可能性があります [12]。 常駐マクロファージおよび樹状細胞は、抗原提示細胞 (APC) として機能します。 活性化されると、これらの抗原提示細胞は組織流出リンパ節に移動し、そこで主要組織適合遺伝子複合体 (MHC) の分子を介して外来抗原を局所免疫細胞に提示し、適応免疫応答を引き起こします。 未解決の炎症反応は、組織に浸潤する細胞適応免疫のエフェクター、すなわちTリンパ球を含む循環白血球の動員をもたらします[12]。 |
| 腸内微生物叢は、自然免疫エフェクターおよび適応免疫エフェクターによって発現される パターン認識受容体の活性化を通じて宿主免疫系と常に相互作用することにより、ヒトで複数の役割を果たします。 たとえば、グラム陰性菌の壁に由来するリポ多糖 (LPS) 誘導体は、TLR4 (Toll様受容体-4) [13] と相互作用します。これは、自然免疫細胞および適応免疫細胞だけでなく、腸上皮細胞によっても発現されるパターン認識受容体です。 腸内細菌叢の組成と機能の変化(dysbiosis:腸内毒素症)は、腸の免疫系を過剰に活性化し、腸のバリア機能不全を誘発する役割を果たしている可能性があります [14]。 |
| 微生物免疫システム通信の追加の経路は、腸内微生物叢によるさまざまなシグナル伝達分子の産生に依存しています。 このような免疫活性シグナル伝達分子には、特に以下が含まれます。 (i) 消化されていない繊維の発酵から細菌によって生成される短鎖脂肪酸。 (ii) 肝臓で産生された一次胆汁酸の微生物叢変換によって生成される二次胆汁酸、および (iii) トリプトファン代謝産物 [15、16]。 したがって、代謝産物の生産は、宿主の食事と微生物叢の組成に依存します。 短鎖脂肪酸は、粘膜および全身のコンパートメントにおける免疫恒常性に寄与します。 例えば、Clostridia によって産生される短鎖脂肪酸は、Treg(制御性T細胞) の活性化と拡大に関与しています [17, 18]。 プロピオン酸などの他の短鎖脂肪酸 は、γδT 細胞亜集団に直接作用して、マウスとヒト (つまり、炎症性腸疾患の患者) の両方でインターロイキン-17 (IL-17) の産生を阻害します [19]。 胆汁酸は、ファルネソイド X 受容体 (FXR) および G タンパク質共役胆汁酸受容体 1 (GPBAR1) の活性化を引き起こします。 これは、腸マクロファージ、樹状細胞、ナチュラル キラー T 細胞などの自然免疫細胞で高度に発現され、腸の免疫機能の維持に寄与します [20]。 トリプトファンは必須アミノ酸ですが、インドール、トリプタミン、セロトニン、キヌレニンなどの多数の生物活性化合物の前駆体としても機能します [4, 21]。 もっぱら腸内微生物叢によって産生されるインドール誘導体は、ナイーブ CD4 + T 細胞の制御性T細胞および T ヘルパー 17 (Th17) 細胞への機能的分化に影響を与えます [21]。 インドールは、粘膜の制御性T細胞/ T ヘルパー 17 (Th17) 細胞(Treg/Th17) 比の制御にも関与しているため、消化管のさまざまなコンパートメントにおける抗炎症バランスにも関与しています [22]。 注目すべきことに、腸で活性化された Th17 細胞は、T 細胞依存性の高親和性免疫グロブリン A (IgA) 分泌を誘発します [23]。 |
| ただし、微生物叢と免疫細胞の間の相互作用はより複雑で、腸ニューロンなどの以前に発見された追加のプレーヤーが含まれている可能性があります。 ごく最近の研究では、微生物シグナル、おそらく(しかし排他的ではない)リポ多糖類または孔形成毒素が腸のニューロン活性化と関連するニューロンインターロイキン-6(IL-6)誘導を調節する調節回路が報告されています。 その後、免疫寛容を制御するために制御性T細胞の腸RORγ + サブセットを調整します[24]。 |
| 要約すると、腸内微生物叢は、末梢骨髄細胞、T 細胞、マスト細胞など、さまざまな免疫細胞サブセットの細胞機能と移動特性に影響を与えます [7]。 全身性免疫応答の調節に加えて、腸内細菌は、病原体に対する宿主防御に役割を果たす粘膜免疫にも影響を与えます [5,7]。 |
| |
|
| 2.2.神経炎症に対する微生物叢の影響 |
|
| 2.2.1.末梢および中枢の免疫クロストークによる間接的な作用 |
| 微生物叢は、「微生物叢 - 腸 - 脳軸」に沿った中枢神経系と腸との間の相互作用を介して、脳の炎症 (神経炎症) にも影響を与える可能性があります。 この軸は、腸内微生物叢と中枢神経系間の双方向通信を可能にする相互作用の複雑なネットワークを指します。 関連する相互作用には、細胞性(免疫細胞などを介して…)と体液性(サイトカインを介して…)の両方のコミュニケーションモードが含まれます。 |
| 中枢神経系恒常性の維持には、血管周囲の空間、髄膜領域、および脈絡叢に限定された T 細胞および成熟抗原提示細胞をパトロールすることによる免疫監視が含まれます。 特に、脳髄膜に存在する活性化された骨髄性およびリンパ性免疫細胞は、脳脊髄液(CSF)に排出され、リンパ系を介して脳実質に輸送されるサイトカインを産生します。 ここでグリア細胞 (ミクログリア、アストロ サイト、オリゴデンドロ サイト) を調節します。 これらの後者は、脳内の内因性サイトカイン産生の主な原因です。 脳由来サイトカインと末梢由来サイトカインの両方が、例えば内皮細胞間のタイトジャンクションタンパク質の発現を減少させることによって、血液-脳関門透過性に影響を与える可能性があります[25]。 その上、病理学的設定では、活性化された免疫細胞は表在軟髄膜血管および脈絡叢を介して中枢神経系実質に入ることができ[26、27]、このプロセスは血液-脳関門の透過処理によりさらに増幅される[25]。 さらに、有能な脳グリア細胞によって産生される炎症誘発性サイトカインは、脳内皮細胞上のセレクチンやインテグリンなどの接着分子の発現を増加させ、脳への T 細胞浸潤を促進します [27]。 したがって、全身性炎症状態の文脈では、末梢サイトカイン産生の増加の影響は、脳内の内因性サイトカイン誘導によってさらに強化される可能性があり、脳炎症反応のフィードフォワードエスカレーションの枠組みを設定する[25]。 |
| すべてのグリア細胞の中で、ミクログリアは中枢神経系におけるサイトカインの主要な供給源です。 これらの脳常駐免疫細胞は、自然免疫応答を駆動し、抗原提示細胞として機能することができます。 環境の手がかりに応じて、ミクログリアはさまざまな表現型を示します [28–31]。 |
| 機能的な観点から、ミクログリアは、神経細胞の健康を促進し、中枢神経系微小環境を調査する恒常性から、時には過剰になるサイトカイン産生および/または食作用のさまざまなパターンによって特徴付けられる病理学的に活性化された状態まで、幅広い反応状態を採用することができます。過度に回転する[29、30]。 ミクログリアのこれらの機能状態は、定常状態での枝分かれした「恒常性」形態から、慢性神経炎症および神経変性に関連するジストロフィー形態を含む病理学的状態および老化中の収縮プロセスおよび細胞体 (「アメーバ状態」) を伴う多様な「分極」形態まで、広範囲の形態に及びます。 最近の大規模な単一細胞のトランスクリプトーム解析により、ミクログリアのより正確な分子特性が可能になりました。 これらの研究は、恒常性 (M0) と疾患関連ミクログリア (DAM) の間で異なる特定のトランスクリプトーム シグネチャを確立しました。後者は、神経変性 [MGnD] プロファイルにおけるミクログリアに類似しています [28–30]。 ミクログリアの分極状態である M1 (古典的、炎症誘発性) と M2 (代替、抗炎症性) の間の以前の区別 [31] は、現在では過度に単純化された分類と見なされていますが、ミクログリア/マクロファージの多様性の 2 つの極端な機能プロファイルを説明するのに役立つ可能性があります。 以前に命名されたミクログリアの M1 様表現型は、マクロファージとの類推により、中枢神経系パトロールまたは浸潤 T ヘルパー 1 (Th1) または Th17 CD4 + T 細胞によって産生されるサイトカインによって促進されます。 このような炎症誘発性 Th1 由来 (例: インターフェロン ガンマ [IFNγ]、腫瘍壊死因子アルファ [TNFα]) および/または Th17 由来 (例: GM-CSF) サイトカインは、病原体関連分子パターン/損傷関連分子パターン(PAMP/DAMP) に対するミクログリア/マクロファージ応答を促進します。 その結果、炎症誘発性サイトカイン (TNFα、インターロイキン-1 ベータ [IL-1β]、IL-6、インターロイキン-12 [IL-12] など…) の産生が増加し、活性酸素種 (ROS) および窒素反応種 (NOS) [が増加します[31]。 一方、M2 (代替、抗炎症性)様の表現型は、ヘルパー T 2 (Th2) 由来 (例: インターロイキン 4 [IL-4]、インターロイキン 5 [IL-5]、インターロイキン 13 [IL-13])および/または Treg 由来 (例: インターロイキン-10 [IL-10]、トランスフォーミング増殖因子ベータ [TGFβ]) サイトカイン) によって促進されます。 その結果、活性化されたミクログリア/マクロファージが生じ、その後、抗炎症性サイトカインおよび神経栄養因子の産生が増加し、食作用が増強されます [32, 33]。 |
| 近年、上記の末梢炎症と中枢炎症の間のクロストークにおける微生物叢の推定上の役割を指摘する新しい概念が出現しました。 たとえば、最近の包括的なレビューで報告されているように、リポ多糖や加熱殺菌した病原体または生きた病原体の末梢注射は、ミクログリアの活性化を促進することによってげっ歯類の脳に免疫反応を誘発します [34]。 このようなミクログリアの活性化は、リボ核酸 (RNA) およびタンパク質レベルの両方での TLR2、TLR4、TNFα、および IL-1β のアップレギュレーションを含む神経炎症に関連しています [34]。 ただし、後者のシステマティックレビューは、転写 M0 対 DAM/MGnD プロファイルの説明の前に公開された研究を対象としており、これまでのところ、トランスクリプトーム表現型の分析に基づく同等の概要はありません。 注目すべきことに、最近の研究では、異なる血中レベルの炎症性サイトカインに関連する末梢 リポ多糖注射の異なるレジメンが、アミロイド病理のマウスモデルにおけるミクログリアと疾患の進行に対して相反する効果を持つことが報告されている[35]。 強化された末梢炎症誘発性プロファイルに関連する治療レジメンは、活性化されたプロファイルを示すミクログリアをもたらし、神経炎症反応、脳β-アミロイドーシス、および神経細胞死を悪化させます。 逆に、炎症誘発性サイトカインの末梢レベルの低下と抗炎症性サイトカイン IL-10 のレベルの持続に関連する治療レジメン(食事療法)は、神経炎症反応の抑制、アミロイドβ (Aβ) 取り込みの増加、ニューロン生存の改善に関連するミクログリアプロファイルを促進した [34 、35]。 したがって、ミクログリアは末梢炎症の長期にわたる刷り込みを保持します。 |
| ミクログリアを介した末梢性炎症と中枢性炎症との間のクロストークにおける腸内微生物叢の推定上の役割は、これまで生理学的条件で十分に評価されていません。しかし、無菌(GF)マウスは、細胞比率の変化と未熟な表現型を伴うミクログリアの全体的な欠陥を示し、自然免疫応答の障害につながることが報告されています[36]。複雑な微生物叢の再定着により、ミクログリアの生理学的特徴が部分的に回復した [36]。驚くべきことに、短鎖脂肪酸の補給は、微生物叢の再定着の効果を模倣し、無菌マウスで観察されたミクログリアの表現型の変化を逆転させるのに十分です [36]。酪酸などの短鎖脂肪酸は、恒常性 (M0) 表現型の発現に向けてミクログリアの機能変化を誘導し、in vitro および in vivo の両方で リポ多糖への曝露後の炎症誘発性サイトカインの産生を阻害します [37]。したがって、微生物叢によって生成された代謝産物は、末梢 - 中枢免疫クロストークへの影響を通じて、有益なフィードフォワード制御ループを増幅することができます [37]。基礎となるメカニズムには、短鎖脂肪酸などの微生物叢の代謝産物が、モノカルボン酸 (MCT) およびナトリウム結合型モノカルボン酸 (SCMT) トランスポーターを介して 血液-脳関門を横切って輸送される能力も含まれている可能性が高く [38]、その後、ミクログリアの炎症反応に影響を与えます。 一致して、分化したHL-60骨髄単球細胞を使用してヒトミクログリアの免疫機能を模倣する最近の研究では、炎症誘発性サイトカイン/ケモカイン(IL-1β、TNFαおよび単球化学誘引物質タンパク質-1 [MCP-1]) は、短鎖脂肪酸に応答する [39]。 in vivoで確認された場合、これらの研究は、有害なフィードフォワードループの増幅や末梢-中枢免疫クロストークの調節などを介して、微生物叢と派生代謝物が神経炎症を間接的に調節する可能性があるメカニズムを提供する可能性があります。 |
| 注目すべきことに、このレビューは脳の重要な自然免疫細胞および神経炎症の中心的役割としてミクログリアに焦点を当てていますが、星状細胞に対する微生物叢の影響に関する利用可能な文献は、ミクログリアの場合よりもはるかに少ない場合でも. 神経炎症反応に対するアストロサイトの重要な寄与を支持する証拠が増えています。 リポ多糖は星状細胞の活性化を誘発することが報告されている [40] が、短鎖脂肪酸は NF-kB阻害(訳者注:NF-kBは転写因子として働くタンパク質複合体)を介して in vitro でリポ多糖誘導性の星状細胞の活性化を阻害する [41]。驚くべきことに、NLRP3欠損マウスの腸内の Lachnospiraceae, Ruminococcaceae および Prevotellaceae の存在量の増加は、星状細胞の機能不全および抑うつ様行動を緩和した[42]。 さらに、Nitriliruptor、Youngiibacter、Burkholderia、および Desulfovibrio の量が多いことは、一部の神経障害 (自閉症スペクトラム障害など) における星状細胞の活性化と相関することがわかっています [43]。 さらに、トリプトファンの微生物代謝産物は、中枢神経系で内因性 I 型インターフェロンと協調して作用し、アストロサイト(訳者注:中枢神経系に存在するグリア細胞の1つ)の活動を調節し、神経炎症を増加させることが示されています [44]。 まとめると、これらのデータは、アストロサイトの反応性の微生物叢を介した調節が、さまざまな神経炎症に関連する神経精神医学的および神経学的状態において役割を果たす可能性が高いことを示しています。 明らかに、微生物叢は、ミクログリアと星状細胞のコミュニケーションを介して、間接的に星状細胞にも影響を与える可能性があります [45]。 |
| 全体として、末梢炎症反応と中枢炎症反応の間のクロストークがますます文書化されていますが、微生物叢によるミクログリア活性化の調節の根底にあるメカニズムは完全には解明されていません。 現在の見解によれば、それらには、血液-脳関門を通過する循環する親油性微生物叢由来の代謝産物の受動輸送などの間接的なメカニズムが含まれる可能性があります。 微生物叢の親水性代謝産物は、脳室周囲器官や脈絡叢など、血液-脳関門が存在しない特定の解剖学的位置での循環から脳に入る可能性もあります。 さらに、微生物叢によって生成された代謝産物および成分は、粘膜固有層の腸粘膜下コンパートメントに存在する免疫細胞による炎症誘発性メディエーター (サイトカインなど) の産生を引き起こす可能性があります。これらの炎症誘発性サイトカインは、毛細血管を介して腸粘膜下の間質腔から拡散して末梢循環に到達し、循環するリンパ系および骨髄系免疫細胞を誘発して追加のサイトカインを産生する可能性があります。循環由来のサイトカインは、血液-脳関門の内皮細胞によって発現されるサイトカイントランスポーターを介して脳に到達し、その後、特にミクログリアや星状細胞によって局所的にサイトカイン産生を調節することができます。髄膜免疫の特定のケースでは、循環サイトカインは髄膜に存在するリンパ系および骨髄系細胞を活性化してサイトカインを分泌し、サイトカインはリンパ系を介して脳実質に輸送され、脳常在グリアの活性化とそれに続く脳由来のサイトカイン産生をもたらします。 |
| |
|
| 2.2.2.迷走神経を介した直接作用 |
| 前のセクションで説明した間接的なメカニズムに加えて、迷走神経の一次自律神経求心性神経を介した直接的な病態生理学的メカニズムが、末梢炎症と中枢炎症の間のクロストークに関与している [46] が、それらはあまり研究されていない。 |
| 迷走神経を介した直接的な神経接続により、脳と腸の双方向通信が可能になります [4, 7]。根底にあるメカニズムの中で、神経活性微生物叢由来の分子は、迷走神経の出力を直接調節することができます。関連する微生物叢の生成物には、ドーパミン、セロトニン、ノルエピネフリン、γ-アミノ酪酸 (GABA) などの多数の神経伝達物質が含まれています [47]。さらに、腸迷走神経終末付近の浸潤または常在免疫細胞を介した微生物叢誘導性サイトカイン産生も、迷走神経出力の調節に役割を果たすことができます。実際、調査では、迷走神経に沿ってサイトカイン特異的かつ用量依存的にニューロン活動を誘発する TNFα および IL-1β の能力が直接実証されています [48]。迷走神経活動に対する微生物叢の影響は、反射のような方法で免疫応答の最近発見された神経制御に関して重要です。関連する「迷走神経免疫反射」は、このレビューの範囲を超えていますが、免疫細胞の活動を制御することにより、炎症反応を弱める迷走神経刺激に応答したアセチルコリン神経伝達物質の放出を伴います[49]。 |
| ただし、微生物叢の免疫調節作用と神経調節作用は重複しています。 一貫して、非常に最近の研究では、抗生物質または無菌成体マウスを使用して微生物叢を操作すると、ミクログリアだけでなく内側前頭前皮質の興奮性ニューロンでも遺伝子発現に大きな変化が誘発されることが報告されています。 これは、ニューロンのコード化活動の欠陥と、学習に関連した樹状突起棘のシナプス後リモデリングに関連していました。 驚くべきことに、これらすべての変化は神経炎症の変化と相関しておらず、迷走神経切除術後も持続したため、微生物叢の代謝産物がニューロンの活動に直接影響を与える可能性があることを示唆している [50]。 これらの発見は、微生物叢の代謝物に関連するニューロンとミクログリアの変化の間の因果関係を解読することに焦点を当てたエキサイティングな研究分野を切り開きます。これは、微生物叢の代謝物がミクログリアとニューロンに独立して、順次または同時に影響を与える可能性があるかどうかを解明するのに役立つ可能性があります。 |
| したがって、(神経)炎症および神経変性疾患における腸-脳軸の中心的役割は、これらの疾患のいくつかにおける微生物叢の関与を示す説得力のある証拠とともに、ますます認識されるようになりました。特に、アルツハイマー病に加えて、腸内毒書証は パーキンソン病、多発性硬化症、筋萎縮性側索硬化症 (背景)とも関連付けられています。 多発性硬化症の病因における微生物叢の推定関与に関する研究 (2021 年 12 月現在、2010 年以降、「微生物叢 - 多発性硬化症」について PubMed で 513 件のヒット)、パーキンソン病と アルツハイマー病(「microbiota-Parkinson」と「microbiota-Alzheimer」でそれぞれ 2012 年と 2013 年以降の PubMed で 622 件と 709 件のヒット) は、筋萎縮性側索硬化症研究 (「microbiota-Amyloid Lateral Sclerosis」で 2014 年以降の 89 件のヒット) よりも数が多く、わずかに早いです。 現在、神経変性疾患における微生物叢の関与に関する統一された概念はありませんが、入手可能な証拠は、アルツハイマー病よりもパーキンソン病の方が一貫しているようです (最近のレビューについては、[51] を参照)。しかし、2020 年以降、毎年 200 以上の出版物が発表されており、アルツハイマー病に対する微生物叢の影響は、この分野で最もダイナミックな研究分野の 1 つであり、この新しいデータがコンセンサスの策定に役立つことが一般的に期待されています。次のセクションでは、アルツハイマー病文献内の微生物叢の包括的かつタイムリーな分析を具体的に提供して、炎症性緊張の末梢調節を介した神経活動に対する微生物叢の影響を指摘する最近の進歩を説明します。 |
| |
|
| 3.アルツハイマー病における認知機能障害と微生物叢 |
|
| 3.1.アルツハイマー病:神経炎症の役割 |
| アルツハイマー病は加齢に伴う不治の神経変性疾患であり、病因はまだよくわかっていません。 臨床的には、アルツハイマー病は現在、病状が始まってから数十年後、疾患経過の後期に診断されています。 これは認知症の最も一般的な原因であり、罹患者数は急速に増加しており、公衆衛生上の大きな懸念となっています。 世界中の認知症患者数は 2020 年に 5,000 万人と推定され、この有病率は 20 年ごとに倍増し、2030 年には 8,200 万人、2050 年には 1 億 5,200 万人に達すると予測されています [52]。 |
| 患者は、シナプス機能障害および神経細胞の喪失と相関する進行性の記憶障害および認知機能低下を示します。これらの変化は、主観的認知機能低下 (SCD) と軽度認知障害 (MCI) という 2 つの初期段階で現れます。 最初のものは臨床的に検出されず、マイナーな気晴らしとして現れ、前臨床段階で発生します。 主観的認知機能低下は、アルツハイマー病の前駆段階 (アルツハイマー病による軽度認知障害) に進行する可能性があり、これは臨床的に定量化可能であり、現在アルツハイマー病が診断される最も初期の段階である [53]。 アルツハイマー病は、2 つの病理学的タンパク質種の蓄積を含むいくつかの生物学的特徴によって特徴付けられます: アミロイドβ ペプチドと過リン酸化タウは、それぞれ細胞外アミロイド斑と細胞内神経原線維変化 (NFT) に凝集します [54]。 これらの神経毒性種の蓄積は、臨床症状の発症の数年、さらには数十年前に始まり、診断がまだ確立されていません。 特に、脳脊髄液における アミロイドβ の減少 (脳実質におけるプラークの沈着による) は、タウの蓄積に先行し、臨床診断の 15 年以上前に検出される [55]。 |
| 動物モデルを使用して、アミロイドーシスとして知られる脳実質における アミロイドβ の蓄積が、ニューロンのシグナル伝達を混乱させ、シナプスおよびニューロンの喪失を引き起こし、認知機能を徐々に損なうことが示されている [3, 56]。 アミロイド沈着と細胞内神経原線維変化はまた、周囲のミクログリアと星状細胞の活性化に反映されるように、慢性的な先天性神経炎症反応を引き起こします [2, 57]。 ミクログリア細胞は、Toll様受容体 やスカベンジャー受容体 (SR) などのいくつかの パターン認識受容体に結合する アミロイドβ ペプチドおよび病的なタウ種によって活性化されます [58]。 これは、ミクログリアの活性化につながり [35, 58]、アルツハイマー病 病理学との関連で脳の アミロイドβ クリアランスに関連する CD33、CR1、および Abca7 を含む貪食関連遺伝子の発現の変化と関連している [58]。 注目すべきは、ゲノムワイド関連研究 (GWAS) により、そのような遺伝子の一塩基多型が同定されたことであり、アルツハイマー病を発症するリスクが高い [59]。 興味深いことに、アルツハイマー病の最も強力な遺伝的危険因子であるアポリポタンパク質 E (ApoE) は、骨髄細胞-2 (TREM2) に発現するトリガー受容体を活性化することにより、恒常性 M0 から DAM/MGnD 表現型への移行に役割を果たします。 脳では、TREM2 はミクログリアによって特異的に発現し、神経炎症と密接に関連しています [29、30]。 |
| 病状の進行した段階におけるアルツハイマー病関連の慢性神経炎症は、IL-1β、IL-6、TNFα、CCモチーフケモカインリガンド-5 (CCL5)、マクロファージ炎症性タンパク質-1αを含む炎症誘発性サイトカイン/ケモカインのミクログリア産生によって現れる(MIP-1α) および MCP-1 は、TLR4、TLR2、およびインフラマソーム NALP3 シグナル伝達を介して伝達される [31、33、58]。 しかし、TNFαなどのサイトカインレベルの上昇は、ヒト [60] と アルツハイマー病様病理の動物モデル [61] の両方で、アルツハイマー病の初期段階ですでに検出可能です。 補体系は、疾患の初期段階におけるアミロイドβ プラークのクリアランスにも関与しており、疾患の段階に応じてアルツハイマー病でさまざまな役割を果たします [62、63]。 たとえば、補体成分 1q (C1q) は、アルツハイマー病の初期段階では神経保護の役割を果たしますが、特にミクログリアの活性化と炎症誘発性表現型へのシフトに寄与することにより、疾患が進行するにつれて神経毒性の役割を獲得します [63] . 興味深いことに、補体系が海馬の記憶形成に重要な役割を果たしている脳領域である歯状回の神経新生を促進することが研究によって示されていますが、これはアルツハイマー病で損なわれています [62]。 逆に、インターロイキン-1 α (IL-1α および TNFα) と組み合わせて作用する場合、C1q は反応性星状細胞の A1 様神経毒性機能プロファイルへの分化を促進します [64]。 さらに、C1q は、ミクログリアが関与する C3 および CR3 を介したシナプス剪定を介して、アミロイド病理のアルツハイマー病様マウス モデルにおける初期のシナプス損失を引き起こします [65]。 その上、C3 は、それぞれ野生型 (WT) および APP/PS1 マウスにおける老化およびアミロイド沈着による海馬シナプス損失を (少なくとも部分的に) 仲介します。 C3 の遺伝的欠失は、APP/PS1 マウスモデルでのプラーク沈着の増加にもかかわらず、WT マウスとトランスジェニックマウスの両方で海馬シナプスと認知を保護した[66、67]。 |
| 疾患が進行するにつれて、過剰かつ慢性的な神経炎症性シグナル伝達が神経およびグリア細胞の死につながります [29, 65]。 アミロイドβの全体的なクリアランスは損なわれますが、炎症誘発性メディエーターのミクログリア産生は上昇したままです。 これは神経変性を引き起こし、さらに悪循環に沿って神経炎症を促進します [68]。 ニューロンの損失は、ミクログリア細胞による 活性酸素腫および窒素反応種の放出によっても加速されます [33]。 |
| アルツハイマー病の進行段階では、ミクログリアクリアランス能力が低下するにつれてプラークをクリアするために、末梢マクロファージも脳に動員される可能性がありますが、この点はまだ議論されています[69-71].これらの進行した段階では、血液-脳関門の完全性と透過性の変化によって末梢免疫細胞の浸潤が促進される可能性が高く、アルツハイマー病中の中枢神経系の炎症性変化をさらに悪化させる[69]。さらに、末梢炎症はアルツハイマー病の進行に寄与し、特に軽度認知障害段階での認知障害と相関しており、IL-1βおよびTNFαの末梢産生の増加はアルツハイマー病のリスクが高いことと関連している[69、72]。興味深いことに、以前の研究では、非ステロイド性抗炎症薬は、特に治療が早期に適用された場合、長期使用者のアルツハイマー病発症の発生率を低下させる可能性があることが示唆されました。しかし、後で投与した場合、つまり症状のある患者に投与した場合、有益な効果は証明されませんでした[71]。これは、病理学の各段階で異なる免疫プロセスが発生することを示唆しており [10, 71]、初期段階のアルツハイマー病関連神経炎症は有益でさえある可能性がある [73]. |
| 全体として、最近の実験的証拠は、中枢神経炎症、末梢炎症、アルツハイマー病関連の認知機能障害の間の複雑な相互作用を示しています。 |
| |
|
| 3.2.シナプス興奮性と可塑性のアルツハイマー病関連障害: LTP(訳者注:シナプス伝達の長期増強)に注目し、神経炎症との関連 |
| アルツハイマー病の病因に関する現在の仮説によれば、シナプス機能不全は認知障害の発症に先行する[74]。シナプス活動の変化は、アルツハイマー病の発症前段階ですでに発生しており、グルタミン酸作動性緊張の増加と、脆弱な脳領域、特に海馬の錐体ニューロンの興奮性と関連しています。グルタミン酸作動性伝達の増加は過興奮性をもたらし、抑制性 γ-アミノ酪酸作動性神経伝達の減少から、またはグルタミン酸の効率の増加から直接生じる可能性があります。グルタミン酸作動性伝達の増加に基づく過興奮性のメカニズムには、α-アミノ-3-ヒドロキシ-5-メチル-4-イソオキサゾールプロピオン酸 (AMPA) および N-メチル-D-アスパラギン酸 (NMDA) 型のイオンチャネル型グルタミン酸受容体: AMPA 受容体 ( AMPAR) と NMDA 受容体 (NMDAR) です。過剰興奮性は、少なくとも海馬における興奮性シナプス後電位 (EPSP) の増加によって反映されるように、基底シナプス伝達中の AMPAR を介した応答の増加につながります [75] (図 1)。 |
| |
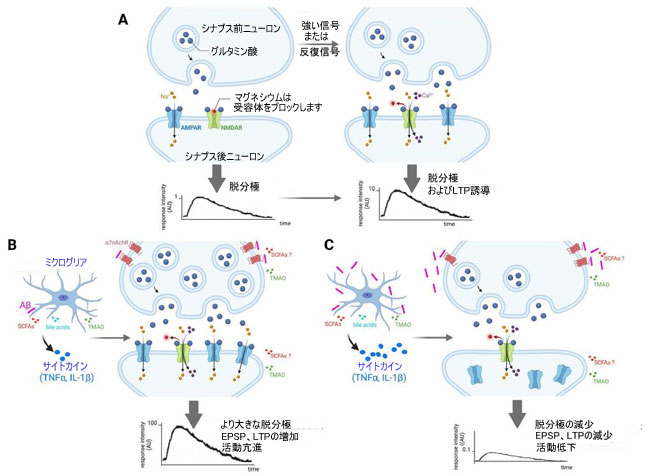 |
| 図 1 アルツハイマー病様病理の動物モデルにおける生理学的およびアルツハイマー 関連の病理学的状態における LTP の誘導と発現、および微生物叢産物によるその調節 |
| (A) 生理学的条件では、シナプス前海馬ニューロンへの最適な入力が、シナプス間隙へのグルタミン酸の放出を引き起こします。 これにより、シナプス後ニューロンの膜 AMPAR が活性化され、細胞内への Na+ の侵入が可能になり、興奮性シナプス後電位 (EPSP) が生じます。 破傷風刺激が与えられると、大量のグルタミン酸がシナプス前終末から放出され、シナプス後膜によって生成される EPSP が増加し、NMDAR でブロックされた Mg2+ が除去され、その後活性化されます。 NMDAR の活性化により、Ca2+ および Na+ イオンの細胞への流入が可能になり、Ca2+-カルモジュリン依存性プロテインキナーゼ II が活性化されます。 これは AMPAR をリン酸化し、その伝導性を高め、細胞質からシナプス後膜への AMPAR の移動を促進し、その密度を増加させ、LTP をもたらします。 |
| (B) アルツハイマー病様の病理の初期段階は、シナプス前ニューロンによるグルタミン酸放出の上昇と、シナプス間隙内およびその周辺のグルタミン酸濃度の増加に関連している可能性があります。 実際、アミロイドβはシナプス前ニューロンでα7nAchR活性化を介してグルタミン酸放出を刺激し、シナプス前促進に寄与することができます。アミロイドβ の蓄積の存在下でミクログリアによって産生される TNFα や IL-1β などの炎症誘発性サイトカインは、シナプス後膜上の AMPAR 発現をアップレギュレートすることができ、これにより、より高いイオン流入とより大きな脱分極が可能になります。 シナプス レベルでのこれらすべての変化は、アルツハイマー病の初期段階で海馬の神経活動亢進と LTP の増加につながります。 短鎖脂肪酸、胆汁酸、トリメチルアミン-N-オキシド(TMAO) などの微生物叢の代謝産物が脳内で特定されています (詳細については、神経炎症およびアルツハイマー病に対する微生物叢の影響と腸内毒素症を参照してください: 神経炎症およびミクログリアの関与との関連性を参照してください)。 シナプス可塑性に対するトリメチルアミン-N-オキシドの負の影響 (すなわち LTP 障害) が報告されている [76] が、関連する実験がトリメチルアミン-N-オキシドの存在下で培養された ex-vivo 海馬スライスで行われたため、 トリメチルアミン-N-オキシドがニューロンに直接作用するのか、それともミクログリアに作用し、その後ミクログリアとニューロンのクロストークを介して神経機能に影響を与えることによって間接的に作用するのかは、現在明らかではありません. 対照的に、5XFAD マウスモデルでは、酪酸ナトリウム (短鎖脂肪酸の 1 つ) は、in vivo での LTP 電気生理学記録によって評価されるシナプス可塑性を促進した [77]。 この研究で使用された実験装置では、観察されたニューロン活動への影響が直接的か間接的か (ミクログリア経由) を判断できませんでした。 現在、神経活動に対する胆汁酸の推定上の影響に関するデータはありません。 |
| (C) アルツハイマー病様病理の後期段階は、初期段階でのパラドックス活動亢進の結果としてのグルタミン酸作動性神経伝達の活動低下によって特徴付けられます。 アミロイドβレベルが上昇すると、α7nAchRの阻害によりシナプス前ニューロンによるグルタミン酸放出が減少し、NMDARのシナプス後活性化が減少します。 さらに、アルツハイマー病病理の初期段階における AMPAR の慢性的な刺激は、これらの受容体の脱感作と内在化につながります。 さらに、ミクログリアによる炎症誘発性サイトカイン (TNFα、IL-1β など) の過剰な産生は、継続的な アミロイドβ 蓄積によって引き起こされる毒性状態に起因し、神経細胞死および死にかけているニューロンからのグルタミン酸の放出を引き起こし、神経毒性をエスカレートさせる可能性があります。 全体として、これにより、認知障害に関連する LTP と EPSP が減少します (また、わかりやすくするために図には示されていませんが、LTD が鏡のように増加します)。 Biorender.com で作成 |
| |
| 障害のある海馬γ-アミノ酪酸受容体 (GABARs) 伝達は、少なくとも動物モデルでは、初期のアルツハイマー病病理学の特徴である過興奮性にも寄与します。 同様に、γ-アミノ酪酸作動性ニューロンの喪失は、マウスアルツハイマー病様モデルの海馬台を除くすべての海馬領域で観察され[78]、疾患の初期段階から検出可能である[79]。 興味深いことに、このアルツハイマー病様マウス モデル (TgCRND8) では、γ-アミノ酪酸作動性ニューロンがグルタミン酸作動性ニューロンまたはコリン作動性ニューロンの前に影響を受けるようです [78, 79]。 |
| 神経回路網の抑制と興奮の間の不均衡は、異常な興奮活動と同期をもたらし、発作に対する感受性を高めます [78, 79]。これらのシナプス機能障害は、学習回路と記憶回路の障害を引き起こし、長期増強 (LTP) の減衰と長期抑圧 (LTD) の増加として現れます。どちらもシナプス可塑性と密接に関連しています。 LTP は実験的に高周波刺激を繰り返すことで誘導され、シナプス間の伝達効率を高めます。 アミロイドβの存在下では、LTP誘導の失敗または異常があり、グルタミン酸興奮毒性によるシナプス可塑性の低下をもたらすことが現在よく認識されている[80]。一方、LTD誘導を目的とした低周波刺激プロトコルでは、シナプス間の伝達効率が低下し、LTD誘導もアミロイドβの存在下で損なわれます。異常な LTP/LTD は、アミロイドβ を介した NMDAR シグナル伝達の増強、シナプス後膜での AMPAR 発現の低下、γ-アミノ酪酸作動性阻害の減弱、および/またはシナプス前およびシナプス後カルシウム チャネルの障害に関連している可能性が高い [81]。マウスアルツハイマー病様モデル[82]およびヒト由来シナプトソーム[83]の両方における海馬LTPの結果として生じる欠損は、加齢の動物モデルにおけるLTP障害[82、84]とともに、アルツハイマー病における認知機能障害の進行性特徴と一致している。 .加齢に伴う LTP の欠損は、活性酸素種および神経炎症の蓄積、特に IL-1β [74、82、85、86] および TNFα [61、72、86] の増加とも相関しています。一貫して、IL-1βとTNFαは海馬のCA1領域と歯状回領域の両方でLTP誘導を損なうことが示された[87]。さらに、サイトカイン TNFα および IL-1β によってそれぞれ増加および減少されるグルタミン酸および γ-アミノ酪酸受容体の調整された調節 [72] は、LTP/LTD 障害をさらに増強する可能性がある。 |
| |
|
| 4.アルツハイマー病と腸内毒素症:神経炎症とミクログリアの関与との関連 |
| 疾患の進行段階では、アルツハイマー病様マウスモデルおよびアルツハイマー病患者は、炎症誘発性分類群の増加と抗炎症性分類群の減少を伴う、微生物の多様性と組成の変化を特徴とする腸内細菌叢の異常を示します。 |
| |
|
| 4.1ヒトおよびげっ歯類モデルにおけるアルツハイマー病および加齢に伴う腸内毒素症の比較 |
| アルツハイマー病の臨床症状を有する患者では、以前の報告でFirmicutes門の減少が明らかになった [88]。これは、炎症性腸疾患などの炎症状態で見られる変化と同様である [89]。最近の研究では、健康な被験者と比較して、軽度認知障害患者で抗炎症性細菌 (Firmicutes門に属する) である Faecalibacterium prausnitzii の減少が報告されている [90]。微生物叢の変化は、ミクログリア活性化のマーカーであるキチナーゼ-3様タンパク質1(YKL-40)の脳脊髄液(CSF)レベルの増加と相関するBacteroidetes門の増加からもなる[88]。アルツハイマー病患者におけるBacteroidetesなどのグラム陰性腸内細菌の存在量の増加は、腸から全身循環へのリポ多糖転座の増加をもたらす可能性があり、これは全身性炎症の刺激を通じてアルツハイマー病の病理に寄与する可能性があります。追加の研究では、微生物叢の豊富さと多様性のアルツハイマー病関連の減少が確認されており、認知的に正常なコントロールまたは軽度認知障害と比較した場合、患者の組成が異なるという明確な証拠があります([91]で概説)。しかし、2017 年に米国 [88] とイタリア [92] で実施されたアルツハイマー病の微生物叢に関する 2 つの先駆的な臨床研究以来、米国からの追加の研究 [93] と中国からの 6 つの研究 [94–99] が発表されました。驚くべきことに、しかしそれほど驚くべきことではないが、これらの最近の研究は、地理的および民族的要因に応じて、アルツハイマー病関連微生物叢の構成に関して顕著な違いを指摘した。たとえば、米国の 2 番目の研究 [93] では、同じ国の先駆的研究 [88] で報告されているように、アルツハイマー病患者におけるBacteroidetesの増加が確認されましたが、中国の研究 [95] では反対のことが発見されました。同様に、Actinobacteria は米国と中国の研究でそれぞれ増加 [88] と減少 [96] したのに対し、対照的にBifidobacteriumはアメリカの研究 [88] で減少し、中国のコホートで増加した [97]。これらの違いは、アルツハイマー病患者、より一般的には世界の集団における微生物叢の変化を研究する際に、地理的および民族的起源 (したがって関連する食事の違い) などの環境要因を考慮することの重要性を強調しています。観察された違いは、国際レベルでの一般化を引き出す前に、地域および国レベルでのアルツハイマー病関連の腸内毒素症の追加研究も促進するはずです。これは、推定される将来の治療アプローチとして微生物叢を標的にするという観点から最も重要です(微生物叢を標的とすることによるアルツハイマー病関連神経機能の回復を参照してください). |
| 上記の地理的な違いにもかかわらず、アルツハイマー病患者の腸内毒素症は、病理学的転帰と説得力のある相関関係にあります。 例えば、炎症誘発性Escherichia / Shigella属の増加と抗炎症性Eubacterium rectaleの減少は、脳脊髄液アミロイドβ42/アミロイドβ40 の減少とリン酸化タウおよびリン酸化タウ/Aβ42 レベルの増加と相関している [92]。 さらに、IL-1β、NLRP3、CXCL2などの炎症の循環バイオマーカーの増加は、それぞれEscherichia / Shigellaの増加および直腸炎の減少と正および負の相関があり、末梢炎症を引き起こす微生物叢の能力を示している[92] . |
| アルツハイマー病の主な危険因子は年齢であるため、微生物叢の加齢に伴う変化を利用することは、腸内細菌叢とアルツハイマー病の病因を結びつけるメカニズムを解読するのに有益であることが判明する可能性があります。若年成人、高齢者、100 歳以上の人の微生物叢を比較したイタリアのコホートの重要な研究では、最年長者は若い人よりもはるかに炎症誘発性の微生物叢を示したことが明らかになりました [100]。一貫して、別の研究では、アイルランドのコホートにおける高齢者の腸内微生物叢は、若年成人とは大幅に異なり、多様性が失われ、炎症性表現型へとシフトしていると報告されている [101]。同様に、Firmicutes (酪酸産生菌) の割合は、Firmicutes が Bacteroidetes よりも多い若年成人と比較して、高齢者で有意に低い [102]。それにもかかわらず、老化の過程におけるBacteroidetesの数の進化に関しては、まだいくつかの矛盾が残っています[103]。さらに、微生物の 短鎖脂肪酸のレベルは老化の過程で減少する [104] のに対し、短鎖脂肪酸は 100 歳以上の人では豊富なまま [104] であり、短鎖脂肪酸が老化を防ぐ可能性があることを示唆している。 |
| トランスジェニック(遺伝子組み換え) アルツハイマー病様マウス モデルを考慮すると、腸内毒素症は病状の進行した段階で検出されます。 したがって、生後8か月のAPPPS1マウスは、同年齢の野生型コントロールと比較して、Firmicutes、Verrucomicrobia、ProteobacteriaおよびActinobacteria門の有意な減少、およびBacteroidetesおよびTenericutes門の有意な増加を示す[105]。 |
| アルツハイマー病様の病理の進行に沿った微生物叢組成の変化に関して、いくつかの研究は、いくつかの微生物株が病因の前症候性段階と症候性段階の間で進化することを報告しました。 一方、他の菌株は発症前の段階から継続的に存在し、病因に沿って持続します。 例えば、Tg2576 マウスでは、症候段階への進行中にLactobacillusの有意な増加が観察されますが、発症前の Tg2576 マウスで見られるRuminiclostridiumの有意な減少は、症候段階の後半に持続します [106]。他の2つの研究では、追加のマウスモデルにおける前述の発症前段階の所見の一部、特に3xTg-ADにおけるLactobacillusの増加[107]とAPP/PS1におけるRuminiclostridiumの減少[108]が確認されました。 より最近の研究では、FirmicutesとBifidobacteria の相対存在量の減少とBacteroidetesの相対存在量の増加が、5xFAD マウスの生後 5 か月ですでに存在することが報告されています (つまり、このモデルでは発症前段階)。非トランスジェニック コントロールに、老化の過程で持続します。 実際、病理学の明らかな段階(生後15ヶ月)でも同様の変化が明らかです。 一貫して、この研究では、NLRP3インフラマソームとIL-1β産生の増加と同時に、5xFADマウスの両方の年齢(5か月と15か月)の腸内でFirmicutes / Bacteroidetes比の減少が見られました。 これらは、大脳NLRP3インフラマソームおよびIL-1βの増加とともに、アストログリオーシスおよびミクログリオーシスと正の相関があった[109]。 |
| さらに、2 つの異なるアルツハイマー病様マウスモデルにおける腸内毒素症の確立に加齢がどのように影響するかを評価するために、縦断的アプローチも使用されました。アミロイドーシスの APP/PS1 モデルでは、生後 3 か月、6 か月、および 24 か月での研究 (このモデルでは、それぞれ、発症前の段階、病状の発症段階、顕性段階に対応する) で、3 か月齢での腸内毒素症の欠如が指摘された。生後6か月のAPP / PS1マウスでは、共生障害が明らかになりました。したがって、生後6か月までに、対照と比較して、APP / PS1マウスではProteobacteria 門とErysipelotrichaceae門が増加した[110]。重要なことに、この研究では、遺伝子型効果に加えて、老化効果も顕著であることが報告されました。Bacteroidetesは安定したままであったが、老化の過程に沿って、Turicibacteriaceae 科とRikenellaceae科はAPP/PS1マウスと対照マウスの両方で増加した[110]。 P301L タウ トランスジェニック マウスを使用してタウの病理をモデル化した同様の研究では、微生物叢の多様性と組成の両方に有意な変化が観察されました。 P301Lマウスでは、コントロールマウスと比較して、発症前の段階(3か月)からBacteroidetesが増加する一方で、FirmicutesとActinobacteriaは減少しました。対照的に、Tenericutes は明らかな病状段階 (すなわち、このモデルでは 10 ヶ月) の P301L マウスでのみ減少した [111]。 |
| しかし、老化に関連した微生物叢の変化に関するげっ歯類の研究では、変化のパターンはヒトと比較して逆転していたため、種特異的である可能性が示唆されました。 Firmicutes の存在量はより高く、Bacteroidetes の存在量は若い (2 ヶ月) C57Bl6 マウスよりも古い (15 ヶ月) の方が低かった [112]。 老齢マウスにおけるこれらの微生物叢の変化は、血漿、腸、および脳における炎症誘発性 (TNFα、IL-1β、および IL-6) サイトカインの発現の増加に付随していました。 血漿と脳の両方で リポ多糖のレベルが上昇すると同時に、Iba-1、TLR4 の脳内発現が増加し、NF-κB の核移行がミクログリアの活性化を示している [112]。 古いラット (20 ~ 24 か月) と若いラット (生後 3 か月) の Sprague-Dawleyラットを比較した類似の研究では、微生物叢の同様の変化が報告されており、若いラットに比べて高齢のラットではBacteroidetesの相対存在量が低く、逆にFirmicutesの相対存在量が高くなっています。 Firmicutes / Bacteroidetes の比率は加齢とともに数倍に増加しました。マウスの研究と同様に、この加齢に伴う微生物叢の変化は、老齢ラットの血清および海馬における炎症誘発性 (TNFα、IL-1β、および IL-6) サイトカインのレベルの増加と相関していた [113]。 観察された微生物叢の変化は、認知障害および安静状態の機能的磁気共鳴画像法(fMRI) におけるニューロン活動の減少とさらに相関していた [113]。 若いラットをレシピエントとして使用し、古いラットを微生物叢のドナーとして使用する糞便微生物叢移植(FMT)アプローチ(以下のFMTの説明を参照)は、安静状態-機能的磁気共鳴画像法でのニューロン活動の低下、構造的および形態学的なシナプス特性の悪化、および血清および海馬における炎症誘発性サイトカインのレベルの増加と同様に[113]、糞便微生物叢移植が若いラットの腸内微生物叢を古いラットの腸内細菌叢に再形成し、若いレシピエントラットの認知行動の障害につながることを示しました。 したがって、この研究は、腸内微生物叢の加齢に伴う変化と、神経炎症、神経機能障害、および認知障害との因果関係を実証しました。 したがって、反対のアプローチ、つまり若いマウスの微生物叢から古いレシピエントへの糞便微生物叢移植をマウスで使用すると、加齢に伴う海馬の神経炎症、メタボロームおよびトランスクリプトームの変化に対抗し、選択的な認知障害を救済した[114]。 |
| げっ歯類モデルで報告されている門の変化を比較することは、異なるモデル間でのアルツハイマー病の病因のステージングの対応がまだ標準化されていないため、依然として困難であることを強調しておく必要があります [106–108]。 さらに、これらの年齢およびアルツハイマー病に関連する微生物叢の変化が相互にどのように相互作用するかについては、さらに調査する必要があります。 さらに、共生は人間とげっ歯類の両方でアルツハイマー病の病因の共通の特徴として表示されますが、異なる特定の門が種固有の方法で影響を受ける可能性があります。 アルツハイマー病および加齢に伴う腸内毒素症に関する知識を広げるには、設定が困難であっても、ヒトを対象とした多国間および縦断的研究が必要になります。 |
| |
|
| 4.2.腸と脳のバリアの微生物叢関連透過処理の役割 |
| 腸内細菌叢組成の変化は、腸-血液関門 (「リーキーガット」) と血液-脳関門 (「リーキーブレイン」) の両方の透過性の増加につながる可能性があります [6, 115]。実際、腸粘膜層は病原体の浸潤から宿主を保護し、腸内細菌の組成がその特性を決定します。 アルツハイマー病患者では、腸のバリアの完全性の維持に寄与するいくつかの細菌株が減少しているのに対し(Akkermansia muciniphila, Bifidobacterium infantis)、上皮細胞の完全性を破壊する他の菌株は増加している(Helicobacter pylori, Shigella, Escherichia coli) [115, 116 ]。 さらに、アルツハイマー病を発症するリスクがはるかに高いイプシロン-4 対立遺伝子アポリポタンパク質 E (ApoE4) キャリア [3、29、68] は、Ruminococcaceae などの保護的 短鎖脂肪酸産生細菌の存在量が少ないことが報告されています。 それらは、腸の完全性の喪失と透過性の増加に対してより脆弱です[116]。 さらに、腸バリアの透過性により、β-N-メチルアミノ-L-アラニン(BMAA)、リポ多糖、微生物アミロイドタンパク質などのアルツハイマー病腸内毒素症関連の腸内細菌叢生成物が循環に到達し、特に中枢神経系に入る可能性があります。血液-脳関門が透過処理されている場合 (下記参照)、神経変性、認知障害、アストログリオーシス、細胞内神経原線維変化の蓄積、および脳アミロイドーシスを促進します [6]。 特に、curli などの腸内で産生される微生物アミロイドタンパク質は、プリオンのような方法で脳の アミロイドβ 凝集をクロスシードし、その後、脳と末梢の両方で炎症反応を誘発する可能性がある [117]。 |
| 腸のバリア機能不全は、炎症性細菌由来のエンドトキシンと代謝産物の血流への移行をもたらし、血液-脳関門の透過性の変化に寄与する可能性があるため、「リーキーブレイン」の原因となる可能性があります。関連する血液-脳関門の完全性の低下は、先天的な神経炎症と神経変性の促進に寄与する可能性があります[115、116]。神経変性およびアルツハイマー病の病理に影響を与える可能性がある特定の腸産生代謝物は、微生物由来の代謝物トリメチルアミン N-オキシド (TMAO) および胆汁酸のように脳に浸潤することができる [116] (図 1)。 実際、アルツハイマー病患者と認知機能が正常な個人の死後脳サンプルで測定された胆汁酸を比較したメタボロミクス分析では、認知機能の低下と二次胆汁酸(デオキシコール酸やリトコール酸など)の量の増加との関連が示されました。 これは、一次胆汁酸から腸内微生物叢によって生成されます [118]。 さらに、脳のアミロイド沈着は、循環リポ多糖と正の関連があるが、酢酸、吉草酸、プロピオン酸とも正の関連があり、循環酪酸と負の関連がある [119]。 |
| |
|
| 4.3.介入的アプローチと腸内毒素症/神経炎症/アルツハイマー病の相互作用 |
| 腸内毒素症を アルツハイマー病の病因に結び付けるメカニズムを理解するための別の有用なアプローチは、宿主機能に対する腸内細菌叢の影響の重要な時期である、初期の腸内細菌叢の変化の結果を評価することです。 アルツハイマー病様アミロイドーシスの2つのマウスモデル(APP/PS1 [120]およびAPPPS1 [121])に適用された広域抗生物質カクテルは、特にLachnospiraceae科およびS24-7属の微生物叢組成の重大な変化と脳アミロイドーシスの有意な減少をもたらしました[121]。 抗生物質で治療されたマウスは、血液と脳の両方でTregレベルの上昇を示しましたが、Th1、Th2、およびTh17 CD4 + T細胞サブセットでは違いは観察されませんでした。 免疫活性化は、IL-6レベルの低下と同様に[121]、IL-1β、インターロイキン-2 (IL-2)、インターロイキン-3 (IL-3)、CC モチーフ ケモカイン リガンド-11 (CCL11)、および幹細胞因子 (SCF) の血中濃度の上昇によっても証明されました。 脳の免疫環境を反映する脳脊髄液の免疫プロファイリングは、IL-1β、CCL11、および IL-6 発現の変化なしに、IL-2、IL-3、および幹細胞因子の減少を示した [121]。 注目すべきは、男性と女性で表現型が異なるため、抗生物質の効果はホルモンの影響を受けた可能性が高いことです。循環する炎症誘発性物質 (IL-1β、IL-2、IL-3、IL-6、CCL11、CCL5、CXC モチーフ ケモカイン リガンド-5 (CXCL5) および幹細胞因子) の減少と抗炎症性物質 (例: IL-10) サイトカイン/ケモカインは雄の APPPS1 マウスで報告されたが、雌では反対のことが観察された [122]。さらに、アミロイドβ関連のミクログリアの反応性は、抗生物質で処理されたマウスでは大幅に減少しました。 これは、 Allobaculum と Akkermansiaなどの特定の微生物属の変化に付随して、抗生物質治療が恒常性M0からDAM / MGnDトランスクリプトームプロファイルへの移行を妨げた雄マウスで特に観察された[122]。 |
| すでに説明したように、ミクログリアは、微生物叢の作用を末梢から中枢の炎症性変化に変換する際に中心的な役割を果たします。これは、状況によってはアルツハイマー病に有益である可能性があります。 実際、無菌APPPS1マウスに微生物叢が存在しないことは、ミクログリオーシスと炎症誘発性サイトカインの皮質産生の両方を減少させ、疾患の進行を遅らせることが実証された[105]。 微生物叢の欠如は、無菌野生型 [36] と APPPS1 マウス [105] の両方で、ミクログリア数と成熟表現型の欠陥につながります。 驚くべきことに、GF APPPS1 マウスに APPPS1 または従来のマウスの微生物叢が定着すると、アミロイドβ の病理が悪化し、それに応じてミクログリアの表現型が変化する [105]。 |
| このレビューの範囲を超えていますが、他の神経変性疾患に対する微生物叢の影響は、アルツハイマー病で見られる変化と類似点と相違点の両方を共有しています。ほとんどの研究では、パーキンソン病内毒素症には、Enterobacteriaceaeの存在量の増加と、Bacteroidetes、Lachnospiraceae、および Prevotellaceae の存在量の減少が含まれていることが報告されています [123, 124]。 アルツハイマー病と腸内細菌叢の冒頭で説明したように、神経炎症とミクログリアの関与との関連性は、アルツハイマー病で報告されている Firmicutes の減少と Bacteroidetes 門の増加とは対照的です [88]。しかし、アルツハイマー病における アミロイドβ との類推により、腸内微生物叢は、α-シヌクレインの凝集、ミクログリアの活性化、脆弱な脳領域における TNFα および IL-6 の誘導に必要である [125]。 パーキンソン病患者の腸内細菌叢異常は、セルロース分解細菌の減少と特に関連している [126]。 ヒト α-シヌクレインを過剰発現する無菌マウスに 短鎖脂肪酸の混合物を補充した動物研究では、パーキンソン病の病因における神経炎症の誘発における短鎖脂肪酸の重要な役割が見事に確認された [125]。 これは、老化の過程で短鎖脂肪酸が発揮する可能性が高い抗炎症作用とは対照的である [104] (アルツハイマー病と腸内細菌叢: 神経炎症およびミクログリアの関与との関連性)。 多発性硬化症に関しては、健康な対照と比較して、寛解期の患者でAkkermansia muciniphilaとMethanobrevibacter smithiiの増加、およびButyricimonasの減少が報告されている[127]。 アルツハイマー病およびパーキンソン病の変化と同様に、多発性硬化症患者由来の A. muciniphila は、in vitro (ヒト末梢血多形核細胞) と in vivo (無菌マウスでの定着後) の両方で炎症誘発性反応を引き起こします。逆に、健康な被験者よりも多発性硬化症患者に少ない Parabacteroides distasonisは、抗炎症性 IL-10 発現 Treg を誘発する [128]。 |
| 全体として、一致したデータは、一般的な神経変性疾患の病理学、特にアルツハイマー病のアミロイド病理学の発達に対する腸内微生物叢の影響を強調しています。 蓄積されたデータは、ミクログリア調節を介した微生物叢と神経炎症との間の関連性を示している [129] (図 2)。これには、少なくともアルツハイマー病における病因の発症前の潜伏期間が含まれる。その上、最近出現した新しい概念によれば、アルツハイマー病は単なる神経学的疾患としてではなく、全身疾患として考慮されるべきであることを心に留めておくことが重要です[10、130]. すでに議論したように (アルツハイマー病: 神経炎症の役割)、この新しい概念によれば、アルツハイマー病における炎症は神経炎症に限定されず、末梢、全身、および 中枢神経系炎症コンパートメント間の持続的な相互作用を伴う全身性炎症も包含する [10 ]、そしてアルツハイマー病の病状は、多くの心血管、肝臓、腎臓、代謝、およびその他の全身機能障害と関連していることが多い[130]。 最も重要なことに、これらの追加の全身異常は、例えば、単球、赤血球、リンパ球、好中球、および肝細胞を介した取り込み、食作用またはエンドサイトーシスによる末梢クリアランスなど、アミロイドβの末梢代謝の障害を伴う可能性がある[130]。 腸内微生物叢が循環からのアミロイドβのそのような末梢クリアランスにどのように影響するかは現在不明ですが、好中球に対する微生物叢の影響は十分に文書化されています[131]。かなりの量の アミロイドβ が末梢で産生され [130]、腸 [132] を含む末梢の アミロイドβ が脳に到達する可能性があるため、これらの質問に答えることが重要です。 将来の研究は、アミロイドβに関連した腸内微生物叢の変化が炎症/神経炎症の原因であるかどうか、または腸内細菌叢異常がアミロイドβ誘発性炎症/神経炎症の結果であるかどうかを明らかにするのに役立つでしょう。 注目すべきは、これら 2 つの可能性は排他的ではなく、どちらもアルツハイマー病 の病因を助長する悪循環の一部である可能性があることです。 |
| |
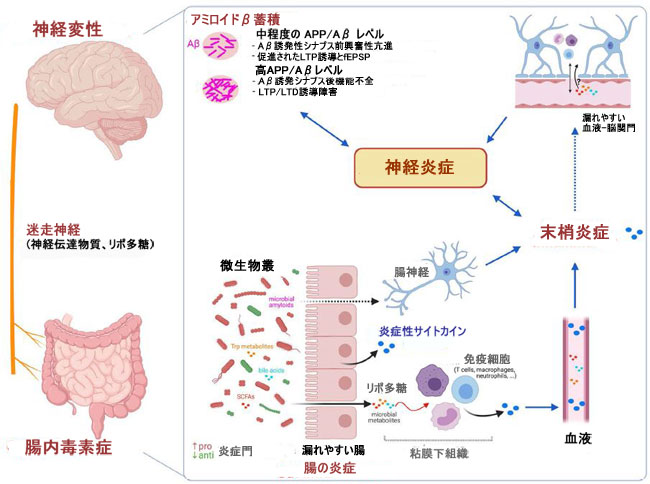 |
| 図 2 腸内毒素症と アルツハイマー病の病因につながるメカニズムとの間の仮説上の関連性 |
| アルツハイマー病患者の腸内微生物叢の組成と機能の変化は、腸のバリアとおそらく血液-脳関門の透過性を増加させ、腸と中枢神経系レベルで炎症を促進するという悪循環を生み出します. アルツハイマー病の初期段階(低濃度のアミロイドβ)は、グルタミン酸作動性神経伝達の増加に続く海馬の錐体ニューロンの興奮性の増加によって特徴付けられます。これは、シナプス前の促進、fEPSPおよびLTPの強化につながります。 逆に、アルツハイマー病の後期段階 (高濃度の アミロイドβ) は、興奮性と fEPSP の顕著な減少、LTP の減少、LTD の増強と関連しており、シナプス AMPA 受容体の数の減少と進行性記憶喪失に関連していると考えられます。 Biorender.com で作成 |
| |
|
| 5.微生物叢を介した免疫調節による神経活動の改善を目的とした推定介入 |
|
| 5.1.末梢免疫調節によるアルツハイマー病関連神経機能の回復 |
| 過去 10 年間、アルツハイマー病様の病理の発症前のげっ歯類モデルにおける初期の末梢免疫調節は、LTP 障害を含む疾患のさまざまな特徴に大きな影響を与えることを説得力をもって示しました。認知症状の発症前の末梢 TNFα の阻害 (アンタゴニストの皮下注射による) は、TgCRND8 マウスモデルの神経細胞の興奮性と可塑性を回復させ、これらの効果は症状の段階でも持続する [61]。この治療法はまた、LTPの障害を救済し、浸潤したCD4 + T細胞を含む脳内の活性化された免疫細胞を減少させる[133]。同様に、3xTgAD マウスにおける TNFα の早期阻害は認知障害を予防し、同時に末梢血白血球の中枢神経系浸潤を減少させ [134]、アミロイドβ-プラーク形成を減少させる [135, 136]。このような治療は、ミクログリアの活性化、リン酸化タウタンパク質、APPの蓄積など、3xTgADマウスの他の神経病理学的特徴も減少させ、シナプス機能を維持する[135]。興味深いことに、TNFα1型死受容体(TNFR1)の欠失は、学習と記憶を改善することにより、APP23マウスの認知障害を軽減します[137]。 |
| アルツハイマー病様マウスモデルでIL-1βを阻害すると、同様の結果が観察されました。 3xTgAD マウスで IL-1 受容体を遮断すると、認知障害が救済され、ミクログリアの活性化とタウの病理が軽減される [138, 139]。 IL-1受容体拮抗薬(IL-1Ra)は、IL-1βによって引き起こされるLTP障害を逆転させることさえできる[140]。 逆に、IL-1βの過剰発現はタウのリン酸化とNFT形成を悪化させ、LTPと記憶の障害をもたらす[138]。 これらの観察結果は、以前に報告された別の炎症誘発性サイトカイン (インターロイキン-18 [IL-18]) が EPSP に与える影響との類似性から、NMDAR を介した EPSP の振幅に対する IL-1β の阻害効果に関連している可能性がある [140]。 さらに、IL-18 は Wistar ラットの歯状回における LTP の誘導を損なう可能性があり、IL-18 のアンタゴニストは、このサイトカインによって引き起こされる LTP および EPSP の低下を軽減する [140]。 さらに、低用量のIL-2の末梢投与によるTreg細胞の選択的増幅による初期の末梢免疫調節は、ミクログリア応答に影響を与え、認知障害の発症を遅らせ、APPPS1マウスの進行した疾患段階での認知機能を改善する[141]。 |
| |
|
| 5.2微生物叢を標的とすることでアルツハイマー病関連の神経機能障害を回復させる? |
| 腸内微生物叢を標的にしてそのバランスを回復することは、アルツハイマー病における有望な治療戦略となる可能性があります。 プレバイオティクス(有益な微生物の成長または活性を誘導する能力を備えた食品成分、通常は非消化性繊維化合物)、プロバイオティクス(適切な量を投与すると宿主に健康上の利益をもたらす生きた微生物)または糞便微生物叢移植(健康なドナーから糞便の溶液を移して、微生物叢関連疾患に苦しんでいる患者の腸内微生物叢を回復させることからなる)など、いくつかのアプローチが考えられます [142、143]。 |
| |
|
| 5.2.1..プロバイオティクスとプレバイオティクスのアプローチ |
| 動物モデルに関しては、i) 腸内微生物叢の摂動と末梢免疫調節 (末梢炎症/免疫に対する微生物叢の影響および神経炎症に対する微生物叢の影響) の間の説得力のあるクロストークにもかかわらず、ii) 末梢炎症と神経炎症 [7, 26, 27, 34] および iii) 神経炎症およびニューロン活動 [48] に関連して、微生物叢の調節によるシナプス活動への影響は、特にアルツハイマー病の発症前の変化を考慮すると、これまで調査されていません。 |
| 私たちの知る限りでは、1 つのレポート (以下を参照) を除いて、この文脈で公開されているすべての証拠は、進行した病理学的段階で実施された研究から得られたものです。たとえば、プロバイオティクス混合物 (VSL#3) の補給を適用して、非トランスジェニックの老齢雄 Wistar ラットの微生物叢を改変し、LTP や神経新生の欠損など、アルツハイマー病 関連の神経機能障害の加齢に伴う特徴を模倣するために使用しました。この研究では、LTPの加齢に伴う赤字の減弱、神経炎症の減少、CD68やCD11bなどのミクログリア活性の特定のマーカーの発現の減少が報告されており、これはプロバイオティクス治療後の微生物叢組成の変化と相関していた[144]。このプロバイオティクス治療は、シナプシンや脳由来神経栄養因子 (BDNF) などの神経可塑性に関連する遺伝子の脳内発現の有意な増加とも関連しており、後者は LTP と正の相関があります [84]。 5xFAD モデルを使用して、発症前の段階での LTP/LTD に対する微生物叢の影響を評価した独自の研究では、短鎖脂肪酸 (酪酸ナトリウムなど) による治療が生後 2 か月でシナプス障害を改善できることが報告されています。これは、「成功した」老化における 短鎖脂肪酸 の抗炎症能 [104] と一致しているが、パーキンソン病における短鎖脂肪酸の炎症促進効果とは対照的である [125]。 最近、健康な被験者から分離された F. prausnitzii 株 (低温殺菌または生きた) の投与が、アミロイドβ を注射したマウスモデルの認知障害を改善することが示されており、F. prausnitzii が軽度認知障害予防の有望な候補である可能性があることを示唆している [90]。 F. prausnitzii が アルツハイマー病の病因に有益な影響を与えると推定されることを確認し、F. prausnitzii が認知機能を調節する可能性があるメカニズムを解読するには、追加の アルツハイマー病様マウス モデルでのさらなる研究が必要です。 |
| プロバイオティクス投与後に観察された LTP の改善は、海馬における興奮性グルタミン酸シナプス伝達に関与する AMPAR/NMDAR 比の変化に起因する可能性がありますが、このメカニズムはアルツハイマー病様モデルではまだ直接的に対処されていません。 認知障害のない中年 Sprague-Dawley 雄ラットをプロバイオティクス (Enterococcus faecium) およびプレバイオティクス (イヌリン) 補給で 5 週間処理すると、海馬のシャファー側副シナプスで NMDAR/AMPAR 比が増加し、CA1地域での LTP の誘導が促進されました [145]。 改善された学習および記憶形成に対するプロバイオティクスとプレバイオティクスの両方の観察された相乗効果は、酪酸産生の増加とも関連しており、脳由来神経栄養因子レベルの増加と海馬の炎症誘発性サイトカインの減少につながります。さらに、プロバイオティクス補給後の腸内細菌による短鎖脂肪酸産生は、記憶形成に決定的に関与するヒストンのアセチル化を増加させることにより、LTP を増強し、オスの Sprague-Dawley ラットおよび C57BL/6 マウスの記憶形成を調節する [37]。注目すべきは、微生物叢の状況によっては、短鎖脂肪酸が有害な影響を与える可能性があることです。したがって、無菌APPPS1 マウスでは、年齢が一致した従来の方法で飼育された特定病原体を含まない(SPF)APPPS1 マウスと比較して、アミロイドβプラークと短鎖脂肪酸の血漿濃度が減少し、外因性短鎖脂肪酸の補給により、アミロイドβプラークの沈着とミクログリア障害が悪化しました。後者は、短鎖脂肪酸で処理した 無菌APPPS1 マウスのアミロイドβ プラーク付近でミクログリアの蓄積が増加しているにもかかわらず、貪食能の低下によって明らかになった [146]。 |
| プロバイオティクスとの類推により、いくつかの細菌代謝産物またはプレバイオティクスは、認知障害のない動物の認知機能、または根底にあるメカニズムにヒストンのアセチル化が関与している可能性があるげっ歯類モデルのアルツハイマー病様病理の進行段階に有益な効果をもたらす [147]。さらに、モリンダ オフィシナリス (OMO) のオリゴ糖を APP/PS1 マウスに 6 か月間補給すると、学習と記憶の障害が回復します。 モリンダ オフィシナリスはまた、モノアミン作動性神経伝達物質などの神経伝達物質の産生と分泌に関与する特定の腸内微生物に影響を与えることにより、神経伝達物質の分泌を調節する[148]。 興味深いことに、SLAB51プロバイオティック製剤(Streptococcus thermophilus, Bifidobacteria, Lactobacilli)による4か月の治療は、アルツハイマー病様病理のマウスモデル(8週齢の3xTg-AD雄)の発症前の段階で糞便中の短鎖脂肪酸産生(酢酸、プロピオン酸、酪酸)を増加させます[149]。 したがって、このプロバイオティクス製剤は、短鎖脂肪酸プレバイオティクスの中間体を介してその作用を発揮し、24 週目の新規物体認識テストで、つまりこのモデルの明らかな病理段階で認知障害の改善をもたらす可能性がある [149]。注目すべきことに、SLAB51治療による認知機能の改善の別の説明は、治療されたアルツハイマー病様マウスの脳における酸化ストレスの減少である[149]。実際、SLAB51 を 16 週間補給した 8 週齢の 3xTg-AD マウスは、活性酸素種産生を低下させ、細胞生存を促進することによって神経保護効果を促進するサーチュイン-1 (SIRT1) 依存性メカニズムの増加を示した [150]。 APP/PS1 モデルを使用した同様のより最近の研究では、Agathobaculum butyriciproducens (SR79) の 8 週間の投与により、プラークの沈着とミクログリアの活性化、アミロイドβ の減少とともに、アルツハイマー病様病理の明らかな段階での新規物体認識テストおよび Y 迷路における認知能力が大幅に改善されました。 最も重要なことは、SR79 治療により、APP/PS1 治療マウスの皮質における IL-1β および補体成分 C1QB 遺伝子の発現が有意に減少したことである [151]。 |
| 驚くべきことに、プロバイオティクスは特定のアルツハイマー病関連症状に対抗するだけでなく、アルツハイマー病治療における有望な治療補助剤となる可能性もあります。 したがって、プロバイオティック菌株 (Lactobacillus plantarum) と FDA 承認の アルツハイマー病薬メマンチンを 12 週間組み合わせることで、シナプス可塑性の障害を改善することに加えて、APP/PS1 マウスの認知機能低下と LTP 欠損を軽減することにより、その治療上の利点が強化されます。 この併用治療は、腸内微生物叢の組成を調節し、トリメチルアミン N-オキシド の合成を阻害する [152]。 さらに、Lactobacillus plantarum をメマンチンに関連付けると、脳内の アミロイドβプラークと アミロイドβ42/アミロイドβ40 比が効率的に減少しました。 プロバイオティクス菌株を単独で、またはメマンチンと組み合わせて使用した場合、神経炎症はさらに軽減されました。 これらの抗炎症作用は、アルツハイマー病様マウスの脳における線維性アミロイドβ凝集体の蓄積を促進することが知られている[153]、クラステリンの血漿レベルの低下と関連していた[152]。 |
| いくつかのヒト研究では、アルツハイマー病患者の認知能力に対するプロバイオティクスの有益な効果が報告されていますが、その効果はステージに依存していました。 60 人の アルツハイマー病患者(年齢範囲 60 ~ 95 歳)を対象としたランダム化二重盲検プラセボ対照試験では、プロバイオティクス製剤(Lactobacillus casei, Lactobacillus acidophilus, Lactobacillus fermentum and Bifidobacterium bifidum)が使用されました。これは被験者の半分に投与され(2 × 109 CFU / g)、残りの半分は12週間プラセボを投与されました. プロバイオティクス治療を受けた患者は、スコアがわずかに悪化したプラセボ群 (-5.03% ± 3.00) と比較して、統計的に有意な認知 MMSE スコアの改善 (+ 27.90% ± 8.07) を示しました。 興味深いことに、プロバイオティクス治療は、全身性炎症の一般的なマーカーであるC反応性タンパク質(CRP)の血清濃度も低下させた[154]。 対照的に、類似しているが濃縮されたプロバイオティック製剤(Lactobacillus casei, Lactobacillus acidophilus, Lactobacillus fermentum, Lactobacillus lactis, Lactobacillus paracasei, Lactobacillus plantarum, Lactobacillus salivarius, Bifidobacterium bifidum およびBifidobacterium lactisの2株)を使用した最近の研究では、 20 人の アルツハイマー病患者 (年齢範囲 60 ~ 93 歳) のコホートにおける (4 週間) 治療では、初期 MMSE スコア (18.5±7.7) の有意な変化は報告されなかった [155]。 注目すべきは、プロバイオティクス処理により、糞便検体中の F. prausnitzii が増加し、免疫活性化の血清バイオマーカーが変化したことです。 血清キヌレニン濃度は、キヌレニン/トリプトファン比の付随する増加とともに減少し、炎症マーカーであるネオプテリンの血清レベルの増加とさらに相関していた[155]。 著者らは、この設定でのプロバイオティクス治療は、マクロファージおよび/または樹状細胞の活性化と関連している可能性があることを示唆しています。. それにもかかわらず、サンプルサイズが限られており(n = 20人の患者)、研究はプラセボ対照ではなかったため、これらの結論は慎重に取られるべきである[155]。 さらに、Lactobacillus acidophilus、Lactobacillus fermentum、Lactobacillus plantarum、Bifidobacterium bifidum、Bifidobacterium lactis、および Bifidobacterium longum を含む同様の (ただし同一ではない) プロバイオティクス製剤を、重度のアルツハイマー病患者 (n = 48) にプラセボに対して 12 週間投与した場合、無作為化、二重盲検試験では、認知スコア(Test Your Memory、TYMスケール)の改善や、プロ(TNFα、IL-6)または抗(IL-10)炎症性サイトカインの血清レベルの変化はありませんでした[156] 。 |
| 興味深いことに、病理学の初期段階で適用した場合、Bifidobacterium breve (A1 株) のプロバイオティクス製剤は、24 週間の補給後に 19 人の (登録された 27 人中) 軽度認知障害被験者の認知機能低下を遅らせた [157]。 この後者の研究は非盲検の単群設定で実施されたため、アルツハイマー病の初期段階に適用された場合、そのようなプロバイオティクス治療のより高い効率を結論付ける前に、これらのデータは二重盲検無作為化プラセボ対照研究で確認する必要があります。 |
| ただし、前述の有益な効果または中立的な効果に加えて、一部の研究ではプロバイオティクス治療の悪影響が報告されていることを強調する必要があります。 被験者を無作為に割り付けた二重盲検プラセボ対照試験では、一般集団から登録された(平均年齢61.8歳±7.3歳、範囲48〜79歳)の健康な被験者のコホート(研究終了時n = 124)に、プロバイオティクス製剤(Lactobacillus casei、Shirota 菌株:6.5 × 109 生菌)を 3 週間、乳飲料に入れて与えました。 研究終了の 2 週間後、プラセボ群はプロバイオティクス治療群よりも意味記憶テスト (Wechsler Memory Scale、1998) で有意に優れた認知能力を示した (p < 0.02) [158]。 このようなプロバイオティクスの悪影響の理由は不明のままですが、著者らは、被験者数が比較的少ないことによる「偶然の影響」である可能性があることを示唆しており、最終的な結論を引き出す前に研究の再現が必要であると述べています[158 ]。 |
| 要約すると、認知パフォーマンスが読み取り値として使用された人間の研究、および動物モデル(認知機能の上流のメカニズムを評価できる)でいくつかの有望な結果が得られたにもかかわらず、現在、プロバイオティクス治療の有益な効果に関するコンセンサスはありません。 これは、少なくとも部分的には、そのようなプロバイオティクスの評価が異なる i) 配合 ii) 濃度 iii) 治療期間 iv) アルツハイマー病病理の段階; v) 読み出し、すなわち、認知機能または基礎となる細胞 (LTP、LTD…) および分子 (シナプス受容体およびタンパク質発現) プロセス研究のデザインに固有のものである可能性があります。 したがって、アルツハイマー病における提案された臨床応用に照らして必要とされる、それらの影響に関する結論を引き出すためにそれらの比較を可能にするパイロット臨床研究における標準化されたプロバイオティクス製剤を確保するために、将来の作業が必要である[159]。 |
| さらに、プロバイオティクスとプレバイオティクスの有益な効果が、飽和脂肪、動物由来のタンパク質、精製糖の摂取量が少ないことと相まって.植物ベースの食品、プロバイオティクス、抗酸化物質、大豆、ナッツ、オメガ-3 多価不飽和脂肪酸の高摂取からなる健康的な食事によってさらに強化されるかどうかはまだ確立されていません。 そのような食事は、認知障害のリスクを低下させ、最終的にはアルツハイマー病のリスクを低下させることが実際に知られている[160](図3)。 |
| |
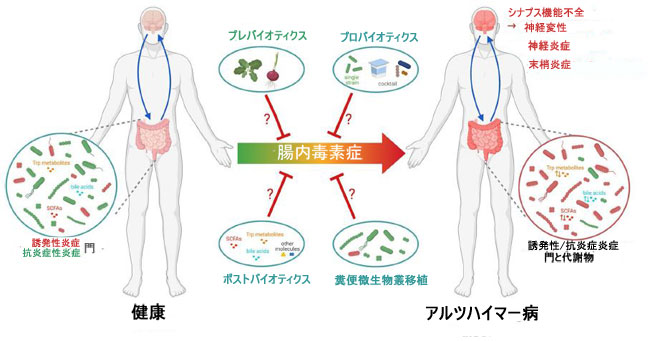 |
| 図3 推定微生物叢ベースの介入の治療可能性 |
| アルツハイマー病は、炎症誘発性(赤い微生物)の増加と抗炎症性(緑色の微生物)の門の減少、および微生物代謝産物量の変化を特徴とする腸内毒素症と関連しています。 地理的および民族的要因によって有意差が存在しますが、ほとんどの研究でアルツハイマー病患者ではBacteroidetesの増加とFirmicutesの減少(それぞれ炎症誘発性門と抗炎症性門)が報告されています(アルツハイマー病と腸内毒素症:: 神経炎症とミクログリアの関与との関連性を参照してください)。 |
| プレバイオティクス (食品の非消化繊維成分) は、微生物叢の成長を刺激する能力があり、有益な作用があります。たとえば、短鎖脂肪酸産生微生物などです。 プロバイオティクスは、例えばF. prausnitziiなどの生きた微生物 (単一株または複数株のカクテル) であり、宿主に有益な効果をもたらします。 ポストバイオティクスは、例えば短鎖脂肪酸などの微生物叢によって生成される代謝産物です。糞便微生物叢移植は、患者の微生物叢の組成と機能を回復するために、健康なドナーから糞便を移すことから成ります。 これらのアプローチはすべて、有害な末梢炎症、神経炎症、シナプス機能障害、およびその後の神経変性への移行を防ぎ、それによって疾患の進行を遅らせる保護治療戦略を表すことができます (詳細については、微生物叢を標的とすることによる AD 関連神経機能の回復を参照してください)。 Biorender.com で作成されました。 |
| |
|
| 5.2.2. 糞便微生物叢移植(FMT)アプローチ |
| 現在、糞便微生物叢移植が動物モデルで アルツハイマー病様の病理を修正しようとした研究はわずかしかありません。 APP/PS1 マウス (生後 6 か月) を対象とした最近の研究では、抗生物質による 3 日間の治療によって内因性微生物叢を除去した後、同年齢の健康な WT ドナーからの糞便微生物叢移植を 1 か月以上投与した場合に、アルツハイマー病の病状に対する世界的な有益な影響が示されました。 [161]。 特に、糞便微生物叢移植は、処理されたAPP / PS1マウスの腸内細菌叢と糞便短鎖脂肪酸レベルを回復し、アミロイドβ40とアミロイドβ42の脳蓄積を軽減し、タウタンパク質の過剰リン酸化、炎症マーカー(COX-2とCD11b)、プレ(シナプシン-1)およびポスト(PSD95)シナプスタンパク質の発現低下と認知を正常化した[161]。。 一貫して、同じ APP/PS1 モデルが 16 か月齢の APP/PS1 (明白な病理段階に対応する) からのドナー糞便を使用して、発症前の段階 (3 か月齢) で糞便微生物叢移植によって処理された場合、蓄積の有意な加速の アミロイドβ プラークが見られた [162]。 ミクログリアに変化はなかったが、星状細胞の形態の変化が観察され、それらの機能障害を連想させた[162]。一致して、生後 2 ヶ月の WT マウスをレシピエントとして、生後 9 ヶ月の 5xFAD マウス (病理学の明らかな段階) を糞便ドナーとして使用する反対のアプローチでは、糞便微生物叢移植処理された WT マウスは認知機能の障害を示しました。 これは、海馬神経新生の減少、ミクログリア活性化の増加、および海馬と血漿の両方における炎症誘発性(TNFα、IL-1β)サイトカイン発現と関連していた[163]。 認知機能障害の誘発における5xFAD由来の微生物叢の重要な役割は、この研究では、生後9ヶ月の(健康な)WTマウスから糞便微生物叢移植を受けた生後2ヶ月のWTマウスに認知的変化がないことにより、さらに強化された[163]。 驚くべきことに、内因性微生物叢を排除し、成体動物への移植微生物叢の成功した生着を可能にするだけでなく、長期的な免疫調節を達成するために抗生物質治療が使用された場合、別の実験設定ではまったく異なる結果が得られました。 後者のパラダイムでは、抗生物質は離乳前(生後2〜3週)に適用され、糞便微生物叢移植はAPPPS1マウスへの抗生物質治療の終了の1日後に投与されましたが、その後の分析は9週齢で行われました。 抗生物質/糞便微生物叢移植で処理した APPPS1 マウスで得られたデータは、アミロイドβ アミロイドーシスと、プラーク関連ミクログリア、プレ (シナプトフィジン陽性) およびシナプス後 (PSD95 陽性) ニューロンの形態が、糞便のドナーかどうかに関係なく、回復したことを示しました。問題はWTまたはAPPPS1マウスでした[164]。 これらの研究 [163, 164] 間の不一致の理由は不明のままですが、発達段階 (成人対出生後)、異なる アルツハイマー病様病理モデルおよび抗生物質カクテル組成、個々の抗生物質濃度および治療期間に関連している可能性が最も高いです。 |
| ヒトでの研究を考慮すると、糞便微生物叢移植はこれまでに承認された単一の適応症、つまり反復性クロストリジオイデス・ディフィシル感染症の治療を受けています。 ごく最近では、研究はアルツハイマー病を含む他の治療手段に焦点を当てていますが、そのような糞便微生物叢移植研究はこれまでヒトで発表されていません。 ユニークな以前の研究 (NCT03998423; https://www.clinicaltrials.gov/) は、残念ながら、重症急性呼吸器症候群コロナウイルス 2 (SARS-CoV2) パンデミックにより中断されました。それにもかかわらず、アルツハイマー病様の病状の動物モデルにおける糞便微生物叢移植研究は、神経炎症、アミロイドβ蓄積およびシナプス機能不全の減少に関して、世界的に有望な結果を示した(研究間にはまだいくつかの不一致があるが、上記参照)[143, 161-165]. |
| 全体として、利用可能なデータは、微生物叢および/またはそれらの代謝産物を操作することが、アルツハイマー病における最適なシナプス可塑性および関連する認知機能を、周辺と中枢神経系の両方で少なくとも自然免疫および適応免疫を調節することによって間接的に回復するための潜在的な革新的で魅力的かつ非侵襲的な治療アプローチであることを示しています(図3)。 ただし、動物研究から得られるほとんどのデータは、進行した病理学的段階にのみ関連しており、病因の初期段階を評価するには将来の研究が必要です。 さらに、プロおよびプレバイオティクスを使用したアプローチと同様に、糞便微生物叢移植の分野でも標準化が緊急に必要とされています。 標準化する必要があるパラメーターには、次のものが含まれます。i) 糞便微生物叢移植に適した アルツハイマー病 病理のステージ。 ii) ドナーの微生物叢の生着を最適化するために、レシピエントの腸内環境を準備する (抗生物質に対する腸洗浄、組成、濃度、持続時間)。 iii) 糞便の起源 (単一または複数のドナーから、新鮮か冷凍かなど); iv) ドナーの遺伝子型 (例えば、遺伝的危険因子の存在または除外)。現在の標準化の欠如は、この分野の進歩を深刻に妨げたり遅らせたりする可能性があります。 |
| |
|
| 6.結論と今後の方向性 |
| 現在利用可能なアルツハイマー病の治療法は、ほとんどが対症療法であり、利益は比較的限られています。したがって、革新的で早期に適用可能な治療法を開発することが不可欠であり、主要な認知障害が発症する前にそのような治療法を開始することで、その有効性が向上する可能性があります。腸内細菌叢の変化は脳活動の変化を誘発する可能性があるため、腸内細菌叢の操作は アルツハイマー病の潜在的な治療標的として浮上しています。微生物叢を調節するためのさまざまな戦略 (プロまたはプレバイオティクス治療、糞便微生物叢移植など…) を使用した奨励データは、げっ歯類モデルの アルツハイマー病様病理の進行した段階で適用された場合でも、認知障害の改善に役立つようです。最近報告された調査結果は、そのような動物モデルでは発症前の段階で微生物叢の変化が検出可能であることを支持しており[106-108]、アルツハイマー病病因の初期段階での腸内微生物叢の変化も有益である可能性があることを強く示唆している。 したがって、潜在的な発症前の段階での微生物叢の早期の修正は、アルツハイマー病の治療のための有望な治療アプローチになる可能性があります。 |
| さらに、治療目的で微生物叢と脳の相互作用を直接調節する手段として、迷走神経刺激を使用する可能性が最近浮上しています。 脳と腸の間の直接的なコミュニケーションにおける迷走神経の役割は、現在広く認識されています [4, 7]。 迷走神経の耳介刺激は、特定の神経学的および神経精神医学的状態の治療的取り扱いにますます使用される非侵襲的アプローチである [166]。 この治療法は、耳からの感覚頸枝を備えた共通の頭蓋幹を持つ迷走神経の解剖学に依存しています[167–169]。 驚くべきことに、迷走神経刺激はすでにアルツハイマー病患者のコホートで6〜12か月間適用されており、有意な認知増強効果が得られています[170、171]。 根底にあるメカニズム、特に微生物叢の変化が含まれているかどうかを解読するには、今後の研究が必要です。 |
| 結論として、腸 - 脳軸に沿った腸内微生物叢と 中枢神経系間の間接的および直接的なコミュニケーション (図 2) は、中枢神経系障害における非侵襲的で手頃な価格の治療革新の理論的根拠を提供します。これらは、アルツハイマー病だけでなく、微生物叢の異常が報告されている他の神経学的および精神医学的障害の文脈においても、公衆衛生政策によってより広く利用される可能性があります。炎症誘発性門と抗炎症性門との間の不均衡として現れるこのような共生異常は、異なる神経変性疾患における異なる分類群に関係している可能性がありますが、神経変性関連の共生障害の結果は同様に見えます。それらは、腸内の炎症誘発性状態への移行を伴い、腸透過性の増加とそれに続く末梢炎症反応の誘発をもたらし、それが神経炎症に影響を与え、神経機能を損ないます。この観点から、微生物叢は末梢炎症/神経炎症の上流にあるため、免疫機能を直接標的にするのではなく、間接的に免疫調節を達成するために微生物叢を標的にすることは魅力的な可能性として現れます。上流の炎症誘発性腸内毒素症を断つことなく直接免疫調節を誘導することは、微生物叢を標的にしてその炎症誘発性成分に対抗するよりも効果が低い可能性があります。ただし、これは、微生物叢と免疫系の両方を標的とする可能性のある組み合わせ免疫調節アプローチを排除するものではなく、単一標的アプローチよりも効率的であることが判明する可能性があります。 |
| |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| |
この文献は、Mol Neurodegener. 2022; 17: 19.に掲載されたMicrobiota in neuroinflammation and synaptic dysfunction: a focus on Alzheimer's disease. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |

