ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
プロバイオティクス:腸から健康を守る |
Gael Urait Varela-Trinidad et al., |
|
|
概要 |
| 腸内微生物叢 (GM) は、人間の消化管内の数十億の微生物で構成されています。この微生物群集は、多くの生理学的機能を発揮します。これらの機能の中で際立っているのは、腸細胞および免疫応答に関与する細胞を強化する栄養素の取り込みによる宿主免疫への影響です。腸内微生物叢の生理学的機能は腸に限定されませんが、腸内微生物叢とさまざまな腸外器官との間の双方向の相互作用が確認されています。これらの相互作用は、何人かの著者によって有機間軸と呼ばれており、その中で腸-脳、腸-皮膚、腸-肺、腸-心臓、および腸-代謝軸が際立っています。腸内微生物叢のバランスが取れている場合、生物は健康である、または恒常性にあることが示されています。ただし、変更された腸内微生物叢または dysbiosis(訳者注:腸内毒素症、以下腸内毒素症と記載) は、多くのローカルおよび全身疾患の病因における重要な要因を表します。したがって、プロバイオティクスはこの文脈に介入し、公開されたさまざまな研究によると、腸内微生物叢でバランスを維持し、個人の健康につながります。 |
| 目次(クリックして記事にアクセスできます) |
| 1. 腸内細菌叢と腸内毒素症 |
| 1.1腸内毒素症とその健康への影響 |
| 1.2. プレバイオティクス、プロバイオティクス、シンバイオティクス、ポストバイオティクス |
| 2. 微生物叢 - 腸 - 脳軸 (MGB) |
| 2.1. アルツハイマー病 |
| 2.2. パーキンソン病 |
| 2.3. 自閉症スペクトラム障害 |
| 2.4. 多発性硬化症 |
| 2.5. うつ病と不安 |
| 3. 微生物叢 - 腸 - 皮膚軸 (MGS) |
| 3.1. アトピー性皮膚炎 |
| 3.2. 乾癬 |
| 3.3. にきび |
| 4. 微生物叢 -腸 - 肺軸 (MGL) |
| 4.1. 慢性閉塞性肺疾患 |
| 4.2. 喘息 |
| 4.3. COVID-19(新型コロナウイルス感染症) |
| 5. 微生物叢 - 腸 - 心臓軸 (MGH) |
| 5.1. 高血圧症 |
| 5.2. アテローム性動脈硬化症 |
| 5.3. 冠動脈疾患 |
| 5.4. 心不全 |
| 6. 微生物叢と他の代謝変化との関係 |
| 6.1. 肥満 |
| 6.2. 2型糖尿病 |
| 7. 結論と今後の展望 |
1. 腸内細菌叢と腸内毒素症 |
| 人体は約 3.9 × 1013 のバクテリアと直接接触しており、バクテリアは外部環境と接触するすべての表面と空洞にコロニーを形成し、体の適切な機能と健康のために共生関係を維持する必要があります。このため、ヒト微生物叢 (HM) という用語は、細菌、真菌、原生動物、ウイルスなどを含むこれらの微生物を指すために使用されます [1]。細菌の割合は他の微生物の 2 ~ 3 倍であるため、研究は主に細菌群集の構成と機能の分析に焦点を当ててきました [2,3]。細菌とヒト細胞の比率は 1:1 であり、細菌は約 330 万の非自己遺伝子の原因であると推定されています。これは、ヒトゲノム自体の 150 倍の遺伝情報が寄与していることを意味します [3,4,5]。これにより、ヒト微生物叢は人体の「隠れた器官」と見なされるようになりました。さらに、ヒト微生物叢は、宿主に利益をもたらすさまざまな生理機能と代謝活動に関与しています [5]。 |
| ヒト微生物叢は、皮膚、口腔、結膜、呼吸器、泌尿生殖器、および胃腸 (GI) 管などの外部環境と接触する上皮および粘膜表面に見られるいくつかの異なる微生物群集で構成されています [2]。 胃腸管は、250 から 400 m2 の表面積を持つ、人体で最大の上皮表面の 1 つを持っているため [6]、人体の全細菌の 70% が結腸だけに存在すると推定されており [1]、腸内細菌叢 (GM) と呼ばれています [2,7]。 腸内には 500 種以上の細菌が存在し、最も一般的なのはBacteroidetes門とFirmicutes門に属し、Proteobacteria, Actinobacteria, および Verrucomicrobiotaがそれに続きます [8,9]。 |
| 腸内細菌叢の代謝機能は食事の基質を変換し、新しい代謝産物、多糖類、短鎖脂肪酸 (SCFA)、ビタミンK、葉酸、およびアルギニンやグルタミンなどのアミノ酸を生成します [4,10]。 さらに、腸内細菌叢は、物理的な保護を提供し、細菌、抗原、炎症誘発性因子、または他の代謝産物の侵入を防ぐことによって免疫系に影響を与えるため、重要な免疫調節の役割を果たします。 また、バランスのとれた免疫応答を維持するために、制御性 T 細胞 (Treg) および抗炎症性サイトカインの誘導を通じて細菌に対する耐性を促進します [6]。 |
| 腸内細菌叢と宿主の間の共生的相互作用は、腸の恒常性の維持に寄与し、自然免疫および獲得免疫応答に影響を与えます。これにより、これらの相互作用は健康の調節において重要な役割を果たします。 |
| 1.1 腸内毒素症とその健康への影響 |
| とりわけ、食事、年齢、抗生物質の消費、タバコの消費、ライフスタイルなどの要因は、腸内細菌叢の構成と機能に影響を与え、変更する可能性があります[11,12]。 この腸内細菌叢の変化は腸内毒素症 (ID) と呼ばれ、通常、病原体の増殖と多様性と共生細菌の喪失によって特徴付けられます [12]。 |
| 病原性因子を介して宿主に害を与える可能性のある細菌である病原体と、特定の状況で有害になる可能性がある共生細菌である病原体は、腸内毒素症中に存在量を増加させ、宿主の恒常性と代謝プロセスを混乱させます [13,14]。腸内毒素症状態では、病原性細菌は炎症誘発性代謝産物、デオキシコール酸やリトコール酸などの有害な二次胆汁酸、および硫化水素を生成し、これらはすべて腸上皮の炎症状態の悪化に寄与します [15]。 |
| 特に、腸内毒素症は消化管の病状だけでなく、腸管外器官に起因する疾患にも関与しています [12]。 改変された腸内細菌叢は、これらの有害な代謝産物を介して免疫系と通信し、相互作用することができます。これにより、血流に入り、脳、肺、心臓、皮膚などの遠位器官に到達する炎症誘発性細胞、サイトカイン、および代謝産物の数が増加します。 それらはこれらの器官の炎症状態に寄与します。 |
| 腸内細菌叢と腸外器官との間の相互作用はグループ化されており、器官間軸と呼ばれています [16]。腸内細菌叢は、炎症を悪化させたり症状を改善したりする代替手段を提供することにより、腸管外のこれらの特定の臓器における疾患の発症または緩和に不可欠な役割を果たすことが現在十分に確立されています。 |
| 1.2 プレバイオティクス、プロバイオティクス、シンバイオティクス、ポストバイオティクス |
| 腸内細菌叢のバランスを回復することは、ダイナミズムと免疫系の機能を促進することが十分に確立されています[17]. 近年、宿主の健康状態を改善するために腸内細菌叢を調節する能力があるため、バイオティクスが研究されています。 バイオティクスという用語は、ホメオスタシスに影響を与えるプレバイオティクス、プロバイオティクス、シンバイオティクス、およびポストバイオティクスを指します。 |
| 最後に、ポストバイオティクスは、微生物がその代謝活動を通じて放出する特定の生理活性化合物であり、宿主にも有益な効果を発揮します [22]。 このグループには、有機酸、炭水化物、脂質、タンパク質、ビタミン、表面タンパク質、およびリポ酸やペプチドグリカンの誘導体などの複雑な分子が含まれますが、これらに限定されません [23]。 |
| このレビューでは、腸内細菌叢が関与する最も研究されている微生物叢 - 腸 - 脳軸、微生物叢 - 腸 - 皮膚軸、微生物叢 - 腸 - 肺軸、微生物叢 - 腸 - 心臓軸などの腸外器官、 微生物叢と肥満や糖尿病などの代謝性疾患との相互作用を分析します。 また、腸内毒素症中にこれらの臓器の病理がどのように影響を受けるかについても説明します。 最後に、経口プロバイオティクスを代替または補完療法として投与した以前の研究と、それらの使用がこれらの軸に関連する疾患の症状を改善するかどうかを検討します。 |
| 2. 微生物叢 - 腸 - 脳軸 (MGB) |
| 神経系は、脳と脊髄を含む中枢神経系 (CNS) と、人体の器官に接続された神経枝を生じさせる神経節からなる末梢神経系 (PNS) で構成されています [24 ]。 末梢神経系は、体性神経系と自律神経系に分けられます。 後者は不随意であると考えられており、中枢神経系と消化管の間の双方向通信を可能にするさまざまな交感神経および副交感神経線維を統合する腸神経系 (ENS) を含むいくつかのバリアントがあります。 2 つのシステム間の実際的な連携により、腸神経系は人体の 2 番目の脳、または小さな脳と見なされるようになりました [25,26]。 |
| 腸神経系は消化管全体に広がっており、粘膜下層と腸間層の 2 つの神経叢に分かれています。 これらの神経叢は、運動性と蠕動運動を制御し、さらには腸粘膜の免疫を調節するさまざまな種類のニューロンによって構成されています [27]。 腸内細菌叢を構成する数百万の細菌は、腸神経系の近くにあります。 腸内細菌と中枢神経系の間に通信システムが存在することさえ観察されています。 これらの発見は、「微生物叢 - 腸 - 脳軸」の説明につながりました。 この軸には、消化管レベル、中枢神経系、および腸内細菌自体で恒常性プロセスを調節するためのさまざまな生物学的システム間の接続が含まれます [16,28]。 |
| 微生物叢 - 腸 - 脳の軸は、腸内細菌叢の内容をさまざまな神経変性疾患、発達障害、および気分の変化に関連付けることに成功しています [29,30,31,32,33,34,35,36]。 これらの疾患と腸内細菌叢との関係は、主に、免疫調節因子および神経化学的因子として作用するいくつかの細菌代謝産物に関連しています [37,38,39]。 |
| 調節に関与する細菌代謝物には、主に 短鎖脂肪酸(SCFA)、さまざまなトリプトファン代謝物、および微生物神経伝達物質が含まれます (図 1) [37]。短鎖脂肪酸は炭素原子が 6 個以下の脂肪酸で構成され、最も重要な割合は酢酸 (C2)、プロピオン酸 (C3)、および酪酸 (C4) です。 短鎖脂肪酸には、血液-脳関門 (BBB) を通過する能力、またはそこにある受容体に結合する能力があります。さらに、短鎖脂肪酸は腸内分泌細胞からのホルモンの分泌を促進します。これらの特性により、それらは中枢神経系レベルでさまざまな機能を調節している可能性があり、神経障害の発症に関与している可能性さえあります [37,40]。 トリプトファン代謝産物は、腸内細菌叢から脳を含むさまざまな末梢器官に信号を送る高い調節能力を持つ分子として説明されています。 そこでは、ミクログリアの発生と活性化を調節し、中枢神経系の炎症を調節する分子の産生を誘導することができます [41,42]。 最後に、微生物の神経伝達物質には、中枢神経系に関連する脳機能と炎症プロセスを調節できる分子である γ-アミノ酪酸 (GABA) や、認知能力、気分、腸の運動性を調節できるカテコールアミンなどの分子が含まれます [27,43]。 |
| 図 1 微生物叢 - 腸 - 脳軸 |
| 腸内微生物叢と中枢神経系の相互作用は、さまざまな神経変性疾患、発達障害、および気分の変化を調節します。 腸内細菌は、短鎖脂肪酸(酢酸、プロピオン酸、酪酸)、トリプトファン代謝物(インドールとその誘導体)、微生物神経伝達物質(GABA、セロトニン、カテコールアミン)などの代謝物を生成します。 これは、免疫細胞とサイトカインを介して腸と脳の間のコミュニケーションを促進するために、腸神経系レベルで活性化シグナルになります。 腸内微生物叢の構成に応じて、これはバランスが取れている場合に保護効果をもたらすか、または腸内毒素症(Dysbiosis)の病気の発症に有利に働く可能性があります。 |
| 腸内細菌叢の変化と神経障害との関連を考えると、さまざまな 中枢神経系障害の調節に関連する微生物代謝産物を生成できるプロバイオティクス微生物の使用が治療戦略として浮上しています。 次のセクションでは、特定の疾患と腸内細菌叢のプロセスとの関係、およびプロバイオティクスの使用がこれらの疾患の潜在的な治療ツールであることがどのように示されているかについて説明します。 |
| 2.1. アルツハイマー病 |
| アルツハイマー病 (AD) は、最も一般的な神経変性疾患の 1 つです。 認知機能を損なう進行性の状態です [44]。 アルツハイマー病は、慢性炎症状態を促進するアミロイド斑の蓄積に基づいています。 これらのプラークは、誤って折り畳まれたβ-アミロイドタンパク質(Aβ)、タウタンパク質、および神経炎症に加えて神経細胞の発達の喪失と萎縮を促進する神経内神経原線維変化の発現増加によって特徴付けられる[45,46]。 |
| 腸内毒素症は、アルツハイマー病の発症または悪化に不可欠な要因です。 いくつかの研究では、腸内細菌叢の組成の変化と腸内の病原性微生物の存在がアルツハイマー病の発症に関連しています[5、34、47、48]。 |
| 腸内毒素症と アルツハイマー病の関係に関するいくつかの研究では、配列決定技術を使用して、アルツハイマー病患者と年齢と性別が一致した対照被験者との間で 腸内細菌叢組成が異なることが示されています。 違いの中で、Firmicutes とBifidobacteriumの存在量の減少とBacteroidetes の存在量の増加がアルツハイマー病患者で発見された[49]。 他の報告では、腸の炎症に関連するタンパク質であるカルプロテクチンの糞便血清濃度が増加し、対照被験者と比較して アルツハイマー病患者のバリア機能が損なわれることが報告されている [50]。 |
| 動物モデルでは、C57BL/6J マウスにエンドトキシンを投与することによって誘発される 腸内細菌叢の変化が、脳内のβ-アミロイドタンパク質(Aβ) 産生を促進し、マウスの血液-脳関門調節不全と認知機能低下を引き起こすことが示されている [51,52]。 さらに、アルツハイマー病のショウジョウバエモデルにおける腸内細菌叢異常は、疾患の悪化をもたらし、神経細胞の喪失、アポトーシスの増加、自発運動の減少、および平均余命の減少をもたらした[53]。 |
| プロバイオティクスとその代謝産物の補給は、変化した腸内細菌叢を効果的に回復させ、アルツハイマー病の症状を改善します。研究されたプロバイオティクスの中で、Lactiplantibacillus plantarum DP189 の投与は、認知機能障害を防ぎ、セロトニン、ドーパミン、γ-アミノ酪酸(GABA) などの微生物神経伝達物質のレベルを増加させました。これにより、ニューロン損傷の改善とβ-アミロイドタンパク質(Aβ)沈着の減少が可能になりました[54]。同様に、Lactobacillus acidophilus, Lacticaseibacillus casei (basonym of Lactobacillus casei), Bifidobacterium bifidum, および Limosilactobacillus fermentum (basonym of Lactobacillus fermentum) を含むプロバイオティック混合物の投与は、アルツハイマー病患者の認知機能および代謝状態の改善に成功した[55]。 他のプロバイオティクスも、腸内細菌叢組成を回復し、認知障害を改善し、β-アミロイドタンパク質(Aβ)沈着を減らす能力を示しています.これらのプロバイオティクスには、Bifidobacterium longum、Candida rugosaおよびケフィアの成分が含まれます [56,57,58]。 |
| 2.2. パーキンソン病 |
| パーキンソン病 (PD) は、2 番目に多い神経変性疾患です。 この病状は、進行性のニューロン喪失および筋骨格ジストロフィーに関連しています。 パーキンソン病は、α-シヌクレイン (α-syn) タンパク質凝集体の蓄積と細胞死の指数関数的増加によって特徴付けられる [59]。α-シヌクレインはミクログリアの活性化を刺激し、炎症性サイトカインの放出を介してドーパミン作動性ニューロ<tr id="1">ンを死滅させ、炎症を悪化させる [60]。 |
| パーキンソン病の患者は腸内毒素症を持っているので、腸内細菌叢が疾患の病因の潜在的な調節因子である可能性があることが示唆されている[61]。 動物モデルでは、パーキンソン病の発生は、分類群 Bacteroides、Lactobacillus、Prevotella、Peptostreptococcus、および Butyricicoccus に属する細菌の低発現と、Enterobacter 属および Proteus 属の大幅な増加と関連していました。 [62,63]。 さらに、パーキンソン病患者の便サンプルの研究では、健康な個人のサンプルと比較して、Blautia, Coprococcus およびRoseburiaなどの酪酸産生種、およびFaecalibacterium属の細菌が増加していることがわかった[64]。 |
| 他の研究では、パーキンソン病患者の腸透過性が大幅に増加していることが示されています。これは、腸レベルでのα-シヌクレインの増加に関連しています [65]。腸内毒素症はまた、運動機能障害およびミクログリア活性化の発症と関連しており、これらの事象は短鎖脂肪酸の濃度と強く関連していた[66]。腸内細菌叢とパーキンソン病の変化の間のその他の関連には、Helicobacter pyloriなどの病原体の過剰増殖 [67] や、疾患の発症段階に応じた微生物叢の一定の変化 [62] が含まれます。 |
| プロバイオティクスとその代謝産物の使用は、特に初期段階でパーキンソン病の発症を調節できることを示しています。 これは、腸内の 短鎖脂肪酸レベルの調節に基づいています [68]。 さらに、Lacticaseibacillus rhamnosum (Lactobacillus rhamnosus の学名)、L. acidophilus、Lactiplantibacillus plantarum (L. plantarum の学名)、および Enterococcus のプロバイオティック ミックスをパーキンソン病患者に使用すると、タイトジャンクションが強化され、腸のバリアの完全性が回復しました。このアプローチはまた、腸内細菌叢の細菌組成を変化させ、炎症成分の減少と関連していた[69,70]。 |
| 2.3. 自閉症スペクトラム障害 |
| 自閉症スペクトラム障害 (ASD) は、コミュニケーションや社会的相互作用の変化、感覚異常、反復行動、さまざまなレベルの知的障害など、認知機能を伴う初期の神経発達障害です [71,72]。自閉症スペクトラム障害の病因は複雑で、染色体数の変化から母体の年齢、周産期の低酸素症、および胎児妊娠中の食事や薬の使用に関連する要因まで、さまざまな遺伝的および遺伝的要因に依存しています[61]。 |
| 便秘、下痢、胃食道逆流、腹痛など、一部の胃腸の問題は、子供の自閉症スペクトラム障害に関連しています。 これらの問題は、自閉症スペクトラム障害患者の行動を悪化させます。 まだ証明されていませんが、関連する腸内毒素症の問題の原因は、腸内細菌叢の構成の変化であると考えられています。 自閉症スペクトラム障害における腸内毒素症に関連する主な種は、Bacteroides, Barnesiella, Odoribacter, Parabacteroides, Prevotella, Alistipes, Proteus, Shigella およびParasutterella であり、自閉症スペクトラム障害患者に多く見られます。 対照的に、Bifidobacterium種の存在量は大幅に減少しています [61,73,74]。 |
| プロバイオティクスの投与による腸内細菌叢の回復が自閉症スペクトラム障害の発症と治療に有益な効果があるかどうかを調べるために、動物モデルと臨床試験の両方が使用されている[75]。 観察された結果には、腸内細菌叢レベルの製品、腸内毒素症および行動症状が含まれます [76,77,78,79,80,81,82,83,84,85]。 いくつかの研究を表 1 にまとめます。 |
| 2.4. 多発性硬化症 |
| 多発性硬化症 (MS) は、脳と脊髄を覆うミエリン鞘の分解を特徴とする、中枢神経系の自己免疫および炎症性疾患である [87]。多発性硬化症の病因は完全には解明されていませんが、主な原因は、さまざまな中枢神経系抗原およびミエリン鞘に対して発達した自己寛容の喪失であることが知られています [88,89]。 |
| この疾患は、ビタミン D 欠乏症、喫煙、肥満、エプスタイン-バーウイルスによる感染など、遺伝的要因と環境要因の両方に依存している [90]。 さらに、マウスモデルとヒトの両方でのいくつかの研究では、健康な被験者と比較して多発性硬化症患者の重要な違いが実証されています。 ただし、地理的地域によって異なる特性が見つかっているため、これらの変化にはさらなる研究が必要です [91]。 多発性硬化症における 腸内細菌叢の変化の中で、FirmicutesとBifidobacteriumの量が少なくなり、Lactobacillus 属、特に Limosilactobacillus reuteri の量が減少します [91,92]。 Methanobrevibacter、Escherichia、Shigella などの細菌は、多発性硬化症患者で豊富に発見されています [49,93,94,95,96]。 |
| 腸内毒素症と多発性硬化症の関係を考えると、従来の治療法をプロバイオティクス投与で補う試みがなされてきた [97]。 使用されているプロバイオティクスの中で、 L. casei, L. acidophilus, L. reuteri, B. bifidum および Streptococcus thermophilusが最も成功しています [98,99]。 ある研究では、 Lactobacillus, Bifidobacterium および Streptococcusを含むプロバイオティック ミックスを多発性硬化症患者に 2 カ月間経口投与したところ、Akkermansia や Blautia などの多発性硬化症に関連する細菌が減少し、抗炎症作用が増加したことが報告されました。 これは、これらのプロバイオティック菌株と従来の治療法との相乗効果を示唆している [100]。 |
| 他の二重盲検プラセボ対照臨床研究では、多発性硬化症の治療におけるプロバイオティクスが有望な結果でテストされています。 拡張障害スケールとベックのうつ病、不安、ストレススケールの健康とスコア、およびC反応性タンパク質(CRP)、一酸化窒素、およびマロンジアルデヒド代謝産物を有益に調節する[101]。 (2) このプロバイオティクス混合物は、多発性硬化症患者の IL-8 および TNFα 遺伝子発現をダウンレギュレートすることも示された [102]。 これらの結果は、他の集団でも再現されました [103,104]。 |
| 2.5 うつ病と不安 |
| うつ病と不安神経症は、公衆衛生にとって深刻な問題を表す 2 つの関連する障害です。 これらの障害は、身体的および感情的な悪化、ならびに社会的機能の問題によって特徴付けられる[105]。 これらのタイプの障害は、人生のどの段階でも発生する可能性があり、再発率が高いため治療が困難です [106]。 うつ病は、「気分の落ち込み、興味や喜びの喪失、罪悪感や自尊心の低下、睡眠や食欲の障害、エネルギーの低下、集中力の低下を人々に経験させる一般的な精神障害」と定義されている[107]。 一方、不安は「不快感、心配、または恐怖の持続的な感覚」を表します[108]。 不安障害およびうつ病障害は、一般に 腸内細菌叢のさまざまな変化に関連しています。 腸内毒素症 は、気分、行動、記憶などの精神プロセスを調節できることが提案されています [109]。 |
| これらの障害に関連する腸内毒素症は、うつ病患者と非ヒト霊長類モデルの両方で検証されています[105]。 この点で、うつ病患者の 腸内細菌叢組成に顕著な違いが見られ、Bacteroidetesに属する細菌集団が減少し、ActinobacteriaとFirmicutes門の存在量が著しく増加した [110,111,112]。 不安症の患者では、Bacteroidaceaeが増加し、Firmicutes門とTenericutes門が減少している [113]。 不安およびうつ病の動物モデルにおける微生物叢分析では、Fusobacteria門およびLactobacillus, Prevotella およびBifidobacterium属の存在量の減少、ならびにアActinobacteria:Proteobacteria比の減少が報告されている[114,115]。 |
| うつ病や不安症に特徴的な行動パターンの治療にプロバイオティクスを使用する前臨床試験や臨床試験が数多く行われています。 これらの中で、B. longum の使用は、混合障害の患者を対象とした二重盲検無作為化プラセボ対照試験で評価され、抑うつ特性の減少を伴う改善が見られました [105]。 別の研究では、L. plantarum が投与され、抑うつ行動の改善に加えて、学習能力の増加も観察されました[116]。 別の三重盲検プラセボ対照試験では、B. bifidum, Bifidobacterium lactis, L. acidophilus, Levilactobacillus brevis, L. casei, Ligilactobacillus salivarius および Lactococcus lactisを含むプロバイオティック ミックスがうつ病患者に投与され、結果は 認知反応性の低下とともに、うつ病の症状が大幅に改善された[117]。 |
| 3. 微生物叢 - 腸 - 皮膚軸 (MGS) |
| 皮膚は、人体の粘膜上皮バリアとともに、自然免疫の一部であり、外部環境に対する最初の防御バリアです。 物理的、化学的、および生物学的損傷から保護し、水分と栄養素の損失を防ぎ、体温を調節し、恒常性を維持するために必要な免疫学的および神経内分泌機能に関与するのに不可欠である [118,119]。 |
| 皮膚の最外層は主にバリア機能を担っています。 次に、表皮は 4 つの細胞層で構成され、基底層幹細胞は角質層に到達するまで、基底層幹細胞が表皮細胞または有棘層と顆粒層のケラチノサイトに分化し、そこで角質化プロセスによって角質細胞、核のない細胞に変換されます。 角質化され、「レンガとモルタル」構造で層状になっています。 さらに、ケラチノサイトは、病原体に対する防御において抗菌ペプチド、サイトカイン、およびケモカインを発現します。 表皮には、ランゲルハンス細胞などの他の免疫細胞も含まれています。 さらに、表皮と真皮の両方に、樹状細胞、マクロファージ、マスト細胞、NK細胞、CD4+ T、CD8+ T、およびTregリンパ球が含まれています[120]。 |
| 毛包、エクリン管、アポクリン管、皮脂腺などの毛包構造を考慮すると、皮膚は 25 m2 という最も広範な上皮表面の 1 つを持っています [121]。消化管、呼吸器、泌尿生殖器の粘膜として、皮膚の上皮表面は何百万もの微生物と常に接触しており、上皮細胞と免疫系を通じて共生関係を維持しています。この関係は、にきび、アトピー性皮膚炎、乾癬などの皮膚疾患では乱されており、これらの病状の病因において、腸内細菌叢が重要な役割を果たしている可能性がある [122]。さらに、皮膚微生物叢が皮膚病で変化するだけでなく、腸内細菌叢も変化することが報告されている[119]。同様に、皮膚症状が観察される消化管疾患では、皮膚と腸の関係が観察される[123]。これは、「微生物叢-腸-皮膚軸」と呼ばれる、これらの上皮表面と接触している微生物叢を含む、皮膚と腸の間に双方向の通信軸があるという理論につながりました[123,124]。 |
| 腸内細菌叢と皮膚の恒常性または変化した状態との間のリンクを可能にする可能性のあるメカニズムは次の通りです。
(1) 血流に入る腸内細菌によって生成された代謝物、 (2) 腸内細菌の移動、 (3) 腸内細菌叢による免疫応答の調節[119]。 マウスでの研究では、L. reuteri などのプロバイオティクスを経口投与すると、真皮の厚さ、毛包形成、および皮脂細胞の産生が増加し、より光沢のあるコートによって証明されることが示されています。 これらの効果は、抗炎症性サイトカイン IL-10 の産生によってのみ可能であり、これらの違いはこのサイトカインが欠損したマウスでは観察されなかった [125]。 ヒトでは、L. brevis SBC8803の経口投与により、皮膚の角質層の水分補給が改善され、経上皮水分損失(TEWL)が減少しました[126]。 これは、プロバイオティクスの経口摂取が、抗炎症細胞やサイトカインを介して皮膚などの遠位器官に利益をもたらし、恒常性を回復し、さまざまな皮膚疾患を治療するための潜在的な代替ルートを提供することを示唆しています (図 2)。 |
| 図 2 微生物叢 - 腸 - 皮膚軸 |
| 腸内微生物叢と皮膚の間の双方向のコミュニケーションは、病原体またはプロバイオティクスによる細菌の代謝産物、細菌の移動、および免疫系の調節を通じて発生します。 (a) 腸内細菌叢は、炎症誘発性代謝産物、サイトカイン、およびリンパ球の増加を通じて、いくつかの皮膚病における皮膚の炎症状態において重要な役割を果たしています。 (b) プロバイオティクスは、短鎖脂肪酸などの抗炎症性代謝産物、Treg リンパ球などの免疫細胞、IL-10 などのサイトカインの増加を通じてバランスを回復し、これらの皮膚病変の間に生じる炎症を軽減および制御するのに役立ちます。 |
| 3.1. アトピー性皮膚炎 |
| アトピー性皮膚炎(AD)または湿疹は、最も一般的な慢性炎症性皮膚疾患であり、成人の 2 ~ 10%、小児の 15 ~ 30% に発生する [127,128]。 それは、痂皮状びらんおよび滲出性または苔癬化したプラーク、表皮バリアの破壊、乾燥肌、および食物および環境アレルゲンに対するIgEを介した感作に発展する湿疹病変における重度のそう痒症によって特徴付けられる[129]。 組織学的には、プラークは表皮の細胞間浮腫とリンパ球、単球、マクロファージ、樹状細胞、好酸球の浸潤を示す [129]。 バリア機能障害の考えられる原因の 1 つは、フィラグリンをコードする遺伝子の変異であり、その結果、バリア機能の維持に重要な役割を果たすこのタンパク質の機能が失われる [127,128]。 これにより、環境抗原による侵入に対する感受性が高まり、2 型免疫応答が強化され、表皮バリアの完全性が損なわれます。 |
| アトピー性皮膚炎の発症における微生物叢の役割は、微生物叢仮説によって説明されています。この仮説では、現代のライフスタイルは微生物への曝露を減らし、微生物叢の組成を変化させ、免疫系の不完全な発達につながり、アレルギーの発症を助長すると述べています。 [130,131]。 この疾患の発症に先立つ腸内毒素症の確立は、この理論を支持する証拠であり、微生物の多様性の減少と、若い年齢でのEscherichia coli やClostridium difficileなどの病原体によるコロニー形成は、幼児のアトピー性皮膚炎リスクの増加と関連している[132,133,134,135,136]。 アトピー性皮膚炎患者は、Clostridium, C. difficile, E. coli, Staphylococcus aureus などの病原性細菌のレベルが高く、Bifidobacterium, Faecalibacterium prausnitzii および Akkermansia muciniphilaなどの共生細菌のレベルが低いため、この異常症は疾患の発症とともに続きます。 [135,137,138,139,140]。 |
| アトピー性皮膚炎の腸内毒素症は、IL-4産生CD4+ Tリンパ球の割合を増加させ、Foxp3+CD25+CD4+ Tリンパ球の割合を減少させる炎症誘発性代謝物によって強化される[139]。 他の研究では、これらの病原体の頻度と血中の好酸球の割合および IgE レベルとの間に正の相関があることが示されている [132,138]。 さらに、アトピー性皮膚炎患者は、アルツハイマー病の重症度に関連するこれらの代謝産物を産生する細菌数の減少により、酪酸やプロピオン酸などの 短鎖脂肪酸のレベルが低い [141,142]。 短鎖脂肪酸はその完全性に必要であり、抗炎症効果があるため、これらの結果は、アトピー性皮膚炎の病因における腸内細菌叢の重要な役割を示唆し、炎症誘発性反応を促進し、上皮バリアの機能に影響を与えます。 これらの代謝産物を産生する細菌数の減少と病原体の増加は、腸と表皮のバリア機能の低下につながり、アトピー性皮膚炎の臨床症状を悪化させます。 |
| プロバイオティクス治療がアトピー性皮膚炎の臨床症状の重症度を軽減するという証拠がある[143]が、他の研究では効果が報告されていないため[144]、これを確認するにはさらなる研究が必要である. さらに、いくつかの研究では、この状態を予防するために経口プロバイオティクスを使用する可能性が報告されています [145,146]。BifidobacteriumとLactobacillusを含むプロバイオティクス混合物は、これらの研究で最も一般的に使用されています。 B. bifidum, B. longum, Bifidobacterium breve, L. rhamnosus, L. acidophilus, などのさまざまな菌株を、この疾患の家族歴を持つ女性に妊娠中および幼児期に投与すると、乳児のアトピー性皮膚炎の発症リスクが低下します。 [147,148,149,150,151]。 |
| アトピー性皮膚炎の治療における経口プロバイオティクスの効果に関して、マウスでの研究では、アルツハイマー病の病変、紅斑、引っかき傷、および表皮の厚さの減少が報告されている [152,153,154,155]。 L. rhamnosus、L. plantarum、F. prausnitzii、および A. muciniphila のさまざまな株は、好酸球およびマスト細胞による浸潤を減少させ、IL-4 および IL-5 などの Th2 プロファイルに関連する IgE およびサイトカインのレベルを低下させます。 TSLP(胸腺間質リンホポエチン)など、このリンパ球サブタイプを誘導するサイトカインのレベルを低下させます。これらのプロバイオティクスの投与は、IL-10 などの抗炎症性サイトカイン、および IFN-γ などの Th1 プロファイルを持つサイトカインを増加させる [152,153,154,155]。 炎症プロファイルのこれらの変化は、Tregリンパ球の増加を介してTh1 / Th2リンパ球のバランスを回復するために、皮膚のフィラグリンと腸のタイトジャンクションタンパク質ZO-1およびクローディン-1の産生を増加させることにより、腸および表皮バリアの機能を改善することに加えて[155]、プロバイオティクスによる免疫系の調節によって誘発される[144]。 |
| Fang らによる最近の研究では、アトピー性皮膚炎のマウスモデルで B. longum CCFM1029 を使用し、プロバイオティクスの別の作用機序が仮定されました。 このプロバイオティクスは 腸内細菌叢を調節して、トリプトファン代謝産物であるインドール-3-カルボキシアルデヒドの産生を増加させ、アリール炭化水素受容体 (AHR) を介して Th2 応答を抑制します。 アリール炭化水素受容体は、Th2、STAT6への分化のための転写因子を阻害するシグナル伝達経路を活性化する[156]。 同様に、B. longum は、これらのリンパ球の分化を促進し、アトピー性皮膚炎の病因に関与する TSLP の発現を阻害する [156,157]。 |
| 最後に、ヒトでは、アトピー性皮膚炎の子供と大人の臨床症状の改善が報告されています[158,159,160,161]。 Bifidobacterium および Lactobacillusからのプロバイオティクスの摂取は、アトピー性皮膚炎の重症度とTEWLの減少、および皮膚の水分補給の改善と関連しています[158,159,160,161]。 これらの研究は、この改善が、トリプトファン代謝を促進するための 腸内細菌叢の調節、微生物移行の減少、Treg および Th1 リンパ球の増加、Th2 リンパ球、IgE、および TNF、TSLP 、ケモカイン CCL17などの炎症性サイトカインの減少に関連していることを報告しています。 [156,158,159,160]。 表 2 は、アトピー性皮膚炎におけるプロバイオティクスの使用に関する関連する最近の研究の概要を示しています。 |
| 3.2. 乾癬 |
| 乾癬は皮膚の慢性炎症性疾患で、有病率は 0.91 ~ 8.5% で、地域によって大きく異なり、15 歳から 25 歳の間に発症する [163,164]。 それは、肥厚し、炎症を起こし、鱗状の紅斑性病変を特徴とし、しばしば明確なプラークを伴い、50%の症例でそう痒症を伴い、体のどこにでも発生する可能性がある[164]. これらの臨床症状は、樹状細胞、マクロファージ、T リンパ球、および好中球からなる炎症性浸潤を伴う、不完全な角化を伴う角化細胞の過剰増殖の結果である [165]。 病因と病因はまだ十分に理解されていないが、遺伝的、環境的、および免疫学的要因が疾患の発症に影響を与える [164]。 |
| 乾癬患者では、より小さな上皮表面と腸の完全性の喪失を伴う異常な腸構造が報告されている[166,167]、 潰瘍性大腸炎、クローン病、セリアック病などの炎症性腸疾患(IBD)を発症するリスクが高まる[168]。 乾癬患者の 腸内細菌叢 は、炎症性腸疾患患者の微生物組成と同様の微生物組成を持ち、健康な人の微生物叢とは異なる [169,170]。 これらの患者の腸内細菌叢の分析は、Bacteroidetesの存在量の減少とFirmicutesの増加、 F. prausnitzii、A. muciniphila、および Prevotella copri などの共生細菌の減少と、それに伴う E. coli などの病原性細菌の増加を示している[169,171]、 [169,170,172]。 これらの結果は、腸内環境異常症と乾癬の間の関係を調査する必要がある可能性を示しています。 |
| マウスとヒトでの研究は、プロバイオティクスが炎症性バイオマーカーのレベルと疾患の特徴的な病変を減らすのにどのように役立つかを示しています. Chenらは、イミキモド誘発性乾癬のマウスにLactobacillus pentosus GMNL-77を摂取させると、紅斑、鱗屑、表皮肥厚が減少し、TNF-αなどの炎症誘発性サイトカインの発現が減少したことを報告しました。 IL-6、IL-23、IL-17A、IL-17F、および IL-26 [173]。 ヒトでは、Bifobacterium infantis 35624, B. longum CECT 7347, B. lactis CECT 8145, および L. rhamnosus CECT 8361 の摂取が、C反応性タンパク質および TNF-α の血漿レベルの低下に役立つことが 2 つの研究で報告されています。 腸内細菌叢を有意に多くの有益な属で調節し、乾癬患者の病変重症度の臨床的改善とも関連していた [174,175]。 したがって、プロバイオティクスは乾癬の治療に有望です。 |
| 3.3. にきび |
| 尋常性座瘡は、面皰、毛包閉塞および皮脂腺過形成によって引き起こされる小さな隆起、および丘疹、膿疱、嚢胞などの痛みを伴う炎症性病変を特徴とする毛包脂腺単位の慢性炎症性疾患である [176,177,178]。 世界的に、それは 8 番目に一般的な疾患であり、世界の疾病負荷の 0.29% を占め、2 番目に一般的な皮膚疾患である [179,180]。 先進国では、12~24 歳の人々の 85~90% が罹患している [176,181]。 |
| 皮脂の過剰分泌、ケラチノサイトの異常な落屑による排泄管の閉塞、面皰に炎症誘発性メディエーターを分泌するCutibacterium acnesの増殖とコロニー形成によって引き起こされる多因子疾患であると考えられている [177,178]。 さらに、高血糖指数と高レベルの乳タンパク質を含む食事は、mTORC1 を調節する転写因子を阻害するインスリンシグナル伝達とインスリン様成長因子-1 (IGF-1) を増加させることにより、病因において重要な役割を果たします。 Fox01. mTORC1の活性化は、過剰増殖、脂質生成、ケラチノサイト過形成を引き起こし、座瘡の発生に寄与する[182]。 |
| いくつかの研究は、座瘡患者の 腸内細菌叢が健康な対照者の 腸内細菌叢と異なることを示しています。 にきび患者は、微生物の多様性が低く、 Firmicutesの量が少なく、Bacteroidetesが増加している[176,183,184]。 男性の座瘡患者は女性よりも腸内細菌叢のレベルが高いため、これらの違いは性別に依存する [183]。 同様に、抗炎症特性を持つ細菌門の数と、抗菌活性および免疫調節活性を持つ短鎖脂肪酸などの代謝産物の生産者の減少が報告されています。 これらには、Bifidobacterium, Butyricicoccus, Lactobacillus, Lactococcus, Clostridium, Clostridiales, Lachnospiraceae, および Ruminococcusが含まれる[176,183,184]。 これは、にきび患者が 腸内毒素症を持っていることを示唆しており、この病状の皮膚症状を悪化させる可能性があります。 |
| 経口投与されたプロバイオティクスは、有望な結果を示しているにきび治療の代替手段ですが、さらなる研究が必要です。1961年、プロバイオティクスのL. acidophilus と Lactobacillus delbrueckii subsp. bulgaricus の投与により、座瘡患者、特に炎症性病変の場合に臨床的改善がもたらされた最初の研究が発表された[185]。 Jungらは、プロバイオティクス L. acidophilus, L. bulgaricus, およびB. bifidum と抗生物質ミノサイクリンによる相乗的治療が、抗生物質単独での治療よりも座瘡皮膚病変のより有意な減少をもたらすことを示した[186]。 Fabbrocini らによる研究では、座瘡患者への L. rhamnosus SP1 の投与も皮膚の状態を改善し、IGF-1 の発現の減少と Fox01 の発現の増加による病変の減少を示した [178] .したがって、これらの特定のプロバイオティクスの有益な効果は、IGF-1 / mTORC1代謝の調節と、抗炎症性サイトカインおよび微生物叢-腸-皮膚軸に影響を与える分子の発現の増加から生じ、にきびに見られる悪化した炎症を軽減します。 |
| 4. 微生物叢 -腸 - 肺軸 (MGL) |
| 微生物叢 -腸 - 肺軸は、主に 腸内細菌叢が肺疾患の経過と結果に影響を与える能力、およびその逆の 腸内細菌叢の能力による 2 つのシステム間の接続を指す [187]。 共生微生物叢は、肺や腸を含む外部環境にさらされている粘膜組織で確立されている[188]。 組織学的には、呼吸器および消化管には、粘膜 (上皮および固有層)、粘膜下組織、軟骨および筋肉、および外膜の 4 つの層があります [189]。 上皮は、血管系の構成要素および腸または気道内腔に対する、呼吸器および消化管における主要な物理的保護バリアです。 |
| 呼吸器系は、空気の吸入と呼気を通じて病原体、アレルゲン、およびその他の粒子と相互作用します [189,190]。 下気道では、肺胞マクロファージと樹状細胞のさまざまなサブセットがセンサーとして機能し、パターン認識受容体を介して病原性細菌、ウイルス、または真菌の存在を警告します。 一方、自然リンパ球、ナチュラルキラー細胞、ナチュラルキラーT(NKT)細胞、粘膜関連インバリアントT(MAIT)細胞、上皮γδ-T細胞、組織常駐メモリーT細胞などの組織常駐リンパ球も見つかりました。 一緒に、それらはタイムリーな病原体除去または常在および一過性微生物叢の耐性に必要なメカニズムを引き起こします[191]。 |
| 呼吸器系の微生物叢は、腸の微生物叢とは非常に異なる[192]。 肺微生物叢の組成は、気道を介した細菌の移動や排泄、肺粘膜の相対的な成長率など、いくつかの要因に依存する[193]。 健康な被験者では、中央の肺微生物叢は、Pseudomonas, Streptococcus, Prevotella, およびFusobacteriumで構成され、続いてHaemophilus, Veillonella および Phorphyromonas,が続き、Pseudomonasは3つの肺葉の支配的な属である[194]。 最も大規模な多施設研究の 1 つである肺 HIV マイクロバイオーム プロジェクトでは、2009 年から 2015 年までの肺と気道のマイクロバイオームが特徴付けられ、口と肺に最も豊富に存在する細菌属はStreptococcus, Prevotella および Veillonellaであることが明らかになりました。 一方、肺では、Haemophilus, Enterobacteriaceae, Methylobacterium,および Tropherymaの分類群が過剰に存在していた[195]。 |
| 腸と肺は、リンパと血液の循環を介して連絡を取り合っています。 最大のリンパ管は胸管であり、胸管からのリンパ液は左鎖骨下静脈に入ります。これは、肺が腸間膜リンパ液に遭遇する最初の臓器であることを意味します[196]。 このため、腸-肺軸は主に 腸内細菌叢とそれが誘発する免疫応答によって調節されている [197,198]。 今日までに、いくつかの研究が、微生物叢-腸-肺軸を介した双方向性肺合併症における腸内細菌叢の関与を実証しています。 さまざまな肺疾患の治療に使用されるプロバイオティクスとプレバイオティクスを表 3 に示します。 |
| 4.1. 慢性閉塞性肺疾患 |
| 慢性閉塞性肺疾患 (COPD) は、世界で 3 番目に多い死因である [210]。 それは、持続的な呼吸器症状、気流制限、および肺気腫の発症を特徴とする慢性変性疾患と考えられています。 主な病因は、遺伝的要因と組み合わされた、喫煙と有害なガスまたは粒子への曝露である [211]。 |
| 慢性閉塞性肺疾患患者では、気道に加えて他の組織が影響を受けます。 Ruttenらは、腸細胞の損傷と腸の腸管透過性の増加は、換気/灌流比の不一致によるものであり、組織の低酸素症につながることを初めて実証した[212]。 Kirschner らは、慢性閉塞性肺疾患患者の小腸関門の完全性が失われ、活動的喫煙者と元喫煙者の腸透過性が増加したことを報告しました。 彼らはまた、いくつかの短鎖脂肪酸、主にアセテートの血漿濃度の減少も発見しました。短鎖脂肪酸の濃度は腸の完全性の他のパラメーターとは関連していませんが、腸内細菌叢とこれらの代謝産物を産生する能力の変化の可能性を示唆しています [213]。 |
| Liらは、腸内細菌叢の根底にあるメカニズムのいくつかと、疾患の進行におけるその重要性を解明しました。 結果は、合併症のある患者は、健康な被験者と比較して、Bacteroidaceae と Fusobacteriaceaeの細菌の量が少ないことを示しています。 これは、糞便サンプル中の総 短鎖脂肪酸濃度の有意な減少とも関連していました。 この関連性を支持するために、慢性閉塞性肺疾患患者から糞便微生物叢移植を受けたマウスは、肺の炎症、肺気腫、気道のリモデリング、粘液の過剰分泌、および肺機能の障害を示した[214]。 |
| 腸のバリアの完全性と腸内毒素症に引き起こされる損傷は、代謝物、サイトカイン、および腸内に存在する細胞の肺組織への移動に寄与し、そこでそれらはエフェクターとして機能し、全身の炎症にさらに寄与します。これに関連して、Wangらは腸内毒素症修復が慢性閉塞性肺疾患マウスの肺炎症パラメータを改善することを実証しました。彼らはまた、慢性閉塞性肺疾患マウスの優勢な細菌属は、Candidatus_Stoquefichus、Streptococcus、および Marvinbryantia であると説明しており、これらは体重と肺機能と負の関連があり、Th17/Treg バランスと炎症性サイトカイン濃度と正の関連がある [215]。 慢性閉塞性肺疾患患者を対象とした別の研究では、腸内毒素症と 1 秒間の強制呼気量 (FEV1) の減少との関連が見つかりました。 Firmicutes と Stenotrophomonas は、より深刻な影響を受けた患者で増加しましたが、対照群では Bacteroidetes、Alloprevotella、Acinetobacter が増加しました。これらの結果は、著者らが結論付けたように、「マウスおよび慢性閉塞性肺疾患患者の肺の炎症状態は、腸内細菌叢 によって部分的に調節される可能性がある」ことを示しています [216] (図 3)。 |
| 図 3 微生物叢 -腸 -肺軸 |
| 微生物叢 -腸 - 肺のコミュニケーションは双方向であり、リンパと血液循環を介して、両方の粘膜組織で放出された代謝産物によって行われます。肺疾患中の腸内細菌叢の存在は、その免疫調節能力を通じて重要な役割を果たしています。 慢性閉塞性肺疾患では、換気と灌流の不一致により、腸組織の低酸素症と腸内細菌叢異常に関連する上皮細胞の損傷が引き起こされ、短鎖脂肪酸分泌の減少、Th17/Treg 比の増加、および肺炎症と相関する炎症誘発性サイトカインの分泌が誘導されます。喘息では、腸の腸内環境異常症が疾患の重症度と正の相関があります。 A. muciniphila の減少と肺胞上皮透過性の増加は、Bacteroides acidifaciens と酪酸濃度の減少と関連しています。 COVID-19(コロナウイルス病 2019)では、SARS-CoV-2 は腸内の ACE2 発現を減少させます。これは、病原体の増加とプロバイオティクス細菌の減少に伴い、腸内毒素症に関連しています。これにより、腸の透過性、炎症誘発性マーカー、好中球動員、および肺組織の細胞活性化が増加します。プレバイオティクス、プロバイオティクス、およびポストバイオティクスの補給は、腸内細菌叢を回復し、気道の炎症を軽減し、サイトカインとケモカインの産生のバランスを回復し、白血球動員を減少させ、短鎖脂肪酸濃度を増加させます。 |
| 喫煙と偏った食生活は、慢性閉塞性肺疾患の発症と 腸内毒素症の重要な危険因子です。慢性閉塞性肺疾患マウスでは、L. rhamnosus と B. breve の補給により、気道の炎症と肺損傷が予防され、気管支肺胞洗浄が減少し、サイトカインとケモカインのバランスが回復する [217]。 この病気に対する食物繊維の効果は、マウスモデルでも研究されています。 Jangらは、高繊維食が肺気腫の進行と炎症反応に関連する生理学的変化を軽減することを実証しました。 彼らはまた、食物繊維が微生物の多様性と、短鎖脂肪酸、胆汁酸、スフィンゴ脂質などのその代謝物を調節することを強調した [200]。 |
| 一方、Koning et alは、ヒトを対象とした無作為化二重盲検試験で、抗生物質治療中および治療後の多株プロバイオティクスの摂取が慢性閉塞性肺疾患患者の腸内細菌叢 を変化させるかどうかを調査しました。 しかし、腸内細菌叢組成に違いは見られなかった[218]。 |
| 4.2. 喘息 |
| 喘息は、さまざまな国の人口の 1 ~ 18% が罹患している慢性呼吸器疾患であり、喘鳴、息切れ、胸部圧迫感、咳、可変呼気気流制限などの症状があります。 気道過敏症と炎症に関連している[219]。 喘息は、複雑で、多因子性の、不均一な呼吸器疾患である [220]。 |
| 喘息と腸内微生物叢との因果関係を示す決定的な証拠はまだありません。 しかし、喘息は炎症性腸疾患コホートで 2 番目に多い併存疾患であった [221]。 メタアナリシスでは、喘息とクローン病の関連性を報告した 15 件の研究が記述されており、16 件の研究が潰瘍性大腸炎との関連性を示しています。 これらの研究のほとんどで、炎症性腸疾患は喘息の発症に先行していた[222]。 456,327 人のヨーロッパ人の分析では、小児期に喘息が存在すると、胃食道逆流、過敏性腸症候群 (IBS)、および消化性潰瘍疾患を発症するリスクが高まることが示された [223]。 Shen らは 2 つの後ろ向きコホート研究を実施しました。1 つは喘息患者を対象とし、もう 1 つは過敏性腸症候群患者を対象としています。 彼らは、喘息患者は過敏性腸症候群のリスクが有意に高く、逆もまた同様であることを発見した[224]。 しかし、今日まで、両方の状態が同様の病理学と危険因子のために発生することを示唆する決定的な証拠はありません[222]。 |
| 喘息発症の環境リスク要因には、微生物叢 - 腸 -肺軸を介した 腸内細菌叢 の役割が含まれます。 健康な被験者と喘息患者の間で腸内細菌叢に違いが見られました。 中国の広州の集団では、特に分類学上の科レベルで、Acidaminococcaceaeの減少に加えて、喘息患者でVeillonellaceae と Prevotellaceaのより高い相対存在量が観察され、これは平均 FEV1 および疾患重症度と正の相関がある [225 ]。 |
| 喘息マウスモデルでは、生理学的および組織学的な喘息の特徴の減衰により、肺微生物叢における門 Verrucomicrobia および A. muciniphila の相対存在量が増加しました。 さらに、肺胞上皮細胞におけるタイトジャンクションタンパク質発現の増加と、リポポリサッカライド(LPS)生合成およびムチン産生の減少が観察されました。 これにより、Bacteroides acidifaciens などの腸内の有益な細菌種の量が増加し、その結果、酪酸濃度が増加しました [226] (図 3)。 |
| 中国南部のアレルギー性および非アレルギー性表現型によって分類された喘息患者の研究では、健康な被験者と不健康な被験者の間、および喘息の表現型間で、腸内細菌叢叢のプロファイルが大きく異なることがわかりました。 これに関連して、疾患状態と血清IL-4濃度が、患者と対照の間の腸内細菌叢の違いの2つの主な要因であることがわかりました. 調査結果には、コントロールと患者の間の 28 の異なる細菌種と、アレルギーの有無にかかわらず喘息の層別化において診断の可能性がある 17 の種が含まれます。 これらのデータは、腸内細菌叢と病状の違いとの密接な関係を示唆している[227]。 |
| 喘息は人間の人生の早い段階で発症し、妊娠の出生前および出生後の段階に依存するため、通常、この期間中にプロバイオティクスの補給が調査されます.マウスモデルは、L. lactis NZ9000 などの有望な治療アプローチを実証するために使用されており、白血球の炎症の減少に好都合でした。 L. rhamnosus GR-1 は、気道過敏性を低下させ、喘息障害の減少に貢献しました。 B. breve M-16V は、新生マウスの気管支肺胞液中の好酸球の減少を促進し、環境汚染によって引き起こされるアレルギーによる肺の炎症を軽減しました。[204,205]。 L. reuteri ATCC 23272、L. rhamnosus GG、または B. lactis Bb-12 で治療された喘息のマウスは、気道過敏性の減少と気管支肺胞細胞の炎症の減少を示した [228]。ヒトでは、結果は多少変動します。湿疹、喘息、アレルギー性鼻炎の子供には、L. rhamnosus GG が投与されました。しかし、喘息発症リスクの低下は観察されなかったが、喘鳴の頻度は低かったため、プロバイオティクスはこの疾患の治療薬とは見なされていない [207]. |
| ビタミン D などのポストバイオティクスは、腸上皮バリアのモジュレーターとして、また微生物叢のホメオスタシスとして重要な役割を果たします。 Lituonja らによって実施されたビタミン D 出生前喘息軽減試験 (VDAART) では、妊娠中の女性にビタミン D を補給することで、子供の喘息やアレルギーの発症を予防できるかどうかを調査しました。 妊娠中の母親にビタミンDを補給しても、子供の喘息のリスクは変わらないことがわかった[229]。 短鎖脂肪酸などの他の代謝物も研究されています。 気管支喘息の有無にかかわらず個人を含む前向き研究では、酪酸とプロピオン酸の濃度が高い人はT細胞分化の増加を示し、アレルギー反応が減少した[230]。 マウスとヒトで得られた結果の違いは、方法論の違い、選択基準、およびマウスとヒトの間の環境調節の違いに起因する可能性があります。 |
| 4.3. COVID-19(新型コロナウイルス感染症) |
| SARS-CoV-2(重症急性呼吸器症候群コロナウイルス 2 ) は、COVID-19(コロナウイルス病 2019 ) の原因です。 そのゲノムは正の一本鎖 RNA ssRNA (+) で構成され、Nidovirales目Coronaviridae科、および SARS 種に属します [231]。 感染は、呼吸器症状のある人からの飛沫や、ウイルス量で汚染された表面との接触によって発生します[232,233,234]。 世界で最初の症例は、2019 年 12 月 31 日に中国の武漢で「原因不明の肺炎」として報告された [235]。 それ以来、ウイルスは急速に広がりました。 2020 年 3 月、世界保健機関 (WHO) は COVID-19 をパンデミックと宣言しました。 これは現在、最も重大な公衆衛生上の問題を表しており、世界中で 539,119,771 人の症例が確認されており (2020 年 6 月 23 日現在)、そのうち 6,322,311 人が死亡しています [236]。 |
| COVID-19 は主に呼吸器感染症として現れ、最も報告されている症状は発熱、疲労、空咳です。 肺炎とサイトカインストームは、COVID-19 の典型的な臨床症状である [237]。 SARS-CoV-2 感染の影響を受けやすい細胞には、呼吸器上皮細胞、肺胞マクロファージ、腸上皮細胞、心筋細胞、嗅覚細胞、胆管細胞、セルトリ精巣細胞が含まれます。 それらはすべて、ウイルスを認識して宿主細胞に組み込むために必要なアンジオテンシン変換酵素2 (ACE2)容体の高発現を示します。 したがって、このウイルスに感染すると、さまざまな呼吸器疾患、心不全、および下痢、嘔吐、吐き気などの消化器症状が引き起こされます [238]。 |
| 消化管の損傷に関しては、SARS-CoV-2 は腸内で アンジオテンシン変換酵素2 に結合することにより、トリプトファンの吸収を損なう可能性がある [239]。 Hashimotoらの研究によると、これは腸内の抗菌ペプチドの分泌の減少につながり[240]、微生物叢の組成に影響を与え、腸内毒素症を促進することが示されている[241]。 ナイアシンまたはトリプトファン欠乏症の患者はペラグラに苦しむことが知られており、その 90% が重度の大腸炎と下痢を発症し、合併症または危険因子として COVID-19 にも関連する状態である [242,243]。 |
| 今日まで、COVID-19患者の胃腸症状が糞口感染に起因するのか、肺粘膜との関連によって媒介される間接的なメカニズムによるものなのかは不明である[196,244]。 SARS-CoV-2感染では、局所免疫細胞が炎症性サイトカインを産生し、消化管などの肺外組織に影響を与えます。 次に、それらは常在細胞を活性化し、この炎症反応は、腸内細菌叢異常および腸透過性の増加と関連しており、全身性および肺の炎症を促進する [245]。 |
| いくつかの論文は、全身シグナルを発する局所細胞の免疫調節能力に基づいて、腸内細菌叢を COVID-19 重症度に関連付けている [246,247,248]。 Tang らは、COVID-19 肺炎患者における特定の腸内細菌の存在量と臨床指標との関連性を実証しました。プロバイオティクス(Lactobacillus および Bifidobacterium)および抗炎症性細菌(F. prausnitzii、Clostridium butyricum、Clostridium leptum、および Eubacterium rectale)の相対的存在量は、血清中の炎症誘発性マーカー(IL-6、C反応性タンパク質、および好中球レベル)、肝障害の指標 (ALT および AST)、および器質的機能障害のマーカー (D ダイマー、LDH、およびクレアチンキナーゼ) と負の関連がありました(図 3)。一方、病原性効果で知られている細菌 (Enterococcus、Enterobacteriaceae、および Atopobium) は、これらの指標と正の相関がありました。重篤な患者のグループでは、腸内細菌叢は病原菌に富んでいる[249]。コホート研究では、SARS-CoV-2 陽性患者の 腸内細菌叢は、炎症誘発性サイトカインや、C反応性タンパク質、LDH、AST、GGT などの他の炎症マーカーの濃度の増加と相関していました。 F. prausnitzii、E. rectale、および Bifidobacterium 種の相対存在量は、感染から 30 日後でも患者の便サンプルで減少しており、著者らは、この病気の晩期症状に寄与している可能性があると考えている [245]。 |
| プロバイオティクス、プレバイオティクス、およびポストバイオティクスが他の呼吸器疾患の臨床的重症度を軽減する能力を説明するいくつかの研究がありますが、COVID-19 についてはまだ決定的な結果はありません [250]。 SARS-CoV-2 陽性の患者のコホートからなる Ceccarelli らによる研究では、彼らの 腸内細菌叢 が特徴付けられました。より長期間症状があった人は、より重度の腸内毒素症を示しました。これらの個人は、Lactobacillus helveticus、L. acidophilus、L. paracasei、L. plantarum、L. brevis、S. thermophilus、および B. lactis の複数のサプリメントを摂取しました。肺炎の患者では、このサプリメントを摂取した人の方が生存率が高かった [208]。一方、亜鉛、カリウム、マグネシウム、カルシウムなどの微量栄養素とともに、ヨーグルトをプロバイオティクスおよびポストバイオティクスのサポート食品およびサプリメントとして使用することが提案されています.この提案は主に、カゼイン由来の活性ペプチドがヨーグルトに存在し、アンジオテンシン変換酵素2(ACE2) 発現の阻害剤として作用し、宿主細胞へのウイルスの侵入を減少させるためである [251]。さらに、バイオインフォマティクス ツールを使用して、遺伝子 ACE、AGTR1、および アンジオテンシン変換酵素2(ACE2) の発現を低下させることができるプロバイオティクスおよび細菌株を特定しました。その結果、Bacteroides thetaiotaomicron、Bacteroides fragilis、A. muciniphila、および F. prausnitzii が miR-124-3p および miR-26b-5p miRNA を有益に調節し、これらの遺伝子の発現を調節することがわかった [252]。バイオインフォマティクス分析は非常に記述的ですが、通常の患者条件下での相互作用と反応を確認できる in vitro および in vivo アッセイに取って代わることはできません。 |
| 5. 微生物叢 - 腸 - 心臓軸 (MGH) |
| 腸内細菌叢とその代謝産物は、高血圧、脂質異常症、アテローム性動脈硬化症、血栓症、心不全、虚血性脳卒中などの心血管疾患 (CVD) の進行に関連している [253]。 さらに、腸内細菌叢はがん治療への反応と有毒な副作用に対する感受性に影響を与える [254]。 薬物はマイクロバイオームを変化させ、薬物分子自体とは無関係の副作用を引き起こす可能性がある [255]。 最近、腸内細菌叢のシスプラチンやドキソルビシンなどの抗腫瘍化学療法剤が、心毒性の病因に関与する障害を引き起こしている[256,257]。 表 4 は、心血管疾患におけるプロバイオティクスの使用に関する最近の関連研究を示しています。 |
| 5.1. 高血圧症 |
| 高血圧は、世界中で主要な死因である心血管疾患の最も一般的な修正可能な危険因子です。 変更は可能ですが、依然として最も重要なものの 1 つです。 塩分の過剰摂取は血圧(BP)の上昇と関連しているが、低ナトリウム食は血圧を下げ、心血管疾患による罹患率と死亡率を低下させる[266,267]。 |
| 腸内細菌叢をヒトの高血圧症と関連付けた研究はほとんどないが、Joe らは最近、無菌ラットが低血圧症で血管収縮性が低下していることを示した。 これらのラットで 腸内細菌叢を回復すると、血圧と血管収縮性も回復する [268]。 Li らによる研究では、高血圧患者の糞便微生物叢を無菌ラットに移植すると、これらの動物の血圧が上昇することが報告されている [269]。 これらの結果は、血圧の調節における 腸内細菌叢の役割を示唆しています。 |
| 最近の証拠は、腸内細菌叢が高血圧の発症と関連していることを示している[270,271]。 この共生異常は、 Bacteroidetesに対するFirmicutesの比率の増加と、マウスモデルにおける短鎖脂肪酸産生細菌種の減少によって強調されています。 同時に、高血圧患者では微生物の豊富さが低いことが見られる[269,272]。 |
| さらに、高血圧患者と高血圧前症の患者の 腸内細菌叢の分析は、それらの組成の類似性、ならびに Prevotella および Klebsiella などの細菌の存在量の増加と、Faecalibacterium、Oscillibacter、Roseburia、Bifidobacterium、Coprococcus 属の細菌および健康な対照被験者と比較したBibrioutyrivの減少を示しています。 マイクロバイオーム解析では、アミノ酸合成、脂肪酸利用、糖代謝に関連する遺伝子の活性が低下していることが示されています。 同時に、リポポリサッカライド(LPS) などの代謝産物の生合成が増加する [269]。 これは、腸内毒素症がどのようにして軽度の炎症を引き起こすかを示している可能性があり、それが高血圧の発症に関与している可能性があります。 |
| 血圧に関連する他の細菌代謝産物には、特定の食品成分に由来する腸内微生物産物であるトリメチルアミン (TMA) およびトリメチルアミン-N-オキシド (TMAO) が含まれます。 トリメチルアミン-N-オキシドは心血管疾患および中枢神経系疾患と関連している [273,274]。 循環トリメチルアミン-N-オキシドの上昇は、心臓、大動脈、腎臓を含む末梢組織 [275,276,277] だけでなく、中枢神経系[278,279] にも炎症反応と酸化ストレスを誘発する。 |
| 図 4 微生物叢 - 腸 - 心臓軸 |
| 腸内毒素症 は、腸内微生物叢と心臓のコミュニケーション軸を通じて、高血圧、アテローム性動脈硬化症、冠動脈疾患、さらには心不全などの心臓病を引き起こしたり、悪化させたりする可能性があります。 この場合、腸内毒素 症は、トリメチルアミン、トリメチルアミン N-オキシド、インドキシル硫酸、および腸と心臓の間の有害な関係の原因となる他のエンドトキシンなどの有毒な代謝産物を生成する細菌の存在を支持します。 一方、バランスの取れた腸内微生物叢は、短鎖脂肪酸、胆汁酸、および心臓の恒常性プロセスを促進するその他の化合物の産生に有利に働きます。 |
| 最近の研究では、塩分の摂取量が多いと 腸内細菌叢の組成が変化し、その結果、動物の トリメチルアミン-N-オキシドの血漿濃度が上昇することが報告されている [271,281]。 最近、Liuらは、高塩食(HS)の長期摂取が血流と脳内で腸内細菌叢によって生成される代謝産物トリメチルアミン-N-オキシドの増加につながることを示しました。 これは、室傍核 (PVN) における神経炎症および酸化ストレスの増加に関連しています。 トリメチルアミン-N-オキシド形成の阻害は、室傍核の神経炎症と酸化ストレスを軽減することにより、高塩食誘発性の交感神経興奮と高血圧を改善します。 これらの調査結果は、高塩食誘発性高血圧のメカニズムに新たな洞察を提供する可能性がある [282]。 |
| Wang らのチームは、微生物のコリントリメチルアミンリアーゼ活性の低分子阻害剤を使用すると、微生物のトリメチルアミンおよびトリメチルアミン-N-オキシドの形成、マクロファージ泡沫細胞の形成、および in vivo でのアテローム性動脈硬化が抑制されることを示しました。 この経路を標的とすることで、ヒトの心血管疾患リスクが同時に減少するかどうかはまだ不明です。 しかし、それは将来の研究にとって不可欠な分野である[283]。 |
| 一方、短鎖脂肪酸などの 腸内細菌叢 によって生成される有益な代謝産物も血圧と関連しています。これらの代謝産物のレベルの低下は通常、高血圧と関連しているからです [272,284]。 Marques らの研究によると、高血圧マウスの繊維と酢酸塩を多く含む食事は、腸内細菌叢を変化させ、酢酸塩を産生する細菌の割合を増加させるだけでなく、短鎖脂肪酸が低血圧と関連していることを示し血圧、心臓繊維症、左心室肥大の減少とも関連していた[285] 。 |
| 最後に、プロバイオティクスの摂取は、高血圧患者の血圧の改善にも関連しています。 これらの効果は、プロバイオティクス治療の期間と用量、および患者の年齢に関連しています。 それらは、BMIや血糖値の低下などの他の利点にも関連しています[286]。 |
| 5.2. アテローム性動脈硬化症 |
| アテローム性動脈硬化症 (AS) は、心血管疾患の根底にある病態である繊維層に囲まれた脂質コアまたはアテロームで動脈に形成されたプラークを指し、その有病率は世界中で増加している [287]。 これらのアテローム硬化性プラークには細菌のDNAが含まれており、アテローム硬化性プラークで観察された細菌分類群は、同じ個人の腸にも見られた[288,289]。 これらの観察結果は、これらの部位の微生物群集が、プラークの安定性と心血管疾患の発生に影響を与える可能性のあるプラーク内の細菌の供給源である可能性があることを示唆しています。 |
| 最近の研究では、アテローム性動脈硬化症が異常な慢性低レベル炎症および腸内環境異常と密接に関連していることが報告されています。 微生物叢の変化は、マウスモデルとヒト患者の両方で炎症状態とアテローム性動脈硬化症から心血管疾患への進行に関連している [290,291,292,293]。 |
| 多価不飽和脂肪酸 (PUFA) は腸内細菌叢と炎症を調節することができ、慢性代謝性疾患において多面的な利点をもたらす [294]。 ただし、食事性多価不飽和脂肪酸がアテローム性動脈硬化症に及ぼす影響とそのメカニズムはまだ完全には解明されていません。 Yiwei らは、アポリポタンパク質 E (ApoE)-/- 欠乏を伴うアテローム性動脈硬化症のマウスモデルにおける多価不飽和脂肪酸の影響を調査する興味深い研究を実施しました。 結果は、α-リノレン酸(ALA)、多価不飽和脂肪酸が豊富な亜麻仁油(FO)の投与が、アテローム性動脈硬化症損傷、体重、胆汁酸、慢性全身性および血管炎症性サイトカイン、およびマクロファージのレベルを改善したことを示しています. さらに、亜麻仁油はリポポリサッカライドレベルを低下させ、腸の完全性を改善し、腸内細菌叢と 短鎖脂肪酸を調節しました。 抗生物質と組み合わせた亜麻仁油による治療は、その有益な効果を減少させ、腸内細菌叢が多価不飽和脂肪酸と相乗的に作用することを示唆している [295]。 これらの結果は、亜麻仁油が豊富な食事が、微生物叢-腸-心臓軸を介してアポリポタンパク質 E -/-マウスのアテローム性動脈硬化症を改善することを示しています。 |
| 多価不飽和脂肪酸 (PUFA) は腸内細菌叢と炎症を調節することができ、慢性代謝性疾患において多面的な利点をもたらす [294]。 ただし、食事性多価不飽和脂肪酸がアテローム性動脈硬化症に及ぼす影響とそのメカニズムはまだ完全には解明されていません。 Yiwei らは、アポリポタンパク質 E (ApoE)-/- 欠乏を伴うアテローム性動脈硬化症のマウスモデルにおける多価不飽和脂肪酸の影響を調査する興味深い研究を実施しました。 結果は、α-リノレン酸(ALA)、多価不飽和脂肪酸が豊富な亜麻仁油(FO)の投与が、アテローム性動脈硬化症損傷、体重、胆汁酸、慢性全身性および血管炎症性サイトカイン、およびマクロファージのレベルを改善したことを示しています. さらに、亜麻仁油はリポポリサッカライドレベルを低下させ、腸の完全性を改善し、腸内細菌叢と 短鎖脂肪酸を調節しました。 抗生物質と組み合わせた亜麻仁油による治療は、その有益な効果を減少させ、腸内細菌叢が多価不飽和脂肪酸と相乗的に作用することを示唆している [295]。 これらの結果は、亜麻仁油が豊富な食事が、微生物叢-腸-心臓軸を介してアポリポタンパク質 E -/-マウスのアテローム性動脈硬化症を改善することを示しています。 |
| 5.3. 冠動脈疾患 |
| 冠動脈疾患 (CAD) は、世界の重大な死亡原因です。 不安定狭心症(UA)は、虚血性心血管疾患および脳血管疾患に典型的な一連の狭心症症状を特徴とする [296]。 インスリン様成長因子-1 は、重要なバイオマーカーであり、冠動脈疾患の治療標的であることが確認されています。 臨床研究では、低血中インスリン様成長因子-1レベルが冠動脈疾患の高発生率と強く関連していることが示されている [297,298]。インスリン様成長因子-1には、炎症の軽減、アポトーシスの軽減、血管新生の刺激など、いくつかの有益な効果があり、これらはすべて血管機能とアテローム性動脈硬化症に関連しています[299]。 |
| 最近の研究では、不安定狭心症の発生と開発の間の腸内細菌叢の役割が強調されています[300]。 たとえば、臨床研究では、不安定狭心症患者は健康な個人よりもBacteroidetesの存在量が少なく、Firmicutesの存在量が高いことが示されました[301]。 さらに、別のマルチオミクス解析研究では、腸内細菌叢、循環代謝産物、および不安定狭心症の重症度の複雑な相互作用が実証された [301]。 |
| 腸内細菌叢は インスリン様成長因子-1関連のシグナル伝達の調節に関与しており、不安定狭心症の発達に寄与していることが報告されています。腸内細菌叢 によるインスリン様成長因子-1 誘導の機序は不明であるが、短鎖医脂肪酸などの代謝産物がインスリン様成長因子-1 産生の増加に寄与している [302]。 |
| Langsha Liu と Fanyan Luo は不安定狭心症患者と健康な被験者との比較研究を実施し、不安定狭心症患者ではBacteroidetesの相対的存在量が増加することを発見しました。 Bacteroidetes 種に属するいくつかの細菌は、アミノ酸の生合成と分解に関与しており、不安定狭心症患者のアミノ酸代謝の不均衡は、その存在量の増加が原因である可能性があることを示唆しています. 彼らはまた、Bacteroidetes の相対量と血清 IGFBP-4 レベルとの間に負の相関関係があることも発見し、これらの細菌がインスリン様成長因子-1システムや 不安定狭心症の発生にさえ関連している可能性があることを示唆しています。 この研究のもう 1 つの重要な発見は、不安定狭心症患者は歯周病に関連する Synergistetes の相対頻度が高いことでした [303]。 |
| プロバイオティクスは炎症マーカーを減少させるため、冠動脈疾患予防の潜在的な手段となります。 冠動脈疾患に苦しんでいるか、または冠動脈疾患を発症するリスクがある患者における研究は、L. plantarum 299v などのプロバイオティクスが、血圧、IL-6、IL-8、IL-12 などの炎症誘発性サイトカインおよびレプチンなどのアディポカインのレベルを低下させ、短鎖脂肪酸レベルを上昇させることによって、この病理のリスクをどのように軽減するか [262,263]を示しています。 どのタイプのプロバイオティクスがこの病状に最も効果的かを判断するには、さらなる研究が必要ですが、これらの最初の研究は、冠動脈疾患の症状を改善して病気の悪化を防ぐことが可能であることを示唆しています。 |
| 5.4. 心不全 |
| 心不全は、心臓の構造と機能の異常な変化によって引き起こされる慢性かつ進行性の疾患である [304]。 心不全の発症における腸の役割、いわゆる「心不全の腸仮説」を支持する科学的証拠が増えています。 この仮説は、心拍出量の減少と全身うっ血の増加が腸粘膜の虚血と浮腫を引き起こし、細菌の移動の増加と循環エンドトキシンの増加を引き起こし、心不全患者に観察される根本的な炎症に寄与する可能性があると述べている[305]。 |
| Niebauer らは、末梢浮腫のある心不全患者は、浮腫のない患者よりもエンドトキシンと炎症性サイトカインの血漿濃度が高いことを発見しました。 短期間の利尿療法の後、エンドトキシンの血清濃度は減少したが、サイトカインは減少しなかった[306]。 |
| 心不全患者を対象とした別の研究では、腸管灌流の低下が抗リポポリサッカライド IgA の血清濃度の上昇と関連していることが示されました。これは、糞便細菌からではなく、腸粘膜の生検から得られた細菌の増殖の増加と相関していました。 細菌微生物叢の性質も、これらの被験者では対照被験者とは異なるように見えた[307]。 最近、Pasini らは、健康な対照被験者と比較して、慢性心不全患者では、Campylobacter, Shigella, Salmonella, Candida 菌などの病原性腸内細菌の量が増加していることを報告した [308]。 これらのデータは、腸のバリア機能の評価が、心不全に対する治療の効果をよりよく理解することにつながる可能性があることを示唆しています。 |
| 腸内細菌叢と心血管および代謝機能との関係の科学的証拠があります。 心臓病は、腸内細菌叢の豊かさ、多様性、構成を変化させる可能性があります。 Anwarらは、強制水泳誘発ストレス(FSIS)モデルによって誘発された心臓リモデリングのラットモデルが、対照動物と比較して微生物多様性の減少を伴う腸内毒素症をもたらしたことを報告しました。 ビタミン C 治療はBacteroidetesの存在量を減少させ、spirochetesの存在量を増加させました。 C反応性タンパク質およびクレアチンキナーゼ心筋バンドの減少も観察された。 この結果は、FSIS 誘発性の心臓合併症も腸内微生物量の変化と関連していることを示唆しています。 高用量のビタミンCは、腸内細菌叢を調節することで免疫力を高め、心臓に良い影響を与える[309]. |
| プロバイオティクスはさまざまな病気の代替治療法と考えられていますが、心不全におけるそれらの利点を判断するには、さらに多くの研究が必要です. 冠動脈閉塞のマウスモデルでは、プロバイオティクスL. rhamnosus GR-1の使用は左心室肥大の減衰と心室機能の改善を示し、プロバイオティクスが心不全への疾患の進行を変えることを示唆している[264]。 心不全患者を対象に実施された別の研究では、真菌性プロバイオティクスであるSaccharomyces boulardii の投与により、クレアチニン、尿酸、高感度C反応性タンパク質などの炎症性バイオマーカーのレベルが低下し、プラセボ群と比較して、左心房の直径を減少させ、左室駆出率を改善することによる心血管機能が改善されました[265]。 |
| 6. 微生物叢と他の代謝変化との関係 |
| 現在、肥満と 2 型糖尿病 (T2DM) は、世界の総人口に対して増加している病状です。 最近の研究では、これらの疾患の代謝に関連する重要な要因として腸内毒素症が特定されており、細菌はホルモンや炎症誘発性免疫応答を刺激する代謝産物を生成することができます。 同様に、これらの病状に見られる軽度の炎症は、腸内に見られる微生物群集を変化させ、炎症の悪化につながります。 腸内細菌叢と代謝の間の双方向の相互作用は、代謝性疾患を予防および制御するための可能な経路を示しています。 さらなる研究が必要ですが、これらの相互作用は、肥満と 2 型糖尿病の治療におけるプロバイオティクスの導入が実行可能な経路であることを示唆しています [310]。 表 5 は、肥満と 2 型糖尿病の研究から得られた、プロバイオティクスの使用に関する最も関連性の高い結果をまとめたものです。 |
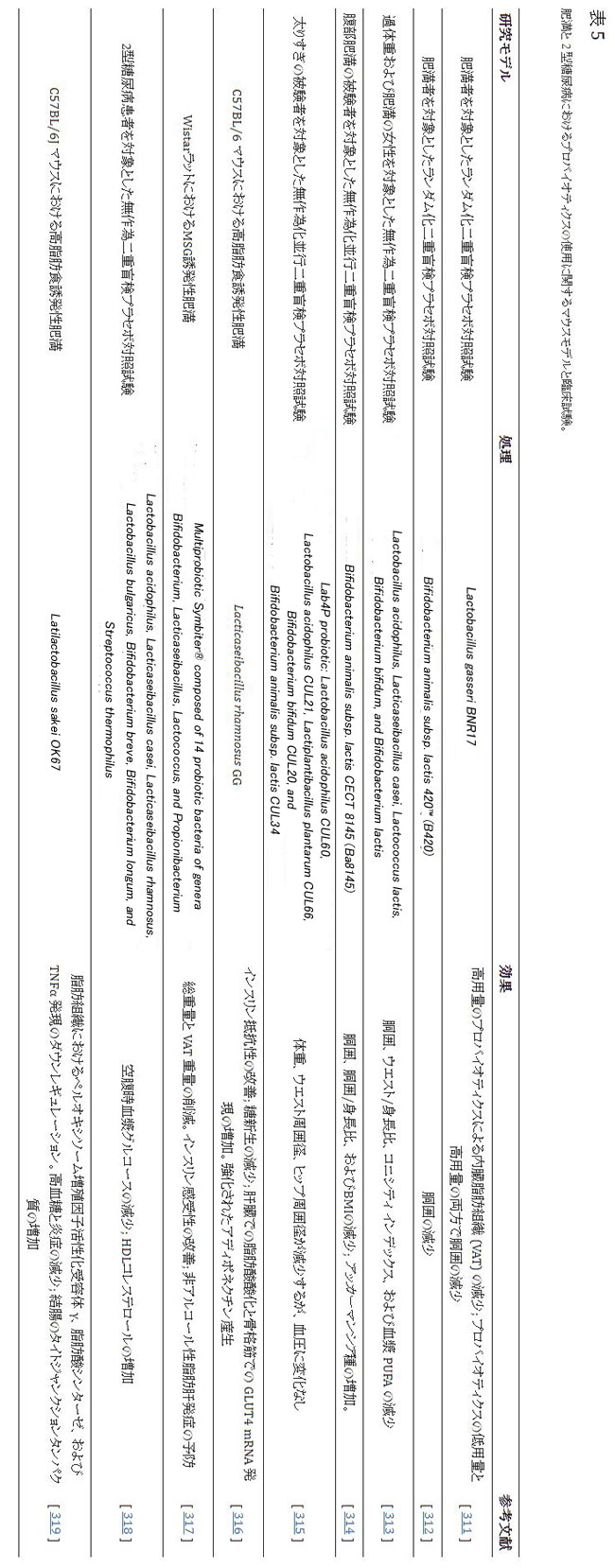 |
| 6.1. 肥満 |
| 世界的に、約 14 億人の成人が過体重であり、5 億人が肥満のカテゴリーに分類されると推定されている [320]。 過体重および肥満は、内臓脂肪組織の異常な蓄積を伴う既知の炎症性疾患です。 この脂肪組織は、TNF-α、IL-1β、IL-6 などの炎症性メディエーターの放出に影響を与えます。 これらのサイトカインは、内分泌またはパラクリン経路で作用し、タンパク質複合体NF-κBの活性化を介してインスリンシグナル伝達を妨害する可能性がある[321,322]。 |
| 肥満の炎症状態は、感染や自己免疫の徴候を伴わず、組織損傷の徴候を示しません。 これが、一部の研究者がメタイン炎症という用語を使用する理由であり、これは代謝的に引き起こされる炎症状態を指す[323]。 いくつかの研究では、過体重と肥満の指標とC反応性タンパク質などの炎症マーカーとの関連が確認されている[324]。 |
| さらに、これらの病状は、真性糖尿病や心疾患などの他の非感染性慢性疾患に関連している[325]。 ただし、腹部の成長を超えた特徴的な症状はありません [326]。 これらの病状は、一般に、食事摂取とエネルギー消費の不均衡によって引き起こされる [327,328]、およびこれらの疾患に関連する炎症において重要な役割を果たしている 腸内細菌叢 の変化などの他の環境的および生物学的要因によって引き起こされる [329]。 |
| 腸内細菌叢は脂肪組織の調節に関与し、その組成に応じて、脂肪組織の炎症性免疫応答を促進する リポポリサッカライドの放出を通じて効果が負になることもあれば、脂肪組織の蓄積に関連する 短鎖脂肪酸を通じて正になることもあります。 脂肪分解を阻害するGPR43とGPR41の活性化により脂肪を分解し、脂肪細胞の分化を改善する[330]。 このように、腸内細菌叢の変化した状態は、腸の感染症に対する感受性の増加につながるだけでなく、肥満、2 型糖尿病、がん、アレルギーなどの代謝病状にもつながることは明らかです [331,332]。 |
| 近年、さまざまな研究が、肥満の病因に対する腸内細菌叢、特に腸内毒素症の寄与の可能性に焦点を当てています。 2006 年に、腸の微小環境と肥満との関係に関する最初の研究が Ley らによって発表されました。そこでは、レプチン欠乏症のマウスの 腸内細菌叢が分析されました。 この研究の結果は、最も豊富な細菌門が Firmicutes と Bacteroidetes であることを示しており、レプチン欠乏症の肥満マウスは、正常体重のマウスと比較して増加した Firmicutes/Bacteroidetes 比を持っていることが示された [333]。 事後研究では、正常な体重の人々とは対照的に、FirmicutesとBacteroidetesの比率の不均衡が肥満の成人に残り、前者が減少し、後者が増加することが確認されました。 さらに、脂肪組織の減少とFirmicutesの割合の増加との関連も報告されている[330,334]。 |
| 栄養に重点を置いた従来の肥満治療には、低カロリー食、肥満手術、身体活動、および場合によっては薬物療法が含まれます。 しかし、腸内細菌叢と肥満における代謝との共生関係を理解することは、この疾患の代替治療の鍵となる可能性があります。 最近、さまざまな研究により、人間の栄養にプレバイオティクスとプロバイオティクスを使用することの利点が示されています [19,335]。 |
| フラクトオリゴ糖、オリゴ糖、ガラクトオリゴ糖などのプレバイオティクスは、肥満の治療に有益な役割を果たしている可能性がある [114,336]。 肥満におけるプレバイオティクスの投与は、血清中の脂質レベルと炎症マーカーのレベルを低下させます。 これらの効果は、摂取したプレバイオティクスの種類と用量に依存する [337]。 |
| さらに、肥満治療におけるプロバイオティクスの使用が広く報告されています。 実験動物モデルと肥満のヒトで実施された研究は、プロバイオティクスが肥満にプラスの効果をもたらし、体重減少を改善し、BMI の低下を達成し、ウエストヒップ周囲長を減少させることを示唆する以前の調査結果を裏付けています。 ヨーグルトや発酵飲料、カプセルやジェルなどのプロバイオティクスが豊富な食品を追加すると、腸内のこれらの細菌集団の増加が促進されます. 最も使用されているプロバイオティクス菌株は、Bifidobacterium animalis spp.、B. lactis、L. acidophilus、L. lactis LL-23、および L. bulgaricus です [311,312,313,314,315,338,339]。 |
| 最も研究されているプロバイオティクス株の 1 つであるLacticaseibacillus rhamnosus GG (LGG) は、グルコース恒常性に利点があることが知られています。 Lacticaseibacillus rhamnosus GGで処理されたマウスは、インスリン感受性の改善と脂質蓄積の減少を示します. Lacticaseibacillus rhamnosus GGはアディポネクチン分泌と細胞エネルギー制御の重要な酵素であるAMPK活性化を刺激するためです[316]。 新生児マウスにLactobacillus 属とBifidobacterium属の生きたプロバイオティクス株を使用すると、体重と内臓脂肪組織が大幅に減少し、インスリン感受性が向上します [317]。 |
| プレバイオティクスとプロバイオティクスが過体重と肥満の予防に関連して腸内細菌叢の調節に及ぼす影響は、短鎖脂肪酸の発酵の増加と腸のバリア機能の改善に関連しています。 同様に、短鎖脂肪酸の増加は無酸素ホルモン、ペプチドYY、およびグルカゴン様ペプチド 1 (GLP-1) の放出に関与し、トリグリセリドおよびコレステロール合成の阻害にも関連しています。 腸内細菌叢の改善は、細菌の転座と血中リポポリサッカライドのレベルを低下させるのに役立ち、IL-6、TNF-α、C反応性タンパク質などの炎症誘発性マーカーの低下を促進する [310] (図 5)。 |
| 図 5 微生物叢 - 腸 - 代謝軸 |
| 肥満および 2 型糖尿病では、炎症状態は感染症や自己免疫因子によってではなく、メタン炎症として知られる状態の代謝機能不全によって引き起こされます。腸内微生物叢の中で最も豊富な細菌門は、FirmicutesとBacteroidetesです。ただし、2 型糖尿病または肥満の人は、健康な人とは対照的に、これらの細菌の割合が不均衡です。さらに、IL-6 や TNF-α などの炎症誘発性サイトカインを促進する細菌移行と血中リポポリサッカライドが増加します。プレバイオティクスとプロバイオティクスの摂取は、腸内細菌叢の正の調節を促進し、糖分解と 短鎖脂肪酸の発酵を促進し、上皮バリア機能を改善し、IL-4 や IL-10 などの抗炎症マーカーの存在量を増加させます。 短鎖脂肪酸の増加は、腸内ホルモン PYY および GLP-1 の放出に影響を与え、トリグリセリドおよびコレステロール合成の阻害に関連しています。また、細菌の転座と炎症誘発性マーカーの産生も減少させます。 |
| 6.2. 2型糖尿病 |
| 2 型糖尿病は、β 細胞機能の進行性の喪失と併せてインスリン作用の低下を伴う慢性疾患である [340,341]。 それは、さまざまな病態生理学的および代謝メカニズムが関与する多因子病理であり、高血糖の状態につながります。 WHO によると、2015 年には、世界中で成人の 11 人に 1 人が 2 型糖尿病に罹患し、合計 4 億 1,500 万件の症例があり、そのうち 46.5% は以前に診断されていませんでした。 現在、2040 年までにこの数は 6 億 4,200 万人に増加し、成人の 10 人に 1 人が罹患すると推定されています [342]。 |
| インクレチンの産生と効果の低下、インスリン抵抗性、腎臓によるグルコース吸収の増加、グルコース代謝の調節の変化など、2型糖尿病の発症にはさまざまな機序が関与している[342]。 インスリン抵抗性は、個人が脂肪組織の蓄積を起こしやすくする要因の1つであり、この組織の機能不全に関与する炎症誘発性メカニズムの活性化の結果であり、炎症誘発性サイトカインを合成し、炎症性表現型の悪化を促進する[343]。 さらに、C反応性タンパク質、IL-6、IL-7、TNF-α、TGF-βなどの他の炎症マーカーが関与すると報告されており[344]、炎症性微小環境を生成する。 |
| 近年、2型糖尿病の発症に直接影響を与える3つのメカニズムが特定されている:軽度の炎症、アミリンの減少、および腸内細菌叢の改変または変化である[345]。 さらに、腸内細菌叢 は、インスリン抵抗性などの真性糖尿病に関連する状態の発症において重要な役割を果たしている [346]。 腸内細菌叢 は、グラム陰性菌によるリポポリサッカライドの放出や 短鎖脂肪酸の減少など、その脂質産物を介して免疫調節メカニズムも仲介します。 優れた腸バリアは、タイトジャンクション複合体の発現を通じて、危険な代謝産物の分子輸送を防止および制御する可能性があります。 ただし、非常に炎症誘発性の微小環境はこれらのタンパク質の発現を変化させ、腸内細菌叢による炎症反応の活性化を増加させます。 |
| 2型糖尿病患者の 腸内細菌叢は、Roseburia intestinalis などの酪酸産生菌の存在が減少しているため、非常に特徴的です。 2 型糖尿病に一般的に関連する他の細菌属は Bifidobacterium と Bacteroidetes であり、他の研究では Faecalibacterium、Akkermansia、Roseburia、Ruminococcus、Fusobacterium、および Blautia との関連が報告されている [347]。 同様に、細菌の割合の変化は、酸化ストレスを促進し、これはビタミンの合成にも関与しており、リポポリサッカライドの血清濃度と腸透過性の増加にも関与している [318,346]。 |
| さらに、肥満と同様に、2 型糖尿病に関連する腸内毒素症は、Firmicutesの存在の有意な低下とBacteroidesの増加に関連している [348]。 この疾患の過程で、Bacteroides caccae、Clostridium hathewayi、Clostridium ramosum、E. coli などの日和見病原体が増加する [346]。 |
| このため、2型糖尿病を制御または予防するために腸内細菌叢を調節する戦略が分析されており、これらの中でプロバイオティクスの使用が増加しています. プロバイオティクスの摂取は、腸内細菌叢の調節を促進するだけでなく、短鎖脂肪酸の発酵を改善するだけでなく、腸のバリア機能も改善します。短鎖脂肪酸の増加は GLP-1 の放出につながり、その結果、IL-6 や TNF-α などの炎症誘発性マーカーが減少する一方で、抗炎症性マーカーが増加する [318,319,349]。 マウスモデルとヒトで実施された研究では、Firmicutes門 (Clostridia, Bacilli, およびNegativicutes) およびBacteroidetes門 (Bacteroidia, Flavobacteriia, Sphingobacteria,および Cytophagia) に属するプロバイオティクス株の割合が、脂質酸化と炭水化物の変化と関連していることが報告されています [343,350,351] (図 5)。 |
| これらの結果は、免疫応答の調節だけでなく、この病状の間の代謝に対する 腸内細菌叢の効果を示しています。 プロバイオティクスを使用すると、免疫反応が低下し、2 型糖尿病に関連する要因をより適切に制御できます。 |
| 7. 結論と今後の展望 |
| 近年、腸内細菌叢は、局所レベルと遠位臓器の両方で、病理学的プロセスの多様性の調節因子としての関連性を獲得しています。 この時点から、代謝性疾患との重要な関係ばかりでなく、微生物叢 - 腸 - 脳軸、微生物叢 - 腸 - 皮膚軸、微生物叢 - 腸 - 肺軸、および微生物叢 - 腸 - 心臓軸などのいわゆる器官間調節軸が出現しました。 |
| 腸内毒素症は、短鎖脂肪酸、トリプトファン誘導体、多様な神経伝達物質などの代謝産物の産生を通じて直接的に、または腸系レベルでの免疫応答の調節によって間接的に、複数の病状の病因における重要な要素として強調されています。 また、血液-脳関門を介した調節分子の通過を可能にすることにより、例えば脳内の遠位臓器レベルでも可能です。 |
| 調節軸の変化に関連する主な病状には、神経変性疾患、発達障害、皮膚病、肺および心臓疾患、代謝に関連する疾患があります。 微生物叢 - 腸 - 器官の変化は、腸内細菌叢の調節を通じてこのアプローチから病状を治療できるさまざまな潜在的な治療薬を研究する機会を生み出しました。 |
| 腸内細菌叢の調節に関する治療的観点の中で、最も研究されているものの 1 つは、プロバイオティック微生物、特に Lactobacillus属およびBifidobacterium属の菌株に属する微生物の使用です。 プロバイオティクスの投与は、さまざまな病理学的プロセスに有益な効果をもたらすことがすでに証明されています。 ただし、これらの治療法の検証はまだ研究中です。 間違いなく、プロバイオティクスは近い将来、複数の病状の治療に重要な機会を提供します。 |
| このレビューで言及された病状におけるプロバイオティクス機能の原因となる提案されたメカニズムのほとんどは、腸内細菌叢に属するさまざまな菌株による微生物代謝産物の産生に基づいています。定義により、これらの代謝産物はポストバイオティクスと見なされます。適切な量を投与すると、宿主の健康に有益な役割を果たす、プロバイオティクス微生物によって分泌される分子です [22]。これは、今後数年間で、さまざまな病気の治療薬としてのプロバイオティクスの投与に加えて、病状の治療におけるより高度な特異性を可能にするポストバイオティクスの使用をさらに研究することが興味深いであろうことを示唆しています. さらに、代替治療として、ナノプロバイオティクスなどのナノ栄養補助食品の分野で新たなアプローチの研究を強化することも必要になります。 これは、微生物をよりよく保護し、腸レベルでのプロバイオティクスの送達を確実に増加させる可能性があるため、プロバイオティクスよりも優れた機能を提供する可能性があります [352,353]。 |
| 最後に、さまざまな病状の治療に有利なメカニズムを解明し、それぞれの病気に使用するのに最適なプロバイオティクスを特定できるようにするために、微生物叢 - 腸 - 器官の関係の研究を続ける必要があります. さらに、微生物叢-腸-肝臓軸などの他の臓器間の相互作用の知識を深め、腎臓などの臓器との関係を強化する必要があります。 さらに、微生物叢 - 腸 - 脳 - 皮膚軸や微生物叢 - 肝臓 - 脳軸など、複数の調節器官が関与するより複雑な軸に関する研究が不足している [354,355]。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Microorganisms. 2022 Jul; 10(7): 1428.に掲載されたProbiotics: Protecting Our Health from the Gutを日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


