ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
乳酸菌とビフィズス菌に由来するエキソポリサッカライドの治療可能性の探求 : 抗酸化、抗腫瘍、および歯周再生 |
Maha A. Khalil et al., |
|
|
概要 |
| 乳酸菌(LAB)とビフィズス菌(Bb)の代謝物は、血液や組織での相互作用を保護する能力、およびヒト組織での生分解性と生体適合性により、最近多くの注目を集めています。細菌由来のエキソポリサッカライド(EPS)は、治療やその他の産業用途で長い間使用されてきましたが、悪影響はありません。この点で、エキソポリサッカライドは、乳酸菌およびビフィズス菌培養上清から分離および特性評価され、抗酸化、抗腫瘍、および歯周再生の特性が決定されました。 エキソポリサッカライドの抗酸化能力は、濃度(0.625〜20 mg / ml)によって異なります。最高の抗酸化活性は乳酸菌:Streptococcus thermophiles DSM 24731-EPS1、Lactobacillus delbrueckii ssp. bulgaricus DSM 20081T-EPS5、Limosilactobacillus fermentum DSM 20049-EPS6、およびビフィズス菌; Bifidobacterium longum ssp. Longum SM200707--PS10で発見されました。ヒト乳癌細胞(MCF7)、ヒト結腸癌細胞(CaCo2)、ヒト肝臓癌細胞(HepG2)、およびヒト胚性腎臓293(HEK 293)細胞を選択したエキソポリサッカライドの抗腫瘍特性を評価するための対照として使用しました。 3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロミド(MTT)アッセイによると、EPS5はヒト乳癌細胞、ヒト結腸癌細胞、およびヒト肝臓癌細胞に対して最も高い細胞毒性を示し、IC50値はそれぞれ7.91、10.69、9.12mg/mlでした。乳酸デヒドロゲナーゼ(LDH)活性は、他のEPS-IC50値と比較してEPS5-IC50値で処理された細胞株で有意に高かった(p <0.05)。リアルタイム(RT)-PCRの結果は、EPS5処理がBax(訳者注:アポトーシスの調節因子)、カスパーゼ8、カスパーゼ3、およびp53(訳者注;癌抑制遺伝子の一つ)遺伝子発現を増加させることを示しました。一方、BCL2(訳者注:細胞死(アポトーシス)の阻害または誘導のいずれかを行う)、MCL1(訳者注:様々な細胞において細胞死(アポトーシス)を抑制するタンパク質)、およびビメンチン遺伝子の発現は減少しました。 3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロミドテストを使用して、ヒト歯根膜線維芽細胞(hPDLFC)の生存率に対するEPS5の影響を調べたところ、EPS5がヒト歯根膜線維芽細胞の生存率を高めることが発見されました。高速液体クロマトグラフィー(HPLC)分析によると、ガラクトースはEPS5の12.5%を占めていました。この研究の結果は、抗酸化剤、抗腫瘍剤、歯周再生などのさまざまな治療目的に大きな期待を寄せるEPSの使用への道を開きます。 |
概要の図示 |
|
乳酸菌とビフィズス菌に由来するエキソポリサッカライドの治療への応用。 |
序章 |
| 細菌は、多種多様な多糖類を生産する能力で知られています。これらの多糖類は、莢膜多糖類(CPS)として細胞表面にしっかりと付着しているか、細胞外多糖類(EPS)として放出されます。多くの細菌分類群、特に乳酸菌とビフィズス菌は、発酵中に広範囲の炭水化物ポリマーを生成します(Sanalibaba and Cakmak,2016)。乳酸菌は一般に安全な微生物(GRAS-一般に安全と認められている)と見なされており、健康上のリスクなしに多くの異なる構造を持つエキソポリサッカライドを作成することもできます(Surayot et al.,2014)。 乳酸菌とは、発酵した天然物から分離されることが多く、産業活動で広く使用されているグラム陽性菌を指します。 乳酸菌とその代謝産物は、免疫力、胃腸機能、肥満への耐性、抗酸化作用、血糖値とコレステロール値を高めることが示されています(Mathur et al.,2020; Wang et al.,2020)。 さらに、抗がん作用、(Tukenmez et al.,2019)、 免疫刺激活性(Adebayo-Tayo et al.,2018)、抗バイオフィルム活性(Lakra et al.,2020)、および抗ウイルス活性(Biliavska et al.,2019)などの潜在的な健康上の利点もあります。 |
| エキソポリサッカライドは、その潜在的な薬理学的および生物医学的用途のために、近年大きな関心を集めています(Barcelos et al.,2019)。 エキソポリサッカライドは2つのカテゴリーに分類されます。ホモ多糖(HoP)は完全に単一の単糖で構成され、ヘテロ多糖(HeP)は2つ以上の単糖で構成されるモノマー単位のポリマー鎖で構成されます(Mende et al.,2016)。高分子量多糖類は、分子量、電荷、側鎖、剛性など、さまざまな化学的性質を示します(Sanalibaba and Cakmak,2016; Wang et al.,2020)。同時に、プロバイオティクス細菌を生産するために使用される成長条件は、EPSの化学構造を変化させます(Zannini et al。、2016)。さらに、実験により、EPSの組成と構造はひずみに依存することが実証されています(Li C. et al。、2014)。 EPSは、分子構造、鎖結合、分子量などの化学的性質により、副作用を最小限に抑えて抗がん作用を示します。結果として、多様な化学構造と特性プロファイルを備えたエキソポリサッカライドは、さまざまな治療用途で有利である可能性があります(Wang et al.,2014; Hussain et al.,2017; Lin et al.,2018)。 |
| 合成抗酸化物質の安全性と毒性についての懸念が高まっていますが、研究者は、人間の健康に安全な天然抗酸化物質を特定するという困難な課題に直面しています(Adebayo-Tayo and Fashogbon,2020)。最近、乳酸菌エキソポリサッカライドには抗酸化特性があり、潜在的な抗酸化剤として使用できることが実証されました(El-Adawi et al.,2012; Adebayo-Tayo et al.,2018)。 Lactobacillus helveticus MB2-1 EPSは、結腸癌細胞において有意な抗酸化および抗癌活性を示します(Li W. et al.,2014; Li et al.,2015)。 Adebayo-Tayo and Fashogbon(2020)は、エキソポリサッカライド活性が、野生型および変異型Lactobacillus delbrueckiiに薬理学的および栄養補助食品として適用されることを確認しました。さらに、Joo Seoetal (2015)は、精製されたLactiplantibacillus plantarumYML009-EPSが高い抗酸化活性を持っていることを確立しました。 Lactobacillus acidophilus、Lactobacillus gasseri、Lactiplantibacillus plantarum、およびLacticaseibacillus rhamnosusは、抗がん作用と抗酸化作用があると報告されています(Sungur et al.,2017; Adesulu-Dahunsi et al.,2018)。 L. delbrueckii ssp bulgaricus SRFM-1の発酵乳から抽出されたエキソポリサッカライドの抗酸化活性は、許容できることが実証されています(Tang et al.,2017)。さらに、L.plantarum ZDY2013から抽出されたエキソポリサッカライドは、スルホン化後に抗酸化活性が増加することが示されました(Zhang et al.,2016)。 |
| 現在、研究者は低リスクの抗がん剤を調査しており、彼らの関心分野の1つは乳酸菌の抗腫瘍特性です(Norouzi et al.,2018)。癌とは、周囲の組織に侵入して損傷を与える可能性のある異常な細胞の制御されていない増殖を指す用語です。グローバルがんセンターによると、がんは主な死因として心臓病を上回っています(Bray et al.,2018)。外科的切除、放射線療法、および薬物療法はすべて、従来の癌治療と見なされています(Qin,2015年)。薬物療法は、骨髄、腎臓、口腔粘膜などの正常な臓器や組織に有害な影響を与えるだけでなく、正常な代謝を損なう可能性があります。さらに、これらの3つのアプローチは、治療後に炎症とそれに続くリンパ浮腫を引き起こす可能性があります(Hu et al.,2017; Adebayo-Tayo and Fashogbon,2020)。手頃な価格、入手可能性、および副作用の欠如の結果として、人々は補完的で代替的な薬を好みます(Liu et al.,2019)。その結果、正常組織への影響はごくわずかでありながら、少なくとも臨床用量を減らし、従来の化学療法剤の効力を高めるためのアジュバントとして作用しながら、癌をうまく治療できる標的療法の必要性が高まっています(Liuetal.,2021)。 |
| 乳酸桿菌は、癌細胞にアポトーシスを誘導し、それらを分化させ、遺伝子毒性物質に結合することができるため、抗癌剤です(Wu et al.,2021)。 乳酸菌エキソポリサッカライドは、胃、肝臓、乳房などのさまざまな腫瘍細胞の増殖を阻害するため、補完的または代替的な癌治療として使用できます。これらの薬剤には、細胞周期の停止やアポトーシスの誘導、抗変異原性、抗酸化性、抗血管新生性、抗炎症性など、さまざまな抗腫瘍効果があります(Nazir et al.,2018; Milner et al.,2021; Wuetal.,2021)。さらに、エキソポリサッカライドには、腫瘍促進酵素活性の低下、免疫応答の増加、宿主支持代謝物と耐性病原体の形成、アポトーシスを介した癌細胞の拡散を阻害することによる細胞増殖の制限など、幅広い効果があります(Liu et al.,2021) 。アポトーシス(プログラムされた細胞死)は、内因性と外因性の2つの異なるメカニズムを介して分子レベルで発生します(Śliżewskaetal.,2021)。アポトーシス促進性および抗アポトーシス性タンパク質のBCl2ファミリーは、内因性またはミトコンドリア経路を調節します。外因性アポトーシスは、細胞質経路とも呼ばれ、腫瘍壊死因子ファミリーのメンバーであるデスレセプターFasによって媒介されます(Zhao et al.,2019)。多くの出版物は、エキソポリサッカライドが抗酸化、免疫刺激、および抗癌特性を含むさまざまな生物学的に活性な特性を持っていることを示しています(El-Adawi et al.,2012; El-Deeb et al.,2018; Angelin and Kavitha,2020)。この点で、海洋細菌L. plantarum 70810からのエキソポリサッカライドは、肝細胞癌細胞株(HepG2)に対して抗増殖効果を示しました(Yahya et al.,2019)。Rajoka et al. (2018)ヒト母乳から得られた乳酸桿菌 Lactobacillus casei SR1, L. casei SR2,および Lactobacillus paracasei SR4の無細胞培養上清(CFCS)の生物活性を調査しました。彼らは、CFCSがアポトーシス遺伝子BAX、BAD、カスパーゼ3、カスパーゼ8、およびカスパーゼ9をアップレギュレートし、BCl2遺伝子発現をダウンレギュレートすることにより、子宮頸がん(HeLa)細胞に対して適切な抗がん効果を示すことを明らかにしました。 |
| エキソポリサッカライドのユニークな特性と潜在的な効果の観点から、歯周病の修復と再生、および癌細胞の増殖阻害とアポトーシスの誘導に大きな影響を与えると仮定しました。 この問題に対処するために、乳がん(MCF7)、結腸がん(CaCo2)、ヒト肝がん細胞(HepG2)、およびヒト胎児腎臓293(HEK 293)細胞(コントロール)に対するエキソポリサッカライドの細胞毒性、およびその抗酸化剤容量を評価しました。 さらに、さまざまな癌細胞株を使用して、現在の研究では、アポトーシス関連の遺伝子発現に対するそれらの影響を調べました。 さらに、in vitroでのヒト歯根膜線維芽細胞(hPDLFC)の生存に対するエキソポリサッカライドの影響を調べた。 |
| 乳酸菌およびビフィズス菌から生成されたエキソポリサッカライドのバイオテクノロジーへの応用を特徴づけ、理解するために、最近多くの研究が行われました。 ただし、特に歯周病の治癒と再生におけるエキソポリサッカライドの途方もない治療の可能性はまだ不明です。 エキソポリサッカライドの幅広い用途と生体高分子の需要の高まりにより、乳酸菌から製造された新しいエキソポリサッカライドを開発することが不可欠です。 私たちの知る限り、L.delbrueckii ssp bulgaricusDSM20081Tによって生成されたエキソポリサッカライドの多機能治療アプリケーションが初めて強調されました。 この範囲の下で、この作業は、乳酸菌およびビフィズス菌培養上清を使用して得られたエキソポリサッカライドの抗酸化、抗腫瘍、および歯周再生の特性を調べることを目的としています。 結果として、L.delbrueckii ssp bulgaricus DSM 20081Tに由来するエキソポリサッカライドは、さまざまな治療用途の有望な候補となる可能性があります。 | 材料および方法 |
| 細胞培養 |
| ダルベッコの改良イーグル培地(DMEM)で、非癌性のヒト胎児腎臓293細胞を増殖させました。結腸がんおよびヒト肝がん細胞は改良イーグル培地で増殖させました。乳がん細胞は、ローズウェルパークメモリアルインスティテュート(RPMI)培地で培養しました。 すべての細胞は、2 mM l-グルタミン、10%ウシ胎児血清(FBS)、および1%ペニシリン-ストレプトマイシンの組み合わせを含む培地で培養されました。 培養物は、5%CO2および95%空気を含む加湿環境で37℃で24時間インキュベートされました。 |
| 細菌株 |
| Streptococcus thermophiles DSM 24731, Lactobacillus lactis ssp. cremoris DSM 20069T, Lacticaseibacillus casei DSM 27537, Lactobacillus delbrueckii ssp. bulgaricus DSM 20080, Lactobacillus delbrueckii ssp. bulgaricus DSM 20081T, Limosilactobacillus fermentum DSM 20049, Lactobacillus acidophilus DSM 20079T, Lactobacillus rhamnosus DSM 20021,および Lactobacillus plantarum ssp. plantarum DSM 20174を含む乳酸菌(n = 9)は、アインシャムス大学農学部およびタンタ大学理学部の培養コレクションから入手しました(El-Adawi et al.,2012)。乳酸菌株は、De Man–Rogosa–Sharpe(MRS,Biokar Diagnostics.Beauvais、フランス)ブロス[10.0 g / lペプトン、8.0 g / l肉抽出物、4.0 g / l酵母抽出物、20.0 g / l D(+)-グルコース、2.0 g / lリン酸水素二カリウム、5 g / l酢酸ナトリウム三水和物、2.0 g / lクエン酸トリアンモニウム、0.2 g / l硫酸マグネシウム七水和物、0.05 g / l硫酸マンガン四水和物、最終pH 6.2]、37°Cで24時間嫌気的に培養しました。 ただし、Streptococcus thermophilusは、M17寒天培地で培養し、好気性および嫌気性条件下で37℃で培養しました。 |
| ビフィドバクテリア菌株Bifidobacterium longum ssp. longum DSM 200707は、KafrEl-Sheik大学から提供されました。 ビフィズス菌は、嫌気性環境において、37℃で0.5g / lのl-システイン(MRSc)を添加したMRS培地で増殖させた。 |
| 粗エキソポリサッカライドの抽出 |
| さまざまな乳酸菌からエキソポリサッカライドを抽出するための実験装置を図1に示します。4°C、10,000 rpmで約20分間の遠心分離を使用して、一晩培養物から細菌を除去しました(Bajpai et al.,2016)。上清を回収し、14%トリクロロ酢酸(1:1)で希釈した後、遠心分離(10,000 rpm、4°Cで20分間)してタンパク質を除去しました。透明な上澄みを収集し、ロータリーエバポレーターを使用して濃縮した。 エキソポリサッカライドは、2倍量の絶対冷エタノールを添加し、4°Cで24時間維持した後、4°C、10,000rpmで20分間遠心分離することにより沈殿させました。脱イオン水で希釈した後、残留物を48時間透析した。溶液を濃縮し、凍結乾燥して、乾燥粉末粗エキソポリサッカライド(mg / l)を得た。粗エキソポリサッカライドの総炭水化物含有量(%)は、標準としてグルコース(2 mg / ml)を使用し、フェノール硫酸法を使用して決定されました(Dubois et al。、1956)。約0.5mlのエキソポリサッカライド溶液(100 mg / ml)を、試験管内で0.5 mlのフェノール6%(v / v)と混合しました。濃硫酸の混合溶液(2.5ml)を試験管に加えた。 10分後、混合物を水浴(30℃)に20分間保持し、そして490nmでの吸光度(Ab)を分光光度計を使用して決定した。検量線にAbsを代入することにより、炭水化物含有量を決定しました。同時に、エキソポリサッカライドのタンパク質含有量はブラッドフォード法(ブラッドフォード、1976年)を使用して決定されました。多糖類溶液(0.5ml、2mg / ml)にタンパク質試薬(2.5ml、95%エタノールおよび100ml85%リン酸中の2.0mg / mlクマシーブリリアントブルーG-250を含む50ml)を加えた。攪拌後、分光光度計を使用して595nmでのAbsを測定しました。タンパク質含有量は、Absを標準曲線に代入することによって決定されました。 |
| 図1 乳酸菌(LAB)とビフィズス菌(Bb)によるエキソポリサッカライド(EPS)の抽出と特性評価のための実験装置で、それらの治療の可能性を探っています。 |
| 粗エキソポリサッカライドの抗酸化活性 |
| 1,1-ジフェニル-2-ピリジルヒドラジン(DPPH)アッセイを使用して、エキソポリサッカライドの抗酸化活性(Kao and Chen,2006)および総抗酸化能(TAC)(Dilna et al.,2015)を調査しました。 図1に示されています。 |
| 1,1-ジフェニル-2-ピリジル-ヒドラジンフリーラジカル捕捉アッセイエキソポリサッカライドがDPPHラジカルを捕捉する能力は、Kao and Chen(2006)によって記述された手順を使用して決定されました。 5ミリメートルの0.02メタノール性DPPHラジカル溶液を5mlのさまざまなエキソポリサッカライド(濃度(0.625〜20 mg / ml)に添加しました。 30分間、反応混合物を暗室に置いた。 混合物のAbsは、分光光度計UV-visible 2401PC(島津、日本)を使用して517nmで分光光度的に測定されました。 測定ごとに3回、平均と標準偏差(SD)が計算されました。 次の式を使用して、DPPHラジカルを除去する能力を決定しました。 |
| |
| Ac、コントロールの吸光度(チェックされた物質を除くすべての試薬は蒸留水に置き換えられます)。 As、サンプル/標準の吸光度。 アスコルビン酸は、伝統的にフリーラジカルスカベンジャーとして利用されてきました。 |
| 総抗酸化能アッセイEPSサンプルのTACは、Dilnaetal。 (2015)。 TAC試薬を作成するには、250 mlの蒸留水に7.45mlの硫酸(0.6 M)、1.235 gのモリブデン酸アンモニウム(4 mM)、および0.9942 gの硫酸ナトリウム(28 mM)を混合します。 15分後、0.1 mlのさまざまなEPS濃度(0.625〜20 mg / ml)を1mlの総抗酸化試薬に溶解し、695nmでのAbsを分光光度計で測定しました。 アスコルビン酸は対照物質として役立った。 さらに、最も抗酸化力のある候補EPS(EPS1、EPS5、EPS6、およびEPS10)が将来の調査のために選択されました。 |
| 細胞毒性アッセイ |
| Manivasagan et al(2013)およびKhalil et al(2022)によって以前に説明されたように,3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウム-ブロミド(MTT)テストを使用して、細胞毒性を評価しました(Sigma Aldrich、セントルイス、ミズーリ州、米国)。 細胞(100μl、乳がん、結腸がん、およびヒト肝がん細胞)を96ウェルマイクロプレートに6×104細胞/ mlの密度で播種し、さまざまな濃度(0.625〜20 mg /)のEPS1、EPS5、EPS6、およびEPS10で処理しました。 ml)。ホルマザン溶液の光学密度は、490nmでBIORADマイクロプレートELISAリーダーを使用して決定しました。さらに、抽出されたエキソポリサッカライドが正常細胞に対して安全であることを確認するために、正常なヒト胎児腎臓293細胞株に対するそれらの阻害効果が決定されました。 MTTは代謝的に活性な細胞でのみ減少するため、活性は細胞生存率の代用となります。エキソポリサッカライド抽出物を5つの細胞株で3回テストし、細胞の生存率を次の式を使用して推定しました。生存率%=サンプルの吸光度/コントロールの吸光度×100。El-Deeb et al. (2018)およびKhalil et al. (2022)、エキソポリサッカライドのIC50値は、グラフパッドプリズム9プログラムを使用して計算され、コントロール細胞(未処理細胞)と比較した場合、成長が50%減少することを示しています。 |
| 抗腫瘍活性 |
| 図1に示すように、アネキシンVテストと細胞から漏れる乳酸デヒドロゲナーゼ(LDH)の量を使用して、エキソポリサッカライドの抗腫瘍活性を測定しました(Gurunathan et al.,2013)。 |
| アポトーシス評価 |
| 製造元の指示によると、すべての細胞株は、ヒトアネキシンVプラチナELISA(eBioscience BMS252 / BMS252TEN; Thermo Fisher Scientific、マサチューセッツ州ウォルサム、米国)によって決定されたアポトーシスを示しました。 37°C、5%CO2の加湿インキュベーターで24時間、細胞株を96ウェル平底培養プレートでEPS1、EPS5、EPS6、EPS10のIC50濃度で培養しました。このアッセイは、サンプルまたは標準に存在するヒトアネキシンVがマイクロウェルプレートコーティング抗体に結合するという事実に基づいています。その結果、ビオチン結合抗ヒトアネキシンV抗体が追加されました。これは、一次抗体によって捕捉されたヒトアネキシンVを特異的に認識します。インキュベーション後、すべての非結合ビオチン結合抗ヒトアネキシンV抗体を洗浄ステップ中に除去しました。ビオチンに結合した抗ヒトアネキシンV抗体と反応するストレプトアビジン西洋ワサビペルオキシダーゼ(HRP)を使用しました。サンプルまたは標準液中のヒトアネキシンVの量に比例する着色物質を作成することが可能です。酸を加えて反応を停止させた後、マイクロプレートリーダーを使用して450nmでのAbsを測定します。検量線の作成では、7つのヒトアネキシンV標準希釈液と7つのヒトアネキシンVサンプル濃度を計算しました。 |
| 乳酸デヒドロゲナーゼアッセイ |
| エキソポリサッカライド処理細胞株から漏れる乳酸デヒドロゲナーゼの量を使用して、原形質膜の完全性を決定しました(Gurunathan et al.,2013)。 細胞は、IC50濃度のさまざまなエキソポリサッカライドに24時間曝露されました。乳酸デヒドロゲナーゼ活性は、標準条件下(K726-500)で3時間培養した後、製造元の指示(Biovision、Mountain View、CA、United States)に従って培養液中で測定しました。乳酸デヒドロゲナーゼの定量化は、マイクロプレートリーダーを使用した450nmの乳酸デヒドロゲナーゼによるNADからNADHへの還元によって引き起こされる色の変化に基づいています。乳酸デヒドロゲナーゼの活性は次の式に従って決定されました。 乳酸デヒドロゲナーゼ活性レベル(nmol / ml)= B /(ΔT×V)×サンプル希釈; ここで、BはΔT(T2-T1)から生成されたNADHの量、T1は最初の読み取り時間(A1)(分単位)、T2は2番目の読み取り時間(A2)(分単位)、Vは 反応ウェルに加えられた前処理されたサンプルの量(ml)。 |
| 粗乳酸菌-EPS5の特性評価 |
| フーリエ変換赤外(FT-IR)分光法を使用して、選択したEPS5の主要な構造グループを決定しました。 KBr技術を使用して、エキソポリサッカライドスペクトルを決定しました。 多糖類サンプルは、1:100のサンプル比でKBrペレットに粉砕されました。 赤外線フーリエ変換スペクトルは、4,000〜400 cm–1の範囲で4 cm–1の分解能でBruker Tensor 27機器を使用して取得されました(Fontana et al.,2015)。 EPS5の単糖含有量は、Yang et alによって説明されているように高速液体クロマトグラフィー(HPLC)を使用して決定されました (2012)。 簡単に説明すると、再水和したEPS1およびEPS5サンプルを1-フェニル-3-メチル-5-ピラゾロンで誘導体化し、4ユニットポンプ(Agilent Technologies、米国デラウェア州ウィルミントン)とShim-PakVPODSカラムを使用した高速液体クロマトグラフィーで分析しました。 (4.6×150 mm)245nmでのAbsモニタリング。 インテグレータを使用して、さまざまな糖標準をEPSサンプルのリテンションタイムと比較しました。 |
| 遺伝子発現分析 |
| RNAは、MagJET RNA精製キットを使用して、未処理(ネガティブコントロール)またはEPS5IC50で処理してから24時間後にすべての癌細胞株から分離されました。 抽出されたRNAの質と量は、1%アガロースゲル電気泳動とNanodrop(Thermo Fisher Scientific、Inc.、Wilmington、DE、United States)を使用して決定しました。 定量的リアルタイム(qRT)-PCRは、Sybr Green Supermix RT-PCRキット、各遺伝子のフォワードおよびリバースプライマー(補足表1)、およびSYBR green PCRマスター混合物を使用して、製造元のプロトコルに従って実行されました。 遺伝子BCL2、MCL1、Bax、カスパーゼ3、カスパーゼ8、ビメンチン、およびp53は、ハウスキーピング遺伝子(GAPDH)で正規化され、未処理の細胞について発現しました。 増幅後、得られたデータを相対的な遺伝子発現の式を使用して分析した(Winner et al.,1999; Livak and Schmittgen,2001)。 |
| 増殖効果の決定 |
| Arslan and Kantarcioglu(2019)に従って、ヒト歯根膜線維芽細胞(hPDLFC)を抽出し、増殖させました。 タイフ大学の臨床研究倫理委員会は、倫理に基づいて研究を受け入れました。 生存率に対するさまざまなEPS5濃度の影響を調べるために、ヒト歯根膜線維芽細胞を96ウェルプレートに1×104細胞/ウェルでプレーティングし、MTTアッセイを使用して生存率を評価しました。 |
| 統計分析 |
| Minitab統計ソフトウェア(17.1.0.0、Minitab Inc.、シカゴ、イリノイ州、米国)およびGraphPad Prismバージョンを使用して、データ(9.0.0)を解釈および処理しました。乳酸デヒドロゲナーゼ活性と相対的な遺伝子発現を評価するために、対応のないt検定を使用してグループの平均を比較しました。 ただし、ANOVA単一因子を使用して、さまざまなプロバイオティクス細菌株による粗エキソポリサッカライドの合成とエキソポリサッカライドの抗酸化活性を分析しました。 すべての測定値は平均値±SDとして表されます。 一元配置分散分析を使用して2つ以上のグループを比較し、テューキー検定を使用して多重比較を行いました。 0.05未満のp値は有意であると見なされました。 | 結果 | r>
| 表1は、乳酸菌とビフィズス菌によるエキソポリサッカライドの生成、およびそれらの炭水化物とタンパク質の含有量を示しています。 さまざまな細菌株によって生成されるエキソポリサッカライドの量は大幅に異なりました(p <0.05)。 細菌由来のエキソポリサッカライドは174.9〜295.4 mg/lの範囲でした。 L. delbrueckii ssp. bulgaricus DSM 20081Tは、最も多くのエキソポリサッカライド(EPS5、295.4±9.7)を生成しました。 一方、L.plantarum DSM 20174の生産量は最も少なかった(EPS9、174.9±5.2)。 粗エキソポリサッカライドの炭水化物とタンパク質の含有量は菌株によって異なります(p <0.05)。 総炭水化物含有量は85.0から96.7%の範囲でしたが、タンパク質含有量は3.3から9.3%の範囲でした。 EPS5の平均炭水化物レベルは他の菌株よりも有意に高い(96.7±0.3%)(p <0.05)。 さらに、最終的な凍結乾燥粗EPSサンプルでは、S. thermophiles DSM24731-EPS1は、タンパク質汚染の濃度が最も低かった。 |
| 表2、3、3に示すように、10の細菌株からの粗エキソポリサッカライドの抗酸化能力は、ラジカルスカベンジャー(それぞれDPPHとTAC)の活性を評価することによってin vitroで評価されました。さまざまなエキソポリサッカライド濃度のDPPHフリーラジカル捕捉能は、濃度依存的に有意に増加しました(p <0.05)(表2)。 20 mg / mlでは、エキソポリサッカライドがDPPHラジカルを除去する能力は33.3%から77.0%の範囲でした。 S. thermophiles DSM 24731-EPS1は、77%で、すべての菌株の中で最も高い除去率であり、L.delbrueckiissp bulgaricus DSM 20081T-EPS5、B.longum DSM 200707-EPS10、およびL. fermentumDSM20049-EPS6がそれに続きました。 L. acidophilusDSMZ20079T-EPS7は除去活性が最小でした(表2)。非酵素的抗酸化防御機構の能力は、TACによって表されます。表3は、抗酸化能が0.75〜2.5%の範囲であることを示しています。 L. delbrueckii ssp bulgaricus DSM 20081T-EPS5の最高阻害率は2.5%でした。、続いてS. thermophiles DSM 24731-EPS1、L.fermentum DSM 20049-EPS6、およびB.longum ssp. longum DSM 200707-EPS10は、すべて同等の分解能力を持ち、L.acidophilus DSM 20079 T-EPS7は23.95%で最も低い阻害率を示しました。 EPS1、EPS5、EPS6、およびEPS10は、テストされた他のエキソポリサッカライドよりも大幅に高い抗酸化活性を示したため、この研究の後続のアッセイに選択されました。 |
| 図2に示すように、乳がん、結腸がん、およびヒト肝がん細胞はすべて、MTT細胞毒性実験に対して異なる反応を示しました。 すべてのエキソポリサッカライドは濃度依存的に細胞を阻害し、さまざまな細胞株にさまざまな影響を及ぼしました。 EPS1、EPS5、EPS6、およびEPS10の最高用量(20 mg / ml)で24時間処理した後、ヒト胎児腎臓293細胞の生存率はそれぞれ93.07、96.3、93.05、および90.07 mg / mlでした(図2A)。 ; 乳がん細胞はそれぞれ55.9、52.1、85.52、および75.01 mg / mlでした(図2B)。結腸がん細胞はそれぞれ68.69、67.0、および87.59 mg / mlであり(図2C)、ヒト肝がん細胞はそれぞれ62.0、59.5、83.86、および72.66 mg / mlでした(図2D)。 図2Aに示すように、選択したエキソポリサッカライドがヒト胎児腎臓293細胞の生存率(%)に与える影響は、0.625 mg / ml(98.9%)で、ヒト胎児腎臓293細胞の生存率に有意差がないことを示しています(p = 0.1340)。 ヒト胎児腎臓293細胞の増殖速度を、0.125 mg / ml(p = 0.0027)、2.5 mg / ml(p = 0.0021)、5 mg / ml(p = 0.0090)の用量でエキソポリサッカライドで処理した細胞の増殖速度と比較した場合、 10 mg / ml(p = 0.0037)と20 mg / ml(p = 0.0012)では、有意差が観察されました。 20 mg / mlでは、乳がんの生存率は対照の生存率と比較して30%以上減少し、p=0.0066の有意差がありました。一方、エキソポリサッカライド濃度が0.625(p = 0.1340)の場合、乳がんの生存率に有意差はありませんでした(図2B)。 コントロールの結腸がん生存率%を5 mg / ml(p = 0.0022)、10 mg / ml(p = 0.0019)、および20 mg / ml(p = 0.0038)(図2C)。 コントロールのヒト肝がん細胞生存率%を、2.5 mg / ml(p = 0.0007)および5 mg / ml(p = 0.0010)のエキソポリサッカライド用量で処理した細胞と比較すると、非常に有意な差が見られました(図2D)。 一般に、EPS1とEPS5で得られたデータによると、抽出物の効力は、さまざまな濃度で乳がん>ヒト肝がん細胞>結腸がんの順でした。ただし、EPS6とEPS10は、ヒト肝がん細胞>乳がん>結腸がんの順に強い抑制率を示しました。さらに、エキソポリサッカライドはヒト胎児腎臓293細胞に対して最小限の細胞毒性効果を持つことがわかりました。 調査結果によると、エキソポリサッカライドは正常細胞に影響を与えずに、さまざまな癌細胞の生存率を大幅に低下させました。 |
| 図2 MTTアッセイを使用したさまざまな癌細胞株におけるエキソポリサッカライドの細胞毒性評価 |
| (A)ヒト胎児腎臓293細胞株、(B)乳がん細胞株、(C)結腸がん細胞株、(D)ヒト肝がん細胞株。 EPS1、S.thermophilusDSM24731に由来するエキソポリサッカライド; EPS5、L.delbrueckii ssp. bulgaricusDSMZ20081Tから派生したエキソポリサッカライド。 EPS6、L.fermentum DSMZ 20049から抽出されたエキソポリサッカライド、および EPS10、B.longum ssp. longumDSMZ200707から抽出されたエキソポリサッカライド。 |
| 図3に示すように、乳がん細胞のEPS1、EPS5、EPS6、およびEPS10のIC50値は、それぞれ8.06、7.91、22.97、および12.36 mg/mlでした。 結腸がんの場合、それぞれ10.69、11.22、25.85、および15.23 mg/mlでした。 ヒト肝がん細胞の場合、それぞれ9.12、9.37、20.40、12.54 mg/mlでした。 EPS5は最も活性の高い成分を持ち、乳がん、結腸がん、およびヒト肝がんで最も低いIC50値(それぞれ7.91、10.69、および9.12 mg / ml)で最も高い細胞毒性を示しました。一方、EPS6は、乳がん、結腸がん、およびヒト肝がんに対してそれぞれ12.36、15.23、および12.54 mg/mlで最も高いIC50値を示しました。未処理のコントロール細胞が高い生存率を維持したことは注目に値します。 エキソポリサッカライドは正常なヒト胎児腎臓293の生存率を低下させましたが、29.26〜85.7 mg / mlのIC50値は、癌細胞のIC50値よりも有意に大きかった(図3)。これらの結果は、異なるエキソポリサッカライドがエキソポリサッカライドの生物活性に大きな影響を与える可能性があること、および阻害機能がヒト細胞株によって異なり、大量投与で重度の細胞毒性を引き起こすことを示しています。 |
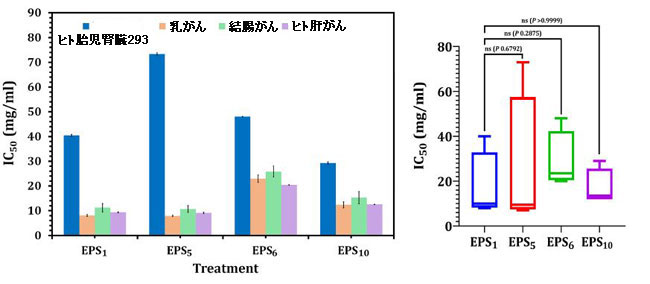
|
| 図3 MTTアッセイを使用したヒト胎児腎臓293、乳がん、結腸がん、およびヒト肝がん細胞に対するエキソポリサッカライドの細胞毒性。 |
| EPS1、S.thermophilusDSM24731に由来する; エキソポリサッカライド EPS5、L.delbrueckii ssp. bulgaricus DSMZ 20081Tから派生したエキソポリサッカライド; EPS6、L.fermentumDSMZ 20049から抽出されたエキソポリサッカライド、およびEPS10、B.longum ssp. longumDSMZ200707から抽出されたエキソポリサッカライド。 |
| アネキシンVは、アポトーシス性ホスファチジルセリン放出細胞に付着し、それらの凝固促進および炎症促進活性を低下させることが示されています。 得られた結果は、図4に示すように、選択した粗エキソポリサッカライドのIC50値処理後、乳がん、結腸がん、およびヒト肝がん処理細胞で細胞アポトーシスが引き起こされたことを示しています。 EPS5-IC50値で処理された乳がん、結腸がん、およびヒト肝がん細胞では、他のエキソポリサッカライド処理と比較して最大のアネキシンV量(それぞれ18.4、10.28、および16.30 ng / ml)が観察されました。 一方、EPS6治療後のアポトーシスアッセイでは、内因性の総アネキシンVレベルがさまざまな癌細胞で低いことが明らかになり、EPS6が効果のない抗癌剤であることが示唆されました。 一般に、さまざまなエキソポリサッカライドで処理された細胞の総内因性アネキシンVレベルは、EPS1、EPS5、EPS6、およびEPS10で処理された細胞のアネキシンVの濃度に対照細胞(未処理)と比較して有意差がないことを示しました(p = 0.2002、0.1077、0.7084、および0.5011)(図4)。 |
| 図4 癌細胞株に対するアネキシンVELISAキットを使用したアポトーシス評価 |
| EPS1、S.thermophilusDSM24731に由来するエキソポリサッカライド; EPS5、L.delbrueckii ssp. bulgaricus DSMZ 20081T;から派生したエキソポリサッカライド。 EPS6、L.fermentum DSMZ 20049から抽出されたエキソポリサッカライド、およびEPS10、B.longum ssp longumDSMZ200707から抽出されたエキソポリサッカライド。 |
| 放出された乳酸デヒドロゲナーゼの量、可溶性細胞質酵素を利用して、EPS1、EPS5、EPS6、およびEPS10のIC50によって影響を受ける細胞膜の分解と漏出の程度を決定しました(図5)。 乳がんに関しては、図5に示すように、EPS1およびEPS5処理細胞の乳酸デヒドロゲナーゼ活性は、対照(未処理)乳がん細胞(p <0.0001)に関連して、それぞれ2.36倍および2.58倍有意に増加しました。 さらに、結腸がんの場合、乳酸デヒドロゲナーゼ活性は、未処理の結腸がん細胞と比較して、各EPS1およびEPS5のIC50値で処理された細胞でそれぞれ2.85倍および3.02倍増加しました。 乳酸デヒドロゲナーゼ活性は、EPS5で処理したヒト肝がん細胞で最も高かった(670 nmol / ml)。 図5に示すように、EPS5はEPS1よりもかなり高い乳酸デヒドロゲナーゼ活性を示し(p = 0.0001)、EPS10とEPS6がそれに続きました。コントロールセルと比較して、さまざまなエキソポリサッカライドで処理された乳がん細胞の乳酸デヒドロゲナーゼリーク濃度は大幅に変動しました(p = 0.0202)。 一般に、EPS5は、テストされたエキソポリサッカライドの抗腫瘍能力について得られたデータに基づいて、私たちの研究で分析された3種類の細胞株で有意な抗腫瘍活性を示しました。 その結果、EPS5はさらに特徴づけられ、以下の生物学的用途で使用されます。 |
| 図5 異なるエキソポリサッカライドで処理された乳がん、結腸がん、およびヒト肝がんの乳酸デヒドロゲナーゼ(LDH)活性。 |
EPS1、S.thermophilusDSM24731に由来するエキソポリサッカライド; EPS5、L.delbrueckii ssp. bulgaricusDSMZ20081Tから派生したエキソポリサッカライド。 EPS6、L.fermentum DSMZ 20049から抽出されたEPS、および EPS10、B.longumssp. longumDSMZ200707から抽出されたエキソポリサッカライド。 |
| フーリエ変換赤外分析では、図6に示すように、EPS5で形成された官能基の変化が示されました。EPS5のFT-IRスペクトルには、3410、2931、2502、1650、1381、1136、872、620、および530 cm–1の8つの吸光度バンドがありました。 表4は、高速液体クロマトグラフィーで測定したEPS5サンプルの保持期間、曲線下面積、および単糖組成を示しています。 EPSサンプルの糖度は大幅に異なります(p <0.05)。 EPS5には、ラムノース、マンノース、リボース、グルコース、ガラクトースなどの高濃度の糖が含まれていました。 EPS5の糖濃度は1.7938から38.8584mg/ 100 gまで変化し、ガラクトースが最大濃度でした。 EPS5のリボース、ラムノース、グルコース、マンノース、ガラクトースの比率は1:2.7:7.4:5.1:12.5でした。 その結果、EPS5サンプルは糖度に基づいてヘテロ多糖類でした。 |
| 図6 L.delbrueckii ssp. bulgaricusDSM20081T由来のEPS5のFTIRスペクトル。 |
| 表4 高速液体クロマトグラフィーを使用したL.delbrueckii ssp. bulgaricus DSM20081T-EPS5の単糖組成の決定 |
| 24時間、定量リアルタイムPCRを使用して、IC50-EPS5値に応答するアポトーシスおよび細胞周期関連遺伝子のmRNAレベルを決定しました(図7)。遺伝子発現のデータは、IC50値を持つEPS5が対照と比較して結腸がん細胞(p = 0.0065)で有意にアップレギュレーションされたBax遺伝子発現であることを明らかにしました(図7A)。しかし、BCL2およびMCL1(p = 0.0001)遺伝子の発現の著しい減少が、処理された結腸がん細胞で観察されました(図7A)。さらに、結果は、EPS5投与がアポトーシス遺伝子カスパーゼ3およびカスパーゼ8の発現を増加させることを示しました。p53遺伝子の最も有意なアップレギュレーションは、IC50-EPS5で処理された結腸がん細胞で検出されました(p = 0.0001)。比較すると、Bax遺伝子の最も有意でないアップレギュレーションは、同じ濃度のEPS5(p = 0.0002)で処理された乳がん細胞で見られました(図7B)。さらに、処理された乳がん細胞では、BCl2、MCL1、およびビメンチン遺伝子がそれらの発現レベルでダウンレギュレーションを観察しました(p <0.0001)。ただし、カスパーゼ3、カスパーゼ8、およびBax遺伝子は、発現のアップレギュレーションを記録しました(図7B)。図7Cに示すように、BCL2の発現は、MCL1およびビメンチンの発現の場合と同様に、処理されたヒト肝がん細胞で強くダウンレギュレーションされ、コントロールと比較して研究対象の遺伝子のレベルを劇的に低下させました(p = 0.0001)。一方、EPS5は、コントロール(p = 0.0001)と比較してp53(12.04)の発現を有意に増加させましたが、Baxの発現には影響を与えませんでした。 |
| 図7 L. delbrueckii subsp. bulgaricusDSM20081T-EPS5がさまざまな細胞株のアポトーシスに関連する遺伝子の相対的発現に及ぼす影響 |
| (A)乳がん、(B)結腸がん、(C)ヒト肝がん。 |
| 培養されたヒト歯根膜線維芽細胞は、健康な臼歯から正常に抽出されました(図8)。 さまざまな濃度の粗EPS5と24時間共培養した後、MTTアッセイを使用して細胞生存率を測定しました。 図9に示すように、ヒト歯根膜線維芽細胞の実行可能性は、粗EPSへの曝露後に大幅に増加しました。 ヒト歯根膜線維芽細胞を0.625mg/ mlの濃度のエキソポリサッカライドで処理した場合、生存率は未処理の細胞と有意差はありませんでした(p = 0.1583)。 未処理のヒト歯根膜線維芽細胞の生存率を2.5mg/ ml(p = 0.0003)および5 mg / ml(p = 0.0003)エキソポリサッカライドで処理した細胞と比較すると、有意差(p = 0.0001)が観察されました(図9)。 |
| 図8ヒト歯根膜線維芽細胞(hPDLF)の分離ステップ |
| (A)健康な臼歯、(B)歯周層の削り取り、(C、D)歯根膜のミンチ。 |
| 図9 L. delbrueckii ssp. bulgaricus DSM 20081Tに由来する粗EPS5が、MTTアッセイを使用したヒト歯根膜線維芽細胞の細胞生存率に及ぼす影響 | 討論 |
r>
| この研究では、乳酸菌(n = 9)とビフィズス菌(n = 1)を使用してエキソポリサッカライドを抽出し、それらのエキソポリサッカライド収量を決定しました。 得られたエキソポリサッカライドは、濃度およびひずみに依存する高度な変動を示しました(p <0.05)。 他のテストされた菌株と比較した場合、L.delbrueckii ssp. bulgaricus DSM 20081Tは最も多くのエキソポリサッカライド(295.49±0.7)を生成しました。 Tukenmez et al(2019)は、L.delbrueckii ssp. bulgaricus B3が最高量のエキソポリサッカライド(449.0±0.4 mg / l)を生成したことを報告しました。 Sungur et al(2017)によると、L.gasseriの2つの菌株は242および255 mg/lのエキソポリサッカライドを産生しました。 Bifidobacterium bifidumWBIN03は241.20mg/ lの濃度でエキソポリサッカライドを生成しましたが、L.plantarumR315は290.17mg / lの濃度でエキソポリサッカライドを生成しました(Li S. et al.,2014)。 |
| 活性酸素種(ROS)と酸素中心のフリーラジカルは、体内の多くの代謝的および生理学的プロセスの副産物です(Thibessard et al.,2004)。 活性酸素種のレベルが上がると、タンパク質、DNA、脂質が分解され、組織の損傷や臓器の機能障害がさらに発生します。 これは、がん腫、動脈硬化症、変形性関節症、神経変性などの深刻な副作用を人間に引き起こします(Li C. et al.,2014)。 酸化防止剤は、酸化を防止または延期する物質です。 腫瘍細胞は、代謝活性の増加および他のさまざまな腫瘍形成プロセスの結果として活性酸素種を生成し、腫瘍細胞の増殖と生存、間葉系の移動と浸透、遺伝子変異、および血管新生を促進します。 活性酸素種の生成を減らす抗酸化剤ベースの治療法は、腫瘍の発生を遅らせたり、予防したりするために使用される場合があります(Liou and Storz.2010; Gurunathan et al.,2013)。 抗酸化作用を有する可能性のあるプロバイオティクス細菌に由来するエキソポリサッカライドについては、数多くの研究が行われています(Adebayo-Tayo and Fashogbon、2020; Wu et al.,2021)。 私たちの調査結果によると、EPS1(77%)とEPS5(75.2%)のラジカル捕捉能力は、抗酸化活性に大きく貢献しています。 Adebayo-Tayo and Fashogbon(2020)は、DPPHシステムおよびその他の生物学的試験を使用して、野生型EPSWLD L. delbrueckii ssp. bulgaricusおよび変異体EPSMLDL.delbrueckii ssp. bulgaricusによって生成されるエキソポリサッカライドの抗酸化活性を評価します。 EPSWLDとEPSMLDの抗酸化能は、DPPH除去能力で1.21〜1.80%、0.41〜1.42%であることがわかりました(それぞれ37.5〜73.4%対37.5〜65.6%)。 El-Adawi et al(2012)は、B.longumとL. plantarumの細胞外抽出物のDPPH除去能力がそれぞれ89.8%と89.8%であると報告しました。 L. delbrueckii ssp. bulgaricus DSM 20081Tの全培養物は、最高のDPPHラジカル捕捉活性を持っていました。 LiS.らによると。 (2014)、B.bifidum WBIN03(B-EPS)とL. plantarum R315(L-EPS)はどちらも、EPS濃度とともに増加する高いDPPH除去能力を持っていました。 明らかに、70 mg / ml EPSは、異なる濃度のB-EPS(30 mg / ml、94.4%)とL-EPS(70 mg / ml、94.49%)のDPPH除去挙動を比較すると、高いDPPH除去能力を持っていました。 最近の研究により、EPSの抗酸化能力は、分子量、単糖組成、単糖モル比、グリコシド結合などの多くの要因の影響を受けることが明らかになっています(Wu et al.,2021)。 結果として、エキソポリサッカライドの重要な抗酸化活性は、ヒドロキシル基、炭素フリーラジカル、および硫酸化基を含むその化学基に起因する可能性があります(Wang et al.,2015)。 |
| がんは、制御不能な細胞増殖を引き起こし、臓器の損傷を引き起こし、最終的には死に至る病気です。 さまざまな種類のがんによる死亡者数は年々着実に増加しています。 癌患者に対する現在の化学療法および放射線療法は、腫瘍細胞と正常細胞の両方に害を及ぼします(El Ghany et al.,2015; Zhang et al.,2017)。 現在の研究は、現在入手可能な合成医薬品よりも副作用の少ない抗腫瘍剤の製造を目指しています。 その結果、エキソポリサッカライドの抗腫瘍特性は、この研究の潜在的ながん治療として調査されています。 ヒトの乳がん、結腸がん、および肝臓がん細胞に対するエキソポリサッカライドの細胞毒性、およびアポトーシス遺伝子発現におけるそれらの役割が決定されました。 抗がん剤の大部分は、健康な細胞に対して細胞毒性があることが示されており、生物医学における安全な代替薬の重要な必要性を浮き彫りにしています(Zhang et al.,2017)。 Mohanta et al(2017)MTTテストが癌性細胞の細胞毒性効果を決定するための最も進んだ方法の1つであることを示しました。 これは、代謝的に活性な細胞のミトコンドリアにおけるミトコンドリアコハク酸デヒドロゲナーゼによるMTTのホルマザンへの還元に基づいています。 この実験での細胞毒性試験の結果は、エキソポリサッカライドによる治療が細胞死の原因と治療の感度に応じて異なる細胞応答を誘発することを明らかにしました。 具体的には、正常な哺乳類細胞(HEK 293)のエキソポリサッカライドのIC50値は、85.7〜29.68 mg/mlの範囲でした。 Nami et al.(2015)はEnterococcus lactis IW5分泌物が正常な細胞に悪影響を及ぼさず、細胞の95%が正常に発達していることを発見しました。 さらに、健康な哺乳動物細胞におけるL.acidophilus 20079からの新しい精製エキソポリサッカライドの2〜5 mg/mlの投与量は、がん細胞を破壊するための選択性指数が1.96〜51.3であることが示されました(El-Deeb et al.,2018)。 |
| L. plantarumの細胞外多糖類は、50 mg / mlの濃度に達するまで、正常な線維芽細胞L929で有害であることが判明していません(Ismail and Nampoothiri、2013)。 L929とHT29でL.paracaseiとLactobacillus brevisからのエキソポリサッカライド 40mg/ mlで処理した後、L929の生存率は60を超えています。 一方、HT29の生存率は20%未満です(Mojibi et al.,2019)。複数のがん性細胞死経路および関連する治療に対する感受性に基づいて、細胞毒性実験により、エキソポリサッカライド治療に対する非同一の細胞応答の存在が明らかになったと推測できます。 EPS5は最も活性の高い成分を含み、乳がん、結腸がん、およびヒト肝がんで最も低いIC50値を示しました(それぞれ7.91、10.69、および9.12 mg / ml、p <0.05)。 Vidhyalakshmi and Vallinachiyar(2013)は、Bacillus sp.に由来するエキソポリサッカライドは、正常細胞には影響を与えずに、低濃度で乳がん細胞に対して細胞毒性を示す可能性が高いことを示しました。 さらに、Liu et al(2011)は、L.casei 01 エキソポリサッカライドが5〜100μg/mlの範囲の用量でHT29の増殖を阻害することを発見しました。 L. fermentum抽出物は、非がん性結腸細胞の成長を促進しながら、結腸がん細胞の成長を阻害しました(Kahouli et al.,2015)。 がん細胞に関する彼らの発見は、ヒストンデアセチラーゼ阻害剤(HDAC)が健康な結腸細胞の増殖を刺激するが、がん細胞を殺すので、プロピオン酸と酪酸の存在がプロバイオティック細菌の選択性に寄与する可能性があることを示唆しています(Kahouli et al.,2015)。 Nami et al(2015)は、E.lactis IW5副産物が、子宮頸がん、乳がん、AGS、およびHT-29を含むいくつかのタイプのがん細胞の生存率を低下させ、この効果の根底にある主要なメカニズムががん細胞のアポトーシスの活性化であったことを報告しました。 |
| アネキシンV分析では、エキソポリサッカライド濃度が上昇すると、調査したすべての細胞株で生細胞の割合が減少することが明らかになりました。 処理された細胞におけるアネキシンVの濃度の上昇は、エキソポリサッカライドがアポトーシスを誘導することを示しています。 調査により、EPS5のIC50で処理すると、乳がん、結腸がん、およびヒト肝がんでそれぞれアポトーシス細胞の数が大幅に増加し(18.4、10.28、および16.3 ng / ml)、続いてEPS1で処理したが、 EPS6のIC50により、アポトーシス細胞の数が大幅に減少しました。 アポトーシスは、主に細胞の形態と生化学の変化によって定義されます。 L.paracaseiとL.brevisのエキソポリサッカライドは、HT29がん細胞の増殖を抑制しました(Mojibi et al.,2019)。 L.paracaseiまたはL.brevisのエキソポリサッカライドを40mg/ mlの濃度で処理してから24時間後に抗増殖活性と細胞増殖を比較すると、抗増殖活性と細胞死はそれぞれ36から80%、40から90%に増加します。 S. thermophilus CH9-EPS-3aは、ヒト肝がん細胞に対して、in vitroでより高い抗がん活性を示し、EPS-3aの抗腫瘍効果は、ヒト肝がん細胞の細胞アポトーシスと関連していました(Liu et al.,2019)。 正常細胞は、がん細胞よりも有意に少ない抗増殖および阻害特性を持っています。 培養上清への乳酸デヒドロゲナーゼ漏出の増加は、エキソポリサッカライドによって誘発された膜損傷も示しています(Deepak et al.,2016)。 乳酸デヒドロゲナーゼ活性は、EPS1で処理されたがん細胞よりもEPS5で処理されたがん細胞で有意に大きいことがわかり(p = 0.0001)、続いてEPS10とEPS6であり、原形質膜の破壊とそれに続く細胞外空間への乳酸デヒドロゲナーゼ分散が確認されました(Fotakis&Timbrell ,2006)。 |
| エキソポリサッカライドはさまざまな生物活性機能を実行することが実証されており、その結果、これらの機能は通常、エキソポリサッカライドの物理化学的特性によってプラスの影響を受けます(Wang et al.,2014; Li et al.,2016)。 これは、FT-IRの結果を議論するときにEPS5で定義された官能基の違いを示しています。 3,410 cm–1の領域で最も強いバンドは、EPS5のヒドロキシル伸縮振動の存在を示しています(Abdhul et al.,2014)。 2,931 cm–1のバンドは、CH2伸縮振動によって生成されますが、1,650 cm–1のバンドは、–OH曲げ振動によって生成されます。 1,381 cm–1での吸収は、対称的なCH3の曲がりが原因である可能性があります。 1,136 cm–1では、グリコシド結合(C–O–C)を伸ばす振動が強い吸収の原因でした(Adebayo-Tayo and Fashogbon,2020)。 さらに、872 cm–1での強い赤外線吸収は、EPS5がβ-アノマーであることを示しています(Pan and Mei、2010)。 EPS5の単糖を高速液体クロマトグラフィーを使用して調べた。 EPS5は主に、分子比1:2.7:7.4:5.1:12.5のさまざまな糖で構成されており、それぞれリボース:ラムノース:グルコース:マンノース:ガラクトースを反映しています。 |
| 初期アポトーシス中に発生する最も重要な生化学的プロセスは、ホスファチジルセリン転座です。 いくつかの生化学的経路はアポトーシス中に収束し、システイン依存性アスパラギン酸指向性プロテアーゼ(カスパーゼ)のファミリーの活性化をもたらします。 カスパーゼ依存性またはカスパーゼ非依存性のメカニズムはアポトーシスを調節できますが、細胞の大部分がカスパーゼの活性化を介してアポトーシスを開始するため、後者の方が一般的です(Gamal-Eldeen et al.,2009)。 得られた抗腫瘍データの結果として、乳がん、結腸がん、およびヒト肝がん細胞におけるアポトーシスマーカー遺伝子発現に対するL. delbrueckii ssp bulgaricusDSMZ20081T-EPS5の影響を調査しました。 この実験では、アポトーシス遺伝子Bax、BCL2、カスパーゼ 3、カスパーゼ8、およびMCL1の相対的な発現を測定しました。 BCL2などのボードタンパク質は、細胞の損傷と増殖の両方を調節します。 BCL2ファミリータンパク質は、ミトコンドリア膜の完全性を維持するため、ミトコンドリアを介したアポトーシスに必要です(Aouacheria et al.,2017)。 |
| 多糖類ががん細胞にアポトーシスを誘導するメカニズムは、アポトーシスを阻害するBCL2やアポトーシスを誘導するBaxなどのBCL2ファミリータンパク質を使用して調査されました。 遺伝子発現分析の結果は、EPS5が調べた細胞株でBax遺伝子発現を増加させることを示しました。 ただし、EPS5で処理された細胞は、BCL2遺伝子発現の有意な減少を示しました。 多くの研究により、乳酸菌エキソポリサッカライドで処理された腫瘍細胞はBCL2の発現が有意に少ないことが示されています。Tukenmez et al(2019)は、L.delbrueckii ssp. bulgaricus B3-EPSは、Bax、カスパーゼ3、およびカスパーゼ 9の発現を増加させ、BCL2とSurvivin(訳者注:細胞分裂の制御とアポトーシスの抑制という,2つの働きを持つタンパク質)の発現を減少させることにより、時間依存性の増殖を阻害し、アポトーシスを誘導しました。 L. acidophilus 606由来の細胞結合エキソポリサッカライド(cb-EPS)は、Bax遺伝子を活性化することにより結腸がん細胞HT-29の増殖を阻害しました(Yang et al。、2007)。 さらに、C32メラノーマ細胞のミトコンドリア経路を介してアポトーシス活性化を促進する抗アポトーシスタンパク質のBCL2ファミリーのメンバーであるMCL1遺伝子は、さまざまな癌のBakおよびBaxアポトーシス促進タンパク質のアポトーシスを阻害します(Beberok et al.,2020 )。 カスパーゼは、細胞死に関与する分子の大部分の調節に関与しています。 アポトーシスに関与するカスパーゼは、イニシエーター(カスパーゼ2、8、9、および10)またはエフェクター(カスパーゼ3、6、および7)として分類できます(Wang et al.,2016)。 |
| アポトーシスにおけるカスパーゼ3の重要な役割と、多くのよく特徴付けられた乳がん細胞株がカスパーゼ3の発現を変化させたという事実を考慮して、処理された乳がん細胞でカスパーゼ3特異的プライマーを使用してRT-PCR(訳者注:リアルタイムPCR)を実行しました。 私たちの調査結果によると、カスパーゼ3は、テストした他の癌細胞と比較して、処理した乳がん細胞で有意に過剰発現していました。カスパーゼ3活性は、化学療法剤、放射線療法、サイトカインなど、さまざまなアポトーシス因子に反応して検出されました。 一方、選択的カスパーゼ3阻害は、細胞死阻害と関連しています。 カスパーゼ3の発現がないため、アポトーシス抵抗性の乳がん細胞が化学療法や放射線療法などのアポトーシス刺激に反応することができると仮定されています。 いくつかの発見は、カスパーゼ3を乳がんの疾患マーカーおよび潜在的な治療標的として使用することに対して重要な臨床的意味を持っています(Devarajan et al.,2002)。 ノーザンブロット分析を使用して、乳がん細胞にカスパーゼ3の発現がないことを確認しました。 乳がん細胞のカスパーゼ3mRNAレベルは、正常な乳房組織よりも10〜50倍低かった。薬剤感受性乳がん細胞では、カスパーゼ3mRNAは125bpの転写産物の欠失によって切り詰められました。 さらに、継続的な乳がん細胞培養に由来する薬剤耐性(MCF7 / DOX)乳がん細胞は、ドキソルビシンの存在下で最大のカスパーゼ3転写持続時間を有することが確立されました(Devarajan et al.,2002)。私たちの結果における処理細胞のカスパーゼ8およびカスパーゼ3遺伝子の有意な増加は、Chang et al(2013)と一致しています。 カスパーゼ3は、タンパク質分解を触媒する適切なデスプロテアーゼであると期待されていました。カスパーゼ8はアポトーシスカスケードの頂点にあり、下流のカスパーゼファミリーのメンバーのタンパク質分解活性化を引き起こし、アポトーシスに寄与します(Chang et al.,2013)。 2つの経路がイニシエーターをトリガーしました。1つはカスパーゼ8によって制御され、次にカスパーゼ8とカスパーゼ3を活性化する細胞死リガンドの挿入を含み、後者はカスパーゼ9ミトコンドリアによって媒介されるアポトーシスを伴います(Karpel-Massler et al., 2017)。 |
| p53腫瘍抑制因子は、内因性経路と外因性経路の両方に関連するアポトーシス促進遺伝子を調節することもできます(Chipuk et al.,2003)。 El-Deeb et al (2018)は結腸がん細胞をL. acidophilus LA-EPS-20079 エキソポリサッカライドで処理した後、p53遺伝子発現が増加したことを観察しました。 EPS5は、テストされた結腸がん細胞株のp53転写物のレベルを増加させました。これは、p53依存性経路が結腸がん細胞のアポトーシスメカニズムでアクティブであることを意味します。 細胞の完全性とストレスへの耐性を維持するために、正常な間葉系細胞は、中間径フィラメント(IF)ファミリーに属するタンパク質であるビメンチンを産生します(Chipuk et al.,2003)。ビメンチンの異常な過剰発現は、黒色腫、乳がん、胃腸がん、神経系腫瘍などのがん細胞におけるより高いレベルの攻撃性に関連しています。 がんにおけるビメンチンの過剰発現は、腫瘍の発生、浸潤、および予後不良の増加に関連しています。それにもかかわらず、がんの発症におけるビメンチンの機能はまだ不明です。 私たちの知る限り、乳がんのビメンチン遺伝子発現調節に対するエキソポリサッカライドの影響に関する研究は行われていません。 McInroy and Määttä(2007)は、ビメンチン発現のサイレンシングが結腸がんおよび乳がん細胞株の移動と浸潤を阻害することを実証しました。 彼らは、ビメンチン発現のダウンレギュレーションが、引っかき傷の実験とコラーゲンでコーティングされた細胞培養インサートを使用した浸潤研究の両方で遊走を損なうことを示しました。 |
| 最近の研究では、シグナル伝達分子に焦点を当てることにより、がん細胞のアポトーシスを誘導する多糖類の有効性が確立されています(Alwarsamy et al.,2016)。 図10に示すように、多糖類は2つの異なるメカニズムを介して抗腫瘍活性を発揮します。サイトカイン欠乏、ERストレス(訳者注:小胞体ストレス)、またはDNA損傷によって活性化されるBCL2調節(内因性、ミトコンドリア、またはストレスとしても知られる)経路と死です。細胞内デスドメインを持つ腫瘍壊死因子受容体(TNFR)ファミリーのメンバーのライゲーションによって活性化される受容体(外因性としても知られる)経路(Green,2005; Czabotar et al.,2014; Zhang et al.,2017)。 アポトーシス促進性BH3のみのサブファミリーのメンバーであるBCL2タンパク質ファミリーのアポトーシス促進性BH3のみのメンバー(BIM、PUMA、BID、BMF、BAD、BIK、NOXA、およびHRK)の過剰発現は、BCL2によって調節されるアポトーシス経路を介して細胞死を促進します。 BH3のみのタンパク質は、生存促進性のBCL2タンパク質(BCL2、BCLXL、MCL1、BCLW、およびA1 / BFL1)と相互作用し、ブロックします。 したがって、細胞死エフェクターBAXおよびBAK(BOKも含む可能性のあるBCL2ファミリーのアポトーシス促進性マルチBHドメインメンバー)を活性化します(Ke et al.,2015; Llambi et al。、2016)。 特定のBH3のみのタンパク質は、BAX / BAKを直接活性化することが示されています(Gree,2005; Youle and Strasser,2008)。 BAX / BAKが活性化されると、ミトコンドリア外膜(MOMP)が透過化され、アスパラギン酸特異的システインプロテアーゼのカスケードと細胞を解体するその活性化因子APAF-1(Cecconi et al。、1998)の活性化が引き起こされます(Zhang et al。、2007) (図10)。 比較すると、ダウンレギュレーションシステムは、アダプターFADDおよびまれにTRADDを介して、原形質膜の結紮されたデスレセプターでプロカスパーゼ-8に結合して活性化することによりアポトーシスを誘導します。いわゆる1型細胞では、カスパーゼ8の活性化とそれに続くエフェクターカスパーゼ(カスパーゼ3および7)の活性化で、アポトーシス(胸腺細胞など)を正常に誘導するのに十分です。 一方、いわゆる2型細胞(肝細胞など)での効果的な細胞死には、BCL2によって調節されるアポトーシス経路のクロスオーバー活性化を介したカスパーゼカスケード増幅が必要です。 これは、通常は不活性なBH3のみのタンパク質BIDのカスパーゼ8を介したタンパク質分解活性化によって達成されます(図10; Zhang et al.,2007、2017; Fan et al.,2014)。 |
|
| 図10 がん細胞の細胞周期とアポトーシスに対するEPS5の影響の考えられるメカニズム | 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Front Microbiol. 2022; 13: 803688.に掲載されたExploring the Therapeutic Potentials of Exopolysaccharides Derived From Lactic Acid Bacteria and Bifidobacteria: Antioxidant, Antitumor, and Periodontal Regeneration を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


