ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) | |
COVID-19における腸-肺軸の腸内細菌叢変調 |
|
Gislane Lelis Vilela de Oliveira et al., |
|
|
|
|
| 概要 | |
COVID-19は、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によって引き起こされる感染症であり、世界保健機関(WHO)によると、これまでにSARS-CoV-2はすでに91.8以上に感染しています。世界中で100万人が死亡し、1,986,871人が死亡しています。 このウイルスは主に呼吸器系に影響を及ぼしますが、消化管も標的であり、SARS-CoV-2は食道、胃、十二指腸、直腸、およびCOVID-19患者の糞便サンプルですでに検出されています。 したがって、腸内毒素症と炎症に加えて、呼吸器と胃腸管の粘膜が影響を受けるため、COVID-19の有害な結果を抑制するためのアプローチとして、腸内細菌叢の調節とユービオシス状態の再確立に基づく補助療法が重要な治療法である可能性があると考えるのが妥当です。 最後に、他の呼吸器感染症におけるプロバイオティクス投与の潜在的な有益な役割を示し、SARS-CoV-2感染症の補助療法としてのプロバイオティクスの可能な役割について議論します。 |
|
序章 |
|
|
人間の腸内細菌叢は、複雑で動的な生態系にある1兆を超える微生物で構成されており、免疫系と私たちの生理機能全体を調節しています(1)。 これらの微生物は、栄養代謝、免疫の発達と調節、有害な病原体に対する防御など、体内で非常に重要な機能を果たします(2)。 消化管では、上皮バリアが病原性微生物の侵入を防ぎ、食物抗原に対する耐性を維持するのに役立ちますが、全身および肺の免疫機能にも関連している可能性があります。 微生物が損傷すると、血流や肺に移動し、敗血症や急性呼吸窮迫症候群を引き起こす可能性があります(3、4)。 |
|
| 確かに、気道と消化管の間、より正確には腸内細菌叢と肺の間のクロストークの証拠があり(図1)、この接続は腸-肺軸と呼ばれます(5)。 腸内毒素症として知られる腸内細菌叢の分類学的組成の変化と多様性と機能の低下は、肺の免疫に影響を与える可能性があります(6)。 一方、気道には独自の微生物叢があり(7)、肺の炎症は腸内毒素症を引き起こす可能性があります(8)。 一例として、呼吸器感染症の患者は通常、腸の機能障害を持っており(9)、これは腸-肺軸の存在をさらに強化します。 したがって、腸内細菌叢と粘膜免疫系の相互作用および腸-肺軸は、科学文献で広く研究およびレビューされています(10–13)。 | |
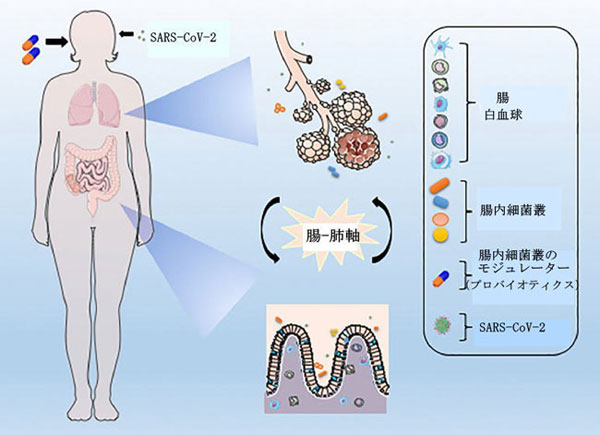
|
|
|
SARS-CoV-2ウイルスは呼吸器系の細胞に優先的に感染しますが、多くの証拠が消化管をウイルスの侵入と複製のもう1つの重要な標的として指摘しています。 腸内毒素症は、バリア損傷および結果として生じる炎症とともに、疾患の確立を促進する可能性があります。 転置された細菌、白血球、および腸-肺軸における炎症性メディエーターの放出は、COVID-19関連の臓器の劣化に寄与する可能性があります。 プレバイオティクスやプロバイオティクスなど、微生物叢の調節を通じて真正生物状態を再確立することを目的としたいくつかの提案された補助療法は、COVID-19の最悪の結果を改善または回避するための代替アプローチを表す可能性があります。 |
|
| 最近の研究では、腸からのエンドトキシン、細菌叢代謝物、サイトカイン、およびホルモンが、双方向の腸-肺軸クロストークで血流と肺のニッチに到達する可能性があるとの仮説が立てられました(10、13、14)。 さらに、増大する証拠は、骨髄造血前駆体の移動および肺の炎症消散における腸内細菌代謝物の影響を示唆している(6、15)。 それと一致して、宿主の免疫状態は腸内細菌叢の影響を受け、SARS-CoV-2を含むウイルス感染に対する免疫の程度に影響を与える可能性があります(16、17)。 粘膜表面での免疫応答の誘導と調節に加えて、免疫系の発達と成熟におけるその本質的な役割のために、微生物相とその代謝物がSARS-CoV-2感染において重要な役割を果たしていると考えるのはもっともらしいです。 (13、18、19)。 | |
消化管がSARS-CoV-2の標的として発生 |
|
すでに広く知られているように、SARS-CoV-2が主に呼吸器系に影響を与えることは明らかです。 ただし、感染症の病原性は肺だけに限定されているわけではありません。 それどころか、ウイルスとそれに続く免疫応答は、他の重要な臓器の組織損傷に関連していますが、重症患者は複数の機能障害症候群を患っています(20、21)。 |
|
| コロナウイルス、ロタウイルス、ノロウイルスなどのいくつかのウイルスは、消化管から腸細胞に感染する可能性があります。感染は吸収過程を損ない、腸機能の不均衡や腸管神経系の活性化を引き起こし、症状や重要な臨床疾患の症状を引き起こします(22–25)。 SARS-CoV-2に関しては、消化管も感染の標的であり、ウイルスはCOVID-19患者の糞便サンプルに加えて、食道、胃、十二指腸、直腸で検出できます(26–28)。 COVID-19中に一般的に見られる主な胃腸症状は、食欲不振、吐き気、嘔吐、下痢、および腹痛です(29、30)。過去数ヶ月間、多くの研究者は、SARS-Cov-2が実際にGITに感染する可能性があり(図1)、生検で観察されるように、主に腸上皮細胞に複製ウイルスが大量に存在することを繰り返し示しています。感染した患者の小腸と大腸の分析(31)。さらに、COVID-19患者の糞便サンプル中の感染性ウイルスの同定は、消化管がウイルスの活動と複製の場所である可能性があることを示唆しました(32、33)。したがって、シンガポールで実施された研究では、SARS-CoV-2感染に陽性の患者の50%が糞便中にウイルスを検出していました。それでも、それらの半分は下痢などの消化管症状を経験しました(34)。別の研究では、SARS-CoV-2の存在が、感染の過程を通じて、咽頭スワブと糞便サンプルの両方で評価されました。糞便と気道スワブは、2つの連続した陰性結果に達するまで、1〜2日ごとに採取されました。結果は、その患者のコホートでは、呼吸器サンプルがウイルスRNAに対して陰性であるとテストされた後、糞便サンプルが約5週間陽性を維持したことを示しました(35)。同様の研究は、感染した子供たちのコホートの80%が、気道検査が陰性であった後、ウイルス性直腸スワブが陽性であったことを補強しました(36)。特に、生のSARS-CoV-2は、電子顕微鏡検査によって、下痢のない患者の糞便サンプルでも検出されました(37)。さらに、プレプリント研究では、腸生検の分析により、最初の感染後の患者の回腸および十二指腸におけるSARS-CoV-2の長期持続性が示されました(38)。したがって、消化管および便中のウイルスの存在または持続性は、SARS-Cov-2が肺に限定されず、潜在的な糞口感染を示していることを強調しています。 | |
| SARS-CoV-2が消化管に感染する特定の経路はまだ完全には解明されていませんが、最近の報告では、それに関与する可能性のあるいくつかの経路が示されています。ウイルスが宿主生物に侵入する重要なステップは、アンジオテンシン変換酵素2(ACE2)細胞受容体(39、40)を介することであり、感染を成功させるには、ウイルスの切断ステップで膜貫通プロテアーゼセリン2(TMPRSS2)も必要です。宿主細胞膜上のSタンパク質、したがって効率的なウイルス融合を可能にする(41)。 アンジオテンシン変換酵素2と膜貫通プロテアーゼセリン2はどちらも、健康な被験者またはCOVID-19患者の回腸と結腸の吸収性腸細胞に加えて、食道上部上皮と腺細胞で共発現が上昇しています(42、43)。さらに、ヒト腸上皮細胞はSARS-CoV-2に正常に感染する可能性があり、腸上皮細胞株とヒト結腸オルガノイドの両方がウイルス複製の潜在的な標的となり、ウイルス血症の増大とSARS- CoV-2感染の拡散に寄与する可能性があります。重要なことに、著者らは、SARS-CoV-2に感染したヒト腸上皮細胞が、主にタイプIIIによって媒介される強力な免疫応答を促進できるが、タイプIのIFNは促進できないことも発見しました。外因性IFNによるSARS-CoV-2感染ヒト腸上皮細胞の前処理は、感染細胞の大幅な減少、ウイルス複製、および感染性ウイルス粒子の生成の急激な減少につながります。腸上皮でのSARS-CoV-2の制御におけるIII型IFNの重要な役割は、その特定の受容体の遺伝的除去後のウイルス複製の有意な拡大によっても確認されました(22、44)。したがって、SARS-CoV-2による感染の主な症状は呼吸器系に直接関連していますが、あまり一般的ではありませんが、病気の間に現れる消化管の変化を観察する必要があります(45、46)。 | |
COVID-19の胃腸症状 |
|
COVID-19中の胃腸の兆候または症状の存在は比較的一般的です。 浙江という中国の州では、2020年1月から2月にかけてCOVID-19と診断された651人の患者のうち、11.4%に少なくとも1つの消化管症状があり、下痢が最も一般的(8.14%)で持続することが観察されました。 ほとんどの場合1日から9日で、平均期間は4日です(28)。COVID-19は子供ではそれほど頻繁ではありませんが(47)、2020年1月から3月の間に中国の武漢市で244人の子供を対象に実施された調査によると(48)、このグループの患者の消化管症状の割合(13.9%)は、成人のそれと非常に類似していました。 |
|
| 胃腸症状のある患者は、COVID-19の患者よりも慢性肝疾患の発生率が有意に高いが、消化管症状はない(10.81%対2.95%)(28)、トランスアミナーゼアスパラギン酸アミノトランスフェラーゼ(AST)(16.5%vs。5%)、およびアラニンアミノトランスフェラーゼ(ALT)酵素(20.4%vs。5.9%)は、肝臓の損傷を示します(30)。これらの被験者はまた、急性呼吸窮迫症候群の合併症(6.76%対2.08%)、COVID-19の重症で重大な形態への進行を有する可能性が高く、プロトロンビン時間の延長(13.1 vs. 12.5 s)(30)に加えて、より頻繁に人工呼吸器を使用し、集中治療室に入院する必要があります(ICU)(6.76%vs。2.08%)(28)。臨床パラメーターに関しては、胃腸症状のある患者は、電解質の不均衡の増加によって引き起こされる可能性のある、発熱、倦怠感、息切れ、および頭痛の影響を受けやすいようです(28)。 COVID-19があり、胃腸症状がない患者と比較して、これらの症状がある患者は、抗生物質、インターフェロン、免疫グロブリンによる治療を受ける可能性も高くなります(30)。一方、消化管に関与していないCOVID-19の患者は、片側性肺炎の発生率が高く(28)、消化器症状のある患者と比較して2倍の確率で疾患から回復します(30.4%対60%)(30 )。 | |
| COVID-19がより重症になるにつれて、胃腸の症状はより明白になります(30)。それにもかかわらず、SARS-CoV-2感染に関連するマーカーに関しては、消化管に関連するCOVID-19症状のある患者とない患者の間の凝固指標(プロトロンビン時間を除く)(30)、 プロカルシトニン、C反応性タンパク質(CRP)の量に有意差はありません(28)全血球数や腎機能にも違いはありません。 | |
| 胃腸症状のある患者とない患者の間で病気の過程で観察されたこれらの違いを説明する理由は完全には明らかではありませんが、管内でのウイルス複製(30)がより深刻な臨床状態につながる可能性があります。 さらに、COVID-19の余分な肺の非古典的症状を示す患者は、医療援助を求めるのに時間がかかり、病気の重症度の増加を促進し、回復をより困難にします(30)。 明らかに、胃腸症状のあるCOVID-19患者の性別分布に違いはありません(46)。 | |
| 前述のように、アンジオテンシン変換酵素2はSARS-CoV-2が宿主細胞に侵入するためのゲートウェイであり(39)、口腔粘膜や舌上皮細胞(50)に加えて、腸(49)でもこの受容体が高発現しています。 したがって、消化管もウイルス感染の重要な標的であるという考えを強化します。実際、口腔と消化管はSARS-CoV-2の感染経路として機能する可能性があり、消化管でのアンジオテンシン変換酵素2Aの発現は、COVID-19患者の胃腸症状の存在を説明する可能性があります(46)。さらに、アンジオテンシン変換酵素2は腸の炎症と下痢を制御することができます(51)。したがって、SARS-CoV-2とACE2の間の相互作用は、この受容体の規制緩和と腸の症状を引き起こす可能性があります(49)。さらに、アンジオテンシン変換酵素2は食餌性アミノ酸の捕捉、抗菌ペプチド発現の調節、および腸内細菌叢の恒常性に関連していたため、アンジオテンシン変換酵素2は腸内細菌叢および免疫の調節因子である可能性があると考えることができます(51)。実際、SARS-CoV-2は消化管に直接感染するため、消化器系に直接的および間接的な損傷をもたらす可能性のある炎症反応を引き起こす可能性があります(30)。 | |
| 抗生物質の使用は下痢に関連しており(27)、COVID-19の治療にはこれらの薬の使用が含まれる可能性があり(29)、腸内細菌叢の組成に変化が生じます(52、53)。 これは、COVID-19患者の下痢エピソードの別の説明である可能性があり、SARS-CoV-2と腸内細菌叢との関係の仮説を補強します(54)。 したがって、警戒を維持し、COVID-19中に現れる消化管症状にもっと注意を払うことが重要です。これは、古典的な呼吸器症状ほど一般的ではないためです。 さらに、下痢などの徴候は、糞便中のウイルス排出のリスクの可能性とCOVID-19の疑いのある症例の早期診断のために過小評価することはできません(28)。 | |
COVID-19における腸-肺軸と腸内毒素症 |
|
腸内細菌叢が全身性免疫に及ぼす影響と呼吸器感染症への影響は、最近、マウスとヒトで調査されました(14、16、55–59)。 研究は、恒常性状態での免疫応答を調節することによって、またウイルス感染の過程で、肺の抗ウイルス応答における共生細菌叢の本質的な役割を示しました(16、55、60)。 特に、研究者らは、上皮細胞、肺胞マクロファージ、樹状細胞(DC)に影響を及ぼし、細胞性および体液性適応免疫応答も変化させるため、気道の抗ウイルス自然免疫に対する細菌叢の基本的な役割を報告しています(60、61)。 | |
| 腸内細菌叢は呼吸器上皮細胞のI型インターフェロン受容体の発現に影響を及ぼし、IFN-αおよびIFN-β分泌を介してウイルス感染に迅速に反応し、ウイルス複製を制限します(60)。無菌マウスのマクロファージと樹状細胞は、微生物リガンドまたはウイルス感染に応答してIFN-α、IFN-β、IL-6、TNF、IL-12、およびIL-18サイトカインを産生できず、ナチュラルキラープライミングは腸内細菌叢とIFN-Iシグナル伝達の欠如(56)。さらに、抗生物質で処理されたマウスを使用して、共生微生物叢が結腸免疫細胞によるIFN-β分泌を介して局所的および全身的なIFN-I応答を調節することが示されている。より具体的には、Bacteroides fragilisに由来する莢膜多糖Aは、in vitroおよびマウスの固有層樹状細胞でIFN-βを誘導し、腸内細菌叢がウイルス感染に対する耐性を高める可能性があることを示唆しています(62)。また、一戸ら (16)は、抗生物質治療とグラム陽性腸内細菌の枯渇が気道からの樹状細胞の分布または活性化を損ない、肺から流入領域リンパ節への樹状細胞の移動の減少を誘発することを示した。さらに、腸内細菌叢は、特定のCD4 +およびCD8 + Tリンパ球の活性化、プロIL-1β、プロIL-18、およびNLRP3の安定した発現にも関与し、インフラマソームの活性化は、樹状細胞の成熟と移動を促進します。ウイルスチャレンジ後の、流入領域リンパ節への肺。 Abt et al(55)は、ウイルス感染への初期応答中の抗生物質治療マウスの腹膜マクロファージにおけるIFN-γRI、MHC-I、CD40、およびCD86分子の発現低下を報告し、腸内細菌叢に由来するシグナルが先天性を調節することを示唆しているウイルス感染前の免疫。 MERS-CoV動物モデルを用いた実験で、研究者らは、マクロファージおよび樹状細胞におけるMHC-IおよびMHC-II発現の低下を誘発し、抗原提示を損ない、T細胞活性化の欠陥を引き起こすウイルスの能力を示しました(63)。 | |
| いくつかの研究では、共生細菌叢からの信号が、上皮または自然免疫細胞の抗ウイルス状態の強化や感染開始時のウイルス複製の制御など、肺粘膜にさまざまな影響を与えることも報告されています。 この自然免疫の改善は、感染の後期過程における細胞性および体液性適応応答の効率に有利に働きます(16、55、60)。 したがって、有益な微生物が粘膜免疫系にプラスの影響を及ぼし、呼吸器ウイルスに対する効率的な反応を促進する可能性があると推測できます(64)(65)。 腸内毒素症は、おそらく免疫応答の調節不全による呼吸器感染症の死亡率の増加、IFN-γ、IL-6、CCL2の分泌の増加、および肺と消化管の制御性T細胞の減少に関連しています(66)。 | |
| 腸内細菌叢が呼吸粘膜免疫に与える影響を説明するために、4つのメカニズムが提案されています。1)すべての粘膜組織が相互に関連している、つまり粘膜内の免疫細胞の活性化が他の離れた粘膜部位に影響を及ぼし、到達する可能性があるという仮説。したがって、消化管から気道の粘膜への免疫細胞の移動は、呼吸器ウイルス感染において腸内細菌叢によって及ぼされる有益な影響に関連している可能性があります(65、67)。 2)共生微生物叢に応答して、消化管粘膜に分泌されるサイトカインおよび成長因子は、体循環に到達し、他の粘膜組織に作用する可能性があります(14、65)。 3)微生物関連分子パターン(MAMP)は吸収されて腸外組織に伝導され、そこで免疫細胞のパターン認識受容体を活性化し、自然免疫応答に影響を及ぼします(68)。 4)腸粘膜に吸収された微生物叢の代謝物は、「代謝の再プログラミング」として知られる効果である粘膜免疫の調節に関連しています。これらの代謝物、特に短鎖脂肪酸は、気道の免疫細胞の受容体に結合し、肺の抗ウイルス反応を増強します(6、64)。 | |
| COVID-19に関しては、SARS-CoV-2による腸上皮細胞の感染が腸内毒素症、腸の炎症および胃腸の症状を誘発する可能性があることが知られています(31、69)。 さらに、2型糖尿病、肥満、高血圧、冠状動脈性心臓病、およびその他の加齢性疾患で観察された以前の腸内毒素症は、SARS-CoV-2に対する炎症性免疫応答の調節解除に関与し、感染、伝播および併存疾患のある患者の重症度を助長します(70)。 宿主の不均衡な免疫応答と「サイトカインストーム」として知られる大量の炎症性サイトカイン分泌は、COVID-19患者の疾患の重症度と最悪の予後に関連しています(71、72)。 さらに、炎症性異生物環境と上皮損傷がアンジオテンシン変換酵素2の発現を誘発し、消化管でのSARS-CoV-2複製を増加させ、他の部位への播種を引き起こします(70)。 これは、COVID-19患者の肛門スワブおよび糞便サンプルにおける胃腸症状およびSARS-CoV-2の検出と一致しており、呼吸スワブでのウイルス検出が陰性の被験者や呼吸器症状の除去後でも同様です(31、73)。 | |
| すでに述べたように、多くのCOVID-19患者は胃腸症状を示し(74)、腸内細菌叢と粘膜免疫系の間の健康的な相互作用に影響を及ぼし、肺感染症に対する免疫応答に影響を与える可能性があるという発見がありました。 さらに、長期にわたる消化管症状、主に下痢は、免疫調節解除とSARS-CoV-2クリアランスの遅延に関連して、微生物叢の豊富さと多様性の低下と逆相関していました(75、76)。COVID-19患者で実施された研究は、腸内毒素症に加えて、患者が咽頭と肺の不均衡な微生物叢を持っている可能性があることを示しており、粘膜表面がつながっている可能性があり、消化管粘膜で起こるすべてが他の部位に影響を与える可能性がある仮説を補強しています(75、77-81)。 | |
| それと一致して、中国で行われた研究において、Guら (75)は30人のCOVID-19被験者、24人のH1N1患者、および30人の健康な対照からの腸内細菌叢を評価しました。 SARS-CoV-2に感染した被験者は、対照と比較して腸内細菌叢の多様性が減少し、Bifidobacterium属など有益な微生物の相対的な存在量の減少に加えて、Actinomyces, Rothia, Streptococcus,や Veillonella,などの日和見属が優勢でした(図2)。 | |
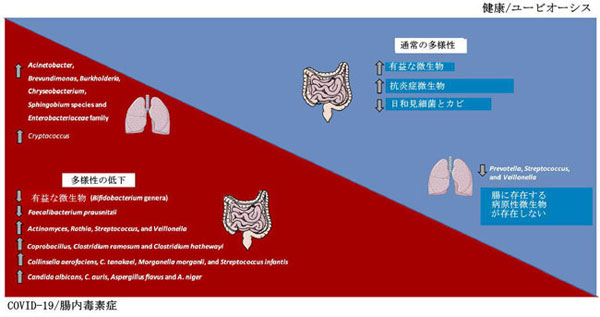
|
|
| COVID-19患者では、腸と肺の微生物叢の頻度と多様性が変化しており、画像に示されている主要な細菌と真菌微生物が優勢です。 対照的に、健康な状態では恒常性環境が保たれユービオーシス状態が優勢です。 | |
| 同様に、15人の入院COVID-19患者からの腸内細菌叢を評価するパイロット研究は、日和見微生物の有病率と有益な微生物の減少を伴う、入院中の有意な変化を報告しました。 SARS-CoV-2の消失と呼吸器症状の解消後も、腸内毒素症は検出されました。 ベースラインでのCoprobacillus、Clostridium ramosum、およびClostridium hathewayiの相対的な存在量は、COVID-19の重症度と正の相関がありました。 さらに、抗炎症性微小環境に有利なFaecalibacterium prausnitziiの存在量は、COVID-19の重症度と逆相関していました(図2)(77)。 入院中、マウス腸でのACE2発現をダウンレギュレートするBacteroides dorei、B。massiliensis、B。ovatus、およびB. thetaiotaomicronの相対的な存在量は、COVID-19患者の糞便中のウイルス量と逆相関していました(82、 77)。 | |
| 観察パイロット研究において、Zuo et al(79)は、15人の入院COVID-19患者における微生物叢の違いとSARS-CoV-2の転写プロファイルとの相関を調査しました。被験者の46.7%で、消化管症状がなく、呼吸器感染症の除去後でも、ウイルスRNAが糞便中に検出されました。これは、腸内の静止SARS-CoV-2感染と、糞口感染の本当の可能性を示唆しています。 SARS-CoV-2感染力が上昇した患者は、炭水化物代謝の増加に加えて、Collinsella aerofaciens、C。tanakaei、Morganella morganii、およびStreptococcusinfantisの相対量の増加を示しました(図2)(79)。 Morganella morganiiは、ヒトの感染に関連する日和見微生物です(83)。 SARS-CoV-2感染力が低下した患者は、Alistipes onderdonkii、Bacteroides stercoris、Lachnospiraceae細菌、およびParabacteroides merdaeの有病率を示し、腸内でのSARS-CoV-2ウイルスとの戦いまたは競合における共生微生物の有益な役割を示唆しています(79)。 | |
| 同じグループの別の研究で、Zuo et al(78)は、健康な対照と比較して、COVID-19患者の糞便中のマイコビオームの個体差が増加していることを報告しました。 研究者は、入院中および入院後のCOVID-19患者からの30の糞便サンプルを評価し、ショットガンメタゲノミクスによって30の対照と比較しました。 入院のすべての時点で、SARS-CoV-2感染症の患者は、Candida albicans, C.auris, Aspergillus flavus および A. nigerなどの日和見真菌の増加を示しました(図2)。 これらの最後の2つの呼吸器病原体は、SARS-CoV-2クリアランスと呼吸器症状の解消後も糞便サンプルで検出され、一部のCOVID-19患者では腸内毒素症が不安定で持続性の腸内毒素症であることを示唆しています(78)。 | |
| 鼻咽頭の微生物叢に関して、De Maio ら(84)は、感染していない22人の対照と比較した18人の軽度のCOVID-19患者からのサンプルを分析しました。 SARS-CoV-2に感染した患者と対照の鼻咽頭微生物叢は類似していた、すなわち、両方のグループから収集されたサンプルの豊富さと多様性に統計的に有意な差はなく、初期の軽度のCOVID-19における回復力のある微生物叢を示唆している。 サンプルで検出された主な門は、Firmicutes、Bacteroidetes、Proteobacteria、Actinobacteria、およびFusobacteriaでした。 | |
| プレプリント作業で、Budding ら(80)は、PCRによるSARS-CoV-2検出が陽性の46人のCOVID-19患者と89人の陰性患者からの咽頭細菌叢を調査し、陰性サンプルの75%を含む均質な微生物叢クラスターと、陽性SARS-CoV-2サンプルの47%を伴うより不均質な別のクラスターの2つの異なる細菌叢クラスタリングがあることを示しました。高齢の患者は微生物の多様性の低下と不均一な微生物叢を示し、咽頭腸内毒素症の年齢依存性とSARS-CoV-2感染に対する感受性を示唆している(80)。さらに、咽頭細菌叢は、ウイルス付着の直接阻害や粘膜免疫応答の調節など、複数のメカニズムを通じて呼吸器ウイルス感染の進行に影響を与える可能性があります(85-88)。豊富さと多様性を含む咽頭細菌叢の状態は、SARS-CoV-2感染感受性、疾患の進行、および病原菌による二次感染の可能性に影響を与える可能性があります(80、89)。 | |
| 健康な人間の肺は、Prevotella, Streptococcus, および Veillonellaなどの微生物の密度が低下しています(90–92)。観察研究で、Fan ら(81)は、COVID-19の20人の致命的な症例からの生検で肺微生物叢を評価しました。これらの患者では、Acinetobacter, Brevundimonas, Burkholderia, Chryseobacterium, Sphingobium species および Enterobacteriaceae membersが肺微生物叢を支配していました(図2)。 腸内細菌叢に一般的に見られる種を含み、Enterobacter, Escherichia coli, Klebsiella, および Proteusなどのいくつかの病原性微生物を含む腸内細菌科は、死亡したCOVID-19患者の肺で検出されました(81)。 Acinetobacter 属の中で、A. baumanniiは多剤耐性感染症と死亡率に関連しています(93)。 COVID-19患者の肺真菌微生物叢はCryptococcusが優勢であり(図2)、続いてAspergillus, Alternaria, Dipodascus, Mortierella, Naganishia, Diutina, Candida, Cladosporium, Issatchenkia, およびWallemiaが優勢でした(81)。 Cryptococcus感染症は免疫不全患者の高い死亡率に関連しており(94)、Issatchenkia、Cladosporium、およびCandidaは免疫抑制患者の真菌症に関与する日和見主義種を表しています(81)。 | |
| 粘膜表面での免疫応答の調節と全身および肺の健康の維持における腸内細菌叢の重要な役割を考えると、SARS-CoV-2感染の文脈でこれらの相互作用に関する知識を向上させるために微生物叢の研究がさらに必要であると信じています。 粘膜微生物群集の同定は、COVID-19関連の腸内毒素症に関与するバイオマーカーの発見、およびこれらの患者の治療のための免疫生物学の開発のための潜在的な治療標的の決定に役立つ可能性があります。実際、COVID-19の予防、診断、予防、治療のためのいくつかの代替案がすでに提案されています。 アンジオテンシン変換酵素2受容体阻害剤の使用(95)や、腸の生態学的バランスの維持、二次細菌感染の防止、さらにはプロバイオティクス、プレバイオティクス、シンバイオティクス、ポストバイオティクスの単独または組み合わせによる腸内細菌叢の調節など呼吸器系を保護します(47、96)。 これらの治療的介入はまた、併存疾患の影響を受けた患者の免疫応答を改善し、将来のワクチン接種後にSARS-CoV-2に対する免疫を改善する可能性があります(97) | |
腸内細菌叢変調に基づく実験的治療 | |
ヒトのウイルス性呼吸器感染症の発生率、期間、重症度を軽減する上でのプロバイオティクス/プレバイオティクス投与の効果を評価する研究が増えています。 プロバイオティクスの使用の可能性は、インフルエンザウイルス、ライノウイルス、および呼吸器合胞体ウイルスに関する実験的研究、メタアナリシス、および臨床試験によって裏付けられています(98-102)。 SARS-CoV-2感染ではメカニズムは決定されていませんが、一部のプロバイオティクス株は他のコロナウイルスで抗ウイルス特性を示します(103–106)。 |
|
| プロバイオティクスとプレバイオティクスのための国際科学協会(2013)によると、プロバイオティクスは「適切な量で投与されると、宿主に健康上の利益をもたらす生きた微生物」と定義されています。プロバイオティクスは発酵食品やいくつかのサプリメントに含まれていますが、科学的に実証された利点を持つ明確に定義された菌株のみを使用できます(107)。 「プレバイオティクス」と呼ばれるものは1995年にギブソンとロバーフロイドによって造られました。現在の定義(2016)は「健康上の利益をもたらす宿主微生物によって選択的に利用される基質」です。つまり、プレバイオティクス食物繊維は腸内の健康促進微生物(108)。さらに、シンバイオティクスは「宿主に有益な影響を与えるプロバイオティクスとプレバイオティクスの混合物」として定義されています(109)。ポスバイオティクスには、宿主の健康に有益な影響を与える短鎖脂肪酸や細菌細胞成分などの代謝物を含む、微生物発酵プロセスから生じる機能的な生物活性物質が含まれます(110、111)。 | |
| プロバイオティクスは、宿主に2つの異なる免疫調節作用を及ぼす可能性があり、炎症誘発性または抗炎症性の免疫応答を誘発する可能性があります(112、113)。免疫刺激反応では、NK細胞活性の増加、炎症性サイトカインの放出、腸粘膜でのTh1 / Th17分極に加えて、マクロファージ、樹状細胞、好中球の食作用が増加します(114–117)。 抗炎症反応では、一部のプロバイオティクス株は、腸粘膜の樹状細胞調節を介して制御性T細胞を誘導し、IL-10、TGF-βを誘導し、IgA分泌と腸バリア機能を増強します(118-120)。 したがって、プロバイオティクス菌株の知識と実験的研究は、治療目的を達成するための最良の菌株を決定するために不可欠です。 したがって、プロバイオティクスが炎症メカニズムと調節メカニズムの間の動的平衡を変更し、ウイルスクリアランス、免疫応答、肺損傷に影響を与えることができれば、それらの使用は急性呼吸窮迫症候群を抑制し、SARS-CoV-2感染症の主要な合併症を防ぐために重要かもしれません(102、121)。 | |
| 実験的なマウスモデルでは、いくつかのプロバイオティクスLactobacillus株が肺でのIFN-γ、IL-6、IL-4、IL-10の分泌を刺激し、肺炎の減少と血流への伝播を刺激します(122)。 さらに、Lactobacillus caseiは、肺胞マクロファージの食作用と死滅のプロセス、IFN-γおよびTNF-αの発現を増加させ、インフルエンザウイルスとの戦いを支援します(123)。 ヒトでは、Lactobacillus plantarum DR7を使用したランダム化臨床試験で、IFN-γやTNF-αなどの炎症性サイトカインの血漿濃度の抑制、および上気道感染症の若年成人におけるIL-4およびIL-10の増加が報告されました(124)。 COVID-19で観察されたサイトカインストームを考えると、この治療アプローチは、密着結合の発現の増加や酪酸を含む短鎖脂肪酸産生の増加を介した腸バリアの再確立などのメカニズムによって患者に利益をもたらす可能性があります。 抗炎症作用があり、理論的には、SARS-CoV-2の結腸細胞への侵入を減らすことができます(102)。 | |
| 人間の上気道および下気道感染症の予防におけるプロバイオティクスサプリメントの影響を示すいくつかの研究があります。 12件のランダム化臨床試験と3,720人の個人を含むメタアナリシスでは、プロバイオティクス投与により、急性上気道エピソードの数と期間、抗生物質の期間、および疾患の重症度が減少しました(125)。 プロバイオティクスは、重症患者の細菌性下気道感染症を予防するためにも使用されています。 ほぼ2,000人の患者を含む2つのメタアナリシスは、プロバイオティクスの補給が人工呼吸器関連肺炎の発生率を低下させることを示しました(126、127)。 | |
| 免疫老化と腸内細菌叢の多様性の減少は、COVID-19のリスクが高い高齢者の感染症の発生率を潜在的に増加させました(128、129)。 したがって、プロバイオティクスを含む発酵食品を毎日摂取すると、消化管粘膜の微生物相との相互作用を介して免疫系のパフォーマンスを向上させることができます。二重盲検対照臨床試験で、Guillemard ら(130)は、Lactobacillus caseiを含む乳製品の効果を、年齢中央値76歳の1,072人を対象に3か月間評価しました。 そして、プロバイオティクスが上気道感染症の発生率とエピソードを大幅に減少させることを示しました。 | |
| 下気道感染症と上気道感染症を予防することに加えて、プロバイオティクスは、SARS-CoV-2感染症自体に関連する、または二次肺感染症の治療に使用される抗生物質によって引き起こされる下痢の治療に役立つ可能性があります(131、132)。SARS-CoV-2感染に関連する危険因子の1つは、続発性細菌性肺炎です。 COVID-19に関する最近の研究では、二次感染は最悪の予後、転帰、および死亡と有意に相関していた(81)。 Szajewska et al(133)が18件のランダム化比較臨床試験を使用して実施した4,208人の参加者によるメタアナリシスは、Lactobacillus rhamnosusGGプロバイオティクスの経口投与が入院患者の下痢期間の短縮と入院の減少に関連していることを示しました。 抗生物質は腸内細菌叢のバランスに重大な変化を引き起こし、抗生物質関連の下痢を引き起こす可能性があります。 プロバイオティクスは、上皮バリアの強化と真正性の回復を介してこの状態を防ぐことができます。実際、6,352人の被験者を対象とした33件のランダム化比較臨床試験を含むメタアナリシスは、プロバイオティクスの補給が抗生物質関連下痢に中程度の保護効果をもたらし、その期間を短縮することを示しました(134)。 | |
| プロバイオティクスを服用することによる腸の微小生態学と真正性プロセスの改善は、調節された免疫系を促進し、過度の炎症や二次感染を防ぐ可能性があります(97、135-137)。 それに応じて、Bifidobacterium, Lactobacillus paracasei, および L. rhamnosusの一部の菌株は、ワクチンの免疫応答を高めることにより、H1N1、H3N2、H5N1などの呼吸器感染症の発生を減らします(67、138、139)。 微生物叢と粘膜免疫系の相互作用のこの改善は、SARS-CoV-2ウイルスに対するワクチン接種に対する免疫応答にも利益をもたらす可能性があります。 それにもかかわらず、腸内毒素症または微生物叢の調節がCOVID-19ワクチンの有効性に影響を与える可能性があると仮定していますが、これまでのところ、腸肺微生物叢とこの感染症へのワクチン接種との関係に関する研究は発表されていません。 それにもかかわらず、世界中の研究者がCOVID-19に対するワクチンの探索に継続的に取り組んでおり、そのうちのいくつかは最近、人間による使用が承認されました(140-142)。 | |
| 現在の知識を考慮して、微生物叢の調節は、COVID-19の可能な補助療法として調査されています。D'Ettorre et al(143)は、28人の患者でプロバイオティクスが病気の進行を抑える効果を評価しました。 含まれた被験者は、発熱、肺病変を示し、非侵襲的酸素療法を要求しました。 患者は、抗生物質、トシリズマブ、およびヒドロキシクロロキンを単独または組み合わせて投与され、複数株のプロバイオティクス投与(24,000億細菌/日)を受けました。 プロバイオティクス製剤には、Lactobacillus acidophilus, L. helveticus, L. paracasei, L. plantarum, L.brevis, Bifidobacterium lactis, and Streptococcus thermophilusが含まれていました。 3日間の補給後、42人の健康な対照と比較した場合、プロバイオティクスグループのすべての患者は下痢の寛解および他の症状の解消を示しました。 7日後、プロバイオティックグループは、呼吸不全の推定リスク、および集中治療室での入院と死亡率の有意な減少を示し、SARS-CoV-2感染症の制御における腸-肺軸の重要な役割を示しました(143)。 さらに、このレビューを書いている時点で、Clinical Trials.govに登録されている約10の臨床試験があり、COVID-19に対する腸内細菌叢のプロバイオティクスとモジュレーターの使用の影響を評価するために現在進行中です。 表1は、COVID-19患者を対象としたこれらの臨床試験の主な側面をまとめたものです。 | |
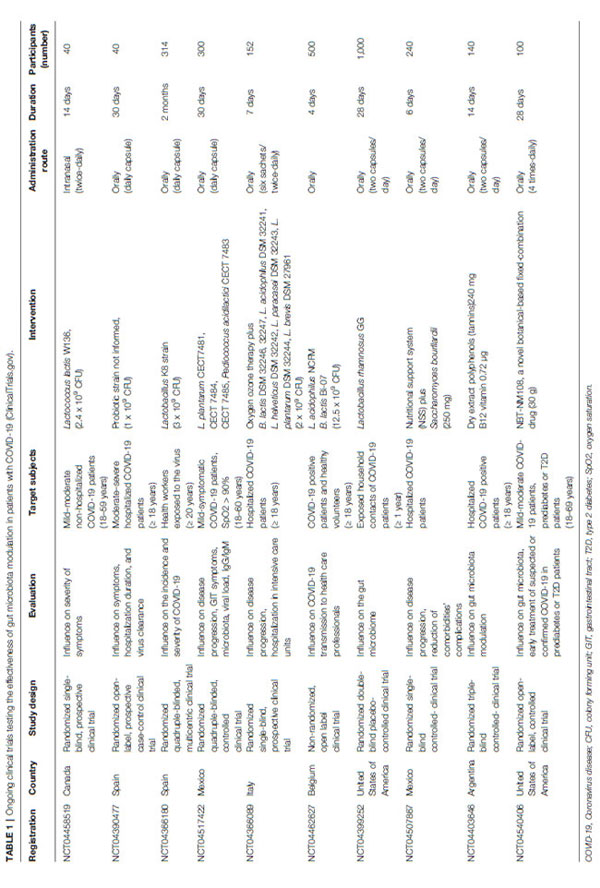 |
|
| 表1 COVID-19(ClinicalTrials.gov)の患者における 腸内細菌叢調節の有効性をテストする進行中の臨床試験 |
|
| スペインのUniversitariodel Vinalopó病院で実施された前向き症例対照オープンラベルパイロット研究は、40人のCOVID-19患者に30日間のプロバイオティクス混合物の毎日の経口投与が、症状の改善、入院日数、およびウイルス除去に及ぼす影響を評価することを目的としています。(NCT04390477)。 カナダのモントリオール大学ホスピタリエセンターでのランダム化単一盲検臨床試験は、入院していないCOVID-19患者40人を対象に、Lactococcus lactis W136を1日2回鼻腔内投与した場合の影響を調べることを計画しています。 (NCT04458519)。 さらに、多施設ランダム化4盲検臨床試験では、2か月間にCOVID-19に曝露された314人の医療専門家に対するLactobacillus Coryniformis K8(3 x 109 CFU /日)の経口投与の予防効果を調査します(NCT04366180)。 | |
| メキシコのマヌエル・ギア・ゴンザレス病院総長で、ランダム化比較臨床試験により、300人の軽度のCOVID-19患者を対象に、Lactobacillus plantarum と Pediococcus acidilactici CECT 7483,のいくつかの菌株を毎日経口補給することの安全性と有効性が評価されます。 この研究の目的は、中等度/重度の疾患または死亡への進行のリスクを評価することに加えて、胃腸症状、肺病変、ウイルス量、および臨床的改善と相関する糞便微生物量の調節の頻度と重症度を調査することです(NCT04517422)。 オーストリアのグラーツ医科大学では、ランダム化された4重盲検プラセボ対照試験で、30日間の108人のボランティアにおけるBifidobacterium bifidum, B. lactis, Enterococcus faecium, Lactobacillus acidophilus, L. paracasei, L. plantarum, L. rhamnosus, L. salivarius、イヌリンおよびフルクトオリゴ糖(FOS)によるシンバイオティック経口治療の効果が調査されます。研究者らは、シンバイオティック療法が下痢の期間を短縮し、便の一貫性、腸の炎症、腸内毒素症、およびCOVID-19の胃腸症状を改善する可能性があると仮定しました(NCT04420676)。 米国では、COVID-19患者の1,000人の曝露された家庭内接触者の腸内細菌叢に対するLactobacillus rhamnosus GGを含むカプセルの経口摂取の影響を評価するために、28日間、ランダム化、三重盲検、プラセボ対照試験がデューク大学で実施されています。(NCT04399252)。 | |
| COVID-19における腸内細菌叢の調節を目的としたプロバイオティクスおよびその他の戦略の役割には、さらなる調査、特に、さまざまな年齢や疾患経過のより大きなコホートを含む、無作為化、二重盲検、対照臨床試験が必要です(64)。 すべてのプロバイオティクスを使用して呼吸器感染症を抑制する必要はありません。研究のバリエーションには、特定の菌株、補給期間、投与形態、用量、追跡時間の違いが含まれます(64、102)。 最後に、COVID-19は本質的に炎症性疾患であるため、プロバイオティクスの使用による肺-腸内細菌叢の形成(図1)は、通常最悪の疾患予後に至る過剰な炎症を制御するための重要な補助ツールとなる可能性があります。 | |
結論 | |
肺や腸などの粘膜表面は、病原性微生物と戦い、過度の炎症や組織の損傷を回避することにより、免疫応答の調節に重要な役割を果たします。局所免疫のこの微調整は、局所微生物叢の平衡にも依存しますが、粘膜耐性の崩壊と異生物状態は、SARS-CoV-2ウイルスによって引き起こされるような感染の確立と進行に有利に働く可能性があります。さらに、COVID-19では、呼吸器粘膜と胃腸粘膜の両方が影響を受け、局所微生物叢と炎症の関連する変化とともに影響を受けるため、腸-肺軸の調節と真正性の再確立に基づく補助療法が可能であると考えるのが妥当です。 COVID-19の有害な結果を抑制するための重要な治療アプローチである。しかし、特にCOVID-19の重症例では、これらの微生物ベースの介入の有効性を解明するために、さらなる研究が依然として必要です。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
|
|
この文献は、Front. Immunol., 24 February 2021に掲載されたMicrobiota Modulation of the Gut-Lung Axis in COVID-19を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


