ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
腸内細菌叢と変形性関節症との関連: 潜在的なメカニズムと治療法のエビデンスのレビュー |
Zhentian Wei et al., |
|
|
概要 |
| 変形性関節症(OA)は、関節軟骨の変性を特徴とする多因子性関節疾患であり、変形性関節症患者の関節の痛み、障害、および生活の質の低下につながります。変形性関節症の病因の根底にある潜在的なメカニズムを解釈することは、新しい疾患修飾治療の開発に不可欠です。複数の要因が変形性関節症の開始と進行に寄与していますが、腸内細菌叢は徐々に変形性関節症の発症における重要な病原性要因と見なされてきました。腸内細菌叢は、一連の免疫、代謝、神経機能に密接に関連する多機能の「器官」と見なすことができます。このレビューでは、腸内細菌叢と変形性関節症の相関関係を裏付ける研究証拠を要約し、免疫系、代謝、腸内細菌軸、腸内細菌叢の調節という4つの側面から相関関係の根底にある潜在的なメカニズムを解釈しました。今後の研究では、特定の腸内細菌叢の組成や特定の病原体、および変形性関節症の開始と進行に寄与する対応するシグナル伝達経路があるかどうかに焦点を当て、変形性関節症患者の治療のために腸内細菌叢を標的とする可能性を検証する必要があります。 |
目次(クリックして記事にアクセスできます) |
| 腸内細菌叢は免疫系を介して変形性関節症の開発に関与しています |
| 腸内細菌叢は腸のバリアに影響を与えます |
| 腸内細菌叢は自然免疫系を活性化します |
| 腸内細菌叢は適応免疫に影響を与えます |
| 腸内細菌は代謝を介して変形性関節症の発症に関与しています |
| エネルギー代謝 |
| 食事に関連する要因の代謝 |
| 骨代謝 |
| 腸内細菌叢-腸-脳軸は、変形性関節症の発症に関与する潜在的な経路です |
| 腸内細菌叢の調節:変形性関節症の新しい治療法 |
| プロバイオティクスとプレバイオティクス |
| 食事と栄養補助食品 |
| 運動 |
| 糞便微生物叢移植 |
| 制限事項 |
| 結論と将来の展望 |
序章 |
| 変形性関節症は、関節軟骨の損傷が支配的な関節組織全体が関与する多因子性関節疾患であり、最終的には痛み、関節の動きの制限、さらには障害につながります(Bijlsma et al.,2011)。変形性関節症は世界中で3億310万人に影響を及ぼしており、年齢標準化された有病率、発生率、および変形性関節症の障害者の生存年数は、1990年以降約8〜10%増加しています(Safiri et al.,2020)。変形性関節症の危険因子には、加齢、性別、関節損傷、食事、肥満、遺伝的素因、および機械的要因が含まれます(Felson et al.,2000; Johnson and Hunter.2014)。変形性関節症の診断と治療の推奨事項には、単純X線写真、超音波診断、MRIの助けが必要です(Abramoff and Caldera,2020)。変形性関節症のレントゲン所見には、関節腔狭窄、骨増殖症、軟骨下硬化症、および嚢胞形成が含まれます(Abramoff and Caldera,2020)。変形性関節症の治療には、主にライフスタイルの変更、理学療法、経口薬、注射、関節置換術のほか、間葉系幹細胞注射、多血小板血漿注射、神経ブロックなどの新しい治療が含まれます(Abramoff and Caldera,2020)。しかし、これらの治療法は、変形性関節症患者の症状を緩和することしかできません。肥満の増加や人口の高齢化に伴い、変形性関節症の発生率の根底にある傾向は徐々に上昇しており、世界に多大な経済的負担をもたらし、変形性関節症患者の生活の質に深刻な影響を及ぼしています。したがって、変形性関節症の病因と病因を解明することが不可欠です。 |
| 変形性関節症に関する研究の進展に伴い、腸内細菌叢が変形性関節症と密接に関連していることを発見する研究者がますます増えています。 腸内細菌叢は、細菌、真菌、ウイルス、ファージ、寄生虫、古細菌からなる腸内細菌集団の集まりであり、宿主の腸管にコロニーを形成し、栄養吸収、代謝恒常性の維持、発達および成熟において重要な役割を果たします。 免疫系、感染に対する抵抗性、全身および粘膜免疫の発達からの保護、および神経伝達物質の産生(Kamada et al.,2013; SommerandBäckhed.2013; Adak and Khan.2019; de Sire et al.,2020)。 内分泌機能と免疫機能を持つ「臓器」である腸内細菌叢(Clarke et al.,2014; Lazar et al.,2018)も、人の健康に大きな影響を与える体の生態系の重要な要素です。 |
| Schott et al(2018)は、プレバイオティクスが腸内細菌叢を調節することにより、変形性関節症に対する高脂肪食の影響を逆転させることを示しました。これは、腸内細菌叢が変形性関節症に及ぼす影響を示唆しています。 Guan et al(2020)は、抗生物質によって誘発された腸内細菌叢の腸内毒素症が変形性関節症の進行を軽減することができると結論を下しました。 Ulici et al(2018)の研究は、内側半月板の不安定化によって誘発される変形性関節症の重症度が、特定病原体除去マウスと比較して、無菌マウスで減少したことを示しました。これは、腸内細菌叢に関連する要因が関節損傷後の変形性関節症の発症を促進したことを示唆しています。実際、いくつかの臨床データでは、腸内細菌叢と変形性関節症との関連も確認されています。 Huang et al(2016)は、腸内細菌叢レベルに由来する血清および滑液リポ多糖(LPS)のレベルが、膝の変形性関節症の重症度および炎症に関連していることを示しました。 Boer et al(2019)はまた、連鎖球菌の豊富さが変形性関節症の膝の痛みと関連していることを発見しました。さらに、Dunn et al(2020)は、ヒトの変形性関節症軟骨と変形性関節症感受性マウスの軟骨の両方で、グラム陰性成分の細菌DNAの含有量が、それぞれヒト対照と変形性関節症耐性マウスと比較して増加したことを示しました。興味深いことに、Zhao et al(2018b)は、変形性関節症患者の滑液および滑膜組織に細菌の核酸が存在することを確認しました。また、関節に存在するこれらの細菌は、損傷した腸内バリアを介して腸内細菌叢から移動する可能性があります。腸内細菌叢が変形性関節症と関連しているという証拠を考えると、関連の根底にあるメカニズムを明らかにすることは、変形性関節症の新しい治療法の開発にとって有益です。したがって、この論文では、免疫系、代謝、腸脳軸、腸内細菌叢の調節という4つの側面から、腸内細菌と変形性関節症との関連の潜在的なメカニズムを検討します。また、この論文が、同僚が変形性関節症の病因の理解を広げるのに役立つことが期待されています。 |
腸内細菌叢は免疫系を介して変形性関節症の開発に関与しています |
| 変形性関節症は長い間軟骨の変性疾患と見なされてきました。 ただし、過去10年間で、変形性関節症の根本的なメカニズムに関する理解は根本的に変化しました。変形性関節症は、通常の身体の摩耗によって引き起こされる典型的な変性疾患ではなく、軽度の慢性炎症が中心的な役割を果たす多因子性疾患と見なされています(Robinson et al.,2016)。 炎症に関しては、免疫系が変形性関節症の発症に関与しているはずです。 同時に、腸内細菌叢も免疫系活性化の潜在的な推進力として徐々に考えられています(Dunn et al.,2020)。 腸内細菌叢が体の免疫系に影響を与えたり、免疫系と相互作用したりすることで、変形性関節症の進行に影響を与えるという証拠が蓄積されていることは有望です。 |
| 腸内細菌叢は腸のバリアに影響を与えます |
| 腸のバリアは、腸管の構造と機能の合計であり、細菌や毒素などの有害物質が腸の粘膜を通過して他の組織、臓器、血液循環に入るのを防ぐことができます。通常の腸のバリアは、機械的バリア、化学的バリア、免疫バリア、生物学的バリアで構成されています。バリアが破壊されると、腸内細菌叢、その生成物、免疫細胞を含む腸の内容物が循環器系に漏れ出し、おそらくエンドトキシンの転座と全身性炎症の一因となります。細菌または関連化合物(すなわち、リポ多糖およびペプチドグリカン)が腸のバリアを通過し、体循環に入り、変形性関節症を媒介することが示されています(Lorenzo et al.,2019)。腸、血液および関節の微生物叢の同時評価に基づいて、Tsai et al(2020)はまた、「リーキー」腸は、免疫遺伝子シグナル伝達の調節不全と炎症の促進に関連する微生物叢が腸から関節に移動し、変形性関節症の発症につながるという仮説を立てました。したがって、腸のバリアの完全性は、変形性関節症の進行を遅らせるのに役立ちます。 |
| 腸内細菌叢がさまざまなメカニズムを通じて腸内バリアの構造と機能に影響を与える可能性があることが、ますます多くの研究で証明されています(図1)。 Szychlinska et al(2019)は、腸内毒素症、つまり腸内細菌叢の変化が、腸内バリアの過度の多孔性を一定期間持続させると促進する可能性があることを示しました。 Li et al(2016a)は、一般的に使用されるプロバイオティクスLactobacillus rhamnosus GGまたは市販のプロバイオティクスサプリメントVSL#3を、性ステロイド欠乏マウスの正常細菌叢に追加すると、腸のバリアの完全性が大幅に向上することを発見しました。性ステロイド欠乏によって引き起こされる骨量減少からマウスを完全に保護します。驚くべきことに、彼らはまた、性ステロイドの欠乏が腸上皮における密着結合タンパク質の発現の減少と上皮バリアの透過性の増加をもたらすことを発見しました(Li et al.,2016a)。 Cani et al(2009)は、プレバイオティクスによって誘発された腸内細菌叢の変化が、グルカゴン様ペプチド-2依存性メカニズムを介して腸内バリア機能を改善することを発見しました。腸内細菌叢は、腸粘膜の生理学的炎症状態を維持し、組織修復因子、抗菌タンパク質、免疫グロブリンA(IgA)を継続的に産生し、腸のバリアの完全性を共同で維持する構成的シグナル伝達の産生を誘導できます(Rakoff-Nahoum et al .,2004; Sansonetti,2004; Peterson et al.,2007)。 Kalinkovich and Livshits(2019)は、腸内細菌叢、特に共生細菌と腸固有層に位置する腸関連リンパ組織との間の活発に調節されたクロストークが、腸のバリアの完全性を促進し、腸上皮の機能を確保し、腸の免疫恒常性を維持すると要約しました。動物実験データは、インビボでの腸カンナビノイド1型受容体の活性化が腸バリア機能を調節できることを示しています(Zoppi et al.,2012)。これに基づいて、Liu et al(2003)は、腸内細菌叢が、特にリポ多糖とおそらく栄養素を介して、腸内カンナビノイドシステムを調節することによって腸のバリアを調節することを発見しました。 外膜小胞(OMV)は、通常の増殖中に病原性および共生のグラム陰性菌によって産生されます。外膜小胞のサイズは約20nmから250nmまで変化します。それらは、細菌の膜タンパク質の調節中に細菌の膜から放出されます(Kulp and Kuehn,2010)。 Kaparakis-Liaskos et al(2015)は、外膜小胞のin vitro活性に基づいて、病原体が外膜小胞を使用して粘膜上皮の完全性を破壊し、細菌成分が粘膜下組織に入り、さまざまな免疫細胞と直接相互作用する可能性があることを示しました。これには、好中球、マクロファージ、樹状細胞が含まれ、病理学的変化を促進します。 |
| 図1 その腸内細菌叢の根底にあるメカニズムは、腸のバリアの構造と機能に影響を与える可能性があります |
| I)プロバイオティクスLactobacillus rhamnosus GG(LGG)または市販のプロバイオティクスサプリメントVSL#3は、性ステロイド欠乏によって引き起こされる腸上皮の密着結合タンパク質の発現低下を阻害することにより、腸バリアの完全性を高めました(Li et al.,2016a)。 |
| II)プレバイオティクスによって誘発された腸内細菌叢は、グルカゴン様ペプチド-2(GLP-2)に応じて、腸のバリア機能を改善しました(Cani et al.,2009)。 |
| III)タウリン、ヒスタミン、スペルミンなどの微生物代謝産物は、NLRP6インフラマソームシグナル伝達、上皮インターロイキン-18(IL-18)分泌、および下流の抗菌ペプチドプロファイルを共調節することにより、宿主と微生物叢の界面を形成することにより、腸のバリアを保護しました(Levy et al .,2015)。 |
| IV)共生乳酸桿菌のトリプトファン代謝物は、アリール炭化水素受容体(AhR)に結合することにより、免疫バリアに寄与しました(Zelante et al.,2013)。 |
| V)腸内細菌叢による食物繊維の発酵に由来する短鎖脂肪酸(SCFA)(Ulici et al.,2018)は、好中球など(Vinolo et al.,2011)いくつかの造血細胞タイプを介して腸の恒常性を促進しました(Levy et al.,2017)。 |
| VI )短鎖脂肪酸は、腸上皮杯細胞におけるムチン(MUC)遺伝子発現をアップレギュレートすることにより、粘膜免疫の維持に貢献しました(Gaudier et al.,2004)。 |
| VII )短鎖脂肪酸は、アデノシン一リン酸活性化プロテインキナーゼ(AMPK)を活性化することにより、密着結合の構築を促進しました(Peng et al.,2009)。 |
| VIII)病原性および共生グラム陰性菌によって産生される外膜小胞(OMV)は、粘膜上皮の完全性を破壊しました(Kaparakis-Liaskos and Ferrero,2015)。 |
| IX)腸内細菌叢と腸管関連リンパ組織(GALT)の間の規制されたクロストークは、腸のバリアに寄与しました(Kalinkovich and Livshits,2019)。 |
| X)リポ多糖(LPS)は、腸のカンナビノイド1型受容体(CB1R)を活性化することにより、腸のバリアを調節しました(Zoppi et al.,2012)。 |
| XI)腸内代謝産物である胆汁酸は、腸内細菌叢によってファルネソイドX受容体(FXR)およびGタンパク質結合胆汁酸受容体1(GPBAR1)または(TGR5)を介して制御され、腸内バリアを保護しました(Levy et al.,2017 )。 |
| 酪酸は短鎖脂肪酸(SCFA)のグループであり、腸内細菌叢による食物繊維の発酵によって下部腸で生成されます(Ulici et al.,2018)。腸内細菌叢によって媒介される酪酸は、結腸腸内細菌の主なエネルギー源であり、腸透過性を低下させ、腸の健康に有益な要因となる可能性があります(Milani et al.,2017)。実際、Peng et al(2009)は、Caco-2細胞単層のアデノシン一リン酸活性化プロテインキナーゼ(AMPK)を活性化して密着結合の構築を促進することにより、酪酸が腸のバリアを強化することを実証しました。さらに、他の研究では、短鎖脂肪酸の補給が杯細胞を介した粘膜免疫の維持に寄与することが示されています。杯細胞では、ムチン遺伝子の発現が酪酸の下でアップレギュレートされます(Gaudier et al.,2004)。同様に、短鎖脂肪酸は、いくつかの造血細胞タイプを介して腸の恒常性を促進し(Levy et al.,2017)、腸のバリアの構造と機能を保護するのに役立ちます。たとえば、好中球の走化性と白血球の機能は短鎖脂肪酸の影響を受けます(Vinolo et al.,2011)。上皮内リンパ球機能の調節における特定の細菌由来代謝物の関与を示唆するいくつかの研究があります(Lee et al.,2011; Li et al.,2011)。トリプトファンの微生物代謝物はその代表的な例です(Lee et al.,2007; Li et al.,2014)。 Zelante et al(2013)は、トリプトファンを代謝することにより、共生乳酸菌がアリール炭化水素受容体のリガンドを生成することを示しました。これは、免疫応答の強力な調節因子であるリガンド活性化転写因子であり、器官形成、腸のリンパ濾胞の発達、免疫細胞の活性化と増殖に幅広い影響を及ぼします。さらに、研究により、アリール炭化水素受容体の役割は、上皮バリアおよび上皮内リンパ球の恒常性を維持する上で不可欠であることがわかっています(Lee et al.,2011; Li et al.,2011)。さらに興味深いことに、Levy et al(2015)は、腸内細菌叢に関連する代謝産物であるタウリン、ヒスタミン、およびスペルミンが、NLRP6インフラマソームシグナル伝達、上皮インターロイキン-18(IL-18)分泌を共調節することにより、宿主と微生物叢の界面を形成することを示しました。下流の抗菌ペプチドプロファイル、つまり、腸内バリアが重要な要素である腸内微小環境の形成に役立ちました。さらに、肝臓のコレステロールによって生成され、腸内細菌叢によってさらに代謝される別の腸の代謝物である胆汁酸(de Aguiar Vallim et al.,2013)は、細菌の増殖を調節し、腸のバリアを保護することができます。これは、ファルネソイドX受容体とGタンパク質結合胆汁酸受容体1を介して腸内細菌叢によって制御されます(Levy et al.,2017)。まとめると、腸内細菌叢が腸内バリアに影響を与えるメカニズムを完全に理解することは、腸内細菌叢と変形性関節症の間のつながりをさらに深め、正確な介入を通じて変形性関節症を改善するのに役立つ可能性があります。 |
| 腸内細菌叢は自然免疫系を活性化します |
| 自然免疫とは、細菌、ウイルス、真菌などの侵襲性病原体によって引き起こされる免疫応答を含む、自然界の保存的パターンに応答する一定パターン認識受容体(PRR)によって誘導される宿主免疫応答を指します(Kawai and Akira、2010)。変形性関節症の開始と持続は、自然免疫系の活性化と密接に関連していることが示されています(Scanzello et al.,2008)。 腸内細菌叢の変化が自然免疫系を活性化し、炎症性サイトカインの産生を増加させ、関節に影響を与える可能性があるという証拠があります(Arend and Firestein,2012; Huang and Kraus,2016)。 最近、マイクロバイオータおよびマイクロバイオータ関連分子が、動物モデルにおいて、自然免疫活性化に関与するメカニズムを通じて、全身レベルと局所レベルの両方で変形性関節症の病因に影響を与えることが確認されました(Liu et al.,2019)。 |
| マクロファージは自然免疫系の重要な構成要素であり、変形性関節症の生成と進行に重要な役割を果たします。 Daghestani et al(2015)は、マクロファージ関連の炎症が構造的損傷と変形性関節症の進行の推進因子であることを示しました。 Kraus et al(2016)はまた、変形性膝関節症患者の膝関節に活性化マクロファージとマクロファージ関連炎症があり、これらは変形性膝関節症の症状と画像の重症度に密接に関連していることを示しました。さらに、マクロファージが全身性関節部位の変形性関節症の痛みの病因であることも示したことは注目に値します(Kraus et al.,2016)。Boer et al(2019)は、腸内細菌叢が変形性関節症関連の膝の痛みと連鎖球菌属に広く関連していることを発見しました。また、連鎖球菌属の相対的な存在量が高いほど、関節の局所的な炎症によって引き起こされた膝の痛みがひどくなります。 特に、彼らはまた、連鎖球菌属のメンバーが代謝産物と膜小胞を産生したという仮説を立てました。これは、腸-血液バリアを通過し、滑膜内層のマクロファージを活性化して関節の炎症や損傷を引き起こすか、血流に入り、マクロファージを炎症誘発性マクロファージに活性化して、低レベルの全身性炎症状態を引き起こす可能性があります。これは、関節の炎症や損傷を引き起こしたり悪化させたりします(図2、I、II)。さらに、Schott et al(2018)は、肥満が肥満マウスの腸内細菌叢を変化させる可能性があることを報告しました-。それは、主要な炎症誘発性種の存在量の増加であり、マクロファージが滑膜に移動し、膝の変形性膝関節症を加速させることにより、それに伴う下流の全身性炎症のクライマックスにつながります。これは、関節の炎症を誘発する2つのサイトカインである単球走化性タンパク質1(MCP-1)と腫瘍壊死因子(TNF)のアップレギュレーションを阻害することにより、難消化性プレバイオティクス繊維であるオリゴフルクトースによって逆転する可能性があります(図2、III、IV)。さらに、肥満では、腸の微生物相の変化が炎症を活性化し(John and Mullin,2016; Portune et al.,2017)、活性化されたマクロファージおよび他の炎症細胞を脂肪組織に移動させ、TNFおよび他の炎症誘発性サイトカインを循環(Weisberg et al.,2003; Xu et al.,2003; Lumeng et al.,2007)は、全身性炎症を悪化させ、変形性関節症の発症を促進します(図2、V)。 |
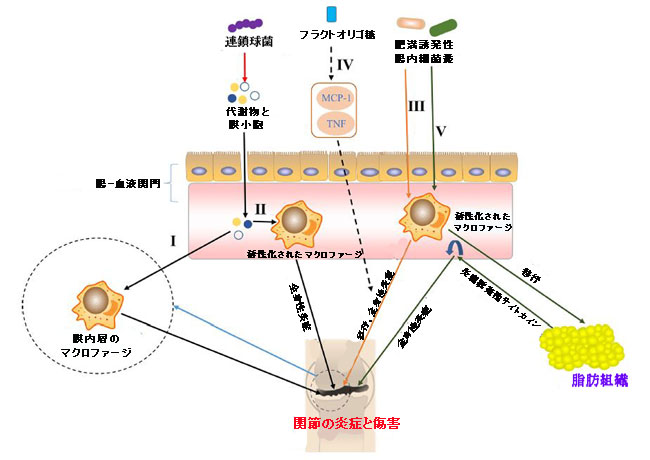 |
| 図2 マクロファージを介した変形性関節症に対する腸内細菌叢の影響の経路 |
| I)連鎖球菌属が産生する代謝物と膜小胞。腸-血液関門を通過して滑膜内層のマクロファージを活性化することにより、関節の炎症と損傷を引き起こしました(Boer et al.,2019)。 |
| II)連鎖球菌属によって産生される循環中の代謝物および膜小胞は、マクロファージを炎症誘発性マクロファージに活性化し、低レベルの全身性炎症状態を引き起こし、関節の炎症および損傷を誘発または悪化させた(Boer et al.,2019)。 |
| III)肥満誘発性腸内細菌叢は、全身性炎症およびマクロファージの滑膜への移動に寄与することにより、膝の変形性関節症を加速させました(Schott et al.,2018)。 難消化性プレバイオティクス繊維である。 |
| IV)オリゴフルクトースは、単球走化性タンパク質1(MCP-1)および腫瘍壊死因子(TNF)のアップレギュレーションを阻害することにより、IIIの経路を逆転させることができます(Schott et al.,2018)。 |
| V) 肥満誘発性腸微生物叢は炎症を活性化し(John and Mullin、2016; Portune et al.,2017)、活性化マクロファージを脂肪組織に移動させ、炎症誘発性サイトカインを循環に放出しました(Weisberg et al.,2003; Xu et al.,2003; Lumeng et al.,2007)、全身性炎症を悪化させ、変形性関節症の発症を促進します。 |
| 腸内細菌が宿主の炎症に及ぼす影響は、主にパターン認識受容体、特にToll様受容体(TLR)とヌクレオチド結合オリゴマー化ドメイン(NOD)様受容体(NLR)に依存します(McPhee and Schertzer,2015; Nagpaletal.,2016)。 微生物関連分子パターン(MAMP)は、微生物関連分子パターンが最も一般的なリガンドであるパターン認識受容体によって認識されます。微生物関連分子パターンには、リポ多糖、ペプチドグリカン(PGN)(Clarke et al.,m2010)、フラジェリン、細菌性無細胞DNAなどの因子が含まれます。これらは、腸のバリアを越えて全身循環に入り、常在免疫細胞に炎症誘発性反応を誘発します。 また、関節に送達され、骨、軟骨、滑膜の自然免疫受容体を刺激して炎症誘発性反応を引き起こします(Huang et al.,2016; Hernandez,2017)。 |
| いくつかの研究は、細菌のペプチドグリカンが関節内滑膜線維芽細胞を刺激し、滑膜線維芽細胞上の外膜タンパク質Toll様受容体2を活性化することによってマトリックスメタロプロテイナーゼ(MMP)および炎症誘発性サイトカインの発現を誘導できることを示しています(Kyburz et al.,2003)(図3, 私)。さらに、ペプチドグリカン-多糖(PGN-PS)複合体は、変形性関節症の影響を受けた関節の滑膜下敷き細胞で検出され(van der Heijden et al.,2000)、アジュバント誘発関節炎モデルで関節形成特性を確認しました(Kool et al., 1991)。 Clarke et al(2010)は、腸内細菌叢由来のペプチドグリカンが、ヌクレオチド結合オリゴマー化ドメイン1の認識を通じて全身の自然免疫を開始および強化することを示しました(図3,II)。 ヌクレオチド結合オリゴマー化ドメイン様受容体タンパク質は、インフラマソームの必須成分(または前駆体)であり(Horng and Hotamisligil,2011; Zhao et al.,2018a)、体の炎症経路に関連しています。ヌクレオチド結合オリゴマー化ドメイン様受容体P3インフラマソームが変形性関節症の診断とモニタリングのための新鮮なバイオマーカーであるという証拠が増えており(McAllister et al.,2018)、Martinon et al(2006)が、マクロファージのヌクレオチド結合オリゴマー化ドメイン様受容体P3インフラマソームがピロリン酸カルシウム二水和物結晶に関与して炎症性サイトカインであるインターロイキン-1-ベータ(IL-1β)の放出を誘導したことを実証しました。これは、II型およびIX型コラーゲン(Goldring et al.,1988)およびアグリカン(Pfander et al.,2004)を含む軟骨細胞外マトリックス成分の産生を阻害することが証明されています。さらに、ヌクレオチド結合オリゴマー化ドメイン様受容体P1インフラマソームの発現は、変形性関節症患者の滑液においてもアップレギュレーションされることがわかっています(Zhao et al.,2018a)。これらのデータは、インフラマソームが変形性関節症の病状と進行に重要な役割を果たしていることを強く示しています。腸内細菌叢に由来するペプチドグリカンがヌクレオチド結合オリゴマー化ドメイン様受容体のリガンドとして使用できることはよく知られています。したがって、ペプチドグリカンは、ペプチドグリカンがヌクレオチド結合オリゴマー化ドメイン様受容体を認識し、インフラマソームを活性化し、炎症性サイトカインの増加を促進する経路を介して変形性関節症の進行に関与していると仮定されます(図3,III)。これらの結果と仮説は、ペプチドグリカンが変形性関節症の誘発と悪化に関係していることを示しています。 |
| 図3 変形性関節症に関与するペプチドグリカンの経路 |
| I) ペプチドグリカンは、滑膜線維芽細胞上のToll様受容体2を活性化することにより、マトリックスメタロプロテイナーゼ(MMP)および炎症性サイトカインの発現を誘導することにより変形性関節症の発症に影響を与えます(Kyburz et al.,2003)。 |
| II) ペプチドグリカンは、ヌクレオチド結合オリゴマー化ドメイン様受容体1(NOD1)を認識し、全身の自然免疫を促進することにより、変形性関節症の発症に影響を与えます(Clarke et al.,2010)。 |
| III) ペプチドグリカンは、ヌクレオチド結合オリゴマー化ドメイン様受容体を認識し、ヌクレオチド結合オリゴマー化ドメイン様受容体P1およびヌクレオチド結合オリゴマー化ドメイン様受容体P3インフラマソームを活性化し、炎症性サイトカインの増加を促進することにより、変形性関節症の発症に影響を与えます。 |
| Huang et al(Huang and Kraus,2016; Huang et al.,2016)は、リポ多糖(エンドトキシンとしても知られる)のレベルが膝変形性関節症の重症度と炎症に密接に関連していることを示し、変形性関節症病因の2つのヒットモデルを策定しました、最初のヒットは、関節組織マクロファージがToll様受容体4を介してリポ多糖によってプライミングされることであり、2番目のヒットは、マクロファージインフラマソーム経路が、構造的関節損傷に起因する損傷関連分子パターンによって活性化されることです。このモデルは、自然免疫を活性化し、インフラマソームの活性化や断片化された軟骨マトリックス分子の集合など、共存する補完的なメカニズムを介して、全身および関節の炎症反応と関節の構造的損傷を促進します(Huang and Kraus,2016)。 リポ多糖は、自然免疫系のマクロファージと好中球を活性化し、IL-1βや腫瘍壊死因子、マトリックスメタロプロテイナーゼ、フリーラジカルなどの炎症誘発性因子を合成するように誘導し、関節組織に重大な二次炎症を引き起こすことが示されています( Lorenz et al.,2013)。驚くべきことに、リポ多糖が変形性関節症の進行に関与する1つの経路が発見されました。 CD14は、主に単球やマクロファージなどのさまざまな細胞型に存在し(Landmann et al.,2000)、LPS-LPS結合タンパク質(LBP)複合体の受容体として機能し(Wright et al.,1990)、変形性関節症の病因。 リポ多糖は、CD14–LPS–LBP複合体とToll様受容体4の結合を介して自然免疫応答を活性化し、さまざまな細胞タイプ、特に単球や他の免疫細胞の細胞表面、およびその補助受容体骨髄分化タンパク質-2(MD -2)(Akashi et al.,2000; Cani et al.,2007)。この活性化により、活性化B細胞(NF-κB)の核因子カッパ-軽鎖エンハンサーのレベルが上昇します(Nair et al.,2012)。活性化B細胞レベルの上昇は、活性化された関節細胞を誘導して、腫瘍壊死因子、IL-1β、IL-6、活性化B細胞リガンドの受容体活性化因子(RANKL)およびIL-8などの異化性サイトカインおよびケモカインを産生させることが知られています。次に、マトリックスメタロプロテイナーゼの産生を高め、コラーゲンとプロテオグリカンの合成を減らし、活性化B細胞の活性化をさらに強化し、最終的に関節組織の二次炎症を引き起こします(Kapoor et al.,2011)(図4,私)。追加できることは、リポ多糖が培養軟骨細胞におけるマトリックスメタロプロテイナーゼおよび自然免疫応答の成分の分泌を誘導し(Haglund et al.,2008)、関節軟骨外植片のマトリックス分解を促進することもできることを示した研究があることです(MacDonald etal.,1994)。さらに、リポ多糖は軟骨細胞を活性化して、補体C1rサブコンポーネント、補体因子B、補体C3、ミメカン(オステオグリシン)、および長いペントラキシン3の産生を誘導し、補体カスケードの活性化と活性補体タンパク質(Haglund et al.,2008)、これは受容体に結合したり、滑膜細胞に沈着したりして、炎症性サイトカインの産生を増加させる可能性があります(図4,II)。この経路は、リポ多糖がToll様受容体4の活性化を通じて自然免疫応答を誘導するだけでなく、炎症誘発性サイトカインをアップレギュレートすることによって既存の慢性低悪性度炎症を悪化させ(Huang and Kraus、2016)、変形性関節症を慢性疾患状態に与えることを示しています(Scanzello et al .,2008)。興味深いことに、サイトカインやアディポカインなど、体脂肪や脂肪組織から分泌される内因性の炎症性メディエーターが、変形性関節症の開始と進行につながる可能性があるという証拠があります(Kapoor et al.,2011; Berenbaum,2013)。同様に、いくつかのin vitro研究では、レプチン、アディポネクチン、ビスファチン、レジスチンなどのアディポカインが炎症性メディエーターと軟骨溶解を誘発する能力があることが示されています(Conde et al.,2011)。上記に基づいて、Bleau et al(2015)はまた、リポ多糖が脂肪組織の炎症を誘発し、サイトカイン、アディポカイン、およびレプチン、IP-10、IL-1αなどの成長因子の全身変化を引き起こし、最終的に内部の局所炎症環境に影響を与えることで変形性関節症の発症を促進したことを示しました膝関節(図4,III)。さらに、リポ多糖はToll様受容体4–CD14複合体と相互作用してシグナル伝達カスケードを刺激し、Toll様受容体2の発現を誘導し、自然免疫応答をさらに増強することが示されています(Ojaniemi et al.,2006)。また、リポ多糖は、ヌクレオチド結合オリゴマー化ドメイン様受容体P1およびヌクレオチド結合オリゴマー化ドメイン様受容体P3インフラマソームによって媒介される変形性関節症患者に由来する線維芽細胞様滑膜細胞に炎症およびピロトーシスを誘発したことにも注意してください(Zhao et al.,2018a)。要約すると、リポ多糖は、自然免疫系を活性化し、複数の経路を介してさまざまなサイトカインの発現を仲介することにより、変形性関節症の永続的な発達において病原性の役割を果たします。 |
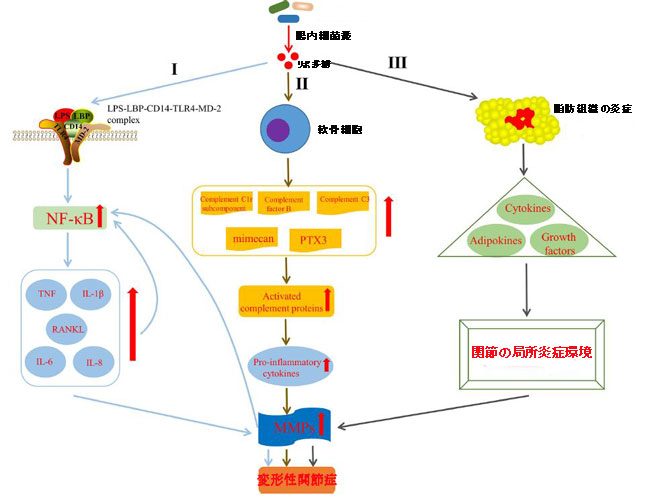 |
| 図4 リポ多糖が変形性関節症の発症に影響を与えるメカニズム |
| I)リポ多糖は、LPS–LBP–CD14–TLR4–MD-2複合体の形成を介して自然免疫応答を活性化し、NF-κBレベルを上昇させ、TNF、IL-1β、IL-6、IL-8をアップレギュレートすることにより、変形性関節症に関与します。 RANKLレベル、MMPの産生を高め、NF-κBの活性化をさらに強化します。 |
| II) リポ多糖は、軟骨細胞の補体経路を活性化することにより変形性関節症に関与しています(Haglund et al.,2008) |
| III) リポ多糖は、脂肪組織の炎症を誘発し、サイトカイン、アディポカイン、成長因子の全身変化を引き起こし、最終的に膝関節内の局所炎症環境に影響を与えることにより、変形性関節症に関与します(Bleau et al.,2015)。 |
| LPS、リポ多糖; LBP、LPS結合タンパク質; MD-2、骨髄分化タンパク質-2; NF-κB、活性化B細胞の核因子カッパ-軽鎖-エンハンサー; TNF、腫瘍壊死因子; IL-1β、インターロイキン-1-ベータ; RANKL、NF-κBリガンドの受容体活性化因子; PTX3、ロングペントラキシン3; MMP、マトリックスメタロプロテイナーゼ。 |
| 腸内細菌叢は適応免疫に影響を与えます |
| 以前は、変形性関節症の滑膜組織には、B細胞、形質細胞、肥満細胞、ナチュラルキラー(NK)細胞などの免疫細胞が含まれていることが発見されたとしても(de Lange-Brokaar et al.,2012; de Lange-Brokaar et al.,2016; Klein-Wieringa et al.,2016)、変形性関節症は適応免疫とは何の関係もないようでした。 しかし、変形性関節症の発症におけるこれらの免疫細胞の可能な病理学的役割を確認するための研究はまだ不足しています。しかし、最近の証拠は、T細胞がOAの病因に役割を果たすことを示唆しています。Qi et al(2016)and Shanetal(2017)の調査によると、T細胞が変形性関節症で調節不全になっていることを示唆することができます。 Sadtler et al(2016)は、ヘルパーT(Th)細胞がマクロファージを誘導して、サイトカインの放出を介してIL-4依存的に再生促進表現型を生成することを発見しました。これは、ヘルパーT細胞が炎症と修復の制御に生物学的役割を果たしていることを示しています。重要なことに、Li et al(2017)は、変形性関節症におけるT細胞、特にTh1、Th2、Th9、Th17、濾胞性ヘルパーT(Tfh)細胞、制御性T(Treg)細胞などのヘルパーT細胞の効果もレビューしています。 :T細胞は明らかに変形性関節症器官に存在し、プロテアーゼを刺激して軟骨基質を破壊するか、抗炎症性サイトカインの分泌とサイトカインの受容体の発現を調節する異化性サイトカインを産生します。さらに、ヘルパーT細胞は適応免疫系を調節することで変形性関節症の進行に影響を与える可能性があります(Woodell-May and Sommerfeld,2020)。 |
| 変形性関節症におけるT細胞の役割を考慮して、腸内細菌叢が適応免疫に影響を与えることによって変形性関節症の発生に関与していることに注意が払われてきました。腸内細菌叢の腸内毒素症は、原始的なCD4+T細胞のエフェクターT細胞またはTreg細胞への分化の方向を決定することができます。 Treg細胞とエフェクターT細胞サブセットTh1、Th2、Th17のバランスは免疫恒常性にとって重要であり、その不均衡は関節を含む慢性炎症を引き起こす可能性があります(Honda and Littman,2012)(図5、I)。 さらに、変形性関節症の病因における濾胞性ヘルパーT細胞の役割は明らかにされていませんが、Shan et al(Shan et al.,2017)は、変形性関節症患者のCXCR5 + CD4+Tfh細胞の割合が健康な対照群患者よりも有意に高いことを発見しました。 興味深いことに、新しい洞察は、CXCR5 + CD4 +濾胞性ヘルパーT細胞の活性化が腸内細菌叢と胆汁酸代謝によって誘発される可能性があることを示しました(Cheng et al.,2022)。 腸に存在する種であるセグメント化された糸状菌は、濾胞性ヘルパーT患者の滑液および滑膜組織に蓄積する可能性があるTh17細胞を介して自己免疫性関節炎を引き起こすことが実証されています(Wu et al.,2010)(Chabaud et al.,1999 ; Qi et al.,2016)。 So et alは、プロバイオティクスであるLactobacillus caseiがTh1型炎症反応をダウンレギュレートすることにより関節リウマチ(RA)を抑制し(So et al.,2008)、Lactobacillus caseiとII型コラーゲン/グルコサミンの混合物が T細胞応答を調節することによる実験的OAにおける滑膜線維芽細胞または軟骨細胞(So et al.,2011)。 リポ多糖は微生物関連分子パターンとして、Toll様受容体4を活性化して炎症性カスケードを引き起こし、インターフェロンと炎症性サイトカインを放出します。これらは転写因子として作用し、ナイーブ免疫細胞を成熟させます(Chen et al.,2011; Chu and Mazmanian、2013;Kim, 2013)(図5,II)。興味深いことに、腸内細菌由来のリガンドは、Toll様受容体2とToll様受容体4を刺激することによって関節の炎症と軟骨および骨の破壊に影響を与える関節炎のマウスモデルでT細胞のバランスを差別的に歪めました(Abdollahi-Roodsaz et al.,2008)。生合成のために微生物相に依存するビタミンBとKは、T細胞の生物学に影響を与えることが報告されています。たとえば、合成がビフィズス菌とラクトバチルスに依存するビタミンB9は、Treg細胞の生存因子です(Kunisawa et al.,2012)(図5,III)。 腸内細菌叢に由来する酪酸は、カルニチンパルミトイルトランスフェラーゼ1A(CPT1A)(Hao et al.,2021)に依存する脂肪酸酸化を増強することにより、結腸誘導性Treg細胞(Furusawa et al.,2013)の分化を誘導することによって、腸の免疫恒常性を形成するのに役立ちます。 酪酸はまた、ヒストンのアセチル化の遺伝子発現をアップレギュレートすることにより、Treg細胞の生成を促進します(Arpaia et al.,2015)(図5,IV)。さらに、Hui et al(Hui et al。、2019)は、酪酸がTreg細胞/ IL-10 / Th17細胞軸を介してコラーゲン誘発関節炎を阻害することを示しました。これにより、酪酸が同じ経路で変形性関節症の進行に影響を与える可能性があるかどうかも考えられます。 まとめると、これらのデータは、腸内細菌叢および関連製品も、適応免疫、特にT細胞の調節に影響を与えることによって変形性関節症の進行に影響を与えることを示しています。 |
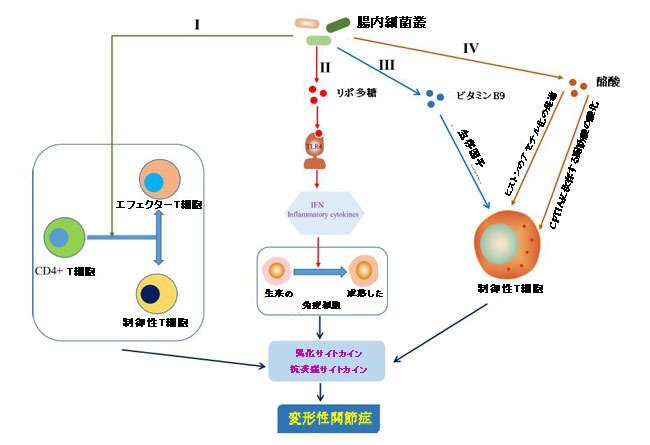 |
| 図5 適応免疫に対する腸内細菌叢の影響 |
| I)腸内細菌叢は、原始CD4 + T細胞のエフェクターT細胞または制御性T細胞への分化の方向を決定しました(Honda and Littman,2012)。 |
| II)リポ多糖(LPS)は、トール様受容体4(TLR4)を活性化して炎症カスケードを引き起こすことにより、ナイーブ免疫細胞を成熟免疫細胞に誘導するのに役立ちました(Chen et al.,2011; Chu and Mazmanian,2013; Kim,2013)。 |
| III)ビタミンB9は制御性T細胞の生存に寄与しました(Kunisawa et al.,2012)。 |
| IV)酪酸は、ヒストンのアセチル化をアップレギュレートし(Arpaia et al.,2015)、カルニチンパルミトイルトランスフェラーゼ1A(CPT1A)に依存する脂肪酸酸化を増強する(Hao et al.,2021)ことにより、制御性T細胞の生成と分化を調節しました。 |
| IFN、インターフェロン |
腸内細菌叢は代謝を介して変形性関節症の発症に関与しています |
| ご存知のように、変形性関節症の危険因子には、体の代謝に関連する老化、食事、肥満などがあります。 Mooney et al(2011)は、代謝調節不全が、高脂肪食によって誘発される2型糖尿病マウスモデルの変形性関節症関連軟骨変性の併存因子であることを示唆しました。 Mobasheri et al(2017)はまた、変形性関節症が代謝障害として作用し、代謝が軟骨と滑膜関節機能に重要な役割を果たすことを示し、変形性関節症の病因における代謝の影響をレビューしました。 さらに、メタボリックシンドローム関連変形性関節症(MetS-OA)は重要な臨床表現型であり、代謝性疾患(肥満、糖尿病およびインスリン抵抗性、脂質異常症、高血圧)を変形性関節症に関連付けます(Courties et al.,2017)。 インスリン抵抗性はまた、独立して変形性関節症と関連していることが見出されており(Silveri et al.,1994)、その関連は、インスリン抵抗性によって損なわれた軟骨基質の分泌と維持によって媒介される可能性があります。 2型糖尿病の結果である終末糖化産物(AGE)によって誘発される軟骨細胞の細胞内シグナル伝達カスケード(DeGroot et al.,2004)。 その結果、代謝は変形性関節症と密接に関連しています。 興味深いことに、腸内細菌叢は独立した内分泌器官と見なすことができ、宿主との分子クロストークを通じて宿主のエネルギー恒常性を維持し、宿主の免疫を刺激することに関与しています(Clarke et al.,2014)、 インスリン抵抗性、軽度の炎症、および宿主のエネルギー代謝および炎症経路との分子相互作用を介した宿主における過剰な脂質蓄積を誘発することにより、肥満および代謝性疾患の病因に間接的に関与している(Boulange et al.,2016)。 上記の証拠に基づいて、腸内細菌叢は、体の代謝に影響を与えるか、相互作用することにより、変形性関節症の発症に関与している可能性があります。 |
| エネルギー代謝 |
| 腸内細菌叢は、消化管の生理機能と運動性(Abrams and Bishop,1967; Musso et al.,2011)および多糖類の消化(Gibson et al.,2004)、腸およびアデノシン一リン酸活性化プロテインキナーゼ(Winder and Hardie,1999; Samuel et al.,2008)の絶食誘発性脂肪因子(Bäckhedetal.,2004)を阻害し、コリンの代謝と変換に影響を与え(Noga and Vance,2003; Dumas et al.,2006; Cole et al.,2012)、ファルネソイドX受容体を調節し(Parséusetal.,2017)、短鎖脂肪酸とGタンパク質(訳者注:Gタンパク質は、グアニンヌクレオチド結合タンパク質の略称であり、GTPまたはGDPを結合して活性のON/OFFを行うことにより、細胞内情報伝達に関与する)結合受容体の間の相互作用を調節(GPCR; GPR41,GPR43,およびGPR109A)、(Bäckhedetal.,2004; Samuel et al.,2008; Bellahcene et al.,2013; Neves et al.,2015)に役立つといういくつかの証拠があります。これは肥満と代謝性疾患の一因となります(図6、I)。慢性炎症はまた、腸内細菌叢を肥満およびインスリン抵抗性に関連付けました。 Cani et al(2007)は、リポ多糖が炎症関連のプロセスを開始したことを示唆しました。これは肥満とインスリン抵抗性の発症に関連しています。いくつかの研究はまた、リポ多糖を介した炎症経路または代謝性内毒素血症が、インスリン分泌の調節に関与することにより、肥満およびインスリン抵抗性の生理学および病理学において重要な役割を果たしたことを示した(Shi et al.,2006; Ghanim et al.,2009 ;Vergèsetal.,2014)炎症性サイトカイン(IL-1β、TNFなど)に依存する軟骨分解酵素マトリックスメタロプロテイナーゼの発現を阻害することにより関節軟骨を保護することができます(Hamada et al.,2016)(図6, II)。 さらに、関節を取り巻く脂肪組織は、もはや受動的なエネルギー貯蔵部位とは見なされませんが、レプチン、レジスチン、ビスファチン、アディポネクチンなどのアディポカインを分泌する能力を備えた真正な内分泌「器官」です(Zeddou,2019)。変形性関節症に寄与する能力は、Metcalfe et al(2012)によって要約されています。 実際、滑液中のレプチンのレベルは変形性関節症に関連していることが示され(Ku et al.,2009; Xiong et al.,2019a)、レプチン遺伝子とその受容体遺伝子も一塩基多型分析によって変形性関節症に関連していることが示されています(Qin et al.,2010; Ma et al.,2013)。 レプチン受容体(Ob-Rb)に結合するレプチンのレベルの増加も注目されています。 Janusキナーゼ2/シグナル伝達物質および転写活性化因子(JAK2 / STAT3)、p38 MAPK(訳者注:p38分裂促進因子活性化タンパク質キナーゼ)、またはホスファチジルイノシトール3-キナーゼ/プロテインキナーゼB(PI3K / AKT)シグナル伝達経路(Xiong et al.,2019b)を介してIL-6の発現を促進します。 さらに、レプチンは、IL-1、マトリックスメタロプロテイナーゼ9、マトリックスメタロプロテイナーゼ13などの他の因子の発現を増強する可能性もあります(Simopoulou et al.,2007; Troeberg and Nagase,2012)。 全体として、上記の証拠は、脂肪組織由来のアディポカイン、特にレプチン(Yang et al.,2013)が炎症性サイトカインの放出を誘発し、軟骨損傷を介して変形性関節症の進行を促進する可能性があることを示唆しています。 興味深いことに、腸内細菌叢に由来するリポ多糖は、脂肪組織を刺激することによってアディポカインの発現の増加を誘導します(Grunfeld et al.,1996; Bleau et al.,2015)、 これは、腸内細菌が代謝に影響を与えることによって変形性関節症の発症に関与するための重要な経路です。 |
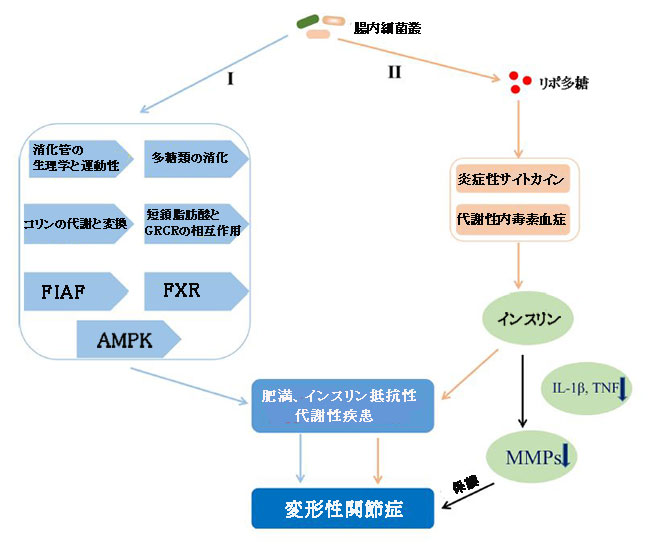 |
| 図6 エネルギー代謝に影響を与えることで変形性関節症に寄与する腸内細菌叢のメカニズム |
| I)腸内細菌叢は、消化管の生理機能と運動性、多糖類の消化、コリンの代謝と変換、SCFAとGPCR、FIAF、FXR、およびAMPKの相互作用に関与する経路を介してエネルギーを獲得し、宿主の脂肪貯蔵を増加させることにより、肥満と代謝性疾患に寄与しました。 |
| II )LPSを介した炎症経路または代謝性内毒素血症は、炎症誘発性サイトカインに依存するMMPの発現を阻害することで関節軟骨を保護できるインスリン分泌の調節に影響を与えることにより、肥満とインスリン抵抗性に寄与しました。 |
| SCFA、短鎖脂肪酸; GPCR、Gタンパク質共役型受容体; FIAF、空腹時誘発脂肪因子; FXR、ファルネソイドX受容体; AMPK、アデノシン一リン酸活性化プロテインキナーゼ; LPS、リポ多糖; TNF、腫瘍壊死因子; MMP、マトリックスメタロプロテイナーゼ。 |
| 食事に関連する要因の代謝 |
| 遊離脂肪酸(FFA)は、変形性関節症の病態生理において重要な役割を果たすことが示されています。 Wu et al(2017)は、肥満関連変形性関節症を予測することが期待される血清および滑液のリピドミックプロファイルが、肥満関連変形性関節症のX線撮影段階の高感度バイオマーカーとして機能する可能性があることを示しました。 ミリスチン酸、オレイン酸、ラノステロールなどの滑液中の遊離脂肪酸の代謝に関連する代謝物は、変形性関節症の構造的劣化と正の相関があることがいくつかの研究で示唆されています(Kim et al.,2017) 総脂肪酸、特にアラキドン酸は、軟骨表面の侵食の重症度と密接に関連していた(Lippiello et al。、1991)。異所性脂質が変形性関節症患者の関節軟骨に蓄積し(Lippiello et al.,1991)、マクロファージや脂肪細胞を含む滑膜組織内の主要細胞の脂質異常症によって引き起こされる脂肪毒性作用が、変形性関節症およびメタボリックシンドローム(Larrañaga-Veraetal.,2017)患者の滑膜炎を悪化させることも観察されました。 さらに、Lee et al(2018)と彼の同僚は、病理学的濃度のオレイン酸が、アポトーシスを介して関節軟骨細胞の生存率を低下させ、軟骨細胞における遊離脂肪酸誘発性脂肪毒性効果が、脂肪滴に最初に隔離された細胞遊離脂肪酸の量と相関することも示しました。 不均衡な腸内細菌叢が、肝臓での遊離脂肪酸合成と遊離脂肪酸輸送に関連する重要な遺伝子の発現の有意な増加(Jin et al。、2016)および特定の腸内細菌叢の特徴、特にアッケルマンシアと乳酸桿菌は、血清遊離脂肪酸プロファイルの変化に関連していることが発見されました(Rodríguez-Carrioetal.,2017)。したがって、腸内細菌叢は、遊離脂肪酸の代謝に影響を与えることにより、変形性関節症の病態生理に間接的な影響を与える可能性がありますが、特定の経路をさらに調査する必要があります。 |
| 飽和脂肪酸、多価不飽和脂肪酸(PUFA)、抗酸化物質、アミノ酸など、さまざまな食事要因が変形性関節症の病態生理に関与していることが報告されています(Li et al.,2016c; Sekar et al.,2017; Thomas et al.,2018)。 飽和脂肪酸は、変形性関節症の病因に毒性作用を及ぼすことが実証されており(Sekar et al.,2017)、Baker et al(2012)は、関節軟骨の組成と構造的損傷に関連している可能性がある食事によって制御されるn-3およびn-6多価不飽和脂肪酸の全身レベルを示唆しています。 ビタミンC、D、Kなどの食事の抗酸化物質は、コラーゲン形成、骨代謝、軟骨の石灰化を調節することにより、多価不飽和脂肪酸の進行を防ぐ可能性があることが示されています(Thomas et al.,2018)。 芳香族アミノ酸(チロシン、トリプトファン、フェニルアラニン)の一部の腸内微生物代謝物も、宿主のシグナル伝達経路と相互作用し、宿主の変形性関節症の開発を加速する可能性がある免疫に影響を与えると考えられていました(Ramadoss et al.,2005; Venkatesh et al.,2014; Boulange et al.,2016 )。 重要なことに、腸内微生物群集の構造と機能は食事と密接に関連しています(Wang et al.,2015; Velasquez,2018)。 Schott et al(2018)は、プレバイオティクス繊維の補給が、多種多様な炎症誘発性微生物を犠牲にして有益なビフィズス菌の量を増やすことにより、腸内細菌叢に対する脂肪強化(特に飽和脂肪酸)食の有害な影響を逆転させることができることを示しました。 Kaliannan et al(2015)は、高n-3および高n-6多価不飽和脂肪酸食餌が互いに拮抗的に、マウスモデルの炎症誘発性細菌と抗炎症性細菌の比率に影響を与えることを発見しました。 これはまた、組織のn-3 /n-6多価不飽和脂肪酸比が腸内細菌叢のプロファイル組成と腸透過性を変化させることを示唆しました。 さらに、いくつかの研究は、高および低ビタミンD食が炎症誘発性細菌、特にバクテロイデス門の割合に影響を及ぼしたことを報告しました(Ooi et al.,2013; Assa et al.,2014; Ghaly et al.,2018)、 これは、ビタミンDが腸内細菌叢の多様性を変化させることを示しました。さらに、食事によるグルタミンの補給は、腸内細菌叢の組成と代謝を調節し、Firmicutes / Bacteroidetes比の変化をもたらす可能性があります(Ren et al.,2014b)。 トリプトファン由来の腸内微生物代謝産物であるインドール-3-プロピオネート(Russell et al.,2013)は、接合タンパク質の発現をアップレギュレートし、TNF-α産生をダウンレギュレートすることで腸のバリア透過性を改善することもわかっています(Venkatesh et al.,2014) 、これは間接的に抗原と病原体の移動を制限し、腸内細菌叢の安定性を維持しました。 さらに、多くの食品に含まれる必須栄養素であるコリンとカルニチンは、トリメチルアミンリアーゼシステム(CutC / D)、腸内細菌叢のカルニチンRieske型オキシゲナーゼ/レダクターゼシステム(CntA/BおよびYeaW/X)(Koeth et al.,2019)およびその後の肝臓のフラビン含有モノオキシゲナーゼ(Canyelles et al.,2018)によってトリメチルアミン-N-オキシド(TMAO)に代謝される可能性があります。 トリメチルアミン-N-オキシドは、TNF-αおよびIL-1βレベルを増加させ、抗炎症因子IL-10レベルを減少させる可能性があり(Ufnal et al.,2014)、酸化ストレスを有意に誘発する可能性があることが示されています(Sun et al., 2016) これは、変形性関節症の病因において極めて重要な役割を果たし(Paździoretal.,2019)、それを通じてトリメチルアミン-N-オキシドが変形性関節症の病理学的変化に関与している可能性があります。 特に、変形性関節症で広く使用されている症候性の遅効性薬物であるコンドロイチン硫酸は、プレバイオティクス特性を持っている可能性があり(Rani et al.,2019)、バクテロイデスなどの腸内細菌叢の組成を調節することができます(Shmagel et al.,2019)。 腸内細菌叢の組成は、A.muciniphilaなどの特定の共生プロバイオティクスの存在において(Wang et al.,2017)、結腸粘液バリアの破壊または強化を介した変形性関節症の悪化または改善に対するコンドロイチン硫酸の炎症誘発性および抗炎症性活性に影響を与えることにより、変形性関節症に対するコンドロイチン硫酸の効果に影響を及ぼしました。 |
| 骨代謝 |
| 興味深いことに、高骨塩密度(BMD)と変形性関節症の関係は、横断的および縦断的疫学研究によって一貫して実証されており、高骨塩密度の増加が変形性関節症の危険因子であることを示唆しています(Hardcastle et al.,2015)。 一部の研究の結果は物議を醸し、矛盾していますが、骨のサイズの違いなどの交絡因子が原因である可能性があり(Javaid and Arden,2013)、高骨塩密度と変形性関節症の関係を混乱させる可能性があります。 高骨塩密度と変形性関節症の関係の根底にあるいくつかの潜在的なメカニズムが提案されたメカニズムです。 骨量の多い人は「骨形成」の傾向を示し、変形性関節症のリスクを高めると推測されています(Hardcastle et al.,2014; Hardcastle et al.,2015)。 さらに、軟骨喪失における軟骨下骨の役割に焦点を当てたいくつかの研究では、ほとんどの変形性関節症の特徴であり、変形性関節症関節の骨と軟骨の界面での軟骨内骨化の再活性化による、下からの関節軟骨の減衰が報告されており、これは、タイドマークの重複と進行につながります(Lories and Luyten,2011; Burr and Gallant,2012)。これは変形性関節症行列を駆動する骨形成を増加させる重要なメカニズムである可能性があります。 また、骨から放出される可溶性メディエーターは、標準的なWnt/β-カテニンシグナル伝達経路を含む潜在的なシグナル伝達経路を介して関節軟骨で役割を果たす可能性があります。トランスフォーミング成長因子β(TGFβ)-骨形成タンパク質(BMP)シグナル伝達経路(Lories and Luyten,2011)は、変形性関節症の進行に影響を与える骨形成の別のメカニズムを提供します。 さらに、遺伝的多面発現は、高骨塩密度と変形性関節症の関係を説明するための重要なメカニズムである可能性があります(Spector and MacGregor,2004; Estrada et al.,2012; Yerges-Armstrong et al.,2014)。 高骨塩密度の変動は、いくつかの変形性関節症感受性遺伝子に関連していることが示されており、その機能アノテーションは、骨格の発達や形態形成、骨芽細胞の発達/分化などの骨中心の経路に関与しています(Reynard and Loughlin,2013)。 高骨塩密度と変形性関節症の両方に関連する遺伝的変異である遺伝的多面発現は、媒介多面発現を介して変形性関節症のリスクを変化させる可能性があります(Davey Smith and Hemani,2014)-高骨塩密度自体または生物学的多面発現の増加(Davey Smith and Hemani、2014) 高骨塩密度遺伝子は、関節の形状や軟骨の厚さなどの他の表現型に影響を与えることにより、変形性関節症を発症するリスクを高めます(Baker-LePain and Lane,2010)。 重要なことに、腸内細菌叢は、複数のメカニズムを通じて骨格組織に影響を及ぼします。 Guss et al(2017)は、成長中の腸内細菌叢の変化が骨の強度を損ない、骨組織の機械的特性に影響を与えたと結論付けました。また、腸内細菌叢は、栄養素の吸収とカロリー摂取に影響を与えることにより、骨代謝に直接的または間接的な影響を及ぼし(Hernandez et al.,2016)、腸内細菌叢の変化は、骨の成長と発達に独立して寄与することが示されています(Blanton et al.,2016 ; Schwarzer et al.,2016)。腸内細菌叢は、ビタミンの代謝(Yatsunenko et al.,2012)と性ホルモンの状態(Li et al.,2016a)、およびカルシウムの吸収(Yan et al。、2016)に影響を与えることにより、骨量に影響を与えます。 Sjögren et al(2012)は、破骨細胞の分化が骨格の成長中に腸内細菌叢によって制御されることを示しました。長期的には、酢酸塩、酪酸塩、プロピオン酸塩を含む短鎖脂肪酸混合物は、血清および骨髄中のインスリン成長因子-1(IGF-1)のレベルを上昇させることもわかっています。これは、骨組織への同化作用と一致します( Yan et al.,2016)。上記の証拠は、骨組織に対する腸内細菌叢の同化作用を示唆しています。さらに、異常な状態では、免疫系が高骨塩密度の制御の中核になります(Ibanez et al.,2019)。たとえば、骨髄の間葉系細胞、骨芽細胞、骨細胞、および活性化CD4 + T細胞によって産生されるNF-κBリガンドの受容体活性化因子(RANKL)は、破骨細胞の分化に関与する主要なサイトカインです(Ibanez et al., 2019)。 IL-17およびTNF-αも破骨細胞形成を刺激する可能性があります(Kotake et al.,1999; Lam et al.,、2000)。 Ohlsson et al(2017)は、腸内細菌叢がヌクレオチド結合オリゴマー化ドメイン様受容体(NOD)1およびヌクレオチド結合オリゴマー化ドメイン様受容体(NOD)2シグナル伝達経路を介して骨量に有意な影響を与えることを示しました。骨器官に分布する微生物関連分子パターン(MAMP)は、 トール様受容体2(Takami et al.,2002)、トール様受容体4(Itoh et al.,2003)、トール様受容体5などの骨細胞の自然免疫受容体の刺激を通じて骨リモデリングに直接影響を与えることが知られています(Kassem et al.,2015)。 まとめると、腸内細菌叢は、骨組織、特に骨の同化作用に影響を与えることにより、変形性関節症の発生と進行に影響を与える可能性があります(図7)。しかし、この潜在的な経路は私たちが確認するのを待っています。 |
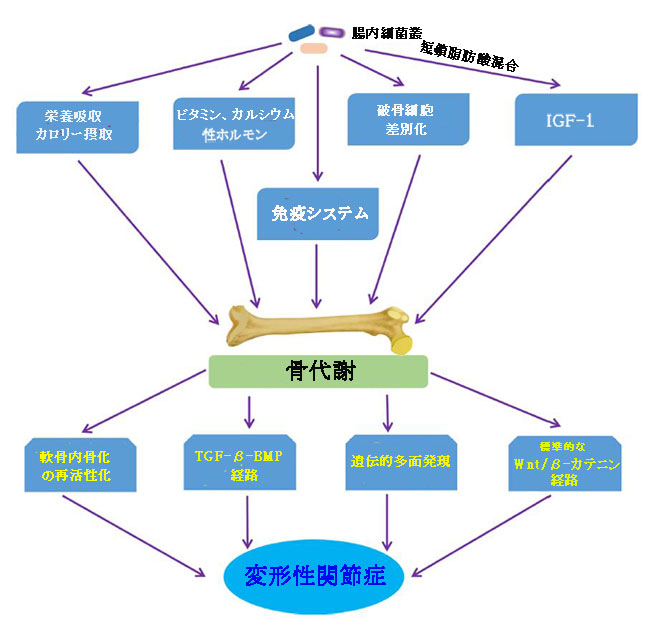 |
| 図7 骨代謝に影響を与える変形性関節症に対する腸内細菌叢の影響の経路 |
| SCFA混合物、酢酸塩、酪酸塩およびプロピオン酸塩を含む短鎖脂肪酸混合物; IGF-1、インスリン成長因子-1; TGF-β-BMP経路、トランスフォーミング成長因子β-骨形成タンパク質シグナル伝達経路。 |
腸内細菌叢-腸-脳軸は、変形性関節症の発症に関与する潜在的な経路です |
| 脳-腸相関は、脳と腸の機能を統合した双方向の情報通信システムです。中枢神経系(CNS)、腸管神経系、および脳腸軸を具体化する胃腸管の間の双方向の相互作用は、多くの疾患の開始と進行に関与しています。いくつかの最近の証拠は、脳腸軸が変形性関節症の発症に関与していることを示唆しています。中枢神経系は、変形性関節症の痛みとリハビリテーションへの影響に関与することが知られています(Murphy et al.,2012)。神経生理学の発達に伴い、身体の中枢神経系と末梢回路の不均衡が変形性関節症の進行に関与していることが知られています(Dobson et al.,2018)。さらに、変形性関節症病態生理学における中枢神経系理論は徐々に洗練されており、その新しい構成要素には、視床下部-下垂体軸、孤束核、視床下部視交叉上核およびその他の関連する高次中心が含まれます。各センターには、腸管(腸内細菌叢)、変形性関節症関節、細胞代謝からのフィードバック回路があります。概日リズム、腸内細菌叢、代謝および酸化還元調節は、上記の中央供給回路によって制御されており、その調節不全は変形性関節症の進行に関与しています(Morris et al.,2019)。さらに、腸管から伝達されたいくつかの情報は視床下部に分配され、食欲、食物摂取、およびエネルギー消費を調節することができます(Silvestre et al.,2020)、 これは、前のパートで述べた代謝のメカニズムを通じて変形性関節症の進行に関与します。 特に、脳と腸の間の双方向通信は腸内細菌叢の影響を大きく受けているため(Caputi and Giron,2018)、微生物叢-腸-脳軸の概念が生まれています。 まとめると、中枢神経系は交感神経系と副交感神経系を介して胃腸管と腸管神経系を調節し、腸内細菌叢は神経経路、特に迷走神経と視床下部-下垂体軸、腸内細菌叢によって刺激された腸内分泌細胞によって産生されるいくつかの神経ペプチド、免疫系、細菌の神経伝達物質、特にセロトニン[5-ヒドロキシトリプタミン(5-HT)]やトリプトファン代謝など(Tillisch,2014; Mayer et al., 2015; Foster et al.,2017)腸内分泌シグナル伝達経路を介して中枢神経系機能に影響を与えます。 また、短鎖脂肪酸は、脳腸軸に関与することにより、変形性関節症関連の痛みの調節に寄与する可能性があります(Russo et al.,2018)。疼痛感作は変形性関節症の慢性疼痛の特徴であり、脊髄後角のミクログリアの活動亢進は、変形性関節症の中枢レベルでの疼痛感作のメカニズムの根底にある(Pan et al.,2021)。 また、Appletonのレビューは、ミクログリオーシス(ミクログリアの活性化)が変形性関節症の疼痛感作の治療標的である可能性があることを示唆しています(Appleton,2017年)。特に、必須の腸内細菌叢由来の短鎖脂肪酸である酢酸塩は、ミクログリアの成熟を促進し、健康と摂動の間に恒常性代謝状態を調節します(Erny et al.,2021)。さらに、Liang et alがいくつかの糞便細菌の概日リズムを発見したことを考えると、腸内細菌叢は宿主の概日時計と相互作用して軟骨の恒常性を調節する可能性があります(Leone et al.,2015; Liang et al.,2015)。まとめると、微生物叢-腸-脳軸は変形性関節症に関与する潜在的な経路であり、腸内細菌叢を標的とすることによって腸-脳軸のバランスを回復することは、変形性関節症の状態の改善に寄与する可能性があります(図8)。 |
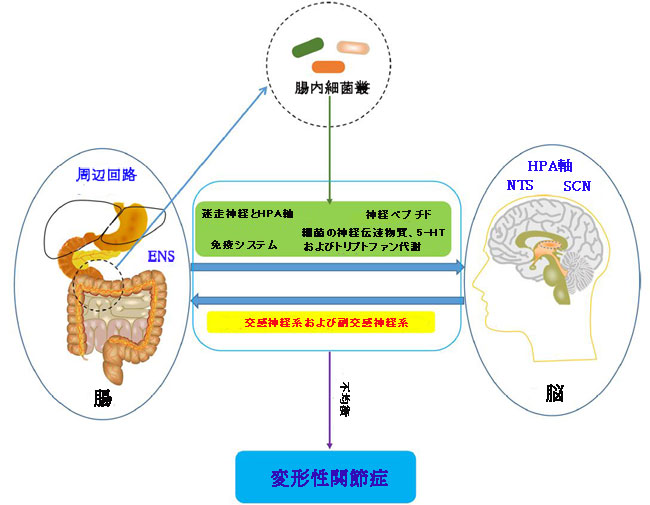 |
| 図8 変形性関節症における腸内細菌叢-腸-脳軸の潜在的な役割 |
| ENS、腸管神経系; HPA軸、視床下部-下垂体軸; NTS、孤束核; SCN、視床下部視交叉上核。 |
腸内細菌叢の調節:変形性関節症の新しい治療法 |
| 変形性関節症は慢性的な衰弱性疾患であり、患者の生活の質に深刻な影響を及ぼします。しかし、疾患修飾性変形性関節症薬(DMOAD)の進行が遅いことを考えると、現在、変形性関節症の唯一受け入れられ利用可能な臨床治療法は緩和ケアです。つまり、症状の緩和が唯一の選択肢です(Ghouri and Conaghan、 2019)。特に、変形性関節症の発症には多くの要因が関与していますが、腸内細菌は変形性関節症の開始と進行の重要な病原因子と見なされており、腸内細菌が変形性関節症に関与するメカニズムは徐々に解明されています。さらに、腸筋軸が炎症性腸疾患のサルコペニアの管理に重要な役割を果たしていることを見て、Nardone et al(2021)は、腸内細菌叢を標的とした治療または補完療法が炎症性腸疾患およびサルコペニアの患者に実施できると仮定しました。したがって、腸内細菌叢の調節は、変形性関節症の新しい治療法として提案することもできます。幸いなことに、腸内細菌叢を調節して変形性関節症を変化させることができるいくつかの要因が報告されています。 |
| プロバイオティクスとプレバイオティクス |
| プロバイオティクスとプレバイオティクスは、安全で効果的な食事物質であり、有益な細菌の増殖を直接的または間接的に促進することにより、宿主の腸内細菌叢を調節することができます(Dahiya et al.,2017)。 Henrotin et al(2019)は、Bifidobacterium longum CBi0703を12週間にわたって経口投与すると、軟骨構造の病変が減少し、II型コラーゲンの分解が減少することを示しました。これは、変形性関節症の発症に対する潜在的な予防効果を示唆しています。 Jhun et al(2021)はまた、Lactobacillus rhamnosusの経口投与が、関節の痛みと炎症を抑制することによって変形性関節症の進行を改善することを示唆しました。 Lei et al(2017)は、ランダム化二重盲検臨床試験において、Lactobacillus casei Shirotaが変形性膝関節症の治療に有益な効果をもたらしたことを示しました。 So et al(2011)は、Lactobacillus caseiが、痛み、炎症反応、関節軟骨の劣化を軽減することにより、変形性関節症治療の強力な栄養補助食品モジュレーターとして機能する可能性があることを示しました。 また、II型コラーゲン/グルコサミンを含むラクトバチルスカゼイは、炎症誘発性サイトカインとマトリックスメタロプロテイナーゼの発現を減少させ、抗炎症性サイトカインをアップレギュレートすることにより、変形性関節症の炎症を相乗的に有意に阻害することも発見しました。 Korotkyi et al(2019)は、プロバイオティクスが、軟骨組織の修復の根底にある関節軟骨タンパク質をコードする主要な遺伝子であるII型コラーゲン線維アルファ1の発現をアップレギュレートしたことを報告しました。Arora et al(2021)プロバイオティクスが変形性関節症の症状(痛み)を軽減するためにそして/または病理学的進行(関節変性)を遅らせるために利用できることができることを示しました。 Arora et alのレビューでは、プロバイオティクスが血清C反応性タンパク質(CRP)レベルの低下、酸化ストレスの低下、および炎症性サイトカインやマトリックスメタロプロテイナーゼ(Arora et al.,2021)など変形性関節症における炎症マーカーの調節、血管内皮増殖因子シグナル伝達の阻害を介して変形性関節症の主要な効果シグナル伝達経路において重要な役割を果たしていることもプロファイルされました。 さらに、動物実験からのいくつかの証拠は、プレバイオティクスが腸内細菌叢を改変することによって変形性関節症状態を改善したことを示しました。 Rios et al(2019)は、プレバイオティクスオリゴフルクトースがラットの膝関節に対する高脂肪/高スクロース食の摂取の悪影響を逆転させ、膝関節の損傷、微生物性腸内毒素症、エンドトキシンレベルおよびインスリン抵抗性を有意に減少させることを示しました。 Schott et al(2018)はまた、プレバイオティクスオリゴフルクトースが腸内細菌叢に対する高脂肪食誘発性肥満の有害な影響を逆転させ、関与する多数の微生物を犠牲にして有益なビフィズス菌の存在量を増加させたことを示しました 。炎症誘発性として、一方で代謝性炎症の軽減を誘発し、関節軟骨変性から変形性関節症を有するマウスの関節を保護します。 まとめると、プロバイオティクスとプレバイオティクス治療は、変形性関節症患者の生活の質を改善する効果的な方法です。 |
| 食事と栄養補助食品 |
| 食事は腸内細菌叢に影響を与える重要な要因として作用することが知られています。食事中の栄養素は、腸内細菌叢の組成や代謝、宿主の免疫応答など、腸内細菌叢の微小環境を変化させることにより、腸内細菌叢を調節する可能性があります(Li et al.,2016b)。たとえば、L-アルギニン(Ren et al.,2014a)またはL-グルタミン(Ren et al.,2014b)は、Firmicutes / Bacteroidetesの比率など、腸内細菌叢に大きな影響を与えることが示されています。グルタミンは、腸内細菌叢に対するグルタミンの効果に依存する免疫経路を介して、マウス腸分泌型IgA(SIgA)産生とIgA +形質細胞数を促進しました(Wu et al.,2016)。キトサンは、腸内細菌叢への影響を通じてマウスの体重を減らすことが報告されています(Xiao et al.,2016)。レスベラトロールの経口補給は、軟骨における関節構造とII型コラーゲン発現の回復、および軟骨細胞アポトーシスの阻害を通じて、高脂肪食誘発性変形性関節症マウスモデルの関節に対する有意な保護効果も示しています(Gu et al.,2016)、これはおそらく腸内細菌叢の変化に関与しています。さらに、グリーンリップドムール貝抽出物(Perna canaliculus)とグルコサミン硫酸塩は両方とも、腸内細菌叢の組成への影響を通じて変形性関節症の症状を改善することが実証されています(Coulson et al.,2013)。 変形性関節症の症状を改善するために広く使用されている栄養補助食品であるコンドロイチン硫酸二糖類は、健康でストレスのある条件下でマウスの腸内細菌叢の構造と機能を変更することによって抗炎症効果を発揮することが示されています(Liu et al.,2017) 。さらに、松樹皮からの独自の抽出物であるピクノジェノールは、腸内細菌叢によって代謝された後、抗炎症、抗酸化、および軟骨保護効果を通じて変形性関節症の症状を緩和することが報告されました(Rohdewald,2018)。まとめると、腸内細菌叢に影響を与える可能性のある食事要因と栄養補助食品を引き続き調査し、変形性関節症の新しくて素晴らしい治療法を見つける必要があります。 |
| 運動 |
| 運動は健康に有益であることが広く知られています。運動は酪酸産生菌を増強し、炎症を軽減し、細胞増殖を促進します(Matsumoto et al.,2008)。高脂肪食が存在するにもかかわらず、運動は腸の形態と完全性を保護し、全身性炎症を軽減することができます。これは、運動が食事とは無関係に独特の腸内細菌叢を示すことを示唆しています(Campbell et al.,2016)。 いくつかの研究は、運動が 腸の通過時間を短縮しCerda et al.,2016)、腸のIgAレベルの上昇を誘発し(Viloria et al.,2011; acpherson et al.,2015)、胆汁酸の分布を変える(Cerda et al.,2016)など、腸粘膜免疫を強化し(Cerda et al.,2016)、Bacteroides/Firmicutesの割合を増やし(Evans et al.,2014)、運動が健康に及ぼす影響の潜在的なメカニズムである短鎖脂肪酸の産生を増加(Evans et al.,2014; Hsu et al.,2015)することにより、腸内細菌叢の組成を調節できることを示しています(Monda et al.,2017) さらに、ラクトバチルスやビフィズス菌など、運動によって積極的に調節できるいくつかの特定のマイクロバイオータ分類群(Yin and Niu,2010; Petriz et al.,2014)は、前述のように、変形性関節症の治療に潜在的な価値があります。 その結果、運動は有益な微生物種の数を増やし、腸内微生物群集の多様性を豊かにし、私たちの健康に貢献することができます。さらに、de Sire et al(2020)が腸関節軸の仮説を支持するいくつかの証拠をレビューした後、彼らは、栄養補助食品の介入と組み合わせた身体運動が腸内細菌叢の調節に重要な役割を果たし、変形性関節症の補助療法と見なすことができることを示しました。 特に、de Sire et al(2021)は、アポトーシス、炎症誘発性、または抗炎症性シグナル伝達のための変形性関節症の分子経路における身体運動と栄養補助食品の関与を要約することにより、変形性関節症に対抗するための身体運動と栄養補助食品介入の相乗効果を示唆しました。ただし、腸内細菌叢の組成と機能、および関連するすべての影響、特に変形性関節症への影響における、運動による運動と運動の組み合わせ、およびその他の介入による変化のメカニズムをさらに研究する必要があります。 |
| 糞便微生物叢移植 |
| 糞便微生物移植(FMT)は、健康なドナーからレシピエントの遠位消化管に糞便を移すことにより、腸内細菌叢に関連する疾患を治療するために設計された手術です(Cammarota et a.,2017)。糞便微生物移植が実施され、Clostridium difficile感染症の治癒に成功したことは有望です(Hamilton et al.,2012)。 研究はまた、糞便微生物移植が胃腸疾患、肝臓疾患、感染症、神経系疾患、および癌の治療に役割を果たしていることを確認しています(Chen et al.,2019; Vaughn et al.,2019; Vendrik et al.,2020 ; Chauhan et al.,2021; Revolinski and Munoz-Price,2021)。 重要なことに、Huang et al(2020)の研究は、さまざまなグループの人々の腸内細菌叢が、無菌マウスの関節損傷誘発性変形性関節症の病理学的プロセスを変化させる可能性があることを示しました。これは、変形性関節症の治療における糞便微生物移植の適用に明るい未来をもたらします。 腸内細菌叢に対する糞便微生物移植の直接的な効果と、糞便微生物移植の優れた可能性を考えると、糞便微生物移植による変形性関節症の治療が可能です。しかし、この分野に関連する研究はほとんどないため、糞便微生物移植による変形性関節症の治療の実現可能性を検証するために広く研究を実施する必要があります。一方、ドナーの特定とスクリーニングのコスト、材料の準備の標準化、糞便微生物移植の適応症、宿主の免疫拒絶反応などの課題に対処する必要があります。 |
制限事項 |
| これまで、上記のこれらの証拠にもかかわらず、腸内細菌叢と変形性関節症の間の因果関係は確立されておらず、変形性関節症における腸内細菌叢の特定の役割はまだ詳細に理解されていません。変形性関節症における腸内細菌叢の役割に関する直接的な臨床データはほとんどなく、腸内細菌叢と変形性関節症を結び付ける証拠のほとんどは、主に動物モデル実験から得られたものです。 さらに、私たちのレビューで引用された研究によって提供された中品質および高品質のエビデンスが主にあります。 |
結論と将来の展望 |
| 治療が難しい変形性関節症は世界的な公衆衛生問題であり、その発生率と障害率はどちらも高い。結果として、変形性関節症の病因の潜在的なメカニズムを明らかにすることは、疾患の予防と治療の新しい手段の開発に重要な意味を持っています。このレビューでは、変形性関節症の開始と進行における腸内細菌叢の関与のメカニズム、および変形性関節症の治療における腸内細菌叢の調節の可能性を要約しました(図9)。ただし、対応する研究の体系的な検索、スクリーニング、および選択プロセスがないため、変形性関節症における腸内細菌叢の関与のいくつかのメカニズムは無視される可能性があります。 |
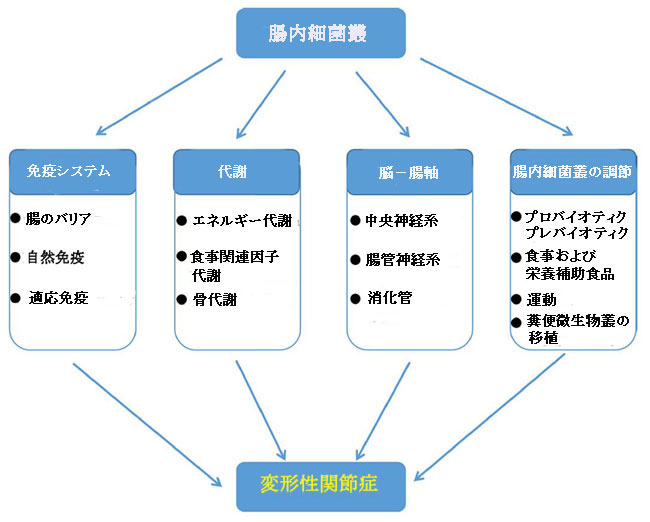 |
| 図9 変形性関節症の開始と進行における腸内細菌叢の役割 |
| さらに、腸内細菌叢による変形性関節症の治療の確固たる理論的基礎を提供するために、腸内細菌叢と変形性関節症との関連の潜在的なメカニズムをさらに調査する必要があり、潜在的な共有経路と腸内細菌叢の調節におけるプロバイオティクス、食事療法、栄養補助食品および運動の間の相乗効果を理解するためにさらなる研究が必要です。 近年、次世代シーケンシング、トランスクリプトミクス、メタボロミクスの活発な開発により、腸内細菌叢の組成、細菌の多様性、および変形性関節症患者の細菌遺伝子と代謝経路の変化を調査することがより効率的かつ信頼できるものになりました。変形性関節症の腸内毒素症に関連するバイオマーカー、および腸内細菌叢を標的とすることによって変形性関節症を治療することを可能にする、変形性関節症の病因に関与する特定の病原体および対応するシグナル伝達経路を発見することは有望です。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Front Cell Infect Microbiol. 2022; 12: 812596.に掲載されたAssociation Between Gut Microbiota and Osteoarthritis: A Review of Evidence for Potential Mechanisms and Therapeutics.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


