ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(アロニア:研究の最前線) |
ポリフェノールが豊富なアロニア メラノカルパ果実は、 コレステロール、グルコース、血清、腸の代謝物に有益な影響を与える: 無作為化臨床試験 |
Morgan L. Chamberlin et al., |
|
|
| 要約 |
ポリフェノールが豊富なアロニア果実は、抗炎症、脂質低下、血糖低下の生物学的活性を持つ機能性食品として大きな可能性を秘めています。しかし、アロニア果実の摂取が人間の健康に与える影響を調査する臨床介入試験は限られています。14人の被験者を対象に、30日間毎日0mLまたは100mLのアロニアジュースを摂取してもらい、ランダム化、対照、二重盲検、並行介入試験を実施しました。介入期間の前後に、人体計測値、空腹時および食後のグルコースおよび脂質代謝と炎症の測定値、16S rRNA糞便微生物組成データ、および質量分析法で取得した血清および糞便メタボロームデータを収集しました。データは、一般線形モデル、分散分析、およびt検定を使用して分析されました。アロニアを毎日摂取すると、コレステロール値の上昇が予防され(β = −0.50、p = 0.03)、食後グルコースが減少しました(β = −3.03、p < 0.01)。状態による微生物群集構成の差はどの分類レベルでも確認されなかったが、アロニアでは微生物の豊富さの減少(β = −18.2、p = 0.04)が検出された。血清および糞便のメタボロームプロファイルは、中心炭素および脂質代謝に関連する変化と炎症誘発性代謝物の減少を示した。私たちの研究は、代謝性疾患のリスクを下げるためのポリフェノールベースの食事戦略の開発にさらに役立つ。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 材料と方法 |
| 2.1. 倫理声明 |
| 2.2. 研究対象者 |
| 2.3. 研究デザイン |
| 2.4. 人体測定 |
| 2.5. ランダム化 |
| 2.6. 介入 |
| 2.7. アロニアジュースの標的液体クロマトグラフィー質量分析および核磁気共鳴分析 |
| 2.8. 習慣的な食事の評価 |
| 2.9. 高脂肪食チャレンジ |
| 2.10. 血液サンプル採取 |
| 2.11. 血液マーカーの分析 |
| 2.12. 炎症バイオマーカーの分析 |
| 2.13. 便の採取 |
| 2.14. ゲノム DNA 抽出と微生物分析 |
| 2.15. 血清代謝物の抽出 |
| 2.16. 糞便代謝物の抽出 |
| 2.17. 糞便および血清抽出物の超高性能液体クロマトグラフィーメタボロミクス分析 |
| 2.18. 統計手法 |
| 2.18.1. 検出力分析 |
| 2.18.2. 人体計測値、血液マーカー、炎症バイオマーカー |
| 2.18.3. 糞便微生物統計分析 |
| 2.18.4. メタボロミクス統計分析 |
| 3. 結果 |
| 3.1. 参加者の一般的な特徴 |
| 3.2. 人体計測値 |
| 3.3. 習慣的食事分析 |
| 3.4. 空腹時および食後脂質および血糖測定 |
| 3.5. 断食と食後炎症 |
| 3.6. 糞便微生物のアルファおよびベータ多様性 |
| 3.7. 微生物分類群の差異 |
| 3.8. 血清メタボロミクス |
| 3.9. 糞便メタボロミクス |
| 4. 考察 |
| 5. 結論 |
本文 |
| 1.はじめに |
| 心血管疾患や2型糖尿病などの非感染性慢性疾患は、世界的に罹患率と死亡率の最も高い要因の1つです[1]。低レベルの炎症[2]、酸化ストレスによる細胞損傷[3,4]、インスリン抵抗性[5]、炭水化物と脂質の代謝障害[6]は、これらの疾患の発症に寄与しています。ポリフェノールは、さまざまな食品に含まれる食事性生理活性化合物で、炎症誘発性細胞メディエーターや活性酸素種および活性窒素種の活性化を防ぎ[7,8,9,10]、抗酸化酵素濃度を調節することで抗炎症および抗酸化作用を発揮します[7]。ポリフェノールは、血圧や脂質プロファイルなどの全身マーカーを改善することもできるため[11]、慢性疾患の進行を抑える食事戦略としてポリフェノールを豊富に含む食品の摂取に関心が集まっています。 |
| アロニア メラノカルパ(別名チョークベリー)は、耐寒性のある低木で、食物ポリフェノールを豊富に含む果実をつけます。アロニア果実は、主にアントシアニン、プロシアニジン、ヒドロキシ桂皮酸に由来するポリフェノールが最も豊富で、クロマトグラフィー法で測定したところ、100 gあたり1756 mgの含有量でした[12]。アロニア果実のポリフェノール含有量が高いため、抗酸化作用が高く、エルダーベリー(100 gあたり1752 mg)に次いで2番目に高い果物です[12]。ポリフェノールが豊富なアロニア果実は、健康を促進する可能性があることから、機能性食品とみなされています。この認識により、サプリメント、ジュース、ジャム、お茶など、アロニアベースの製品が広く商業的に生産されるようになりました。しかし、アロニア果実の摂取による代謝上の利点を調べたヒト研究は限られており、その結果は矛盾しており、炎症や脂質およびグルコース代謝の指標が改善したとする研究もあれば、効果がないと報告している研究もある[13,14,15,16,17,18]。これらの矛盾した結果は、用量、期間、または投与方法によるものである可能性があります。代謝の健康状態の違いも、研究結果の大きなばらつきに寄与している可能性があります。 |
| 宿主の腸内微生物群集の多様性も、相反する研究結果の一因となっている可能性がある。ポリフェノールのバイオアベイラビリティは、化合物の物理化学的性質によって部分的に影響を受けるが、ポリフェノールのバイオエフィカシーは腸内微生物叢によって媒介される可能性が高い [19,20,21,22]。一部のポリフェノールは小腸で吸収されるが、ほとんどは大腸に移行して微生物酵素の作用を受ける。腸内細菌はポリフェノールをフェノール代謝物に代謝することができる [23,24]。微生物が生成したフェノール誘導体のバイオアベイラビリティとバイオエフィカシーは、親化合物を上回ることが多い [24,25,26,27]。さらに、ポリフェノールの摂取は抗菌性およびプレバイオティクスのような方法で微生物叢の構成を変化させる可能性があることを示す証拠がある [28]。これは腸内メタボローム [22] および宿主の食後反応 [29] に影響を及ぼす可能性がある。したがって、微生物の豊富さと腸由来の代謝物の変化は、ポリフェノール関連の健康上の利点を達成するための追加の作用メカニズムを表しています[19]。しかし、アロニアの摂取が成人の腸内微生物叢に及ぼす影響を調査した研究は不足しています。 |
| さらに、代謝の健康と疾患リスクに関連した食後代謝の重要性は十分に確立されているが[30,31,32,33,34]、これらの指標は非急性ポリフェノール介入研究では一貫して分析されていない。ポリフェノールを豊富に含む食品が食後代謝と糞便微生物群集にどのように影響するかを調査する臨床試験は、健康に有益な影響を与える有効性を正確に評価するために必要である。そこで私たちは、健康な成人を対象に30日間の臨床介入試験を実施し、アロニア果汁摂取が宿主の代謝、糞便微生物組成、宿主と微生物の代謝プロファイルに与える影響を評価した。私たちの研究戦略は、小さな健康な個人コホートにおけるアロニアの影響を包括的に分析する実現可能性調査を実施し、さらなる調査のための確実な影響を特定することだった。この探索的調査では、長期にわたるアロニア摂取に対する空腹時および食後の脂質、血糖、炎症反応、および 16S rRNA 配列解析と血清および腸内代謝物による微生物分類の変化を評価しました。アロニア摂取により全身代謝マーカーが改善され、腸内微生物組成および/または微生物代謝が変化するという仮説を立てました。 |
| 2. 材料と方法 |
| 2.1. 倫理声明 |
| このプロトコルは、モンタナ州立大学の機関審査委員会 (MC010819) によって承認されました。インフォームドコンセントの口頭によるレビューは対面で行われ、質問や説明のための時間も設けられました。参加者全員が参加前に書面によるインフォームドコンセントを完了しました。この研究は、2022 年 2 月に ClinicalTrials.gov (NCT05255718) に遡及的に登録されました。 |
| 2.2. 研究対象者 |
| 潜在的な参加者は、2019 年 4 月から 2019 年 9 月まで、チラシ広告、口コミ、メール リスト、スノーボール リクルートメント方式を通じて、モンタナ州ボーズマンで継続的に募集されました。関心のある個人は、メールまたは電話で研究の適格性について審査されました。潜在的な参加者は 18 ~ 55 歳で、慢性疾患の診断、抗炎症薬の定期的な使用、血圧または脂質低下薬の使用、過去 90 日間の抗生物質の使用、小麦、チョークベリー、および/または乳製品に対するアレルギー、または妊娠している場合は除外されました。参加者は、その他の食事、ライフスタイル、または健康歴の基準で除外されませんでした。 |
| 2.3. 研究デザイン |
| この研究は、慢性的なアロニアジュースの摂取の影響を評価するために設計された、二重盲検、ランダム化、プラセボ対照介入試験でした。参加者は、30 日間、1 日あたり 100 ミリリットル (mL) のアロニアジュース (ARO) またはプラセボジュース (PLA) を摂取しました。プラセボはポリフェノール含有量が低く、食品着色料と人工香料を使用して味と色を合わせました。試験は、モンタナ州立大学栄養研究ラボで実施されました。参加者は、ラボで 3 回のデータ収集訪問を完了しました。被験者の同意と人体計測値は、訪問 1 で取得されました。訪問 2 は、参加者が食事からポリフェノール含有量の高い食品を除外するよう求められた 1 週間の食事ウォッシュアウト期間の後に行われました。訪問 2 と 3 では、グルコース、脂質、炎症、およびメタボロミクス分析のために、高脂肪食チャレンジ (バターを塗ったトースト) と食後採血を実施しました。その間に 30 日間の介入期間が設けられました。参加者は、糞便微生物分類と代謝分析のために、自ら採取した便サンプルをこれらの訪問に持参しました。介入期間には 2 日間の期間が組み込まれており、介入期間は 28 日から 32 日間の範囲になる可能性がありました。参加者は、最後の訪問の前日に最後のジュースを飲みました。参加者は、研究期間中、ポリフェノール含有量の高い食品を食事から除外するように指示されました。 |
| 2.4. 人体測定 |
| 参加者の人体測定は、ベースライン時と介入終了後に再度収集されました。被験者は、テスト前の 3 時間は飲食や運動を控えるよう指示されました。参加者の身長は身長計を使用して測定されました。体重 (kg)、脂肪量 (%)、内臓脂肪 (L) を測定するために、検証済みの [35] セグメント多周波生体電気インピーダンス分析 (SECA mBCA 515、Hamburg, Germany) が使用されました。血圧は、高脂肪食チャレンジ前の 2 回目と 3 回目の訪問の朝に、被験者が少なくとも 15 分間着席した後で測定されました。2 回の自動測定が行われ、その平均値が分析に使用されました。 |
| 2.5. ランダム化 |
| ブロックランダム化は、R ブロックランド パッケージ [36] のブロックランド関数を使用して実行されました。2 つのレベルを持つ 3 つのブロックが作成され、各ブロックのシードは、sys.time 関数によって生成された最後の 5 つの整数を使用して作成されました。参加者は、最初の訪問の完了後に、アロニアジュース (ARO) またはプラセボジュース (PLA) グループにランダムに割り当てられました。ランダム化とジュースの準備は、参加者とやり取りしない指定された研究チームメンバーによって実行されました。研究訪問を行う調査員は、治療の割り当てについて知りませんでした。研究終了後、ジュース条件はデータ分析のために盲検化解除されました。 |
| 2.6. 介入 |
| 参加者は、30日間の介入期間中、毎日100mLのアロニアジュースまたはプラセボジュースを飲むよう求められました。この介入用量は、同様のまたはより少ないアントシアニン用量を使用した過去の研究に基づいており、急性摂取では食後脂質と炎症反応が減少し、健康なヒトでは慢性摂取(約30日間)で炎症マーカーが減少しました[38]。ジュース摂取のタイミングは強制されませんでしたが、参加者はコンプライアンスを向上させるために毎日ほぼ同じ時間にジュースを飲むように奨励されました。生ジュースは研究で使用する前に加熱殺菌されました。 プラセボジュースは、色、風味、炭水化物含有量が アロニアジュースと一致しており、ソルビトール 128.5g、グルコース 74.5 g、フルクトース 77.9 g、ブラックチェリー Koolaid© ミックス (砂糖不使用) 28.8 g、レモンジュース 4 オンス、青色食品着色料 16 滴、および 1 リットル (L) の溶液を作るのに十分な水で構成されていました。別のポリフェノール介入研究では、プラセボ飲料にブラックチェリー Koolaid を使用したところ、ポリフェノール含有量と抗酸化活性が最小限に抑えられたことがわかりました [39]。参加者は介入中に約 3 回研究室に戻り、半ガロンのプラスチック容器に入った新鮮なジュース 1 L を受け取りました。プラスチック容器はラベルの付いた紙袋に入れられ、参加者が受け取るまで冷蔵されました。 |
| 介入期間中、参加者は、ベリーやケール、赤豆、黒豆、ダークチョコレートなどの特定の果物や野菜を含むポリフェノール含有量の高い食品を除いて、通常の食事を摂るように指示されました。食品の全リストは、補足表 S1 に記載されています。参加者は、2 回目の訪問前の 1 週間のウォッシュアウト期間と、その後の介入期間の合計約 5 週間にわたってこの食事療法に従うように指示されました。食事療法ガイドラインの遵守は、1 週間のウォッシュアウト期間と介入期間中に記入された自己申告の食事療法遵守アンケートによって確認されました。 |
| 2.7. アロニアジュースの標的液体クロマトグラフィー質量分析および核磁気共鳴分析 |
| アロニアジュースは、西部農業研究センターから提供されたもので、モンタナ州コーバリスの同センターで栽培されたバイキング、マッケンジー、オータムマジックの栽培品種のブレンドです。アロニアジュースは、以前に説明したように、炭水化物とフェノールの組成を決定するために分析されました[22]。簡単に言うと、ポリフェノール含有量は、Agilent 6538四重極飛行時間型(Q-TOF)質量分析計(Agilent、Santa Clara, CA, USA)およびAgilent 1290標的液体クロマトグラフィー-質量分析(UPLC)システム(Agilent、Santa Clara, CA, USA)で使用するために開発された超高性能液体クロマトグラフィー(LCMS)法を使用して測定されました。分離には、Acquity HSST-3 超高性能液体クロマトグラフィー逆相カラム、1.8 μM、100 mm/2.1 mm (Waters、 Milford, MA, USA) を使用しました。ジュースの炭水化物含有量は、600 MHz TCI (H-C/N-D05Z) LT プローブを備えた Bruker 600 MHz Avance III NMR 分光計 (Bruker、Billerica, MA, USA) を使用した核磁気共鳴 (NMR) 分析によって測定しました。測定された炭水化物濃度を使用して、対応するプラセボ ジュースを開発しました。アロニア ジュースの炭水化物とフェノール濃度を表 1 に示します。 |
| 表 1 アロニアジュースの炭水化物とポリフェノール含有量。 |
 |
| 2.8. 習慣的な食事の評価 |
| 習慣的な食事は、国立がん研究所が提供するウェブベースの調査である、検証済みの食事履歴質問票 (DHQ III) を使用して評価されました。2 回目の訪問で高脂肪食チャレンジ中に着席している間、参加者は 30 日間の記憶を完了するよう求められました。参加者は、すべての飲料と食品の摂取量について正確な分量を思い出す可能性は低いことを認識した上で、習慣的な摂取量の最良の推定値を提供するよう指示されました。食事履歴質問票調査には、食事の頻度と分量を評価するための 26 のサプリメントと 135 の食品と飲料に関する質問が含まれています。健康的な食事指数 (HEI、2015) スコアは、食事履歴質問票調査の組み込み分析によって計算されました。これらのスコアは、2015~2020 年の米国人向け食事ガイドラインに準拠した食事の質の指標として機能します [40,41]。分析された健康的な食事指数スコアには、適切さに基づく 9 つのスコア (全粒穀物、脂肪酸、果物総量、緑黄色野菜と豆類、全果物、野菜総量、魚介類と植物性タンパク質、乳製品、総タンパク質食品) と、節度に基づく 4 つのスコア (添加糖、精製穀物、飽和脂肪、ナトリウム) が含まれていました。すべてのスコアの合計を表す合計健康的な食事指数スコアも分析されました。 |
| 2.9. 高脂肪食チャレンジ |
| 高脂肪食は、トーストした全粒粉パン (Wheat Montana、Three Forks, MT, USA) 3 枚に有塩バター (Tillamook、Tillamook, OR, USA) 58.3 g を塗って作りました。この食事には合計 714 キロカロリー (kcal)、タンパク質 12 g、炭水化物 54 g、脂肪 50 g、食物繊維 9 g が含まれていました。参加者全員に水が自由に提供され、習慣的にコーヒーを飲む参加者にはカフェイン入りアールグレイ紅茶 (Bigelow、Fairfield, CT, USA) が提供されました。食後時間は参加者が食事を開始した時点から始まり、食べ終わるまでに 15 分が与えられました。 |
| 2.10. 血液サンプル採取 |
| 参加者は、2 回目と 3 回目の来院前の 24 時間は激しい運動やアルコール摂取を控え、一晩 (10~12 時間) 絶食するよう指示されました。2 回の来院は午前中に行われました。参加者は、3 回目の来院の前日に最後のジュースを飲むよう指示されました。認定採血技師が肘静脈穿刺により血液サンプルを採取しました。参加者が高脂肪食を摂取する前に絶食時 (ベースライン) の血液サンプルを採取し、続いて食後 1、2、4、6 時間で追加の血液採取を行いました。血液は、EDTA、血清分離、ヘパリン添加バキュテナーチューブ (BD Vacutainer, Franklin Lakes, NJ, USA) に採取しました。血清分離チューブは、遠心分離 (1200 RPM、15 分) の前に室温で 15 分間凝固させました。血清アリコートは分析まで -80 °C で凍結されました。ヘパリン化および EDTA 添加全血は、採取後すぐに血液マーカー分析に使用されました。 |
| 2.11. 血液マーカーの分析 |
| ヘパリン処理した全血から、Picollo Xpress Chemistry Analyzer 脂質パネル (Abaxis、Union City, CA, USA) を使用して、低密度リポタンパク質コレステロール (LDL)、高密度リポタンパク質コレステロール (HDL)、総コレステロール (CHOL)、トリグリセリド (TG)、およびグルコース (GLU) レベルを測定しました。EDTA チューブに採取した全血を使用して、Affinion2 分析装置 (Abbott、Princeton, NJ, USA) を使用してグリコヘモグロビン (HbA1c) を測定しました。 |
| 2.12. 炎症バイオマーカーの分析 |
| 高感度マルチプレックス法(Bio-Rad Bio-Plex® 200 HTS、Hercules, CA, USA)を使用して、ミリポア(EMD Millipore Corporation、Billerica, MA, USA)の手順に従い、血清サイトカイン濃度を測定した。分析したサイトカインには、顆粒球マクロファージコロニー刺激因子(GM-CSF)、インターフェロンガンマ(IFN-γ)、腫瘍壊死因子アルファ(TNF-α)、およびIL-1β、IL-6、IL-10、IL-17、IL-23を含む5種類のインターロイキン(IL)が含まれていた。各時点で2つのサンプルを検査し、その平均値を分析に使用した。検出限界以下と測定された値は、対応するサイトカインの最小検出濃度の1/2に置き換えて分析した[42]。 |
| 2.13. 便の採取 |
| 参加者は、腸内微生物叢の構成と腸内代謝の測定のために、合計 2 つの便サンプルを採取するよう求められました。参加者には、ベースラインと最終訪問の 24 時間以内に自分で便サンプルを採取するための自己採取キットと説明書が提供されました。便サンプルは滅菌された 50 mL エッペンドルフ チューブに採取され、冷蔵状態で研究者に輸送されました。研究訪問に到着すると、サンプルは 16S rRNA と便代謝分析のために分注されました。便の分注は、事前に還元されたリン酸緩衝生理食塩水で処理され、嫌気性チャンバー内の低温バイアルに分注されました。サンプルは、DNA と代謝物の抽出のためのさらなる処理が行われるまで、-80 °C で保管されました。 |
| 2.14. ゲノム DNA 抽出と微生物分析 |
| ヒトの糞便サンプルからの細菌DNA 抽出には、Dneasy Powersoil® Pro キット (QIAGEN Sciences、Germantown, MD, USA) を使用しました。抽出した DNA は分析まで -80 °C で保存しました。16S rRNA V4 領域の Illumina MiSeq アンプリコン シーケンシングは、ミシガン大学ミシガン マイクロバイオーム プロジェクトによって実施されました。DNA 定量後、デュアル インデックス バーコード プライマーを使用して V4 アンプリコン ライブラリを生成し、その後ライブラリの精製、プーリング、MiSeq ペアエンド (2 × 250) シーケンシングを行いました。MOTHUR ソフトウェア (バージョン 1.35.1) (mothur.org) を使用して、MiSeq プラットフォームの標準 MOTHUR 操作手順 [43] に従ってシーケンシング リードを処理およびキュレートしました。簡単に言うと、連続したシーケンスはペアエンド リードからアセンブルされ、長さと品質についてスクリーニングされました。残りのコンティグは、rRNA 配列のアラインメントを改善するために、SILVA リボソーム RNA データベース (リリース 132) にアラインされました。MOTHUR の UCHIME アルゴリズムは、潜在的にキメラの配列を識別して削除するために使用されました。リボソーム データベース プロジェクトのベイジアン分類器は、分類の割り当てに使用されました。非ターゲット読み取りの削除後、97% の類似性しきい値を持つ VSEARCH 距離ベース クラスタリングを使用して、操作分類単位 (OTU) が割り当てられました。 |
| 2.15. 血清代謝物の抽出 |
| 血清サンプルは、超高性能液体クロマトグラフィー(LCMS)分析まで -80 °C で保存し、超高性能液体クロマトグラフィー分析時にサンプルを保管庫から取り出して氷上で解凍しました。液体抽出は、まず血清 20 µL を取り出し、これを 80 µL の冷アセトンとともに清潔なバイアルに入れて血清タンパク質を沈殿させることで完了しました。沈殿は、バイアルを -80 °C で 2 時間保存することで促進されました。次に、サンプルを 20,000×g で 30 分間遠心分離してタンパク質をペレット化しました。得られた代謝物上清を清潔なバイアルに集め、真空濃縮器で乾燥するまで濃縮しました。乾燥サンプルは、標的液体クロマトグラフィー質量分析の準備ができるまで-80 °C で保存しました。超高性能液体クロマトグラフィー分析の直前に、代謝物を 40 µL の MeOH:H2O (50:50) で再構成し、清潔な 液体クロマトグラフィーバイアルに入れました。 |
| 2.16. 糞便代謝物の抽出 |
| 糞便分析は、まず糞便 1 g を量り取り、分析の準備ができるまで -80 °C で保存して実施しました。糞便を氷上で解凍し、3 倍量の冷水を加えました。次に、糞便スラリーのバイアルを冷亜鉛ビーズに入れ、超音波プローブを使用して 40% のデューティ サイクルで 5 分間超音波処理しました。超音波処理後、同量のメタノールをスラリーに加え、1 分間撹拌しました。次に、サンプルを -80 °C で 1 時間保存しました。サンプルを再度 1 分間撹拌し、遠心分離機で 20,000 × g で 15 分間回転させました。上清を取り除き、清潔なバイアルに入れました。ペレットに同量の MeOH:H2O (50:50) を加えました。洗浄ステップとして、超音波処理、冷蔵保存、撹拌、遠心分離の同じ手順を繰り返しました。得られた上清層を除去し、最初の層に加えました。 |
| 次に、アセトンを使用してタンパク質沈殿を行いました。サンプルの 5 倍量のアセトンをサンプル チューブに加え、その後サンプルを-80 °C で 12 時間保存しました。保存後、サンプルを 20,000 × g で 5 分間遠心分離し、タンパク質をペレット化しました。代謝産物が豊富な上清を取り除き、清潔なバイアルに入れました。次に、サンプルを真空濃縮器で濃縮して乾燥させ、超高性能液体クロマトグラフィー分析まで -80 °C で保存し、分析後に 40 µL の MeOH:H2O (50:50) で再構成しました。 |
| 2.17. 糞便および血清抽出物の超高性能液体クロマトグラフィーメタボロミクス分析 |
| 超高性能液体クロマトグラフィー分析は、モンタナ州立大学のプロテオミクス、メタボロミクス、質量分析施設で実施されました。血清代謝物の分析は、Agilent 6538 Q-TOF MS に接続された Agilent 1290 UHPLC システムを使用して実施されました。すべての分析はポジティブ モードで実施され、分離は 130 Å、1.7 μm、2.1 mm × 100 mm Acquity BEH-HILIC HPLC カラムを使用して、移動相 A として水、移動相 B としてアセトニトリル (どちらも 0.1% ギ酸を含む) で実施されました。溶媒グラジエントは 1 分間 90% A で開始し、その後 5 分で直線的に 60% A まで減少し、さらに 1 分間 90% A に戻りました。総分析時間は 6 分で、溶媒流量は 400 µL/分一定、カラム温度は 30 °C でした。同定は、社内ライブラリの正規標準、MS-DIAL [44] と MoNA スペクトルライブラリを使用したフラグメンテーションマッチング、SIRIUS と CSI:Fingerprint ソフトウェア (バージョン 5) [45] を使用した in silico MSMS アノテーションを使用して完了しました。MS-DIAL アノテーションパラメータには、10 ppm (パーツパーミリオン) のエラーウィンドウと 50% の同定スコアカットオフが含まれていました。SIRIUS パラメータには 10 ppm のエラーウィンドウが含まれ、COSMIC スコアが 0.4 を超える場合にのみ一致が受け入れられ、最初の構造のみが選択されました。MSMS 分析注入は、同一の超高性能液体クロマトグラフィー条件を使用して完了しました。 |
| 糞便サンプルは、Waters Synapt-XS Q-IMS-TOF および Waters I-Class UHPLC を使用して分析しました。イオン化は、100 Å、1.8 μm、2.1 mm × 100 mm Waters Acquity HSST3 逆相カラムを使用した ESI でネガティブ モードで完了しました。カラム コンパートメントは 40 °C に保たれ、流量は 200 µL/分でした。分析実行時間は 28 分で、移動相 A および B として、それぞれ 0.1% ギ酸を含む UHPLC グレードの水とアセトニトリルを使用しました。分析は 0.5 分まで 99% A で開始され、その時点で A は直線的に減少し始め、25 分で 1% になりました。25 分で A は 99% に増加し、分析終了までその値を維持しました。同定は、HMDBスペクトルライブラリ[46]を参照したMassLynxを使用した真正標準と同位体スコアリングおよびフラグメンテーションマッチングを使用して完了しました。合計スコアが30を超える特徴は、陽性注釈として保持されました。MSMS分析注入は、同一の超高性能液体クロマトグラフィー(LCMS)条件を使用して完了しました。 |
| 2.18. 統計手法 |
| 分析はRStudio(2023年6月1日)でR 4.3.1を使用して実施され、データはggplot2 [47]およびeffects [48]パッケージを使用して視覚化されました。 |
| 2.18.1. 検出力分析 |
| 検出力は、介入前と介入後の時点での空腹時の血液サンプルから得た非標的血清メタボロミクスデータを使用して事後的に計算されました。経時的なトップ代謝物(特徴)と介入グループは、多変量経験的ベイズ分散分析(MEBA)[49]によって特定されました。多変量経験的ベイズ分散分析は、さまざまな条件で一時的な代謝プロファイルを比較し、経時的な変化の度合いに基づいて特徴をランク付けする時系列モデリング手法です。多変量経験的ベイズ分散分析分析によって特定された特徴は、経時的なパターンの違いに基づいて、最も重要なものから最も重要でないものにランク付けされました。次に、このリストの特徴は、経時的な介入グループ間の識別の精度に基づいて、最も効果的な特徴から最も効果的でない特徴までの範囲を捕捉するために、10グループ(10パーセンタイル)に分けられました。選択された特徴の効果を定量化するために、各特徴のCohenのd効果サイズを計算し、10パーセンタイルビン全体で平均しました。これらの平均効果サイズは、各パーセンタイルランキングからの代表的な特徴の識別力に基づいて、期待される効果サイズを表します。次に、選択された特徴の Cohen の d 効果サイズから検出力が計算され、アロニアグループとプラセボグループ間の平均の差 (測定前後) が求められました。したがって、これらの検出力値は、異なるランクの特徴から期待される識別力を表しています。この方法を使用すると、サンプルサイズ n = 14 では、ランク付けされた特徴の上位 10 パーセンタイルに対して非常に高い検出力 (0.87 ~ 0.99) が得られ、平均効果サイズが大きくなりました (d = 0.93)。さらに、R の pwr パッケージの pwr.f2.test を使用して、空腹時総コレステロールの線形回帰モデルから事後的に検出力が計算されました。計算された検出力は、タイプ 1 の確率 0.05 で 97% でした。 |
| 2.18.2. 人体計測値、血液マーカー、炎症バイオマーカー |
| 分析参加者の身体的および生物学的特徴について記述要約統計量が決定され、一般線形モデルを使用して、ベースラインで介入グループ間で特徴が異なるかどうかを判断しました。一般線形モデルを使用して、次の変数のカテゴリに対する介入の影響を評価しました:人体計測値(内臓脂肪、脂肪量パーセント、体重)、空腹時血糖値(グリコヘモグロビン (HbA1c)、グルコース (GLU))、空腹時血清脂質値(低密度リポタンパク質コレステロール (LDL)、高密度リポタンパク質コレステロール (HDL)、総コレステロール (CHOL)、トリグリセリド (TG))、および空腹時炎症マーカー(腫瘍壊死因子アルファ(TNF-α)、顆粒球マクロファージコロニー刺激因子(GM-CSF)、インターフェロンガンマ(IFN-γ)、IL-23、IL-10、IL-1β、IL-17、およびIL-6)。統計分析の前に、RパッケージbestNormalize [50]を使用してサイトカインの正規化を行いました。すべての従属変数は、ベースラインからの値の変化(介入後 - 介入前)として計算されたデルタ値として要約されました。線形モデルの予測変数は、各変数カテゴリ内で次のように共通していました:人体測定 - 介入グループ、血中脂質プロファイル - 介入グループ、内臓脂肪組織、血糖コントロール - 介入グループ、炎症 - 介入グループ、内臓脂肪組織。食事履歴質問票 (DHQ III) 健康的な食事指数 (HEI)スコアは、習慣的な食事を評価し、ベースラインでの介入グループ間の食事の違いを特定するために、一般線形モデルを通じて分析されました。 |
| 食後代謝(グルコース (GLU)、トリグリセリド (TG))および炎症(腫瘍壊死因子アルファ(TNF-α)、顆粒球マクロファージコロニー刺激因子(GM-CSF)、インターフェロンガンマ(IFN-γ)、IL-23、IL-10、IL-1β、IL-17、IL-6)測定値は、食後0(空腹時)および食後1、2、4、6時間の時点で収集され、auctime [51] Rパッケージを使用して、曲線下面積(AUC)として集計されました。次に、各従属変数は、曲線下面積介入後—介入前)の変化を表すデルタ値として集計されました。炎症測定値は、統計分析の前に、RパッケージbestNormalizeを使用して正規化されました。介入が各従属変数に与える影響は、対応する空腹時モデルで使用されているものと同じ予測変数を持つ一般線型モデルを使用して評価されました。 |
| 2.18.3. 糞便微生物統計分析 |
| 全サンプルで合計 738,952 の生の読み取りが得られました。シーケンス深度による偏りのない多様性マトリックスを支援するために、データは MOTHUR でサンプル全体のシーケンスの最小数 (6001 読み取り/サンプル) にランダムにサブサンプリングされました。サブサンプリングの結果、合計 168,028 の高品質読み取りが得られました。 |
| 別途指定がない限り、ベースR 4.3.2を実行するRStudio(バージョン2023.12.0.369)を使用して、生態学的分析と視覚化を実行しました。アルファ多様性(豊かさとピエルーの均等性)は、MOTHUR(バージョン1.35.1)(mothur.org)およびvegan(バージョン2.6-4)を使用してOTUレベルで計算されました。ベータ多様性分析は、サンプルの少なくとも20%でOTUが3カウント未満になるようにフィルタリングして、サブサンプルデータに対して実行されました。距離行列の順列多変量解析(PERMANOVA)は、vegan(バージョン2.6-4)のadonis2を使用して999の順列で実行されました。固定効果には、時間とジュースの状態の相互作用、相互作用の根本的な主効果、および対象が含まれます。我々は、階層的特徴エンジニアリングによって選択された分類群に加えて、分類学上の各レベル(門-属)でのコミュニティ構成を、並べ替えランダムフォレスト[52]を使用せずにtaxaHFEを使用して調査した。ベータ多様性は、phyloseq [53]の非計量次元スケーリングを使用して視覚化された。 |
| 4週間のジュース摂取による属の変化の可能性を特定するために、差分存在量分析も実施しました。被験者をランダム効果として、時間とジュースの状態の相互作用を固定効果として、MaAsLin2 [54]を使用しました。デフォルトのMaAsLin2パラメータを使用しました。次に、相互作用出力を抽出し、ベンジャミニ・ホッホバーグ法を使用して多重検定調整のためのq値を再計算しました。 |
| 2.18.4. メタボロミクス統計分析 |
| 超高性能液体クロマトグラフィー(LCMS)分析後、血清データはMSConvert v3.0 (proteowizard.sourceforge.io) を使用してmzML形式に変換されました。次に、mzMine v3とMS-DIAL [55] (mzmine.github.io) を使用して、強度カットオフ 1000、保持時間ウィンドウ 0.25 分、エラー 15 ppm で固有の特徴を分離してデータをマイニングしました。溶媒と処理ブランクを使用して、バックグラウンドノイズを除去し、生物学的に関連する代謝物を保持しました。処理ブランクと溶媒ブランクの 5 倍を超える面積を持つ特徴は保持されました。データ処理後、血清サンプル内で 950 を超える特徴が保持されました。糞便データは、5 ppm エラー識別検索パラメータを使用して Progenesis を使用して処理されました。血清データセットと同様にバックグラウンドノイズを除去した後、糞便サンプルで約 14,000 の特徴が見つかりました。統計解析はMetaboAnalyst v5.0 [56] (metaboanalyst.ca)を使用して行われた。統計解析の前処理手順には、対数変換による正規化と四分位範囲に基づくフィルタリングが含まれていた。t検定や多変量解析などの統計解析を使用して重要な特徴を決定し、多重検定を補正するために非標的解析で偽発見率(FDR)を使用してスクリーニングした。特定された重要な特徴はデルタ値(介入後の相対濃度-介入前の相対濃度)として調べられた。 |
| 3. 結果 |
| 3.1. 参加者の一般的な特徴 |
| 合計 25 人の成人が研究への参加についてスクリーニングされ、そのうち 10 人が参加基準を満たさなかったため除外されたか、追跡調査から脱落したか、介入に関連しない理由で脱落しました。15 人が介入グループにランダム化され、1 人の参加者は瀉血困難のため脱落しました (補足図 S1)。合計 14 人の成人 (平均 ± SD)、年齢 (32.87 ± 6.98 歳)、ボディマス インデックス (BMI) (25.75 ± 4.66 kg/m2) が研究を完了しました。研究を完了した 1 人の参加者は、最後の採血訪問前の急性アルコール摂取のため、脂質パネル (グルコース (GLU)、トリグリセリド (TG)、総コレステロール (CHOL)、高密度リポタンパク質コレステロール (HDL)、低密度リポタンパク質コレステロール (LDL)、) および炎症血液分析から除外されましたが、代謝および微生物組成分析には含まれました。 |
| 参加者コホートは、概して良好な代謝健康状態を示しました(表2)。平均して、両介入群の参加者は、ボディマス インデックス (BMI)で分類すると軽度過体重であり、米国心臓協会ガイドライン[57]で定義されている正常血圧でした。空腹時血中グルコース (GLU)とグリコヘモグロビン (HbA1c)は平均して正常でした。空腹時総コレステロール(CHOL)、低密度リポタンパク質コレステロール (LDL)、トリグリセリド (TG)は正常で、高密度リポタンパク質コレステロール (HDL)は標準基準範囲と比較して両介入群で中間でした。ベースラインでは、人体測定値と血液測定値は両群間で同様でした。 |
| 表 2 割り当てられた食事介入別の参加者のベースライン特性 (n = 14)。血液プロファイルは空腹時のベースライン値を表します。 |
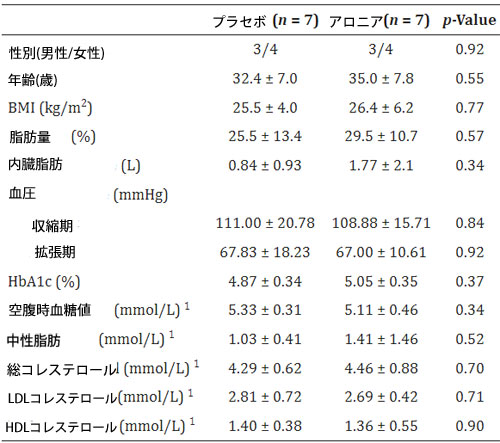 |
データは平均±標準偏差を表します。1 でマークされた特性は、断食ガイドラインを満たさなかった参加者 1 名が除外されたため、(n = 13) で計算された p 値を示します。性別の p 値は、指定された割合の 2 サンプル テストによって決定され、その他のすべての p 値は 2 サンプル t テストによって決定されます。略語: ボディマス インデックス (BMI)、トリグリセリド (中性脂肪)、グリコヘモグロビン (HbA1c)、低密度リポタンパク質 (LDL)、高密度リポタンパク質 (HDL)。 |
| 3.2. 人体計測値 |
| 30日間の介入期間中、脂肪量率(F = 1.02、p = 0.34)、体重(F = 0.09、p = 0.77)、内臓脂肪組織(F = 1.23、p = 0.29)の変化において、アロニアジュース (ARO) とプラセボジュース (PLA)の間に差は見られませんでした。 |
| 3.3. 習慣的食事分析 |
| アロニアジュース (ARO) と プラセボジュース (PLA)の参加者は、自己申告の食事履歴質問票 (DHQ III) 健康的な食事指数 (HEI)合計スコアと構成スコアの比較により、ベースラインで同様の習慣的食事をとっていたことが判明しました (補足図 S2)。健康的な食事指数構成スコアと健康的な食事指数合計スコアは、飽和脂肪摂取量を除いて介入グループ間で差はありませんでした。飽和脂肪摂取量はアロニアジュース (ARO)で低かった (t = −2.54、p = 0.03) (補足表 S2)。重要なことに、野菜全体 (F = 0.03、p = 0.87)、緑黄色野菜と豆 (F = 0.25、p = 0.62)、果物全体 (F = 1.88、p = 0.20)、果物全体 (F = 0.46、p = 0.51) など、ポリフェノール含有量が高いカテゴリの健康的な食事指数構成スコアは介入グループ間で差がありませんでした。果物や野菜とともに、コーヒーや紅茶などのカフェイン入り飲料はポリフェノールの主要な食事源です[12]。参加者は介入中にこれらの飲料を避けるように指示されていませんでしたが、ベースラインではカフェイン摂取量(mg/日)はグループ間で差がありませんでした(F = 0.01、p = 0.95)。しかし、コーヒーと紅茶にはカフェインに加えて、食事履歴質問票では推定されていない他のポリフェノールが含まれています。直接測定されていないものの、介入グループ間の健康的な食事指数構成要素スコアとカフェイン摂取量の一致は、ポリフェノールの同様の習慣的摂取を示唆しています。 |
| 3.4. 空腹時および食後脂質および血糖測定 |
| 介入前と介入後に空腹時血中脂質パネルを実施し、マーカーがアロニア介入によって調整されたかどうかを判断しました。アロニア摂取は、プラセボグループと比較して、30日間の介入期間中、総コレステロール (CHOL)(β = −0.50、p = 0.03)レベルの安定性と関連していることがわかりました(図1)。アロニアジュース (ARO)は0.08 mmol/Lのわずかな増加を示し、ベースラインレベルが維持されたことを示していますが、プラセボジュース (PLA)は平均0.40 mmol/Lの増加を示しました。空腹時グルコース (GLU)(F = 3.82、p = 0.08)、トリグリセリド (TG)(F = 0.44、p = 0.52)、高密度リポタンパク質コレステロール (HDL)(F = 2.39、p = 0.15)、または低密度リポタンパク質コレステロール (LDL)、(F = 3.13、p = 0.11)では介入群間で差は認められませんでした。 |
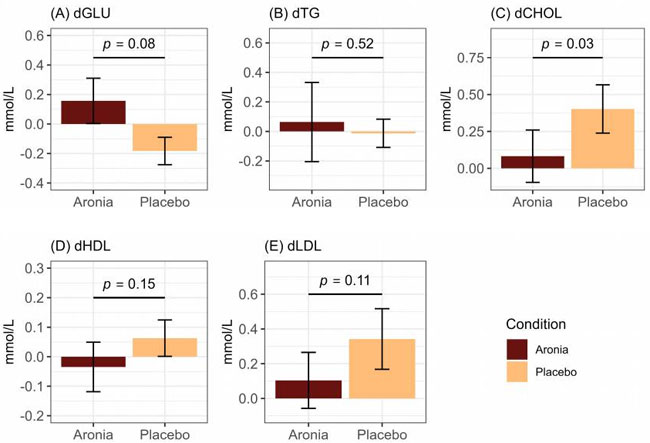 |
| 図 1 (A) 空腹時血糖値 (dGLU)、(B) 空腹時トリグリセリド値 (dTG)、(C) 空腹時総コレステロール値 (dCHOL)、(D) 空腹時高密度リポタンパク質コレステロール値 (dHDL)、(E) 空腹時低密度リポタンパク質コレステロール値 (dLDL) における (介入後 - 介入前) として計算されたデルタ (d) 値の要約プロット。多変量解析(ANOVA )によって決定された介入グループ間の差異。 |
| アロニア摂取が食後代謝に与える影響を判断するために、高脂肪食チャレンジに対するトリグリセリドとグルコースの反応を調べました。空腹時トリグリセリド曲線下面積(dTGAUC) の変化に対するアロニアの影響はありませんでした (F = 1.19、p = 0.30)。平均空腹時トリグリセリド曲線下面積(dTGAUC) は アロニアジュース (ARO) で 1.27 mmol/L、プラセボジュース (PLA)で 0.10 mmol/L でした (補足図 S3)。両方の介入グループの空腹時トリグリセリド曲線下面積(dTGAUC)には個人間で大きなばらつきがあり、介入前から介入後にかけて 0.91 mmol/L の減少から 4.97 mmol/L の増加までの範囲でした。介入グループ別の食後トリグリセリド反応の概要は、補足図 S4 に示されています。 |
| アロニア摂取は食後血糖反応の低下と関連しており(β = −3.03、p < 0.01)、平均で1.94 mmol/Lの低下であったのに対し、プラセボジュース (PLA)では1.09 mmol/Lの増加であった(図2)。参加者全員が食後2時間の時点で血糖値を7.8 mmol/L未満に維持しており、混合食に対する血糖反応が正常であることを示している。介入前後の食後血糖反応の概要は補足図S5に示されている。 |
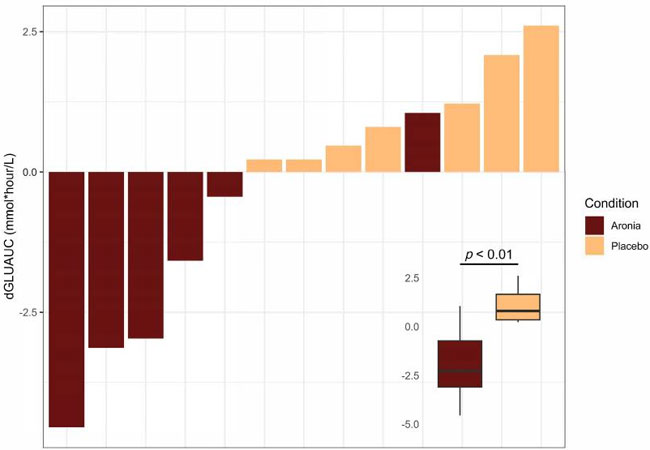 |
| 図 2 グルコース曲線下面積 (dGLUAUC) の個々の変化 (介入後 - 介入前) の概要プロット。グルコース曲線下面積値は、高脂肪食摂取後 6 時間の空腹時および 1 時間ごとの時点からの値の合計の変化を表します。各バーは、1 人の参加者 (n = 13) の値を表します。食事グループ間のグルコース曲線下面積の差は、多変量解析(ANOVA )で決定され、挿入図に表示されています。 |
| 3.5. 断食と食後炎症 |
| 高脂肪食は炎症反応を引き起こす可能性があるため[58]、30日間のアロニア摂取が断食時のレベルに加えて食後炎症に与える影響を調べた。介入グループが介入前と介入後の断食時または食後炎症マーカーの変化に及ぼす影響は検出されなかった(補足表S3)。 |
| 3.6. 糞便微生物のアルファおよびベータ多様性 |
| 4週間のジュース摂取が糞便微生物の豊富さと均一性(アルファ多様性)およびコミュニティ構成(ベータ多様性)に与える影響を調べた。アロニアジュースを摂取した人の糞便微生物コミュニティは、微生物の豊富さが平均的に減少し(β = −18.2、p = 0.04、図3A)、ボディマスインデックス (BMI)(β = −0.31、p = 0.73)を説明できることがわかった。ピエルーの均一性で測定した微生物均一性では、アロニアグループとプラセボグループの間に違いは見られなかった(p = 0.74、図3B)。また、介入後に階層的特徴エンジニアリングによって選択された微生物特徴や、どの分類レベルでも微生物コミュニティ構成に違いは見られなかった(補足表S4)。属レベルでの制約のない順序付けは、図3Cに示されている。 |
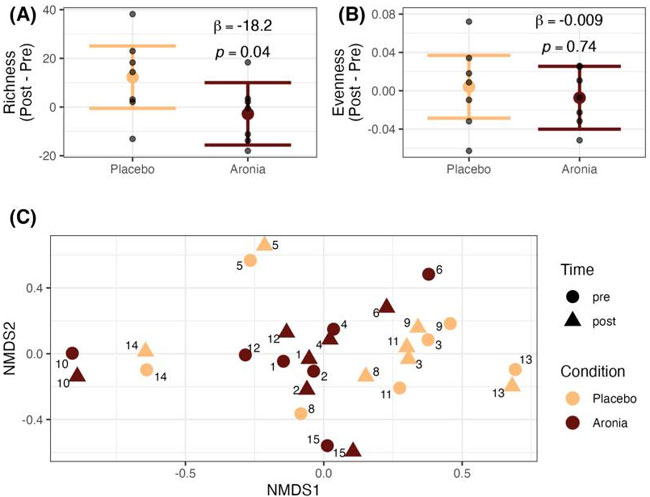 |
| 図3 腸内微生物叢のアルファおよびベータ多様性。(A) 微生物の豊富さ、(B) 微生物の均一性、(C) 微生物群集の構成。豊富さと均一性のベータ係数は、ノンパラメトリックなランクベースの推定法から導き出されました。バーは 95% 信頼区間を表します。属レベルのベータ多様性は、非計量次元尺度法 (NMDS) を使用して視覚化されました。各ポイントは単一のサンプルを表し、数字は特定の対象を示しています。 |
| 3.7. 微生物分類群の差異 |
| 微生物の豊富さが減少したことから、4 週間後にどの微生物属の豊富さが変化したかを調べるため、MaAsLin を使用して差異豊富さ分析も行いました。多重検定補正を行わない場合、アロニアの摂取により Holdemania と Barnesiella の豊富さが減少し、Oxalobacteraceae、Prevotellaceae、および Pasturellaceae 内の 3 つの未確認属の豊富さが増加したことが検出されました (補足表 S5)。これらの 5 つの関連性は、多重検定補正後には維持されませんでした。 |
| 3.8. 血清メタボロミクス |
| 超高性能液体クロマトグラフィーデータの取得と処理 (ブランクとノイズの除去、ピークのアライメント) の後、血清データセットは約 950 の特徴で構成されました。プラセボグループとアロニアグループの両方からの介入前と介入後のサンプルの初期分析を PCA 2-D プロットで行ったところ、メタボロミクス プロファイルの類似性と全体的なデータ品質および再現性が示されました (補足図 S6A)。 |
| 真正標準、断片化ライブラリのマッチング、および in silico アノテーションを使用したアノテーションの結果、47 件の固有の識別が行われました (補足ファイル S1)。識別された各代謝物のデルタ値は、介入前の測定された相対濃度から介入後の相対濃度を差し引くことによって決定されました。次に、各代謝物に対して t 検定を実行し、2 つの代謝物が FDR 補正後に有意な p 値 (<0.05) を持つことがわかりました (図 4)。この分析により、アスパラギン(Asparagin)とチロシン(Tyrosine)の両方の空腹時レベルが有意に異なり、介入後に アロニアジュース (ARO)グループで両方の濃度が上昇したことが示されました。 |
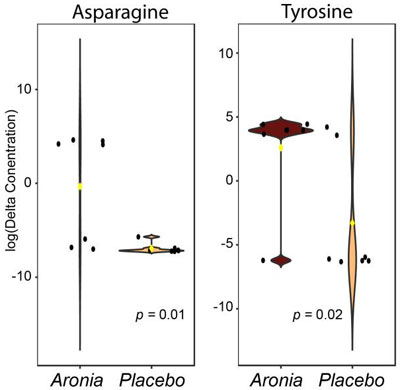 |
| 図 4 血清中の容疑者スクリーニング統計分析結果。バイオリンプロットは、空腹時のアスパラギンおよびチロシン レベルの相対濃度変化 (介入前後) を示しています。黒い点は参加者の値を表し、黄色の菱形はグループの中央値を示します。4 週間後、アロニアグループでは両方のアミノ酸がアップレギュレーションされました。各パネルには、t 検定を使用した関係の p 値が表示されています。 |
| 空腹時血清メタボロミクスデータセットの非標的解析も完了しました。この解析により、最初の採血と最後の採血の間で 3 つの特徴が有意に異なる (p < 0.05) ことが判明しました (図 5A)。これらの特徴には、m/z 120.002、164.027、および 286.200 が含まれます。これらの特徴の注釈は質量値を使用して作成され、164.027 は 2-クロロキノリン、286.200 は 6-オクテノイルカルニチンとして暫定的に注釈が付けられましたが、他の特徴については信頼性の高い注釈を作成できませんでした。6-オクテノイルカルニチンは アロニアジュース (ARO)でダウンレギュレーションされましたが、他の 2 つの特徴はアロニアの摂取により上昇しました (図 5B)。 |
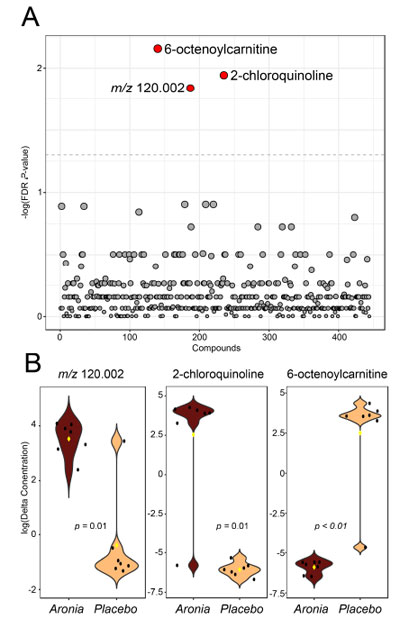 |
| 図 5 空腹時血清メタボロームの非標的解析。(A) 実験グループ間の血清メタボローム特性の相対濃度変化 (介入前後) を比較した t 検定結果。FDR 補正後の p < 0.05 の特性は赤い点で示され、このカットオフを超える特性は灰色の点で示されます。(B) 3 つの重要な特性のバイオリン プロット。特定の t 検定 p 値が表示されます。黒い点は参加者の値を表し、黄色の菱形はグループの中央値を示します。 |
| 3.9. 糞便メタボロミクス |
| 糞便超高性能液体クロマトグラフィー分析では、バックグラウンドノイズを除去した後に約 14,000 の特徴が生成されました。コントロール グループと実験グループの両方の糞便メタボロミクスプロファイルのグローバル分析では、参加者の分離やグループ化がなく、同様のメタボロミクス プロファイルが示されました (補足図 S6B)。これも、データの再現性と一貫した糞便超高性能液体クロマトグラフィー結果を示しています。 |
| 本物の胆汁酸参照標準を糞便サンプル分析と組み合わせて使用し、15 種類の胆汁酸を特定しました (補足ファイル S2)。統計分析を実施したところ、最初の糞便収集と 4 週間後の糞便収集の間で 1 つの胆汁酸が大幅に変化しました (p < 0.10)。胆汁酸であるケノデオキシコール酸 (CDCA) は、アロニアを摂取した人の糞便サンプルで 4 週間後に増加しました (図 6)。 |
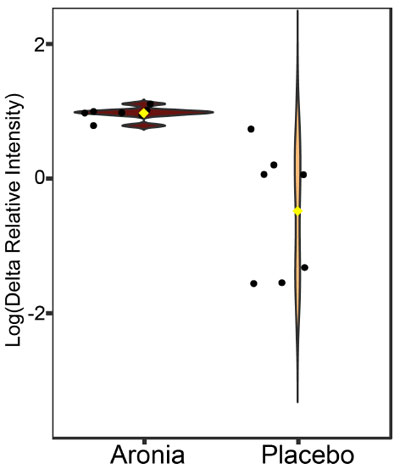 |
| 図 6 糞便中のケノデオキシコール酸 (CDCA) の相対濃度変化 (介入前後) のバイオリン プロット。黒い点は参加者の値、黄色の菱形はグループの中央値を示します。ケノデオキシコール酸レベルは 4 週間後にアロニア グループで上昇しました。一元配置分散分析テストを使用して p 値 0.07 が計算されました。 |
| 取得した糞便データの非標的分析も実施しました。断片化ライブラリのマッチングと同位体スコアリングにより、42 のレベル 2 注釈が作成されました (補足ファイル S3)。これらのうち、4 つは対応のある t 検定を使用して有意に異なることが判明しました (図 7A ~ D)。見つかった特徴はすべて脂質であり、アロニアを 4 週間摂取した後にアップレギュレーションされました。 |
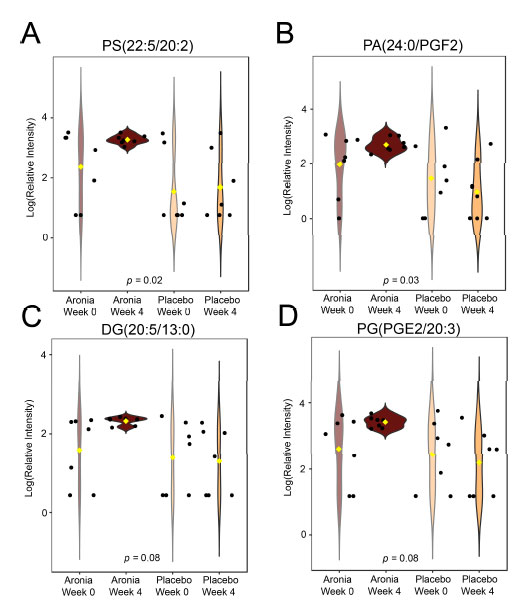 |
| 図 7 糞便メタボロームの非標的分析。バイオリン プロット (A ~ D) は、両方の実験グループにおける介入前と介入後の有意に異なる特徴の相対濃度を示しています。黒い点は参加者の値を表し、黄色の菱形はグループの中央値を示しています。注釈が付けられた特徴はすべて脂質であることがわかりました: ホスファチジルセリン (PS)、ホスファチジン酸 (PA)、ジグリセリド (DG)、およびホスファチジルグリセロール (PG)。 |
| 4. 考察 |
| ポリフェノール含有量の高いアロニア果実は、抗炎症、脂質低下、血糖低下の生物学的活性が確立されており、機能性食品として大きな可能性を秘めています [59]。ポリフェノールの代謝に対する有益な影響は、ポリフェノールの糞便微生物代謝によって緩和される可能性が高いため、健康転帰のメカニズムの基盤を解明するには、全身代謝と腸内代謝を同時に評価する必要があります。私たちは、空腹時および食後の炎症、脂質、グルコース代謝バイオマーカー、糞便微生物組成、糞便および血清代謝物を分析することにより、アロニア介入のヒト被験者への影響を特徴付ける 30 日間の臨床試験を実施しました。この研究の主な知見には、アロニアジュースの摂取による食後血糖値の減少、空腹時コレステロールの減衰、微生物の豊富さの減少、腸内および宿主のメタボロームの変化が含まれます。メタボロームの変化は炎症の低下と一致していますが、安静時および食後の炎症性サイトカインレベルは変化しませんでした。さらに、対照群の背景食から多くのポリフェノール源を除去したことで、代謝に悪影響が及んだようです。 |
| 30日間のアロニアジュース摂取は、プラセボを対照としたグループと比較して空腹時総コレステロール値の低下と関連していることがわかった。ポリフェノール摂取による血中脂質値の改善は文献で十分に実証されている[11]。マウスモデルでは、腸管脂質吸収の阻害[60]やグリセロリン脂質代謝に関連する遺伝子の調節[61]など、コレステロール低下効果の潜在的なメカニズムがいくつか特定されている。アロニアをベースとした介入に焦点を当てた対照試験はほとんどないが、アロニアのコレステロール値への影響を調査したランダム化対照試験のメタアナリシス2件では、総コレステロール値[62,63]や低密度リポタンパク質コレステロール (LDL)、および高密度リポタンパク質コレステロール (HDL)値の改善が認められた[63]。アロニアグループとプラセボグループの総コレステロール (CHOL)値の有意な差は、研究中に行われた低ポリフェノール食を反映している可能性があり、プラセボグループでのポリフェノール摂取不足が総コレステロール (CHOL)値の上昇に寄与している。本研究では、高密度リポタンパク質コレステロール (HDL)、低密度リポタンパク質コレステロール (LDL)、トリグリセリド (TG)を含む血中脂質測定値のその他の変化は確認されなかったが、これは健康な参加者コホートにおけるアロニア摂取を調べたランダム化クロスオーバー試験の結果と一致している[14]。変化がないことを示す本研究の指標の背景となる、長期にわたるアロニア摂取後の食後トリグリセリド反応の変化を調べた他の研究は知らない。しかし、参加者の代謝的に健康な状態と、介入前後の反応における個人間の大きなばらつきを考えると、この結果は合理的に予想されるものかもしれない。 |
| アロニアジュースの摂取は、高脂肪食摂取に対する食後血糖反応を低下させた。同様の研究では、100 mLのアロニアジュースが健康な被験者の食後血糖値を下げることがわかった[64]。この低下は、アロニアジュースによるジペプチジルペプチダーゼIV、α-グルコシダーゼ、およびアンジオテンシン変換酵素の酵素活性の阻害に起因するものであった。これらの酵素の阻害は、インクレチン調節や上皮グルコース輸送などのさまざまなメカニズムを介して血糖値を低下させる[65,66,67]。しかし、血糖値は急性アロニアジュース摂取に対する反応として測定されたものであり、高脂肪食試験の日にジュースを摂取しなかったという点で本研究とは異なります。したがって、本研究における血糖反応の低下は別のメカニズムによるものである可能性があります。食後血糖反応に影響を与える要因には、ベースラインの血糖状態やインスリン分泌などいくつかあります。空腹時または食後のインスリン反応は測定しなかったため、本研究ではインスリン分泌との関係を推測することはできません。しかし、空腹時血糖値と グリコヘモグロビン (HbA1c) で測定された参加者のベースライン血糖状態は最適であり、アロニア群ではこれらの指標に変化は見られませんでした。総コレステロール値で確認されたように、プラセボ群では食後血糖値のわずかな上昇が確認されました。この結果も、基礎食からポリフェノールを除去したことによるものと考えられます。アロニアの長期摂取に対する食後血糖反応を調べるさらなる研究により、アロニアが食後血糖コントロールに及ぼす有益な影響をより明確にする必要があります。 |
| 私たちの仮説に反して、アロニアジュースを30日間摂取した後も、空腹時の炎症レベルは低下しませんでした。ランダム化比較試験では、アロニアの補給により炎症が軽減したと報告されていますが [14,68]、変化が見られなかった試験もあります [18]。これらの研究は、代謝的にリスクのある集団を対象に実施され、介入期間は6~12週間でした。したがって、介入期間がはるかに短く、研究コホートとして代謝的に健康な参加者を使用したため、本研究では空腹時の炎症マーカーに変化がなかった可能性があります。本研究は、急性の影響ではなく、アロニアによって引き起こされる全身の抗炎症変化を検出するように設計されていました。ただし、トリグリセリドとグルコースの測定のために食後サンプルが収集され、高脂肪食の摂取は炎症刺激として確立されているため、食後炎症分析も実施しました。アロニアの摂取による食後炎症マーカーの改善は見られませんでした。これは、ポリフェノールの最大血清濃度が、本研究で使用した炎症刺激である高脂肪食のタイミングと一致しておらず、最大の抗炎症効果が見られなかったためと考えられます。アロニアのヒドロキシ桂皮酸とアントシアニンは、小腸で部分的に吸収され、摂取後3時間以内に最大血清濃度に達します[69,70]。しかし、ポリフェノールの90~95%は大腸に移行し、消化管微生物による消化代謝を受けます。親ポリフェノールのこれらの微生物誘導体は、循環系に入るまでに時間がかかります。健康な成人が同位体標識シアニジン-3-グルコシドを摂取したところ、誘導体のフェルラ酸と馬尿酸が最大血漿濃度に達するまでにそれぞれ平均8.2時間と15.7時間かかることが明らかになりました[71]。さらに、アントシアニン代謝物の中には半減期が最長96時間であるものもあります[71]。そのため、チャレンジ食テスト中に何らかの生理活性誘導体が循環していた可能性があります。しかし、血漿濃度は急性摂取後のピーク濃度のわずかな部分であった可能性があります。著者らは、ジュース摂取とチャレンジ食テストのタイミングも、アロニア摂取による食後トリグリセリド反応の変化が見られなかったことに寄与している可能性があると仮説を立てています。 |
| アロニアの健康への影響を促進する代謝基盤を特定するためのメタボロミクス調査により、根本的な代謝シフトを反映している可能性のある変化が明らかになりました。血清データセットで一般的な代謝物の容疑者スクリーニングにより、いくつかの代謝物が分離され、その後の分析により、アロニアの摂取による血清アミノ酸の変化、具体的には、アスパラギンとチロシンの空腹時濃度の上方制御が示されました。これらのアミノ酸は、他のアミノ酸とともに、エネルギー代謝やさまざまなシグナル伝達経路を含む無数の代謝経路の中心です。これらの増加の正確な原因と機能を解明することは困難ですが、この現象は以前に in vitro でのフェノール補給で報告されています。Gerdemann らは、ポリフェノール補給により、他のアミノ酸の中でも特にアスパラギンとチロシンが上方制御されることを発見しました [72]。この一貫した結果は、アロニアが中枢炭素代謝やその他の重要な代謝経路に及ぼす役割を示しています。 |
| 空腹時および食後の炎症性サイトカインはアロニア摂取によって変化しませんでしたが、メタボロームにおいて抗炎症性の変化が見られた可能性があります。アロニアジュースを摂取した参加者では、血清中の6-オクテノイルカルニチン濃度の低下が確認されました。6-オクテノイルカルニチンは、長鎖アシルカルニチンの酸化によって形成される中鎖アシルカルニチンです[73]。中鎖アシルカルニチンは、炎症誘発経路を活性化することが示されています[74]。6-オクテノイルカルニチンは炎症経路と関連しており[75]、糖尿病や多発性硬化症などの疾患を持つ集団で増加しています[76,77]。 |
| 循環バイオマーカーと代謝物におけるアロニアの全身代謝への影響が確立されているため、腸内細菌叢または微生物代謝の構成に変化が生じる可能性が高いと予想されました。アロニアの摂取により、腸内細菌叢のベータ多様性に影響を与えることなく、アルファ多様性の一側面である微生物の豊富さが減少することがわかりました。腸内でのアルファ多様性が高いと、機能的な冗長性が提供され、専門的な代謝機能が継続されると考えられています [78]。豊富さの減少は、高極性フェノール誘導体の抗菌効果を示している可能性がありますが、多重検定補正後に細菌の豊富さに差が見られなかったため、この効果は可能性が低いようです。介入中にポリフェノールを豊富に含む食品を控えたことが、豊富さの減少に寄与した可能性もあります。ポリフェノールは繊維などの他の栄養素と共存するため、ポリフェノールを豊富に含む食品を摂取しないことで、確立された微生物群集の成長のための習慣的な食事基質プールが制限された可能性があります [79]。健康な成人の習慣的な食事にアロニアジュースを追加することで、糞便中の微生物群集が変化する可能性は低い。しかし、高脂肪食など、微生物が大きく乱れた時期には、アロニアジュースがアルファ多様性のさらなる低下を防ぐ可能性があることが以前に確認されている[22]。総合すると、コミュニティ全体の変化と特定の微生物シグナルの欠如は、アロニアポリフェノールが健康な成人の腸内微生物叢のさまざまな微生物分類群によって代謝されることを示唆している。アントシアニンを代謝するヒト腸内微生物叢の代謝能力と、その結果生じるフェノール誘導体が食後の結果にどのように影響するかを評価するには、さらなる研究が必要である。 |
| 腸内の胆汁酸は、グルコースや脂質の代謝、炎症に影響を及ぼす可能性があるため、この調査では特に注目されました [80]。私たちの分析では、主要な胆汁酸であるケノデオキシコール酸 (CDCA)が、アロニアを摂取した研究参加者で4週間後にアップレギュレーションされたことが示されました。ケノデオキシコール酸は、ファルネソイドX受容体の活性化を含むいくつかの作用を通じて、脂質とグルコースの調節を促進します [81]。以前の研究では、ケノデオキシコール酸が炎症誘発性サイトカインを減らし、酸化ストレスを減らしながら脂質プロファイルを改善できることが実証されています [82,83]。ケノデオキシコール酸レベルは、Akkermansia、Bifidobacterium、Lactobacillu、Desulfovibrioの個体数の増加など、腸内微生物叢の変化とも関連しています [84]。糞便代謝物の非標的分析から、グループ間でデルタ相対濃度が異なる4つの脂質を検出しました。これは、アロニアの効果によるものである可能性があり、ケノデオキシコール酸に誘発された大きな変化や微生物代謝の差によるものである可能性もあります。 |
| 私たちの研究は、アロニアジュースの摂取が人間に及ぼすいくつかの重要な影響を実証しましたが、研究の限界も認識しています。私たちの実験は、アロニアが人間の代謝健康の指標に与える影響を調査するための実現可能性調査として設定されました。参加者コホートの規模はこの研究設計の結果であり、アロニアに対する代謝反応を確認し、さらに特徴付けるには、より大きなサンプルサイズが必要であることを認識しています。研究コホートはまた、ベースラインで代謝的に健康であると特徴付けられており、これは代謝リスク要因を持つ個人と比較して、参加者の研究指標の効果サイズが小さいことを示している可能性があります。薬物動態分析はこの研究の焦点ではなかったため、アロニアの吸収または代謝は評価しませんでした。この分野での今後の研究は、アロニア由来のポリフェノールと健康結果の関連性に関する貴重な洞察を提供する可能性があります。さらに、参加者は研究に参加している間、通常の身体活動パターンを維持するように指示されていましたが、血液検査の採取訪問前の運動活動の変更は研究指標に影響を与える可能性があります。介入期間中にポリフェノール含有量の高い食品を避けるという指示に従わなかった場合も、研究結果に影響する可能性があります。参加者は、提供されたポリフェノール含有量の高い食品リストから食品を摂取した事例を記録するよう求められましたが、記録したからといって研究から除外されることはありません。また、お茶やコーヒーなどのカフェイン入り飲料はポリフェノールの主要な食事源ですが[12]、参加者は介入期間中にこれらの食品の摂取を制限するように指示されませんでした。この決定は、研究の実現可能性と参加者の募集を改善するために意図的に行われました。これらの理由から、介入期間中の食事からのポリフェノール摂取量がグループ間で異なり、研究結果に影響を与えた可能性があります。さらに、サンプル採取前の急性の食事摂取量は記録されていなかったため、この研究では制御できません。 |
| 私たちの研究は、健康なヒトコホートにおけるアロニア誘発性代謝影響を独自に特徴づけています。ポリフェノール摂取の利点は、少なくとも部分的には腸内細菌叢によって緩和されることが知られていますが、ヒトにおけるアロニア摂取に対する微生物分類と代謝の変化を調べた研究は限られています[19]。代謝の健康の空腹時マーカーに加えて、高脂肪食チャレンジに対する食後脂質、グルコース、炎症反応を測定しました。代謝の健康と疾患リスクとの関係における食後代謝の重要性は十分に確立されていますが[30,31,32,33,34]、これらの指標は非急性研究では一貫して分析されていません。これらの指標を研究に含めることで、アロニア投与が代謝の健康に与える影響をより包括的に特徴づけることができます。その他の研究の強みは、自由生活を送る成人に対するホールフードベースの介入の使用であり、これは代謝の健康を改善しようとする個人が行う可能性のある食生活の変化を最もよく特徴づけます。 |
| 5. 結論 |
| 30 日間のアロニアジュースの摂取により、総コレステロールの上昇が予防され、食後血糖反応が改善されました。メタボロミクス分析では、全身代謝の潜在的な変化と炎症性代謝物の減少が示唆されましたが、測定された影響との明確な関連性はありませんでした。微生物の豊富さで測定された微生物アルファ多様性の減少が観察されましたが、これはおそらく、アロニア由来のポリフェノールの影響を分離するための介入中の食事制限の副作用でした。この研究で特定された宿主代謝への有益な変化は、アロニアジュースの摂取が代謝の健康を改善するための効果的な食事戦略である可能性があることを示しています。アロニアを介した健康への影響を調査するさらなる臨床試験が必要であり、アロニアの潜在的な代謝の利点をさらに特定するために、より大きな用量またはより長い介入期間を検討する可能性があります。この情報は、将来の臨床試験の研究設計にさらに情報を提供し、健康を改善するためのポリフェノールベースの食事戦略の開発に必要な新しい洞察を提供します。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Foods. 2024 Sep; 13(17): 2768.に掲載されたPolyphenol-Rich Aronia melanocarpa Fruit Beneficially Impact Cholesterol, Glucose, and Serum and Gut Metabolites: A Randomized Clinical Trialを日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


