ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(アロニア:研究の最前線) |
アロニアベリーエキスはMYD88/NF-kB/P糖タンパク質軸を調節し、 膵臓癌におけるゲムシタビン耐性を克服する |
Yuan Li,Caiming Xu,et al., |
|
|
| 要約 |
膵管腺癌(PDAC)は、主にゲムシタビン(Gem)(訳者注:ゲムシタビンとは、抗癌剤として用いられる含フッ素ヌクレオシドの一種です)ベースの化学療法の有効性が限られていることと、化学療法耐性の獲得が原因で、生存率が低い致死率の高い疾患です。フェノール成分が豊富なアロニアベリー抽出物(ABE)は、最近、抗癌特性と、さまざまな癌における化学療法耐性の克服に役立つ有望な可能性が認識されています。本研究では、膵管腺癌におけるゲムシタビン耐性を克服するアロニアベリー抽出物の可能性を調査し、その抗癌活性の原因となる特定の成長制御経路を特定しました。ゲムシタビン耐性(Gem-R)細胞での一連のin vitro実験を通じて、ゲムシタビンとアロニアベリー抽出物治療の相乗的な相互作用を解明しました。高度なトランスクリプトーム解析とネットワーク薬理学を使用して、ゲムシタビン耐性膵管腺癌細胞における化学療法耐性に関連する主要な分子経路とアロニアベリー抽出物の潜在的な治療ターゲットを明らかにしました。その後、細胞培養研究の知見は患者由来の 3D 腫瘍オルガノイド (PDO) で検証されました。アロニアベリー抽出物 とゲムシタビンの併用療法は、ゲムシタビン耐性細胞の細胞生存率、増殖、遊走、浸潤に顕著な相乗効果と抗癌効果を示しました。トランスクリプトーム解析により、NF-Κb(訳者注:NF-κBは転写因子として働くタンパク質複合体である)シグナル伝達経路とゲムシタビン耐性(p < 0.05) の間に相関関係があり、MYD88 (訳者注:MYD88は、自然免疫や適応免疫の応答において重要な役割を果たす細胞質アダプタータンパク質です)の顕著な上方制御がみられました。さらに、MYD88 は TCGA (訳者注:The Cancer Genome Atlas は、ゲノム配列決定とバイオインフォマティクスを使用して、がんの原因となるゲノム変化をカタログ化するプロジェクトです)コホートの 膵管腺癌患者の全生存率と有意な相関関係を示しました (HR = 1.58、p < 0.05)。MYD88/NF-Κb 経路は、P 糖タンパク質 (P-gp) (訳者注:P糖タンパク質は、細胞膜に存在する分子ポンプで、異物や薬物を細胞外へ排出する役割を担っています。)などの排出トランスポーターを潜在的に上方制御することで化学療法抵抗性に寄与します。我々の研究結果から、アロニアベリー抽出物との併用療法は MYD88 を標的とし、P 糖タンパク質発現を低下させて ゲムシタビン耐性を克服することで NF-κb 経路を抑制することが明らかになりました。最後に、併用療法は腫瘍オルガノイドの数とサイズの両方を減少させるのに非常に効果的であることが証明されました (p < 0.05)。我々の研究は、MYD88/NF-κb/ P 糖タンパク質軸を標的とすることで 膵管腺癌細胞におけるゲムシタビン耐性を克服するアロニアベリー抽出物の能力について、これまで認識されていなかった洞察を提供し、膵管腺癌の治療結果を改善するための安全で費用対効果の高い補助治療戦略を提供します。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 結果 |
| 2.1. アロニアベリー抽出物とゲムシタビンによる治療は、ゲムシタビン耐性膵臓癌細胞で相乗的な阻害を示す |
| 2.2. アロニアベリー抽出物とゲムシタビンの併用は、ゲムシタビン耐性膵管腺癌細胞株における細胞増殖、コロニー形成、遊走、浸潤を阻害する |
| 2.3. アロニアベリー抽出物はゲムシタビンと併用すると細胞アポトーシスを促進する |
| 2.4. MYD88/NF-κB シグナル伝達経路はゲムシタビン耐性膵管腺癌細胞で活性化される |
| 2.5. ゲムシタビンとアロニアベリー抽出物の併用治療は MYD88/TLR3/NF-κB シグナル伝達経路を介して P 糖タンパク質をダウンレギュレーションする |
| 2.6. ゲムシタビンとアロニアベリー抽出物の組み合わせはオルガノイドの成長を抑制しました |
| 3. 考察 |
| 4. 材料と方法 |
| 4.1. 細胞培養 |
| 4.2. ハーブ製剤 |
| 4.3. 試薬 |
| 4.4. Cell Counting Kit-8 アッセイ |
| 4.5. 薬物反応試験 |
| 4.6. コロニー形成アッセイ |
| 4.7. 創傷治癒アッセイ |
| 4.8. 浸潤アッセイ |
| 4.9. アポトーシスアッセイ |
| 4.10. 遺伝子エンリッチメントとパスウェイ解析 |
| 4.11. 細胞質抽出物および核抽出物の分離 |
| 4.12. タンパク質の単離とウェスタンブロット |
| 4.13. 定量的逆転写PCR (qRT-PCR) |
| 4.14. 免疫蛍光アッセイ |
| 4.15. 患者由来の 3 次元腫瘍オルガノイド (PDO) |
| 4.16. 統計分析 |
| 5. 結論 |
本文 |
| 1.はじめに |
| 膵管腺癌(PDAC)は、がん関連死の第3位の原因です。米国における5年全生存率(OS)は、1990年の5%未満から2023年には約10%にまで改善しましたが、膵管腺癌患者の予後は依然として悲惨なほど低いままです。この高い死亡率は、主に膵臓癌の早期診断の難しさ、および現在利用可能な治療オプションの有効性が不十分であることに起因しています[1,2]。ゲムシタビン(Gem)(訳者注:ゲムシタビンとは、抗癌剤として用いられる含フッ素ヌクレオシドの一種です)ベースの化学療法は、1997年に主要な治療オプションとして最初に承認されて以来、膵管腺癌患者の治療を前進させる上で重要な役割を果たしてきました。Nabパクリタキセル(訳者注:ナノ粒子アルブミン結合パクリタキセルまたはnab-パクリタキセルとしても知られるタンパク質結合パクリタキセルは、乳がん、肺がん、膵臓がんなどの治療に使用されるパクリタキセルの注射可能な製剤です)とゲムシタビン塩酸塩の併用は、膵管腺癌で一般的に使用される治療レジメンです[3,4,5,6,7]。しかし、その有効性は、ほとんどの患者で薬剤耐性が出現することによって著しく制限されており、この致死的な悪性腫瘍の効果的な管理における主な課題を浮き彫りにしています[8,9]。FOLFIRINOX(訳者注:フォルフィリノックス療法:5-FU・イリノテカン・オキサリプラチンの3種類の抗がん剤に、5-FUの増強剤であるレボホリナートを加えた多剤併用の治療法です)などの新しい併用療法は、治療結果がわずかに改善される一方で、重大な毒性を示し、高価です。総合的に、これらの知見は、ゲムシタビン耐性の根底にある分子メカニズムについてより深い洞察を得ること、および膵管腺癌における化学療法耐性を克服して患者の転帰を改善するための新しい治療法を調査することの重要性を強調しています。 |
| これまでの研究で、ABC薬物トランスポーター(訳者注:ATP Binding Cassette (ABC)トランスポーターとは、共通性の高いアミノ酸配列を示すATP加水分解酵素活性を担う領域を持つ膜貫通型タンパク質のことです)が膵管腺癌におけるゲムシタビンに対する治療耐性の付与において重要な役割を果たしていることが実証されている[10,11]。これらのうち、P糖タンパク質(P-gp)(訳者注:P糖タンパク質(P-glycoprotein)は、細胞膜に存在する分子ポンプで、異物や薬物を細胞外へ排出する役割を担っています。)は化学療法耐性に寄与する最も認知され確立された調節因子である[12]。ABCB1またはMDR1としても知られるP糖タンパク質は、多剤耐性(MDR)の出現に重要な役割を果たしており、特徴付けられた最初のヒトABCトランスポーターである[13]。P糖タンパク質は、細胞排出機能の調節を通じて化合物の取り込み、分布、および排除に影響を与えることが示されている[14]。さらに、パクリタキセル(PTX)、シスプラチン(CP)、およびドキソルビシン(DOX)を含むいくつかの化学療法剤の有効性は、P糖タンパク質過剰発現によって影響を受ける可能性がある。しかし、キニジンやベラパミルなどのP糖タンパク質阻害剤は毒性と選択性の低さに悩まされており、臨床使用が制限されています[14,15,16]。したがって、より安全で効果的なP糖タンパク質阻害剤の探索は、さまざまな癌において依然として非常に価値があります。 |
| 最近では、様々な天然物やその誘導体が様々な癌に対して多標的の有効性と安全性を持つことから、補完的かつ代替的な治療法として使用できる可能性を探る熱意が高まっています [17,18,19,20,21,22,23,24,25,26,27,28,29]。これらの天然化合物には、クルクミン [22,30,31,32,33,34,35,36]、アンドログラフィス [29,37,38,39]、レスベラトロール [40,41]、高麗人参 [42] などがあり、膵管腺癌を含む様々な癌に対する補助的かつ相乗的な有効性が研究されています。さらに、これらの天然療法のいくつかは、P糖タンパク質、MRP1、MRP2、BCRP の阻害剤であることが確認されており、癌細胞を様々な化学療法薬に対して感受性にすることができます。フラボノイド、クマリン、樹脂、サポニン、テルペノイドなどのさまざまな天然化合物が、P糖タンパク質を阻害することで癌の薬剤耐性と戦う能力について研究されてきました[43]。特に、アロニアベリー(ブラックチョークベリー)は、プロシアニジン、アントシアニン、フェノール酸、およびそれらの類似体などの強力な抗酸化作用と抗炎症作用を持つフェノール化合物が豊富に含まれているため、抗癌作用があると考えられています[44]。以前の研究では、アロニアベリー抽出物の誘導体が乳癌幹細胞の形成を阻害できることも示されており、癌の化学予防の有望な候補となっています[45]。さらに、アロニアメラノカルパ抽出物は、AsPC-1などの膵臓癌細胞株でアポトーシスを誘導することにより、膵管腺癌の増殖を阻害すると報告されています[46]。最近の研究では、膵管腺癌における アロニアベリー抽出物の抗癌効果が示唆されていますが、特に化学療法剤と併用した場合の化学感受性に対する具体的な影響については、ほとんど調査されていません。ほとんどの天然薬が従来の化学療法の補助として使用されていることから、アロニアベリー抽出物には 膵管腺癌における腫瘍の増殖を抑制し、化学療法抵抗性を克服する可能性があるという仮説を立てました。 |
| 現在の研究では、アロニアベリー抽出物の抗癌作用の分子メカニズムと、膵管腺癌における ゲムシタビン耐性を克服する可能性についてさらなる洞察を得るため、膵管腺癌細胞株と患者由来の 3D オルガノイド (PDO) (訳者注:オルガノイドとは試験管の中で幹細胞から作るミニチュアの臓器です)で包括的な一連の実験を実施しました。 |
| 2. 結果 |
| 2.1. アロニアベリー抽出物とゲムシタビンによる治療は、ゲムシタビン耐性膵臓癌細胞で相乗的な阻害を示す |
| 今回の研究では、以前の研究 [34] で説明したように、最初に 2 つの ゲムシタビン耐性 (Gem-R) 細胞株を使用しました。注目すべきことに、ゲムシタビンの半最大阻害濃度 (IC50) は、それぞれの親細胞株と比較して、ゲムシタビン耐性BxPC-3細胞と ゲムシタビン耐性 MIA-PaCa-2 細胞で大幅に高くなりました (図 1A、E)。具体的には、親細胞における ゲムシタビンの IC50 は、それぞれ 680.35 nM と 728.81 nM と測定されました。これらの値は、IC50 値が 1200 nM を超える ゲムシタビン耐性対応細胞である ゲムシタビン耐性 BxPC-3 と ゲムシタビン耐性MIA-PaCa-2 で観察された値よりも大幅に低かったです。次に、アロニアベリー抽出物が ゲムシタビン耐性 膵管腺癌 細胞のゲムシタビン耐性を低下させることができることを突き止めました。その後、さまざまな濃度のアロニアベリー抽出物(0、30、60、90、120 μg/mL) とゲムシタビン (0、400、800、1200 nM) を同時投与し、細胞生存率の相乗的な低下を実証しました。次に、ゲムシタビン耐性BxPC-3 および ゲムシタビン耐性MIA-PaCa-2 細胞株に対する アロニアベリー抽出物の抗癌効果を調査しました。これらの耐性細胞株をアロニアベリー抽出物で 48 時間処理し、CCK-8 アッセイを使用して細胞生存率を評価しました。結果は、アロニアベリー抽出物による用量依存的な細胞生存阻害を示し、IC50 値は ゲムシタビン耐性 BxPC-3 では 110.97 μg/mL、Gem-R MIA-PaCa-2 では 89.17 μg/mL でした (補足図 S1)。最終的に、併用治療におけるゲムシタビン耐性とゲムシタビンの最適投与量比の基準は、両方の用量反応曲線が 50% を超える阻害を達成し、Bliss 相乗効果スコアが 10 ポイントを超えることで確立されました。これらの治療では、90:800 の アロニアベリー抽出物/ゲムシタビン比が両方の細胞株で相乗的な抗癌効果を示しました。 ゲムシタビン耐性BxPC-3 細胞株では、この比率では阻害率が 64.36% であったのに対し、ゲムシタビン耐性処理のみでは -9.23%、アロニアベリー抽出物処理のみでは 45.92% であり、相乗効果スコアは 23.43 でした (図 1B ~ D)。同様に、同じ比率のゲムシタビン耐性MIA-PaCa-2 細胞株では、阻害率が 67.02% であったのに対し、ゲムシタビン処理のみでは 9.53%、アロニアベリー抽出物 処理のみでは 49.6% であり、相乗効果スコアは 12.61 でした (図 1F ~ H)。したがって、以降のすべての実験は、90 μg/mL アロニアベリー抽出物および 800 nM ゲムシタビンの濃度を使用して実施しました。 |
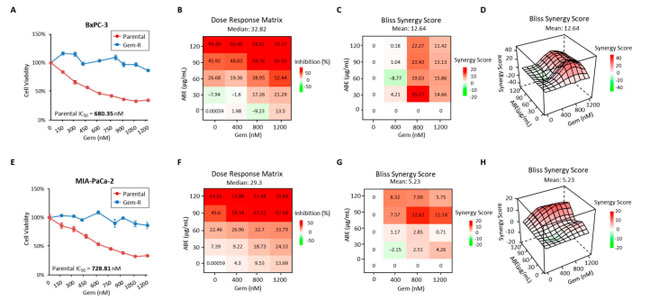 |
図 1 ゲムシタビン耐性膵管腺癌細胞における薬剤耐性の特定と、ゲムシタビンを含む アロニアベリー抽出物による治療は、ゲムシタビン耐性膵管腺癌細胞の増殖を相乗的に阻害します。 親 BxPC-3/Gem-R BxPC-3 (A) および親 MIA-PaCa-2/Gem-R MIA-PaCa-2 (E) の ゲムシタビン に対する IC50 は、CCK8 アッセイを使用して計算されました。エラー バーは平均 ± SD です。アロニアベリー抽出物(0、30、60、90、および 120 μg/mL) と ゲムシタビン(0、400、800、および 1200 nM) の複数の組み合わせで処理したゲムシタビン耐性 BxPC-3 細胞株 (B) および ゲムシタビン耐性MIA-PaCa-2 (F) 細胞株の増殖阻害率。用量反応マトリックスは、CCK8 アッセイを使用して測定されました。 Bliss 相乗効果値は、ゲムシタビン耐性膵管腺癌細胞におけるアロニアベリー抽出物処理後の細胞生存率を評価する 2D 輪郭 (C、G) および 3D 輪郭 (D、H) の薬物用量反応モデルとしてアクセスされた B および F のデータから計算されました。 |
| 2.2. アロニアベリー抽出物とゲムシタビンの併用は、ゲムシタビン耐性膵管腺癌細胞株における細胞増殖、コロニー形成、遊走、浸潤を阻害する |
| ゲムシタビン耐性膵管腺癌細胞におけるゲムシタビンに対する化学感受性を高めるアロニアベリー抽出物の潜在的効果を評価するために、コロニー形成、創傷治癒 (スクラッチ)、浸潤アッセイを含む一連の機能実験を実施しました。アロニアベリー抽出物とゲムシタビンの併用が 膵管腺癌細胞増殖に与える影響を評価するために、ゲムシタビン耐性膵管腺癌BxPC-3 細胞と ゲムシタビン耐性膵管腺癌MIA-PaCa-2 細胞を、ゲムシタビン(800 nM) と アロニアベリー抽出物(90 µg/mL) を単独または併用して 48 時間処理しました。 CCK-8 アッセイを実施したところ、ゲムシタビンとアロニアベリー抽出物の組み合わせが個別の処理よりも有意に優れていることが明らかになりました (ゲムシタビン耐性MIA-PaCa-2 細胞では ゲムシタビンに対して p < 0.01、アロニアベリー抽出物に対して p < 0.01、ゲムシタビン耐性BxPC-3 細胞では ゲムシタビンに対して p < 0.01、アロニアベリー抽出物に対して p < 0.01、図 2A)。さらに、コロニー形成アッセイでは、BxPC-3 細胞 (併用 vs. ゲムシタビン: 倍率変化 [FC] = 0.49、p < 0.01、併用 vs. アロニアベリー抽出物: FC = 0.66、p < 0.01、図 2B) および MIA-PaCa-2 細胞株 (併用 vs. ゲムシタビン FC = 0.22、p < 0.01、併用 vs. アロニアベリー抽出物: FC = 0.37、p < 0.01、図 2B) において、ゲムシタビンとアロニアベリー抽出物の併用によりクローン原性が個別に処理された場合と比較して大幅に低下することが示されました。ゲムシタビン と アロニアベリー抽出物の併用が膵管腺癌細胞の運動性と浸潤能により有意な影響を及ぼしたかどうかを判断するために、スクラッチ傷アッセイとトランスウェルアッセイを実施しました。スクラッチ・ワウンドアッセイでは、BxPC-3(併用 vs. ゲムシタビン:FC = 0.22、p < 0.01、併用 vs. アロニアベリー抽出物:FC = 0.37、p < 0.01、図 2C)および MIA-PaCa-2 細胞株(併用 vs. ゲムシタビン:FC = 0.14、p < 0.01、併用 vs. アロニアベリー抽出物:FC = 0.37、p < 0.01、図 2C)の両方において、ゲムシタビンとアロニアベリー抽出物の併用が個別の処理よりも細胞の移動を有意に阻害することが明らかになりました。トランスウェルアッセイでは、BxPC-3(併用 vs. ゲムシタビン:FC = 0.53、p < 0.01、併用 vs. アロニアベリー抽出物:FC = 0.68、p < 0.01、図 2D)およびMIA-PaCa-2細胞株(併用 vs. ゲムシタビン:FC = 0.20、p < 0.01、併用 vs. アロニアベリー抽出物:FC = 0.27、p < 0.01、図 2D)の両方において、ゲムシタビンとアロニアベリー抽出物の併用により、単独治療よりも浸潤が有意に減少することが示されました。さらに、上皮間葉転換(EMT)およびマトリックスメタロプロテアーゼ関連タンパク質は、腫瘍の転移および浸潤に密接に関連しています。ゲムシタビン、アロニアベリー抽出物、およびそれらの併用による治療後のこれらのタンパク質の発現を調べました。私たちの研究結果では、併用療法により、遊走および転移に関連するタンパク質(MMP9、ビメンチンなど)の発現が大幅に減少する一方で、細胞接着を促進するタンパク質(E-カドヘリンなど、補足図S2)の発現が大幅に増加することが明らかになりました。 |
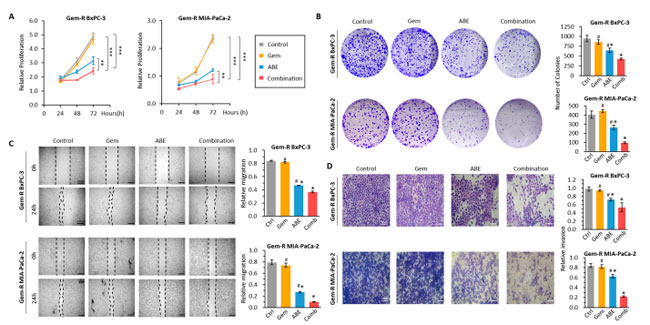 |
図 2 アロニアベリー抽出物は、ゲムシタビン耐性膵管腺癌細胞において抗増殖、遊走、および浸潤効果を示します。 (A) ゲムシタビン、アロニアベリー抽出物、およびそれらの組み合わせで処理したゲムシタビン耐性 細胞株の細胞増殖を比較しました。細胞生存率は、24、48、および 72 時間の時点で CCK-8 アッセイを使用して評価しました。 (B) 48 時間の処理後の各グループのクローン形成性を評価するために、コロニー形成アッセイを実施しました。コロニーの代表的な画像を撮影し、コロニーの数を数えました。 (C) ゲムシタビン、アロニアベリー抽出物、およびそれらの組み合わせで 48 時間処理したゲムシタビン耐性膵管腺癌細胞に対して創傷治癒アッセイを実施しました。創傷および回復領域 (黒線でマーク) の代表的な画像を撮影し、創傷閉鎖率を測定しました。 (D) ゲムシタビン、アロニアベリー抽出物、およびそれらの組み合わせで 48 時間処理したゲムシタビン耐性膵管腺癌細胞に対してトランスウェルアッセイを実施しました。侵入細胞の数は、膜上のランダムに選択された 3 つの領域でカウントされました。 * p は、対照群と比較して p < 0.05 を示します。# p は、併用群と比較して p < 0.05 を示します。** p は、p < 0.01 を示します。*** p は、p < 0.001 を示します。 |
| これまでの結果と一致して、私たちの研究結果は、ゲムシタビンとアロニアベリー抽出物の組み合わせにより膵管腺癌細胞の移動および浸潤能力が大幅に低下することを実証しました。 |
| 2.3. アロニアベリー抽出物はゲムシタビンと併用すると細胞アポトーシスを促進する |
| 膵管腺癌細胞に対するゲムシタビンとアロニアベリー抽出物の併用によるアポトーシス効果を評価するために、まずアネキシン V 結合アッセイを実施しました。解析の結果、ゲムシタビンとアロニアベリー抽出物の併用により、両方のゲムシタビン耐性 細胞株 (図 3A) で、ゲムシタビンとアロニアベリー抽出物の個別投与と比較してアポトーシス率が上昇することが示されました (BxPC-3 細胞株: 併用 vs. ゲムシタビン: 26.55% vs. 8.095%、p < 0.01、併用 vs. アロニアベリー抽出物 26.55% vs. 17.33%、p < 0.01、図 3A、および MIA-PaCa-2 細胞株: 併用 vs. アロニアベリー抽出物: 25.60% vs. 11.29%、p < 0.01、併用 vs. ABE: 25.60% vs. 14.8%、p < 0.01、図 3A)。次に、ウエスタンブロッティング (WB) を実施して、処理後のアポトーシスタンパク質の変化を分析しました。 ウエスタンブロッティング解析では、ゲムシタビンとアロニアベリー抽出物の組み合わせにより、対照および個別の処理と比較して、プロアポトーシスタンパク質である切断されたカスパーゼ 9 および Bax の発現が増加し、同時に抗アポトーシスタンパク質である総 PARP(訳者注:PARP(ポリADP-リボースポリメラーゼ)はDNA一本鎖切断を認識し、この修復に関連する塩基除去修復蛋白を運んでくる運び屋(酵素)です) の発現が減少することが示されました (図 3B) [47,48,49,50,51]。これらのデータを総合すると、ゲムシタビンと アロニアベリー抽出物の組み合わせにより、in vitro での個別の処理と比較して、より多くのゲムシタビン耐性膵管腺癌細胞アポトーシスが誘導されたことが確認されます。 |
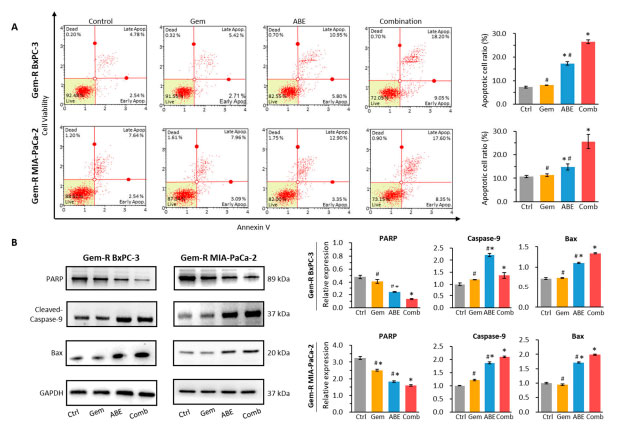 |
図 3 アロニアベリー抽出物はゲムシタビン耐性膵管腺癌細胞で細胞アポトーシスを誘導します。 (A) アネキシン V アッセイを実施し、ゲムシタビン、アロニアベリー抽出物、およびそれらの組み合わせで 48 時間処理したゲムシタビン耐性膵管腺癌細胞上のアポトーシス細胞の割合を測定しました。 (B) ウェスタンブロット分析は、ゲムシタビン、アロニアベリー抽出物、およびそれらの組み合わせで 48 時間処理した ゲムシタビン耐性膵管腺癌細胞に対して実施しました。PARP、カスパーゼ-9、および Bax の相対レベルは、対照 GAPDH(訳者注: グリセルアルデヒド 3-リン酸デヒドロゲナーゼ(GAPDH)は、解糖の第 6 段階を触媒する約 37 kDa の酵素で、グルコースを分解してエネルギーと炭素分子を得る働きをします)発現と比較して定量的に分析しました。 * p は対照群と比較して p < 0.05 を示します。# p は、組み合わせ群と比較して p < 0.05 を示します。 |
| 2.4. MYD88/NF-κB シグナル伝達経路はゲムシタビン耐性膵管腺癌細胞で活性化される |
| 膵管腺癌細胞におけるゲムシタビン耐性のメカニズムを調査するため、公開されている Gene Expression Omnibus (GEO) データセット (GSE148200 および GSE140077) を使用して、親細胞とゲムシタビン耐性膵管腺癌細胞を比較し、遺伝子発現プロファイリング解析を実施しました。MIA-PaCa-2 細胞では 2520 個のアップレギュレーション遺伝子と 1292 個のダウンレギュレーション遺伝子、BxPC-3 細胞株では 1958 個のアップレギュレーション遺伝子と 1984 個のダウンレギュレーション遺伝子が特定されました。これらの遺伝子は、log2FC > ±0.5 および p 値 < 0.05 という特定の基準に基づいて選択されました (図 4A)。その後、両方の細胞株で一貫して同じ方向に制御されている遺伝子に焦点を当て、276 個のアップレギュレーション遺伝子と 111 個のダウンレギュレーション遺伝子を特定しました。これらの著しく調節異常な遺伝子に関連する生物学的経路についてさらに詳しく知るために、KEGGパスウェイ解析を実施しました。この解析は、DAVIDデータベース(https://david.ncifcrf.gov/、2022年8月28日にアクセス)[52,53]を利用して実施しました。上位15のエンリッチメント経路が優先されました(図4B)。これらのうち特に興味深いのは、MYD88/NF-κBシグナル伝達経路であり、これはトップの経路としてランク付けされ、膵管腺癌およびゲムシタビン耐性への潜在的な関与を強調する多数の以前の研究の対象となってきました[54,55,56,57]。さらに、以前の研究では、MYD88の発現は癌組織で増加しており、乳癌、卵巣癌、肺癌などの他の癌におけるパクリタキセル耐性と相関していることが示されています[58,59,60]。 MYD88は、様々な上流リガンド受容体複合体を結びつける重要な分子的役割を果たしているため、膵臓癌の革新的治療の重要なターゲットとなっています[61]。TCGAデータベースから179の原発腫瘍組織と171の正常組織におけるMYD88の発現レベルを評価しました。その結果、正常組織と比較して癌組織でMYD88の発現が有意に高いことが明らかになりました(p < 0.001、図4C)。さらに、カプランマイヤー生存率解析により、TCGAコホートの膵管腺癌患者におけるMYD88発現と全生存率の間に有意な関連があることが判明しました(HR = 1.58、p = 0.045、補足図S3)。最後に、qRT-PCR アッセイにより、ゲムシタビン耐性膵管腺癌細胞株では親細胞株と比較して MYD88 の mRNA 発現が高いことを検証しました (BxPC-3 細胞株: p < 0.05、図 4D、p < 0.05、図 4D)。その結果、私たちの研究結果は、アロニアベリー抽出物とゲムシタビンの組み合わせが MYD88/NF-κB シグナル伝達経路を標的とする可能性を示唆しています。 |
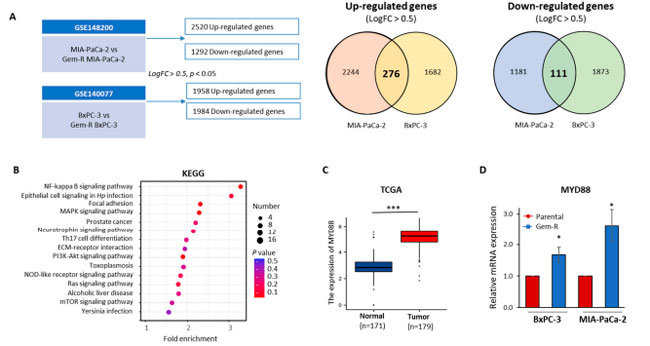 |
図 4 MYD88/NF-κB シグナル伝達経路は、膵管腺癌細胞におけるゲムシタビン耐性と関連しています。 (A) 図は、BxPC-3-R と BxPC-3-Parental 細胞株 (GSE 140077) および MIA-PaCa-2-R と MIA-PaCa-2-Parental 細胞株 (GSE 148200) で差次的に発現した遺伝子を示しています。ベン図は、Log2FC > 0.5 および p < 0.05 を使用して選択された遺伝子の上方制御および下方制御された発現を表しています。 (B) ゲムシタビン耐性膵管腺癌細胞株で上方制御および下方制御された遺伝子の KEGG 経路エンリッチメント解析の散布図。上位 15 の有意にエンリッチされた KEGG経路が優先されました。円は差次的に発現した遺伝子の数を表し、円の色は p 値の範囲を表します。 (C) 選択された遺伝子 MYD88 の発現レベルは、TCGA データセットの膵管腺癌症例を使用して分析されました。 (D) β-アクチン発現を内部コントロールとして使用し、ゲムシタビン耐性および親膵管腺癌細胞株における選択された遺伝子の mRNA 発現レベルを測定するために qRT-PCR アッセイを実施しました。 * p は対照群と比較して p < 0.05 を示します。*** p は p < 0.001 を示します。
|
| 2.5. ゲムシタビンとアロニアベリー抽出物の併用治療は MYD88/TLR3/NF-κB シグナル伝達経路を介して P 糖タンパク質をダウンレギュレーションする |
| TLR1-10 を含む Toll 様受容体 (TLR) ファミリーは、主に免疫細胞で発現する膜貫通糖タンパク質で構成されています。特に、TLR3 と TLR4 は、MYD88 依存性経路と MYD88 非依存性経路の両方を介して転写因子 NF-κB を活性化できます [62]。MYD88/TLR3/NF-κB シグナル伝達経路が、ゲムシタビンとアロニアベリー抽出物の併用治療の重要な標的経路であるかどうかを調べるために、ウエスタンブロッティングを実施し、ゲムシタビン、アロニアベリー抽出物、およびそれらの組み合わせで治療した場合の MYD88/TLR3/NF-κB 軸に関与する主要な遺伝子の発現レベルを評価しました。我々の結果は、ゲムシタビン耐性BxPC-3 および ゲムシタビン耐性MIA-PaCa-2 細胞株の両方において、TLR3、MYD88、および p65 が併用治療によって有意にダウンレギュレーションされたことを明らかにした (図 5A)。さらに、MYD88/NF-κB シグナル伝達経路は、P 糖タンパク質などの排出トランスポーターをアップレギュレーションする能力を持っているため、化学療法抵抗性と関連している [56,63]。P 糖タンパク質のタンパク質発現レベルを評価するために、免疫蛍光分析 (励起: 488 nm、発光: 564 nm) を行った。親膵管腺癌細胞株と比較して、ゲムシタビン耐性細胞株におけるP 糖タンパク質の発現は有意に高く、アロニアベリー抽出物による治療は治療後の両方の膵管腺癌細胞株におけるP 糖タンパク質の発現を減少させた。 |
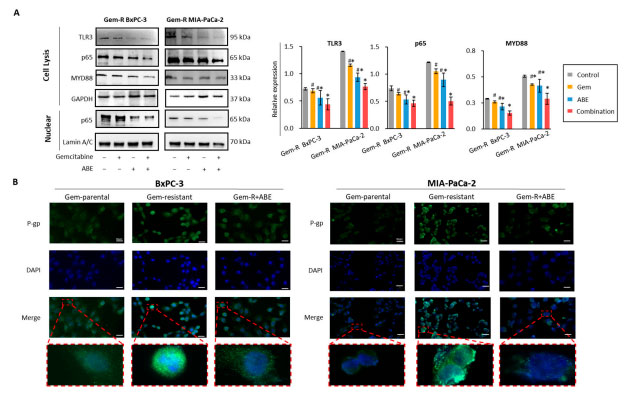 |
図 5 ゲムシタビンとアロニアベリー抽出物の併用処理は、ゲムシタビン耐性膵管腺癌細胞株における MYD88/TLR3/NF-κB/ P 糖タンパク質複合体を調節することが示されています。 (A) ゲムシタビン、アロニアベリー抽出物、およびそれらの併用で 48 時間処理した Gem-R ゲムシタビン耐性膵管腺癌細胞に対してウエスタンブロット分析を実施しました。TLR3、MYD88、および p65 の相対レベルは、対照 GAPDH 発現と比較して定量的に分析しました。 (B) 親膵管腺癌細胞株、ゲムシタビン耐性膵管腺癌細胞株、およびアロニアベリー抽出物で 48 時間処理したゲムシタビン耐性膵管腺癌細胞株におけるP 糖タンパク質発現を評価するために、免疫蛍光アッセイの代表的な画像が得られました。 * p は対照群と比較して p < 0.05 を示します。# p は併用群と比較して p < 0.05 を示します。 |
| 2.6. ゲムシタビンとアロニアベリー抽出物の組み合わせはオルガノイドの成長を抑制しました |
| 3 次元オルガノイド培養システムは、特に薬物反応の調査や治療効果の評価において、がん生物学のさまざまな側面をモデル化するための貴重なツールとして登場しました。この研究では、2 人の患者から得られた腫瘍オルガノイド モデルを使用して、ゲムシタビンとアロニアベリー抽出物の抗腫瘍効果を調べました。予想どおり、結果は、ゲムシタビンとアロニアベリー抽出物の組み合わせがオルガノイドのサイズと数の両方を大幅に抑制することを実証しました (図 6A)。オルガノイドの数に関しては、個別の治療と比較した場合(患者1:組み合わせ対ゲムシタビン:FC = 0.48、p < 0.05、組み合わせ対アロニアベリー抽出物:FC = 0.56、p < 0.05、図6B、患者2:組み合わせ対Gem:FC = 0.65、p < 0.05、組み合わせ対ABE、FC = 0.62、p <0.05、図6B)、組み合わせの方が効果的でした。同様に、ゲムシタビンとアロニアベリー抽出物の組み合わせは、個別の処理と比較して、オルガノイドのサイズを大幅に縮小しました (患者 1: 組み合わせ vs. ゲムシタビン: FC = 0.52、p < 0.05、組み合わせ vs. アロニアベリー抽出物: FC = 0.64、p < 0.05、図 6C、患者 2: 組み合わせ vs. Gem: FC = 0.65、p < 0.05、組み合わせ vs. ABE、FC = 0.73、p <0.05、図 6C)。これらの結果は、ゲムシタビンとアロニアベリー抽出物の組み合わせがオルガノイドの成長を効果的に阻害するという考えを支持し、私たちの細胞培養実験の結果を裏付けています。 |
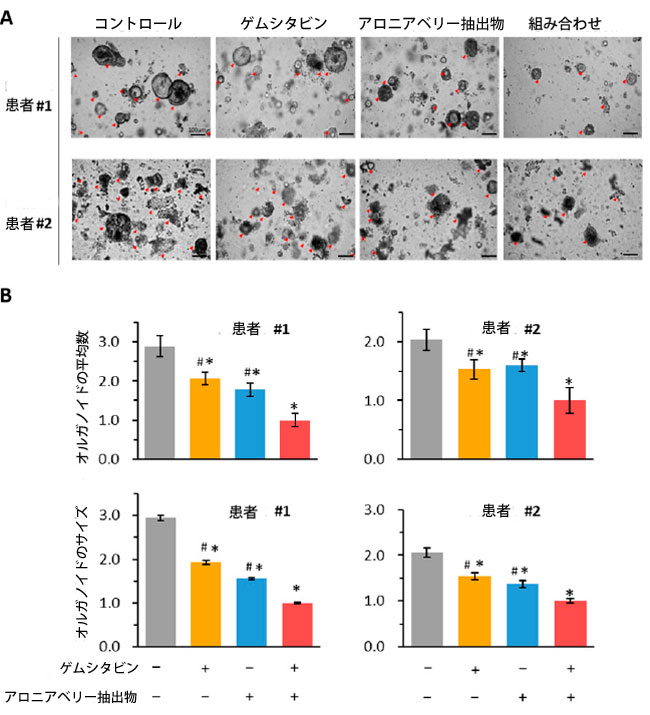 |
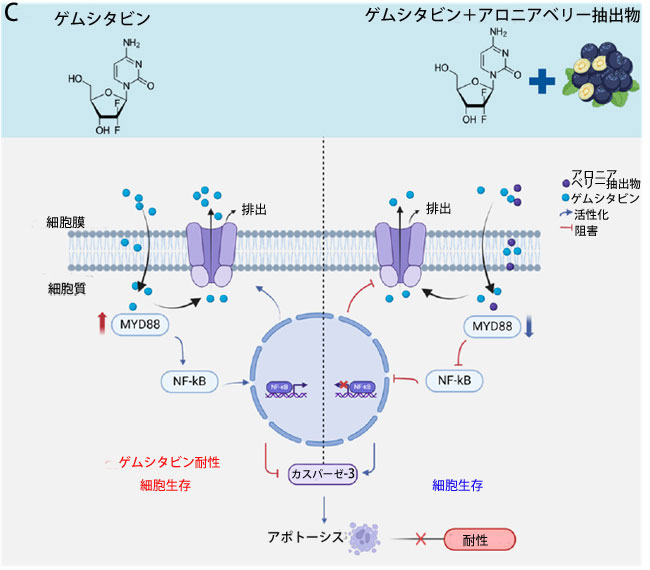 |
図 6 ゲムシタビンとアロニアベリー抽出物 の組み合わせは、膵管腺癌患者由来 3D オルガノイド (PDO) モデルで効果的な抗癌活性を示します。 (A) ゲムシタビン、アロニアベリー抽出物、およびそれらの組み合わせで 48 時間処理した オルガノイドの代表的な画像。 (B) ゲムシタビン、アロニアベリー抽出物、およびそれらの組み合わせで 48 時間処理した オルガノイドの平均数とサイズ。 (C) 膵管腺癌での アロニアベリー抽出物誘導によるゲムシタビン耐性の逆転の模式図。この図は、ゲムシタビンが MYD88/NF-Κb 軸を活性化し、排出トランスポーター (P-gp) をアップレギュレーションして 膵管腺癌細胞の細胞アポトーシスを阻害することで化学療法耐性をもたらすことを示しています (左)。対照的に、アロニアベリー抽出物は膵管腺癌細胞で MYD88 と下流のシグナル伝達経路をダウンレギュレーションすることで化学療法耐性を打ち消すのに役立ちます (右)。 * p は対照群と比較して p < 0.05 を示します。 # pは併用群と比較してp < 0.05を示します。 |
| 3. 考察 |
| 1996 年に FDA が承認して以来、ゲムシタビンベースの化学療法は、卵巣がん、乳がん、非小細胞肺がんなど、さまざまな種類の固形がんの標準治療レジメンとして広く使用されています [64]。ゲムシタビンを組み込んだ併用化学療法戦略は、進行性膵管腺癌に対する好ましい治療法であり続けています [65]。しかし、膵管腺癌患者では化学療法耐性がしばしば発生します。特に、ゲムシタビンに対する耐性の発現は、膵管腺癌患者の効果的な治療管理において重要な臨床的課題を提示しています [66]。いくつかの研究により、P 糖タンパク質、BCRP、MRP1 などの ABC トランスポーターがゲムシタビン化学療法に対する耐性を媒介する上で重要な役割を果たしていることが実証されており [12]、ABC トランスポーター阻害剤が腫瘍細胞を化学療法剤に対して感受性にする能力が広く研究されています。前臨床研究および初期段階の臨床試験ではいくつかの肯定的な結果が観察されているが、ABCトランスポーターを標的とした有効な多剤耐性(MDR)拮抗薬はこれまで臨床使用に承認されていない[67]。 |
| そのため、天然物は、健康な組織における潜在的な抗癌活性と低毒性について研究されており、最近では薬剤耐性を克服することが報告されています[68,69]。私たちの研究では、ゲムシタビンとアロニアベリー抽出物を組み合わせて、アロニアベリー抽出物がゲムシタビン耐性細胞のゲムシタビンに対する感受性を高めることができるかどうかを調べることを目的としました。ゲムシタビンとアロニアベリー抽出物の組み合わせをゲムシタビン耐性細胞に投与した後、私たちの結果は、アロニアベリー抽出物が相乗的にゲムシタビン耐性細胞のゲムシタビンに対する感受性を高めることを明らかにしました。さらに、アロニアベリー抽出物とゲムシタビンの組み合わせは、膵管腺癌細胞でより高いアポトーシス率を誘導しながら、細胞生存率、クローン形成性、移動、および浸潤を効果的に阻害しました。さらに、アロニアベリー抽出物とゲムシタビンの併用治療は、膵管腺癌オルガノイドを阻害する抗癌活性を大幅に強化できることを発見し、細胞培養に基づく私たちの発見を裏付けています。 |
| アロニアベリー抽出物とゲムシタビンに対する感受性を高めるメカニズムを調査するため、公開されている 2 つの Gene Expression Omnibus (GEO)データセットから遺伝子発現プロファイルを解析し、親細胞とゲムシタビン耐性膵管腺癌細胞を比較しました。解析の結果、Toll 様受容体のアダプター分子である MYD88 [70,71,72,73] がゲムシタビン耐性膵管腺癌細胞でアップレギュレーションされていることが明らかになりました。さらに、TLR3 は MYD88 依存性経路と MYD88 非依存性経路の両方を介して転写因子 NF-κB を活性化できることもわかりました [62]。MYD88/NF-κB シグナル伝達経路は、P 糖タンパク質などの排出トランスポーターの発現を上昇させるため、化学療法抵抗性と関連しています [56,74,75]。今回の研究では、腫瘍組織で MYD88 がアップレギュレーションされており、MYD88 の高発現レベルは PDAC の予後不良と相関していることが明らかになりました。第二に、MYD88 も ゲムシタビン耐性細胞株でアップレギュレーションされていることを発見しました。そのため、アロニアベリー抽出物が MYD88 を標的とし、ゲムシタビン耐性細胞株の ゲムシタビンに対する感受性を回復できる可能性があるという仮説を立てました。ウエスタンブロッティングの結果では、ゲムシタビンと アロニアベリー抽出物の併用処理により、MYD88、TRL3、および P65 の発現が抑制されることが示されました。これらの知見は、MYD88/TRL3/NF-κB が アロニアベリー抽出物が ゲムシタビン耐性を克服する能力における重要な経路であるというさらなる証拠を提供します。ただし、本研究では、TLR3 発現の変化が MYD88 に依存しているかどうかを確立する決定的な証拠がありません。さらに、ゲムシタビンとアロニアベリー抽出物の併用処理により、免疫蛍光染色で示されるように、P 糖タンパク質の発現が抑制されました。これらの結果は、アロニアベリー抽出物が 膵管腺癌細胞におけるゲムシタビン耐性を打ち消す標的メカニズムとして MYD88/TRL3/NF-κB/ P 糖タンパク質軸が関与していることを示す説得力のある証拠を示しています (図 6C)。 |
| 最後に、2 人の膵管腺癌患者から得た腫瘍オルガノイド モデルを利用して、ゲムシタビンと アロニアベリー抽出物の抗腫瘍効果を確認しました。ただし、ゲムシタビン耐性オルガノイドは生成していないため、生体内での発見の検証が制限される可能性があります。これらに基づいて、将来的には動物モデルでこれらの発見を検証できると提案します。 |
| 要約すると、私たちの研究は、膵管腺癌におけるゲムシタビン耐性を克服するアロニアベリー抽出物の可能性について貴重な洞察を提供します。私たちのデータは、アロニアベリー抽出物とゲムシタビンの相乗的相互作用の根底にある重要なメカニズムを明らかにしています。これらの発見は、特に ゲムシタビン耐性に直面している患者に対する膵管腺癌の新しい治療法としてのアロニアベリー抽出物の可能性を裏付ける証拠の増加に貢献します。 |
| 4. 材料と方法 |
| 4.1. 細胞培養 |
| 膵管腺癌細胞株 BxPC-3 および MIA-PaCa-2 は、American Type Culture Collection (ATCC、Manassas, VA, USA) から入手しました。細胞株は、1% ペニシリン/ストレプトマイシン (Sigma-Aldrich、St. Louis, MO, USA) および 10% ウシ胎児血清 (Gibco、Waltham, MA, USA) を含む RPMI 培地 (Gibco、Carlsbad, CA, USA) で培養しました。細胞は、加湿環境下、37 °C、5% CO2 で培養しました。接着細胞は、0.05% トリプシン (Invitrogen、Carlsbad, CA, USA) を使用して回収しました。ゲムシタビン耐性MIA-PaCa-2 およびゲムシタビン耐性BxPC-3 は、以前に説明したように、ゲムシタビンの用量を増やしながら細胞を継続的に培養することで確立されました [3]。 |
| 4.2. ハーブ製剤 |
| 本研究で使用したアロニアベリーエキス(Aronia Berry Complex, EuroPharma USA, Green Bay, WI, USA)は、紫から暗赤色までの色を特徴とする粉末製品です。これはアロニアメラノカルパ植物の果実から抽出され、70% エタノールで抽出され、40% ポリフェノール含有量に標準化されています。エキスは最初にジメチルスルホキシドに溶解してストック濃度を作成し、その後、培養培地で適切なレベルにさらに希釈されました。 |
| 4.3. 試薬 |
| ゲムシタビン (Sigma-Aldrich、St. Louis, MO, USA) をジメチルスルホキシド (DMSO、Sigma-Aldrich) に溶解しました。ゲムシタビン(10 μM) および アロニアベリー抽出物 (100 mg/mL) のストック溶液は、安定性と信頼性を確保するために、暗所で -20 °C で慎重に保管しました。これらのストック溶液は、各アプリケーションの前に、完全培養培地で必要な実験濃度に希釈しました。 |
| 4.4. Cell Counting Kit-8 アッセイ |
| Cell Counting Kit-8 (CCK-8) アッセイでは、CCK-8 キット (Dojindo、Kumamoto, Japan) を使用して、以下の指示に従って細胞生存率を測定しました。まず、ゲムシタビン耐性特性を確認するために、ゲムシタビンの用量を段階的に増加させて、ゲムシタビン耐性とその親細胞間の増殖率を比較しました。細胞は、96 ウェル フラット プレートに 5 × 103 細胞/ウェルの密度で播種し、24 時間インキュベートしました。その後、細胞を増加する濃度の Gem (0~1200 nM) で処理しました。48 時間の処理後、10 μL の CCK-8 溶液を各ウェルに加え、2 時間インキュベートしました。製品の吸光度は、Tecan Trading AG (Tecan Trading AG、Männedorf, Switzerland) のマイクロプレートリーダーを使用して、波長 450 nm (OD450) で測定されました。 |
| 次に、アロニアベリー抽出物とゲムシタビンの組み合わせが 膵管腺癌細胞の増殖に及ぼす影響を調べるために、細胞を 96 ウェル プレートに 100 µL の完全培養培地で 2 × 103 細胞/ウェルの密度で播種し、24 時間インキュベートしました。その後、細胞を適切な濃度の ゲムシタビン(800 nM)、アロニアベリー抽出物(90 μg/mL)、およびそれらの組み合わせに曝露しました。細胞増殖率はさまざまな時点で評価されました。 |
| 4.5. 薬物反応試験 |
| ゲムシタビン耐性膵管腺癌細胞株を 96 ウェルプレートに 5 × 103 細胞/ウェルの密度で播種し、薬物投与前に 24 時間培養しました。その後、細胞をさまざまな濃度のゲムシタビン (0、400、800、1200 nM)、アロニアベリー抽出物(0、30、60、90、120 μg/mL)、およびこれらの薬物の 20 種類の異なる組み合わせに 48 時間さらし、相乗効果のある濃度を特定しました。細胞生存率は CCK8 アッセイを使用して評価しました。その後、組み合わせ反応結果のインタラクティブな分析と視覚化のために特別に設計された無料でアクセスできるツールである SynergyFinder 3.0 を使用して相乗効果スコアを計算しました [76]。 |
| 4.6. コロニー形成アッセイ |
| 細胞コロニー形成アッセイでは、6 ウェル フラット プレートに 1 ウェルあたり 5 × 102 個の細胞を播種し、ゲムシタビン、アロニアベリー抽出物、およびそれらの組み合わせで 48 時間処理しました。この処理の後、コロニー形成を 7 ~ 10 日間継続させ、培養培地を 3 日ごとに更新しました。このインキュベーション期間の終了時に、細胞コロニーを PBS (Thermo Fisher Scientific、Fair Lawn, NJ, USA) 中の 4% パラホルムアルデヒドで 30 分間固定し、1% クリスタル バイオレット (Thermo Fisher Scientific) で染色しました。コロニー数は、ImageJ 1.53q ソフトウェアを使用して定量化しました。 |
| 4.7. 創傷治癒アッセイ |
| 細胞創傷治癒アッセイでは、ゲムシタビン、アロニアベリー抽出物、またはそれらの組み合わせで 48 時間処理した後、6 ウェル フラット プレートに 1 ウェルあたり 5 × 105 個の細胞を播種しました。細胞が 80% ~ 90% のコンフルエンスに達した後、滅菌済みの 20 μL マイクロピペット チップを使用して単層に制御されたスクラッチを作成しました。その後、剥離した細胞を除去するために無血清培地で洗浄しました。その後、細胞を完全培地で培養しました。創傷形成から 24 時間後に細胞の写真を撮影し、ImageJ ソフトウェアを使用して創傷閉鎖率を決定しました。 |
| 4.8. 浸潤アッセイ |
| 細胞浸潤アッセイを行うために、8.0 μm ポアポリエステルメンブレンを備えた BioCoat Matrigel 浸潤チャンバー (BD Biosciences、Franklin Lakes, NJ, USA) を使用しました。浸潤アッセイでは、ゲムシタビン、アロニアベリー抽出物、およびそれらの組み合わせで 48 時間処理した後、ウェルあたり 5 × 104 個の細胞を 24 ウェルフラットプレートに播種しました。次に、細胞を無血清培地のインサートに移し、続いて 10% FBS を添加した培養培地を含むウェルに移しました。48 時間の培養期間後、膜の底面に浸潤した細胞を固定し、Diff-Quick 染色キット (Thermo Fisher Scientific) を使用して染色しました。染色された細胞は、後で顕微鏡下で定量化されました。 |
| 4.9. アポトーシスアッセイ |
| アポトーシスアッセイには、メーカーのガイドラインに従って、Muse™ Annexin V および Dead Cell キット (Luminex Corp、Austin, TX, USA) を使用しました。これらの実験では、6 ウェル フラット プレートに 1 ウェルあたり 5 × 105 個の細胞を播種しました。ゲムシタビン、アロニアベリー抽出物、およびそれらの組み合わせで 48 時間処理した後、細胞を回収しました。その後、100 μL の細胞懸濁液を 100 μL の Muse Annexin V および Dead Cell Reagent と混合しました。アポトーシス細胞の割合は、メーカーの指示に従って、Muse™ Cell Analyzer (Millipore Corp、Billerica, MA, USA) を使用して評価しました。 |
| 4.10. 遺伝子エンリッチメントとパスウェイ解析 |
| ゲムシタビン耐性膵管腺癌細胞で差次的に発現する遺伝子を特定するために、Gene Expression Omnibus (GEO) データベース (https://www.ncbi.nlm.nih.gov/geo/、2022 年 8 月 28 日にアクセス) から取得した 2 つの公開データセット (GSE148200 および GSE140077) の遺伝子発現プロファイルが解析されました。さまざまなグループ間での差次的遺伝子発現は、R の「DEseq2」パッケージを使用して調べられ、有意閾値は p < 0.05、Log2FC (フォールド変化の対数) は ±0.5 を超えました。 |
| 京都遺伝子ゲノム百科事典(KEGG)パスウェイ解析は、DAVIDバイオインフォマティクスデータベース(https://david.ncifcrf.gov/、2022年8月28日にアクセス)を使用して実施しました。KEGGパスウェイエンリッチメント解析は、Rの「ggplot2」パッケージを使用して視覚化されました。 |
| 4.11. 細胞質抽出物および核抽出物の分離 |
| ゲムシタビン、アロニアベリー抽出物、およびそれらの組み合わせで48時間処理した後、製造元の指示に従って核抽出キット(Active Motif、Carlsbad, CA, USA)を使用して細胞から細胞質抽出物および核抽出物を分離しました。これらの抽出物を収集し、アリコートで-80 °Cで保存しました。 |
| 4.12. タンパク質の単離とウェスタンブロット |
| ゲムシタビン、アロニアベリー抽出物またはそれらの組み合わせで48時間処理した膵管腺癌細胞株から総タンパク質を抽出しました。細胞はプラスチック製スクレーパーを使用して収穫しました。その後、細胞はプロテアーゼ阻害剤カクテル(Thermo Fisher Scientific)を含む氷冷タンパク質抽出溶液RIPAで溶解しました。タンパク質濃度はBCA法(Thermo Fisher Scientific)を使用して測定しました。等量のタンパク質サンプルを6%または10%のMini-PROTEAN TGXTMプレキャストゲル(BIO-RAD、Hercules, CA, USA)を使用してSDS-PAGEで分離し、次にニトロセルロース膜に転写し、さらに0.45μmのPVDF膜(Cytiva、Marlborough, MA, USA)に転写しました。膜は、0.1% Tween-20 を含むトリス緩衝生理食塩水中の 5% ウシ血清アルブミンで室温で 1 時間ブロックされました。続いて、膜を、抗Bax(1:1000、5023S、Cell Signaling Technology [CST]、Danvers, MA, USA)、抗切断カスパーゼ9(1:1000、9505、CST)、抗PARP(1:1000、9532S、CST)、抗TLR3(1:1000、PA5-20183、Thermo Fisher Scientific)、抗MYD88(1:1000、23230-1-AP、Proteintech、Rosemont, IL, USA)、抗P65(1:1000、3034、CST)、抗ラミンA/C(1:2000、10298-1-AP、Proteintech)、抗ビメンチン(1:2000、10366-1-AP、Proteintech)などの一次抗体でインキュベートしました。抗MMP-9(1:1000、10375-2-AP、Proteintech)、抗E-カドヘリン(1:2000、10375-2-AP、Proteintech)、抗GAPDH(1:2000、5174T、CST)で4°Cで一晩希釈しました。TBSTで3回洗浄した後、膜を対応する抗ウサギ(1:2000、7074、CST)または抗マウス(1:2000、7076、CST)二次抗体で室温で1時間インキュベートしました。ブロットは、Gel Imaging Systems(BIO-RAD)を備えたHRPベースの化学発光キット(Thermo Fisher Scientific)を使用して視覚化しました。GAPDHタンパク質は内部コントロールとして機能し、タンパク質バンドの強度はImageJソフトウェアを使用して定量化しました。 |
| 4.13. 定量的逆転写PCR (qRT-PCR) |
| Qiagen miRNeasy Kit (Qiagen、Hilden, Germany) を使用して全RNA抽出を行いました。続いて、Thermo Fisher ScientificのHigh-Capacity cDNA Reverse Transcription Kitを使用して全RNAを逆転写し、cDNAを合成しました。RT-PCRアッセイは、QuantStudio 6 Flex RT-PCR System (Applied Biosystems、Foster City, CA, USA) を使用して、製造元の指示に従い、Bioline (London, UK) のSensiFAST SYBR Lo-ROX Kitを使用して実施しました。MYD88の相対mRNA発現レベルは、2−ΔΔCt法を使用して決定し、内部コントロールとして機能するβ-アクチンの発現に対して正規化しました。プライマー配列は補足表S1に記載されています。 |
| 4.14. 免疫蛍光アッセイ |
| 免疫蛍光アッセイでは、ウェルあたり 5 × 105 個の細胞をスライド付き 6 cm 平板に播種しました。18 時間の培養期間の後、細胞をゲムシタビン、アロニアベリー抽出物、またはそれらの組み合わせで 48 時間処理しました。その後、スライドを 4% パラホルムアルデヒドで室温で 10 分間固定し、0.5% Triton-X-100 (Thermo Fisher Scientific) で室温で 10 分間透過処理しました。内因性過酸化物を除去するために、スライドを 3% BSA を含む TBST (Tween-20 を含むトリス緩衝生理食塩水) で室温で 1 時間処理し、その後ブロックしました。次に、スライドを抗 P 糖タンパク質ポリクローナル抗体 (1:500、22336-1-AP、Proteintech) とともに 4 °C で一晩インキュベートし、続いて FITC 標識二次抗体 (1:1000、A-21202、Thermo Fischer Scientific) とともに 37 °C で 1 時間インキュベートしました。インキュベーション後、スライドをリン酸緩衝生理食塩水で 5 分間ずつさらに 3 回洗浄しました。最後に、細胞核を DAPI (Thermo Fischer Scientific) で染色し、すべての画像を Carl Zeiss 蛍光顕微鏡 (Zeiss、Oberkochen, Germany) を使用して撮影しました。 |
| 4.15. 患者由来の 3 次元腫瘍オルガノイド (PDO) |
| 膵管腺癌細胞患者からのオルガノイドは、以前の研究 [77] で説明されているように生成されました。機関の倫理委員会の承認を得て、すべての患者から書面によるインフォームドコンセントを得ました。機密性と匿名性を確保するために、患者はヘルシンキ宣言に概説されている倫理ガイドラインに従ってコード化されました。ヒトオルガノイドの場合、ヒト完全栄養培地 (hCPLT) は、製造元の指示に従って、EGF (STEMCELL Technologies) とプロスタグランジン E2 (STEMCELL Technologies) を添加した PancreaCultTM オルガノイド成長培地 (STEMCELL Technologies、Cambridge, MA, USA) で構成されていました。膵管腺癌オルガノイドは、hCPLT 500 μL を含む 40 μL マトリゲル (Corning、Tehama County, CA, USA) で 24 ウェルプレートに播種され、ドームを形成しました。その後、ドームを 4 つのグループに分け、適切な濃度の ゲムシタビン (800 nM)、アロニアベリー抽出物(90 μg/mL)、およびそれらの組み合わせを適用しました。7 日間の処理後、オルガノイドの数とサイズを顕微鏡 (倍率 ×100) で分析し、ImageJ ソフトウェアを使用して測定しました。 |
| 4.16. 統計分析 |
| 統計分析は、SPSS ソフトウェア バージョン 21.0 および GraphPad Prism バージョン 6.0 を使用して実施しました。2 つのグループ間で観察された差の有意性を評価するために、スチューデントの t 検定を採用し、多重比較間の差を評価するために一元配置分散分析 (ANOVA) を使用しました。すべての実験は、独立した生物学的複製で 3 回実施され、データは平均 ± 標準偏差として示されました。有意水準 p < 0.05 は統計的に有意であるとみなされました。 |
| 5. 結論 |
| まず、一連の体系的なゲムシタビン耐性細胞培養と患者由来腫瘍オルガノイド実験を使用して、膵管腺癌細胞におけるゲムシタビン耐性を克服するアロニアベリー抽出物の可能性について新たな知見を提供しました。さらに、MYD88/NF-κB/ P 糖タンパク質軸が膵管腺癌の膵管腺癌耐性において重要な役割を果たしていること、および膵管腺癌細胞における MYD88 とその下流シグナル伝達経路をダウンレギュレーションすることでアロニアベリー抽出物がこの耐性を克服できることを観察しました (図 6C)。これは、アロニアベリー抽出物が 膵管腺癌の治療結果を向上させる有望で費用対効果の高いアプローチであることを示唆しています。これらの結果は、膵臓癌患者の治療効果を改善するための補助療法としての可能性を検証するために、臨床現場でアロニアベリー抽出物をさらに調査する価値があります。次の研究段階では、必要最小限の投与量でゲムシタビン耐性に効果的に対抗するためのアロニアベリー抽出物の最適投与量をさらに調査する必要があります。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Pharmaceuticals (Basel). 2024 Jul; 17(7): 911.に掲載されたAronia Berry Extract Modulates MYD88/NF-kB/P-Glycoprotein Axis to Overcome Gemcitabine Resistance in Pancreatic Cancer. を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


