ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(アロニア:研究の最前線) |
チョークベリー(アロニア メラノカルパ)はヒト前脂肪細胞の炎症を軽減する |
Dale C. Brunelle,a et al., |
|
|
| 要約 |
チョークベリー(Aronia melanocarpa)は、北米原産の果物で、先住民族が食用や慢性疾患の予防に使用しています。本研究の目的は、パルミチン酸誘導性IL-6遺伝子発現、IL-6 DNAメチル化、およびヒストン(H3)アセチル化に対するアントシアニンの抗炎症効果を試験することです。さらに、アントシアニンのシアニジン-3-O-ガラクトシドおよびシアニジン-3-グルコシドがIL-6遺伝子発現に及ぼす影響を調べました。ヒト一次前駆脂肪細胞を、パルミチン酸またはリポ多糖の存在下または非存在下で、チョークベリージュース抽出物、シアニジン-3-O-ガラクトシド、またはシアニジン-3-グルコシドで処理しました。チョークベリージュース抽出物はリポ多糖およびパルミチン酸誘導性IL-6 mRNA発現を阻害しましたが(p < 0.0001)、シアニジン-3-グルコシドおよびシアニジン-3-O-ガラクトシドの効果は小さかった。 チョークベリージュース抽出物処理細胞では、対照細胞と比較してヒト IL-6 プロモーター DNA のメチル化が増加しました (p = 0.0256)。ヒストンのアセチル化はチョークベリージュース抽出物またはパルミチン酸処理による影響を受けませんでした。これらのデータは、チョークベリージュース抽出物がヒト前脂肪細胞におけるヒストンH3修飾に影響を与えることなく IL-6 DNA メチル化を調節することで、パルミチン酸誘発性炎症をエピジェネティックに軽減したことを示しています。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.材料と方法 |
| 2.1. 細胞処理: チョークベリージュース抽出物とパルミチン酸 |
| 2.2. チョークベリー抽出物、シアニジン3-グルコシドおよびシアニジン3-O-ガラクトシド |
| 2.3. 脂肪酸の結合 |
| 2.4. RNA、DNA、タンパク質の分離 |
| 2.5. RT-qPCR 分析 |
| 2.6. DNA メチル化分析 |
| 2.7. ウエスタンブロット |
| 2.8. 統計分析 |
| 3.結果 |
| 3.1. パルミチン酸、チョークベリージュース抽出物、アントシアニンの IL-6 mRNA 発現に対する影響 |
| 3.2. リポ多糖およびシアニジン3-グルコシドの IL-6 mRNA 発現に対する影響 |
| 3.3. リポ多糖、チョークベリージュース抽出物、アントシアニンの IL-6 mRNA 発現への影響 |
| 3.4. パルミチン酸およびシアニジン 3-ガラクトシドの IL-6 mRNA 発現に対する影響 |
| 3.5. パルミチン酸、チョークベリージュース抽出物、アントシアニンの IL-6 mRNA 発現への影響 |
| 3.6. パルミチン酸、チョークベリージュース抽出物、およびアントシアニンの IL-6 DNA メチル化への影響 |
| 3.7. パルミチン酸、チョークベリージュース抽出物、アントシアニンのヒストンH3 アセチル化への影響 |
| 4.考察 |
本文 |
| 1.はじめに |
| 全身性および局所性の炎症の増加は、インスリン抵抗性(Rehman et al., 2017)、2 型糖尿病(T2DM)(Raghav et al., 2018)、関節炎(Prasad et al., 2021)、心血管疾患(Cao et al., 2016)、およびがん(Goh et al., 2016; Nost et al., 2021)の発症と関連しています。肥満(Kunz et al., 2021)、過剰な脂肪組織(Greenberg and Obin, 2006)、および過剰なエネルギー摂取は、全身性炎症を促進します。食事中の生理活性フラボノイドは、全身性炎症および関連する慢性疾患の有病率を低下させる (Zhang et al., 2020; Hang et al., 2018; Maleki et al., 2019) ため、フラボノイドは慢性疾患を予防するための潜在的に重要な食品因子となります。チョークベリー (Aronia melanocarpa) は、ブルーベリー (Mendelova et al., 2022) とブラックベリー (Zapolska-Downar et al., 2012) の両方を上回るフラボノイド含有量が最も高い果物の 1 つです。チョークベリーは歴史的に、カナダのニューファンドランドからアパラチア山脈の南部にかけての五大湖周辺と北米東部に分布しています (Hardin, 1973)。注意深い観察と研究を通じて、先住民はチョークベリーを食品および慢性疾患の予防手段として認識し、利用してきました (Kokotkiewicz et al., 2010)。先住民族の間で慢性疾患の有病率が高いため(Williams et al., 2019; O'Connell et al., 2021)、疾患予防のための実現可能で、文化的に結びついた、持続可能な食事による解決策を決定する必要があります。 |
| 炎症は、免疫反応を活性化する病変または因子(パルミチン酸など)(Roe、2021)によって生じます。免疫細胞と脂肪細胞/前駆脂肪細胞は、自己分泌、傍分泌(訳者注:傍分泌とは、細胞間におけるシグナル伝達のひとつ。特定の細胞から分泌される物質が、血液中を通らず組織液などを介してその細胞の周辺で局所的な作用を発揮することである)、または内分泌様式を介して炎症性サイトカインおよびケモカインを分泌し、局所炎症を引き起こします(Roe、2021)。脂肪細胞は、細胞表面受容体を介して作用する炎症性シグナル伝達分子に反応し、全身性炎症を促進します(Tanaka et al.、2014)。脂肪組織と白色脂肪細胞は、2 型糖尿病 (Rehman et al., 2017)、アテローム性動脈硬化症 (Zheng et al., 2022)、関節リウマチ (Larsson et al., 2023) における炎症および自己免疫プロセスを刺激する炎症誘発性サイトカイン IL-6 (Tanaka et al., 2014) の主要な組織および細胞タイプの供給源の 1 つであることが知られています。チョークベリー抽出物は、IL-6 および IL-8 濃度で測定される炎症を軽減します (Naruszewicz et al., 2007; Iwashima et al., 2019; Appel et al., 2015)。さらに、チョークベリー全体(Pei et al., 2019)、チョークベリージュース(Appel et al., 2015)、チョークベリーに含まれる単離された生理活性化合物(例:アントシアニン)(Goh et al., 2016)の摂取は、いずれも生体内および生体外で抗炎症効果があります。 |
| チョークベリーにはプロシアニジンとアントシアニンが含まれています (Kokotkiewicz et al., 2010)。アントシアニンはチョークベリーのポリフェノールの 25~57% を占め、シアニジン-3-ガラクトシドが最も豊富で、シアニジン-3-グルコシドが最も少ない (Oszmianski and Wojdylo, 2005; Tian et al., 2017)。これらのポリフェノールと他の生理活性化合物は、遺伝子のエピジェネティック(訳者注:エピジェネティクスとは、DNAの塩基配列を変えずに細胞が遺伝子の働きを制御する仕組みを研究する学問です。 「エピ」はギリシャ語で「上」を意味し、「エピジェネティック」は遺伝暗号を超えた要因を意味します。 エピジェネティックな変化とは、遺伝子のオン、オフを制御するためにDNAに起こる化学的な修飾となります)な修飾と遺伝子発現に一般的に影響することが知られているエピジェネティック経路の調節を介して抗炎症効果を発揮します (Kim et al., 2017; Guo et al., 2015; Zhao et al., 2018)。エピジェネティクスの変化は、DNA 配列を変えることなく、DNA、ヒストン、クロマチン、RNAi の改変を通じて遺伝子発現を制御する可逆的かつ遺伝性の修飾です (Perkins et al., 2016)。慢性の低度炎症を制御するエピジェネティックメカニズムを理解することは、代謝性疾患の発症を減らすために重要です (Russo et al., 2017)。炎症に関連する生理学的経路を理解するための研究は豊富にありますが、それらの経路に対するエピジェネティック効果の役割については、まだ解明されていないことがたくさんあります。さらに、食事中の食品全体または個々の生理活性化合物が遺伝子発現にエピジェネティックにどのように影響するかを理解することは、食品が炎症および炎症誘発性の慢性疾患をどのように減らすことができるかについての洞察を提供します (Russo et al., 2017)。 |
| IL-6 を含む炎症性サイトカインの合成は、エピジェネティックに制御されています (Cai et al., 2020; Takahashi et al., 2015)。肥満女性では、IL-6 プロモーターでのメチル化の増加が IL-6 mRNA の発現の増加と一致していました (Na et al., 2015)。ウシ子宮内膜細胞では、リポ多糖によって誘導されると、IL-6 プロモーターでの DNA メチル化の増加を介して IL-6 遺伝子発現が増加します (Wang et al., 2018)。Alpinia katsumadai Hayata 植物に含まれるフラボノイドであるアルピネチンは、IL-6 プロモーター領域の CpG アイランドのメチル化を増加させることで、マウスマクロファージでの IL-6 遺伝子発現を阻害しました (Hu et al., 2020)。したがって、IL-6 はプロモーター領域でエピジェネティックに制御されており、フラボノイド処理によっても制御されています。 |
| 本研究では、この分野におけるこれまでの研究を拡張し、チョークベリー抽出物に含まれるフラボノイドがエピジェネティックに制御されたヒト一次前脂肪細胞に及ぼす抗炎症効果を試験しています。これまでの研究では、フラボノイドとフラボノイド含有量の高い食品がヒト組織の炎症経路に影響を及ぼし、単離されたフラボノイド(フィセチンとシアニジン-3-グルコシド)が転写因子(NF-κB)を制御し(Peng et al., 2018)、炎症性遺伝子発現(IL-6)を減少させることが示されています(Sun and Li, 2018)。チョークベリー抽出物自体を使用した細胞培養研究では、ヒト内皮細胞におけるIL-1B、IL-6、IL-8 mRNAの発現が減少することがわかりました(Iwashima et al., 2019)。別のフラボノイドが豊富な抽出物を使用した臨床試験では、タルトチェリージュースの摂取により炎症マーカーであるケモカインMCP-1とサイトカインTNF-α単球が減少することが実証されました(Martin et al., 2018)。研究では、ヒト細胞株における炎症のエピジェネティック制御に対するフラボノイドの効果も調べられています。ヒト単球では、(−)-エピカテキンがH3K9のエピジェネティック制御とH3K4のジメチル化によって炎症を軽減し(Cordero-Herrera et al., 2017)、一方、ゲニステインはマイクロRNA-155/SOCS1を介してNF-kBシグナル伝達経路を抑制することでヒト臍帯静脈内皮細胞の炎症を軽減しました(Zhang et al., 2017)。 |
| したがって、本研究の目的は、パルミチン酸誘発性炎症の有無における、全果チョークベリージュース抽出物 (CBE) がヒト一次前脂肪細胞 (HPA) における IL-6 DNA メチル化、ヒストン (H3) アセチル化、および IL-6 mRNA 発現に及ぼす影響を明らかにすることでした。さらに、チョークベリージュース抽出物と単離ポリフェノール化合物シアニジン-3-グルコシド(C3G)および シアニジン-3-O-ガラクトシド(C3Gal)の抗炎症能に差があるかどうかを判断するために、ヒト一次前脂肪細胞における IL-6 発現に対するシアニジン-3-O-ガラクトシドおよびシアニジン-3-グルコシドの影響を調べました。全果チョークベリージュース抽出物 (CBE) は H3 アセチル化を増加させて IL-6 mRNA 発現を減少させるという仮説を立てました。さらに、チョークベリージュース抽出物 は IL-6 プロモーター領域のメチル化を減少させ、IL-6 mRNA 発現を減少させるという仮説を立てました。この研究では、チョークベリージュース抽出物がヒト前脂肪細胞におけるリジン残基 K9、K14、および K18 の全体的なヒストン H3 アセチル化に影響を与えることなく、IL-6 プロモーター DNA メチル化を調節することにより、パルミチン酸によって誘導される IL-6 mRNA 発現を減少させるという新しい証拠が提示されています。 |
| 2.材料と方法 |
| 2.1. 細胞処理: チョークベリージュース抽出物とパルミチン酸 |
| 結果 3.1、3.6、3.7 で報告されている実験 1 では、一次皮下ヒト前脂肪細胞 (American Type Culture Collection (ATCC)、Manassas VA、PCS-210-010) を、線維芽細胞増殖キット低血清 (ATCC、PCS-201-401)、ゲンタマイシン、フェノールレッドを含む完全線維芽細胞培地 (cFBM、ATCC、PCS-201-030) に 150,000 細胞/ウェルの密度で播種しました。細胞をチョークベリージュース抽出物(2 μM シアニジン-3-グルコシドに相当、4 μl/ml) で 3 時間前処理し、洗浄した後、4 つの処理方法のいずれかでさらに 3 時間処理しました。対照として 0.17 mM ウシ血清アルブミン (BSA)、2 μM チョークベリージュース抽出物、1.0 mM パルミチン酸+ 2 μM チョークベリージュース抽出物。および 1.0 mM パルミチン酸。結果 3.2 ~ 3.5 に報告されている実験 2 ~ 5 では、シアニジン-3-グルコシド、シアニジン-3-O-ガラクトシドまたはチョークベリージュース抽出物、および パルミチン酸またはリポ多糖 (LPS、1 mg/ml) を 12 ウェル プレートに 80,000 個の細胞密度で播種しました。細胞を収穫し、-80℃ の冷凍庫で保存し、AllPrep DNA/RNA/Protein Mini Kit (Qiagen、Valencia, CA) を使用してゲノム DNA、全 RNA、タンパク質を分離しました。 |
| 2.2. チョークベリー抽出物、シアニジン3-グルコシドおよびシアニジン3-O-ガラクトシド |
| 冷凍された新鮮なチョークベリーは Northwest Wild Foods (Burlington, Washington) から購入し、-20℃で保存しました。冷凍ベリーの抽出物は 100 g のベリーから得られ、ブレンドされ、4℃で 15,000 RPM、5 分間遠心分離されました。ジュース抽出物は小分けされ、-80℃の冷凍庫で保存されました。研究 (Olivas-Aguirre 他、2016) で発表された定量データに基づいて、100 g のチョークベリーには 20 mg の シアニジン-3-グルコシドが含まれていると推定されました。処理に使用する最適なチョークベリージュース抽出物処理濃度 (例: 2 μM シアニジン-3-グルコシド相当または 4 μl/ml) を決定するために用量研究を実施しました。同様に、シアニジン-3-グルコシドと シアニジン-3-O-ガラクトシド(Sigma-Aldrich、Burlington, MA, USA) の両方に 2 μM の濃度を使用しました。 |
| 2.3. 脂肪酸の結合 |
| 68.5 mg のパルミチン酸ナトリウム (PA) (Sigma、Burlington, MA) を 70°C のウォーターバスで 10 ml のダルベックスリン酸緩衝生理食塩水 (dPBS) (ATCC、Manassas VA) に溶解しました。4.534 g の脂肪酸を含まないウシ血清アルブミン (FAFBSA) (Sigma、Burlington, MA) を 17 ml (37°C) のダルベックスリン酸緩衝生理食塩水に溶解し、37°C のインキュベーター内に置きました。ダルベックスリン酸緩衝生理食塩水をウシ血清アルブミンに加えて 20 ml の容量にしました。10 ml のウシ血清アルブミンを 37°C のインキュベーター内のフラスコに移し、6 ml の パルミチン酸ナトリウムを加えました。20 分間結合した後、さらに 2 ml の パルミチン酸ナトリウムを加えて 40 分間結合させました。結合溶液をダルベックスリン酸緩衝生理食塩水で20 mlに希釈し、濃度を1.7 mM ウシ血清アルブミン 1.0 mM パルミチン酸ナトリウムとした。残りの10 ml ウシ血清アルブミンを10 ml ダルベックスリン酸緩衝生理食塩水で希釈し、濃度を1.7 mM ウシ血清アルブミンとした。ウシ血清アルブミン:パルミチン酸ナトリウムおよびウシ血清アルブミン溶液にフェノールレッドを加えた。溶液をLuer-Lok 20 mlシリンジ(Becton, Dickenson and Co.、Franklin Lakes、NJ)およびAcrodisc 0.2 μM Supor膜、低タンパク質結合、非発熱性フィルター(Paul Corp.、Ann Arbor、MI)で安全キャビネット内で濾過し、小分けして-20℃で保存した。 |
| 2.4. RNA、DNA、タンパク質の分離 |
| 実験 1 の細胞はホモジェナイズされ (Retsch MM200 ホモジェナイザー、Retsch、Newtown, PA)、全 RNA、DNA、タンパク質は AllPrep DNA/RNA/Protein Mini Kit (カタログ番号 80004、Qiagen、Valencia, CA, USA) を使用して分離されました。実験 2 ~ 5 のヒト前脂肪細胞からの全 RNA 抽出は、Qiagen の RNeasy 脂質組織ミニキット (Qiagen、Valencia, CA, USA) のプロトコルに従い、Qiacube (Qiagen、Valencia, CA, USA) を使用して行われました。 |
| 2.5. RT-qPCR 分析 |
| RT-qPCR 分析は、以前に発表した研究 (Claycombe-Larson et al., 2022) の方法を使用して実施しました。cDNA は、Quantitect Reverse Transcriptase キット (Qiagen、Valencia, CA, USA) を使用して合成しました。遺伝子発現は、Rox FastStart Universal Probe Master mix (Roche、Indianapolis, IN, USA) を使用して qPCR (ABI Prism 7500 PCR System、Applied Biosystems、Foster City, CA USA) によって測定しました。Hs-IL6 プライマーは、Integrated DNA Technology (IDT、Coralville, IA, USA) から購入しました。
フォワード、5′-GCAGATGAGTACAAAAGTCCTGA-3′、 リバース、5-TTCTGTGCCTGCAGCTTC-3′、 プローブ、5′-56-FAM/CAACCACAA/ZEN/ATGCCAGCCTGCT/3IABkFQ/-3′。 内因性コントロール (18S rRNA) は、Applied Biosystems (Foster City, CA, USA) から購入しました。mRNA 発現は 18S rRNA に正規化されました。ΔΔCT 法を使用して、IL-6 mRNA 発現の倍数変化を計算しました。 |
| 2.6. DNA メチル化分析 |
| 実験 1 から抽出した 200 ng の DNA を、Bisulphite Kit (Qiagen、Valencia, CA, USA) を使用して亜硫酸水素ナトリウムで処理しました。DNA のピロシーケンシングは、PyroMark Q48 (Qiagen、Valencia, CA, USA) を使用して亜硫酸水素ナトリウムで処理した 20 ng の DNA で行いました。 IL-6 プライマー (Qiagen Valencia、CA, USA) (GenBank AF372214.2) は次のとおりでした:
フォワード (位置 -268 ~ -243): 5′-GGGAAAAAAGAAAGTAAAGGAAGAGT-3′ リバース (位置 -81 ~ -54): (ビオチン)5′-AAAACTCATAAAAAAATCCCACATTTAA-3′ シーケンシング プライマー (位置 -255 ~ -240): 5′-GTAAAGGAAGAGTGGTT-3′ |
| 2.7. ウエスタンブロット |
| 実験 1 から抽出したタンパク質について、以前に発表した研究 (Claycombe-Larson et al., 2022) の方法を使用してウエスタンブロットを分析しました。タンパク質(25μg)をNovex WedgeWell 4~20%トリスグリシンゲル(Invitrogen、Thermo Fisher Scientific、Carlsbad, CA, USA)で分離し、0.45μM Immobilon-FL転写膜(Millipore、Burlington, MA, USA)に転写し、Li-Cor Intercept Blocking Buffer(Li-Cor Biosciences、Lincoln, NE, USA)中で、一次抗体として抗ヒストンH3(アセチルK9)抗体ab10812(Abcam、Cambridge, MA, USA)、抗アセチルヒストンH3(Lys14)抗体07~353(Millipore、米国マサチューセッツ州バーリントン)、抗アセチルヒストンH3(Lys18)抗体07~354(Millipore、Burlington, MA, USA)とともにインキュベートした。内因性コントロール。画像は Odyssey M (Li-Cor Biosciences、Lincoln, NE, USA) で現像し、Empiria Studio Software (Li-Cor Biosciences、Lincoln, NE, USA) で解析しました。 |
| 2.8. 統計分析 |
| GraphPad Prism 9 を使用して、qPCR、ウェスタンブロット、DNA メチル化データについて一元配置分散分析を行い、条件間の差の有意性を判断し、その後 Tukey の事後検定を行って、p < 0.05 で有意に差があった条件を判断しました。qPCR データは、平均 ± 平均の標準誤差 (SEM) として示され、対照群が測定単位として機能し、対照群に対する治療の表現は倍数変化として表されます。ウェスタンブロットと DNA メチル化データは、平均 ± SEM として示されます。 |
| 3.結果 |
| 3.1. パルミチン酸、チョークベリージュース抽出物、アントシアニンの IL-6 mRNA 発現に対する影響 |
| 図 1 に示すように、IL-6 発現は、コントロール 1.00 ± 0.92 倍、チョークベリージュース抽出物 1.06 ± 0.94 倍、チョークベリージュース抽出物+ パルミチン酸(PA )21.57 ± 0.91 倍、パルミチン酸627.71 ± 1.17 倍の倍数変化 ± SEM として示されています。コントロール(ウシ血清アルブミン)グループと比較して、チョークベリージュース抽出物(ウシ血清アルブミン+ チョークベリージュース抽出物) で処理した ヒト一次前脂肪細胞細胞では、IL-6 mRNA 発現の増加は検出されませんでした (p = 0.9998)。ヒト一次前脂肪細胞細胞を パルミチン酸で処理すると、コントロール (ウシ血清アルブミン) (p < 0.0001)、チョークベリージュース抽出物(p < 0.0001)、チョークベリージュース抽出物 +パルミチン酸(p = 0.0004) 条件と比較して、IL-6 mRNA 発現が増加しました。 ヒト一次前脂肪細胞細胞細胞を チョークベリージュース抽出物+ パルミチン酸で処理すると、コントロール (p = 0.0011) およびチョークベリージュース抽出物 (p = 0.002) 条件と比較して IL-6 発現が増加しましたが、パルミチン酸処理と比較すると発現は減少しました (p = 0.0004)。 |
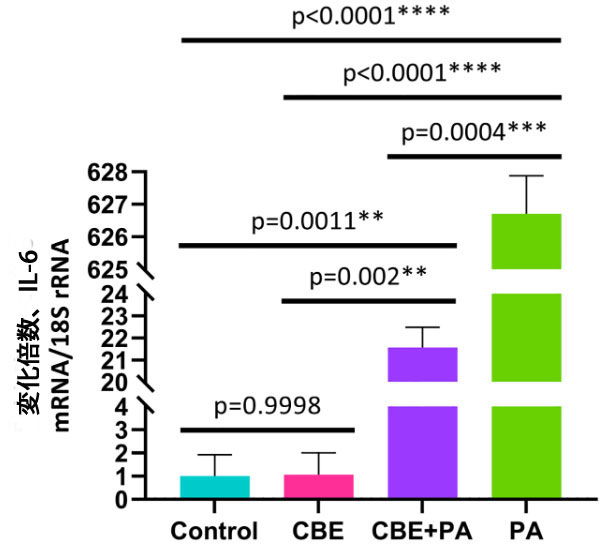 |
図 1. AllPrep 抽出液からの IL-6 発現によって判定した、パルミチン酸誘発炎症に対する チョークベリージュース抽出物処理の効果。 Control:ウシ血清アルブミン、CBE:チョークベリージュース抽出物、PA:パルミチン酸。 ヒト一次前脂肪細胞における IL-6 発現の RT-qPCR 検証結果を、倍数変化 ± SEM として示します。倍数変化はコントロールに対する相対値です。 一元配置分散分析および Tukey の事後検定により、有意な (P < 0.05) 効果が特定されました。RNA は図 3 および 図4と同じソースから抽出しました。 |
| 3.2. リポ多糖およびシアニジン3-グルコシドの IL-6 mRNA 発現に対する影響 |
| 図2A に示すように、IL-6 発現は、コントロール 1 ± 0.33 倍、シアニジン3-グルコシド0.06 ± 1.05 倍、シアニジン3-グルコシド+ リポ多糖 6.43 ± 0.59 倍、リポ多糖 16.28 ± 0.52 倍の倍数変化 ± SEM として表されます。コントロールは、シアニジン3-グルコシドよりも高い発現 (p = 0.0006) を示し、シアニジン 3-グルコシド + リポ多糖(p = 0.0258) および リポ多糖(p = 0.005) よりも低い発現を示しました。シアニジン3-グルコシド条件は、シアニジン3-グルコシド+ リポ多糖 (p < 0.0001) および リポ多糖 (p < 0.0001) 条件よりも低い発現を示しました。シアニジン3-グルコシド+ リポ多糖条件と リポ多糖条件の間には差はありませんでした (p = 0.4537)。 |
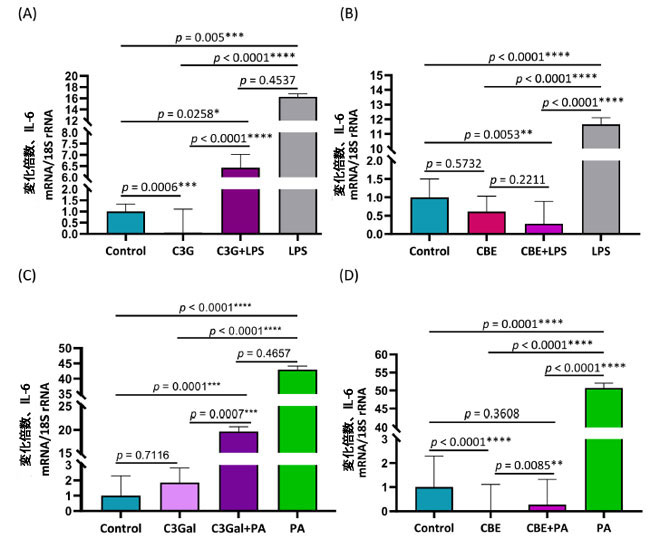 |
図2. IL-6発現で測定したパルミチン酸またはリポ達糖誘発炎症に対するシアニジン3-グルコシド、シアニジン3-ガラクトシド、チョークベリージュース抽出物処理の効果 Control:ウシ血清アルブミン、C3G:シアニジン3-ガラクトシド、LPS:リポ多糖、CBE:チョークベリージュース抽出物、PA:パルミチン酸、C3Gal:シアニジン3-ガラクトシド。 ヒト一次脂肪前駆細胞における IL-6 発現の RT-qPCR 検証結果を、倍数変化 ± SEM として示します。倍数変化はコントロールに対する相対値です。 (A) リポ多糖および シアニジン3-ガラクトシド処理の結果 (B) リポ多糖および チョークベリージュース抽出物処理の結果 (C) パルミチン酸 およびシアニジン3-ガラクトシド処理の結果 (D) パルミチン酸および チョークベリージュース抽出物処理の結果。 一元配置分散分析および Tukey の事後検定により、有意な (P < 0.05) 効果が特定されました。 |
| 3.3. リポ多糖、チョークベリージュース抽出物、アントシアニンの IL-6 mRNA 発現への影響 |
| 図 2B に示すように、IL-6 発現は、コントロール 1.00 ± 0.50 倍、チョークベリージュース抽出物0.61 ± 0.42 倍、チョークベリージュース抽出物+ リポ多糖0.28 ± 0.61 倍、リポ多糖 11.66 ± 0.44 倍の倍数変化 ± SEM として表されます。コントロール グループは、チョークベリージュース抽出物と有意差はなく (p = 0.5732)、チョークベリージュース抽出物 + リポ多糖 より有意に高く (p = 0.0053)、リポ多糖より低かったです (p < 0.0001)。チョークベリージュース抽出物処理は、チョークベリージュース抽出物+ リポ多糖と有意差はありませんでした (p = 0.2211) が、リポ多糖より有意に低かったです (p < 0.0001)。チョークベリージュース抽出物 + リポ多糖処理は、リポ多糖 より有意に低かった (p < 0.0001)。 |
| 3.4. パルミチン酸およびシアニジン 3-ガラクトシドの IL-6 mRNA 発現に対する影響 |
| 図 2C に示すように、IL-6 発現は、コントロール 1 が ± 1.29 倍、シアニジン3-ガラクトシドが 1.85 ± 0.96 倍、シアニジン3-ガラクトシド+ パルミチン酸が 19.66 ± 1.03 倍、パルミチン酸が 43.01 ± 1.09 倍の倍数変化 ± SEM として表されます。コントロール条件はシアニジン3-ガラクトシドと差がなく (p = 0.7116)、シアニジン3-ガラクトシド+ パルミチン酸(p = 0.0001) および パルミチン酸(p < 0.0001) 条件よりも低くなりました。シアニジン3-ガラクトシド条件も シアニジン3-ガラクトシド+ パルミチン酸(p = 0.0007) および パルミチン酸 (p < 0.0001) 条件よりも低くなりました。シアニジン3-ガラクトシド+ パルミチン酸と パルミチン酸条件の間には差はありませんでした (p = 0.4657)。 |
| 3.5. パルミチン酸、チョークベリージュース抽出物、アントシアニンの IL-6 mRNA 発現への影響 |
| 図 2D に示すように、IL-6 発現は、コントロール 1 ± 01.29 倍、チョークベリージュース抽出物0.02 ± 1.09 倍、チョークベリージュース抽出物+ パルミチン酸0.28 ± 1.04 倍、パルミチン酸 50.68 ± 1.36 倍の倍数変化 ± SEM として表されます。コントロール条件は、チョークベリージュース抽出物より高く (p < 0.0001)、パルミチン酸より低く (p = 0.0008) なりましたが、チョークベリージュース抽出物 + パルミチン酸 とは差がありませんでした (p = 0.3608)。チョークベリージュース抽出物は、チョークベリージュース抽出物 + パルミチン酸p = 0.0085) および パルミチン酸 (p < 0.0001) 条件より低くなりました。チョークベリージュース抽出物 + パルミチン酸は、パルミチン酸条件より低く (p < 0.0001) なりました。 |
| 3.6. パルミチン酸、チョークベリージュース抽出物、およびアントシアニンの IL-6 DNA メチル化への影響 |
| 図 3 に示すように、IL-6 のプロモーター領域にある 4 つの CpG 部位の DNA メチル化が分析され、メチル化 CpG の割合をメチル化 CpG と非メチル化 CpG の割合で割った、全体的なメチル化の割合として報告されています。 図 3A、IL-6 プロモーター CpG 部位の位置 1 (-227 シトシン) のメチル化の割合は、コントロールで 7.00 ± 1.2、チョークベリージュース抽出物(CBE)で 8.14 ± 1.64、チョークベリージュース抽出物+ パルミチン酸で 5.78 ± 0.94、パルミチン酸処理で 8.78 ± 0.66 でした。 図3B、IL-6プロモーターCpG部位の位置2(−212シトシン)のメチル化率は、コントロールで5.88 ± 0.97、チョークベリージュース抽出物で6.43 ± 1.40、チョークベリージュース抽出物 + パルミチン酸で4.22 ± 0.10、パルミチン酸処理で5.22 ± 0.80でした。 図3C、IL-6プロモーターCpG部位の位置3(−162シトシン)のメチル化率は、コントロールで14.13 ± 1.46、チョークベリージュース抽出物で14.86 ± 3.50、チョークベリージュース抽出物 + パルミチン酸で11.89 ± 2.31、パルミチン酸処理で14.11 ± 1.45でした。 図 4C、IL-6 プロモーター CpG サイトの位置 4 (-118 シトシン) のメチル化率は、コントロールで 9.63 ± 2.23、チョークベリージュース抽出物で 18.29 ± 2.88、チョークベリージュース抽出物+ パルミチン酸で 10.44 ± 1.32、パルミチン酸 処理で 13.11 ± 1.39 でした。 分散分析では、CpG 位置 1~3 の DNA のメチル化について処理間に差は見られませんでした: 位置 1 (p = 0.2196)、位置 2 (p = 0.4919)、位置 3 (p = 0.7916)。位置 4 の 分散分析では、チョークベリージュース抽出物処理に起因する差 (p = 0.0229) が見られました。 CpG位置4のIL-6プロモーター領域は、コントロール(p = 0.0256)およびチョークベリージュース抽出物+パルミチン酸(p = 0.0418)よりもメチル化されていましたが、パルミチン酸(p = 0.2710)条件ではそうではありませんでした。 |
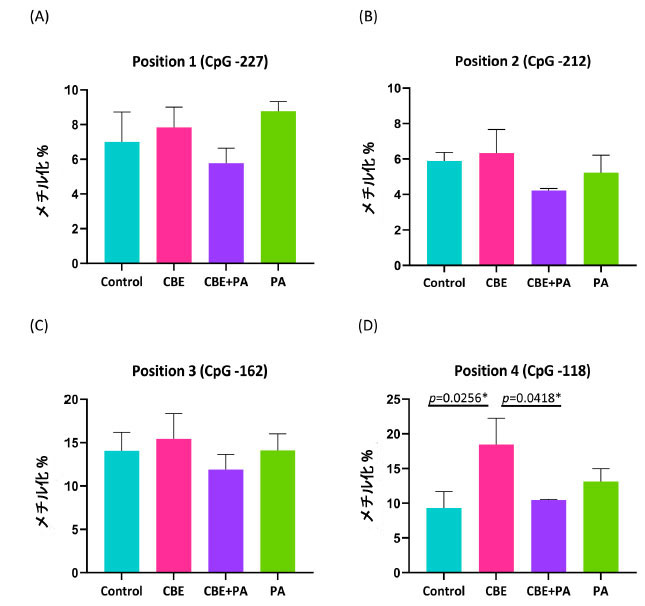 |
図 3. AllPrep 抽出からの IL-6 プロモーター領域の DNA のメチル化に対する チョークベリージュース抽出物および パルミチン酸処理の影響。 Control:ウシ血清アルブミン、CBE:チョークベリージュース抽出物、PA:パルミチン酸。 IL-6 プロモーター領域のピロシーケンス DNA からの 4 つの CpG アイランドのメチル化分析。 (A) 位置 1 (CpG −227)、(B) 位置 2 (CpG −212)、(C) 位置 3 (CpG −162)、(D) 位置 4 (CpG −118)。 一元配置分散分析および Tukey の事後検定により、有意な (P < 0.05) 効果が特定されました。DNA は図 1 および 44 と同じソースから抽出されました。 |
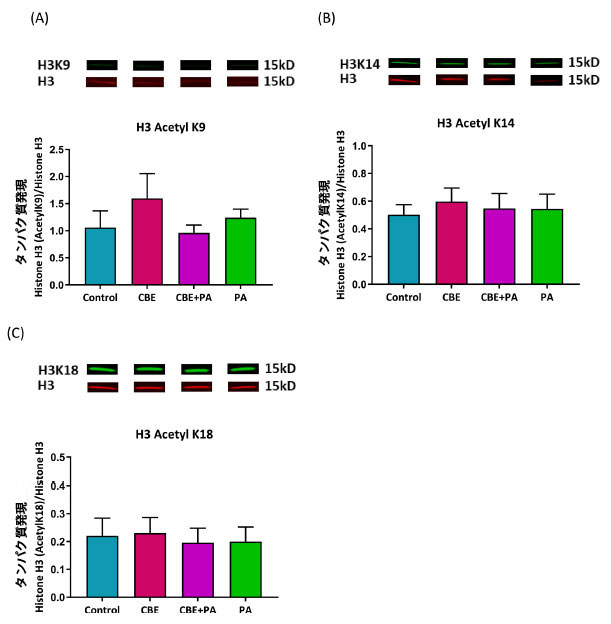 |
図 4. AllPrep 抽出液からのヒストン H3 のアセチル化に対するチョークベリージュース抽出物および パルミチン酸処理の効果。 Control:ウシ血清アルブミン、CBE:チョークベリージュース抽出物、PA:パルミチン酸。 ヒストン H3 に対するタンパク質発現によって決定されたリジン残基 9、14、および 18 のヒストン H3 アセチル化。 (A) H3K9 のアセチル化 (B) H3K14 のアセチル化 (C) H3K18 のアセチル化。 一元配置分散分析および Tukey の事後検定により、有意な (P < 0.05) 効果が特定されました。図 1 および 図3 と同じソースから抽出されたタンパク質。 |
| 3.7. パルミチン酸、チョークベリージュース抽出物、アントシアニンのヒストンH3 アセチル化への影響 |
| チョークベリージュース抽出物、チョークベリージュース抽出物 + パルミチン酸、または パルミチン酸による処理では、対照または互いと比較してアセチル化に違いは見られませんでした。分散分析では、H3K9 (p = 0.5001)、H3K14 (p = 0.9163)、および H3K18 (p = 0.9658) のアセチル化について処理間に違いがないことが示されました。 |
| 4.考察 |
| チョークベリーは北米原産の果物で、食生活に関連する疾患の症状を緩和することが知られているフラボノイド含有量の高さから恩恵を受け、ペミカン(訳者注:ペミカン(英語: pemmican)は、カナダおよびアメリカに先住するインディアンたちの伝統的な食品であり、携行食・保存食の一種である)やお茶として先住民に利用されてきました (Kokotkiewicz et al., 2010)。慢性全身性炎症は、肥満、がん、糖尿病、関節炎などの疾患と関連しており (Rehman et al., 2017; Prasad et al., 2021; Nost et al., 2021; Kunz et al., 2021)、北米の先住民に多く見られます (Williams et al., 2019)。慢性炎症を軽減することが、これらの慢性疾患の発症を防ぐ鍵となる可能性があります。慢性の低度炎症を制御する生理学的、遺伝学的、およびエピジェネティックなメカニズムを理解することは、高齢者やリスクのある集団における慢性疾患リスクの軽減に重要な光を当てる可能性があります。この研究では、チョークベリージュース抽出物が、ヒトの前脂肪細胞におけるヒストン修飾に影響を与えることなく、IL-6 DNAメチル化を制御することで、身体活動誘発性炎症を軽減することを初めて実証しました。 |
| 現在の研究では、位置 4 CpG −118 部位の過剰メチル化 (チョークベリージュース抽出物 処理により誘導、図 3D) により、コントロールと比較して IL-6 遺伝子の発現が減少しました。DNA メチル化を分析した実験 (図 1) では観察されませんでしたが、チョークベリージュース抽出物処理により他の 2 つの実験 (図 2B および D) では IL-6 発現が減少しました。私たちの結果は、IL-6 遺伝子の −240 と −80 領域の間にある 4 つの CpG 部位が過剰メチル化され、非がん細胞と比較して IL-6 発現が低下したというヒト肺がん細胞モデル研究と一致しています (Tekpli ら、2013)。さらに、全身性エリテマトーデス(SLE)患者および健康な成人のT細胞を5-アザシチジンで処理したところ、IL-6 mRNA発現の増加と、-419~-115のCpGアイランドでのメチル化の減少が見られました(Mi and Zeng、2008)。抗炎症分子であるα-リポ酸で処理したSK-N-BEヒト神経芽細胞腫細胞では、IL-6 mRNA発現の減少と、IL-6遺伝子領域1446~1648のCpG部位、および上流のIL-6プロモーター領域-245~-43でのCpG部位の高メチル化が見られました(Dinicola et al.、2017)。全体として、これらの知見は、IL-6プロモーターのこの領域のCpGは、高メチル化されると転写を抑制する可能性があり、本研究ではチョークベリージュース抽出物がIL-6発現に対する保護効果を発揮している可能性があることを示唆しています。 |
| この保護効果は、チョークベリージュース抽出物処理と チョークベリージュース抽出物+ パルミチン酸処理間の IL-6 mRNA 発現の差に見られます (図 1)。 どちらの場合も、チョークベリージュース抽出物の前処理により位置 4 の過剰メチル化が起こります。 その後のチョークベリージュース抽出物+ パルミチン酸処理により、パルミチン酸は位置 4 をコントロール レベルまで脱メチル化し (図 3D)、パルミチン酸処理のみの場合と比較して IL-6 mRNA 発現が大幅に減少します (図 1)。 |
| しかし、パルミチン酸処理では位置 4 の CpG サイトがわずかにメチル化されており、これはメチル化の増加によって転写が増加し、チョークベリージュース抽出物にはメチル化の増加をもたらす揮発性成分があることを示している可能性があります (Kokotkiewicz ら、2010)。 前述のように、パルミチン酸が存在すると、位置 4 は脱メチル化されます。 したがって、位置 4 のメチル化の増加がチョークベリージュース抽出物の揮発性成分の結果である場合、観察された減少ではなく、チョークベリージュース抽出物または パルミチン酸と比較して、チョークベリージュース抽出物 + パルミチン酸処理でのメチル化率が高くなるはずです。 チョークベリージュース抽出物によって引き起こされるメチル化は、パルミチン酸 とは異なる経路で作用する可能性があります。 |
| 例えば、リポ多糖は RAW 264.7 マクロファージで活性化 B 細胞の核因子 κ-軽鎖エンハンサー (NF-κB) 経路を活性化することで IL-6 転写を誘導しましたが、その後のチョークベリー濃縮物による処理は転写因子 NF-κB を阻害し、用量依存的に IL-6 発現を減少させました (Appel et al., 2015)。パルミチン酸は NF-κB 経路を活性化することで 3T3-L1 脂肪細胞で IL-6 発現を増加させ、アントシアニン抽出物による前処理はパルミチン酸誘導 NF-κB 経路を阻害しました (Muscara et al., 2019)。転写因子 p65 は NF-κB 経路の他の転写因子とともに IL-6 のプロモーター領域に結合して発現を増加させます (Kobayashi et al., 2016)。核因子E2関連因子(Nrf2)経路の活性化は、IL-6のすぐ近くでNrf2が結合することによってIL-6の発現を減少させ、IL-6のP65活性化を妨害し、RNAポリメラーゼIIのリクルートを阻害することによって阻害効果をもたらしますが、そのメカニズムは解明されていません(Kobayashi et al., 2016)。チョークベリーは、Nrf2の発現を増加させると報告されているフラボノイドシアニジン3-グルコシド(Fratantonio et al., 2015; Ferrari et al., 2016)、およびシアニジン3-ガラクトシッド(Cui et al., 2021)でNrf2経路を活性化する可能性があります。したがって、位置 4 のメチル化は、転写因子と、おそらくヌクレオチド -123 から -119 の間に結合する特異性タンパク質 1 (SP1) を阻害することによって パルミチン酸誘導性 IL-6 転写から保護するために Nrf2 経路によって使用されるメカニズムの 1 つである可能性があります (Tanaka et al.、2014)。 |
| フラボノイドシアニジン3-グルコシドおよびシアニジン3-ガラクトシッドは、チョークベリージュース抽出物に多く含まれるフラボノイドの 1 つです (Oszmianski および Wojdylo、2005)。これらは、チョークベリージュース抽出物の他のフラボノイドと組み合わせることで、IL-6 発現を著しく阻害する可能性があります。これは、私たちのデータによって裏付けられています。2 μM シアニジン3-グルコシドは、リポ多糖処理による IL-6 発現を部分的に減少させることがわかりました (図 2A)。また、2 μMシアニジン3-ガラクトシッド は、パルミチン酸による IL-6 発現を部分的に減少させることもわかりました (図 2C)。以前の研究では、5 μM および 10 μM のシアニジン3-グルコシド処理により、パルミチン酸によって誘導された 3T3-L1 脂肪細胞での IL-6 発現が用量依存的に阻害され、パルミチン酸処理に比べて 5 μM では約 1.7 倍、10 μM では約 2.2 倍の発現減少が見られました (Molonia ら、2020)。粒子状物質(<10 μM)に曝露されたマウスマクロファージ細胞は、その後のシアニジン3-ガラクトシッド処理によりIL-6発現を誘導し、高濃度(200および400 μg/ml)では発現の減少が観察されたが、低濃度(100 μg/ml)では減少は見られなかった(Cui et al., 2021)。本研究で2μM用量のシアニジン3-グルコシドおよびシアニジン3-ガラクトシッドがIL-6 mRNA発現に影響を及ぼさなかったという結果は、有効性には低い閾値があるというこれまでの研究結果と一致しているが、この低い閾値を決定するにはさらなる研究が必要である。しかし、シアニジン3-グルコシド + リポ多糖におけるIL-6発現は、リポ多糖単独と比較して2.5倍低く、シアニジン3-ガラクトシッド + パルミチン酸はパルミチン酸単独と比較して2.2倍低く、これは5 μM(1.7倍低い)および10 μM(2.1倍低い)で報告された値と同等である。これは、私たちのデータのばらつきが大きいためである可能性がある。今後の研究では、シアニジン3-グルコシドとシアニジン3-ガラクトシッドがチョークベリーに含まれる他のアントシアニンと組み合わせて IL-6 発現を低下させる相加効果があるかどうかをテストする価値があるかもしれません。 |
| ウシ乳腺上皮細胞(MAC-T)では、リポテイコ酸とペプチドグリカンの処理により、ヒストンH3K9とH3K14の全体的なアセチル化が減少することが示されています(Wu et al.、2020)。アルキル化剤で処理したヒトリンパ腫細胞(HBL-2)では、ヒストンH3K18の全体的な高アセチル化が誘導されています。ただし、この研究では、リジン残基H3K9、H3K14、およびH3K18でのヒストンH3の全体的なアセチル化は処理間で有意差がなく、IL-6領域に特異的なヒストンをターゲットとするより具体的な分析が必要になる可能性があります(図4)。クロマチン免疫沈降法(ChIP)を用いた研究は、IL-6プロモーターに特異的なヒストンH3のアセチル化を決定するために使用されてきた(Wada et al., 2014; Hu et al., 2017; Zhang et al., 2015)。リポ多糖で処理したマウスマクロファージでは、クロマチン免疫沈降法分析により、H3およびH4のアセチル化がIL-6発現と正の相関関係にあることが示された(Zhang et al., 2015)。パラクォートで処理したマウスマクロファージでは、クロマチン免疫沈降法-qPCRにより、IL-6プロモーターでのH3K4me3およびH3K9acレベルの上昇が、IL-6の発現増加と一致していることが示された(Hu et al., 2017)。また、クルクミンで処理したヒト関節リウマチ滑膜線維芽細胞では、クロマチン免疫沈降法分析により、ヒストンH3のアセチル化の増加がIL-6産生の増加につながることが判明した(Wada et al., 2014)。したがって、今後の研究では、クロマチン免疫沈降法分析を使用して、IL-6 発現との相関関係におけるチョークベリーのヒストン H3 のアセチル化とメチル化への影響をさらに明らかにする必要があります。 |
| ここでの結果は、チョークベリーが IL-6 mRNA 発現を低下させることで炎症を軽減するという以前の研究を裏付けるものです (Iwashima et al., 2019; Appel et al., 2015)。さらに、私たちの結果は、アルピネチンが RAW246.7 マウスマクロファージの IL-6 プロモーター領域の DNA メチル化によって IL-6 mRNA 発現を制御するという報告と一致しています (Hu et al., 2017)。アルピネチンは、IL-6 プロモーター領域 -500 から -2500 にある複数の CpG サイトを含む 2 つの CpG アイランドでメチル化を増加させました (Hu et al., 2017)。一方、私たちの結果は、チョークベリーがヒト前脂肪細胞の位置 4 にある 1 つの CpG サイト -118 でメチル化を増加させることを示しました。 |
| チョークベリージュース抽出物とパルミチン酸が CpG の位置 4 (-118) のメチル化と IL-6 mRNA 発現の両方に及ぼす相互作用の提案されたメカニズム (図 5) には、それぞれ Nrf2 経路と NF-kB 経路の両方の活性化が含まれます。チョークベリージュース抽出物による前処理中、Nrf2 経路はフラボノイド (シアニジン3-グルコシド、シアニジン3-ガラクトシッド) および/またはポリフェノール群の別のフラボノイドによって活性化されます。Nrf2 経路の活性により位置 4 のメチル化が増加し、SP1 転写因子の結合が阻害されるほか、以前に報告されているように RNA ポリメラーゼ II およびその他の転写因子が阻害され、IL-6 発現が減少します (Kobayashi ら、2016)。処理中にパルミチン酸が追加されると、NF-kB 経路と IL-6 転写が誘導され、位置 4 のメチル化が減少すると仮定します。チョークベリージュース抽出物とパルミチン酸の両方が存在する場合、各化合物は IL-6 メチル化と mRNA 発現の両方に拮抗的に作用する経路を誘導し、パルミチン酸処理のみの場合と比較して、位置 4 のメチル化が減少し、IL-6 発現が減少します。 |
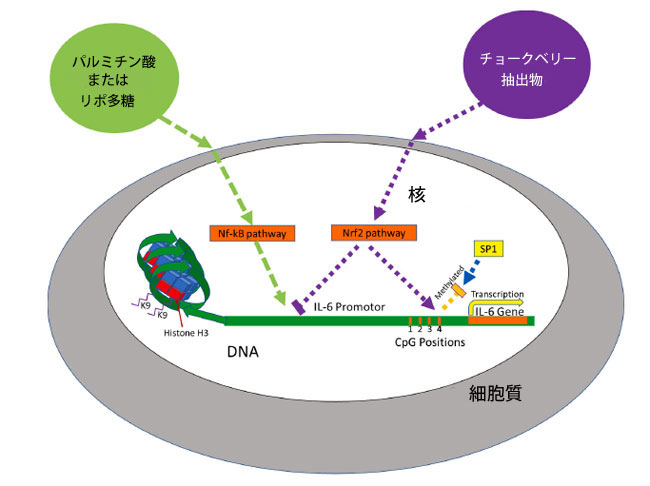 |
| 図 5. チョークベリージュース抽出物と パルミチン酸の相互作用 チョークベリー抽出物処理は、Nrf2 経路の転写を誘導し、NF-kB 経路を妨げ、CpG 位置 4 のメチル化を増加させます。位置 4 のメチル化は SP1 結合を阻害します。パルミチン酸処理は、NF-kB 経路による IL-6 遺伝子の転写を誘導しますが、チョークベリージュース抽出物が存在すると IL-6 発現が減少します。 |
| この研究にはいくつかの限界があります。この研究は試験管内で行われたため、生体内での相互作用に影響を与えるさまざまな生理学的要因がある可能性があります。IL-6 プロモーターのメチル化は観察されましたが、これらの効果を誘発する追加の特定のエピジェネティック制御因子はまだ解明されていません。さらに、チョークベリージュース抽出物がヒト前脂肪細胞で NF-kB と Nrf2 の両方の経路を調節する正確なメカニズムをさらに調査する必要があります。 |
| 結論として、チョークベリーが先住民に慢性疾患の予防に与えた健康効果は、その抗炎症作用によるものと考えられる。IL-6 などの炎症遺伝子のエピジェネティックな変化は、チョークベリーを含む食事の間、その保護を維持する可能性がある。本研究では、初代ヒト前脂肪細胞における IL-6 mRNA 発現によって示されるように、チョークベリージュース抽出物はパルミチン酸または リポ多糖によって引き起こされる炎症を軽減するのに有効であることが実証された。しかし、シアニジン3-グルコシドおよびシアニジン3-ガラクトシド は 2 μM の濃度で IL-6 発現を部分的にしか阻害しないため、チョークベリージュース抽出物の他の生理活性成分が IL-6 遺伝子発現の減少に関与している可能性がある。また、リジン残基 K9、K14、および K18 の全体的なヒストン H3 アセチル化は、パルミチン酸またはチョークベリージュース抽出物のいずれかが IL-6 遺伝子発現に影響を与えることを示さず、より具体的な分析が必要である。ここでのデータは、チョークベリージュース抽出物がヒト前脂肪細胞における IL-6 プロモーター領域のエピジェネティックな修正効果を持ち、パルミチン酸誘発性 IL-6 発現の低下に寄与する可能性があることを示しています。ただし、CpG -118 でのメチル化の増加が パルミチン酸処理に対する保護効果としてどのように作用するかについては、さらに解明する必要があります。チョークベリージュース抽出物とパルミチン酸の相互関係におけるエピジェネティックな効果については、さらに解明する必要があります。結果として、チョークベリー ジュースの摂取量を増やすことは、慢性疾患を引き起こす可能性のある炎症を軽減するための実行可能な食事療法になる可能性があります。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、J Funct Foods. 2024 Jan; 112: 105947.に掲載されたChokeberry reduces inflammation in human preadipocytes.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


