ケフィアライフをお勧めする中垣技術士事務所

HOME>委託研究>ジペプチジルペプチダーゼIVとα-グルコシダーゼ阻害によるアロニア果汁摂取マウスにおける血糖値と肥満の改善
| 委託研究 |
|
この研究はJournal of Nutritional Biochemistry 31 (2016) 106-112に掲載された英文 論文を日本語に訳したものです。 |
ジペプチジルペプチダーゼIVとα-グルコシダーゼ阻害による |
北海道大学大学院薬学研究院特任講師 |
博士(医学)山根拓也 |
1.はじめに
アロニアベリーは脳卒中や高血圧の治療のための伝統薬としてロシアや東ヨーロッパで使用されてきた[1]。アロニアベリーはアントシアニン、プロシアニジンそしてフラボノイドを含むファイトケミカルを高い割合で含んでいる。アロニアベリーにおける活性化合物の濃度はクランベリーに比較して5倍以上高い[2,3]。アロニアベリーはまた、様々な健康効果を有しており[4]、そしてアロニア果汁は糖尿病のヒトやラットにおいて、血漿中の血糖濃度に役立つ効果があり[5,6]、また糖尿病のヒトにおいて、総コレステロールと脂質レベルに有益な効果があると報告されている[7]。さらにヒト臨床研究の結果はアロニア果汁が肥満症の治療に役立つことを示唆しています[8]。最近、私たちはアロニア果汁にジペプチジルペプチダーゼIV (DPP IV) の阻害効果があり、その阻害物質はシアニジン 3,5-ジグルコシドであることを同定した[9]。DPP IV (EC 3.4.14.5) はセリンプロテアーゼであり[10]、グルコース依存性インスリノトロピックポリペプチド(GIP)やグルカゴン様ペプチド-1 (GLP-1)、そしてインスリン分泌の減少はDPP IVによるインクレチンの不活化によって誘導される[11-14]。DPP IV阻害剤は糖尿病患者における血漿中の血糖レベルにおいて有用な効果を有しており[15]、DPP IV阻害剤はいくつかの植物において見出されている[16]。本研究において、私たちは体重、白色脂肪組織の重量そして血糖値がアロニア果汁を摂取した糖尿病モデルマウスにおいて減少することを見出した。DPP IVとα‐グルコシダーゼ活性はアロニア果汁を摂取した糖尿病モデルマウスにおいて阻害された。これらの結果はアロニア果汁が糖尿病状態下においてDPP IVとα‐グルコシダーゼの両方の阻害を通して糖尿病や肥満の改善効果を有していることを示唆している。 |
2. 実験方法と材料
2-1. 実験に用いた物質
2-2. 動物実験 C57BL/6JmsSlcとKK-Ayオスマウスは4週齢で日本SLCから購入した。すべてのマウスは通常食を食べさせ、2週間後にC57BL/6JmsSlcとKK-Ayマウスはそれぞれ5匹ずつ、2つのグループに分けた。1つのグループには水を摂取させ(control group)、もう一方のグループにはアロニア果汁を摂取させた(aronia group)。アロニア果汁は自由摂取させた。28日後に血清を採取し、肝臓や小腸を摘出し、重量を測定した。
2-3. 血糖値測定 血糖値は小型血糖測定装置グルテストネオアルファ(パナソニックヘルスケア)を用いて測定した。
2-4. プロテアーゼ活性測定 10 ulの10 mM 基質、100 ulの0.5 M Tris-HCl, pH 9.0、5 ul の酵素溶液を混合し、水で1mlとした溶液を37℃で30分間インキュベートし、2 mlの0.2 M 酢酸を加えて反応を止めた。酵素活性はAMCの蛍光検出(励起波長380 nm, 蛍光波長440 nm)で測定した。
2-5. α‐グルコシダーゼ活性測定 10 ulの20 mM 基質、100 ulの150 mM リン酸ナトリウム (pH 7.0)、10 ulの酵素溶液を加え、水で300 ulとした。基質にはp-nitrophenyl-α-D-glucopyranosideを用いた。37℃で30分間インキュベートした後、PNP-glycosideを405 nmで定量した。
2-6. インスリン測定 血中インスリン濃度はマウスインスリン測定キットを用いて測定した。
2-7. RT-qPCR マウスの小腸からRNAを抽出し、逆転写を行った。得られたcDNAを鋳型として定量PCRを行った。プライマー配列はTable 3に示した。
2-8. 統計計算 データは平均値±SEであらわし、Student’s t testとTukey-Kramer testを用いて統計計算を行った。
2-9. 倫理声明 すべての動物実験はNational Institutes of Health Guide for the Care and Use of Laboratory Animalsに従い、プロトコルは北海道大学動物実験委員会により承認を受けて行われた(許可番号:15-0009)。
|
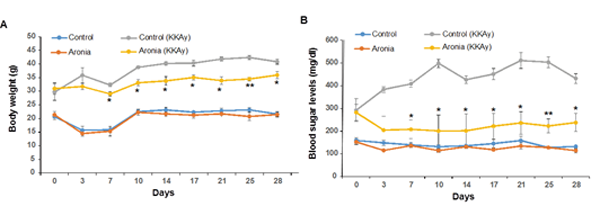
3. 結果 3-1. 体重と血糖値におけるアロニア果汁の有益な効果 体重と血糖値に対するアロニア果汁の効果を調べるために、3-4日おきにマウスの体重と血糖値を測定した。その結果、Fig. 1Aに示すようにアロニア果汁を摂取したKK-Ayマウスでは体重が顕著に減少し、28日目にはアロニア果汁を摂取していないKK-Ayマウスと比較して12%体重が減少していた。血糖値についてもアロニア果汁を摂取したKK-Ayマウスで顕著に減少が見られ、28日目にはアロニア果汁を摂取していないKK-Ayマウスと比較して45%血糖値が減少していた(Fig. 1B)。C57BL/6JmsSlcマウスでは体重、血糖値ともに変化しなかった。
Fig. 1. コントロール群とアロニア果汁摂取群の体重と血糖値の違い(A) 体重 (B) 血糖値 3 – 4日おきに28日間測定した。 KK-Ayのコントロール群とアロニア果汁摂取群で 顕著に異なる。 *p<0.05、**p<0.01、n=5.
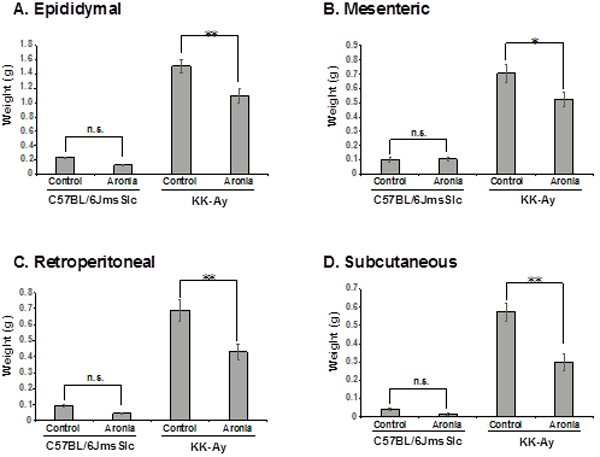
3-2. 脂肪組織に対するアロニア果汁の有益な効果 28日間、アロニアを摂取させた後、脂肪組織を摘出し、重量を測定した結果、アロニアを摂取したKK-Ayマウスにおいて白色脂肪組織が顕著に減少した。アロニア果汁を摂取していないKK-Ayマウスと比較して精巣上体周囲脂肪で27%、腸間膜周囲脂肪で26%、後腹膜脂肪で38%そして皮下脂肪で48%減少していた。C57BL/6JmsSlcマウスでは体重、血糖値ともに変化が認められなかった(Fig. 2A - D)。
Fig.2 アロニア果汁を摂取したKK-Ayマウスにおける脂肪組織重量の減少 *p<0.05、n.s.:有意でない、n=5.
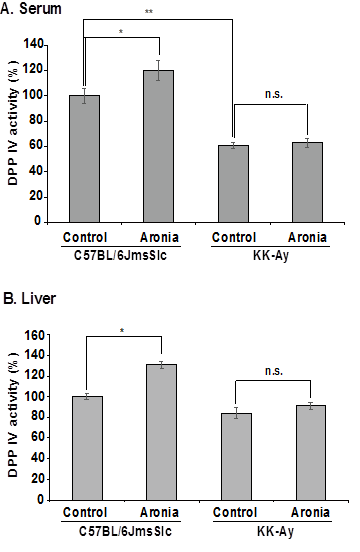
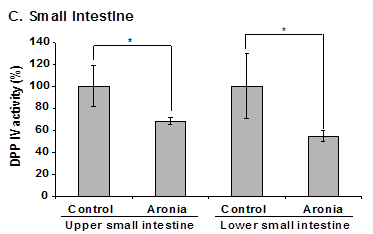
3-3. 血清、肝臓そして小腸におけるアロニア果汁によるDPP IV活性の阻害効果 28日間、アロニアを摂取させた後、血清、肝臓、小腸を摘出し、DPP IV活性を測定した。Fig. 3Aに示すように、KK-Ayマウスの血清におけるDPP IV活性はC57BL/6JmsSlcマウスよりも低かった。アロニア果汁を摂取したC57BL/6JmsSlcマウスでは、摂取していないマウスと比べてDPP IV活性が増加した。KK-Ayマウスでは変化が見られなかった。肝臓でも同様の結果であった(Fig. 3B)。Fig. 3Cに示すように、アロニア果汁を摂取したKK-Ayマウスでは、摂取していないマウスと比べてDPP IV活性が小腸上部では35%、下部では46%減少した。
Fig. 3. 血清、肝臓、小腸におけるDPP IV活性 (A) 血清、(B) 肝臓、(C) 小腸 *p<0.05、**p<0.01、n.s.:有意でない、n=5.
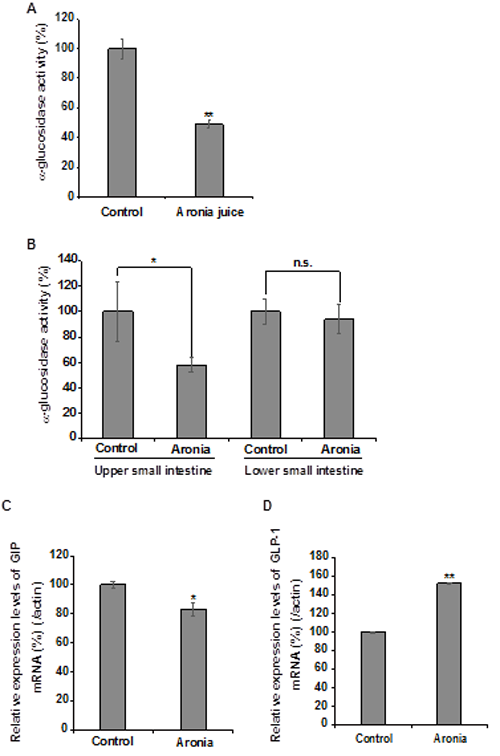
3-4. 小腸上部におけるアロニア果汁によるα‐グルコシダーゼ活性阻害効果 アロニア果汁によるα‐グルコシダーゼ活性阻害効果を決定するために、合成基質であるp-nitrophenyl-α-D-glucopyranosideを用いてα‐グルコシダーゼ活性を測定した。Fig. 4Aに示すようにアロニア果汁によりDPP IV活性は51%阻害された。アロニア果汁を摂取したKK-Ayマウスでは、摂取していないマウスと比べてα‐グルコシダーゼ活性が小腸上部では42%阻害された(Fig. 4B)。アロニア果汁を摂取したKK-Ayマウスでは、GIP mRNAの発現は小腸上部において減少し、GLP-1 mRNA発現は小腸下部で増加した(Fig. 4C, 4D)。
Fig.4 小腸上部におけるアロニア果汁のα‐グルコシダーゼ阻害効果と小腸におけるGIPおよびGLP-1の発現レベル アロニア果汁にはα‐グルコシダーゼ阻害効果がある。(B) 小腸上部と下部におけるα‐グルコシダーゼ阻害効果 (C) GIP発現レベル (D)GLP-1発現レベル *p<0.05、**p<0.01、n.s.:有意でない、n=5.
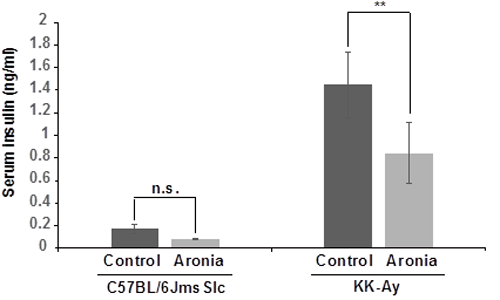
3-5. インスリンレベルにおけるアロニア果汁の有益な効果 28日間、アロニアを摂取させた後、血清を採取し、インスリン濃度を測定した。Fig. 5に示すようにKK-Ayマウスの血清インスリン濃度はC57BL/6JmsSlcマウスよりも高かった。アロニア果汁を摂取したKK-Ayマウスでは、摂取していないマウスと比べて血清インスリン濃度が顕著に減少した
Fig. 5. アロニア果汁を摂取したKK-Ayマウスにおける血中インスリンレベルの変化 **p<0.01、n.s.:有意でない、n=5. |
4. 考察 本研究において、私たちは体重と血糖値がアロニア果汁を摂取したKK-Ayマウスでは顕著に減少することを見出した。コントロールであるC57BL/6JmsSlcマウスでは変化は認められなかった。最近、私たちはアロニア果汁がDPP IVを阻害することを報告した[9]。本研究と以前の研究結果は血糖値がDPP IV活性の阻害を通して減少し、糖尿病の改善効果を有することを示唆している。また白色脂肪組織の重量はアロニア果汁を摂取したKK-Ayマウスでは顕著に減少した。私たちはまたα‐グルコシダーゼ活性がアロニア果汁を摂取したKK-Ayマウスの小腸上部で減少していることを見出した。GIPを分泌するK細胞は小腸上部に豊富に存在する[17]。GIP発現はグルコースによって調節されており、α‐グルコシダーゼ活性が小腸上部で阻害されるとGIPレベルが減少する[18]。GIPの発現レベルはアロニア果汁を摂取したKK-Ayマウスの小腸上部において減少した。脂肪細胞において脂肪の蓄積はGIPによって誘導される[19]。一方、α‐グルコシダーゼ活性はアロニア果汁を摂取したKK-Ayマウスの小腸下部において阻害されなかった。L細胞から分泌されたGLP-1は小腸下部に豊富に存在する[17]。GLP-1の発現はまた小腸上部におけるα‐グルコシダーゼ阻害によって増加することがすでに示されている[18]。最近、GLP-1の循環レベルがDPP IV阻害剤単独よりもα‐グルコシダーゼ阻害剤との併用によってより上昇し、この併用療法は2型糖尿病と肥満症の治療に役立つことが報告されている[20]。これら以前の研究と私たちの発見はアロニア果汁に含まれるα‐グルコシダーゼ阻害剤が小腸上部でα‐グルコシダーゼを阻害し、小腸上部におけるグルコースの吸収を減少させることによって、GIPの発現、分泌そして循環レベルが減少し、小腸下部におけるグルコースの吸収が増加することで、GLP-1の分泌、循環レベルが増加することを示している。プログルカゴン遺伝子の転写はβ‐カテニンによって活性化され、Wntシグナル経路をターゲットの1つとしている[21]。Cyanidin-3-O-glucoside (C3G)とpeonidin-3-O-glucosideを含むブラックライス抽出物はWntシグナル経路を活性化する[22]。プログルカゴン遺伝子の転写はまた、cyclic AMP response element (CRE)を通して刺激される[23]。C3GはプロテインキナーゼA活性化を通してCRE-binding protein (CREB)のリン酸化レベルを増加し、結果としてCREBを介した遺伝子転写が上昇する[24]。それらの研究結果はGLP-1 mRNAの発現がWntシグナル経路かアロニアベリーに含まれるアントシアニンによりターゲットされたCREを介して増加することを示唆している。最近、STC-1細胞において、プレプログルカゴンmRNAの発現とGLP-1の分泌はneftin-1によって濃度依存的に増加し、GIP mRNA発現とGIP分泌もまた同様に増加することが報告された[25]。この報告はこれらの遺伝子と遺伝子産物においてmRNA発現レベルと分泌量の間に正の相関があることを示している。KK-Ayマウス小腸上部および下部においてDPP IV活性がアロニア果汁によって阻害されることを示した。DPP IVは小腸上皮細胞において活性型GLP-1ペプチドを分解し、門脈にたどりつく活性型GLP-1は1/3から1/4にすぎないことが報告されている[26, 27]。小腸におけるDPP IVによるGLP-1の分解の阻害は増加し、増加した活性型GLP-1レベルはグルコースレベルに影響を与えるので、本研究における私たちの発見と以前の研究はアロニア果汁を摂取したKK-Ayマウスにおけるグルコースレベルが小腸におけるDPP IVとα‐グルコシダーゼ阻害を通して減少していることを示している。一方、C57BL/6JmsClcマウスのアロニア果汁摂取群において増加した血清のDPP IV活性はDPP IVとα‐グルコシダーゼ阻害剤によって誘導され増加したGLP-1による低血糖を防ぐのに必要かも知れない。さらにKK-Ayマウス血清におけるDPP IV活性はC57BL/6JmSlcマウスに比較して低かった。これらの結果はKK-Ayマウスにおいてインクレチンペプチドは血糖値の減少に必要なので、DPP IV活性を上昇させ、インクレチンペプチドを切断する必要がないことを示している。さらに、血清インスリンレベルはアロニアを摂取したKK-Ayマウスにおいて減少した。白色脂肪細胞の重量はまた、アロニア果汁を摂取したKK-Ayマウスで顕著に減少したので、抗インスリン血症やインスリン抵抗性はアロニア果汁を摂取したKK-Ayマウスにおいて減少した。DPP IV阻害剤とα‐グルコシダーゼ阻害剤の併用療法は血清インスリン濃度を減少させる[28, 29]。インスリン抵抗性の減少の後、血中グルコースの吸収は抗インスリン血症におけるインスリン濃度のような高いインスリン濃度によってではなく、より低いインスリン濃度で誘導される。これらの結果はアロニア果汁がDPP IVとα‐グルコシダーゼ阻害を通して糖尿病と肥満の改善効果を有していることを示唆している。 |
文献 [1] Kokotkiewicz A, Jaremicz Z, Luczkiewicz M. Aronia plants: a review of traditional use, biological activities, and perspectives for modern medicine. J Med Food 2010; 13:255-69. [2] Wu X, Gu L, Prior RL, McKay S. Characterization of anthocyaninsand proanthocyanidins in some cultivars of Ribes, Aronia, and Sambucus and their antioxidant capacity. J Agric Food Chem 2004; 52:7846-56. [3] Wu X, Beecher GR, Holden JM, Haytowitz DB, Gebhardt SE, Prior RL. Concentrations of anthocyanins in common foods in the United States and estimation of normal consumption. J Agric Food Chem 2006; 54:4069-75. [4] Kulling ES, Rawel MH. Chokeberry (Aronia melanocarpa) –A Review on the Characteristic Components and Potential Health Effects.Planta Med. 2008; 74:1625-34. [5] Badescu M, Badulescu O, Badescu L, Ciocoiu M. Effects of Sambucus nigra and Aronia melanocarpa extracts on immune system disorders within diabetes mellitus. Pharm Biol. 2015; 53:533-9. [6] Valcheva-Kuzmanova S, Kuzmanov K, Tancheva S, Belcheva A. Hypoglycemic and hypolipidemic effects of Aronia melanocarpa fruit juice in streptozotocin-induced diabetic rats. Methods Find Exp Clin Pharmacol. 2007; 29:101-5. [7] Simeonov SB, Botushanov NP, Karahanian EB, Pavlova MB, Husianitis HK, Troev DM. Effects of Aronia melanocarpa juice as part of the dietary regimen in patients with diabetes mellitus. Folia Med (Plovdiv) 2002; 44:20-3. [8] Zielinska-Przyjemska M, Olejnik A, Dobrowolska-Zachwieja A, Grajek W. Effects of Aronia melancarpa polyphenols on oxidative metabolism and apoptosis of neutrophils from obese and non-obese individuals. Acta Sci Pol Technol Aliment 2007; 6:75–87. [9] Kozuka M, Yamane T, Nakano Y, Nakagaki T, Ohkubo I, Ariga H. Identification and characterization of a dipeptidyl peptidase IV inhibitor from aronia juice.Biochem Biophys Res Commun. 2015; 465:433-6. [10] Ohkubo I, Huang K, Ochiai Y, Takagaki M, Kani K. Dipeptidyl peptidase IV from porcine seminal plasma: purification, characterization, and N-terminal amino acid sequence. J Biochem. 1994; 116:1182-6. [11] Kieffer TJ, McIntosh CHS, Pederson RA. Degradationof glucose-dependent insulinotropic polypeptide andtruncated glucagon-like peptide 1 in vitro and in vivo bydipeptidyl peptidase IV. Endocrinology 1995; 136:3585-96. [12]Pridal L, Deacon CF, Kirk O, Christensen JV, Carr RD, Holst JJ. Glucagon-like peptide-1(7-37) has a larger volumeof distribution than glucagon-like peptide-1(7-36) amide in dogsand is degraded more quickly in vitro by dog plasma. EuropeanJournal of Drug Metabolism and Pharmacokinetics 1996; 21:51-9. [13] Mentlein R. Dipeptidyl-peptidase IV (CD26)--role in the inactivation of regulatory peptides. Regul Pept. 1999; 85:9-24. [14]Baggio LL, Drucker DJ. Biology of incretins: GLP-1 andGIP. Gastroenterology 2007; 132:2131-57. [15] Zhong J, Gong Q, Goud A, Srinivasamaharaj S, Rajagopalan S. Recent Advances in Dipeptidyl-Peptidase-4 Inhibition Therapy: Lessons from the Bench and Clinical Trials. J Diabetes Res. 2015; 2015:606031. [16] Ríos JL, Francini F, Schinella GR. Natural Products for the Treatment of Type 2 Diabetes Mellitus. Planta Med. 2015; 81:975-94. [17]Cho HJ, Kosari S, Hunne B, Callaghan B, Rivera LR, Bravo DM, Furness JB. Differences in hormone localisation patterns of K and L type enteroendocrine cells in the mouse and pig small intestine and colon. Cell Tissue Res. 2015; 359:693-8. [18]Narita T, Katsuura Y, Sato T, Hosoba M, Fujita H,Morii T, Yamada Y. Miglitol induces prolonged and enhancedglucagon-like peptide-1 and reduced gastricinhibitory polypeptide responses afteringestion of a mixed meal in Japanese Type 2diabetic patients. Diabetic Med.2009; 26:187-93. [19] Miyawaki K, Yamada Y, Ban N, Ihara Y, Tsukiyama K, Zhou H, Fujimoto S, Oku A, Tsuda K, Toyokuni S, Hiai H, Mizunoya W, Fushiki T, Holst JJ, Makino M, Tashita A, Kobara Y, Tsubamoto Y, Jinnouchi T, Jomori T, Seino Y. Inhibition of gastric inhibitory polypeptide signaling prevents obesity. Nat Med. 2002; 8:738-42. [20] Imai C, Saito M, Mochizuki K, Fuchigami M, Goda T, Osonoi T. Cotreatment with the α-glucosidase inhibitor miglitol and DPP-4 inhibitor sitagliptin improves glycemic control and reduces the expressions of CVD risk factors in type 2 diabetic Japanese patients. Metabolism. 2014; 63:746-53. [21] Ni Z, Anini Y, Fang X, Mills G, Brubaker PL, Jin T. Transcriptional activation of the proglucagon gene by lithium and beta-catenin in intestinal endocrine L cells. J Biol Chem. 2003; 2:1380-87. [22]Jang WS, Seo CR, Jang HH, Song NJ, Kim JK, Ahn JY, Han J, Seo WD, Lee YM, Park KW. Black rice (Oryza sativa L.) extracts induce osteoblast differentiation and protect against bone loss in ovariectomized rats.Food Funct. 2015; 6:265-75. [23]Gevrey JC, Malapel M, Philippe J, Mithieux G, Chayvialle JA, Abello J, Cordier-Bussat M.Protein hydrolysates stimulate proglucagon gene transcription in intestinal endocrine cells via two elements related to cyclic AMP response element.Diabetologia. 2004; 47:926-36. [24]Zhu W, Jia Q, Wang Y, Zhang Y, Xia M. The anthocyanin cyanidin-3-O-β-glucoside, a flavonoid, increases hepatic glutathione synthesis and protects hepatocytes against reactive oxygen species during hyperglycemia: Involvement of a cAMP-PKA-dependent signaling pathway.Free Radic Biol Med. 2012; 52:314-27. [25]Ramesh N, Mortazavi S, Unniappan S.Nesfatin-1 stimulates glucagon-like peptide-1 and glucose-dependent insulinotropic polypeptide secretion from STC-1 cells in vitro.Biochem Biophys Res Commun. 2015; 462:124-30. [26]Hansen L, Deacon CF, Orskov C, Holst JJ. Glucagon-like peptide-1-(7-36)amide is transformed to glucagon-like peptide-1-(9-36)amide by dipeptidyl peptidase IV in the capillaries supplying the L cells of the porcine intestine. Endocrinology. 1999; 140:5356-63. [27]Holst JJ. Incretin hormones and the satiation signal.Int J Obes (Lond). 2013; 37:1161-8. [28] Horikawa Y, Enya M, Iizuka K, Chen GY, Kawachi S, Suwa T, Takeda J. Synergistic effect of α-glucosidase inhibitors and dipeptidyl peptidase 4 inhibitor treatment. J Diabetes Investig. 2011; 2:200-3. [29] Jones RB, Vickers SP, Cheetham SC, Headland KR, Mark M, Klein T. Effect of linagliptin, alone and in combination with voglibose or exendin-4, on glucose control in male ZDF rats. Eur J Pharmacol. 2014; 729:59-66. |
[要約]
[用語解説] KK-Ayマウス:KK-Ayマウスは、KKマウスにAy遺伝子を導入したモデルマウスで、早期(7~8週齢)かつ重度な肥満・高血糖を発現するマウスです。
DPP IV:ジペプチジルペプチダーゼIVというタンパク質分解酵素でGLP-1やGIPといった消化管から分泌される生理活性ペプチドを分解し、血糖値の上昇を抑制する効果を持っています。 GLP-1:グルカゴン様ペプチド-1の略称でインスリンの分泌を促進し、血糖値の上昇を抑制する。 GIP:グルコース依存性インスリノトロピックポリペプチドの略称でインスリン分泌を促進し、血糖値の上昇を抑制するとともに、脂肪細胞への脂肪の蓄積を促進する。 |