
Ryuta Ejima 1, Riko Mishima et al., |
| 要約 |
| プロバイオティクス、特に腸内細菌叢に固有のものは、腸内環境に大きな影響を与えます。この研究では、Bifidobacterium longum BB536 (B. longum BB536) が健康な人の糞便細菌叢と代謝物組成に及ぼす影響を調べるために、ランダム化プラセボ対照二重盲検並行群間比較試験を実施しました。Streptococcus thermophiles と Lactobacillus bulgaricusのみで製造した発酵乳 (プラセボ群) と、B. longum BB536を添加した発酵乳 (BY 群) の効果を比較しました。調査結果から、3 日目までに BY群の Faecalibacterium(訳者注:腸内で酪酸を多く作り出す善玉菌で、代表的な酪酸菌にFaecalibacteriumがあります。 酪酸は免疫機能の調整や整腸作用等、多くの有益な機能への関与が知られています。 そのため、酪酸菌が増えることでこれらの有益な機能が向上し、健康なカラダを手に入れることが期待できます) の相対的存在量がプラセボ群よりも有意に多いことが明らかになり、この傾向は試験終了の 17 日目まで続きました。さらに、BY 群では 17 日目にトリプトファン (Trp)、インドール-3-乳酸、インドール-3-アルデヒドの濃度が有意に増加しました。Faecalibacterium の相対的存在量と糞便中の B. longum BB536 生菌数の間には、有意な正の相関が見られました。トリプトファンとインドール-3-酢酸の濃度も、糞便中の B. longum BB536 生菌数と有意に相関していました。私たちの結果は、B. longum BB536 摂取が腸内細菌叢と代謝プロファイルを調節できることを示唆しています。これらは腸内環境を監視するための一般的な指標であり、宿主に健康上の利益をもたらす可能性があります。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 材料と方法 |
| 2.1. 臨床試験デザイン |
| 2.2. 細菌株と培養条件 |
| 2.3. 16S rRNA遺伝子解析 |
| 2.4. Faecalibacterium-特異的定量PCR分析 |
| 2.5. 糞便代謝物のメタボローム解析 |
| 2.5.1. 化学薬品と試薬 |
| 2.5.2. 糞便サンプルからの代謝物の抽出 |
| 2.5.3. 液体クロマトグラフィー-タンデム質量分析(LC-MS/MS)分析 |
| 2.5.4. HPLC分析 |
| 2.6. 統計分析 |
| 2.7. データの入手可能性 |
| 3. 結果 |
| 3.1. BY 群とプラセボ群間の糞便微生物叢構成の違い |
| 3.2. BY 群とプラセボ群の糞便代謝物存在量の差 |
| 3.3. 消化を生き延びた B. longum BB536 菌の数と糞便微生物叢の多様性との相関関係 |
| 4. 考察 |
| 5. 結論 |
| 本文 |
| 1.はじめに |
| ヒトの腸は、腸内細菌叢として知られる数兆個の微生物が生息する複雑な生態系です [1]。この生態系は宿主の健康維持に不可欠であり、腸管バリアの維持 [2]、代謝 [3]、免疫 [4]、神経系におけるシグナル伝達 [5] など、さまざまな生理機能に複雑に関わっています。この生態系が乱れると、さまざまな疾患のリスクが高まる可能性があるため、健康な腸内環境を維持することの重要性が強調されます [6]。 |
| プロバイオティクスは、適量を摂取すると宿主に健康上の利益をもたらす生きた微生物であり[7]、腸内環境の調整を通じて直接的および間接的に免疫系および腸上皮細胞に影響を与えることができます。これらの有益なプロバイオティクスの一般的な供給源の1つは発酵乳であり、抗酸化作用、抗高血圧作用、抗アレルギー作用などの有益な特性も持っています。これらの利点は、グラム陽性通性嫌気性菌で動物由来の乳酸菌に分類されるStreptococcus thermophilesとLactobacillus bulgaricusの存在に起因する可能性があります。ただし、微生物による間接的な影響を考慮すると、腸内細菌叢に固有の種は、他の腸内細菌との相互作用が強化されているため、腸内環境にさらに大きな影響を与える可能性があります。この観点からすると、S. thermophiles や L. bulgaricus など、もともと人間の腸内に生息していない種のみを含む発酵乳と、腸内細菌叢の一部であるBifidobacteriumなどの種を含む発酵乳とでは、影響が根本的に異なる可能性があります。 |
| Bifidobacterium longum BB536 (B. longum BB536) は、50 年以上にわたり世界中で安全に利用されてきたヒト常在Bifidobacterium (HRB) 株です。 B. longum BB536 は、腸内環境の調整など、さまざまな健康上の利点をもたらすことが報告されています [8]。これまでの研究では、B. longum BB536を含む製品の摂取により、腸内環境と排便が調整され [9]、免疫系の調整に寄与する可能性があり [10,11]、Bifidobacterium breve MCC1274 と同時摂取すると内臓脂肪と中性脂肪のレベルが低下することが報告されています [12]。特に、B. longum BB536 は、宿主の健康に重要な役割を果たすトリプトファン代謝産物の生成に関連しています [13]。トリプトファンとその代謝産物は、宿主と微生物の栄養要求を満たすだけでなく [14]、さまざまな受容体のリガンドとして腸の炎症の抑制にも寄与します [15,16,17]。これらの知見は、B. longum BB536 がこれらの代謝産物の産生を通じて腸内環境の維持に重要な役割を果たしている可能性を示唆しています。しかし、B. longum BB536を含む発酵乳の摂取が腸内細菌叢とこれらの代謝産物の両方に与える影響を包括的に報告した臨床試験はほとんどありません。 |
| 本研究では、健常者を対象に、S. thermophiles と L. bulgaricus のみで製造した伝統的な発酵乳(プラセボ群)と B. longum BB536 を添加した発酵乳(BY 群)を試験食品として、ランダム化プラセボ対照二重盲検並行群間比較試験(RCT)を実施した。我々は以前、この実験プロトコルを使用して、糞便中の B. longum BB536 生菌数を報告した [18]。本研究では、同じ実験で BY 群とプラセボ群との間で、大腸環境をモニタリングするための一般的な指標である糞便微生物叢と代謝物の違いを、短期(摂取 3 日目)と中期(摂取 17 日目)の影響を考慮して評価した。この研究の目的は、B. longum BB536 が宿主にさまざまな有益な効果をもたらすメカニズムを解明することです。 |
| 2. 材料と方法 |
| 2.1. 臨床試験デザイン |
| この研究は、日本の松本衛生研究所で実施された二重盲検ランダム化プラセボ対照試験でした。この試験は、健康な成人の腸内環境にB. longum BB536が及ぼす影響を調査することを目的としました。この研究の主な結果は、腸内環境の改善でした。腸内代謝産物の量と腸内微生物叢の構成の変化が結果の指標となりました。18〜64歳の健康な成人が登録されましたが、除外基準は前述のとおりでした[18]。簡単に言うと、参加者は、1週間の事前観察期間に続いて、17日間の介入期間中、2000万CFU/gのB. longum BB536を含む市販の発酵乳または同一のプラセボを毎日摂取するようにランダムに割り当てられました。介入中のすべての食事摂取は、食事記録アプリCalomeal®(Life Log Technology,Inc.Tokyo, Japan)で記録されました。コンプライアンスは、発酵乳の残量とアプリのエントリをチェックすることで監視されました。本研究で実施されたプロトコルに準拠したセットの分析は、以前の研究[18]で説明された参加者のものと同じであり、プロトコルに準拠したセットは、プラセボ群の参加者17人とBY群の参加者17人で構成されていました。便サンプルは、特定の日に楽流カップを使用して収集され、特定の収集チューブに移され、アネロポーチケンキ(Mitsubishi Gas Chemical Co., Tokyo, Japan)に封入され、24時間以内に研究室に運ばれました。この試験は、大学病院医療研究ネットワークにUMIN000052110として登録されました。 |
| 2.2. 細菌株と培養条件 |
| B. longum BB536 凍結培養物は森永乳業(Tokyo, Japan)から入手し、F. prausnitzii JCM 39207 は日本微生物コレクション(Tsukuba, Japan)から購入しました。本研究で使用したすべての株は、YCFA 培地 [21] で嫌気条件下、37 °C で 24 時間前培養されました。B. longum BB536 の F. prausnitzii JCM 39207 に対する効果を評価するために、株(両方とも 1 × 106 CFU/mL)を岐阜嫌気培地ブロス(Shimadzu Diagnostics Co., Ltd., Kyoto, Japan)で嫌気条件下、37 °C で 24 時間培養しました。 |
| 2.3. 16S rRNA遺伝子解析 |
| 細菌DNAをサンプルから抽出し、前述のように増幅した[21]。細菌16S rRNA遺伝子のV3-V4領域は、Illumina NextSeq 1000プラットフォームとNextSeq 1000/2000 P1試薬キット(600サイクル)(Illumina, Inc., San Diego, CA, USA)を使用してペアエンドシーケンスされた。シーケンスはQIIME2(バージョン2022.8)[22]を介して解析された。デマルチプレックスされたリードは、フィルタリング、ノイズ除去、マージ、キメラ除去、およびDADA2によるアンプリコンシーケンスバリアント(ASV)の生成という手順で処理された[23]。ASVは、Greengeens2データベース(バージョン2022.10)に基づいて分類学的に割り当てられました。 |
| 2.4. Faecalibacterium-特異的定量PCR分析 |
| 定量PCR分析は、CFX96サーモサイクラー(Bio-Rad Laboratories, Hercules, CA, USA)とリアルタイムPCR検出キット(Clostridium cluster iv:RI-0001)(TechnoSuruga Laboratory Co., Ltd., Nagasaki, Japan)およびTB Green Premix Ex Taq II(TaKaRa Bio Inc., Shiga, Japan)を使用して、製造元の指示に従って実施しました。 |
| 2.5. 糞便代謝物のメタボローム解析 |
| 2.5.1. 化学薬品と試薬 |
| 内部標準物質を含む対象分析に使用したすべての化学薬品は、東京化成工業株式会社(Tokyo)、Sigma-Aldrich (St. Louis, MO, USA)、富士フイルム和光純薬株式会社(Osaka)から購入しました(表S1およびS2)。LCMSグレードの水、メタノール、ギ酸は、富士フイルム和光純薬株式会社から購入しました。移動相とpH緩衝液は、島津ジーエルシー株式会社(kyoto)から購入しました。 |
| 2.5.2. 糞便サンプルからの代謝物の抽出 |
| 各糞便サンプル約 100 mg (±5 mg) を 1000 μL の IS 溶液 (50% 水/メタノール中の 1 μM MO) または水に懸濁しました。これらの懸濁液を、TissueLyser 装置で激しく振とう (25 Hz、10 分) して 0.1 mm のジルコニア/シリカビーズと均質化し、20,380 × g で 5 分間遠心分離しました。次に、上清を NANOSEP 3K OMEGA (Cytiva, Marlborough, MA, USA) または ULTRAFREE MC PLHCC 5K (Human Metabolome Technologies, Inc.、Yamagata, Japan) 培地に移しました。次に、限外濾過フィルターに移した上清を 9100 × g で 3~5 時間遠心分離しました。濾過したサンプルは、さらなる分析まで -80 °C で保存されました。 |
| 2.5.3. 液体クロマトグラフィー-タンデム質量分析(LC-MS/MS)分析 |
| LC-MS/MS分析は、LC-40D XRポンプ2台、DGU-405デガッサー、SIL-40C XRオートサンプラー、CTO-40Cカラムオーブン、CBM-40コントロールモジュールを装備したNexera X2システム(Shimadzu, Kyoto, Japan)とLC-8045トリプル四重極質量分析計(Shimadzu)を使用して実施しました。代謝物の分離には、XBridge® C8カラム(4.6×150mm、5μm、Waters Corporation、米国マサチューセッツ州ミルフォード)を使用しました。移動相は、A:水中0.1%(v/v)ギ酸とB:メタノール中0.1%(v/v)ギ酸で構成されていました。流量、カラム温度、注入量は、それぞれ 0.2 mL/分、40 °C、2 µL に設定しました。移動相 B のグラジエントプログラムは、0 分、30%、5 分、30%、42 分、95%、47 分、95%、50.5 分、30%、60 分、30% でした。質量分析計には、エレクトロスプレーイオン化 (ESI) 源が装備されており、次の条件でした。噴霧ガス流量、3 L/分、加熱ガス流量、10 L/分、インターフェース温度、300 °C、脱溶媒和ライン温度、250 °C、加熱ブロック温度、400 °C、乾燥ガス流量、10 L/分、衝突誘起解離ガス圧、230 kPa。 |
| 2.5.4. HPLC分析 |
| HPLC分析は、LC-40Dポンプ2台、DGU-405デガッサー、SIL-40Cオートサンプラー、CTO-40Cカラムオーブン、CBM-40コントロールモジュール、CDD-10A VP導電率検出器を備えたNexera X2システム(Shimadzu)を使用して実施しました。代謝物の分離には、タンデムイオン排除カラム(Shim-pack SCR-102H、300 mm × 8.0 mm、7 µm、島津ジーエルシー株式会社)を使用しました。移動相とpH緩衝液は、0.8 mL/分の流速で送液しました。カラム温度と注入量は、それぞれ50 °Cと10 µLに設定しました。 |
| 2.6. 統計分析 |
| 3日目と17日目の糞便微生物叢の群間差異は、中心対数比(CLR)変換後のQuadeのノンパラメトリック共分散分析(QuadeのノンパラメトリックANCOVA)で分析されました。同様に、3日目と17日目の糞便代謝物の群間差異は、QuadeのノンパラメトリックANCOVAで分析されました。その他の結果は、必要に応じて、Studentのt検定とMann–Whitney U検定で群間で比較されました。相関分析は、Spearmanの相関係数で実施されました。統計分析は、IBM SPSS Statistics(バージョン29.0.2.0(20)、Armonk、NY、USA)で実施されましたが、Spearmanの相関分析はR(バージョン4.3.1)で実施されました。データが欠損している場合は、これらの欠損値を処理するためにリストワイズ削除を実行しました。p値<0.05は統計的に有意であるとみなされました。 |
| 2.7. データの入手可能性 |
| 生の配列データは、バイオプロジェクト番号 PRJDB18808 で、日本 DNA データバンク (DDBJ) のシーケンス リード アーカイブ (DRR596307-DRR596404) に保存されています。このプロジェクトには、糞便サンプル データ (バイオサンプル SAMD00819537-SAMD00819634) へのリンクとアクセスが含まれています。 |
| 3.結果 |
| 3.1. BY 群とプラセボ群間の糞便微生物叢構成の違い |
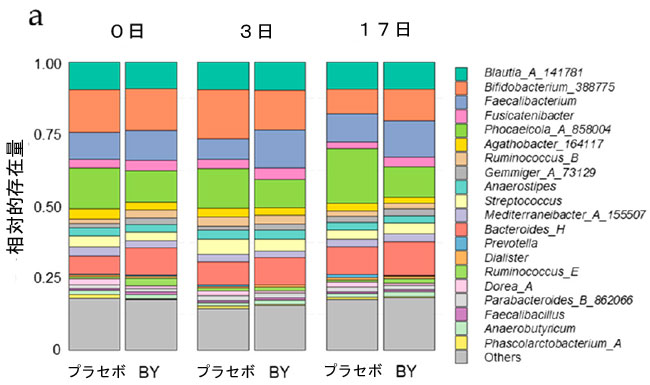
| 摂取前、3 日目、17 日目に採取した糞便サンプルの 16S rRNA 遺伝子配列解析により、B. longum BB536 (BY) で発酵させた牛乳が糞便微生物叢に与える影響を評価しました。糞便微生物叢のアルファ多様性は、Chao1、観察された特徴、Pielou の均等性、および Faith の系統発生多様性指標をスコアリング指標として使用して群間で比較されました。ただし、プラセボ 群と BY群の間には有意な差異は見られませんでした (図 S1)。次に、属レベルで相対的存在量を比較しました。プラセボ群と比較して、BY群は 3 日目に Faecalibacterium の相対存在量が有意に高く、この傾向は 17 日目にも見られました (図 1a、b)。さらに、3 日目と 17 日目の Phascolarctobacterium_A の存在量と 17 日目の Holdemanella の存在量にも、2 つの群間で有意な差が見られました (表 S3 および S4)。興味深いことに、3 日目に、Faecalibacterium の相対的な存在量は、同じ日に糞便サンプルで検出された B. longum BB536 の生存細菌数と正の相関関係がありました (図 S2)。有益な関係を検証するために、B. longum BB536 と代表的な Faecalibacterium である Faecalibacterium prausnitzii を共培養しました。結果は、F. prausnitzii のみの単一培養と比較して、B. longum BB536 との共培養により F. prausnitzii の増殖が有意に促進されることを示しました (図 1c)。 |
 |
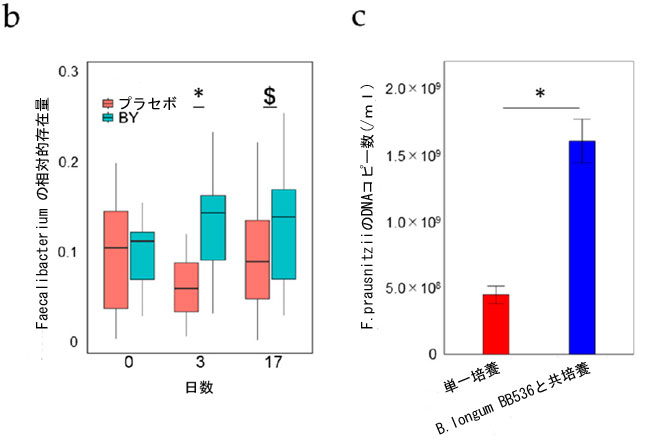 |
図1 B. longum BB536 細菌の糞便微生物叢構成への影響: (a) 糞便微生物叢で最も豊富な 20 属を示す積み上げ棒グラフ、 (b) 糞便サンプル中の Faecalibacterium の相対的存在量、 (c) B. longum BB536 と GAM 培地で 37 °C で 24 時間共培養した F. prausnitzii JCM 39207 の DNA コピー数。 統計的有意性は次のように示されます: $ p < 0.1、* p < 0.05 (b) Quade のノンパラメトリック ANCOVA、および (c) Student t 検定を使用。 |
| 3.2. BY 群とプラセボ群の糞便代謝物存在量の差 |
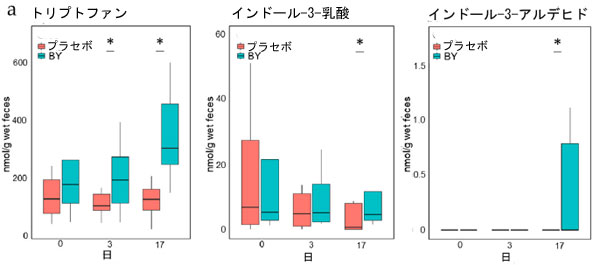
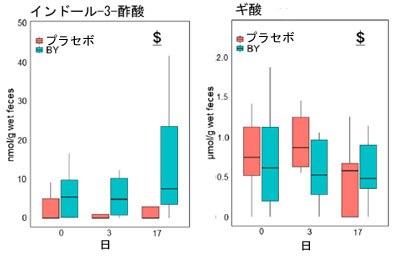
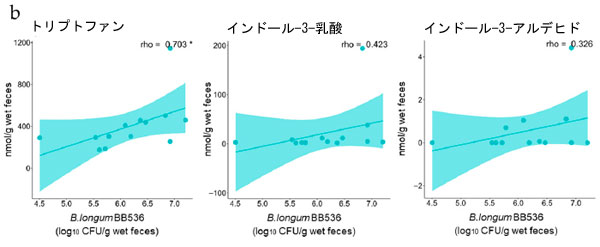
| BY 摂取が糞便代謝物、短鎖脂肪酸 (SCFA)、トリプトファン (Trp) 代謝物の存在量に与える影響を評価しました。糞便サンプルは摂取前と実験 3 日目および 17 日目に採取し、HPLC および LC-MS/MS で分析しました。BY 群とプラセボ群の両方で 16 種類の代謝物が検出され、そのうち 5 種類は異なる濃度を示しました (表 S5)。トリプトファン、インドール-3-乳酸 (ILA)、およびインドール-3-アルデヒド (IAld) は、17 日目に BY 群で対照群よりも有意に高い濃度で存在し、インドール-3-酢酸 (IAA) も高い濃度で存在する傾向がありました (図 2a)。 17 日目に BY 群の糞便中のギ酸濃度はプラセボ群よりも低い傾向にあった。17 日目に群間で有意差または傾向が認められた 5 つの代謝物と糞便中に検出された生菌 B. longum BB536 菌数との間で Spearman の相関分析を行った。この分析により、17 日目に糞便中の トリプトファン インドール-3-酢酸 (IAA)の濃度が有意に正の相関関係にあることが明らかになった (図 2b)。異なるトリプトファン代謝物間では有意な相関は認められなかったが、いくつかの代謝物の濃度はトリプトファンの濃度と正の相関関係にあることが示された (図 3)。興味深いことに、インドールと インドール-3-乳酸 (ILA)の間には有意な負の相関関係が認められた。逆に、食事記録に基づくと、試験期間中の 2 つの群間の食事性栄養素摂取量に有意差は認められなかった (表 S6)。さらに、ほとんどのトリプトファン代謝物のレベルは、BY 乳製品とプラセボ乳製品との間で有意差は認められなかった。しかし、最も顕著な違いを示したトリプトファンは、BY強化乳製品では有意に低い濃度を示しており、糞便中のトリプトファン濃度と逆相関関係にあることを考えると興味深い結果です(図S3)。 |
 |
 |
 |
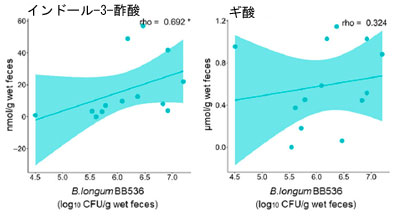 |
図2 糞便代謝物濃度と生存 B. longum BB536 数の相関: (a) 糞便中の トリプトファン(Trp)、インドール-3-酢酸 (IAA)、インドール-3-乳酸 (ILA)、インドール-3-アルデヒド (IAld)、およびギ酸濃度の定量測定、 (b) 17 日目の同じ 5 つの代謝物濃度と生存 B. longum BB536 数の相関。 統計的有意性は次のように示されます: $ p < 0.1、* p < 0.05、(a) Quade のノンパラメトリック ANCOVA および (b) Spearman の相関。 |
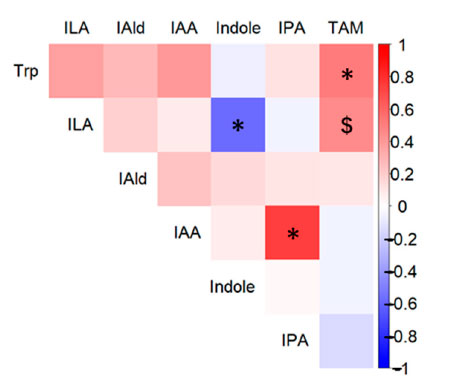 |
図3 17 日目のトリプトファン代謝物間の Spearman 相関のヒートマップ。 マップには、17 日目の トリプトファン、インドール-3-乳酸 (ILA)、インドール-3-酢酸 (IAA)、インドール-3-アルデヒド (IAld)、インドール、インドール-3-プロピオン酸 (IPA)、およびトリプタミン (TAM) のペア比較が表示されます。統計的有意性は次のように示されます: $ p < 0.1; * p < 0.05。 |
| 3.3. 消化を生き延びた B. longum BB536 菌の数と糞便微生物叢の多様性との相関関係 |
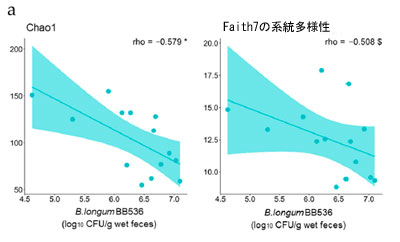
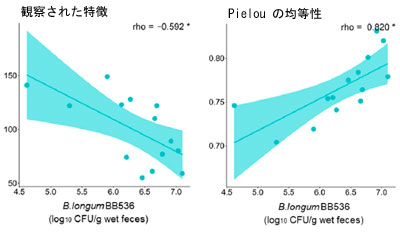
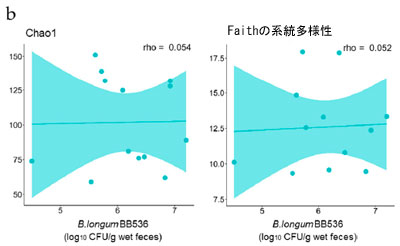
| 特定の腸内細菌の存在量または特定の代謝物の濃度と糞便中の生存 B. longum BB536 菌の数との間に有意な相関関係が認められることから、これらの細菌が腸内で生存する能力が腸内環境に有益な効果をもたらす上で重要であると推測されます。したがって、腸内環境における細菌の生存に影響を与える要因を明らかにするために、研究参加者からの摂取前情報と糞便中に検出された生存 B. longum BB536 菌の数との相関分析を実施しました。結果は、3 日目に糞便中に検出された生菌 B. longum BB536 細菌の数が Chao1、観察された特徴、および Faith の系統多様性と有意に負の相関を示し、Pielou の均等性と有意に正の相関を示したことを示しました (図 4a)。逆に、17 日目に糞便中に検出された生菌 B. longum BB536 の数といずれのスコアにも有意な相関は検出されませんでした (図 4b)。 |
 |
 |
 |
 |
図4 糞便微生物叢のアルファ多様性と生存 B. longum BB536 数の相関。 摂取前糞便微生物叢アルファ多様性と生存 B. longum BB536 数の相関 ((a) 3 日目、(b) 17 日目)。 アルファ多様性は、Chao1、Faith の系統学的多様性、観察された特徴、および Pielou の均等性検定によってスコア化されました。統計的有意性は次のように示されます: $ p < 0.1、* p < 0.05、Spearman の相関。 |
| 4.考察 |
| プロバイオティクス摂取と宿主の健康との関係は近年大きな注目を集めている [24]。プロバイオティクスは、免疫細胞に作用して [25]、腸内細菌叢の構成を変化させ [26]、間接的に代謝産物の量を調節することで宿主に影響を与えることができる [27]。本研究で使用した B. longum BB536 株は、宿主の免疫機能と腸内細菌叢の構成に影響を与えることが報告されている [28]。しかし、この株を含む発酵乳が、乳酸菌のみを使用した一般的な発酵乳と比較して、宿主に対して具体的にどのような利益をもたらすのかは、まだ十分に解明されていない。本研究では、乳酸菌のみを含む発酵乳または B. longum BB536 を添加した発酵乳を被験者に摂取させる RCT (訳者注:ランダム化比較試験(Randomized Controlled Trial))を実施し、糞便細菌叢と代謝産物プロファイルの両方への影響を評価した。これらの要素は、腸内環境をモニタリングするための一般的な指標として役立つ。私たちの調査結果は、これらの指標の大きな変化によって証明されているように、B. longum BB536を添加した発酵乳 (BY)の摂取が腸内環境に与える影響を強調しています。 |
| プラセボ群と比較して、BY群では3日目にFaecalibacteriumの相対的存在量が増加し(図1a、b)、in vitroアッセイではB. longum BB536の存在下でF. prausnitziiが増加することが明らかになりました(図1c)。Faecalibacteriumは酢酸を利用して増殖することが報告されているため[29]、B. longum BB536によって生成された酢酸がFaecalibacteriumの増殖を促進したと考えられます。Faecalibacteriumによって生成された酪酸は、大腸がん細胞の重要なエネルギー源として機能するだけでなく[30]、抗炎症効果を発揮し[31]、腸壁の完全性を強化し[32]、大腸がんを予防する[33]ことも報告されています。しかし、2つの群間で糞便中の酪酸濃度に有意差は検出されませんでした(表S5)。これは、Faecalibacterium が酪酸を生成するための食事由来の栄養素が不十分であることに起因する可能性があります。さらに、血液中の短鎖脂肪酸は糞便中の短鎖脂肪酸よりもプロバイオティクスの摂取に敏感であると報告されているため、宿主に吸収される短鎖脂肪酸の量が異なり、血中濃度が異なる可能性があります [34]。F. prausnitzii の相対的な存在量は、炎症性腸疾患 (IBD) および大腸がんの患者で減少すると報告されており [35]、Faecalibacterium 自体を高い割合で維持することが、宿主の健康を維持する上で極めて重要な役割を果たす可能性があると仮定しています。ただし、プロバイオティクスが短鎖脂肪酸の生成に及ぼす影響を調べるには、さらなる調査が必要です。 |
| 腸内細菌が産生する物質の中でも、トリプトファン代謝物は極めて重要である。腸内細菌叢はトリプトファンを様々な代謝物に変換することで宿主の健康に寄与していると考えられている[36]。これらの代謝物は、宿主の恒常性維持に重要な役割を果たすアリール炭化水素受容体(AhR)およびヒドロキシカルボン酸受容体3(HCA3)のリガンドとして機能する[37]。本研究では、プラセボ群と比較して、BY群は17日目にインドール-3-乳酸 (ILA)、インドール-3-酢酸 (IAA)、インドール-3-アルデヒド (IAld)などのトリプトファン代謝物の糞便濃度が上昇していることを観察した(図2a)。Bifidobacteriumによって産生されるインドール-3-乳酸 (ILA)は、Th2、Th17、およびIFN-βの産生を減少させ、それによって腸の炎症の抑制に寄与することで、乳児の健康維持に重要な役割を果たすことが報告されている[38,39]。 インドール-3-酢酸 (IAA)の糞便中濃度は、炎症性腸疾患 (IBD)およびアルコール性肝炎患者で低下することが知られている[40,41]。インドール-3-アルデヒド (IAld)は、IL-22によって誘発されるCandida albicans感染を抑制し[42]、腸管バリア機能を強化する役割を果たす可能性があることが報告されている[43]。 |
| 注目すべきことに、3日目にはBY群のトリプトファン濃度がプラセボ群よりも有意に高く、この差は17日目にさらに顕著になりました(図2a)。トリプトファンは、宿主の栄養所要量[44]を満たすために、大腸から大腸中性アミノ酸トランスポーター小サブユニット2(LAT2)を介して吸収される可能性があります。トリプトファンは、宿主内でキヌレニン経路とセロトニン経路という2つの主要な代謝経路を介してさまざまな生物学的シグナル分子に変換されると報告されています[45]。キヌレニン経路によって生成されるキヌレニンは、免疫細胞の活動を調節し、抗炎症効果を発揮することが報告されています[46]。逆に、セロトニン経路を介して生成されるセロトニンと5-ヒドロキシトリプトファンは、神経伝達物質として機能し、睡眠の調節に重要な役割を果たします[47]。これらは、うつ病や不安などの精神疾患とも関連付けられています[48]。したがって、私たちの研究結果は、B. longum BB536が精神活性物質として作用する可能性があると報告した以前の研究を支持する可能性がある[49]。 |
| 本研究では、高濃度のトリプトファン代謝物は、腸内に自然に生息する腸内細菌がB. longum BB536の補給によって増加したトリプトファンを代謝することで生成された可能性があることを確認しました。腸内細菌がトリプトファンをさまざまなトリプトファン代謝物に変換できることは、これまでの多くの研究で実証されています。たとえば、インドール-3-酢酸 (IAA)はBifidobacterium, Bacteroides, Clostridium, Parabacteroides, およびEubacterium, などさまざまな細菌によって生成されると報告されており、インドール-3-アルデヒド (IAld)はLactobacillusなどによっても生成されると報告されています[50]。実際、ヒト消化管モデルを使用した研究による糞便培養の結果は、トリプトファン補給によりトリプトファン代謝物の濃度が上昇することを示しました[51]。逆に、プロバイオティクスの摂取が糞便中のトリプトファン濃度を上昇させるメカニズムは依然として不明です。以前の報告では、B. breve CCFM1025 の摂取により糞便中の トリプトファン濃度が有意に上昇したことが実証されていますが、そのメカニズムは不明です [52]。食事や摂取した試験食品の違いが影響しているのではないかと仮説を立てましたが、今回の研究ではどちらの群の食事にも違いは見られませんでした (表 S6)。対照的に、B. longum BB536 を添加した発酵乳では、トリプトファンの濃度が有意に低かった (図 S3)。以前の報告では、腸内細菌は互いの栄養ニーズを補完することで腸内で共生関係を維持していることが示されています [53]。特に、in silico 解析の結果、トリプトファンは腸内細菌の栄養素として微生物叢の多様性と恒常性に寄与していることが明らかになりました [14]。これらの以前の研究に基づくと、B. longum BB536 が他の腸内細菌と共存する特定の条件下でのみトリプトファンが蓄積すると考えられます。とはいえ、これらは単なる仮説であり、将来的にはさらなる研究が必要です。 |
| これまでの試験管内研究では、ヒト常在Bifidobacterium (HRB) がインドールをインドール-3-乳酸 (ILA)に変換することが示唆されている[13]。しかし、この研究では、2つの群間でインドール含有量に有意差は検出されなかった(表S5)。それにもかかわらず、17日目のインドールとインドール-3-乳酸 (ILA)の濃度の間に観察された有意な負の相関(図3)は、インドールからインドール-3-乳酸 (ILA)への変換が起こったことを示唆している。有意差がないのは、トリプトファンの濃度に大きな差があるか、群間で異なるインドール産生菌が存在するためである可能性がある。 |
| この研究では、2 つの群間で存在量が異なっていた腸内細菌および代謝物の一部と、糞便中に検出された生菌 B. longum BB536 菌の数との間に正の相関が見られました (図 2b および図 S2)。したがって、腸内に到達する生菌数に影響を与える要因を特定することで、B. longum BB536 摂取による腸内環境への有益な効果を高めることができる可能性が非常に高いと考えられます。摂取 3 日後に腸内に到達した生菌 B. longum BB536 菌の数は、摂取前の糞便微生物叢のアルファ多様性に関連していることが観察されました (図 4a)。Chao1、観察された特徴、および Faith の系統多様性との負の相関は、種の多様性が大きいほど腸内に到達する生菌の割合が減少することを示しており、一方、Pielou の均等性との正の相関は、種の均等な分布によってこの割合が増加することを示唆しています。これらの結果は、腸内細菌叢の多様性が高いほど、新たに到着したB. longum BB536が腸内で生存することが困難になることを示唆している。実際、同様の現象は環境細菌に関する報告でも確認されている[54]。逆に、17日目に腸内に到達した生きたB. longum BB536菌の数には、この多様性との顕著な関係はなかった(図4b)。したがって、腸内細菌叢の種の豊富さと均一性は、腸内に到達する生菌数を決定する上で重要な要因であり、摂取期間が長くなるにつれてその影響は減少すると予測される。 |
| この研究は貴重な知見を提供しているものの、いくつかの限界があります。まず、この試験には両群で基準を満たした被験者が 34 人しか含まれていませんでした。より堅牢なデータを取得するには、今後の臨床試験でサンプル サイズを拡大することが有益です。次に、この研究で BY群で観察されたトリプトファン濃度の増加の背後にあるメカニズムは不明です。この現象を解明するには、細菌間の複雑なクロストークを解明するためのさらなる検証実験が必要です。これらの課題に対処することで、B. longum BB536 を含むプロバイオティクスの複雑な効果をさらに明らかにし、より効果的なプロバイオティクス製品の開発に貢献できます。 |
| 5.結論 |
| 結論として、私たちの研究は、B. longum BB536 菌を含む乳製品の摂取により、摂取 3 日目までに腸の健康の重要な指標である Faecalibacterium の相対的存在量が増加することを示した。さらに、シグナル伝達分子として機能し、腸の健康を監視するためのもう 1 つの一般的な指標となるトリプトファン代謝物の濃度の大幅な変化が、17 日目の糞便サンプルで観察された。これらの変化は、糞便サンプルに存在する生存 B. longum BB536 菌の数が多いほど顕著であり、B. longum BB536を添加した発酵乳 (BY )摂取後の腸の健康の改善を示唆している。これらの結果は、B. longum BB536 菌の定期的な摂取が腸内環境を調整することで全体的な健康に貢献できるという考えを裏付けるものであると私たちは考えている。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Nutrients. 2024 Oct 22;16(21):3580.に掲載されたThe Impact of Fermented Milk Products Containing Bifidobacterium longum BB536 on the Gut Environment: A Randomized Double-Blind Placebo-Controlled Trial.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |