
Yiran Li et al., |
要約 |
| 腸内微生物叢と宿主の間の相互作用は、宿主の免疫系に影響を与える可能性があります。 腸内細菌の共生属であるBifidobacterium,は、宿主の健康に良い影響を与えるようです。 我々の以前の臨床研究では、B. longum subsp. longum BB536(以下B.longum BB536と記載)が免疫力の低い高齢者の自然免疫応答と獲得免疫応答を強化することが示されましたが、免疫調節機構はまだ不明です。 この研究では、健康な人から分離された末梢血単核球の樹状細胞 (DC) 表面マーカーが、加熱殺菌B.longum BB536との共培養によって評価されました。 樹状細胞マーカー、自然免疫活性、および血漿中のサイトカイン レベルも、4 週間の連続生B.longum BB536摂取によるランダム化二重盲検プラセボ対照並行群間研究 (UMIN000045564) によって評価されました。 B.longum BB536は、in vitro で形質細胞様樹状細胞 (pDC) 上の CD86 (訳者注:免疫グロブリンスーパーファミリーに属する共刺激分子です。CD86は、主にB細胞、樹状細胞、マクロファージを含む抗原提示細胞上で発現します)および HLA-DR(訳者注:細胞の表面マーカーで、自己と非自己を区別する上で重要な抗原)の発現を有意に増加させました。 プラセボ (n = 48) と比較して、生B.longum BB536 摂取の 4 週目に末梢形質細胞様樹状細胞上の CD86 発現の有意な増加が検出されました (n = 49; 1 × 1010 CFU/日)。 さらに、加熱殺菌B.longum BB536との共培養は IFNγ 発現レベルを有意に増加させ、IFNα1 および IFNβ 発現の増加傾向を示しました。 これらの発見は、B.longum BB536の摂取が末梢形質細胞様樹状細胞の活性化を通じて健康な個人に対して潜在的な免疫調節効果があることを示唆しています。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.材料と方法 |
| 2.1. in vitro分析 |
| 2.1.1. 末梢血単核球の調製 |
| 2.1.2. 末梢血単核球と加熱殺菌B.longum BB536の共培養 |
| 2.1.3. 蛍光活性化セルソーター分析 |
| 2.1.4. 遺伝子発現解析 |
| 2.2. 臨床研究 |
| 2.2.1. 参加者 |
| 2.2.2. 研究のデザインと介入 |
| 2.2.3. 蛍光活性化セルソーター分析 |
| 2.2.4. ナチュラルキラー細胞活性、好中球食作用、殺菌活性の測定 |
| 2.2.5. 末梢血単核球のToll様受容体リガンドに対する Ex Vivo での免疫学的応答の評価 |
| 2.2.6. 末梢血から分離された血漿中のサイトカインの測定 |
| 2.3. 統計 |
| 3. 結果 |
| 3.1. 熱処理したB.longum はin vitroで末梢血単核球の末梢血単核球の表面マーカーを活性化した |
| 3.2. in vitroでの末梢血単核球におけるインターフェロン遺伝子発現に対する 加熱殺菌B.longum BB536の効果 |
| 3.3. 臨床研究における初期参加者の特徴 |
| 3.4. in vivoでの 樹状細胞活性に対するB.longum BB536摂取の影響 |
| 3.5. B.longum BB536摂取が生体内でのナチュラルキラー細胞活性、好中球貪食活性、殺菌活性に及ぼす影響 |
| 3.6. B.longum BB536摂取が生体外での インターフェロン応答に及ぼす影響 |
| 3.7. 体外での血漿中のインターフェロン応答に対するB.longum BB536摂取の影響 |
| 4.考察 |
| 5.結論 |
| 本文 |
| 1.はじめに |
| 人間の免疫系と微生物叢の間の複雑な相互作用は、近年大きな注目を集めています。 人間の腸内細菌叢は、免疫応答の形成と全体的な健康の維持において重要な役割を果たしています [1]。 プロバイオティクスは、適切な量を投与すると宿主に健康上の利益をもたらす生きた微生物として定義され、免疫応答の有望な調節因子として浮上しています[2]。 |
| ビフィズス菌はヒトの腸内細菌叢の豊富なメンバーであり、特に乳児では初期定着菌のかなりの部分を占めています[3]。 多種多様な微生物が生息する中で、ビフィズス菌は、その潜在的な免疫調節効果でかなりの注目を集めています。 これらの有益な細菌は、宿主の免疫系と相互作用し、その恒常性(ホメオスタシス)に影響を与える能力を実証しています[4、5]。 |
| 乳児から分離されたBifidobacterium longum BB536 は、臨床的に有効で確立された多機能プロバイオティクスです。 人間が腸疾患の緩和、花粉過敏症の緩和、免疫の維持、病原体感染の予防に使用してきた長い歴史があります[6]。 B.longum BB536 の投与により、未就学児 (2 ~ 6 歳) において、プラセボ群と比較して、風邪による上気道疾患の期間、特に喉の痛みの期間が大幅に短縮されました [7]。 高齢者において、B.longum BB536 を摂取すると、発熱の頻度が大幅に減少し、末梢血中のナチュラルキラー (NK) 細胞活性と好中球貪食活性の低下が抑制され、体内の抗体力価が増加しました [8]。 これらの結果は、B.longum BB536 が宿主の免疫を強化し、呼吸器疾患の期間を短縮する可能性があることを示唆しています。 しかし、B.longum BB536とヒト腸管免疫系との特異的な相互作用は不明です。 |
| 免疫細胞の 70% 以上が腸内に存在するため、腸内細菌と腸上皮細胞との相互作用が宿主免疫系に影響を与える上で重要であると考えられるようになってきています [9]。 樹状細胞 (DC) は、成熟後に従来の樹状細胞と形質細胞様樹状細胞(pDC) に大別できます [10]。 これらは主に二次リンパ器官内、特に肺や腸の粘膜環境に存在し[11,12]、自然免疫および獲得免疫において中心的な位置を占める抗原提示細胞の非常に可塑的な細胞集団です。 pDC は、ウイルス感染の認識と、下流の刺激と抗ウイルス防御に必須のサイトカインである I 型インターフェロン (IFN) を有意なレベルで産生することに特化しています。 形質細胞様樹状細胞は、直接相互作用と抗原提示によって T 細胞の活性化と分化を促進し [13、14]、B 細胞と相互作用して分化を促進し、共刺激シグナルやサイトカインを提供することで抗体分泌を増強します [15、16]。 形質細胞様樹状細胞は、I 型 IFN によって ナチュラルキラー細胞の細胞傷害機能を強化し、病原体に対する免疫応答を強化することもできます [17、18、19]。 全体として、形質細胞様樹状細胞による刺激はさまざまな免疫細胞に広範な影響を及ぼし、病原体感染に対する協調的かつ効果的な免疫応答をもたらします。 プロバイオティクスは 形質細胞様樹状細胞の活性化を誘導できますが [20,21]、Bifidobacteriumとヒトの免疫系との相互作用は研究されていません。 我々は、B.longum BB536 の経口投与が腸内の 形質細胞様樹状細胞と相互作用することによって宿主免疫応答を誘導すると仮説を立てました。 したがって、我々は、B.longum BB536が in vitro および臨床試験で 形質細胞様樹状細胞の活性化を誘導できるかどうかを調査することを目的としました。 |
| 2.材料と方法 |
| 2.1. インビトロ分析 |
| この研究は、ヘルシンキ宣言の現行改訂版(2013年)およびヒトを対象とした医学および健康研究の倫理ガイドライン(2015年)に準拠しました。 研究計画書およびインフォームドコンセントフォームは、日本の和歌山県立医科大学の治験審査委員会(IRB)によって承認されました(承認番号 3345)。 健康な成人ドナーから書面によるインフォームドコンセントを得ました。 |
| 2.1.1. 末梢血単核球 (PBMC) の調製 |
| 各参加者から 20 ミリリットルの末梢血が収集されました。 血液は、提供された指示に従って、Lymphoprep™ Tube (Serumwerk、Bernburg、Germany) を使用して、できるだけ早く単核球の単離に使用されました。 赤血球は、塩化アンモニウム溶液 (eBioscience、San Diego, CA, USA) で 25 °C で 10 分間処理することにより除去されました。 溶血後、細胞を冷 D-PBS (Fujifilm、Tokyo, Japan) で 2 回洗浄し、計数し、実験用の PBMC として使用しました。 |
| 2.1.2. 末梢血単核球と加熱殺菌B.longum BB536の共培養 |
| B. longum subsp. longum BB536は、Morinaga Culture Collection (Morinaga Milk Industry Co., Ltd., Tokyo, Japan). で維持されているストック培養物から得られました。 細菌を、0.05%L-システインを含むMRSブロス(DIFCO, Mich., Detroit, MI, USA)中で37℃で16時間培養した。 その後、菌を回収し、滅菌蒸留水で3回洗浄し、培地成分を完全に除去した。 細菌を95℃で30分間処理し、計数し、RPMI-1640培地に懸濁しました。 末梢血単核球を、1 × 106 細胞/mL の加熱殺菌B.longum BB536 (hk-BB536) または Cpg-ODN 2216 (1 μM) (InvivoGen, San Diego, CA, USA) を含む 24 ウェル プレートに 5 × 105 細胞/ウェルで播種しました。無添加のウェルを対照として設計した。 共培養は、5% CO2 および湿潤条件下、37 °C で実行されました。 |
| 2.1.3. 蛍光活性化セルソーター (FACS) 分析 |
| 24 時間の共培養後、末梢血単核球を FITC 標識抗ヒト CD304 (クローン No. U21-1283)、PE-Cy7 標識抗ヒト CD123 (クローン No. 7G3)、APC 標識抗ヒト CD86 (クローン No. 7G3) 、Horizon Fixable Viability Stain 780 (BD, Franklin Lakes, NJ, USA) で処理後の PE 標識抗ヒト HLA-DR (クローン No. G46-6) (BD, Franklin Lakes, NJ, USA) およびヒトBD Fcブロック(BD, Franklin Lakes, NJ, USA)で染色しました。 次いで細胞を染色緩衝液で2回洗浄し、FACS分析(訳者注:FACS(Fluorescence activated cell sorter)検査とは、細胞を1個ずつ定量測定する精度の高い細胞測定法です)のためにCytofix緩衝液(BD, Franklin Lakes, NJ, USA)で固定した。 フローサイトメトリー(訳者注:微細な粒子を流体中に分散させ、その流体を細く流して、個々の粒子を光学的に分析する測定手法のこと)は、CD123+CD304+細胞として定義される形質細胞様樹状細胞を選択することによる形質細胞様樹状細胞の表面マーカーの分析に使用されました。 CD86+HLA-DR+形質細胞様樹状細胞をゲートして、表面マーカーの活性化を評価しました。 データは、FlowJo ver 7.6 (Tree Star, Ashland, OR, USA) を使用して処理および取得されました。 |
| 2.1.4. 遺伝子発現解析 |
| 4 時間の共培養後、NucleoSpin® RNA Plus キット (Takara, Kusatsu, Japan) を使用して全 RNA を抽出しました。 相補 DNA は、PrimeScript RT Master Mix (Takara, Japan) を使用して、メーカーのプロトコールに従って調製されました。 qRT-PCR は、7500 FAST リアルタイム PCR システム (Applied Biosystems、Waltham, MA, USA) で SYBR Premix Ex Taq (Takara, Japan) を使用して実行されました。 増幅プログラムは、最初に 95 °C で 30 秒間保持し、続いて 95 °C で 3 秒間、および 60 °C で 30 秒間を 40 サイクル行うことから構成されました。 プライマーの配列を表 1 に示します。2-ΔΔCt 法を適用して相対遺伝子発現を計算し、ハウスキーピング遺伝子 β-ACTIN の発現に対して正規化しました。 |
| 表 1 この研究で使用したプライマー |
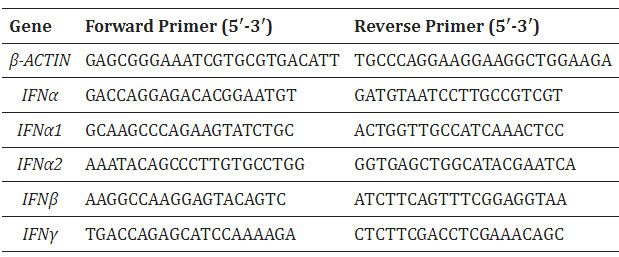 |
| 2.2. 臨床研究 |
| 2.2.1. 参加者 |
| 参加者100名は書面によるインフォームドコンセントを提供した20歳以上65歳未満の日本人成人であった。 その他の慢性または急性疾患、薬剤または重度の食物アレルギーのある参加者、プロバイオティクスのサプリメントやヨーグルトを使用している人、過度の飲酒をしている人、スクリーニング前1か月以内にインフルエンザまたは新型コロナウイルス感染症のワクチン接種を受けた人、および以下のような症状のある人 研究中のワクチン接種計画は除外された。 さらに、何らかの理由で主任研究者または副研究者が研究に不適当と判断した参加者も除外されました。 |
| 2.2.2. 研究のデザインと介入 |
| この研究は、千代田パラメディカルケアクリニック(Tokyo, Japan)の治験審査委員会によって承認された、ランダム化二重盲検プラセボ対照並行群間研究として実施されました。 研究プロトコルは、UMIN Clinical Trials Registry (UMIN000045564) に登録されました。 100 人の参加者が、投与前の 形質細胞様樹状細胞および mDC FACS の結果、性別、BMI、血液および尿のパラメータに基づいて、プラセボ群またはB.longumBB536群にランダムに割り当てられました。 ランダム化された参加者には、マルトデキストリンとともにコロニー形成単位約100億個のB. longum subsp. longum BB536を含む凍結乾燥粉末、またはマルトデキストリンのみを含むプラセボ粉末を毎日摂取し、滅菌牛乳を4週間経口投与された。 介入の前後に血液サンプルを収集しました。 |
| 2.2.3. 蛍光活性化セルソーター(FACS)分析 |
| 末梢血単核球(PBMC)の調製のために 18 ミリリットルの末梢血を収集しました。 それらはセクション 2.1.1 に記載されているように分離されました。 末梢血単核球は、形質細胞様樹状細胞については FITC 標識抗ヒト CD304、PE-Cy7 標識抗ヒト CD123、APC 標識抗ヒト CD86、および PE 標識抗ヒト HLA-DR で染色され、PE-Cy7- Horizon Fixable による処理後の mDC に対する標識抗ヒト CD11c、FITC 標識抗ヒト Lin1、APC 標識抗ヒト CD86、および PE 標識抗ヒト HLA-DR (BD, Franklin Lakes, NJ, USA) Viability Stain 780 (BD, Franklin Lakes, NJ, USA) およびヒト BD Fc ブロック (BD, Franklin Lakes, NJ, USA) で染色。 次いで細胞を染色緩衝液で2回洗浄し、FACS分析のためにCytofix緩衝液(BD, Franklin Lakes, NJ, USA)で固定した。 データは、FlowJo ver 7.6 (Tree Star, Ashland, OR, USA) を使用して処理および取得されました。 |
| 2.2.4. ナチュラルキラー細胞活性、好中球食作用、殺菌活性の測定 |
| ナチュラルキラー(NK) 細胞活性の測定のために 9 ミリリットルの末梢血が採取されました。この測定は、SRL Inc. (Tokyo, Japan) によってクロム 51 (51Cr) 放出法を使用して実施されました。 さらに、好中球の食作用と殺菌活性は、LSI メディエンス株式会社 (Tokyo, Japan)) によって測定されました。 |
| 2.2.5. 末梢血単核球のToll様受容体(TLR)リガンドに対する Ex Vivoでの免疫学的応答の評価 |
| Cpg-ODN 2216 および R848 に対する免疫学的応答は次のように評価しました。末梢血単核球を 2 × 105 細胞/ウェルの密度で 96 ウェルプレートに播種し、Cpg-ODN 2216 (1 μM) または R848 (10 μg/ mL)を4時間。 その後、総 RNA が単離され、セクション 2.1.4 に記載されているように qRT-PCR が実行されました。(訳者注:ex vivoとは、「生体外で」を意味する用語) |
| 2.2.6. 末梢血から分離された血漿中のサイトカインの測定 |
| 末梢血単核球分離ステップから得られた血漿をサイトカイン測定に使用しました。 IFNα2a、IFNβ、IFNγ、IL-10、IL-12/IL-23p40、IL-12p70、IL-15、IL-23、および MCP-1 の濃度は、U-PLEX バイオマーカー グループ 1 (ヒト) を使用して測定されました。 重複サンプルでのアッセイ (MSD Maryland、Rahway、NJ、USA)。 測定はメーカーのプロトコルに従って実行され、データは MESO Quick Plex SQ 120 (MSD Maryland、Rahway、NJ、USA) を使用して収集されました。 データ処理と濃度計算は、DISCOVERY WORKBENCH 4.0 (MSD Maryland、Rahway、NJ、USA) を使用して実行されました。 |
| 2.3. 統計 |
| すべてのデータは平均値と標準誤差として表示されます。 統計分析は、SPSS IBM バージョン 26 (IBM Corp.、Armonk, NY, USA) を使用して実行されました。 実験グループ間の遺伝子発現の差の統計的有意性を評価するために、それらの ΔCt 値を比較しました。 樹状細胞マーカーの幾何平均については、インビトロでの共培養データの統計分析のために Tukey の多重比較検定を実行しました。 さらに、被験食品群を説明変数、ベースライン値を共変量として共分散分析(ANCOVA)を実施した。 正規性については Shapiro-Wilk 検定が使用されました。 データは正規分布に従うため、ベースラインと比較したグループ内変化は対応のある t 検定を使用して評価されました。 正規分布の帰無仮説はシャピロ・ウィルク検定に従って棄却されたため、ノンパラメトリック・マン・ホイットニーU検定を利用して、ナチュラルキラー細胞活性、好中球性食作用および殺菌活性、末梢血単核球におけるIFN遺伝子発現および血漿中のサイトカイン濃度における群差を比較した。グラフは Prism 9.0 を使用して生成されました。 |
| 3. 結果 |
| 3.1. 熱処理したB.longum BB536はin vitroで末梢血単核球の形質細胞様樹状細胞の表面マーカーを活性化した |
| この研究では、フローサイトメトリー分析の結果は、Cpg-ODN 2216 または 加熱殺菌B.longum BB536の共培養が全生細胞中の CD123+CD304+ 細胞の割合に影響を及ぼさないことを示しました (図 1a)。 強力なToll様受容体9リガンドであるCpg-ODN 2216は、表面マーカーCD86(p < 0.01)およびHLA-DR(p < 0.01)の発現を強力に誘導しました(図1c、d)。 末梢血単核球を 加熱殺菌B.longum BB536と共培養して 24 時間後、総形質細胞様樹状細胞に対する CD86+HLA-DR+ の比率が大幅に増加しました (図 1b)。 加熱殺菌B.longum BB536は、コントロールと比較して、形質細胞様樹状細胞上の表面マーカー CD86 (p < 0.0001) および HLA-DR (p < 0.01) も上方制御しました (図 1c、d)。 |
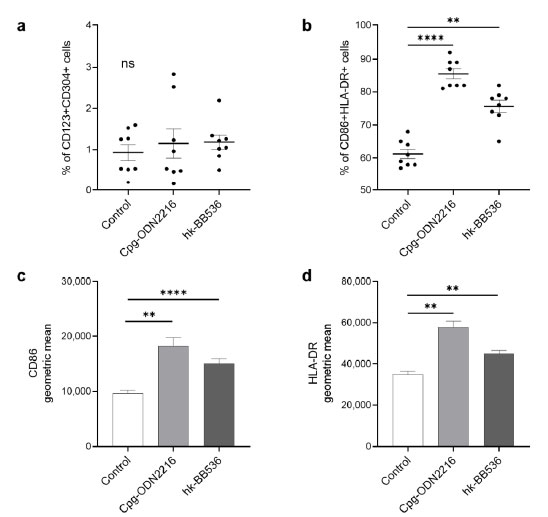 |
図1 形質細胞様樹状細胞(pDC )マーカーの活性化に対する Cpg-ODN 2216 および 加熱殺菌(hk-)B.longum BB536の効果。 (a) 全生細胞中の CD123+CD304+ 細胞の割合。 (b) 形質細胞様樹状細胞(pDC )内の CD86+HLA-DR+ 細胞の割合。 (c) 全形質細胞様樹状細胞(pDC )におけるCD86活性化の幾何平均。 (d) 全形質細胞様樹状細胞(pDC )における HLA-DR 活性化の幾何平均。 すべてのデータは平均値 ± SE (n = 8) として表されます。 **、p < 0.01 および ****、p < 0.0001 対照との有意差。 ns: 有意差なし。 |
| 3.2. in vitroでの 末梢血単核球におけるインターフェロン遺伝子発現に対する 加熱殺菌B.longum BB536の効果 |
| 加熱殺菌B.longum BB536が 末梢血単核球の免疫応答に影響を与えるかどうかをさらに決定するために、末梢血単核球 における IFN 遺伝子、IFNα、IFNα1、IFNα2、IFNβ、および IFNγ の相対遺伝子発現レベルを、加熱殺菌B.longum BB536 または Cpg-ODN 2216 4 時間 との共培養後に qRT-PCR によって分析しました。 Cpg-ODN 2216 は、コントロールと比較して、これらの遺伝子の極めて高い発現を誘導しました。 加熱殺菌B.longum BB536との共培養は、IFNγ 発現を有意に増加させ(p < 0.05)(図 2e)、対照と比較して 末梢血単核球における IFNα1 および IFNβ の発現に高い傾向が検出されました(図 2b、d)。 |
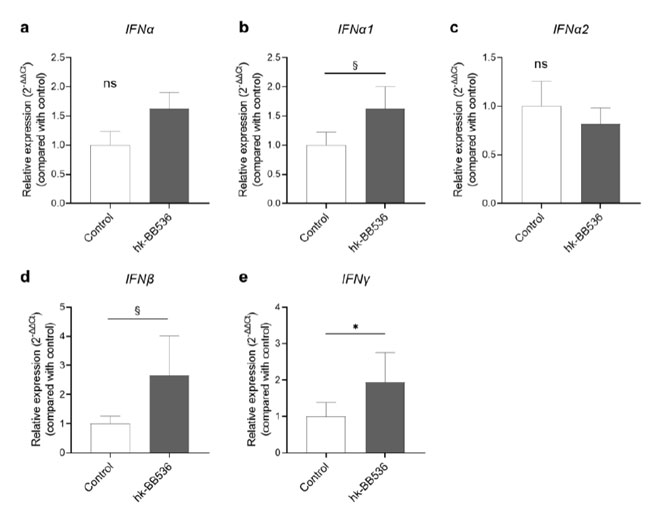 |
図 2 qRT-PCR 分析による末梢血単核球の遺伝子発現レベルに対する 加熱殺菌(hk-)B.longum BB536の効果。 (a) IFNα; (b) IFNα1; (c) IFNα2; (d) IFNβ。 (e) IFNγ。 すべてのデータは平均値 ± SE (n = 8) として表されます。 *、p < 0.05 および §、0.5 ≤ p < 0.1 対対照。 ns: 有意差なし。 |
| 3.3. 臨床研究における初期参加者の特徴 |
| 合計100人の健康な成人に研究への参加を依頼し、参加者1名が個人的な理由で研究から辞退した。 スクリーニング訪問時に参加者から収集された血液サンプルは、形質細胞様樹状細胞表面マーカー CD86 および HLA-DR の分析と安全性パラメーターのテストに使用されました。 形質細胞様樹状細胞上の表面マーカー活性の結果は、ランダム化の優先要素と考えられました。 参加者の1人は、個人的なワクチン接種計画を理由に治験を辞退した。 残りの99人の参加者は、生B.longum BB5361×1010 CFU/日; n = 50)またはプラセボ(B.longum BB536なし; n = 49)のいずれかを投与される2つのグループに無作為に割り付けられました。 プラセボ群の参加者の1人は、身体的な理由で採血に失敗したため辞退した。 さらに、B.longum BB536 グループでは最低消費率 (80%) を満たしていなかったため、1 人の参加者がプロトコルごとの分析から除外されました (図 3)。 2 つのグループの分析された参加者 (治療意図のある集団) のベースライン特性を表 1 に示します。グループ間に有意差は見つかりませんでした (表 2)。介入期間中に重大な臨床副作用は報告されませんでした。 |
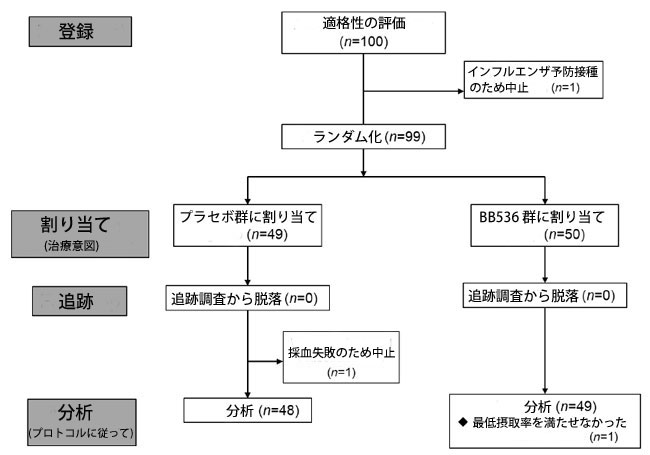 |
| 図 3 このランダム化二重盲検プラセボ対照臨床試験の CONSORT フローチャート |
| 表 2 研究参加者のベースライン特性 (治療意図のある集団) |
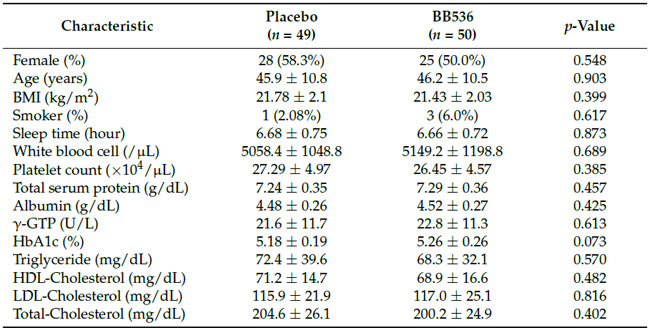 |
データは平均±SEまたはn(%)として表されます。 検査値は日本臨床検査標準委員会発行の日本基準間隔を参考に評価した。 BMI、肥満指数。 γ-GTP、γ-グルタミルトランスペプチダーゼ。 HbA1c、糖化ヘモグロビン。 HDL、高密度リポタンパク質。 LDL、低密度リポタンパク質。 |
| 3.4. in vivoでの 樹状細胞活性に対する B.longum BB536摂取の影響 |
| 我々は、加熱殺菌B.longum BB536が in vitro で 形質細胞様樹状細胞(pDC)に対して刺激活性を示すことを検出しました。 我々は、ランダム化二重盲検プラセボ対照臨床研究において、4週間のB.longum BB536投与前後の末梢血単核球(PBMC)における形質細胞様樹状細胞(pDC)およびmDCにおける表面マーカーCD86およびHLA-DRを含む樹状細胞活性をそれぞれ評価した。 いずれのマーカーについても、ベースラインにおいて B.longum BB536群とプラセボ群の間に有意差はありませんでした。 4 週間の介入後、B.longum BB536グループでは形質細胞様樹状細胞に対する CD86 活性の有意な増加が観察されましたが (p < 0.05)、プラセボ グループでは変化は観察されませんでした。 4週目では、形質細胞様樹状細胞上のCD86の発現はプラセボ群よりもB.longum BB536群で有意に高かった(p<0.05)(図4a)。 B.longum BB536グループとプラセボグループの両方で、形質細胞様樹状細胞および CD86 の表面マーカー HLA-DR と mDC の HLA-DR に大幅な減少がありましたが、グループ間の有意な変化は観察されませんでした (図 4b-d)。 |
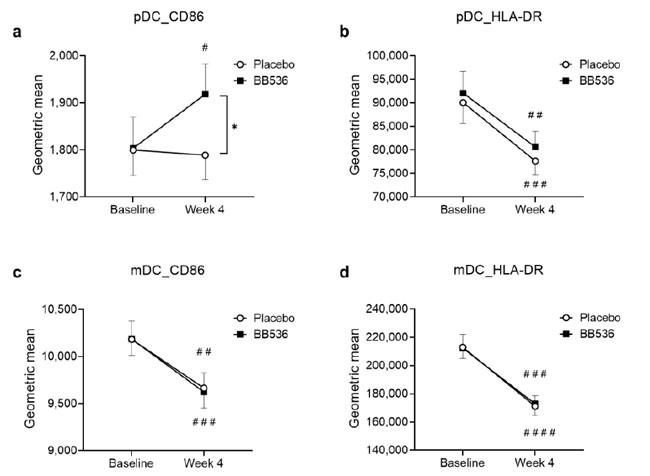 |
図 4 in vivoでの 形質細胞様樹状細胞(pDC) および mDC の活性変化(表面マーカーで測定)に対するB.longum BB536投与の効果、4 週間の摂取期間前後のプラセボ群とB.longum BB536 群の比較。 (a) 形質細胞様樹状細胞(pDC)上の CD86 活性。 (b) 形質細胞様樹状細胞(pDC)に対する HLA-DR 活性。 (c) mDC 上の CD86 活性。 (d) mDC 上の HLA-DR 活性。 すべてのデータは平均値±SEです。 *、2 つのグループ間で p < 0.05; 介入前と介入後の各グループ内で #、p < 0.05、##、p < 0.01、###、p < 0.001、および ####、p < 0.0001。 |
| 3.5. B.longum BB536摂取が生体内でのナチュラルキラー細胞活性、好中球貪食活性、殺菌活性に及ぼす影響 |
| 我々は、プラセボ群とB.longum BB536群の参加者の末梢血中のナチュラルキラー細胞活性と好中球の食作用および殺菌活性を4週間の摂取前後で調査した。 ベースラインと比較して、プラセボ群 (p < 0.001) と B.longum BB536群 (p < 0.01) の両方で ナチュラルキラー細胞活性の有意な低下が観察されました (図 5a)。 4 週間の摂取後、プラセボ群と B.longum BB536群の間に有意差はありませんでした (図 5)。 |
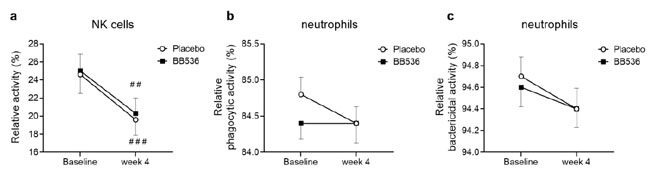 |
図 5 相対的な ナチュラルキラー細胞活性 プラセボおよびB.longum BB536の4週間摂取前後の末梢血単核球(PBMC)における(a)および好中球の貪食活性(b)および殺菌活性(c)。 すべてのデータは平均値±SEです。 介入前と介入後のグループ内で ##、p < 0.01、および ###、p < 0.001。 |
| 3.6. B.longum BB536摂取が生体外での インターフェロン(IFN )応答に及ぼす影響 |
| 末梢血中の末梢血単核球(PBMC)の免疫応答を評価するには、末梢血単核球における IFNα、IFNα1、IFNα2、IFNβ、および IFNγ 遺伝子の相対発現レベルは、R848 (表 3) または Cpg-ODN 2216 (表 4) で 4 時間刺激した後、qRT-PCR によって定量的に分析されました。 ベースラインまたは 4 週目にプラセボと B.longum BB536の間に有意差は見つかりませんでした。 しかし、摂取前後のB.longum BB536群におけるIFNα1の-ΔΔCt変化は、ex vivoでCpg-ODN2216刺激を行ったプラセボ群よりも有意に低かった(表4)。 |
| 表3 ex vivoでのR848刺激によるIFN遺伝子の相対発現レベル |
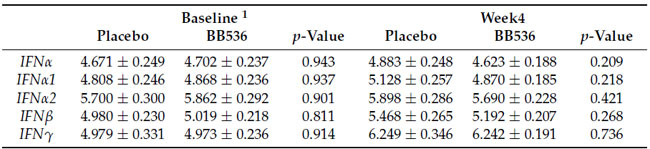 |
| 1 すべてのデータは平均値 ± SE です。 |
| 表4 ex vivoでのCpg-ODN2216刺激によるインターフェロン遺伝子の相対発現レベル |
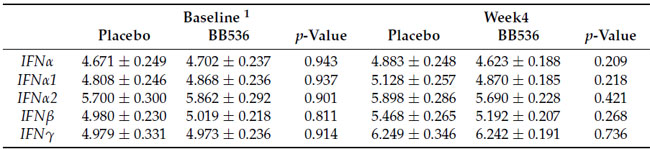 |
| 1 すべてのデータは平均値 ± SE です。 |
| 3.7. 体外での血漿中の インターフェロン(IFN )応答に対する B.longum BB536 摂取の影響 |
| 血漿中のサイトカインを正確に測定するために、IFNα2a、IFNβ、IFNγ、IL-10、IL-12/IL-23p40、IL-12p70、IL-15、IL-23、および MCP-1 のサイトカイン濃度を、 ECL ベースの U-PLEX アッセイ法は、サンプル中の微量の標的分子を検出する際のこのイムノアッセイの感度が高いためです。 それでも、IFNα2a、IFNβ、IFNγ、IL-10、IL-12p70、IL-23の測定値はメーカーの指示による定量限界を下回りました。 IL-12/IL-23p40、IL-15、およびMCP-1の測定値はすべて標準曲線から得られる値の範囲内にあり、これらのデータはさらなる統計解析に使用されました。 |
| 図6に示すように、ベースラインまたは4週目に、プラセボ群とB.longum BB536群の間でIL-12/IL-23p40またはMCP-1に有意差はありませんでした(図6a、c)。 4週間の摂取後、B.longum BB536グループはプラセボグループよりも有意に低いIL-15を示しました(図6b)。 個人差が統計結果に影響を与えることを考慮し、ベースラインから摂取4週間後までのサイトカイン濃度の変化を算出したところ、IL-12/IL-23p40、IL-15、MCP-1には有意差は認められませんでした。 (図 6d–f)。 |
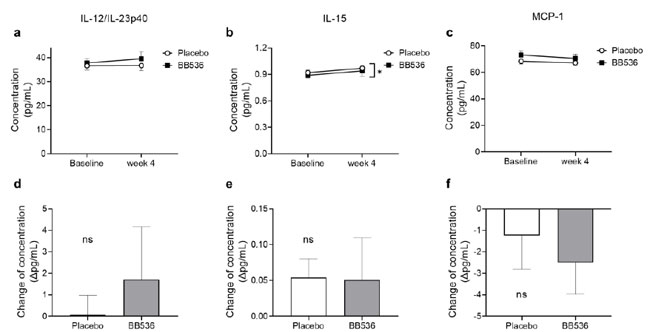 |
図6 血漿中のサイトカイン濃度と、末梢血中のプラセボおよびB.longum BB536摂取の4週間後のベースラインからの変化。 (a) 血漿中のIL-12/IL-23p40濃度。 (b) 血漿中のIL-15濃度。 (c) 血漿中の MCP-1 濃度。 (d) IL-12/IL-23p40 濃度の変化。 (e) IL-15 濃度の変化。 (f) MCP-1 濃度の変化。 すべてのデータは平均値±SEです。 *、グループ間では p < 0.05。 ns: 有意差なし。 |
| 4.考察 |
| B.longum BB536の摂取により、経腸栄養を行っている入院高齢患者において ナチュラルキラー細胞活性が維持され、血清中の IgA が増加することで免疫反応が強化されたと報告されています。 B.longum BB536の補給も、A/H1N1 インフルエンザワクチン接種後の抗体力価を増加させることにより、獲得免疫反応を高めました [22]。 この研究では、B.longum BB536 がヒト 末梢血単核球由来の形質細胞様樹状細胞を活性化し、in vitro で CD86 および HLA-DR マーカーの発現を誘導することを実証しました。 健康な成人を対象とした当社の二重盲検ランダム化臨床試験では、B.longum BB536の摂取により、4週目にプラセボと比較して末梢血単核球の形質細胞様樹状細胞(pDC)におけるCD86発現が増加することが明らかになりました。 |
| 腸管免疫細胞のうち、形質細胞様樹状細胞(pDC)は病原体から胃腸管を防御し、宿主の免疫恒常性を維持する上で重要な役割を果たしています [23,24]。 形質細胞様樹状細胞上の表面マーカー CD86 および HLA-DR は、免疫系において重要な役割を果たします。 CD86 は、T 細胞上のリガンド CD28 および CTLA-4 と結合して T 細胞の活性化、サイトカイン産生、増殖を促進し、病原体または腫瘍に対する強力な免疫応答を促進することにより免疫制御に関与しており [25、26]、HLA-DR は 病原体や異常細胞などの外来抗原を効果的に CD4+ T ヘルパー細胞に提示し、適応免疫応答を開始します [27、28]。 Wittmannら[29]は、抗マウスPDCA-1抗体を使用してマウスの形質細胞様樹状細胞(pDC)を枯渇させた そして、B. adolescentis は対照と比較して Yersinia enterocolitica 感染に対する防御機能を失っていることを発見し、ビフィズス菌が 形質細胞様樹状細胞(pDC)を介した腸内の病原体の除去を通じて宿主の免疫応答を活性化することを示唆しました。 この研究では、加熱殺菌B.longum BB536は共培養後に 末梢血単核球の形質細胞様樹状細胞上の CD86 および HLA-DR の発現を有意に増加させ、臨床研究では 4 週間の B.longum BB536 摂取後にも CD86 発現の増加が検出されました。 興味深いことに、加熱殺菌B.longum BB536処理とコントロールの間で形質細胞様樹状細胞比に有意差は観察されませんでした。 これらの結果は、加熱殺菌B.longum BB536が 形質細胞様樹状細胞の増殖を刺激するのではなく、形質細胞様樹状細胞における CD86 および HLA-DR の発現を上昇させることによって免疫応答を活性化する可能性があることを示唆しました。 しかし、4週間の介入後、B.longum BB536群とプラセボ群の間で形質細胞様樹状細胞におけるHLA-DR発現の有意な変化は観察されなかった。 細菌と宿主細胞の直接的な相互作用と比較して、B.longum BB536の経口摂取後の相互作用は、腸リンパ器官を介して末梢形質細胞様樹状細胞に部分的な刺激しか及ぼさないように思われました。 |
| さらに、加熱殺菌B.longum BB536との 4 時間の共培養により、インターフェロンγ(IFNγ )の発現レベルが大幅に増加し、IFNα1 および IFNβ の発現レベルに増加傾向が観察されました。 体中を循環するシグナル伝達タンパク質のグループである インターフェロン(IFN )は、ウイルスやその他の病原性感染症への応答において重要な役割を果たしています [15、30]。 末梢血細胞では、形質細胞様樹状細胞は必須の番兵として機能し、高レベルでの IRF7 の構成的発現により、主に I 型インターフェロンの産生に寄与しています [31]。 しかし、杉村ら [21]は、加熱死滅させたLactococcus lactis JCM5805による形質細胞様樹状細胞刺激後、上清中のIFNα産生がELISAでは検出できないことを報告した。 この研究では、検出感度が非常に高い S-PLEX アッセイを実施して、共培養 24 時間後の上清中の IFNα2a および IFNβ 濃度を定量しましたが、ほとんどの測定値は検出下限を下回っていました。 末梢血中の形質細胞様樹状細胞亜集団とは異なり、パイエル板から単離された腸管形質細胞様樹状細胞は、マウスの脾臓由来形質細胞様樹状細胞と比較して I 型インターフェロン(IFN)の産生が低下しています。 この違いは、無害な抗原や共生細菌に対する過剰な免疫反応を防ぐことを目的とした、腸内の免疫反応の厳密な制御に起因すると考えられています[33]。 これは、共培養実験では I 型 インターフェロン遺伝子発現の誘導が起こったのに、臨床研究では有意な変化が観察されなかった理由についての説明を示唆している可能性があります。 ウイルス感染時の末梢形質細胞様樹状細胞(pDC)によるI型インターフェロン(IFNα/β)産生を特徴とする急性免疫応答と比較して、腸管形質細胞様樹状細胞は粘膜病原体に対する耐性と免疫間の恒常性において重要な役割を果たす傾向がある。 B.longum BB536によって引き起こされる in vivo での I 型 インターフェロン 産生は非常に穏やかであると予想するのが合理的です。 |
| 以前の研究では、生きたB.longum BB536細菌はヒト抹消血単核球(PBMC)と24時間共培養するとインターフェロンγ(IFNγ)の量を高度に誘導した[34]。 インターフェロンγは重要なサイトカインとして、自然免疫応答と獲得免疫応答の両方において重要な役割を果たし、主にマクロファージを活性化し、MHCクラスII分子の発現を誘導します。 この研究では、インターフェロンγ遺伝子発現レベルは、in vitro で 加熱殺菌B.longum BB536 によって有意に誘導されました (図 2e)。 サイトカイン IL-12 は、主に形質細胞様樹状細胞やマクロファージなどの活性化 APC によって産生されると考えられており、ナチュラルキラー細胞や T 細胞からの インターフェロンγの産生を誘導することができます [35]。 臨床研究の結果は、B.longum BB536グループの血漿中の IL-12 濃度がプラセボグループよりもベースラインレベルを超えて上昇したが、グループ間で有意な差はなかったことが示されました (図 6d)。 これらの結果は、B.longum BB536が病原体感染に対する宿主の防御を改善する潜在的な効果があることを示唆しています。 |
| 一方、自然免疫応答のレベルに対するB.longum BB536の効果に関しては、好中球の貪食活性または殺菌活性 (図 5) または MCP-1 (図 6c) には明らかな変化は検出されませんでした。 参加者間の大きなばらつきを考慮すると、4週目の血漿中のIL-15濃度はB.longum BB536とプラセボの間で大きく異なりましたが、摂取前と摂取後のIL-15濃度には差はありませんでした(図6b、e)。 さらに、多くの種類のサイトカインが定量限界を下回っていたため、血漿中では検出されなかったことに気づきました。 今回の臨床試験は、新型コロナウイルス感染症が流行する冬季に実施されたにもかかわらず、対象者は全員が健康な人であった可能性が高い。 個人の衛生習慣とマスク着用の改善により、感染の可能性が大幅に減少しました[36]。 健康な宿主では ナチュラルキラー細胞活性のリズミカルな変動が年間を通じて報告されており、特に冬の季節の初期段階で劇的な増加が見られます [37]。 この ナチュラルキラー細胞活性の増加は、冬の寒く乾燥した気候の始まりと一致します。 このような状況では、宿主の自然免疫応答がより活発になります。 マスクの着用は、ウイルスの蔓延を防ぎ、鼻粘膜や喉などの上気道に潤いを与えるのに非常に役立ちます[38]。 これにより、ナチュラルキラー細胞や好中球の活動などの自然免疫応答の過剰な発生が軽減される可能性があります。 これまでの臨床研究では、経口投与されたプロバイオティクスが末梢血中のナチュラルキラー細胞活性を大幅に上昇させる可能性があることが実証されています。 私たちは、これらの研究が60歳以上の個人[39,40]または通常よりも白血球数が少ない被験者[41]を募集しており、介入期間が長かった(8週間以上)[42]ことに気づきました。 そして彼らの所見は我々の以前の臨床転帰と一致していた[8,22]。 健康な男性被験者(LcS、n = 34、対照、n = 34)における4週間の介入にわたるLactobacillus casei Shirota摂取後、ナチュラルキラー細胞活性の変化は検出されなかった[43]。 しかし、243人の大学運動選手(LcS、n = 126、プラセボ、n = 117)を対象とした別の臨床試験では、20週間の摂取期間後にナチュラルキラー細胞活性の有意な増加が観察された[44]。 これらのこれまでの発見は、被験者の免疫状況と介入期間によって異なる結果が生じる可能性があることを示唆しています。 |
| この臨床研究の限界の1つは、新型コロナウイルス感染症(COVID-19)のパンデミック中に取られた防御措置の強力な効果と、ベースラインでの免疫レベルが正常範囲内にあったため、免疫関連の臨床転帰の大きな変動を観察することが困難だったことかもしれない。 さらに、投与量と介入期間もさらに調査する必要があり、マスクを着用しない追加の臨床研究が必要です。 |
| 5.結論 |
| 結論として、加熱殺菌B.longum BB536は、in vitro でヒト末梢血単核球と共培養した場合、形質細胞様樹状細胞上で CD86 および HLA-DR 発現を有意に誘導しました。 プラセボと比較して、生B.longum BB536を4週間経口摂取した後、末梢血形質細胞様樹状細胞におけるCD86の有意な増加が確認された。 さらに、IFNγ 発現の有意な増加と、IFNα1 および IFNβ 発現の高い傾向が in vitro で観察されました。 これらの結果は、B. longum BB536 摂取が形質細胞様樹状細胞活性化を通じて健康な成人の免疫応答を改善する可能性を示唆しています。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Nutrients. 2024 Jan; 16(1): 42.に掲載されたThe Potential Immunomodulatory Effect of Bifidobacterium longum subsp longum BB536 on Healthy Adults through Plasmacytoid Dendritic Cell Activation in the Peripheral Blood.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |