
Tsutomu Takeda et al., |
要約/ |
| はじめに:高齢者の慢性便秘に対するプロバイオティクスの治療効果に関する報告はほとんどない。 この研究では、慢性便秘のある高齢者におけるBifidobacterium longum BB536 の効果を評価しました。 |
| 方法:これは、日本における無作為化二重盲検プラセボ対照並行群間優越性試験(UMIN 000033031)であった。 慢性便秘と診断された80人の高齢者を、プロバイオティクス(B.longum BB536、5×1010コロニー形成単位、n = 39)またはプラセボ(n = 41)のいずれかを1日1回、最大4日間投与する群にランダムに(1:1)で割り当てました。 数週間。 便秘の重症度は、便秘スコアリング システムを使用して評価されました。 主要評価項目は、4週目における2群間の便秘スコアリングシステム合計スコアのベースラインからの変化の差であった。 |
| 結果:BB536群の患者38名とプラセボ群の患者41名を含む合計79名の患者(平均年齢77.9歳)が研究を完了した。 主要評価項目は有意ではありませんでしたが(P = 0.074)、BB536 グループではベースラインから 4 週目までに有意な改善が見られましたが(P < 0.01)、プラセボ グループでは有意な変化はありませんでした。 4週目に2つのグループ間で、排便頻度(P = 0.008)および排便失敗(P = 0.051)の下位スケールについて、それぞれ、ベースラインからの変化に有意な差と差が出る傾向があった。 プロバイオティクスに関連する有害事象はほとんど観察されませんでした。 |
| 議論:主要評価項目は有意ではありませんでした。 しかし、プロバイオティクスのサプリメントを摂取すると、便通が大幅に改善されました。 これらの結果は、B. longumBB536 の補給が安全であり、高齢者の慢性便秘の改善に部分的に効果があることを示唆しています。 |
 |
| 目次(クリックして記事にアクセスできます) |
| 2方法 |
| 2.1.設計の概要 |
| 2.2.設定と参加者 |
| 2.3.ランダム化、介入、評価 |
| 2.4.糞便DNAの調製、微生物叢の解析、微生物叢の機能 |
| 2.5統計分析 |
| 3.結果 |
| 3.1.排便 |
| 3.2.腸内細菌叢と微生物叢の機能 |
| 3.3.安全性 |
| 4.議論 |
| 本文 |
| 1.はじめに |
| 慢性便秘は、世界の高齢化社会における健康長寿の主な障害の 1 つです。 メタ分析では、Rome IV 基準を使用した場合の慢性便秘の有病率は 10.1% であり、その発生率は年齢とともに増加することが示されました (1,2)。 慢性便秘症患者は今後も増加すると予想されており、慢性便秘症患者の予後は不良であることが報告されている(3,4)。 日常臨床では便秘ケアは必ずしも重要視されておらず、下剤使用時の腹痛や膨満感、下痢を恐れて社会に出ることを躊躇する高齢者の患者さんに遭遇します。 刺激性下剤は比較的一般的ですが、慢性的に使用すると、腹痛、下痢、耐性の発現など、いくつかの副作用が生じます(5)。 プロバイオティクスが胃腸疾患に有効であるという臨床証拠は増えているが、急性感染性下痢、抗生物質関連下痢、Clostridium difficile関連下痢、早産児の壊死性腸炎を除き、プロバイオティクスの日常的な臨床使用を裏付ける証拠はまだ不十分である。 乳児では副作用が少ない (2,6)。 さらに、特に高齢者の慢性便秘に対するプロバイオティクスの効果については十分な証拠がありません。 |
| 近年、次世代シークエンシングを利用した報告により、高齢者の便中のビフィズス菌の量が減少していることが示されています(7)。 慢性便秘と腸内細菌の関係が注目されています。 Bifidobacterium longum BB536は元々健康な乳児から分離されたもので、臨床的に有効で確立された多機能プロバイオティクスであり、胃腸疾患、免疫疾患、感染症の軽減に人類が使用してきた長い歴史があります (8)。 B. longum BB536は、乳製品と一緒に与えると腸の動きの異常に効果があることがわかっています (9)。 スターターカルチャー(Streptococcus thermophilus およびLactobacillus bulgaricus)で発酵させた標準的なヨーグルトと比較して、BB536ヨーグルト(スターターカルチャーとB. longum BB536で発酵させたもの)を補給すると、ビフィズス菌の量が増加し、腸内環境が改善されました(糞便レベルの低下など)。 アンモニア、短鎖酸と揮発性酸のレベルの増加) (9,10)。 この株の粉末形態は、経腸栄養を受けている高齢患者に有用であることが報告されている(11)。 この研究では、近藤ら。 どちらの治療でも全体の排便回数にグループ間差はなかったと報告しましたが、ベースラインの排便回数に基づくサブグループ分析では、排便頻度が低い患者では排便が大幅に増加し、患者では排便が大幅に減少したことが明らかになりました。 BB536 グループでは介入後に高頻度で発生しました。 それにもかかわらず、外来治療を受けている高齢患者の慢性便秘に対するBB536粉末の有効性や、プロバイオティクスの投与による腸内細菌叢の変化については、詳細には調査されていない。 したがって、私たちは、この株の二重盲検ランダム化対照試験を実施して、その有効性を検証することを目的としました。 |
| 2方法 |
| 2.1.設計の概要 |
| この研究は順天堂大学倫理委員会の承認を得て実施され、ヘルシンキ宣言の教義に基づいて行われた。 各参加者からインフォームドコンセントを得た。 この研究は、University Hospital Medical Research Network (UMIN000033031) に登録されています。 |
| 2.2.設定と参加者 |
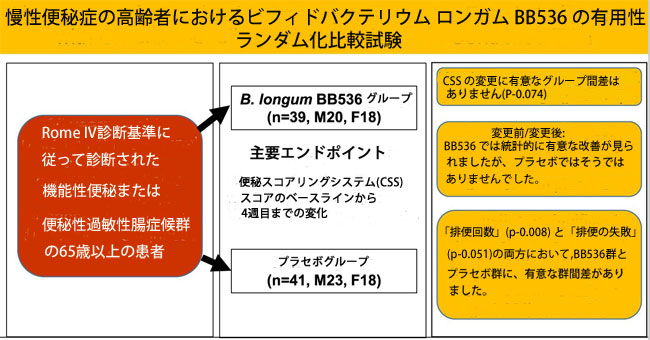
| この研究は順天堂大学東京江東老人医療センター消化器科の外来患者を対象に実施された。 包含基準は次のとおりであった:(i)同意時点で65歳以上の男性および女性患者、(ii)Rome IV診断基準に従って機能性便秘または便秘性過敏性腸症候群と診断された患者、(iii)患者 便秘スコアリングシステム(CSS)スコアが6以上と診断された患者、および(iv)この研究への参加について書面によるインフォームドコンセントを提供した患者。 除外基準は次のとおりであった。(i) 結腸直腸癌、結腸直腸または肛門の狭窄、直腸腫瘤または直腸過負荷、偽性腸閉塞、または巨大直腸による器質性便秘。 (ii) 脊髄病変、脳梗塞、パーキンソン病、多発性硬化症による神経疾患。 (iii) 糖尿病、高カルシウム血症、低カリウム血症、低マグネシウム血症、甲状腺機能低下症、または尿毒症。 (iv) オピオイド、抗コリン薬、カルシウムチャネル遮断薬、抗けいれん薬、向精神薬、鎮痙薬、ヒスタミン H1 受容体拮抗薬、または制吐薬の使用。 (v) アミロイドーシス、全身性強皮症、または重金属中毒。 ⑥重篤な脳血管疾患、肝疾患、腎疾患、消化器疾患、内分泌・代謝疾患、届出が必要な感染症、消化器系がんの既往歴、現在治療・投薬を受けている方、大きな手術の既往がある方 胃切除術、胃腸縫合術、腸切除術などの消化器系、または感染性腸炎や炎症性腸症候群などの消化器疾患。 (vii) 排便に影響を与える薬剤(抗生物質、整腸剤、下痢止めなど)、または特定の健康食品やサプリメント(乳酸菌、ビフィズス菌、オリゴ糖、食物繊維など)を定期的に使用している。 (viii) 血圧/血液検査における重大な異常、重度の貧血、または薬物や食物に対するアレルギー。 (ix) 過度の喫煙、アルコールの常用、不規則な食事、異常な睡眠サイクル、またはその他の生活習慣の異常。 (x) 上記に加え、主任研究者は患者を不適格とみなす場合がある。 |
| 2.3.ランダム化、介入、評価 |
| 適格性の評価後、参加者を性別(男性対女性)およびCSSスコア(9以上対9未満)で階層化した後、プロバイオティクス(BB536)グループとプラセボグループの参加者のバランスの取れた割り当てを確保するためランダムに並べ替えたブロックを使用して無作為化を実施しました。 B. longum BB536の凍結乾燥粉末 (5 × 1010 コロニー形成単位以上、2 g/パッケージ) またはプラセボを含む小袋を、以前に記載されているように調製しました (8)。 各参加者はプロバイオティクスまたはプラセボの小袋を毎日 1 袋ずつ 4 週間摂取し、4 週間の事後観察に参加するよう求められました。 研究チームのメンバーは全員、研究が終了してデータベースがロックされるまで、割り当てられた配列を知りませんでした。 |
| 患者は:CSS (12) (補足表 1、http://links.lww.com/AJG/C706 を参照)および胃腸逆流症 (FSSG; 胃腸逆流症 [GERD]) の症状の頻度スケール (13)の2 つのアンケートによって評価されました アンケートは、介入開始前(ベースライン、第 0 週)、介入開始後(第 4 週)、および期間の終了時(第 8 週)の外来受診時に患者に行われました。 CSS アンケートでは、(i) 排便の頻度、(ii) 困難さ: 痛みを伴う排出努力、(iii) 完全性: 不完全な排出の感覚、(iv) 痛み: 腹痛、(v) 時間: の合計 8 項目を評価しました。 (vi) 介助: 介助の種類 (下剤、浣腸、手動操作)、(vii) 失敗: 24 時間ごとの避難試行の失敗、(viii) 病歴: 便秘の期間 (年)。 8項目のスコアを総合CSSスコアとして集計しました。 合計 12 項目を含む FSSG スケールを使用して、胃食道逆流症の症状を評価しました。 ベースラインから 4 週目および 8 週目までの患者のスコアの変化も調べました。 介入後(4週目)の合計CSSが主要評価項目であり、FSSG合計スコアとCSSおよびGERDの下位尺度スコア、およびベースラインからの変化スコアが副次評価項目であった。 |
| 2.4.糞便DNAの調製、微生物叢の解析、微生物叢の機能 |
| 介入の前後に糞便サンプルを収集した。 糞便 DNA の調製と微生物叢の分析は、以前に記載されているように実行されました (14)。 簡単に説明すると、0週目と4週目にテクノスルガ採便キット ブラシタイプを用いて糞便サンプルを採取した。糞便サンプルからDNAを抽出し、精製したDNAを2,000mLのTris-EDTA緩衝液(pH8.0)に懸濁した。 細菌の 16S rRNA 遺伝子の V3 ~ V4 領域のポリメラーゼ連鎖反応増幅と DNA 配列決定は、以前に記載されているように Illumina MiSeq 装置 (Illumina、カリフォルニア州サンディエゴ) で実行されました (15)。 Genome Reference Consortium human build 38 (GRCh38) からのデータと一致する配列と、生の Illumina ペアエンド リードからの phiX リードを除去した後、QIIME2 ソフトウェア パッケージ (バージョン 2017.10) (1) を使用して配列を分析しました。 潜在的なキメラ配列は、Divisive Amplicon Denoising Algorithm 2 (DADA2) (16) を使用して除去され、順方向リードと逆方向リードの 30 領域からそれぞれ 30 塩基と 90 塩基がトリミングされました。 分類学的分類は、全長操作分類単位の 99% 配列類似性閾値を備えた Greengenes 13.8 データセットでトレーニングされた単純ベイズ分類器を使用して実行されました。 Bray-Curtis 距離に基づく主座標分析は、Quantitative Insights Into Microbial Ecology 2 (QIIME2) ソフトウェアを使用して実行されました。 Phylogenetic Investigation of Communities by Reconstruction of Unobserved States 2 (PICRUSt2) (17) を使用して、デフォルト設定の 16S rRNA 遺伝子配列の微生物相組成に基づいて腸内微生物の機能遺伝子を推測しました。 |
| 2.5統計分析 |
| 治療効果が機能性便秘の改善における日本の伝統医学の有効性を調査した以前の研究と同等であると予想されると仮定して(18)、治療前と治療後の差のCSS平均のグループ差は次のように設定されました- 2.5、測定値のSDは4、治療前と治療後の測定値の間の相関係数は0.6、治療前と治療後の差のSDは3.58でした。 したがって、グループ間の -2.5 の差を検出し、2 サンプル t 検定で 80% の検出力を得るには、各グループに 34 人の参加者 (合計 68 人の参加者) が必要でした。 患者の脱落などを考慮し、参加者数を約15%増員し、合計80名を目標症例数とした。 |
| データ収集が完了すると、コードを解読する前にすべてのデータが修正されました。 主要評価項目は、4週目における2つのグループ間のCSS合計スコアのベースラインからの変化の差でした。ベースラインからの変化は、ウィルコクソン順位和検定を使用して、プロバイオティクス群とプラセボ群の間で比較されました。 さらに、ウィルコクソンの符号付き順位検定を使用して、ベースラインと介入後の値のグループ内変化を検定しました。 統計分析は、胃腸データについては SAS ソフトウェア バージョン 9.4 (SAS Institute、ノースカロライナ州ケアリー)、および R ソフトウェア バージョン 9.4 を使用して実行されました。 腸内微生物叢データの場合は 3.6.0、有意性は P < 0.05 に設定されています。 |
| 3.結果 |
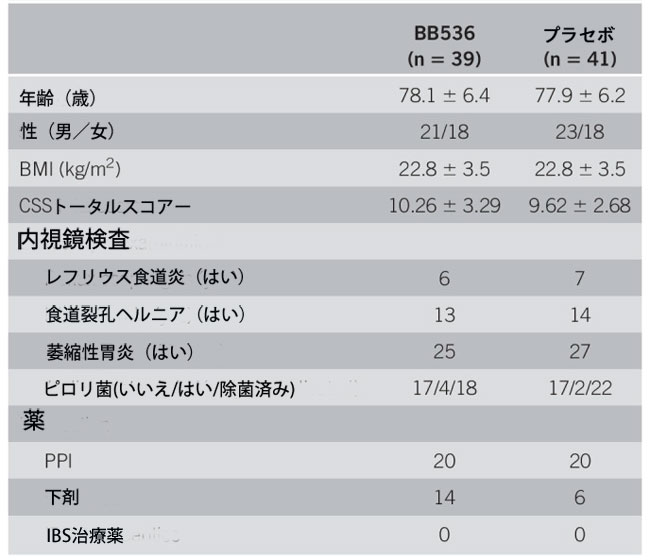
| 96 人の患者が適格性について評価され、80 人がランダムに割り当てられました (図 1)。患者数は 80 人 (男性/女性: 36/44、平均年齢 77.9 歳)、そのうち 39 人がプロバイオティクス群、41 人がプラセボ群でした。 また、グループ間で患者背景に差はありませんでした(表 1)。 プロバイオティクス群の患者 1 名が通院の困難を理由に脱落し、プロバイオティクス群の 38 名とプラセボ群の 41 名が評価対象となりました。 どちらのグループでも、線量率はほぼ 80% 以上でした。 |
|
| 図 1. 試験プロファイル |
| 表 1. ベースライン時の患者の特徴 |
 |
| 3.1.排便 |
| 表 2 は CSS の結果を示しています。 プロバイオティクス群ではベースラインから4週目(介入後、P < 0.01)および8週目(観察期間後、P < 0.05)までCSSスコアに有意な改善が観察されましたが、プラセボ群では有意な変化はありませんでした。 ただし、グループ間の差異は観察されませんでした。 ベースラインから介入後までの CSS スコアの変化には 2 つのグループ間で差異がある傾向がありました (4 週目、P = 0.074、図 2a)。 プロバイオティクス群では治療後に改善する傾向があった項目がいくつかありましたが、プラセボ群ではこれらの項目は改善されませんでした。 介入後(4週目)、排便の失敗(24時間当たりの排便の試みの失敗)については、群間で有意な差が観察された。 さらに、排便回数(P = 0.008)や排便の失敗(P = 0.051)など、ベースラインから 4 週目のサブスケール項目の変化にはグループ間差がありました。 |
| 表2 CSSの結果 |
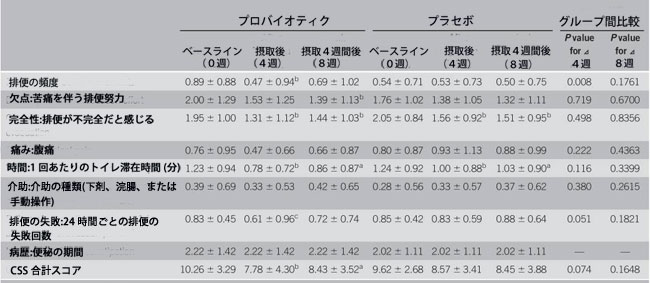 |
データは平均値を表します(SDあり) CSS:便秘スコアリングシステム aP<0.05 bP<0.01:ベースラインからの有意差(ウィルコクソンの符号付き順位検定) cP<0.01:プラセボとの有意差(ウィルコクソン順位和検定)、 ベースラインとの差に基づくP値(ウィルコクソン順位和検定)、 |
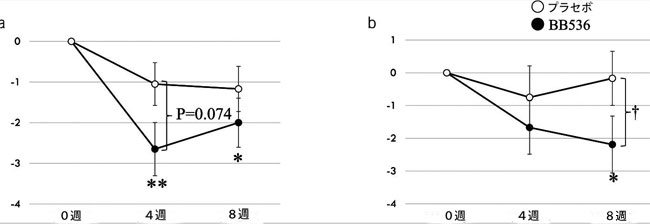 |
図2.慢性便秘症の高齢者の臨床症状に対するBifidobacterium longum BB536 投与の効果。 (a) ベースラインからの便秘スコアリング システム (CSS) スコアの変化。 (b) 胃腸逆流症スコア (胃腸逆流症 [GERD]) の症状の頻度スケールのベースラインからの変化。 *P < 0.05、**P < 0.01、ベースラインからの有意差 (ウィルコクソンの符号付き順位検定)。 †P < 0.05、プラセボ群と比較した有意差 (ウィルコクソン順位和検定)。 |
| FSSG スケール (表 3) では、プラセボ群では改善が観察されませんでしたが、介入後のプロバイオティクス群では胸やけとサブスケールを飲み込む際の治療の行き詰まりに改善が観察されました (P < 0.05)。 変数値のグループ間比較では、胸やけ(P = 0.089)および食後の気分が悪くなる(P = 0.075)の下位尺度は、プラセボグループと比較して4週間の摂取後に改善する傾向がありました。 興味深いことに、介入後(4 週目)には有意差はなかったものの、介入後評価(8 週目)では、胃の膨満感(P = 0.032)、喉の異常な感覚(P = 0.039)、 プラセボ群と比較した場合、プロバイオティクス群では嚥下中に動けなくなる(P = 0.057)。 プラセボ群では介入後(4週目)、合計FSSGスコアに有意な変化はありませんでした。 しかし、プロバイオティクス群では有意な改善が観察され(P < 0.05)、介入後評価(8週目)では群間差(P = 0.097)の傾向が見られました(図2b)。 |
| 表3.FSSG の結果 |
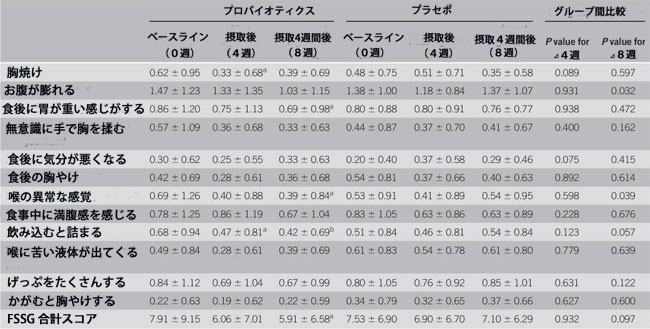 |
データは平均を表す(SAあり) FSSG、胃腸疾患の症状の頻度スケール aP<0.05 bP<0.01、ベースラインからの有意差(ウィルコクソンの符号付き順位検定)。 P値、ベースラインとの差に基づく(Wilcoxon順位和検定) |
| 3.2.腸内細菌叢と微生物叢の機能 |
| 属レベルの組成に基づくブレイ・カーティス主座標分析では、治療摂取前後のグループ間に有意差は示されませんでした(図3a)。 ベースラインと比較して、4週目のBB536グループではClostridiaceaeグループの相対存在量が増加し(P = 0.042)、Coprococcusの相対存在量が減少した(P = 0.045)ことがわかりました(図3b)。 ただし、これらの違いは誤発見率 (FDR) 補正では有意ではありませんでした (補足表 2、http://links.lww.com/AJG/C707 を参照)。 次に、PICRUSt2 による微生物叢組成に基づいて腸内微生物の機能遺伝子を推定しました。 0週目と4週目に、それぞれグループ間に2つと14つの異なる経路が見つかりました(補足図1と表3、http://links.lww.com/AJG/C704、http://links.lww.com/を参照) AJG/C708)。 また、プラセボ群とプロバイオティクス群の 0 週間と 4 週間の間に、それぞれ 1 つと 3 つのグループ内差異が観察されました(補足付録の図 2 と表 4、http://links.lww.com/AJG/C705、http://links を参照) .lww.com/AJG/C709)。 ただし、経路におけるこれらの違いは、FDR 補正では有意ではありませんでした。 |
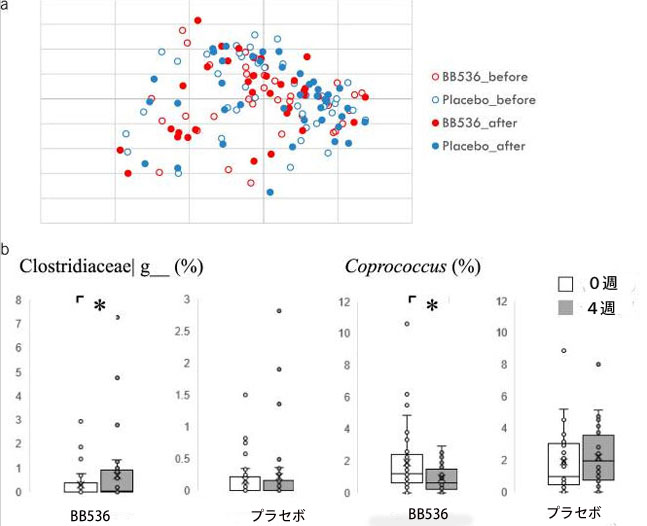 |
図3.腸内細菌叢組成に対するBifidobacterium longum BB536 投与の効果。 (a) ブレイ・カーティス距離主座標分析 (PCoA)。 (b) 各群における投与前後の属の違い。 *P < 0.05 (ウィルコクソンの符号付き順位検定)。 |
| 3.3.安全性 |
| この試験では死亡者は出なかった。BB536 群とプラセボ群の両方で、治療摂取中に下痢が 1 件観察されました。 BB536 群とプラセボ群の間で、重篤な総有害事象の発生率、または有害事象による離脱の発生率に差はありませんでした。 治療の投与に続発する有害事象はありませんでした。 |
| 4.議論 |
| この研究では、CSS および FSSG アンケートを使用して、慢性便秘の高齢患者の便秘および腹部症状に対する BB536 の効果を調査しました。 これは、外来患者の慢性便秘症に対するBB536を評価する最初のランダム化比較試験である。 総CSS(主要評価項目)には群間差はありませんでしたが、プラセボ群と比較して、BB536を4週間摂取した後の患者の排便および上腹部症状の改善が観察されました。 興味深いことに、治療摂取後 4 週間でも症状スコアの改善が観察されました。 私たちの知る限り、これは慢性便秘の高齢患者の便秘と上腹部症状に対するプロバイオティクスの長期的な効果を確認した最初の研究です。 この長期にわたる効果は、4週間のプロバイオティクス摂取による腸内環境の改善によって引き起こされる可能性があります。 |
| 以前の研究では、慢性便秘に対するプロバイオティクスの有効性が報告されています(19,20)。 高齢者の慢性便秘に関する系統的レビューが以前に報告されている(21)。 系統的レビューでは、B. longum, B. lactis, Lactobacillus, Bifidobacterium, およびStreptococcus が発酵オート麦飲料と組み合わせて、または粉末として投与されました (11、22、23)。 しかし、これらの臨床試験の患者は慢性便秘とは診断されておらず、これらの研究には下痢を患っている患者も含まれていました(11)。 なお、対象は入院患者または経管栄養を受けている患者とした。 したがって、これらの研究には多くのバイアスが含まれています。 |
| Bifidobacterium は、酢酸などの短鎖脂肪酸の生成を通じて腸の蠕動運動を促進することが報告されています (24-26)。 これらの短鎖脂肪酸は腸内細菌叢に影響を与え、便通を改善します(15)。 腸内代謝産物の変化は測定していませんが、BB536ヨーグルトの摂取により酢酸や酪酸のレベルが上昇するなど、腸内環境の改善に有効であることが以前の研究で実証されています(11)。 Bifidobacterium は酢酸を生成することでよく知られており、B. longum BB536 は腸内細菌叢内の他の細菌とのクロストークによって媒介される酪酸レベルを促進することが実証されています (27-29)。 したがって、B. longum BB536 は、これらの患者の排便回数や排便困難の改善などの排便異常の改善に寄与する可能性があります。 |
| 近年、消化不良や便秘などの機能性胃腸疾患の重複が報告されています(30,31)。 機能性胃腸症では、十二指腸の炎症の影響が報告されており(32)、胃腸管粘膜の微小炎症が影響していると考えられています。 Bifidobacterium は腸のバリア機能を改善し、炎症を抑制することが報告されています(27)。 B. longum BB536 は、花粉症などのアレルギー疾患に有用であることが報告されており、腸免疫系を通じて免疫バランスを調節し、炎症を抑制すると考えられています (33)。 したがって、炎症の抑制により、これらの患者の上腹部症状も改善すると考えられました。 |
| この研究では、治療摂取後の腸内細菌叢の組成に顕著な変化は見つかりませんでした。 ベースラインと比較して、4 週目の BB536 グループでは、Clostridiaceae グループの相対存在量が増加し、Coprococcus の相対存在量が減少しました。 Coprococcus の相対的な存在量は、BB536 グループの 4 週目の CSS スコアと正の相関関係がある傾向があることがわかりました。 しかし、Coprococcus 増加グループとCoprococcus 減少グループの間で、ベースラインからのCSSスコアの変化に明らかな差はなく、0週目でのCoprococcus とCSSスコアの相関関係はありませんでした(データは示さず)。 私たちのデータは、この属の相対的な存在量が CSS スコアに影響を与えないようであることを示唆しています。 これは、微生物叢の組成の変化ではなく、細菌成分やBB536の酢酸などの代謝産物によって媒介される代謝経路および生理学的経路の変化が排便に影響を与える可能性があることを示唆しています。 Kaczmarczyk ら (34) も同様の観察を行い、プロバイオティクスの介入により、微生物叢の組成や代謝機能の経時的な変化に関係なく、生化学的および生理学的パラメータが変化することを発見しました。 McNultyら(35)は、組成に変化がないにもかかわらず、プロバイオティクスの影響下で微生物叢の代謝機能が変化することを観察した。 本研究では、PICRUSt2 分析により、ベースラインよりも介入後のグループ間の MetaCyc 差次経路がより多く示されました。 BB536 介入を 4 週間続けると、プラセボ群と比較して MetaCyc 経路の差異がさらに大きくなるようです。 ただし、経路におけるこれらの違いは、FDR 補正では有意ではなく、臨床観察との関連については今後の研究が待たれます。 一方で、総CSSの有意な改善は観察できなかったため、本研究で観察された腸内細菌叢の変化と臨床効果との関係については、より大きなサンプルサイズでの研究でのさらなる調査が待たれます。 |
| この研究では、BB536 が慢性便秘の高齢患者の排便と一部の上腹部症状を改善したことを報告しました。 改善された症状の一部は、プロバイオティクスの投与を中止してから 4 週間後でも維持されていることが観察されました。 このプロバイオティクス療法には副作用はほとんどありませんでした。 これらの結果は、高齢者の慢性便秘に対する B. longum BB536の摂取の安全性と有用性を示唆しています。 ただし、この研究にはいくつかの制限があります。 まず、この研究には比較的少数の個人が含まれていました。 第二に、介入中に食事、アルコール摂取、運動習慣などの生活習慣を評価しませんでした。 第三に、長期にわたる患者の追跡調査を行っていないことです。 この研究には、便秘症状と上腹部症状の詳細な評価が含まれる、無作為化二重盲検プラセボ対照並行介入研究であることなど、いくつかの利点がありました。 この研究には、糞便微生物叢の評価も含まれています。 今後は複数の施設で多数の症例を検討し、腸管内の有機酸などの代謝産物を解析する必要がある。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Am J Gastroenterol. 2023 Mar; 118(3): 561–568.に掲載されたUsefulness of Bifidobacterium longum BB536 in Elderly Individuals With Chronic Constipation: A Randomized Controlled Trial.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |