
Beatrice Garavaglia et al., |
| 要約 |
| 背景: 腫瘍関連マクロファージは、大腸がんの腫瘍微小環境の重要な役割を担っており、その中で最も豊富な免疫細胞です。腸内細菌叢、マクロファージ、がん細胞の相互作用は、マクロファージの極性化を促進して腫瘍の進行に大きく影響します。特に、腫瘍形成促進性の M2 様腫瘍関連マクロファージ表現型への極性化は、細胞外マトリックスのリモデリング、がん細胞の増殖、転移、免疫抑制、および治療抵抗性を促進します。プロバイオティクス代謝物はこのクロストークを阻害し、腫瘍関連マクロファージ の極性化を炎症促進性の抗腫瘍表現型へと戻す可能性があり、腸粘膜に利益をもたらし、大腸がんの進行を阻止する可能性があります。以前、Lactiplantibacillus plantarum OC01 代謝物がインターロイキン (IL)-6 誘発性の大腸がんの増殖と移動に対抗することを示しました。 |
| 方法: ここでは、プロバイオティクスが 大腸がんセクレトームにどのように影響し、それが 腫瘍関連マクロファージ (TAM)極性化にどのように影響し、それが 大腸がんの悪性度にどのように影響するかを調査します。 |
| 結果: 大腸がん細胞の調整培地は確かにマクロファージの M2 様表現型への極性化を促進しましたが、L. plantarum OC01 代謝物で前処理した大腸がんの調整培地は、NLRP3 インフラマソーム活性化および活性酸素種 (ROS) 産生、および M2 表現型マーカー CD206 および CD163 の発現低下を特徴とする炎症誘発性マクロファージ表現型を誘導しました。一貫して、L. plantarum OC01 で処理した大腸がん細胞では、M2 マクロファージ極性化のプロモーターである腫瘍増殖因子 (TGF)-β の発現が低下しました。炎症誘発性マクロファージは大腸がんの増殖および移動を阻害しました。 |
| 結論: 全体として、私たちの研究は、L. plantarum OC01 の代謝物ががん細胞の代謝を再プログラムし、腫瘍関連マクロファージをより炎症性および抗腫瘍性の表現型にシフトさせることで腫瘍微小環境を再形成する可能性を強調しており、大腸がんに対する新しい治療法の進歩におけるプロバイオティクスの有望性を強調しています。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 材料と方法 |
| 2.1. 細胞培養と処理 |
| 2.2. プロバイオティクス製剤 |
| 2.3.大腸がん細胞馴化培地(大腸がん細胞調整培地)の採取 |
| 2.4. 抗体 |
| 2.5. ウェスタンブロッティング分析 |
| 2.6. 免疫蛍光アッセイ |
| 2.7. 貪食作用研究 |
| 2.8. MitoSOX™蛍光アッセイによるアニオンスーパーオキシドの生成 |
| 2.9. RNA の分離と定量的 PCR |
| 2.10. マクロファージと大腸がん細胞株の共培養システムアッセイ |
| 2.11. 統計分析 |
| 3. 結果 |
| 3.1. THP-1 のマクロファージ様表現型への分化 |
| 3.2. Lactiplantibacillus plantarum OC01 処理大腸がん細胞由来の調整培地は、NLRP3 活性化を介してマクロファージの炎症性表現型を促進する |
| 3.3. Lactiplantibacillus plantarum OC01 代謝物は大腸がん細胞における TGF-β の発現を低下させる |
| 3.4. Lactiplantibacillus plantarum OC01 処理大腸癌細胞由来の調整培地は、マクロファージの M2 様表現型への分極を減少させる |
| 3.5. Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN)で治癒した大腸がん細胞から調製した培地で再プログラムされたマクロファージ |
| 4. 考察 |
| 本文 |
| 1.はじめに |
| 大腸がんは、年間90万人以上の死亡原因となっており、世界で3番目に多いがんであり、がん関連死の第2位の原因となっています[1]。その発生率の上昇は、遺伝的要因とエピジェネティック要因、および食習慣と座りがちな生活習慣に関連しており、特に発展途上国で顕著です[1]。これらの要因に加えて、多くの研究で、大腸がんの発症と治療結果における腸内細菌叢の重要な役割が実証されています[2,3]。腸内細菌叢のディスバイオーシス(訳者注:腸内細菌叢の乱れ、腸内毒素症、Dysbiosis)は、微生物毒素の分泌、代謝産物の生成の変化、ホルモン調節異常、慢性免疫活性化、持続性炎症など、さまざまなメカニズムを通じて大腸がんに寄与します[4,5,6]。 |
| 腸内細菌叢は大腸がんの発症に重要な役割を果たしていることから、腫瘍微小環境の重要な構成要素として認識されています[7,8]。腫瘍微小環境には間質細胞、免疫細胞、および腫瘍の成長を支える細胞外マトリックス(ECM)、サイトカイン、ケモカイン、成長因子などの非細胞成分も含まれます[9]。免疫細胞の中で、腸管マクロファージは大腸がん組織で最も多く存在する腫瘍浸潤免疫細胞です。これらの細胞は自然免疫応答を調節し、組織の恒常性を維持し、炎症を調整します[10]。 |
| 腫瘍微小環境内で、マクロファージは腫瘍関連マクロファージに分化し、表現型の可塑性を示します [11]。腫瘍関連マクロファージは、がん細胞から放出されるシグナルによって、M1 または M2 表現型に分極します [12]。M1 様表現型は、インターロイキン (IL)-1β、IL-6、腫瘍壊死因子 (TNF)-α などの炎症性サイトカインの放出を通じて、炎症促進、免疫刺激、抗腫瘍形成特性を示します。対照的に、M2 様表現型は、IL-10、形質転換成長因子 (TGF)-β、および細胞外マトリックスリモデリングに寄与し、がんの浸潤と転移を促進する MMP-9 などのタンパク質分解酵素の分泌による免疫抑制および腫瘍形成促進特性を特徴とします [11,13]。 |
| M1 様表現型への分極は、外因性リポ多糖 (LPS) やその他の炎症誘発性シグナルなどの微生物刺激によって誘導されます [14,15]。一方、M2 様表現型は、関与する刺激に応じて、M2a、M2b、M2c、および M2d の 4 つの異なるサブタイプに分けられます。M2a は IL-4 または IL-13 によって誘導され、M2b は IL-1β または リポ多糖 (LPS)と組み合わせた免疫複合体によって誘導され、M2c は IL-10 および TGF-β によって誘導され、M2d は Toll 様受容体 (TLR) または IL-6 シグナル伝達によって誘導されます [16]。これらのサブタイプは、特定の表面マーカーによって識別でき、M1 マクロファージは膜上に CD80 および CD86 を発現し、M2c マクロファージは CD206 および CD163 の発現が上昇しています [17]。 |
| M1 マクロファージと M2 マクロファージは、免疫学的役割が大きく異なります。M1 マクロファージは NLRP3 インフラマソーム [18,19,20] を介して活性化されますが、これは活性酸素種 (ROS) の産生によって引き起こされる可能性があります [21]。この活性化により、炎症性サイトカイン IL-1β と IL-18 が放出されます [22]。さらに、活性酸素種 (ROS)は NF-κB シグナル伝達経路を活性化し、追加の炎症性サイトカインの転写を促進し、炎症反応の誘導と腫瘍細胞の根絶に重要な役割を果たします [17]。対照的に、M2 マクロファージは抗炎症性サイトカインを放出することを特徴とし、免疫抑制の役割を持ち、腫瘍の増殖、血管新生、転移を促進します。 |
| がんの進行中、M1およびM2マクロファージの表現型は固定されておらず、時間とともに変化します。腫瘍発達の初期段階では、M1マクロファージが優勢であり、がん細胞を破壊するために積極的に働きます。腫瘍が進行するにつれて、マクロファージは徐々にM2表現型を採用し、免疫抑制と腫瘍の増殖をサポートします[23]。腸内細菌叢のディスバイオーシスは、マクロファージをM2様表現型に活性化し、腫瘍の進行と転移を促進する免疫抑制性腫瘍微小環境を作成することで、このプロセスで重要な役割を果たします[24]。 |
| プロバイオティクスは大腸がんの管理に有望な新しいアプローチです。プロバイオティクスは、病原菌とスペースや栄養素を競い合い、抗菌物質を生成することで、腸内細菌叢のバランス(ユーバイオシス)を回復するのに役立ちます。このバランスは、発癌性分子を打ち消し、アポトーシスと細胞分化を促進し、免疫反応と炎症反応を調節することで抗腫瘍活性を発揮します[25,26]。 |
| 私たちの研究の目的は、プロバイオティクス代謝産物の有益な効果に関する知識を 大腸がん管理に統合し、腫瘍微小環境に誘発される変化に焦点を当てることです。腸内細菌叢によって生成される代謝産物は、M2 様表現型への極性化ががんの進行に寄与するがんと腫瘍関連マクロファージ間のクロストークを阻害する可能性があると仮定しています。 |
| 我々は以前の研究で、プロバイオティクス株Lactiplantibacillus plantarum OC01の上清が、がん治療で一般的に標的とされる発がん経路に及ぼす影響を調査した。その結果、L. plantarum由来の代謝物は、がんの発症に関与する重要な経路であるERKとS6の活性化に悪影響を及ぼすことが明らかになった。さらに、これらのプロバイオティクス由来の代謝物は、IL-6誘導性の細胞増殖と遊走を阻止し、大腸がん細胞に有益な効果を発揮することができた[27]。 |
| ここでは、Lactiplantibacillus plantarum OC01 代謝物が、がん細胞とマクロファージ間のクロストークに影響を与えることで腫瘍微小環境を調節することを示します。プロバイオティクス処理した大腸がん細胞の調整培地は、マクロファージにおいて、NLRP3 インフラマソームの活性化と 活性酸素種 (ROS)産生の増加を特徴とする、より炎症誘発性の表現型への移行を誘発しました。この移行は、M2 極性化に関与する重要なサイトカインである TGF-β のレベルの低下と、プロバイオティクス処理したがん細胞に反映され、IL-6、IL-1β、TNF-α などの炎症誘発性サイトカインには有意な変化がありませんでした。より炎症性の表現型は、プロバイオティクス処理した大腸がん細胞からの調整培地にさらされたPMA分化THP-1マクロファージにおけるM2関連マーカーCD206およびCD163の発現が、未処理細胞からの調整培地にさらされたマクロファージと比較して減少したことでさらに確認されました。共培養実験では、プロバイオティクス処理したがん細胞からの調整培地で分化したマクロファージはがん細胞の増殖と移動を減少させることができましたが、未処理細胞からの調整培地で分化したマクロファージはこれらのプロセスを促進しました。これは、より炎症性マクロファージ表現型への移行ががんと戦うための実現可能な目標であることを強調しています。これらの知見は、プロバイオティクスがマクロファージの行動と炎症性サイトカインプロファイルを調節することによって腫瘍微小環境を変化させ、最終的にがん細胞の進行に影響を与えることを示唆しています。 |
| 微生物代謝産物が腫瘍関連マクロファージに与える影響と、腫瘍形成促進表現型の調節における役割を解明することで、私たちの研究結果は、腸内微生物叢と腫瘍微小環境の免疫成分の両方を標的としたプロバイオティクス治療への応用の前臨床的根拠を提供します。プロバイオティクスを通じて健康な微生物叢を回復することで、大腸がん患者の全体的な健康状態が改善され、二次転移や再発のリスクが軽減される可能性があります。 |
| 2. 材料と方法 |
| 2.1. 細胞培養と処理 |
| 急性単球性白血病患者の末梢血から分離されたヒト THP-1 単球細胞株 (TIB-202™) と、それぞれ異なる遺伝的背景と腫瘍部位の起源を特徴とするヒト大腸がん細胞株 HCT116 (CCL-247™) および HT29 (CCL-227™) は、American Type Culture Collection (ATCC) から入手しました。 すべての細胞株は、10% 加熱不活化ウシ胎児血清 (FBS、ECS0180L、Euroclone, Milan, Italy)、1% グルタミン (G7513、Sigma-Aldrich、St. Louis, MO, USA)、および 1% ペニシリン/ストレプトマイシン (PES、P0781、Sigma-Aldrich、St. Louis, MO, USA) を添加した RPMI-1640 培地 (R8758、Sigma-Aldrich、St. Louis, MO, USA) で培養されました。細胞は標準培養条件 (37 ◦C、95% 空気、5% CO2) で維持されました。 |
| THP-1単球を20 ng/mLのホルボール-12-ミリステート-13-アセテート(PMA、P8139、Sigma-Aldrich、St. Louis, MO, USA)で処理し、DMSOに溶解してマクロファージへの分化を誘導した。 |
| 2.2. プロバイオティクス製剤 |
| プロバイオティカルSpAコレクションから採取したLactiplantibacillus plantarum OC01(NCIMB 30624)の上清は、前述のように細菌を培養して調製した[27]。 |
| 刺激実験では、真核細胞を、細菌培養液を 0.2 μm のシリンジフィルターで濾過した後、Lactiplantibacillus plantarum OC01の無細胞上清にさらしました。この上清には、一晩増殖させた 100 億個の生菌性プロバイオティクス細胞から放出されたすべての異化および同化産物が含まれています。 |
| 大腸がん培養には、最終培養培地量 1 mL あたり 10 μL のLactiplantibacillus plantarum OC01無細胞上清を添加しました。 |
| 2.3.大腸がん細胞馴化培地(大腸がん細胞調整培地)の採取 |
| 大腸がん細胞(HCT116およびHT29)を75cm2フラスコで培養し、Lactiplantibacillus plantarum OC01上清の有無で48時間処理した後、調整培地を採取した。大腸がん細胞調整培地を2000rpmで5分間遠心分離して細胞残渣を除去し、50:50に希釈し(大腸がん細胞調整培地:RPMI-1640)、使用するまで-20℃で保存した([28])。 |
| 2.4. 抗体 |
| 免疫蛍光法またはウェスタンブロッティングには、以下の一次抗体(記載の希釈度で)を使用しました:マウス抗CD68(1:500、コード14-0688-80、Life Technologies、Paisley, UK);ウサギ抗NLRP3(1:500、コードMA5-32255、Life Technologies、Paisley, UK);ウサギ抗CD206(1:500、コードMA5-32498、Life Technologies、Paisley, UK);マウス抗CD163(1:500、コードab156769、abcam、Cambridge, UK);マウス抗p21(1:100、コードB1313、Santa Cruz、Biotechnology、Dallas, TX, USA);ウサギ抗Ki67(1:100、cod. HPA001164、Sigma-Aldrich、St. Louis, MO, USA)、ウサギ抗GAPDH(1:1000、cod. G9545、Sigma-Aldrich、St. Louis, MO, USA)、およびマウス抗β-アクチン(1:2000、cod. A5441、Sigma-Aldrich、St. Louis, MO, USA)。 |
| 2.5. ウェスタンブロッティング分析 |
| THP-1細胞をp35ペトリ皿に播種し(50,000細胞/cm2)、指示通りに処理した。 細胞ホモゲネートは、プロテアーゼ阻害剤を含むRIPA溶解緩衝液で凍結融解および超音波処理して調製した。等量のタンパク質(30μg)をSDS-PAGEで分離し、PVDF膜に転写した。膜は[29]に詳述されているように、4℃で一次抗体とともに一晩インキュベートし、続いて室温で1時間、HRP結合二次抗体とともにインキュベートした。バンドは、Enhanced Chemiluminescence試薬(コードNEL105001EA、Perkin Elmer、Waltham, MA, USA)を使用して検出し、Quantity Oneソフトウェア(v.4.5)を搭載したVersaDOC Imaging System(BioRad、Hercules, CA, USA)を使用して分析した。バンドの強度は、Quantity One ソフトウェア (v.4.5) を使用したデンシトメトリーによって定量化され、膜を GAPDH または β-アクチンで再プローブすることによって正規化が行われました。データは少なくとも 3 回再現されました。 |
| 2.6. 免疫蛍光アッセイ |
| 細胞は、30,000個(がん細胞)~50,000個(THP-1)/cm2の密度で滅菌カバーガラス上に播種され、報告されているように処理された。実験終了時に、カバーガラスは氷冷メタノール(癌細胞)または4%パラホルムアルデヒド(THP-1)で固定され、前述のように特異的一次抗体とともに4℃で一晩インキュベートされた[29]。翌日、カバーガラスは、二次抗体(0.1%トリトンPBS + 10%FBSで希釈)とともに室温で1時間インキュベートされた。 AlexaFluor488 標識ヤギ抗ウサギ IgG (1:000、コード A32731、Invitrogen、Paisley, UK) または AlexaFluor555 標識ヤギ抗マウス IgG (1:1000、コード A32727、Invitrogen、Paisley, UK) を適宜使用しました。核は UV 蛍光色素 DAPI (4′,6-ジアミジノ-2-フェニルインドール) で染色しました。カバーガラスは SlowFade 試薬 (コード S36936、Life Technologies、Paisley, UK) を使用してガラス上にマウントし、蛍光顕微鏡 (Leica Microsystems DMI6000、Wetzlar, Germany) で撮影しました。 |
| 2.7. 貪食作用研究 |
| THP-1 細胞を滅菌カバーガラス上に 50,000 細胞/cm2 の密度で播種し、記載のとおり処理しました。貪食作用を評価するために、細胞をまず 100 nM LysoTracker™ Red プローブ (コード L7528、Life Technologies, Paisley, UK) とともに 37℃ で 10 分間インキュベートし、続いて緑色蛍光を発する 30 nm カルボキシ官能化ナノ粒子 (COOH-NP) 25 μg/mL (コード L5155、Sigma-Aldrich、St. Louis, MO, USA) とともに 37 ◦C で 10 分間インキュベートしました [30]。カバーガラスを洗浄し、マウントし、すぐに蛍光顕微鏡 (Leica Microsystems DMI6000、Wetzlar, Germany) を使用して画像化しました。 |
| 2.8. MitoSOX™蛍光アッセイによるアニオンスーパーオキシドの生成 |
| THP-1細胞をカバーガラス上に50,000細胞/cm2の密度で播種し、記載どおりに処理しました。ミトコンドリアアニオンスーパーオキシドは、以前に記載されたように[31]、5μM MitoSOX™ Red(コードM36008、Life Technologies、Paisley, UK)を使用して生細胞で検出されました。 カバーガラスをPBSで3回洗浄し、ガラススライドにマウントし、蛍光顕微鏡(Leica Microsystems DMI6000、Wetzlar, Germany)を使用してすぐに画像を撮影しました。 |
| 2.9. RNA の分離と定量的 PCR |
| HCT116 細胞と HT29 細胞を 50,000 細胞/cm2 の密度で p60 ペトリ皿に播種し、前述のように処理しました。細胞から TRIzol 試薬 (コード T9424、Sigma-Aldrich、St. Louis, MO, USA) を使用して全 RNA を抽出しました。次に、RevertAid First Strand cDNA 合成キット (コード K1622、Thermo-Scientific、Waltham, MA, USA) を使用して mRNA を相補 DNA (cDNA) に逆転写しました。次に、組み換え Taq DNA ポリメラーゼ (コード 10342-020、Invitrogen、Waltham, MA, USA) と 5' および 3' 非翻訳領域 (UTR) にアニールするように設計されたプライマーの存在下で cDNA を PCR により増幅しました。 PCR産物はアガロースゲル電気泳動により分析された。 使用したプライマーの配列は以下の通りである(表1)。 |
| 表 1. 分析したサイトカインの概要。増幅産物の長さ、増幅に使用したフォワードプライマーとリバースプライマーの配列が含まれます。 |
 |
| 2.10. マクロファージと大腸がん細胞株の共培養システムアッセイ |
| がんと腫瘍関連マクロファージの生体内相互作用を部分的に再現するために、非接触共培養システム(Transwell® Permeable Supports、ポリカーボネート膜、12 mmインサート、0.4 μm孔径、コード番号3413、Corning Incorporated Costar、NY、USA)を使用して、マクロファージの存在にさらされたがん細胞の増殖能力を評価しました。 THP-1細胞は、インサート内で30,000細胞/cm2の密度で播種され、報告されているようにマクロファージに分化した後、カバーガラス上に大腸がん (CRC)細胞があらかじめ播種された24ウェルプレートに移されました。 24 時間の共培養後、がん細胞を載せたカバーガラスを PBS で洗浄し、氷冷メタノールで固定し、PBS 中の 0.2% Triton X-100 で透過処理しました。次に、細胞を一次抗体とともにインキュベートし、上記のように免疫蛍光染色を行いました。 |
| THP-1 分化マクロファージとの共培養におけるがん細胞の移動能力を評価するために、THP-1 細胞を 24 ウェル プレートに 50,000 細胞/cm2 の密度で播種し、前述のようにマクロファージに分化させました。がん細胞は p35 ペトリ皿に 40,000 細胞/cm2 の密度で播種し、80% のコンフルエンスに達するまで培養しました。48 時間の培養後、がん細胞をトリプシン処理し、収集して計数しました。実験条件ごとに 50,000 細胞のアリコートを無血清培地に再懸濁し、コーティングされていないインサート (Transwell® 透過性サポート、ポリカーボネート メンブレン、6.5 mm インサート、8.0 μm 孔径ポリカーボネート メンブレン、コード 3422、Corning Incorporated、Costar、NY、USA) に播種しました。各インサートを、完全RPMIを含む24ウェルプレート内のTHP-1分化マクロファージ上に置き、プレートをインキュベーター内に置いた。24時間のインキュベーション後、各細胞集団の一部が多孔質膜を通過してインサートの裏側に移動した。移動した細胞をPBSで洗浄し、メタノールで30分間固定し、再度PBSで洗浄し、エオシン-ヘマトキシリン溶液(コード05-M06002、Bio-Optica、Milan, Italy)で1時間染色した。インサートをPBSで洗浄し、少なくとも1日間乾燥させた後、SlowFade試薬(コードS36936、Life Technologies、Paisley, UK)を使用して切断し、スライドに載せた。写真は、Axioscan 7顕微鏡(倍率20倍、ZEISS、Oberkochen, Germany)を使用してランダムな視野から撮影した。遊走細胞の量(染色強度に反映)は、ImageJ ソフトウェアを使用して定量化されました。データは、各条件ごとに異なる視野から遊走した細胞の平均数として表されます。 |
| 2.11. 統計分析 |
| すべてのデータは、少なくとも 3 つの個別の実験を参照しています。ヒストグラムのデータは、平均 ± S.D. として表示されます。統計分析は、GraphPad Prism 5.0 ソフトウェアを使用して実行されました。 一元配置分散分析 (無対、両側) 後の Bonferroni の多重比較検定と t 検定が採用されました。有意性は次のように判断されました:**** p < 0.0001; *** p < 0.001; ** p < 0.01; * p < 0.05。 |
| 3.結果 |
| 3.1. THP-1 のマクロファージ様表現型への分化 |
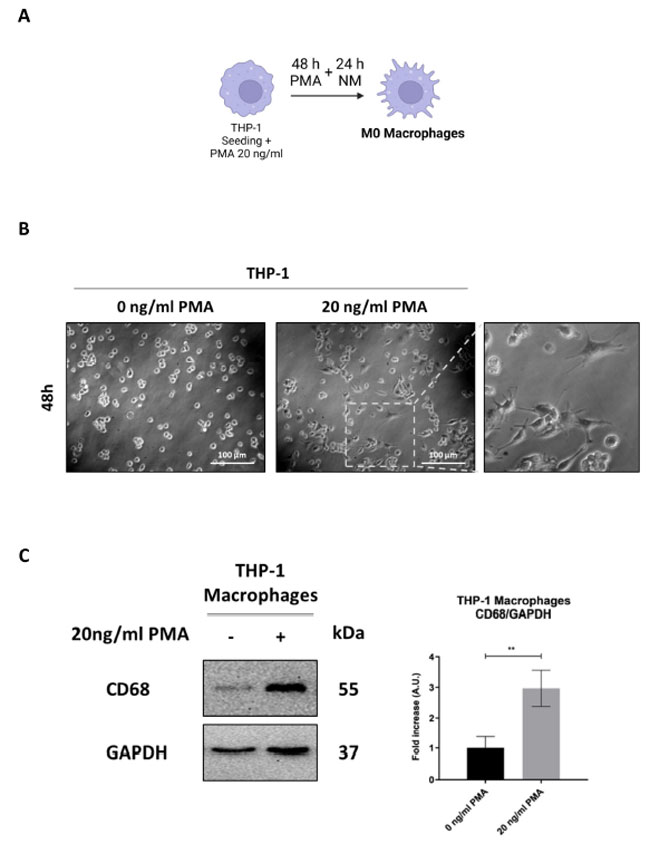
| マクロファージ分化の研究によく使用されるヒト単球細胞株 THP-1(訳者注:THP-1はヒトの急性単球性白血病(AML)由来の細胞株です。単球やマクロファージの活性や機能、自然免疫機構、シグナル伝達経路の研究などに用いられています) を、20 ng/mL のフォルボール-12-ミリステート-13-アセテート (PMA) に曝露するか曝露しないかで、マクロファージへの分化を刺激しました (図 1A)。フォルボール-12-ミリステート-13-アセテート (PMA)で 48 時間培養し、その後通常の培地で 24 時間回復させた後、処理した細胞は、マクロファージ分化の重要な指標である培養プレートへの接着性が向上し、星状および多角形の形態と拡張した仮足を示しました。対照的に、コントロール細胞は丸い形状を維持し、浮遊状態のままでした (図 1B)。この表現型の変化は、ウェスタンブロッティングと免疫蛍光法によって汎マクロファージまたは M0 様表現型マーカー CD68 の発現をモニタリングすることで確認されました。フォルボール-12-ミリステート-13-アセテート (PMA) 処理細胞における CD68 の発現の有意な増加は、THP-1 単球が M0 様表現型マクロファージに活性化されたことを裏付けました (図 1C、D)。 |
| CD68 は主にリソソームに局在する膜貫通糖タンパク質で、細胞外粒子の内在化と分解に重要な役割を果たし、貪食を促進します。そのアップレギュレーションはマクロファージの活性の増強と関連しています [32]。M0 マクロファージの貪食能力を評価するために、細胞を蛍光標識ナノ粒子 (NP) とともにインキュベートし、赤色の Lyso-Tracker™ プローブを使用してリソソームへの取り込みを視覚化しました。蛍光標識ナノ粒子 (NP) とリソソームの共局在 (黄色の信号) は、マクロファージによる蛍光標識ナノ粒子 (NP)の貪食が成功したことを示しています。 フォルボール-12-ミリステート-13-アセテート(PMA)処理細胞では共局在が増加し、貪食活性が強化されたことが示唆されましたが、未処理細胞ではリソソームへの蛍光標識ナノ粒子 (NP)の取り込みがまったく見られず、単球細胞における貪食機能の欠如が確認されました(図1E)。 |
 |
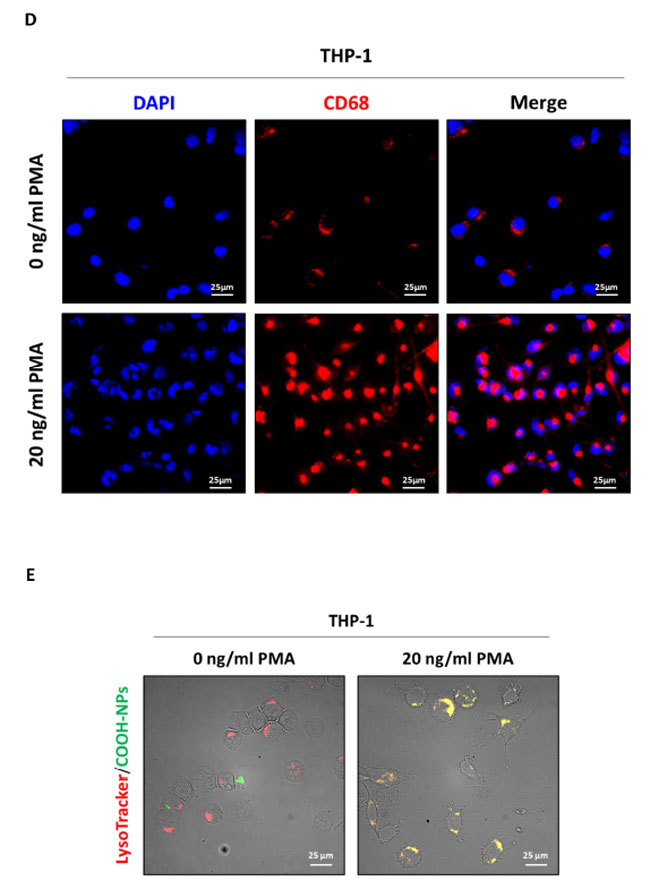 |
図 1. THP-1 細胞の M0 マクロファージへの分化。 (A) 実験設計の概略図。THP-1 細胞を播種し、20 ng/mL の フォルボール-12-ミリステート-13-アセテート (PMA)の有無で 48 時間処理した後、通常の培地 (NM) で 1 日回復させました (BioRender で作成)。 (B) THP-1 の細胞形態画像は、位相差顕微鏡を使用して取得しました (スケール バー = 100 μm、倍率 = 20 倍)。 (C) 細胞ホモゲネートをウェスタン ブロット法で分析し、M0 マクロファージ マーカー CD68 の発現を調べました。フィルターは、ローディング コントロールとして GAPDH で再プローブしました。ブロットは、再現性のある結果が得られた 3 つの実験の代表例です。標準偏差を含む濃度測定分析が提供されます (有意性は ** p < 0.01 とみなされました)。 (D) THP-1 細胞をカバーガラス上に播種し、記載のとおりに処理しました。処理の最後に、細胞を M0 マクロファージ マーカー CD68 (赤) で染色し、蛍光顕微鏡を使用して画像化しました (スケール バー = 25 μm、倍率 = 63 倍)。核は DAPI で染色しました。各条件の代表的な画像を示します。 (E) THP-1 細胞をカバーガラス上に播種し、記載のとおりに処理しました。処理の最後に、細胞を Lysotracker™ プローブとともに 37 ◦C で 10 分間インキュベートし、その後 25 μg/mL COOH-NP にさらに 10 分間さらして、リソソームへの内部化を評価しました (黄色の信号)。画像は蛍光顕微鏡を使用して取得しました (スケール バー = 25 μm、倍率 = 63 倍)。各条件の代表的な画像を示します。 |
| 3.2. Lactiplantibacillus plantarum OC01 処理大腸がん細胞由来の調整培地は、NLRP3 活性化を介してマクロファージの炎症性表現型を促進する |
| 腫瘍微小環境内のマクロファージは、特にがん細胞によって分泌されるサイトカイン、ケモカイン、および成長因子の影響を強く受け、古典的に活性化された M1 様表現型または代替的に活性化された M2 様表現型のいずれかに分極化します。これらの腫瘍関連マクロファージ は、大腸がんの進行と転移において重要な役割を果たします [33]。 |
| 腫瘍関連マクロファージが腫瘍微小環境内で炎症反応を媒介する上で極めて重要な役割を果たしていることから、インフラマソームが引き起こす炎症の中心的要素である NLRP3 (訳者注:NLRP3(NLR family pyrin domain-containing protein 3)は、炎症反応に関わるタンパク質で、自己炎症性疾患や動脈硬化、2型糖尿病などの病態に関与している可能性があります)に焦点を当てて、インフラマソームの活性化を調査しました [34]。炎症誘発性および抗腫瘍性の表現型に関連する M1 マクロファージは、通常、NLRP3 活性のレベルが高いのに対し、M2 マクロファージは、抗炎症プロファイルおよび腫瘍促進効果と一致して、NLRP3 活性が低下していることが特徴です [19]。特に、ミトコンドリアの活性酸素種 (ROS) は、NLRP3 活性化の誘導因子として特定されており、酸化ストレスとインフラマソーム活性化および炎症反応を結び付けています [21]。 |
| 大腸がん細胞の分泌物がマクロファージの NLRP3 活性化に与える影響を調べるため、分化した M0 マクロファージを、遺伝的背景が異なる 2 つの大腸がん細胞株 HT29 と HCT116 の調整培地に曝露しました。がん細胞を Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN) の有無で 48 時間前処理し、この処理によって分泌が変化し、マクロファージの炎症状態に影響するかどうかを調べました (図 2A、B)。 |
| Lactiplantibacillus plantarum OC01代謝物で前処理したHCT116細胞およびHT29細胞由来の調整培地で培養したマクロファージは、NLRP3発現の上昇と活性酸素種 (ROS)産生の増加を示した。対照的に、未処理のがん細胞由来の調整培地で培養したマクロファージは、NLRP3発現の低下と活性酸素種 (ROS)産生の最小値を示した(図2C、D)。これらの知見は、Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN)で処理したがん細胞由来の調整培地にさらされたマクロファージは、より炎症性の表現型をとる可能性があり、M1様プロファイルを示す可能性があることを示唆している。逆に、未処理のがん細胞由来の調整培地にさらされたマクロファージは、炎症状態がより低いようで、M2様プロファイルと一致する可能性がある。 |
| 3.3. Lactiplantibacillus plantarum OC01 代謝物は大腸がん細胞における TGF-β の発現を低下させる |
| 腫瘍微小環境のサイトカインは、マクロファージの活性化を抗炎症性、腫瘍促進性の表現型、または炎症促進性、抗腫瘍性の表現型に誘導し、腫瘍内の全体的な免疫環境に影響を与える可能性があります。がん細胞は、特に IL-10、TGF-β、コロニー刺激因子 1 (CSF-1) などのサイトカインの分泌を通じて、免疫抑制性、腫瘍促進性の環境に大きく寄与しています。これらの分子は、マクロファージが M2 様表現型を採用するように再プログラムするのを助け、免疫監視を抑制し、組織のリモデリングを強化することで腫瘍の進行を促進します [35–38]。対照的に、TNF-αなどのサイトカインは、一般的に炎症誘発性の腫瘍抑制マクロファージ表現型と関連しており[39]、腫瘍と戦う免疫系の能力を高めることができます。 |
| Lactiplantibacillus plantarum OC01が 大腸がん細胞の分泌と、その後のマクロファージの炎症状態を調節するメカニズムを調査するために、HCT116 細胞と HT29 細胞のサイトカインプロファイルを分析しました。特に、腫瘍微小環境の形成に重要な役割を果たすことが知られている IL-8、IL-1β、IL-10、IL-18、IL-6、TNF-α、TGF-β などの重要なサイトカインを分析しました。 |
| 我々の結果は、大腸がん細胞をLactiplantibacillus plantarum OC01 上清 (LpOC01-SN)で処理すると、特に HT29 細胞で TGF-β の発現が著しく減少することを示しています。さらに、HCT116 細胞と HT29 細胞の両方で、IL-1β、IL-6、TNF-α レベルにわずかではあるものの有意ではない変化が観察されました (図 3)。 |
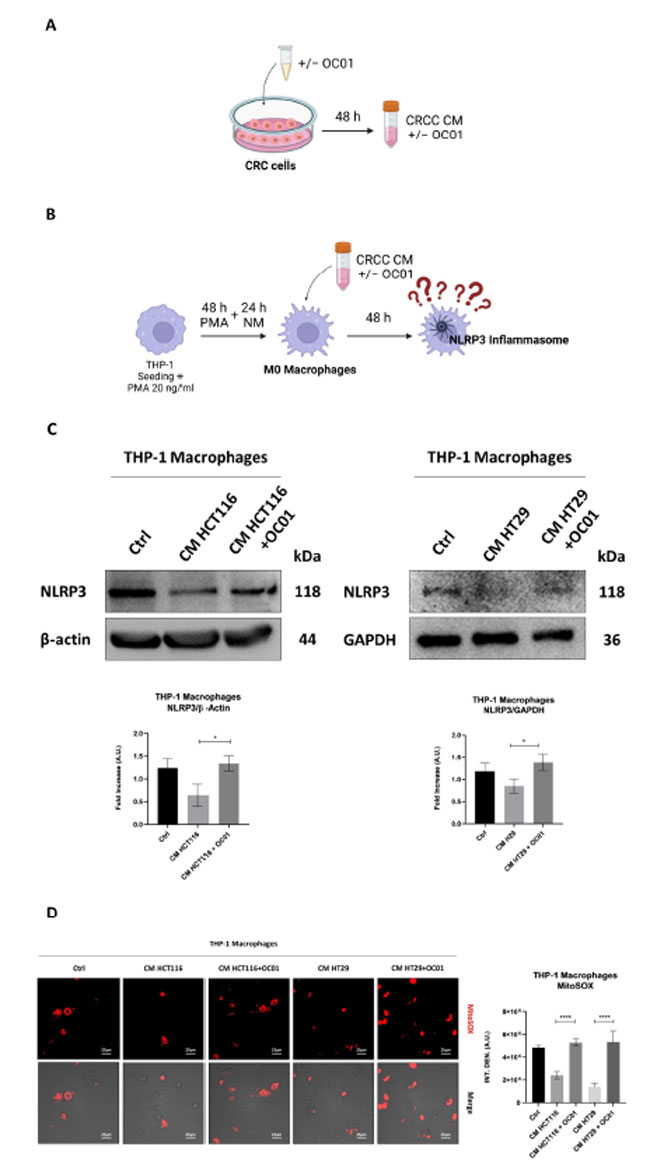 |
図2. Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN)で治癒した大腸がん細胞の分泌物は、マクロファージ内で NLRP3 の活性化と 活性酸素種(ROS) 生成を引き起こします。 (A、B) 実験設計の模式図。HCT116 細胞と HT29 細胞を播種し、10 µL の Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN) で 48 時間処理した、または処理しなかった。処理は 24 時間ごとに更新しました。処理期間の終了時に、調整培地を収集し、分化した M0 マクロファージを 48 時間処理するために使用しました (BioRender で作成)。 (C) 細胞ホモゲネートをウェスタンブロッティングで分析し、NLRP3 の発現を評価しました。ブロットは、再現性のある結果が得られた 3 つの実験の代表例です。フィルターは、ローディングコントロールとして β-アクチンまたは GAPDH で再プローブしました。標準偏差を含む濃度測定分析が提供されます (有意性は * p < 0.05 とみなされました)。 (D) THP-1 細胞をカバーガラス上に播種し、上記のように分化および処理しました。48 時間の処理後、細胞を MitoSOX™ で標識しました。カバーガラスは蛍光顕微鏡を使用して直接視覚化しました (スケールバー = 25 μm、倍率 = 63 倍)。示されているデータは、各条件の複数のフィールドの代表値です。グラフは、細胞あたりの蛍光強度の定量化を示しています (有意性は **** p < 0.0001 とみなされました)。 |
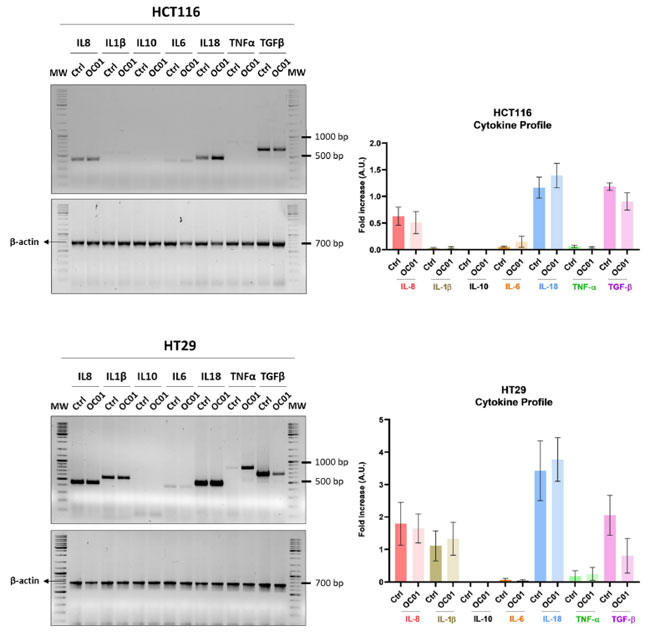 |
| 図 3. Lactiplantibacillus plantarum OC01細胞フリー上清は、HCT116 細胞および HT29 細胞における TGF-β 発現を減少させます。細胞をペトリ皿に播種し、10 µL の Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN) の有無で 48 時間処理し、培地と処理は毎日更新しました。アガロースゲル電気泳動を使用して、IL-8、IL-1β、IL-10、IL-18、IL-6、TNF-α、および TGF-β の PCR 産物を視覚化しました。示されているサイトカイン発現プロファイルは、再現性のある結果が得られた 3 つの実験の代表例です。 |
| 私たちの研究結果は、Lactiplantibacillus plantarum OC01 の代謝産物ががん細胞のサイトカインプロファイルを変化させ、より炎症性マクロファージ状態を促進する環境を作り出し、腫瘍の進行を制限する可能性があることを示唆しています。 |
| 3.4. Lactiplantibacillus plantarum OC01 処理大腸癌細胞由来の調整培地は、マクロファージの M2 様表現型への分極を減少させる |
| Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN)治癒がん細胞由来の調整培地に曝露されたマクロファージにおけるインフラマソーム活性化の観察された変化がマクロファージ表現型の変化に関連しているかどうかをさらに調査するために、炎症状態の低下および腫瘍形成促進活性と関連することが知られている M2 マーカー CD206 および CD163 の発現を評価しました [40]。 |
| 我々の結果は、Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN) を補充した大腸がん細胞由来の調整培地が CD206 および CD163 の発現を著しく減少させ、それによって M0 マクロファージの M2 様表現型への分化を制限することを示しました。対照的に、未処理の大腸がん (CRC)細胞由来の 調整培地にさらされたマクロファージは、インフラマソーム活性化の減少と一致して、抗炎症性 M2 マクロファージへの分化を示すこれらのマーカーの発現の増加を示しました。逆に、Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN) で治癒した大腸がん細胞由来の調整培地で処理したマクロファージにおける CD206 および CD163 の発現の減少と NLRP3 発現および活性酸素種 (ROS)産生の増加は、炎症誘発性マクロファージ状態への移行を示唆しています (図 4)。 |
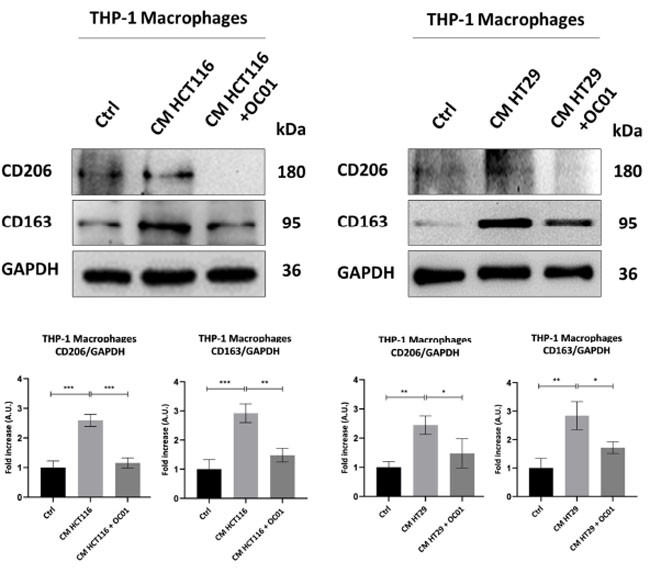 |
| 図4 Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN)で治癒した 大腸がん細胞からの調整培地は、M2 マクロファージへの分化を制限します。HCT116 細胞と HT29 細胞を播種し、10 µL の Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN)で 48 時間処理した、または処理しなかった。処理は 24 時間ごとに更新しました。処理期間の終了時に、調整培地を収集し、分化した M0 マクロファージを 48 時間処理するために使用しました。細胞ホモゲネートをウェスタンブロッティングで分析し、M2 マクロファージマーカー CD206 および CD163 の発現を評価しました。フィルターは、ローディングコントロールとして GAPDH で再プローブしました。ブロットは、再現性のある結果が得られた 3 つの実験の代表例です。標準偏差を含む濃度測定分析が提供されます (有意性は次のように考慮されました: *** p < 0.001、** p < 0.01、* p < 0.05)。 |
| 3.5. Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN)で治癒した大腸がん細胞から調製した培地で再プログラムされたマクロファージ |
| 私たちは、がん細胞の調整培地が抗炎症特性に関連する M2 様表現型へのマクロファージの分化を促進することを実証しました。対照的に、Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN)にさらされたがん細胞の調整培地は、M2 様マーカーを発現しない、より炎症性のマクロファージ表現型を誘導します。 |
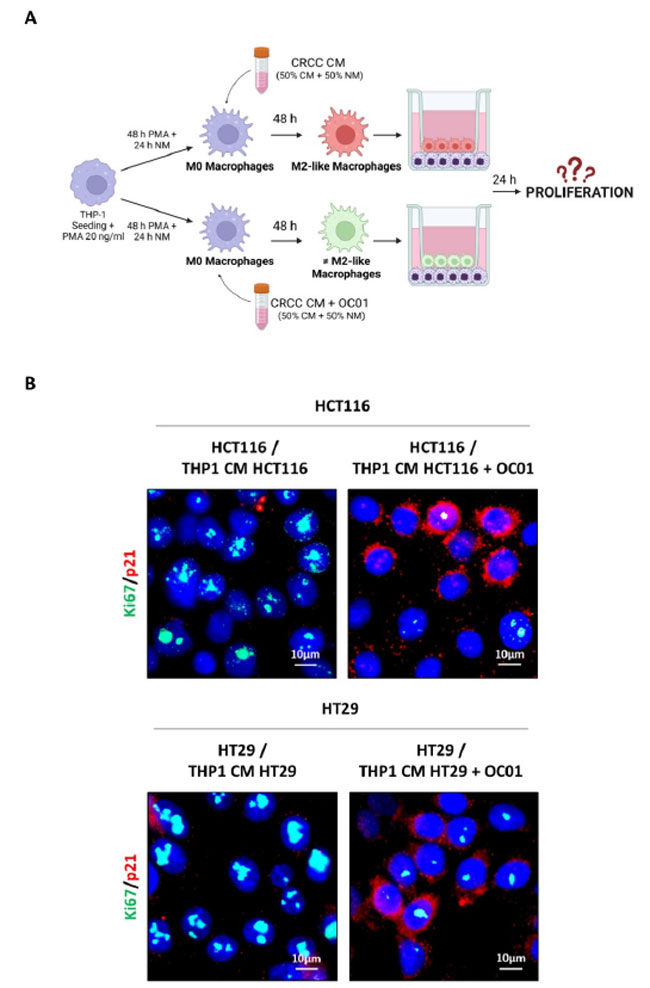
| これらの異なって分極したマクロファージが HCT116 および HT29 がん細胞の挙動にどのように影響するかを調べるために、トランスウェルインサートを使用した非接触共培養システムを採用しました。このシステムでは、細胞同士が直接接触することなく可溶性因子を交換できました。分化したマクロファージ (Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN)に 48 時間曝露した、または曝露していない HCT116 または HT29 細胞からの調整培地に曝露した M0 マクロファージ) をトランスウェルシステムの上部コンパートメントに播種し、がん細胞を下部コンパートメントに播種しました (図 5A)。24 時間の共培養後、増殖マーカー Ki67 およびサイクリン依存性キナーゼ阻害剤 p21waf/Cip1 の発現を免疫蛍光法で評価することで、がん細胞の増殖を分析しました。図 5B に示すように、M2 様マクロファージとの共培養により、HCT116 細胞および HT29 細胞で Ki67 発現が増加し、p21waf/Cip1 が減少しました。対照的に、Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN)で前処理したがん細胞から調整培地で分化した炎症性マクロファージとがん細胞を共培養すると、がん細胞の増殖が減少し、p21waf/Cip1 が増加し、Ki67 発現が減少しました。 |
 |
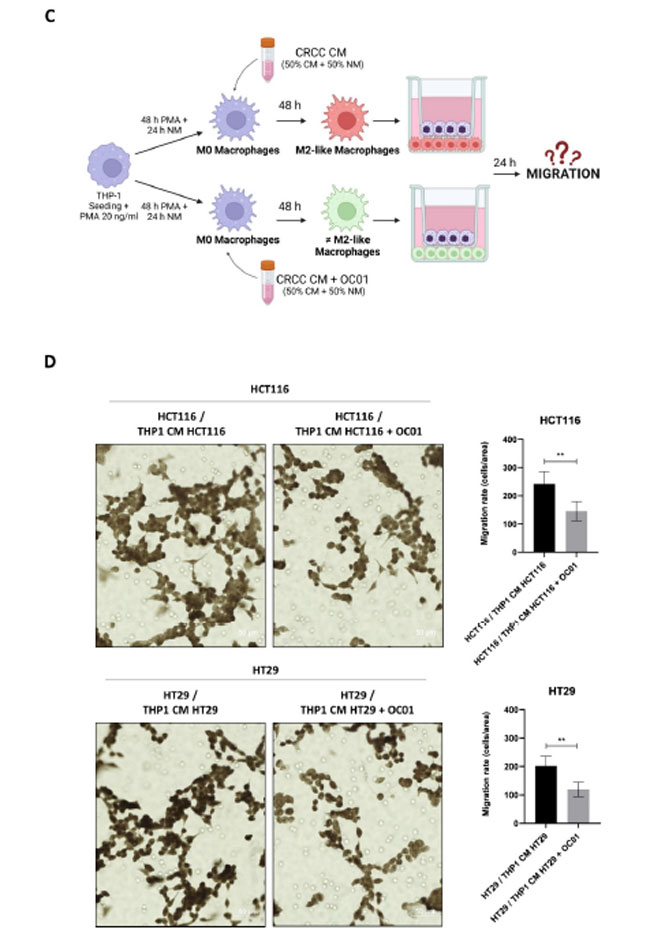 |
図5 Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN)で治癒した大腸がん細胞から調製した培地で再プログラムされたマクロファージは、HCT116 細胞および HT29 細胞の増殖および遊走を抑制します。 (A) 実験設計の模式図。THP-1 細胞を Transwell インサート (上部チャンバー) に播種し、マクロファージに分化させました (PMA で 48 時間、さらに通常の培地で 24 時間培養し、さらに 10 µL の Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN)で前処理した、または前処理していない大腸がん細胞の調整培地で 48 時間培養)。次に、インサートを、カバーガラス上で 24 時間大腸がん細胞をあらかじめ播種した 24 ウェル プレート (BioRender で作成) に移しました。 (B) 通常 (完全) 培地で 24 時間共培養した後、カバーガラス上の HCT116 細胞および HT29 細胞を Ki67 (緑) および p21 (赤) の免疫蛍光染色用に処理しました。核は DAPI で染色しました。細胞は蛍光顕微鏡下で撮影されました(スケールバー = 10 μm、倍率 = 63×)。各条件の代表的な画像を示します。 (C)実験設計の概略図。THP-1細胞を下部チャンバーに播種し、マクロファージに分化させました(PMAで48時間、さらに通常の培地で24時間、さらに10 µLのLactiplantibacillus plantarum OC01 上清 (LpOC01-SN)で前処理した大腸がん細胞の調整培地または未処理の大腸がん細胞の調整培地で48時間インキュベート)。HCT116細胞とHT29細胞をトランスウェルインサートに播種し、24ウェルプレートに配置しました。大腸がん細胞を含む上部チャンバーには無血清培地を入れ(血清因子による影響を避けるため)、マクロファージを含む下部チャンバーには通常(完全)培地を入れました。インキュベーションは24時間続きました(BioRenderで作成)。 (D) 24 時間の共培養後、遊走した HCT116 細胞と HT29 細胞を Axioscan 7 顕微鏡を使用してランダム視野で画像化しました (スケールバー = 50 µm、倍率 = 20×)。各条件の代表的な画像と、遊走した細胞の定量化が標準偏差とともに示されています (統計的有意性: ** p < 0.01)。 |
| 異なるマクロファージ表現型ががん細胞の移動に与える影響をさらに調査しました。この設定では、がん細胞を上部コンパートメントに播種し、上記のように分化したマクロファージをトランスウェルシステムの下部コンパートメントに播種しました(図5C)。24時間後、多孔質膜を通過して移動したがん細胞の数を定量化しました。Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN)で前処理したがん細胞からの調整培地で分化した炎症性マクロファージとの共培養は、未処理の大腸がん細胞の調整培地とのインキュベーションから得られたM2マクロファージとの共培養と比較して、HCT116細胞とHT29細胞の移動を大幅に減少させました(図5D)。 |
| これらの結果は、腫瘍形成を促進する可能性が高い M2 様マクロファージががん細胞の増殖と移動を促進する一方で、より炎症性の表現型を持つマクロファージがこれらのプロセスを阻害することを示唆しています。 |
| 4.考察 |
| 腫瘍塊は、がん細胞だけでなく、線維芽細胞、内皮細胞、免疫細胞、脂肪細胞などの間質成分を含む複雑な微小環境内に存在します。これらの間質細胞は、サイトカイン、ケモカイン、成長因子などの可溶性因子の交換を通じてがん細胞と活発にコミュニケーションを取り、双方向の相互作用を確立します。この動的なクロストークにより、間質細胞はより攻撃的で悪性の表現型を採用するように促され、腫瘍の増殖に寄与します。その結果、腫瘍微小環境は、腫瘍の発生、進行、転移において重要な役割を果たしていることがますます認識されるようになっています[9]。 |
| 大腸がんでは、腸管マクロファージが腫瘍に浸潤する主な免疫細胞です [41]。これらのマクロファージは、休止状態では非極性M0様表現型を示します [42]。しかし、腫瘍微小環境からのシグナル、特にがん細胞によって分泌されるシグナルは、マクロファージの極性化に影響を与え、古典的に活性化されたM1様表現型または代替的に活性化されたM2様表現型のいずれかへと促します [15]。さらに、腸内細菌叢はマクロファージと密接に相互作用し、腫瘍微小環境内でのマクロファージの行動を形作り、腫瘍の増殖にさらに影響を及ぼします [3]。免疫細胞、細菌叢、がん細胞の相互作用は、大腸がんの発生と進行に大きく影響します [43]。 |
| ここでは、Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN) が大腸がん細胞のセクレトームに与える影響と、このセクレトームがマクロファージの極性化にどのように影響するかを調査しました。これらのプロバイオティクス代謝物がセクレトームをどのように変化させるかを理解することは非常に重要です。なぜなら、これらの変化は腫瘍微小環境に大きく影響し、腫瘍の成長と拡散を遅らせる可能性があるからです。注目すべきは、がんセクレトームの影響を受ける重要なプロセスの 1 つが、マクロファージの腫瘍関連マクロファージへの極性化であるということです。 |
| 腫瘍微小環境では、腫瘍関連マクロファージは主に M2 のような表現型を採用します。この分極は、マクロファージの M2 表現型への変換を促進する IL-4 や IL-10 などの抗炎症性サイトカインの豊富さによって引き起こされます。さらに、腫瘍微小環境の代謝ランドスケープは重要な役割を果たしており、乳酸が M2 表現型変換の推進力となっています [44]。M1 と M2 はエネルギー代謝の点でも異なり、前者は主に好気性解糖代謝を示し、ATP の産生は低く (したがって、大量のグルコースの利用可能性に依存)、後者はせいぜいミトコンドリア呼吸を利用しています [42]。がん細胞は、急速な増殖をサポートするために主に好気性解糖を介してグルコースを利用し、それによって他の細胞のグルコースの利用可能性を制限します。その結果、腫瘍微小環境内のマクロファージはグルコースが不足し、エネルギー産生のために酸化的リン酸化に依存しており、これが M2 分極をサポートしています。さらに、がん細胞は腫瘍微小環境に乳酸を放出し、これがM2表現型の維持にさらに寄与します。これらの条件が組み合わさって、腫瘍の進行と免疫回避を促進する免疫抑制環境が形成されます[17]。 |
| 私たちの研究では、大腸がん細胞の調整培地によって極性化されたマクロファージが炎症誘発性または抗炎症性のどちらの表現型を示したかを評価するために、NLRP3の発現を評価しました。私たちの結果は、M0マクロファージをHCT116およびHT29 調整培地で処理すると、NLRP3と活性酸素種(ROS)の両方のレベルが大幅に低下することを実証しました。しかし、マクロファージをLactiplantibacillus plantarum OC01 上清 (LpOC01-SN)で前処理したがん細胞からの調整培地でインキュベートすると、NLRP3と活性酸素種 (ROS)レベルの顕著な増加が観察されました。これらの知見は、後者のシナリオでより炎症性の表現型へのシフトを伴う差別的な炎症状態を示唆しています。マクロファージの炎症状態のこのシフトは、特に大腸がん細胞のセクレトームにおける腫瘍微小環境の変化と密接に関連しているようでした。我々は以前、Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN)が2Dおよび3Dスフェロイド培養の両方で大腸がん細胞の増殖を対照させ、オートファジーを誘導できることを示した[27]。Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN)への(48時間の)曝露により、大腸がん細胞のグルコース代謝がダウンレギュレーションされ、プロテオームが変化し、培養液中の乳酸が少なくグルコースが豊富になるようにする可能性が高い。このような培養液は、マクロファージの代謝に影響を与え、好気性解糖とそれに伴うミトコンドリア機能不全、活性酸素種 (ROS)の生成とインフラマソームの活性化を特徴とするM1様表現型への分極をシフトさせることができる。 |
| 極性化表現型を定義するために、M2cマクロファージに特徴的な表面マーカーであるCD206とCD163の発現を分析した[17]。マクロファージを未処理のがん細胞由来の調整培地とともにインキュベートすると、これらのマーカーが有意に上昇し、顕著なM2c極性化を示した。逆に、Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN)で前治療した大腸がん細胞由来の調整培地とともにインキュベートすると、マクロファージのCD206およびCD163発現が顕著に減少し、Lactiplantibacillus plantarum OC01代謝物ががん細胞のセクレトームを変えることで腫瘍微小環境を修正したことを裏付けた。M2cマクロファージはTGF-βによって強く誘導されることが知られている[16,17]。特に、Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN)による処理は、HCT116細胞とHT29細胞の両方でTGF-β(他のサイトカインではない)レベルの低下を誘導した。この TGF-β の減少は、マクロファージの極性化の調節、特に M2 様表現型の減少に重要な役割を果たしたと考えられます。 |
| 要約すると、これらの知見は、大腸がん細胞セクレトームがマクロファージに M2c 様表現型を誘導する能力を強調しており、これは部分的に TGF-β によって促進される。プロバイオティクスでがん細胞を前治療すると、TGF-β レベルが低下し、M2c 極性化が緩和され、がん細胞のセクレトームとマクロファージの挙動の重要な相互作用が強調された。我々の実験設定では、プロバイオティクス (経口投与されるため上皮粘膜と接触する) と、内腔に突出する (そのため腸内細菌叢および代謝物と接触する) 腫瘍細胞との間の空間関係を in vitro で再現しようとしたが、腫瘍細胞は細胞外マトリックスのより深い層でも増殖し、そこでマクロファージなどの間質細胞と接触する。 |
| M2 様マクロファージ、特に M2c の抗炎症性表現型は腫瘍促進活性と広く関連しているのに対し、より炎症性の表現型は抗腫瘍機能と結びついています。がん細胞と腫瘍関連マクロファージ間の生体内相互作用を模倣することで、トランスウェルを使用した共培養システムを確立し、これらの機能的差異をさらに調査しました。このアプローチにより、異なる分極状態と炎症状態を持つマクロファージが腫瘍の進行にどのように影響するかを評価することができました。以前の研究結果と一致して、未処理のがん細胞からの調整培地によって誘導された M2c 様表現型を示すマクロファージは、p21 の発現の減少と Ki67 の発現の増加によって示されるようにがん細胞の増殖と、トランスウェルを通過した細胞数の増加によって示されるようにがん細胞の移動を促進しました。逆に、Lactiplantibacillus plantarum OC01 で前処理した大腸がん細胞由来の調整培地によって誘導された、より炎症性の表現型を持つマクロファージは、p21 の発現増加と Ki67 の発現減少、および細胞遊走によって示されるように、がん細胞に対して細胞増殖を抑制する逆の効果を示しました。マクロファージは、栄養素、代謝物、およびサイトカイン (例: グルコース、乳酸、TGFβ など) の利用可能性に応じて、腫瘍微小環境条件に適応するために表現型 (および代謝) を非常に急速に変化させることが知られています。私たちの共培養システムでは、マクロファージは通常の培地で 24 時間培養している間、その活性を維持しました。これは、大腸がん分泌がない場合でも、獲得した表現型を保持できることを示唆しています。これは、特定のマクロファージサブタイプマーカーの発現を評価することによって、TGFβ の変化がより顕著であった HT-29 細胞由来の調整培地で確認されました (図 S1)。しかし、マクロファージの獲得表現型が外部刺激がない場合に長期間持続するかどうかはテストしていません。本研究のもう1つの限界は、このような有益な効果の原因となるLactiplantibacillus plantarum OC01上清中の生理活性代謝物をまだ特定していないことですが、以前の研究で示唆されたように、酪酸が主な候補の1つである可能性があります[27,29] |
| 全体的に、我々の結果は、Lactiplantibacillus plantarum OC01 代謝物が 大腸がん細胞のサイトカイン分泌パターンを調節し、マクロファージをより炎症誘発性状態に導く可能性があることを示唆している。この調節は腫瘍微小環境内の免疫抑制シグナル伝達に対抗する可能性があり、マクロファージの極性を変える有望な方法を提供する。ここでは、炎症誘発性表現型に極性化したマクロファージが大腸がん細胞の増殖と移動と対照的であることを示した。Lactiplantibacillus plantarum OC01 上清 (LpOC01-SN)で前処理した大腸がん細胞による TGFβ と乳酸の分泌の減少は、より炎症性のマクロファージプロファイルへのシフトの原因である可能性が高く、M1 様表現型または M2b などの M1 と M2 の中間表現型と一致する可能性がある。 M2bマクロファージはIL-1βまたはリポ多糖 (LPS)によって誘導され、IL-10、IL-1受容体、TNF-α、M1マーカーCD86などのマーカーを発現することが知られています[45]。これらのマクロファージは、通常、よりバランスのとれた免疫応答と関連しており、腫瘍微小環境内のより炎症促進性の環境を好みます。しかし、この表現型を明確に分類し、マクロファージの極性化と活性化に関与する正確なメカニズムを解明するには、さらなる調査が必要です。 |
| 結論として、本研究はプロバイオティクス代謝物が大腸がんの補助療法として有望であることを強調しています。腫瘍微小環境に影響を与える能力、特に腫瘍関連マクロファージの分極と活性化の調整能力に焦点を当てることで、免疫抑制に対抗する新しい戦略を明らかにすることを目指しました。大腸がんの進行と治療結果における腸内細菌叢の重要な役割を考慮すると、これらの研究結果は、プロバイオティクスがどのようにして腸内細菌叢を回復し、腫瘍の成長を抑制し、従来の治療法の有効性を高めることができるかについて貴重な洞察を提供します。腫瘍微小環境に対する有益な効果が維持されるように、大腸がんの補助療法としてプロバイオティクスを継続的に投与することを提案します。最終的に、この研究は、腫瘍微小環境の細菌叢と免疫成分の両方に対処することで、大腸がん管理に対するより効果的で個別化されたアプローチの開発に貢献します。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Biomedicines. 2025 Feb 3;13(2):339.に掲載されたProbiotic-Derived Metabolites from Lactiplantibacillus plantarum OC01 Reprogram Tumor-Associated Macrophages to an Inflammatory Anti-Tumoral Phenotype: Impact on Colorectal Cancer Cell Proliferation and Migration.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |