
Irfan A Rather et al., |
要約 |
| 抗ウイルス薬耐性の発達により、公衆衛生への脅威が高まっています。その結果、現在使用されている薬を効果的に置き換えることができる非従来型の抗ウイルス薬の需要が高まっています。乳酸菌 (LAB) は、食品業界で使用される最も一般的な細菌の 1 つです。これらの細菌は、多くの食品や飼料の発酵に不可欠な役割を果たしています。さらに、これらの細菌は、医療の武器庫の中でより経済的で効率的で安全な「栄養補助食品」と考えられています。そこで、生のラクダ乳乳酸菌分離株のスクリーニングと分子特性評価を行い、インフルエンザウイルス H1N1 に対する阻害活性をテストしました。H1N1 ウイルスに対して最も高い抗ウイルス活性を示した株は、赤血球凝集アッセイによって確認され、Lactiplantibacillus plantarum KAU007(L. plantarum KAU007) と特定されました。この研究では、L. plantarum KAU007から分離された無細胞培養上清(CFCS)がMDCK細胞(訳者注:マディン・ダービー犬腎臓(MDCK)細胞は、生物医学研究で使用されるモデル哺乳類細胞株です。)に対して細胞毒性を示さないことも確認され、哺乳類細胞に対する安全性への懸念が裏付けられました。さらに、5 mg/mLおよび10 mg/mLの無細胞培養上清は、用量依存的にそれぞれIFN-γ(p < 0.001およびp < 0.001)およびIL-6(p < 0.001およびp < 0.005)のレベルを著しく低下させました。これは、ラクダのミルクから分離されたL. plantarum KAU007の抗インフルエンザ活性に関する予備報告です。この研究は、ラクダのミルクにH1N1インフルエンザウイルスに対する拮抗特性を持つ有益な乳酸菌分離株が含まれていることを裏付けています。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 材料と方法 |
| 2.1. ラクダのミルクサンプルからのプロバイオティクスの分離と同定 |
| 2.2. 無細胞培養上清の調製 |
| 2.3. 哺乳類細胞の培養とその維持 |
| 2.4. 無細胞培養上清の細胞毒性分析 |
| 2.5. MDCK細胞に対する無細胞培養上清の抗ウイルス試験 |
| 2.6. 血球凝集抑制 |
| 2.7. サイトカイン プロファイル |
| 2.8. 統計分析 |
| 3. 結果と考察 |
| 3.1. プロバイオティクス 乳酸菌分離株の分離、精製、および同定 |
| 3.2. MDCK 細胞に対する無細胞培養上清の細胞毒性評価 |
| 3.3. 無細胞培養上清の in vitro 抗ウイルス活性を MDCK 細胞を用いて評価 |
| 3.4. 無細胞培養上清の抗ウイルス活性を特定病原体フリー発育卵と赤血球凝集アッセイを使用して評価 |
| 3.5. ELISA によるサイトカインの推定 |
| 4. 結論 |
| 本文 |
| 1.はじめに |
| インフルエンザ」は、インフルエンザウイルスによって引き起こされる伝染性の呼吸器疾患です。インフルエンザの流行により、世界中で 300 万から 500 万人が重症化し、25 万人から 50 万人がインフルエンザ関連の死者を出す可能性があります [1,2]。インフルエンザワクチンは有効であるにもかかわらず、インフルエンザにより米国だけで約 36,000 人が死亡し、最大 22 万人が入院しています [3]。これは、現在のワクチン接種プログラムの有効性が限られているか、ワクチン株が流行しているインフルエンザウイルスと一致した場合にのみ有効であり、抗ウイルス薬のインフルエンザに対する効果に限界があることに一部起因しています [4]。2009 年の H1N1 パンデミックウイルスは、現在のワクチンの無効性を実証しました [5,6]。これまでに合計18種類のHA(H1~H18)とH11種類のNAサブタイプ(N1~N11)が特定されており、HAとNAの組み合わせは多種多様であることが示唆されている[7]。これらの株特異的な変化により、すべての人にワクチンを開発することは不可能である。したがって、インフルエンザウイルスに対する最前線の防御を提供するには、株特異性に関係なく、代替の予防手段を見つける必要がある。さらに、この疾患に対する防御のための非従来的な対策に対する需要が高まっており[5,8,9]、これらのウイルスの新しい変異体は世界的な医療上の脅威となっている[10,11,12]。 |
| 乳酸菌は、宿主に健康上の利益をもたらす最も一般的なプロバイオティクスです。したがって、プロバイオティクスは、腸内細菌叢に似た宿主に利益をもたらす生きた微生物であり [4,13,14,15,16,17,18,19,20,21,22]、胃酸や消化管の胆汁酸で生存することが知られています [23,24]。発酵食品や乳製品には、さまざまなプロバイオティクス 乳酸菌株が含まれていることが報告されています [1,2,14,16,17,23,24,25,26,27,28,29,30,31,32]。しかし、ラクダのミルク由来の 乳酸菌の健康上の利益についてはあまり研究されていません。マウス [2,33]、ニワトリ [25]、およびヒト [2,34] において、乳酸菌プロバイオティクス株はさまざまな感染症に対して有意な予防効果を示しています [17,19,20,21,25,35,36,37,38,39,40,41,42]。乳酸菌株による鼻腔内および経口前処置は、インフルエンザウイルス感染からマウスを保護するのに効果的であることが証明されましたが、重度の体重減少疾患からは保護しませんでした [43,44]。さらに、さまざまな試験で、健康な高齢者の風邪を予防し、インフルエンザにかかったマウスの生存時間を延長する結果が得られました [2,19,35,45]。多くの研究で、いくつかの新しいプロバイオティクス分離株は自然免疫と獲得免疫を高め [46,47,48]、抗ウイルス防御を高めることがわかりました [25,43,44,46]。 |
| 注目すべきは、乳酸菌による治療によってある程度の予防効果が得られるかどうかは不明であるということです。そのため、この研究は、プロバイオティクス株 Lactiplantibacillus plantarum KAU007 (L. plantarum KAU007) の MDCK哺乳類細胞における H1N1 インフルエンザウイルスに対する抗ウイルス効果を視覚化するために実施されました。 |
| 2. 材料と方法 |
| 2.1. ラクダのミルクサンプルからのプロバイオティクスの分離と同定 |
| サウジアラビアのジェッダで、生乳を採取するために合計 10 頭の健康なラクダがランダムに選ばれました。新鮮なミルクサンプルはラクダの乳房から直接採取されました。乳房はオートクレーブで滅菌した蒸留水で洗浄し、使い捨てタオルを使用して乾燥させました。最初の 3 回のミルクストリームは、検査のために採取する前に廃棄されました。滅菌チューブに採取された後、ミルクサンプルはアイスボックスに保管され、2 時間以内に研究室に運ばれました。 |
| さらに、サンプルを希釈(1~10)して、ミルクから有益な微生物を分離しました。この目的のために、ラクダのミルク10 mLと生理食塩水90 mLの均質溶液を調製しました。de Man Rogosa(MRS)寒天プレートに、各希釈液1 mLを塗布し、24~48時間培養しました。いくつかのコロニーを表現型に基づいて選択し、続いてPCB培地で継代培養して乳酸菌を確認しました。最後に、選択した分離株を16S rRNA遺伝子配列決定(Macrogen、Seoul, Korea)に送りました。選択した分離株は、in vitro実験で使用するまで-80°Cで保存しました。その後、各分離株は、20% (v/v) グリセロールを添加した MRS ブロスで 37 °C で 18 ~ 24 時間 2 回継代培養され、実験に使用する前に 37 °C で 48 時間 3 回継代培養して活性化されました。 |
| 2.2. 無細胞培養上清の調製 |
| 無細胞培養上清(CFCS)の調製では、分離株をMRS培地で37℃で18時間培養しました。簡単に説明すると、乳酸菌培養物を収集し、4℃で10,000rpmで10分間遠心分離しました。次に、上清を50mLシリンジに慎重に収集し、0.22μmシリンジフィルターを使用して濾過滅菌しました。濾過した上清を1M NaOHで中和(pH 6.5)し、凍結乾燥させました。サンプルは、さらなる研究に使用するまで4℃で保存しました。 |
| 2.3. 哺乳類細胞の培養とその維持 |
| MDCK細胞株は、以前に発表した報告書[12,26,46]に記載されているのと同じ方法で、研究室で日常的に培養されました。簡単に言うと、細胞は10% リン酸緩衝生理食塩水と0.1%抗生物質/抗真菌溶液を加えたDMEMで培養され、その後、37°Cで5% CO2と95%空気中で維持されました。すべてのin vitroアッセイは、70~80%の細胞密度で実施されました。 |
| 2.4. 無細胞培養上清の細胞毒性分析 |
| 無細胞培養上清の細胞毒性を評価するために、MDCK 細胞を用量依存的 (0~10 mg/mL) に 24 時間処理しました。具体的には、細胞を 96 ウェル プレートに 2 × 104 の密度で播種し、80% のコンフルエンスに達するまで増殖させました。細胞が 80% のコンフルエンスに達した後、細胞をさまざまな濃度 (2.5、5、10 mg/mL) の無細胞培養上清で処理し、哺乳類細胞に対する細胞毒性を評価しました。対照として、リン酸緩衝生理食塩水のみを使用しました。24 時間の処理後、細胞培養培地をウェルから吸引し、各ウェルに 100 μL の新鮮な推奨培地を 10 μL の MTT (5 mg/mL) とともに加え、37 °C で 4 時間インキュベートしました。次のステップでは、培養培地を除去しました。次に、不溶性の出現したフォルマザン結晶を 50 μL DMSO に溶解し、ウェルプレートシェーカーで室温で 30 分間さらにインキュベートしました。マイクロプレートリーダーを使用して 540 nm での吸光度を測定しました。生存細胞の割合は、次の式を使用して推定しました。 |
| 2.5. MDCK細胞に対する無細胞培養上清の抗ウイルス試験 |
| インフルエンザウイルスH1N1(A/Korea/01/2009)は、韓国のKCDAから以前に入手されました。ウイルス株は、MDCK細胞モデルで4%CO2環境下、37℃で72時間増殖されました。次に、1500rpmで5分間遠心分離を行い、感染したMDCK細胞からウイルスを分離しました。H1N1の力価と培養については、以前の研究で詳細に説明されています[16,25,39]。H1N1ウイルスは、5%CO2環境下で、2.5、5、10mg/mLの濃度の無細胞培養上清で37℃で1時間処理されました。その後、MDCK細胞に注入し、5%CO2の加湿チャンバーで37℃で2日間培養しました。細胞は2%リン酸緩衝生理食塩水、100 g/mL ストレプトマイシン、1% (v/v) 100 U/mol ペニシリンを含むDMEMプレートに播種された。2日後にプレートの細胞変性効果(CPE)を観察した。プレートに細胞変性効果が見られない場合、抗ウイルス活性が存在するとみなされた[25]。 |
| 2.6. 血球凝集抑制 |
| H1N1株の血球凝集力価は、標準的な方法[49]と我々が以前に報告した方法[25]を使用して決定した。無細胞培養上清2.5、5、10 mg/mLをH1N1(106.5 EID50/0.1 mL)とともに使用し、我々が以前に使用した方法[25,39]に従って、11日齢の特定病原体フリー(SPF)発育卵の尿膜腔に注入した。 |
| 2.7. サイトカイン プロファイル |
| 細胞は、細胞密度が 80% に達するまで推奨培地で培養されました。その後、細胞はさまざまな濃度 (2.5、5、および 10 mg/mL) の無細胞培養上清で処理され、24 時間培養されました。インターロイキン IFN-γ および IL-6 のレベルは、市販の定量サンドイッチ ELISA キット (R&D Systems, Inc、Minneapolis, MN, USA) を使用して、製造元のプロトコルに従って推定されました。プレートの読み取りには 450 nm の波長が使用されました。結果は、プレートあたりのタンパク質のミリグラム数として表されました。 |
| 2.8. 統計分析 |
| この研究の実験結果は、定量的な結果を決定するために平均 x 標準偏差 (SD) として表されました。統計的有意性と実験グループ間の差異を決定するために、各列のペアの比較には Tukey 検定、複数のグループの比較には Dunnett の事後比較検定を使用した一元配置分散分析 (ANOVA) を使用しました。ここで、* は p 値 < 0.05、** は p 値 < 0.01、*** は p 値 < 0.001、ns は有意でないことを示します。グラフは Prism 9 を使用して作成されました。 |
| 3. 結果と考察 |
| 3.1. プロバイオティクス 乳酸菌分離株の分離、精製、および同定 |
| ラクダのミルクから合計 10 株が分離されました。抗ウイルス活性の予備スクリーニング後、L. plantarum KAU007株が H1N1 に対して最も高い阻害活性を示しました。この株は 16S rRNA 遺伝子配列決定に送られ、L. plantarum (GenBank アクセッション番号 OM442911) と同定され、以降 L. plantarum KAU007 と命名されます。 |
| 3.2. MDCK 細胞に対する無細胞培養上清の細胞毒性評価 |
| 宿主体内での無細胞培養上清の細胞毒性を評価するために、MTT アッセイを使用して 無細胞培養上清で処理した MDCK 細胞の細胞生存率を判定しました。図 1 から、選択した濃度 (2.5、5、10 mg/mL) は、24 時間後に対照の未処理細胞と比較して MDCK 細胞に有意な影響を与えなかったことがわかります。このデータは、分離された無細胞培養上清がテストした哺乳類細胞に対して細胞毒性がないことを裏付けています。 |
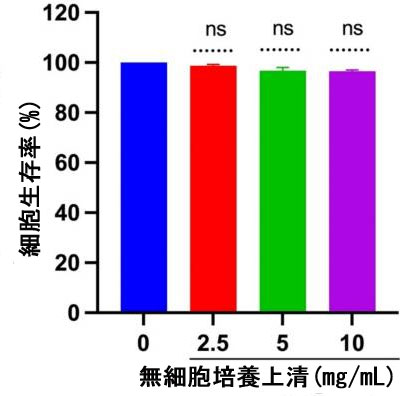 |
| 図1 哺乳類細胞における 無細胞培養上清の細胞毒性。細胞生存率は MTT アッセイを使用して決定されました。実験は 3 回実行され、結果は平均 ± SE 値として示されました。ns = グループ間に統計的に有意な差はありません。 |
| 3.3. 無細胞培養上清の in vitro 抗ウイルス活性を MDCK 細胞を用いて評価 |
| L. plantarum KAU007 の強力な抗ウイルス効果を、インフルエンザ A ウイルス H1N1 に対する MDCK 細胞で調べました。結果は、H1N1 ウイルス量 (106.5 EID50/0.1 mL) が MDCK 細胞で細胞変性効果を誘発したことを裏付けています。その結果、感染していない MDCK コントロール細胞の生存率と比較して、生存可能な MDCK 細胞の数が減少しました (p < 0.001)。それにもかかわらず、L. plantarum KAU007 から分離された無細胞培養上清(5 および 10 mg/mL) で処理した MDCK 細胞は、コントロール (未処理) 細胞および感染細胞と比較して、ウイルス注入から 72 時間後でも細胞変性効果を示さなかった。H1N1 感染細胞に 2.5 mg/mL 無細胞培養上清を処理した後でも、細胞生存率に有意な差 (p < 0.001) が見られました。したがって、L. plantarum KAU007 は MDCK 細胞における細胞変性効果の効果的な阻害剤であると考えられます。図 2 に示すように、無細胞培養上清の段階希釈 (5 および 10 mg/mL) も MDCK 細胞における細胞変性効果を制御することができました。同様の結果は Rather ら [16] によっても報告されており、キムチから分離された L. plantarum にも抗ウイルス活性があることが観察されています。私たちの以前の研究の 1 つでは、最近、L. plantarum が SARS-CoV を阻害することが示されました [31]。 |
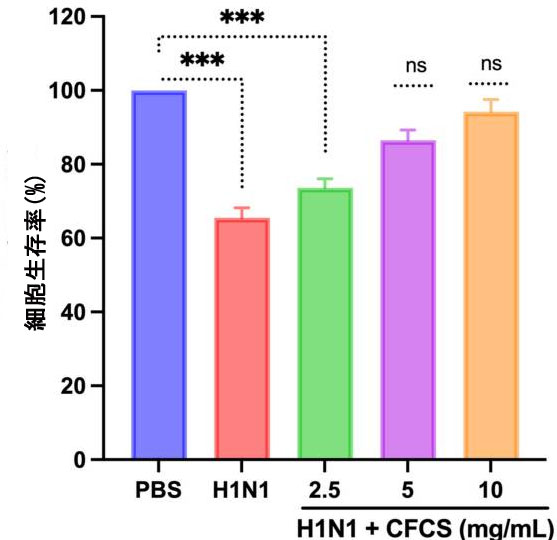 |
| 図2 H1N1 ウイルスの細胞変性効果に対する無細胞培養上清の有効性。細胞生存率は MTT アッセイを使用して決定されました。実験は 3 回実施され、結果は平均 ± SE 値として示されています。統計的有意性は、治療群の細胞生存率をコントロール (PBS のみ) と比較して評価されました。p 値: *** < 0.001。ns = 有意ではありません。 PBS:リン酸緩衝生理食塩水、H1N1: インフルエンザ A ウイルス、CFCS: 無細胞培養上清。 |
| 3.4. 無細胞培養上清の抗ウイルス活性を特定病原体フリー発育卵と赤血球凝集アッセイを使用して評価 |
| 106.5 EID50/0.1 mL のウイルス量を発育卵に接種し、L. plantarum KAU007 の 無細胞培養上清 (2.5、5、10 mg/mL) を同様に使用しました。結果に基づいて、10 mg/mL無細胞培養上清 が発育卵の最高の生存率を促進することがわかりました (図 3)。赤血球凝集アッセイ (HA) を使用して、ウイルスに対する卵培養と発育卵から採取した羊水中の赤血球凝集剤をスクリーニングしました。L. plantarum KAU007 を検査して、その抗ウイルス特性を確認し、生ウイルスと不活化ウイルスを検出しました。 5 mg/mLおよび10 mg/mLの濃度の無細胞培養上清を使用したところ、無細胞培養上清はウイルス感染を完全に無効化することがわかりました(図4)。しかし、2.5 mg/mLではH1N1ウイルス感染に対する効果は低かった。同様に、Sunmolaらの結果は、L. plantarum AA09aがウイルス感染性を効果的に低下させることができることを証明しました[50]。 |
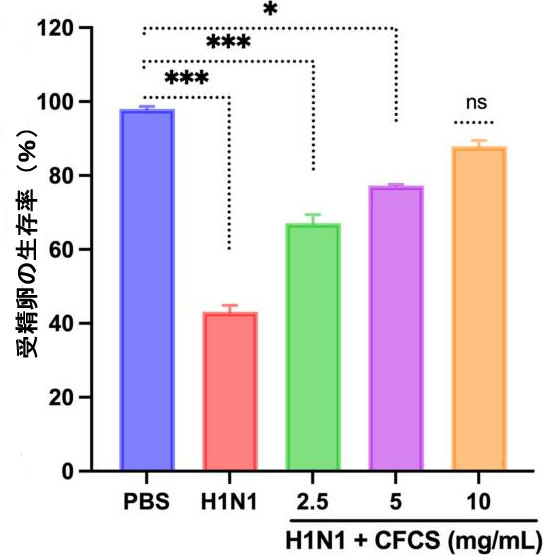 |
| 図3 無細胞培養上清が H1N1 ウイルスに感染した発育卵の生存率に与える影響。実験は 3 回実施し、結果は平均 ± SE 値として示しています。統計的有意性は、治療群の発育卵の生存率をコントロール (PBS のみ) と比較することによって評価しました。結果は、コントロール グループ (PBS のみ) と比較して統計的に評価されました。p 値: * < 0.05、*** < 0.001、ns = 有意でない。 PBS:リン酸緩衝生理食塩水、H1N1: インフルエンザ A ウイルス、CFCS: 無細胞培養上清。 |
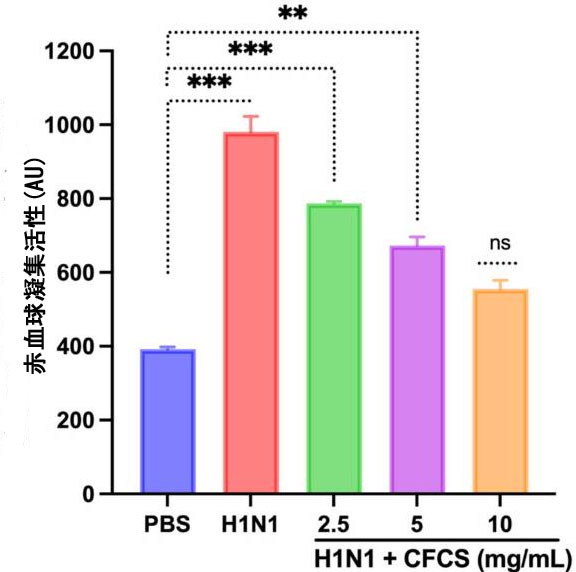 |
| 図4 無細胞培養上清の赤血球凝集活性に対する効果。実験は 3 回実施し、結果を平均 ± SE 値として示しました。統計的有意性は、治療群の赤血球凝集活性をコントロール (PBS のみ) と比較することによって評価しました。p 値: ** < 0.01、*** < 0.001、ns = 有意でない。 PBS:リン酸緩衝生理食塩水、H1N1: インフルエンザ A ウイルス、CFCS: 無細胞培養上清。 |
| 3.5. ELISA によるサイトカインの推定 |
| IFN-γ と IL-6 に限らず、いくつかの炎症誘発性サイトカインは、炎症の発生と制御に大きな役割を果たします。そのため、無細胞培養上清がこれら 2 つのサイトカインの発現レベルに与える影響をテストしました。両方のサイトカインの発現レベルが大幅に低下していることがわかりました。ただし、H1N1 (106.5 EID50/0.1 mL) に感染した細胞では、IFN-γ が対照細胞 (11.4 ± 4.22 pg/mL) と比較して大幅に増加しました (81.64 ± 4.23 pg/mL) (p < 0.001)。さらに、図5に示すように、5 mg/mLおよび10 mg/mLの無細胞培養上清は、用量依存的にIFN-γのレベルをそれぞれp < 0.001およびp < 0.001で有意に低下させました。しかし、2.5 mg/mLの無細胞培養上清処理では、H1N1感染細胞と比較して有意な変化は見られませんでした。さらに、図5に示すように、H1N1感染細胞では、炎症反応に影響を与えるIFN-γとIL-6の相互作用が観察されました。ELISAを使用することで、感染細胞の総IL-6レベル(75.38 ± 2.19 pg/mL)も、コントロール細胞(8.4 ± 2.14 pg/mL)よりも有意に高いことがわかりました(p < 0.001)。しかし、H1N1感染細胞と比較して、それぞれ2.5、5、10 mg/mLの無細胞培養上清で処理した場合、IL-6レベルの有意な低下が観察されました(p < 0.01、p < 0.01、p < 0.001)。他の研究者による研究でも、L. plantarumはTNF-α、IL-6、IL-8などの炎症性サイトカインを減少させる可能性があることが示されています[50]。さらに、L. plantarum IS-10506は、アトピー性皮膚炎の血清中のIL-17、IL-4、IFN-γレベルを低下させることで免疫系を調節することもわかっています[51]。L. plantarumの無細胞培養上清をH1N1感染細胞に処理した場合にも同様の結果が観察されました。 |
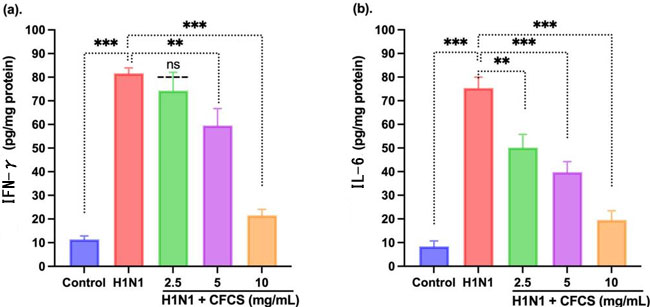 |
| 図5 H1N1 ウイルスに感染した哺乳類の腎臓細胞における無細胞培養上清処理によるインターロイキン レベルへの影響。(a) IFN-γ および (b) IL-6。実験は 3 回実施し、結果を平均 ± SE 値として示しています。統計的有意性は、コントロール グループおよび処理グループのサイトカイン レベルを H1N1 のみに感染したグループと比較することによって評価しました。p 値: ** < 0.01、*** < 0.001、ns = 有意でない。 Control:リン酸緩衝生理食塩水、H1N1: インフルエンザ A ウイルス、CFCS: 無細胞培養上清。 |
| プロバイオティクスは、宿主に有益な効果をもたらすことから、発酵食品や乳製品に利用されてきた長い進化の歴史を持っています [14,17,19,20,21,25,27,45,46]。ここ数十年で、栄養補助食品としてのプロバイオティクスへの関心が高まっています。さらに、何千もの科学的研究が、細菌、ウイルス、真菌感染症に限らず、さまざまな疾患に対するプロバイオティクスの有効性を強化しています。抗菌性とプロバイオティクスの特性により、乳酸菌は近年注目を集めており、化学合成薬の有望な代替品であることを示唆しています [52,53,54]。ラクダのミルクの異なるサンプルからいくつかの異なる乳酸菌株が分離され、H1N1 インフルエンザウイルスに対する抗ウイルス活性がテストされました。これら 10 の乳酸菌株の中で、L. plantarum KAU007 が非常に強力な株であることが判明し、H1N1 インフルエンザに対して最も強い抗ウイルス活性を示しました。 L. plantarum KAU007 から分離された 無細胞培養上清は、MDCK 細胞に対して細胞毒性を示さなかった。これらの結果は、分離された L. plantarum KAU007 は、宿主細胞に影響を与えない安全な候補であると考えられることを裏付けている。MDCK 細胞株に対する in vitro 抗ウイルス活性アッセイでは、L. plantarum KAU007 が H1N1 ウイルスに対して非常に強い抗ウイルス活性を示すことが示された。注目すべきことに、L. plantarum KAU007 の 無細胞培養上清濃度 10 mg/mL が、H1N1 ウイルスに対して最も効果的な用量であった。同様の結果は特定病原体フリー発育卵を使用しても観察され、抗ウイルス活性は無細胞培養上清濃度 10 mg/mL で最大であることが確認された。したがって、私たちの結果に基づいて、L. plantarum KAU007 は、抗インフルエンザ予防活性を有するラクダのミルクに含まれる強力なプロバイオティクス候補である可能性があると結論付けることができる。この研究では、インフルエンザウイルスによって引き起こされる呼吸器疾患の予防策として効果的な治療候補を開発するために、作用機序を調査し、他のインフルエンザ株をターゲットにする必要があります。 |
| 4. 結論 |
| 本研究は、ラクダのミルクとその有益なプロバイオティクス分離株の重要性を裏付けるものです。私たちの知る限り、ラクダのミルクから分離した乳酸菌株が H1N1 に対して評価されたのはこれが初めてです。ラクダのミルクは、必須栄養素が豊富であることに加え、最も高いプロバイオティクスの可能性を秘めています。しかし、ラクダのミルクに含まれる 乳酸菌の種類は地域によって大きく異なります。したがって、本研究は、L. plantarum KAU007がインフルエンザ感染を防ぐための新しい抗ウイルス性プロバイオティクス株である可能性を裏付けています。これは予備研究であり、H1N1 およびその他の株に対する分離株の強さを評価するには、さらなる in vivo 調査が必要です。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Vaccines 2022, 10(3), 456;に掲載されたPotential Antiviral Activity of Lactiplantibacillus plantarum KAU007 against Influenza Virus H1N1.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |