
Min-Kyu Kwak et al., |
要約 |
| 韓国の伝統的な発酵食品キムチから Lactobacillus plantarum LBP-K10を分離しました。有機酸を除去すると、この分離株の培養濾液はインフルエンザA(H3N2)ウイルスに対して高い抗ウイルス活性(プラーク形成アッセイで測定)を示しました。インフルエンザAウイルスに対して活性のある2つの画分は、高性能液体クロマトグラフィーを備えたC18カラムを使用して培養濾液から精製されました。これらの活性画分は結晶化され、ガスクロマトグラフィー質量分析法を使用して環状ジペプチドシス-シクロ(L-Leu-L-Pro)およびシス-シクロ(L-Phe-L-Pro)であることが同定されました。この同定はX線結晶構造解析によって確認されました。これらの環状ジペプチドは、Lactobacillus spp., Leuconostoc spp., Weissella spp., および Lactococcus lactis などの他の乳酸菌の培養濾液でも確認されました。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.材料と方法 |
| 2.1.菌株 |
| 2.2.有機酸を含まない培養濾液の調製 |
| 2.3.抗ウイルス物質の分画 |
| 2.4.プラークアッセイ |
| 2.5.細胞毒性試験 |
| 2.6.質量分析 |
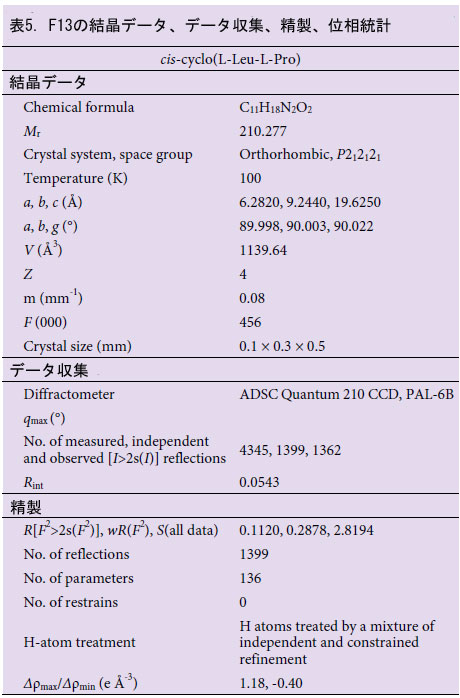
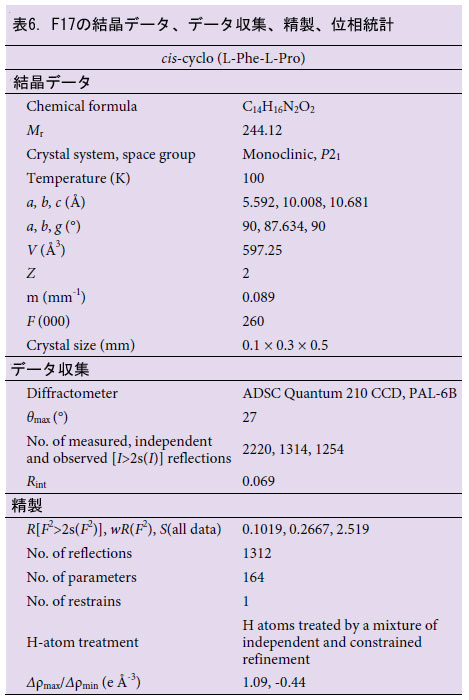
| 2.7.X 線結晶構造解析 |
| 3.結果 |
| 3.1.キムチからの乳酸菌の分離と同定 |
| 3.2.有機酸を含まない培養濾液の抗ウイルス活性 |
| 3.3.培養濾液の分画 |
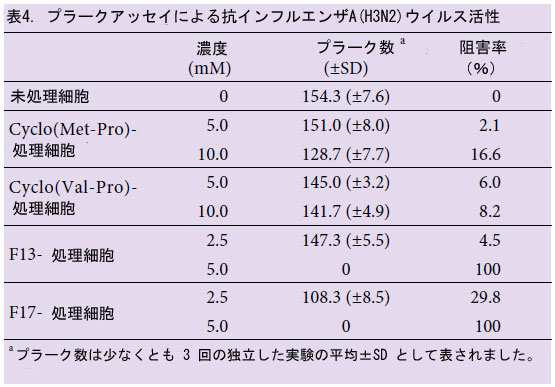
| 3.4.活性画分の同定、抗ウイルス活性および細胞毒性 |
| 4.考察 |
| 本文 |
| 1.はじめに |
| 乳酸菌とその培養上清は、細菌や真菌の増殖を抑制するのに有用なツールです (Rouse and van Sinderen, 2008)。げっ歯類の胃における酵母の増殖抑制 (Savage, 1969) や、マウスの消化管における Ristella 種に対する乳酸菌による拮抗作用が報告されています (Ducluzeau et al., 1971)。 Lactobacillus acidophilus を含む発酵混合物は、Shigella dysenteriae、Salmonella typhimurium、および Escherichia coli の増殖を抑制しました (Rani and Khetarpaul, 1998)。C57BL/6 雌マウスでは、Lactobacillus reuteri の接種により Cryptosporidium parvum 感染が抑制されました (Alak et al., 1997)。 Lb.acidophilus、Lb. reuteri、Lactobacillus casei GG、および Bifidobacterium animalis の抗真菌活性は、無胸腺マウスおよび胸腺正常マウスを全身性カンジダ症から保護する能力を測定することによって調査されました (Wagner et al., 1997)。Lactobacillus coryniformis、Lactobacillus plantarum、および Pediococcus pentosaceus も真菌に対して活性でした (Magnusson et al., 2003)。Lactococcus lactis、Streptococcus cremoris R3、Lactococcus diacetylactis V1、および Streptococcus thermophilus T2 株は、グラム陽性細菌に対して広い阻害スペクトルを示しました (Mezaini et al., 2009)。ライ麦サワードウから分離された乳酸菌は、細菌や真菌に対してバクテリオシン様阻害物質を生成することが報告されています(Digaitiene et al.、2012)。 |
| 乳酸菌の抗菌作用は、乳酸、酢酸、過酸化水素、アミノ酸、ジアセチル、ロイテリサイクリン、3-フェニル乳酸、安息香酸、メチルヒダントイン、ベンゼン酢酸、2-プロペニルエステル、メバロノラクトン、2,6-ジフェニルピペリジン、5,10-ジエトキシ-2,3,7,8-テトラヒドロ-1H,6H-ジピロロ[1,2-a;1,2-d]ピラジン、環状ジペプチドなどの低分子量物質の生成に起因すると考えられています(Niku-Paavola et al., 1999; Gänzle et al., 2000; Ross et al., 2002; Ström et al., 2002; Li et al., 2012)。Lb. plantarum VTT E-78076 由来の Cyclo(Gly-Leu) は Pantoea agglomerans VTT E-90396 および植物病原菌 Fusarium avenaceum VTTD-80147 の増殖を阻害した (Niku-Paavola et al., 1999)。Lb. casei AST18 由来の Cyclo(Leu-Pro) (Li et al., 2012) および Lb. plantarum MiLAB 393 由来の cyclo(Phe-Pro) および cyclo(L-Phe-trans-4-OH-L-Pro) (Ström et al., 2002) は抗真菌物質であると報告されている。Streptomyces属のシクロ(Phe-Pro)とシクロ(Leu-Pro)の相乗的な抗菌活性は、細菌に対しても報告されており、バンコマイシン耐性のEnterococcus faecium, Candida albicans, やCryptococcus neoformans に対しても効果があることが報告されている(Rhee, 2004)。Streptomyces KH29のシクロ(Trp-Trp)は、多剤耐性のAcinetobacter baumanniiやその他の微生物株に対して阻害活性を示した(Lee et al., 2010)。シクロ(Phe-Phe)は、試験管内でセロトニントランスポーターとアセチルコリンエステラーゼを阻害し、アルツハイマー病と認知症の発症を予防する働きがある(Tsuruoka et al., 2012)。Lb. reuteri 由来のシクロ(Phe-Pro)とシクロ(Tyr-Pro)は、staphylococciが産生する毒性因子を弱めることにより、クオラムセンシング(訳者注:細菌が細胞間で化学物質を介してコミュニケーションを取り、集団として生育する現象)におけるシグナル伝達エフェクターとして同定された(Li et al., 2011)。グリシン含有環状ジペプチド、シクロ(Phe-Cys)、特にシクロ(Tyr-Cys)は、試験管内でHT-29、HeLa、MCF-7細胞におけるがん細胞の増殖を著しく阻害した(Van der Merwe et al., 2008)。シクロ(Pro-Trp)、シクロ(Phe-Pro)、シクロ(Trp-Pro)、シクロ(Trp-Trp)は、微生物の増殖を阻害し、胃腸細胞の成熟を促進した(Graz et al., 1999)。シクロ(His-Phe)およびシクロ(His-Tyr)は、心血管疾患および子宮頸がん細胞に対して顕著な活性を示した(McCleland et al., 2004)。さらに、アルボノウルシン産生株であるStreptomyces albulus KO-23は、環状ジペプチドを対応するデヒドロ誘導体に変換する触媒作用をすることが報告されており、これが細胞分裂を阻害することが観察されている(Kanzaki et al., 2000)。 |
| 環状ジペプチドとその構造は、細菌や真菌に対する活性を含め、生物学的活性の点で広く研究されてきました (Prasad、1995 年、Trabocchi ら、2008 年)。しかし、その抗ウイルス活性についてはまだ報告されていません。そこで、韓国の発酵食品キムチから乳酸菌を分離し、その培養上清から抗ウイルス物質を探しました。 |
| 2.材料と方法 |
| 2.1.菌株 |
| 乳酸菌は、1.0%寒天を含むde Man、Rogosa、Sharpe(MRS)培地(De Man et al.、1960)で、白菜、カラシナの葉と茎、マンネングサなどのさまざまな野菜を含む自然発酵植物から分離されました。分離株の同定には、16S rDNA配列決定法を使用しました。真正細菌プライマーは、ポリメラーゼ連鎖反応(PCR)に使用されました(27F:5֍-AGA GTT TGA TCM TGG CTC AG-3֍、1492R:5֍-GGY TAC CTT GTT ACG ACT T-3֍)。 PCR には、次の反応を使用しました: 30 サイクル、94°C で 5 分間のプレ変性、94°C で 1 分間の変性、55°C で 1 分間のアニーリング、および 72°C で 7 分間の伸長。分離された株から得られた選択された 16S rDNA 配列の相同性は、ヌクレオチド BLAST (NCBI、http://www.ncbi.nlm.nih.gov) を使用して比較され、ゲノム データベースを使用して増幅された PCR 産物が特定されました。分離されたすべての乳酸菌は、MRS 培地を使用して 30°C で 3 日間培養されました。抗ウイルス活性を予測するために、最小発育阻止濃度とディスク拡散アッセイを使用して抗菌活性と抗真菌活性を測定しました。 |
| 2.2.有機酸を含まない培養濾液の調製 |
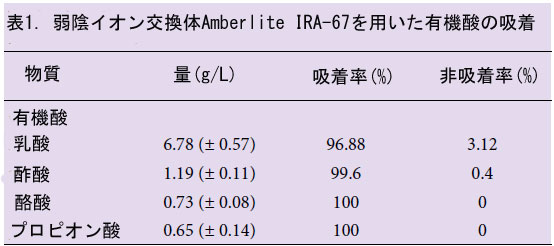
| Lb. plantarum LBPK10 の培養濾液から抗ウイルス物質と有機酸の干渉を避けるため、以前に提案された方法に若干の修正を加えた弱陰イオン交換樹脂 Amberlite IRA-67 で有機酸を除去しました (Gao et al., 2010)。HPLC 分析では、L-乳酸、酢酸、酪酸、プロピオン酸を購入しました (Sigma、USA)。Amberlite IRA-67 樹脂で溶出除去された有機酸を定量しました。培養上清からの溶出液を凍結乾燥し、得られた粉末を 5 倍量の塩化メチレンで抽出しました。塩化メチレン画分を蒸発させた後、得られた粉末をプラークアッセイ用に適切な量の滅菌蒸留水に溶解しました。 |
| 2.3.抗ウイルス物質の分画 |
| 3日間培養したLb. plantarum LBP K-10の上清を凍結乾燥により濃縮し、塩化メチレンで抽出しました。蒸発により塩化メチレンを除去した後、シロップ状の生成物を蒸留水に溶解し、0.22 μm-セルロースアセテート膜で濾過しました。濾過したサンプルは、セミ分取C18逆相カラム(9.4 × 250 mm、Agilent、USA)とChemStation HPLCソフトウェアを備えた高性能液体クロマトグラフィー(セミ分取HPLCシステム、Agilent 1200シリーズ、USA)システムで分離しました。移動相は水67.0%、アセトニトリル3.0%、メタノール30.0%で45分間、対応するクロマトグラムを観察するための波長はそれぞれ210、260、280 nmでした。各画分を収集し、凍結乾燥により濃縮して粉末を得ました。 |
| 2.4.プラークアッセイ |
| 抗ウイルス活性は、以前に提案された手順に若干の修正を加えて調査しました (Huprikar および Rabinowitz、1980)。宿主細胞としてマディン・ダービー犬腎臓(MDCK) 上皮細胞を使用し、感染にはインフルエンザ A (H3N2) ウイルスを使用することが韓国国立衛生研究所によってサポートされました。この研究のプラークアッセイには、X 線結晶構造解析に使用された結晶化された単一化合物を使用しました。さらに、抗ウイルス物質を他の類似体と比較するために、プラークアッセイ用にシクロ (Met-Pro) およびシクロ (Val-Pro) (Bachem、Switzerland) を購入しました。 |
| 2.5.細胞毒性試験 |
| 環状ジペプチドのマディン・ダービー犬腎臓細胞に対する細胞毒性効果は、以前に提案された方法(Watanabe et al., 1994)に従って、モスマンベースの3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウム臭化物を使用して決定されました。 マディン・ダービー犬腎臓細胞は、適切な細胞密度で96ウェル丸底マイクロタイタープレートに接種されました。10%ウシ胎児血清を含むダルベッコ改変イーグル培地で増殖した細胞は、37°Cでインキュベートされました。マディン・ダービー犬腎臓細胞をダルベッコ改変イーグル培地で48時間増殖させた後、各ウェルを2.0~14.0 mM(2.0 mM単位)の濃度の環状ジペプチドで処理し、細胞をさらに48時間インキュベートしました。細胞生存率は、Power Wave X 分光光度計(Bio-tek Instruments、USA)を使用したマイクロタイタープレートリーダーで 492 nm の吸光度を測定して評価しました。 |
| 2.6.質量分析 |
| 各画分の電子イオン化(EI)と化学イオン化(CI)を調べるために、直接挿入プローブを使用したガスクロマトグラフィー質量分析(GCMS)システムで分子量を測定しました。7679シリーズ自動液体サンプラーを備えたAgilent 6890シリーズGC(Agilent Technologies、Germany)で構成されるクロマトグラフィーシステムを使用しました。質量分析は、高分解能質量分析計(JEOL JMS-700、Japan)を使用して実施しました。 |
| 2.7.X 線結晶構造解析 |
| すべての分画の結晶はパラトーン N オイルでコーティングされ、韓国のポハン加速器研究所の 2D SMC ビームラインで、ADSC Quantum 210 検出器とシリコン (111) 二重結晶モノクロメータ (DCM) を使用して、シンクロトロン放射 (λ = 0.66999 Å) で 95 K で回折データが測定されました。データ収集には ADSC Q210 ADX プログラム 1 が使用され (検出器距離は 62 mm、オメガスキャン、Δω = 1°、露出時間は 1 フレームあたり 20 秒)、セルの改良、データ削減、吸収補正には HKL3000sm (Ver. 703r) が使用されました。すべてのフラクションの結晶構造は、SHELXTL-XS プログラムによる直接法で解析され、SHELXTL-XL (Ver. 2008) プログラム パッケージによるフル マトリックス最小二乗法計算によって精密化されました。これらの結晶構造は、ケンブリッジ結晶学データ センター (https://www.cdc.am.c.uk/ervices/structure_deposit/) に寄託されました。データは、それぞれ 13 番目と 17 番目のフラクションに対応する寄託番号 CCDC 937533 と CCDC 937534 に割り当てられています。 |
| 3.結果 |
| 3.1.キムチからの乳酸菌の分離と同定 |
| 記載されているようにさまざまな野菜を使用して調理されたキムチから、Leuconostoc spp.、Lactobacillus spp.、Weissella spp.、および L. lactis を含む約 400 株の乳酸菌が分離されました。これらの株は、PCR 増幅による 16S rDNA 配列決定法を使用して識別されました (データ未掲載)。分離株のうち、Lb. plantarum LBP-K10 の培養濾液は、予備的に最も顕著な抗菌および抗真菌活性を示しました (データ未掲載)。 3 日間培養された Lb. plantarum LBP-K10 の培養濾液は、いくつかの条件で確認された顕著な抗菌および抗真菌活性を示しました。培養濾液は熱およびタンパク質分解に対して安定でした (データ未掲載)。これらのデータを総合すると、インフルエンザAウイルスに対する抗ウイルス物質を分離するために、この研究でLb. plantarum LBP-K10を使用すべきであることが示唆されました。 |
| 3.2.有機酸を含まない培養濾液の抗ウイルス活性 |
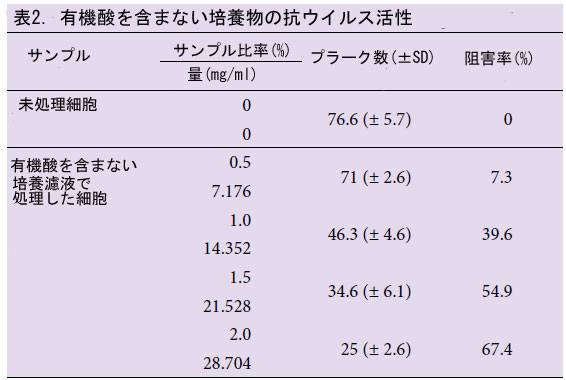
| 分離株の培養濾液には多量の有機酸が含まれているため、有機酸を除去した後に抗ウイルス活性を検討し、予測する必要がありました。培養濾液を使用した抗ウイルス活性は、以下の理由から有機酸なしでテストされました。乳酸菌由来の乳酸およびその他の揮発性酸の抗菌および抗ウイルス活性の幅広いスペクトルは以前に報告されています (Naidu ら、1999)。また、プラークアッセイ用のマディン・ダービー犬腎臓(MDCK)細胞は有機酸の存在下では増殖できません (データ未掲載)。有機酸は Amberlite IRA-67 樹脂を使用して完全に除去され、その量は表 1 に示されています。培養濾液から有機酸を除去後、インフルエンザ A (H3N2) ウイルスに対する抗ウイルス活性を調査しました。培養濾液を添加した場合のウイルス増殖は、培養濾液を添加しない場合の約70%阻害された(表2)。この結果から、有機酸を含まない培養濾液の抗ウイルス化合物は、プラーク形成ウイルス感染とインフルエンザAウイルスの増殖の両方の阻害に寄与する可能性があると推測された。 |
 |
 |
| 3.3.培養濾液の分画 |
| 最も高い抗ウイルス活性は、3日間培養した細胞の培養濾液で観察され、この活性は冷蔵条件下で2~3年間維持されました(データ未掲載)。したがって、抗インフルエンザAウイルス化合物は、3日間培養した細胞の培養濾液から精製されました。培養濾液の抗ウイルス活性は、滅菌および0.22μmセルロースアセテート膜による濾過後も維持されており、抗ウイルス物質が小さな化合物であることを示唆しています。Lb. plantarum LBP-K10の培養濾液から、F1~F17と名付けられた17の異なる画分が収集されました(図1)。 |
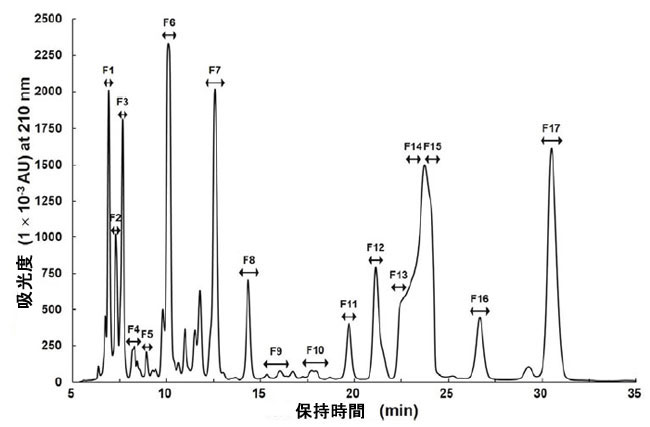 |
| 図 1. 培養濾液から 17 個の画分を塩化メチレン抽出により収集しました。HPLC プロファイルから 17 個の異なる画分を収集しました。これらの画分は保持時間に従って分離されました。AU、任意単位。 |
| 3.4.活性画分の同定、抗ウイルス活性および細胞毒性 |
| 17画分の抗ウイルス活性を予備的に確認した後(データ未掲載)、すべての画分をガスクロマトグラフィー質量分析(GCMS)で同定し、続いて結晶化して抗ウイルス化合物の3次元構造を決定した。 そこで、適量の滅菌蒸留水に溶解した後、結晶化したサンプルで抗ウイルス活性を調べた。17画分のうち、抗ウイルス画分F13とF17のCI値はそれぞれ211と245であることが明らかになった。EIフラグメンテーションパターンから、F13とF17はそれぞれシス-シクロ(L-Leu-L-Pro)とシス-シクロ(L-Phe-L-Pro)であることが示唆された(図2および表3)。 cis-シクロ(L-Leu-L-Pro)およびcis-シクロ(L-Phe-L-Pro)の抗ウイルス活性の濃度は2.5 mM以上であることが観察され、インフルエンザウイルスに感染した5.0 mM処理MDCK細胞では60時間後でもプラークは観察されませんでした(表4)。対照的に、シクロ(Met-Pro)およびシクロ(Val-Pro)などの市販のプロリン含有環状ジペプチドでは抗ウイルス活性は検出されませんでした(表4)。さらに、シクロ(Met-Pro)およびシクロ(Val-Pro)の濃度は、cis-シクロ(L-Leu-L-Pro)およびcis-シクロ(L-Phe-L-Pro)の濃度の約2倍でした。この結果は、環状ジペプチドの類似体が、宿主細胞の生存率と感染性を説明する感染性の基準として使用できることを示唆している。しかし、2 つの環状ジペプチド、cis-cyclo(L-Leu-L-Pro) と cis-cyclo(L-Phe-L-Pro) の抗ウイルス活性は、濃度に応じていくらかの細胞毒性を示した (図 3)。2 つの環状ジペプチドの高濃度、特に 10.0 mM を超える濃度は、宿主細胞の生存率にわずかに影響した (図 3)。インフルエンザウイルスに対する有効濃度は、宿主細胞に対する細胞毒性濃度よりもはるかに低かったため、2.5~5.0 mM の濃度でウイルスの感染性と増殖が著しく阻害されると結論付けた (図 3 および表 4)。 |
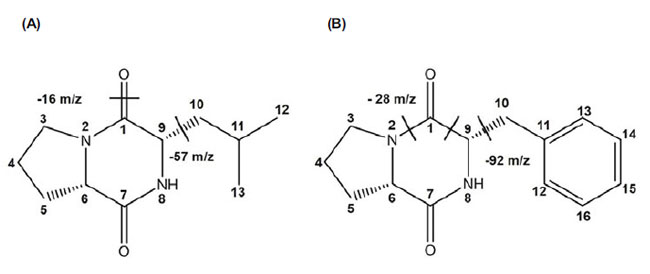 |
| 図 2. GC-MS による F13 と F17 の提案構造。EI および CI 質量スペクトルから、(A) F13 の m/z 211 [M+H]+ ベースピーク、(B) F17 の m/z 245 [M+H]+ ベースピークが明らかになりました。F13 と F17 の予測構造は次のとおりです。F13: cis-cyclo(L-Leu-L-Pro)、F17: cis-cyclo(L-Phe-L-Pro)。化学結合で区切られた構造単位は破線で区切られています。 |
 |
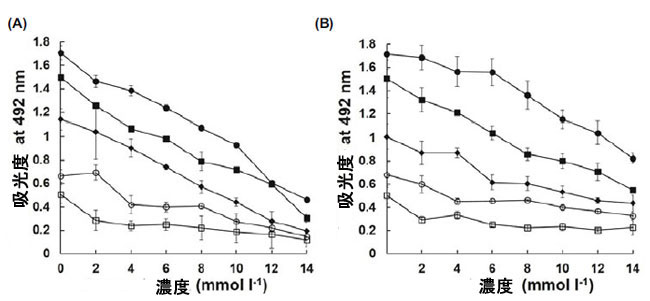 |
| 図 3. 抗ウイルス化合物の MDCK 細胞に対する細胞毒性効果。細胞毒性は、MDCK 細胞を使用して、cis-cyclo(LLeu-L-Pro) (A) または cis-cyclo(L-Phe-LPro) (B) で測定されました。エンドポイント生存率アッセイは、MTT アッセイを使用したハイスループットスクリーニング法のために 96 ウェルマイクロプレートで使用されました。各実験は、2.0 mM から 14.0 mM の範囲の濃度で調査され、48 時間インキュベートされました。次の初期細胞数が使用されました: 6.0 × 104 細胞 (Ձ��)、3.0 × 104 細胞 (Վ��)、1.5 × 104 細胞 (Ռ��)、7.5 × 103 細胞 (Ձ��)、および 3.75 × 103 細胞 ()。すべての結果は、3回の実験の平均±標準偏差として表されます |
 |
| 3.5.抗ウイルス物質の構造決定 |
| cis-シクロ(L-Leu-L-Pro)およびcis-シクロ(L-Phe-L-Pro)の構造を確認するために、これらの抗ウイルス化合物を使用してX線結晶構造解析を実施しました(表5、6、および図4)。 cis-シクロ(L-Leu-L-Pro)(図4A、左)またはcis-シクロ(L-Phe-L-Pro)(図4B、左)の結晶は、メタノール/塩化メチレンを使用して得られました。X線回折データ(表5および6)から、cis-シクロ(L-Leu-L-Pro)(図4A、右)およびcis-シクロ(L-Phe-L-Pro)(図4B、右)の3次元構造が提案されました。Lb. plantarum LBP-K10 の cis-cyclo(L-Leu-L-Pro) および cis-cyclo(L-Phe-L-Pro) であることが確認されました (表 5、6、図 4)。 |
 |
 |
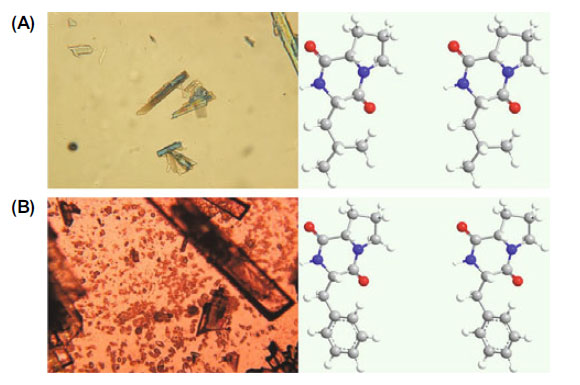 |
図 4. X 線結晶構造解析により決定された cis-cyclo(L-Leu-L-Pro) (A) および cis-cyclo(L-Phe-L-Pro) (B) の 3 次元構造。 cis-cyclo(L-Leu-L-Pro) および cis-cyclo(L-Phe-L-Pro) の結晶 (A および B、左) と立体表示 (A および B、右)。炭素 (灰色)、水素 (白)、酸素 (赤)、窒素 (青) が示されています。 |
| 4.考察 |
| 最近、100 種類を超える環状ジペプチドが生物学的活性を持つことが報告されています (Prasad,1995、Trabocchi et al.,2008) が、研究者は主に抗菌および抗真菌特性に注目してきました (Niku-Paavola et al.,1999、Gänzle et al.,2000、Ström et al.,2002、Rhee,2004、Lee et al.,2010、Li et al.,2012)。しかし、抗ウイルス活性を持つ環状ジペプチドはまだ報告されていません。さらに、乳酸菌によって生成される有機酸は、微生物に対して pH を低下させると同時に強力な抗菌活性を持つことが報告されています (Matsuda,1994、Naidu et al.,1999)。有機酸を含まない培養濾液から抽出した混合物中の各環状ジペプチドの量を調べたところ、これらの混合物が抗インフルエンザウイルス複合体であることが確認されました(表2)。 有機酸を含まないシス-シクロ(L-Leu-L-Pro)およびシス-シクロ(L-Phe-L-Pro)を含む環状ジペプチドの混合物と単一化合物との間の濃度差は次のとおりであった。有機酸を含まない2.0%培養濾液の場合、プラーク形成アッセイにより、シス-シクロ(L-Leu-L-Pro)およびシス-シクロ(L-Phe-L-Pro)の濃度はそれぞれ180.3 μMおよび165.6 μMであったのに対し、単一分子の場合はそれぞれ2.5 mMおよび5.0 mMであった(表2)。 これらの濃度は、2.5~5.0 mM cis-シクロ(L-Leu-L-Pro)およびcis-シクロ(L-Phe-L-Pro)に相当する投与量では、それぞれ13.9~27.7倍および15.1~30.2倍の減少に相当しました。したがって、これら2種類の環状ジペプチドを含む混合物の相乗効果は、抗ウイルス物質の正体に関する手がかりとなる可能性があります。インフルエンザAウイルスに対して、cis-シクロ(L-Leu-L-Pro)またはcis-シクロ(LPhe-L-Pro)は、シクロ(Met-Pro)またはシクロ(Val-Pro)と比較して、劇的な抗ウイルス活性を示しました(表4)。この結果は、シス-シクロ(LLeu-L-Pro)とシス-シクロ(L-Phe-L-Pro)がインフルエンザAウイルスに対して活性な環状ジペプチドであると考えられることを示唆している。 |
| これらの環状ジペプチドの両方のアミノ酸残基のα、β位に二重結合が存在することが抗菌活性に必要であると示唆されており、また、ジケトピペラジン環のNHプロトン、またはピロリン環とジケトピペラジン環の平面構造の配座(ボートアップ型やボートダウン型など)が微生物に対する阻害活性に影響した可能性がある(Borthwick,2012)。予測NMR結果から、エネルギー的に有利な配座異性体の大多数がボート型配座を採用した環状ジペプチドを含むことが明らかになった(Li et al.,2013)。しかし、環状ジペプチドの構造特性による抗ウイルス活性は確認されていない。生物活性構造に関する議論のこれらの側面に加えて、細胞毒性も考慮する必要がある。シスシクロ(L-Leu-L-Pro)とシスシクロ(L-Phe-L-Pro)のマディン・ダービー犬腎臓(MDCK)細胞に対する細胞毒性は、これらがマディン・ダービー犬腎臓細胞の増殖速度を低下させる可能性を示唆しており、環状ジペプチドの高濃度では細胞増殖が制限された(図3)。 |
| 結論として、我々は乳酸菌由来の環状ジペプチドに接近して抗ウイルス化合物を探索し、その構造を決定し、有機酸を含まない培養濾液由来の環状ジペプチドと単一の環状ジペプチドとの間に相乗効果を観察した。環状ジペプチドの特定の機能は、豊富なキラリティーに依存すると考えられており、立体化学と配座構造を変えることができる4つの位置の利用可能性は、抗ウイルス活性において重要な役割を果たすと考えられていた。したがって、環状ジペプチドの抗ウイルス活性を調査するための他のアプローチは、抗ウイルス機能と構造検証の関係に焦点を当てなければならない。さらに、インフルエンザウイルス感染のメカニズムは、コルチゾール濃度の低下を引き起こす副腎皮質刺激ホルモンの抑制に関連する遺伝子によって引き起こされると示唆されている(Jefferies et al.,1998)。インフルエンザウイルス感染時に活性化する遺伝子のうち、ヒトプロテアーゼ遺伝子やウイルスのヘマグルチニンタンパク質の切断に関連する未確認遺伝子(Steinhauer,1999)は、感染の根本原因を解明する上で有用なツールとなり得る。したがって、環状ジペプチドの効果とウイルス感染を引き起こす遺伝子の調査は、感染メカニズムの重要な手がかりとなる可能性がある。 |
| 有機酸を含まない培養濾液の顕著な抗ウイルス活性は、発酵食品由来の環状ジペプチドの相乗効果が抗ウイルス物質開発の新たな方向性をもたらす可能性があることを示唆している。本研究では環状ジペプチドはやや高濃度で有効であったが、これらの化合物は発酵食品由来の天然抗生物質である。さらに、Lb. sakei LBP-S01、Lc. lactis LBP-S03、Ln. mesenteroides LBPK06、Lb. plantarum LBP-K10、W. cibaria LBP-K15、W. confusa LBP-K16 などのさまざまな乳酸菌の画分は、類似の代謝物を生成および排泄すると考えられており (データ未掲載)、これらの同族化合物は同時に抗ウイルス機能を示した。さらに、インフルエンザA(H3N2)に対する抗ウイルス活性を示したLb. plantarum LBP-K10の培養濾液由来の化合物cis-cyclo(L-Leu-L-Pro)およびciscyclo(L-Phe-L-Pro)が特許出願されています(大韓民国特許出願番号10-2012-0111164、2012年;PCT/KR2013/002077、2013年)。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Journal of Microbiology (2013) Vol. 51, No. 6, pp. 836–843に掲載されたCyclic Dipeptides from Lactic Acid Bacteria Inhibit Proliferation of the Influenza A Virus.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |