
Jun-Hong Xing et al., |
要約 |
| 従来のインフルエンザワクチンには、新しい変異株に関するいくつかの制限があります。したがって、抗原に関連しないタイプのインフルエンザウイルスに対する予防手段の開発が特に重要です。最近の研究では、プロバイオティクスが免疫系を調整し、ウイルス感染の重症度を軽減できることが示されています。この研究では、インフルエンザウイルスH9N2に対するLactiplantibacillus plantarum 0111の可能性を調査しました。チャレンジ実験では、L. plantarum 0111の前処理により、マウスの生存率と体重減少が効果的に改善され、肺と気管支肺胞洗浄液(BALF)中の炎症性サイトカインIL-6とTNF-αが減少し、肺と腸の損傷の程度が軽減されることが示されました。FMT実験(訳者注:糞便移植(FMT:Fecal Microbiota Transplantation )とは健康な人の便に含まれている腸内細菌を病気の患者さんに投与する治療法です)では、L. plantarum 0111によって生成される保護効果が腸内微生物に関連していることが実証されています。さらに、マウス腸内細菌叢の16Sハイスループットシーケンシングにより、L. plantarum 0111はH9N2感染後に腸内細菌叢を再構築し、腸内細菌叢のバランスを維持することが示されました。マウスモデルでは、L. plantarum 0111の経口投与により、血清と気管支肺胞洗浄液中のIFN-β発現が増加しました。同時に、マウスの腸と肺のIFN-βと関連ISG(訳者注:ISG(interferon stimulating gene)とは、インターフェロン誘導性遺伝子のことで、自然免疫系における抗ウイルス応答において中心的な役割を担っています)の転写レベルも増加しました。さらに、フローサイトメトリーにより腸間膜リンパ節(MLN)と脾臓のT細胞の活性化と極性化が検出され、その結果、L. plantarum0111は腸間膜リンパ節と脾臓のT細胞でサイトカインを調節し、B細胞でIgA発現を増加させることが示されました。したがって、L. plantarum 0111 は腸内細菌叢を介した免疫反応を改善し、インフルエンザウイルスによる感染に抵抗する可能性があり、インフルエンザウイルスに対する効果的な予防策として使用できる可能性があります。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.材料と方法 |
| 2.1.細菌、細胞、ウイルス、動物 |
| 2.2.実験設計とサンプル収集 |
| 2.3.抗生物質治療と糞便移植(FMT) |
| 2.4.Illumina シーケンシング |
| 2.5.フローサイトメトリー分析 |
| 2.6.ウイルス力価検出 |
| 2.7.定量PCR |
| 2.8.組織学的分析 |
| 2.9.統計分析 |
| 3.結果 |
| 3.1.Lactiplantibacillus plantarum 0111 の保護効果 |
| 3.2.Lactiplantibacillus plantarum 0111 による保護は腸内細菌叢と関連している |
| 3.3.腸内微生物組成のαおよびβ多様性 |
| 3.4.Lactiplantibacillus plantarum 0111 は H9N2 感染後に腸内細菌叢を再構築します |
| 3.5.ランドマーク共生種の LEfSe 分析 |
| 3.6.Lactiplantibacillus plantarum 0111 は IFN-β および ISGs の発現を増加させます |
| 3.7.Lactiplantibacillus plantarum 0111 は T 細胞と B 細胞の反応を調節します |
| 3.8.相関分析 |
| 4.考察 |
| 本文 |
| 1.はじめに |
| 鳥インフルエンザウイルスは、病気の重症度に応じて、低病原性ウイルスと高病原性ウイルス(LPAI と HPAI)に分けられます。H9N2 サブタイプなどの一部の低病原性ウイルスは、鳥、哺乳類、およびヒトの間で伝染することができ、通常は養殖業界に経済的損失をもたらし、ヒトの健康に深刻な脅威をもたらします(Peiris etal,.1999;Zhang et al.,2013,2020)。1998 年、H9N2 サブタイプインフルエンザウイルスによるヒトの感染が中国南部で初めて発見され(Guo et al.,1999 )、その後、ヒトの H9N2 感染の症例報告が増加し(Song and Qin,2020)、このウイルスの感染による死亡例さえありました(Peacock et.,2019 )。ウイルスは、公衆衛生に重大な脅威をもたらすH7N9などの高病原性インフルエンザウイルスの内部遺伝子の一部またはすべてに対する重いリガンドを提供しながら、ヒトに直接感染します(Pu et al., 2015)。H9N2は呼吸器細胞と胃腸細胞で複製することができ、病理学的損傷を介して免疫抑制が宿主に損傷を引き起こします(Yao et al., 2014; Zhang et al., 2014; Li et al., 2016; Zhu et al., 2018)。AIV(訳者注:高病原性鳥インフルエンザ)に対するワクチン接種は通常、実用的な予防アプローチですが、ウイルスの変異が急速に発生するため、ウイルスの侵入を完全に抵抗するには不十分です(Ujike et al., 2010)。したがって、新興の異種インフルエンザウイルスに対処するための新しい治療法の研究と開発が不可欠です。 |
| 世界保健機関は、プロバイオティクスを、適切な量を投与すると宿主に健康上の利益をもたらす生きた微生物と定義しています。さらに、プロバイオティクスは、腸管内の微生物のバランスを調整し、腸上皮細胞のバリア機能を強化し、病原性微生物の増殖と付着を阻害し、免疫調節効果を調整することで、宿主動物の健康と成長を効果的に促進することができます (Bubnov et al., 2015; Hu et al., 2017; Cao et al., 2020)。乳酸菌は最も一般的なプロバイオティクスであり、広く使用されており、人間と動物にとって安全であると考えられています (Slattery et al., 2019)。それらが生成する有機酸やバクテリオシンなどの代謝物は、宿主に有益な効果をもたらします (Yousefi et al., 2019)。さらに、乳酸菌は腸粘膜の免疫系を刺激および調節し、病原体やウイルス感染から生物を保護します (Surendran Nair et al., 2017)。以前の研究では、Lactobacillus pentosusの経口投与により IgA 産生が増加し、マウスを致命的なインフルエンザウイルス感染から保護することが示されました (Kobayashi et al., 2011)。同時に、プロバイオティクスには副作用もあります。プロバイオティクスの摂取は、プロバイオティクスを含む粉ミルクを摂取している成人および乳児の D-乳酸アシドーシスおよびアシドーシスと関連しており、D-乳酸アシドーシスは脳のぼんやり感の原因です (Papagaroufalis et al., 2014; Rao et al., 2018)。 |
| 腸内微生物叢の機能には、栄養効果、代謝効果、免疫刺激などがある (Sánchez et al., 2017)。H9N2 型鳥インフルエンザウイルス感染は宿主の腸内微生物叢の乱れを引き起こすことがわかっている (Li et al., 2018)。腸内微生物叢の不均衡が生じると、正常な腸内微生物叢の生理学的役割を効果的に果たせなくなり、体の免疫機能が損なわれ、インフルエンザウイルスの排除能力が低下します (Pang et al., 2018)。同時に、経口プロバイオティクスは、相互に有益な共生腸内微生物生態学的バランスシステムの確立に役立ちます (Hu et al., 2017)。したがって、インフルエンザウイルスによって引き起こされる腸内細菌叢の調節異常を調節するためにプロバイオティクスを研究することが重要です。 |
| 天然株である Lactiplantibacillus plantarum 0111 は、マウスの腸から選別され、高い免疫活性と接着性を示しました。本研究では、L. plantarum 0111 の経口投与により、感染したマウスの生存率が向上し、体重減少が減少しました。さらに、L. plantarum 0111 は腸内細菌叢と免疫系を調節するため、インフルエンザウイルス感染を予防する候補株となる可能性があります。 |
| 2.材料と方法 |
| 2.1細菌、細胞、ウイルス、動物 |
| Lactiplantibacillus plantarum 0111 は、山東宝来利来生物工学株式会社から提供されたものであり、NCBI アクセッション番号: MT907445、MRS 培地を使用しています。37°C で 16 時間嫌気培養した後、細菌を 4°C で 4000g で 10 分間遠心分離し、滅菌リン酸緩衝生理食塩水 (PBS、pH = 7.4) で 3 回洗浄し、その後の用途のために 滅菌リン酸緩衝生理食塩水に再懸濁しました。この実験では、マディン・ダービー犬腎臓(MDCK細胞株)細胞を保存し、DMEM(訳者注:ダルベッコ改変イーグル培地)、FBS(訳者注:FBS(ウシ胎仔血清)は、細胞培養の増殖培地にサプリメントとして添加される血清で、細胞の増殖や成長をサポートする効果があります)、10,000 U/mlペニシリン、10,000 μg/mlストレプトマイシンとともに37°C、5% CO2で培養しました。細胞の生存率を確保するため、細胞は使用前に回収し、3世代以上継代しました。 |
| H9N2は当研究室で保存されていた(Shi et al., 2014)。インフルエンザウイルスの力価レベルとして、組織培養感染量(TCID50)の中央値を使用した。SPF(訳者注:SPFとはSpecific Pathogen Freeの略で「特定の病原体をもっていない」という意味の学術用語です)グレードの6週齢C57BL/6雌マウス(n = 90、各ケージに5匹)は、北京維河実験動物技術有限公司から購入した。これらのマウスは、SPF動物飼育センターで水と餌を自由に摂取できた。すべての動物実験は、吉林農業大学113動物管理および倫理委員会の要件(JLAU20200704001)を満たしていた。 |
| 2.2.実験設計とサンプル収集 |
| Lactiplantibacillus plantarum 0111 (108) を 200µl の量で 7 日間連続して経口投与し、対照群には滅菌リン酸緩衝生理食塩水を経口投与した。実験群は 0 日目に H9N2 (106.5 EID50) で感染させた。マウスはペントバルビタールナトリウムの腹腔内注射で麻酔し、H9N2 は点鼻薬で感染させた (Yang et al., 2018)。すべてのマウスは 14 日間毎日モニタリングされ、体重と生存率が記録された。糞便サンプルは 7 日目に収集され、全 DNA 抽出と配列決定のために直ちに -80°C で保存された。別の繰り返し実験では、L. plantarum 0111 を 7 日間経口投与した後、マウスから血清と気管支肺胞洗浄液 (BALF) を採取して I 型インターフェロンを検出し、マウスの肺と小腸を採取して qPCR 分析を行いました。脾臓、パイエル板、MLN(訳者注: 腸間膜リンパ節)のフローサイトメトリー分析用に単一細胞懸濁液を調製しました (Jiang et al., 2017; Yang et al., 2018)。感染後 7 日目にマウスの肺と小腸を採取し、4% ホルムアルデヒドで固定して組織病理学的分析を行いました。肺組織と 気管支肺胞洗浄液を調製して、ウイルス力価と炎症性サイトカインを検出しました。 気管支肺胞洗浄液を1 ml滅菌注射器で気管に挿入して固定し、800 μlの冷滅菌リン酸緩衝生理食塩水を注入し、15回繰り返し吸引し、1.5 EPチューブに移し、2,000 rpmで10分間遠心分離し、上清を-80°Cで凍結した。 |
| 2.3.抗生物質治療と糞便移植(FMT) |
| マウスの腸内微生物バックグラウンドを可能な限り排除するために、アンピシリン(1 mg/ml)、ストレプトマイシン(5 mg/ml)、バンコマイシン(0.25 mg/ml)、マイコマイシン(1 mg/ml、Solarbio)をマウスの滅菌飲料水に6日間添加し、その後糞便移植(FMT)を行った。滅菌リン酸緩衝生理食塩水 + H9N2およびL. plantarum 0111 + H9N2グループのマウス糞便は7日目に収集され、以前に説明したように処理された(Yang et al.、2021)。簡単に説明すると、糞便サンプルを滅菌N2インキュベーターに入れ、十分に混合した後、セルフィルターに差し込んで細菌を収集し、12,000 rpmで10分間遠心分離した。その後、サンプルを10%グリセロールに加え、-80°Cで保存した。グリセロールを滅菌リン酸緩衝生理食塩水に置き換える前の糞便移植をメチレンブルー染色で染色し、生存微生物の数を数えました。マウスには100μlの容量で経口投与しました(n = 5)。1日後、すべてのマウスにH9N2(106.5 EID50)を鼻腔内投与し、感染後14日間の生存と体重減少をモニタリングしました。糞便移植実験は独立して2回繰り返しました。 |
| 2.4.Illumina シーケンシング |
| V3-V4 超可変領域の 16S rRNA シーケンシング ライブラリは、当研究室の以前の研究 (Chen et al., 2020) に従って構築されました。具体的な方法については、S 方法を参照してください。プライマー シーケンスは次のとおりです。フォワード プライマー 5′-GTACTCCTACGGGAGGCAGCA-3′、リバース プライマー 5′-GTGGACTACHVGGGTWTCTAAT-3′。このシーケンスは、NCBI (SRP301018) に記録されています。生データ シーケンシングでは、最初にバーコードとプライマー シーケンスを削除し、次にそれらをスプライシングして生のタグを取得しました。生のタグを使用して、キメラと短いシーケンスを削除し、クリーンなタグを取得しました。シーケンスは分類操作 (クラスター) にかけられました。シーケンスは、分類操作による類似性に応じて多くの OTU に分類されました。シーケンスは通常、97% の類似性レベルで OTU に分割され、その後、OTU のバイオインフォマティクス統計分析が行われます。最後に、α多様性、β多様性、およびスクリーニングされたさまざまな種が、OTUおよび分類上の順位に従って分析されました。(訳者注:lluminaは、カリフォルニア州サンディエゴに本社を置くアメリカのバイオテクノロジー企業です。1998年4月1日に設立され、遺伝子変異と生物学的機能の分析のための統合システムの開発、製造、販売を行っています。同社は、シーケンシング、遺伝子型判定、遺伝子発現、プロテオミクス市場向けの製品とサービスを提供しており、155か国以上にサービスを提供しています)。 |
| 2.5.フローサイトメトリー分析 |
| L. plantarum 0111 によって誘導される細胞性免疫応答を決定するために、0 日目にマウスを安楽死させ、その後脾臓、パイエル板、腸間膜リンパ節を採取し、単一細胞懸濁液を調製しました。PerCP-Cy5.5 標識抗マウス CD3 抗体、PE-Cy7 標識抗 CD4 抗体、APC-Cy7 標識抗 CD8 PE 標識抗 IFN-γ 抗体、APC 標識抗 IL-4 抗体、FITC 標識抗 TNF 抗体、APC 標識抗 B220 抗体、および FITC 標識抗 IgA 抗体を使用して、FACS(訳者注: FACS(Fluorescence activated cell sorter)とは、細胞を1つずつ定量測定して、細胞の特性に基づいて分取する技術です。フローサイトメトリーの特殊なタイプで、細胞の特性を解析して、細胞を物理的に別々の容器に分けることができます)分析を実施しました。すべての抗体は、米国の Becton, Dickinson, and Company から購入しました。実験は 3 回実施し、データ補正と分析は FlowJo v7.6.1 を使用して実施しました。並行して、製造元の指示に従って MU 抗ウイルス応答パネル (13 プレックス、LEGENDplexTM、740,622) を使用して、0 日目の血清および 気管支肺胞洗浄液中の IFN-α および IFN-β 発現、および 7 日目の肺上清および 気管支肺胞洗浄液中の IL-6 および TNF-α 発現を分析し、LEGENDplex v8.0 を使用してデータ解析を実施しました。 |
| 2.6.ウイルス力価検出 |
| ウイルス力価を決定するために、等量の肺組織を DMEM (ダルベッコ改変イーグル培地)でホモジェナイズし、組織ホモジェネートの段階希釈 10 倍懸濁液を得ました。さらに、MDCK細胞(訳者注:イヌの正常腎臓尿細管上皮細胞に由来する細胞株。培養すると単層に細胞が密着しタイトジャンクションを形成し極性を示す上皮層が形成され、物質の輸送や薬物の膜透過性の研究に用いられる)の 96 ウェル培養プレートで滴定しました。力価の計算にはリード ミュンヒ法を採用し、肺組織 1 g あたりの log10TCID50 として表しました。 |
| 2.7.定量PCR |
| メーカーの指示に従い、Universal RNA抽出キット(Takara)を使用してマウスの腸と肺から全RNAを抽出しました。逆転写は、TransScript® One-Step gDNA除去およびcDNA合成スーパーミックス(TRANSGEN China)を使用して実施しました。その後、PerfectStart™ Green qPCR SuperMix(TRANSGEN China)を使用して、Applied Biosystems 7,500(Life Technologies、USA)でトリプルqPCRを実施しました。熱サイクル条件は、94°Cで30秒間、続いて95°Cで5秒間、その後60°Cで30秒間の40サイクルでした。データは、Applied Biosystems 7,500(Life Technologies、USA)を使用して収集し、7,500ソフトウェアv2.3を使用して閾値サイクル(ΔΔCT)法で分析しました。 qPCR プライマーは、クロスイントロン設計によるゲノムの汚染を回避し、ゲノム DNA の増幅を阻害するように設計されています。プライマーは補足表 S1.2 に示されています。(訳者注:定量PCR(quantitative PCR)は、qPCRやリアルタイムPCRとも言われ、決められたサイクル数までの一連のPCRにより発生した蛍光物質を測定する手法です)。 |
| 2.8.組織学的分析 |
| マウスの肺組織と小腸を 4% ホルムアルデヒドで固定し、パラフィンに包埋しました。組織を脱水し、段階的アルコールで染色した後、切片にしました。各サンプルから少なくとも 2 つの組織切片 (3 μm) をヘマトキシリン・エオシン (HE) で染色し、最終的に当研究所の倒立蛍光顕微鏡 (Leica Microsystems、Germany) を使用して分析しました。 |
| 2.9.統計分析 |
| すべてのデータは平均±SEMとして表されました。統計分析は、GraphPad Prism 8.0(GraphPad Software)を使用して一元配置分散分析とt検定を使用して実施されました。p値は次のように示されます:*p < 0.05、**p < 0.01、および***p < 0.001。 |
| 3.結果 |
| 3.1.Lactiplantibacillus plantarum 0111 の保護効果 |
| 最適投与量は 108 CFU と決定しました (補足図 S1B、E)。その後、マウスに H9N2 亜型鳥インフルエンザウイルスを投与し、14 日間にわたって健康状態を調べました。ウイルス投与後、マウスは通常、感染後 5 日目から 8 日目の間に死亡しました (図 1B)。L. plantarum 0111 + H9N2 グループは、滅菌リン酸緩衝生理食塩水+ H9N2 グループよりも H9N2 の攻撃に対して 40% 高い保護効果を示しました (p < 0.05)。体重に関しては、対照群を除き、他のグループのマウスの体重は投与後徐々に減少し、7 日目までに L. plantarum 0111 + H9N2 グループは徐々に体重が回復する傾向を示し、14 日目までに 80% を超えました (図 1A)。対照的に、滅菌リン酸緩衝生理食塩水 + H9N2群は7日目まで減少し続けました。したがって、L. plantarum 0111の前処理により、マウスの生存率と体重減少が改善されました。 |
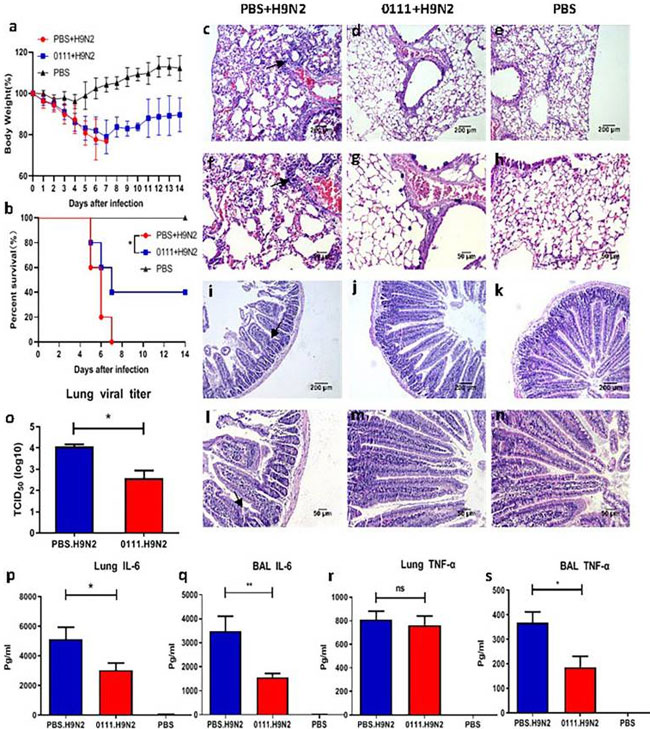 |
| 図1 C57BL/6マウスをLactiplantibacillus plantarum 0111で前処理すると、体重減少が減り、生存率が向上し、肺と小腸の組織損傷が減少し、H9N2インフルエンザウイルス感染による肺のウイルス量と炎症性サイトカインが減少しました。 C57BL/6マウス(n = 5 /グループ)は、H9N2ウイルス(2 x LD50)を持続経口投与してから7日後にL. plantarum 0111(1 x 108 CFU / 200グリマウス)に感染しました。マウスの体重(A)と生存率(B)は、感染後14日以内に記録されます。感染後5日目に、一部のマウスを安楽死させ、肺と小腸を採取して組織学的に分析しました。肺ウイルスと炎症性サイトカインは、肺と気管支肺胞洗浄液(BALF)で測定されました。 (C、D、E、I、J、K) 100倍の拡大。スケールバーは200 μmを示す。 (F、G、H、L、M、N) 200倍の拡大。スケールバーは50 μmを示す。 (C、F) 滅菌リン酸緩衝生理食塩水前処理後にH9N2でチャレンジしたマウスの肺。(D、G) L. plantarum 0111で前処理した後にH9N2でチャレンジしたマウスの肺。(E、H) 滅菌リン酸緩衝生理食塩水のみでチャレンジしたマウスの肺。(I、L) 滅菌リン酸緩衝生理食塩水前処理後にH9N2でチャレンジしたマウス小腸。(J、M) L. plantarum 0111で前処理した後にH9N2でチャレンジしたマウス小腸。(K、N) 滅菌リン酸緩衝生理食塩水のみで処理したマウス小腸。(O) 肺ウイルスlog10TCID50/g肺組織。(P) 肺中のIL-6 (pg/ml)。 (R) 肺中のTNF-α (pg/ml)。(Q) 気管支肺胞洗浄液中のIL-6 (pg/ml)。(S) 気管支肺胞洗浄液中のTNF-α (pg/ml)。結果は平均±SEM (N = 5)として示され、統計的有意性は一元配置分散分析によって計算されました。*P < 0.05; **P < 0.01。 |
| 各グループのマウスの肺と小腸の組織学的分析により、H9N2インフルエンザウイルスが肺と小腸に損傷を引き起こしたことが示された。滅菌リン酸緩衝生理食塩水+ H9N2グループのマウスでは泡状の滲出液と損傷した肺胞構造が観察された(図1C、F)。L. plantarum 0111+ H9N2グループでは肺胞構造は無傷で、肺損傷は見られなかった(図1D、G)。一方、滅菌リン酸緩衝生理食塩水+ H9N2グループのマウスの小腸壁(図1I、L)は、滅菌リン酸緩衝生理食塩水グループと比較して肥厚し、腸絨毛が脱落し、粘膜固有層の炎症細胞が浸潤していた(図1K、N)。しかし、L. plantarum 0111 + H9N2グループでは損傷状態は見られなかった(図1J、M)。したがって、L. plantarum 0111 の前処理により、H9N2 によって引き起こされる肺および小腸の損傷を軽減できる可能性があります。 |
| H9N2感染5日後、マウスを安楽死させて肺ホモゲネートを調製し、上清をMDCK細胞に接種してTCID50を測定した(図1O)。ウイルス感染後、L. plantarum 0111 + H9N2群のマウスのウイルス量は、模擬治療マウスよりも約1.6倍低かった(p < 0.05)。一方、インフルエンザ感染中は炎症性サイトカインが過剰に産生され、炎症性サイトカインストームにより重篤な肺障害を引き起こす可能性がある。そのため、肺および気管支肺胞洗浄液中のIL-6およびTNF-α炎症性サイトカインの測定は、H9N2による肺障害のメカニズムを理解するのに役立つ可能性がある。感染後5日目に、肺(p < 0.05)および気管支肺胞洗浄液(p < 0.01)で検出されたIL-6のレベルは、滅菌リン酸緩衝生理食塩水 + H9N2群よりも有意に低かった(図1P、Q)。さらに、気管支肺胞洗浄液中のTNF-αのレベル(p < 0.05)も滅菌リン酸緩衝生理食塩水+ H9N2群よりも有意に低かったが、肺では差は見られなかった(図1R、S)。L. plantarum 0111は、H9N2感染によって誘発される炎症性サイトカインの産生を減少させた。 |
| 3.2.Lactiplantibacillus plantarum 0111 による保護は腸内細菌叢と関連している |
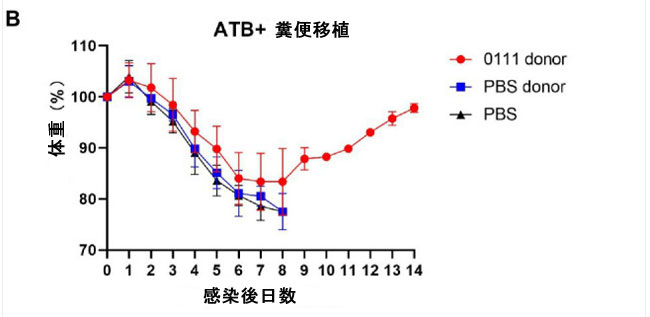
| Lactiplantibacillus plantarum は主に腸管に定着し、プロバイオティクス効果を発揮します。L. plantarum 0111 の保護効果が腸内微生物と関連しているかどうかを検証するために、マウスで 糞便移植(FMT)を実施しました (図 2A)。その結果、L. plantarum 0111 + H9N2 グループで治療したマウスは生存率と体重減少が改善されたのに対し、滅菌リン酸緩衝生理食塩水+ H9N2 グループで治療したマウスは対照群と同じ感受性を示しました (図 2B、C)。これは、腸内細菌叢を介した L. plantarum 0111 の保護効果を実証しています。 |
 |
 |
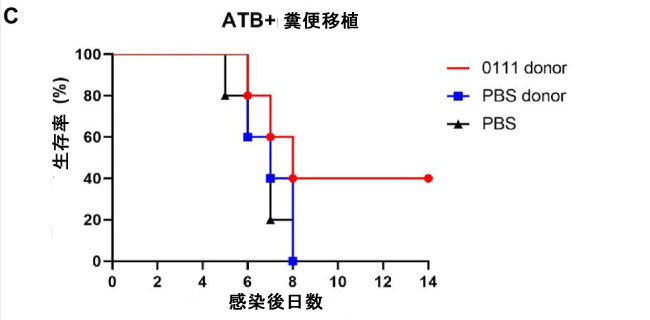 |
| 図2 糞便移植(FMT)実験。 H9N2 感染後 7 日目にマウスの糞便を採取し、抗生物質治療の 6 日後に 糞便移植を実施した (A)。マウス (N = 10/グループ) は 0 日目に感染を検査し、その後 14 日間感染の有無を観察した。糞便移植を受けたマウスの体重 (B)。糞便移植 を受けたマウスの生存率 (C)。 |
| 3.3.腸内微生物組成のαおよびβ多様性 |
| 16S rRNA遺伝子の配列解析に基づき、グッドカバレッジ指数が98%を超える15のサンプルから合計2,894のOUT(訳者注:OTUとは、細菌の特定の塩基配列をコンピュータ上でその類似度を指標に分類したときに得られる単位)が得られ、すべてのサンプルのグッドカバレッジ(補足図S3A)、希薄化曲線(補足図S3B)、シャノン・ウィーナー指数(補足図S3C)、および種の蓄積(補足図S3D)曲線は、十分なデータサンプリングと配列深度を示しました。16S rRNA遺伝子配列のデータベースは、ほぼすべての微生物群をカバーしていました。 |
| α多様性は、Chao1、観察された種、およびShannon指数を使用して評価されました。結果は、H9N2感染は滅菌リン酸緩衝生理食塩水グループと比較して実際に観察されたOTUの数を有意に増加させたが(p < 0.05)、経口L. plantarum 0111グループではOTUの数が乱れなかったことを示した(図3B)。さらに、Chao1およびShannon指数に有意差はなかったものの、滅菌リン酸緩衝生理食塩水グループと比較して上昇傾向が見られたのに対し、L. plantarum 0111グループは安定する傾向があった(図3A、C)。一方、NMDS(非計量多次元尺度法)を使用して、異なるグループのサンプルのβ多様性を分析したところ、α多様性と驚くほど一致して、H9N2感染は滅菌リン酸緩衝生理食塩水グループと比較して生物学的集団に有意な差を引き起こしたが、L. plantarum 0111グループでは有意差は観察されなかった(図3D)。したがって、L. plantarum 0111 を経口投与すると、H9N2 感染によって引き起こされる腸の不均衡を効果的に維持することができます。 |
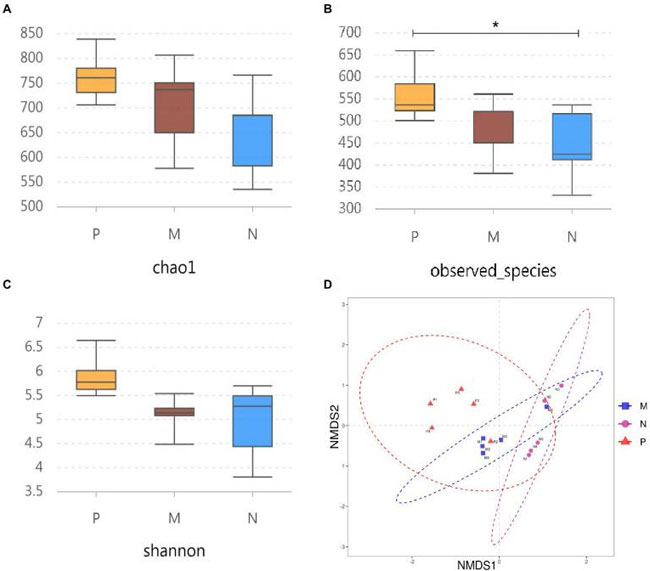 |
| 図3 3つの実験群のα多様性とβ多様性は、16S rRNA遺伝子の配列決定によって分析されました。 Chaol (A) と観察された種の数 (B) は、存在量の推定値として使用されました。シャノン-ウィーナー指数 (C) は、多様性の推定値として使用されました。(D) NMDS は、異なるサンプル間の差異の程度を分析して β 多様性を評価するために採用されました。結果は、t 検定 (N = 5/グループ) を使用して統計的有意性を計算しました。*P < 0.05。P、滅菌リン酸緩衝生理食塩水で前処理した後の攻撃された H9N2 細胞。M、L. plantarum 0111 で前処理した後の攻撃された H9N2 細胞。N、滅菌リン酸緩衝生理食塩水で前処理。 |
| 3.4.Lactiplantibacillus plantarum 0111 は H9N2 感染後に腸内細菌叢を再構築します |
| H9N2 に感染したマウスの腸内微生物組成に対する L. plantarum 0111 の影響を調べるために、細菌を門 (図 4A) および属 (図 4B) レベルで分析し、微生物分類分布の動態を特徴付けました。門レベルでは、Proteobacteria, Actinobacteria, Verrucomicrobia, Firmicytes, および Bacteroidetes が腸内微生物群集で優勢です。Proteobacteria, Actinobacteria, Firmicytes, と Bacteroidetesは、グループ N でそれぞれ 1.44、1.29、53.31、43.62% を占めました。同時に、P群ではActinobacteriは出現せず、ActinobacteriとBacteroidetesはそれぞれ3.672%と53.02%に増加しました。Firmicytesの割合は40.717%に減少しました。M群ではActinobacteria, Verrucomicrobia, とBacteroidetes はそれぞれ3.73%、1.75%、49.32%で増加せず、Firmicytesは44.08%に減少しました。 |
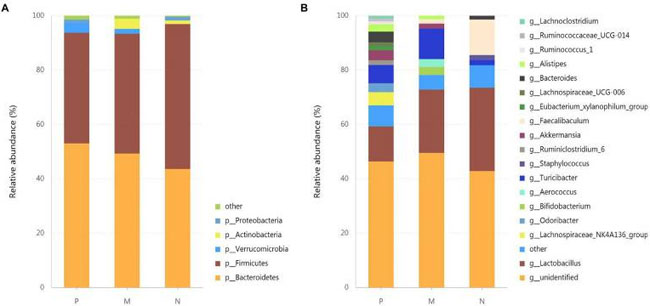 |
| 図4 H9N2 に感染したマウスの腸内微生物組成に対する L. plantarum 0111 の影響。 門 (A) および属 (B) レベルでの腸内微生物群の相対的存在量。ここで示す腸内細菌の相対的存在量は、各グループで 5 回繰り返して得られたデータを平均して計算しました。P、滅菌リン酸緩衝生理食塩水で前処理した後の感染 H9N2 細胞。M、L. plantarum 0111 で前処理した後の感染 H9N2 細胞。N、滅菌リン酸緩衝生理食塩水で前処理。 |
| Lactobacillus と Faecalibaculum は腸の恒常性を維持する重要な常在微生物叢であり、N 群の属レベルではそれぞれ Lactobacillus と Faecalibaculum の 30.66% と 13.05% を占めていました。しかし、Faecalibaculum は観察されず、P 群では Lactobacillus はわずか 12.92% を占めていました。一方、M 群では Lactobacillus と Faecalibaculum がそれぞれ 23.28% と 1.64% を占めていました。興味深いことに、Lachnoclostridium、Ruminococcaceae-UCG-014、Ruminococcus-1、Lachnospiraceae-UCG-006、Eubacterium-xylanophilum-group、Ruminiclostridium-6、Odoribacter、およびLachnospiraceae-NK4A136-groupはグループPにのみ出現しました。 |
| 3.5.ランドマーク共生種のLEfSe 分析 |
| L. plantarum 0111 が H9N2 に感染したマウスの腸内細菌叢に与える影響を完全に理解するために、LEfSe (LDA 効果サイズ) 分析を実施しました。LEfSe 分岐図 (補足図 S4) と LDA スコア (図 5A) を使用して、腸内細菌の変化を評価しました。 LEfSe分析では、Faecalibaculum(図5B)はN群と比較してP群で有意に減少し、M群では増加する傾向にあることが示されました。比較すると、Akkermansia(図5C)とAlistipes(図5D)はP群で有意に増加しました。それでも、M群ではそれに応じて減少しました。同時に、Lachnospiraceae-NK4A136-groupはN群と比較してP群で有意に増加し(図5E)、M群では正常レベルを示しました。したがって、L. plantarum 0111は、共生微生物と相互作用することで、H9N2感染後の腸の恒常性を維持できます。 (訳者注:LEfSe(Linear discriminant analysis effect size)は Curtis Huttenhowerらによって開発されたメタゲノムバイオマーカーを発見するためのツールです。 複数条件下の微生物群集データを対象に、集団の違いを説明できる特徴量(生物種、系統、OTU、遺伝子、機能など)を統計学的に抽出することができ、ある現象を引き起こす原因菌などを探索することにも用いられます)。 |
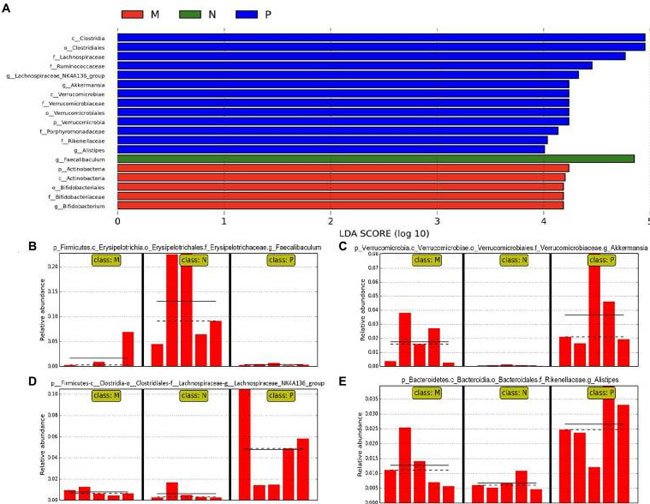 |
| 図5 Lactiplantibacillus plantarum 0111 は、腸内バランスを維持するために Faecalibaculum の存在量を増加させました。腸内微生物の変化を評価するために、LEfSe 分析を実施しました。(A) 異なるグループの腸内微生物叢の LEfSe 分析で得られた LDA スコア。3 を超える LDA 効果サイズが、LEfSe 分析のしきい値として使用されました。(B) Faecalibaculum、(C) Akkermansia、(D) Lachnospiraceae-NK4A136 グループ、および (E) 異なるグループでの Alistipes の存在量分析。P、滅菌リン酸緩衝生理食塩水で前処理した後の感染 H9N2 細胞。M、L. plantarum 0111 で前処理した後の感染 H9N2 細胞。N、滅菌リン酸緩衝生理食塩水で前処理。 |
| 3.6.Lactiplantibacillus plantarum 0111 は IFN-β および ISGs の発現を増加させます |
| 腸に由来する特定の微生物は、I 型インターフェロンの発現を増加させることでウイルス感染に抵抗できることが示されています (Yang et al., 2021)。I 型インターフェロンは感染段階で重要な役割を果たし、抗ウイルス能力の評価に重要です。L. plantarum 0111 を 7 日間連続経口投与した後、マウスの血清および気管支肺胞洗浄液中の IFN-α および IFN-β の発現レベルを測定しました。結果は、L. plantarum 0111 の経口投与により、血清および 気管支肺胞洗浄液中の IFN-β の発現レベルが向上する可能性があることを示しました (p < 0.05、図 6C、D)。特に、IFN-α の発現レベルは、血清または気管支肺胞洗浄液のいずれにおいても有意差がありませんでした (図 6A、B)。したがって、L. plantarum 0111 による前処理は IFN-β の誘導を増強したが、IFN-α の誘導は増強しなかった。 |
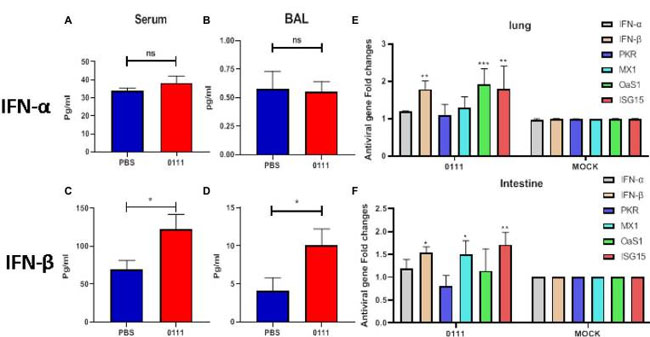 |
| 図6 C57BL/6マウスをL. plantarum 0111で前処理すると、血清および気管支肺胞洗浄液(BALF)中のI型インターフェロンの発現が増加し、腸および肺中のIFN-βおよびISG(訳者注:ISGs;インターフェロン誘導遺伝子群)の転写レベルが増加しました。C57BL/6マウス(n = 5/群)をL. plantarum 0111(1×108 CFU/200 μl/マウス)の持続経口投与7日後に安楽死させ、血清および気管支肺胞洗浄液(BALF)中のIFN-αおよびIFN-βの発現を測定した。(A)血清中のIFN-α(pg/ml)。(B)気管支肺胞洗浄液中のIFN-α(pg/ml)。(C)血清中のIFN-β(pg/ml)。(D)気管支肺胞洗浄液中のIFN-β(pg/ml)。異なるマウス群で異なる処理をした腸と肺に対して Q-PCR を実施しました。IFN-α、IFN-β、PKR、MX1、OaS1、および ISG15 の転写レベルを測定しました。(E) マウス腸における IFN-α、IFN-β、PKR、MX1、OaS1、および ISG15 の転写レベル。(F) マウス肺における IFN-α、IFN-β、PKR、MX1、OaS1、および ISG15 の転写レベル。PBS: 滅菌リン酸緩衝生理食塩水前処理したマウスを使用しました。0111: L. plantarum 0111 で前処理したマウス。MOCK: テンプレート cDNA を加えなかったコントロール群。結果は平均値 ± SEM (N = 3) として示し、統計的有意性は t 検定で計算しました。*P < 0.05; **P < 0.01; ***P < 0.001。 |
| 宿主がウイルス感染を抑制する能力は、主に初期の抗ウイルス自然免疫応答の有効性に依存し、これがIFN、続いてISGの上方制御につながります。PKR、MX1、OaS1、およびISG15は、IFN刺激によって生成される主要な抗ウイルスタンパク質です(Lenschow et al.、2007; Schoggins、2019)。次に、L. plantarum 0111の前処理後のI型インターフェロンとISGの発現をテストしました。マウスの腸と肺におけるIFN-α、IFN-β、および4つのISGの相対mRNAレベルを定量PCRで測定しました。腸を調べた結果、MX1(p < 0.05)とISG15(p < 0.01)の転写レベルが対照群と比較して約1.6倍増加していることが示されました。同時に、IFN-βの転写レベルも上昇しました(p < 0.05、図6F)。特に、IFN-α、PKR、およびOaS1の転写レベルは有意に上昇しませんでした。肺を検出した結果、IFN-βの発現は対照群と比較して1.8倍増加し、腸ではISG15の発現レベルも有意に増加しました(p < 0.01)。腸とは異なり、OaS1の発現レベルは対照群と比較して肺で有意に増加しました(p < 0.001)。同時に、IFN-α、PKR、およびMX1の発現は肺で上昇しませんでした(図6E)。 |
| 3.7.Lactiplantibacillus plantarum 0111 は T 細胞と B 細胞の反応を調節します |
| フローサイトメトリーにより、腸間膜リンパ節と脾臓における T 細胞の活性化と分極が検出されました (補足図 S2)。L. plantarum 0111群では、滅菌リン酸緩衝生理食塩水群と比較して、腸間膜リンパ節 における CD3+ CD4+ IFN-γ+ T 細胞 (図 7D、p < 0.01) と CD3+ CD8+ IFN-γ+ T 細胞 (図 7F、p < 0.05) の割合が有意に増加しましたが、脾臓では同様の傾向は見られませんでした (図 7E、G)。一方、L. plantarum 0111群では、腸間膜リンパ節(p < 0.05) と脾臓 (p < 0.01、図 7H、I) の両方で CD3+ CD4+ IL-4+ T 細胞の割合が増加しました。さらに、L. plantarum 0111群では、滅菌リン酸緩衝生理食塩水群と比較して、脾臓中のCD3+CD4+TNF-α+ T細胞(図7K、p < 0.01)およびCD3+CD8+ TNF-α+ T細胞(図7M、p < 0.01)の割合が有意に増加しましたが、腸間膜リンパ節では差は認められませんでした(図7J、L)。パイエル板中のB220+ IgA+ B細胞の数を調べたところ、B220+ IgA+ B細胞の数(p < 0.01)が有意に増加しました(図7A~C)。これは、L. plantarum 0111がT細胞内のサイトカインに調節効果を持ち、腸間膜リンパ節および脾臓のB細胞内のIgA発現を増加させたことを示しています。 |
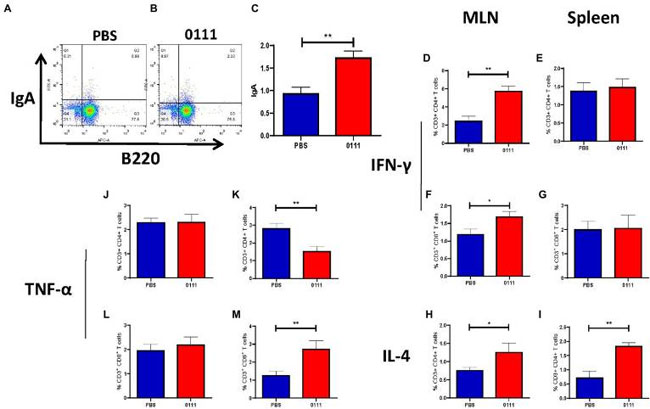 |
| 図7 L. plantarum 0111は適応免疫を調節する。C57BL/6マウス(n = 5/群)をL. plantarum 0111(1×108 CFU/200 μl/マウス)の持続経口投与により安楽死させ、記載のとおり単一細胞を調製し、示されたゲーティング方法(A)を使用してフローサイトメトリー分析を実施した。免疫マウスの腸間膜リンパ節中のCD4 + IFN-γ + T細胞(D)、CD8 + IFN-γ + T細胞(F)、CD4 + 1L-4 + T細胞(H)、CD4 + TNF-α + T細胞(J)、およびCD8 + TNF-α + T細胞(L)と、脾臓中のCD4 + IFN-γ + T細胞(E)、CD8 + IFN-γ + T細胞(G)、およびCD4 + 1L-4 + T細胞(I)を計算した。 CD4+ TNF-α+ T細胞(K)とCD8+ TNF-α+ T細胞(M)の割合。滅菌リン酸緩衝生理食塩水グループ(A)とL. plantarum 0111グループ(B)のパイエル板におけるB220+ IgA+ B細胞の数と統計分析(C)。結果はt検定を使用して統計的有意性を計算しました。*P < 0.05; **P < 0.01。 |
| 3.8.相関分析 |
| ピアソン相関の結果を図 8A に示します。I 型インターフェロンの発現レベルでは、P 群の Ruminococcus-1、Lachnospiraceae-NK4A136-group、Aerococcus は血清 IFN-β 発現と有意に正の相関を示し、血清 IFN-α 発現と負の相関を示しました。一方、Turicibacter も血清 IFN-β と負の相関を示しました。Ruminiclostridium-6、Ruminococcus-1、Eubacterium-xylanophilum-group は 気管支肺胞洗浄液中の IFN-α 発現と有意に負の相関を示しました。Akkermansia は M 群の血清および 気管支肺胞洗浄液中の IFN-β と負の相関を示しました。対照的に、Bifidobacterium は血清および 気管支肺胞洗浄液 中の IFN-β と正の相関を示しました。 P 群の Faecalibaculum および Lachnoclostridium は、転写レベルで腸管 IFN-β 転写レベルと正の相関を示しましたが、Alistipes は負の相関を示しました。特に、肺における Turicibacter と IFN-β 転写レベルの間には有意な正の相関が見られました。M 群では、Bacteroides および Odoribacter は腸管 IFN-α 転写レベルと正の相関を示しましたが、Ruminococcaceae UCG-014 は腸管および肺の IFN-α 転写レベルと有意に負の相関を示しました。さらに、Actinobacteria、Verrucomicrobia、Firmicytes、および Bacteroidetes について相関ネットワークをプロットし、4 つの主要な門に属するいくつかの重要なメンバー間の関係を示しました (図 8B~D)。 |
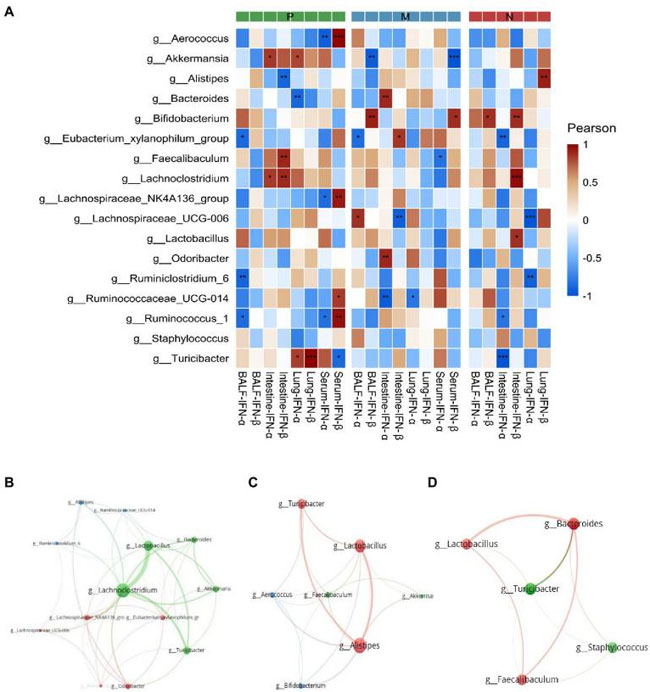 |
| 図8 相関図には、優勢な細菌属と I 型インターフェロンの転写および発現との間のピアソン相関 (A) と、P 群 (B)、M 群 (C)、および N 群 (D) における優勢な細菌属間の相関が示されています。P 値は、偽発見率を決定するために Bonferroni および Hochberg 手順に従って調整されました。アスタリスクは、細菌群と I 型インターフェロンの間に有意な相関があることを示します (*P < 0.05、**P < 0.01、***P < 0.001)。P、滅菌リン酸緩衝生理食塩水で前処理した後の攻撃を受けたH9N2 細胞。M、L. plantarum 0111 で前処理した後の攻撃を受けた H9N2 細胞。N、滅菌リン酸緩衝生理食塩水で前処理。 |
| 4.考察 |
| ここでは、L. plantarum 0111 の経口投与がマウスの H9N2 インフルエンザウイルス感染を予防および防御できることを実証します。また、L. plantarum 0111 の経口投与は腸内細菌のバランスを維持し、免疫反応を調節してインフルエンザウイルスによる攻撃を緩和できることも明らかにします。 |
| ウイルス感染は、ウイルスRNAの解読に宿主のトランスファーRNA(tRNA)に大きく依存しており、これがウイルス感染の成功の主な決定要因となっている(Ou et al., 2020)。腸内でのtRNAの使用を制御する要因は未解明のままであるが、微生物叢とウイルス叢がこれに影響を与える可能性があり、したがって推論により、L. plantarumも同様に影響を与える可能性がある(Zhang et al., 2021)。プロバイオティクスが自然免疫系と獲得免疫系の複数の側面を調節することにより免疫保護を提供するという証拠が増えている(Giorgetti et al., 2015)。腸肺系と粘膜免疫系におけるプロバイオティクスの潜在的な抗ウイルスメカニズムは、SARS-CoV-2感染の予防と支持治療に役割を果たす可能性がある(Sundararaman et al., 2020)。したがって、プロバイオティクスは免疫応答の活性化に関与し、呼吸器感染症の予防に積極的に関与している可能性がある。本研究では、L. plantarum を経口投与されたマウスは、体重減少と肺のウイルス量の減少、生存率の向上によって示されるように、致死的なインフルエンザウイルス感染に対する優れた防御力を示しました。したがって、新しいLactobacillus 株である L. plantarum 0111 は、抗インフルエンザウイルス活性を持つ可能性があります。 |
| 常在細菌の主な役割は、宿主の免疫、発達、生理機能を調節することで正常な恒常性を維持することです (Yitbarek et al., 2018)。リポ多糖、フラジェリン、ペプチドグリカン、ホルミルペプチド、独自の核酸構造などの細菌の微生物関連分子パターン (MAMP)、および腸内細菌由来の 短鎖脂肪酸、トリプトファン代謝物、ポリアミンは、腸の免疫系を調節することができます (Rooks and Garrett, 2016)。H9N2 型高病原性鳥インフルエンザ(AIV)感染は、腸内で細菌叢異常を引き起こす可能性があります (Li et al., 2018)。プロバイオティクスの補給により、プロバイオティクスが腸内で優位になり、腸の健康を維持できます (Sanders et al., 2019)。数学的分析により、腸内微生物群の多様性が腸管系の安定性に影響を与える可能性があることが予測されています (Coyte et al., 2015)。16S シーケンスの結果、この研究では H9N2 感染が腸内微生物構造を変化させたことが示されました。Lachnoclostridium、Ruminococcaceae-UCG-014、Ruminococcus-1、Lachnospiraceae-UCG-006、Eubacterium-xylanophilum-group、Ruminiclostridium-6、Odoribacter、および Lachnospiraceae-NK4A136-group は、H9N2 感染グループにのみ存在し、補充されたL. plantarumグループには存在しませんでした。Faecalibaculum は腸の健康に有益であり、抗腫瘍特性があることが示されています (Li et al., 2020; Zagato et al., 2020)。 L. plantarum 0111 の補給により、H9N2 感染によって引き起こされた Faecalibaculum と Lactobacillus の存在量の劇的な減少が回復し、腸内微生物のバランスが維持されました。Alistipesは大腸がんの病原性因子であり、Alistipesの存在量の調節不全は腸内微小環境に影響を及ぼすことが示されています (Parker et al., 2020)。この研究では、H9N2 感染によりAlistipesの存在量が上昇し、腸内 IFN-β の転写レベルと逆相関していました。特に、L. plantarum 0111 の補給によりAlistipesの存在量が大幅に減少しました。Akkermansiaの粘液層の常在細菌は、代謝、免疫反応、腸の健康保護を調節することができます (Zhai et al., 2019)。 Akkermansia は、ヒトとマウスの両方において最も重要なプロピオン酸生産菌であり、免疫の重要な修飾因子です (Al-Lahham et al., 2010; Su et al., 2021)。Akkermansia 関連のタンパク質濃縮は、TLR2 と TLR4 を活性化して特定のサイトカインの産生を誘導することにより、腸管バリアを制御します (Ottman et al., 2017)。したがって、L. plantarum 0111 は他のプロバイオティクスと相乗的に作用して免疫系を活性化する可能性があります。 |
| ウイルス感染の病因は、過剰な炎症反応と関連している (de Jong et al., 2006; Wang et al., 2010)。インフルエンザウイルス感染時には、多数の炎症細胞が肺に浸潤し、過剰な炎症性サイトカインを産生してサイトカインストームを形成し、重度の肺障害を引き起こすことが報告されている (Kobasa et al., 2007; Cillóniz et al., 2009)。致死的なインフルエンザ A (H1N1) に感染したマウスにBifidobacterium bifidumを投与した後、肺での IL-6 産生が著しく減少することが確認された (Iwabuchi et al., 2011)。 I 型インターフェロンは、ウイルス複製の拮抗、免疫系の監視、細胞変性効果の阻害において重要な役割を果たしており、外来病原体による感染から宿主を守る強力なツールとなっています (Fuertes et al., 2013; Rönnblom, 2016)。インフルエンザウイルスは体内に侵入すると、宿主の自然免疫応答を活性化して I 型インターフェロンの産生を誘導し、これが受容体 IFNAR1 および IFNAR2 に結合して下流のシグナル伝達経路を活性化し、それによって下流のインターフェロン誘導遺伝子(ISG) の転写と発現を活性化します (Pestka, 2007)。標準的な インターフェロン誘導遺伝子転写調節メカニズムに加えて、非標準的なインターフェロン誘導遺伝子転写調節も重要な役割を果たしています (Wang et al., 2017)。たとえば、細菌は転写のエピジェネティック調節因子を変更することでインターフェロン誘導遺伝子の転写に影響を与える可能性があります (Alphonse et al., 2021)。 インターフェロン誘導遺伝子の発現産物は、直接的に体内の抗ウイルス効果を促進し、さらにI型インターフェロンを誘導し、それによって間接的に体内の抗ウイルス効果を高めることができます(Schoggins,2014)。多くのISG、OAS1、Mx1、PKR、およびISG15は一般的なインターフェロン誘導遺伝子です(Schoggins,2019)。以前の研究では、プロバイオティクスがウイルス量を減らし、保護効果を発揮できることが示されています(Goto et al.,2013; Park et al.,2013)。Lactococcus lactis JCM5805とLactobacillus gasseri SBT2055は、肺での抗ウイルス因子の発現を増加させましたが、これは私たちの調査結果と同様です(Nakayama et al.,2014; Jounai et al.,2015)。本研究では、L. plantarum 0111 を前処理したマウスの肺と腸における IFN-β、OAS1、Mx1、および ISG15 の転写レベルがそれに応じて増加し、ウイルス感染後の肺ウイルス量が大幅に減少しました。したがって、プロバイオティクスの調節経路は自然免疫システムに依存しており、I 型インターフェロンと密接に関連している可能性があります。 |
| 病気の人では、腸内細菌が宿主の免疫系を調節する能力があることが実証されています (Perez-Lopez et al., 2016)。また、腸内細菌は、細菌自体またはその代謝物/産物を免疫細胞が認識することで制御性 T 細胞を調節し、粘膜免疫に大きな影響を与えます (Hall et al., 2008; Goto et al., 2016)。健康な新生児にプロバイオティクスを補給すると、IFN-γ の発現が大幅に強化され、プロバイオティクスが Th1 免疫応答の改善に重要な役割を果たすことが示されました。さらに、bifidobacteriaは、体液性免疫応答と細胞性免疫応答を調節し、インフルエンザ感染に対するバランスのとれた Th1/Th2 免疫応答を誘導する強力な可能性があることが示されました (Mahooti et al., 2019)。私たちの研究では、CD4+ T細胞によって産生されるIFN-γとIL-4の割合によって、Th細胞のTh1およびTh2サブタイプへの分化の方向を決定しました。結果は、L. plantarum 0111の処理後にTH細胞におけるIFN-γとIL-4の発現がさまざまな程度に増加したことを示しており、体液性免疫と細胞性免疫に対する潜在的な調節作用を示しています。IFN-γは、ウイルス感染細胞にウイルス抗原を発現するように誘導し、感染細胞を認識して殺し、ウイルス複製に抵抗する免疫系の能力を高めることができます(Maggi et al.、1992)。NK細胞は、感染細胞を直接殺すことができる初期の抗ウイルスエフェクター細胞です。IL-12はNK細胞とTh1細胞の増殖を促進することができ、Th1細胞の増殖はNK細胞の増殖にも影響してウイルス感染に抵抗する可能性があります。さらに、Th1細胞によって産生されるIFN-γはNK細胞をさらに活性化する可能性があり、NK細胞が抗ウイルス効果を発揮する可能性を示唆しています(Komastu et al., 1998)。一方、プロバイオティクスは腸管関連リンパ節内のB細胞のIgA発現と腸管分泌IgAを上昇させることが示されています(Kikuchi et al., 2014)。この実験結果はこれらの結果と一致しており、インフルエンザウイルス感染の初期段階での腸管保護にはIgAが不可欠であることを示唆しています。 |
| 要約すると、L. plantarum 0111 はマウスを H9N2 によるダメージから保護し、この保護は腸内細菌叢を介した自然免疫および獲得免疫反応の機能である可能性があります。したがって、L. plantarum 0111 はインフルエンザウイルスを予防する候補株である可能性があります。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Front Microbiol. 2022 Jun 30;13:820484.に掲載されたLactiplantibacillus plantarum 0111 Protects Against Influenza Virus by Modulating Intestinal Microbial-Mediated Immune Responses.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |