
Luolin Wang et al., |
要約 |
| はじめに:この研究は、ヒト大腸腫瘍 HCT 115 がん細胞に対する異なる乳酸菌株の抗がん効果を体系的に評価することを目的とし、主に関与するアポトーシス機構に焦点を当てています。乳酸菌株は羊乳から分離され、綿密な微生物分離プロセスを経ています。これまでの研究では、Lactobacillus種を含む特定のプロバイオティクス細菌が、アポトーシス誘導などの機構を通じて抗がん特性を発揮する可能性があることが示されています。しかし、異なる乳酸菌株ががん細胞にこれらの効果をどのように発揮するか、また、関与する基礎的な分子経路については、十分に理解されていません。 |
| 方法:細胞毒性は、3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウム臭化物 (MTT) 分析と、Lactobacillus無細胞凍結乾燥濾液の曝露期間によって評価されました。追加のアポトーシス特性は、核断片化のための 4.6-ジアミジノ-2-フェニルインドール (DAPI) 分析とアポトーシス定量のためのアネキシン V/PI 分析を使用して特徴付けられました。遺伝子分析では、Lactobacillus処理に対するアポトーシスタンパク質 (Bax および Bcl2) の変調を調査しました。研究で使用された乳酸菌株の遺伝子構成を理解するために、全ゲノム配列決定 (WGS) を実施しました。 |
| 結果:この研究では、特に L. plantarum で ヒト大腸腫瘍(HCT) 115細胞の生存率が大幅に低下していることが、スルホローダミン B (SRB) および MTT分析によって実証されました。4.6-ジアミジノ-2-フェニルインドール (DAPI) 分析では核の断片化が明らかになり、アポトーシス細胞死のメカニズムが強調されました。Annexin V/PI 分析では、L. plantarum 処理細胞で早期および後期アポトーシスの割合が高いことが示され、これが裏付けられました。遺伝子分析では、Lactobacillus処理に対する反応として、プロアポトーシス タンパク質 Bax のアップレギュレーションと抗アポトーシス タンパク質 Bcl2 のダウンレギュレーションが明らかになりました。WGS (訳者注:全ゲノムシーケンス)研究では、NCBI PRJNA439183 に報告された菌株が明らかになりました。 |
| 考察:L. plantarum は、複雑な分子メカニズムを通じてアポトーシスを誘導し、ヒト大腸腫瘍(HCT) 115がん細胞に対する強力な抗増殖剤として浮上しました。この研究は、抗増殖、接着、遺伝子タンパク質調節への影響に焦点を当て、がん治療における L. plantarum の潜在的な役割の科学的根拠を強調しています。関与する特定の分子経路を解明し、前臨床および臨床環境で L. plantarum の治療可能性を評価するには、さらなる研究が必要です。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.方法 |
| 2.1.サンプル収集と乳酸菌株の分離 |
| 2.2. 乳酸菌株のゲノムドラフト作成 |
| 2.3.ヒト大腸腫瘍HCT 115 細胞培養および細胞フリー凍結乾燥濾液の調製 |
| 2.4.L. plantarum、L. rhamnosus、 L. acidophilus のスルホローダミンB(SRB)分析 |
| 2.5.L. plantarum、L. rhamnosus、L. acidophilus の MTT 分析 |
| 2.6.L. plantarum、L. rhamnosus、L. acidophilus の4.6-ジアミジノ-2-フェニルインドール (DAPI)による核染色 |
| 2.7.L. plantarum、L. rhamnosus、L. acidophilusのアネキシンVおよびヨウ化プロピジウム分析 |
| 2.8.統計分析 |
| 3.結果 |
| 3.1.乳酸菌株とゲノム研究 |
| 3.2.ヒト大腸腫瘍 HCT 115細胞株の SRB分析 |
| 3.3.MTT 分析 |
| 3.4. DAPI分析 |
| 3.5.L. plantarum、L. rhamnosus、L. acidophilus の アネキシンV/ヨウ化プロピジウム(PI)分析 |
| 3.6. 乳酸菌菌株のアポトーシスタンパク質発現のアップ/ダウン制御 |
| 4.考察 |
| 5.結論 |
| 本文 |
| 1.はじめに |
| 大腸がんは、依然として世界的に大きな健康負担を強いており、予防と治療のための革新的な戦略の継続的な探求が必要です(1)。大腸がんは世界で 3 番目に多く診断されるがんで、最近のデータによると、大腸がんは世界中のすべての新規がん症例の約 10%、がん関連死亡の 9% を占めています(2)。現在使用されている治療法には、手術、放射線療法、化学療法が含まれますが、多くの望ましくない副作用を引き起こす可能性があります(3)。これらには臨床症状が含まれますが、これらに限定されません。さらに、これらの治療に使用される薬剤は、選択性の欠如と化学療法耐性の発生に関連する課題に直面しています(4)。これらの問題は、がん治療の安全性と有効性に大きな障害をもたらし、全体的な管理に影響を与えます。栄養は、がんの予防、発症、進行に極めて重要な役割を果たし、多様で効果的な治療法を補完しているようです(5)。消化器系は、さまざまな有益な微生物と有害な微生物の両方を宿す複雑な生態系を形成しています(6)。プロバイオティクス、特に乳酸菌のさまざまな株は、発がん物質の除去、結腸の物理化学的条件の修正、腸内微生物叢の代謝活動、抗変異原性または抗腫瘍性化合物の生成、免疫系の刺激などの抗がん特性を含む、さまざまな健康上の利点を持つ潜在的な薬剤として浮上しています(7,8)。Lactobacillus casei, Lactobacillus rhamnosus, およびLactobacillus acidophilusなどのいくつかの乳酸菌は、ヒトの 大腸がんの腫瘍マーカーを制御し、実験動物モデルで発がん物質誘発性結腸悪性腫瘍を予防する効果があります(9)。乳酸菌は細胞と相互作用して細胞の増殖を阻害します(10)。本研究は、特にヒト大腸腫HCT 115結腸がん細胞株を標的とした新規乳酸菌株(L. plantarum、L. rhamnosus、L. acidophilus)の細胞毒性効果の比較評価に焦点を当てています。Gholipour らの研究結果では、乳酸菌のメタボロミクスががん細胞に対して直接毒性を誘発することが示唆されています。主な目的は、これらのプロバイオティクス菌株によって誘発されるアポトーシスのメカニズムを解明して理解し、大腸がんに対する治療介入としての可能性を明らかにすることです。L. plantarum、L. rhamnosus、L. acidophilus の明確な特徴は、特に結腸がん細胞に対する潜在的な影響に関して調査する価値があります。本研究の目的は、大腸がん治療におけるアジュバントとしての応用に影響を与える可能性のある貴重な洞察を提供することです。羊乳からの乳酸菌株の分離が本研究の基礎となっています。この研究は、大腸がん細胞に対する異なる乳酸菌株の細胞毒性の比較に関する新たな知見を提供することを目的とします。アポトーシスのメカニズムの解明は、プロバイオティクスの抗がん作用に関する理解を深めるだけでなく、潜在的な治療への応用の基盤も提供します。この研究結果は、特に大腸がん研究の文脈において、腫瘍学におけるプロバイオティクスの発展分野にとって有望です。 |
| 2.方法 |
| 2.1.サンプル収集と乳酸菌株の分離 |
| インド、マハラシュトラ州のコールハープル、サングリ、アダマプル地域の現地から合計 180 個の羊乳サンプル (インド種) を収集しました。細菌数測定のため、使用前にミルクサンプル (1 mL) を 15% グリセロール中で -80°C に保管しました。分離と精製は、ド・マン・ロゴサ・シャープ (MRS) ブロスと寒天培地で行いました(11)。サンプルを MRS 寒天に接種し、微好気条件下で 48 時間培養しました。培養後、形成された個々のコロニーを滅菌 MRS ブロス培地に移して濃縮しました。精製培養物は、16sRNA PCR 分析とシーケンシングを使用して同定しました。ユニバーサルプライマーペアF-5′-CTTGTACACACCGCCCGTCA-3′とリバースR-5′-CTCAAAACTAAACAAAGTTTC-3′を使用した。PCRプロトコルは当研究室から採用した(12)。 |
| 2.2.乳酸菌株のゲノムドラフト作成 |
| 特定された菌株は DNA 抽出にかけられました。全 DNA は、製造元の指示に従って PureLink ゲノム DNA 抽出キット (Life Technologies) を使用して抽出されました。シーケンス ライブラリは Nextera XT ライブラリ キットを使用して準備され、L. plantarum、L. rhamnosus、および JRARSH と表記される L. acidophilus 菌株の全ゲノム シーケンスが、Illumina NextSeq 500 シーケンス プラットフォーム (150 bp ペアエンド リード) でショットガン戦略を使用して実行されました(13)。 Illumina によって生成されたシーケンス リードは、FastQC v.0.10.1 (http://www.bioinformatics.babraham.ac.uk/projects/fastqc/) によって品質フィルター処理され、低品質のリードはアセンブリ前に削除されました。品質フィルタリングされたリードは、SPAdes v.3.9,14,15 を使用して de novo アセンブルされ、31 個のコンティグが生成されました。遺伝子予測は、Rapid Annotations using Subsystems Technology (RAST) サーバー v.2.0 (rast.nmpdr.org/) を使用して、デフォルトのパラメータで実行されました(16–18)。 予測された遺伝子は、Prokaryotic Genome Annotation Pipeline (PGAP) v.4.919 および BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi) を使用して注釈が付けられました。特に指定がない限り、すべてのソフトウェアでデフォルトのパラメータが使用されました。 |
| 2.3.ヒト大腸腫瘍HCT 115 細胞培養および細胞フリー凍結乾燥濾液の調製 |
| ヒト大腸がん細胞株 HCT 115 は、RPMI (ロズウェル パーク記念研究所培地) で維持することにより単層として開発されます。これらの細胞は、インドのプネにある NCCS から調達されました。これらの培地には、100 U/mL ストレプトマイシン ペニシリンと、11% の温度で維持された加熱殺菌ウシ胎児血清 (FBS) が添加されています。細胞は、約 36°C で 4.6% CO2 の加湿大気条件で維持されました。80~85% の合流後、細胞は細菌サンプルの細胞フリー凍結乾燥濾液で処理されました。LactobacillusのL. plantarum、L. acidophilusおよびL. rhamnosus培養物を、1 x 107〜8 cfu count/mLの濃度でMRSブロス中で37°Cで一晩培養した。その後、これらの培養物を4°Cで5.5分間5100 x gで遠心分離してペレットを得た。形成された細胞ペレットをリン酸緩衝生理食塩水(PBS)で洗浄した後、冷却氷浴(4°C)で28秒間隔で15分間超音波破砕した。形成された上清を0.22 µm孔マイクロフィルター(Himedia、USA)に通した。さらに、細胞を含まない凍結乾燥濾液については、培養物が必要なOD600に達したときに、4°Cで15分間5000 rpmで遠心分離して細菌細胞を抽出した。細菌ペレットは、放出された代謝物と細菌副産物を含む上清から慎重に分離されました。細胞汚染が残っていないことを確認するために、0.22 μm の滅菌メンブレン フィルターを使用して上清を濾過しました。凍結乾燥機を使用して、細菌細胞のない濾液を凍結乾燥させました。材料を凍結乾燥させた後、滅菌リン酸緩衝生理食塩水 (PBS) で再構成して濃縮ストック溶液を作製しました。この溶液は、次に必要になるまで -80°C で保存しました。その後のテストでは、この細胞を含まない凍結乾燥濾液 (CFLF) を使用して細胞毒性とアポトーシスを調べました。上清の滅菌濾液を凍結乾燥させ、さまざまな濃度で細胞生存率分析に使用しました(20)。 |
| 2.4.L. plantarum、L. rhamnosus、L. acidophilusのスルホローダミン B (SRB) 分析 |
| スルホローダミン B (SRB)分析では、細胞密度を測定することで細胞タンパク質含有量を測定します。簡単に説明すると、96 ウェル マイクロタイター プレートを使用して、1×105−6 細胞/mL の濃度の細胞を 24 時間培養しました。培養後、細胞を L. plantarum、L. rhamnosus、および L. acidophilus の細胞を含まない凍結乾燥濾液で 10、20、30、40、および 50 (µg/mL) の濃度で処理しました。次に、培地全体を 38°C、5% CO2 大気条件で 24 時間、48 時間、および 72 時間培養しました。インキュベーション期間後、形成された細胞単層を 9.9% (w/v) トリクロロ酢酸で固定した。さらに、スルホローダミン B (SRB)で 30 分間染色し、余分な染料を除去するために 1% (v/v) 酢酸を使用した。細胞生存率の測定には、マイクロプレートリーダーを使用して、タンパク質結合染料を 9.9 mm トリス塩基溶液に溶解し、500 nm で OD を計算した。細胞生存率のパーセンテージは、乳酸菌サンプルを含まないコントロールウェルの値と比較し、式 1 を使用して計算した。L. acidophilus サンプルを参照コントロールグループとして使用した(21)。 |
| 細胞生存率(%)=処理中の細胞の吸光度/コントロール細胞の吸光度 (1) |
| 2.5.L. plantarum、L. rhamnosus、L. acidophilus の MTT分析 |
| 細胞増殖の形での足場依存性生存率は、3-(4-5-ジメチルチアゾール-2-イル-)-2, 5-ジフェニルテトラゾリウムブロミド( MTT )試薬を使用した比色分析によって測定されました。MTT 分析では、還元 MTT 染料の紫色のホルマザン色が、分光光度計による研究で定量化された生存細胞数に正比例していることがわかりました。簡単に説明すると、96 ウェル平底組織培養プレートに 9,000~10,500 個のヒト大腸腫瘍 HCT 115細胞を 24 時間 (3 重) 播種しました。 24時間後、細胞をL. plantarum、L. rhamnosus、L. acidophilusの細菌サンプルの細胞を含まない凍結乾燥濾液で10、20、30、40、50(µg/mL)の濃度で処理した。分析用に保持した陰性対照群は、接種していないRPMI培地で構成した。処理後24時間後にリン酸緩衝生理食塩水溶液で洗浄した細胞に、リン酸緩衝生理食塩水中のMTTの5 mg/mL溶液を接種した。さらに、細胞を37°Cで4時間インキュベートしてミトコンドリア脱水素酵素活性を調べ、後に紫色のフォルマザン結晶の形成によって可視化した。最後に、各ウェルに120 µLのDMSO(ジメチルスルホキシド)を加え、37°Cで28分間インキュベートした。マイクロプレートリーダーを用いた分光光度法によって、色の強度は570 nmで測定されました。すべての実験は3回(n=3)実行され、データは対照と比較した生存率のパーセントとして表されました(22,23)。 |
| 2.6.L. plantarum、L. rhamnosus、L. acidophilus の DAPI による核染色 |
| 細胞特異的アポトーシスプロセスは、4.6-ジアミジノ-2-フェニルインドール (DAPI) 分析によって特徴付けられます。ヒト大腸腫瘍 HCT 115 細胞では、核断片化とクロマチン凝縮の分析は、蛍光顕微鏡を使用した4.6-ジアミジノ-2-フェニルインドール (DAPI)染色によって行われました。70~80% のコンフルエントヒト大腸腫瘍 HCT 115細胞を、L. plantarum、L. rhamnosus、L. acidophilus の細胞を含まない凍結乾燥濾液 (RPMI 中 50 µg/mL) で 24 時間処理した後、細胞を氷冷リン酸緩衝生理食塩水ですばやく洗浄し、氷冷アセトン: メタノール (1:1) 混合液で暗所で 4°C で 10 分間固定しました。氷冷リン酸緩衝生理食塩水で洗浄した細胞を、DNA 特異的蛍光色素4.6-ジアミジノ-2-フェニルインドール (DAPI)で 20 分間インキュベートしました。氷冷リン酸緩衝生理食塩水洗浄により、余分な4.6-ジアミジノ-2-フェニルインドール (DAPI)を除去した。最後に、蛍光顕微鏡を使用して20~40倍の解像度で細胞を観察した。L. acidophilusサンプルを参照対照群として使用した(24)。 |
| 2.7.L. plantarum、L. rhamnosus、L. acidophilusのアネキシンVおよびヨウ化プロピジウム(PI)分析 |
| ヒト大腸腫瘍 HCT 115細胞を60 mmのディッシュで培養し、さらにL. plantarum、L. rhamnosus、およびL. acidophilusの無細胞濾液(500 µL)で処理しました。24時間の培養期間後、採取した細胞を冷リン酸緩衝生理食塩水で洗浄しました。1%アネキシン結合緩衝液を調製しました。1 mg/mLヨウ化プロピジウムストック溶液5 µLを使用して、ヨウ化プロピジウムの希釈100 µg/mL作業溶液を調製しました。接種した細胞とともに最終溶液を遠心分離し、上清溶液を捨てた後、細胞を1Xアネキシン結合緩衝液に懸濁しました。 1 分析あたり 100 µL の最終容量のバッファーは、1X アネキシン結合バッファーを 1 × 105~6 細胞/mL に希釈して調製しました。1 µL の 100 µg/mL ヨウ化プロピジウム作業溶液と 6 µL の Alexa Fluor® 488 アネキシン V を加えて 100 µL の細胞懸濁液を作りました。その後、細胞を室温で約 12 分間インキュベーションしました。最後に、細胞に 390~410 µL の 1X アネキシン結合バッファーを接種し、氷浴に入れました。染色した細胞は、フローサイトメトリーを使用して 520 nm で蛍光発光を測定することによって評価しました(20)。 |
| 2.8.統計分析 |
| 米国のGraphPad Prism 5.01ソフトウェアを使用して、Tukeyの多重比較検定による一元配置分散分析(ANOVA)を使用して、プロバイオティクスグループとコントロールグループの結果を比較しました。標準偏差と有意差は、*p<0.05、**p<0.01として示されました。 |
| 3.結果 |
| 3.1.乳酸菌株とゲノム研究 |
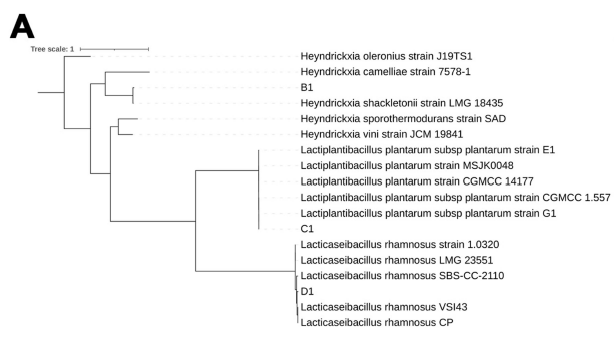
| 16sRNA シーケンシングにより、3 つの株が L. plantarum、L. rhamnosus、L. acidophilus であることが確認され、系統樹が作成されました (図 1A)。最終アセンブリでは、平均 G+C 含有量 44.5%、N50 値 174,093 bp、L50 6、合計 3128 個の遺伝子 (うち 2980 個はタンパク質コード遺伝子、59 個は tRNA 遺伝子、5 個は rRNA 遺伝子 (35S rRNA、116S rRNA、123S rRNA)、4 個は非コード RNA (ncRNA) 遺伝子) の 3.20 Mb ゲノムが得られました。ゲノムには 80 個の擬似遺伝子も含まれていました。合計 3128 個の遺伝子のうち、2135 個 (68.25%) の生物学的機能が定義されました。特定された予測遺伝子は、細胞代謝 (n =38)、タンパク質処理 (n =323)、エネルギー (n = 276)、ストレス応答防御および毒性 (n = 182)、DNA 処理 (n = 181)、細胞応答 (n = 163)、RNA 処理 (91)、膜輸送 (n = 33)、細胞エンベロープ (n = 28)、および調節および細胞シグナル伝達 (n = 18) に関連しています (図 1B)。さらに、遺伝子にはそれぞれ推定機能が割り当てられました。推定される機能には、細胞接着、耐酸性、胆汁毒性、モリブデン補因子生合成、葉酸およびプテリジン生合成、芳香族化合物分解、細胞外多糖類生成、リボフラビンおよびバクテリオシン生成、チアミンおよびメチオニン生合成、リン酸代謝、硫黄代謝、休眠および胞子形成、脱窒作用などが含まれます。この L. plantarum 細菌株は、ヘキソース糖を代謝し、高濃度のエタノールおよび酸に耐えるという特徴的な天然能力により、リグノセルロース系バイオマスをバイオ燃料に代謝する魅力的な候補であることも証明されています。 |
 |
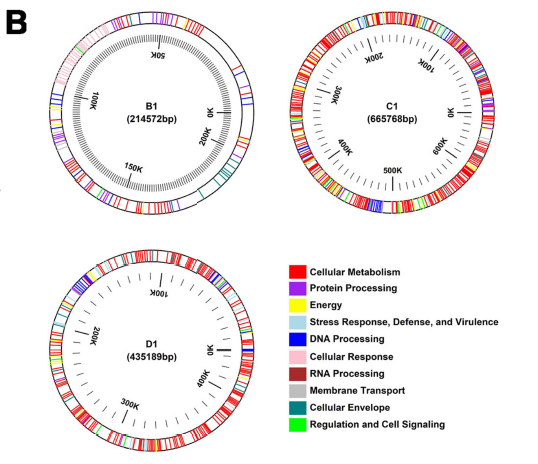 |
| 図1 (A) 16S rRNA 配列に基づく系統樹により、L. plantarum (B1)、L.rhamnosus (C1)、および L. acidophilus (D1) が確認されました。(B) 組み立てられたLactobacillus ゲノムのゲノム注釈の概要。異なる色はさまざまな機能カテゴリを表します。細胞代謝 (赤)、タンパク質処理 (紫)、エネルギー (黄色)、ストレス応答、防御、および毒性 (水色)、DNA 処理 (濃い青)、細胞応答 (ピンク)、RNA 処理 (茶色)、膜輸送 (灰色)、細胞エンベロープ (青緑)、調節および細胞シグナル伝達 (緑)。 |
| 3.2.ヒト大腸腫瘍 HCT 115細胞株の SRB分析 |
| スルホローダミン B (SRB) 分析によって ヒト大腸腫瘍 HCT 115細胞株に対して行われた生存率調査では、対照群と比較して、L. plantarum の場合 50 µg/mL の濃度で細胞生存率が約 64% 低下することが示されています。同様に、L. rhamnosus および L. acidophilus の場合に得られた細胞生存率の結果では、対照群と比較して、ヒト大腸腫瘍 HCT 115 細胞株の 50 µg/mL での生存率は 74% および 88% であることが示されています。時間依存 スルホローダミン B (SRB) 分析は、24 時間、48 時間、および 72 時間の期間にわたって実施されました。この調査では、細胞生存率が時間とともに低下することが明らかになっています。L. plantarum は、対照群と比較して、24 時間で約 64%、48 時間で約 52%、72 時間後に約 48% まで生存率が低下しています (図 2A)。同様に、L. rhamnosus の場合、細胞生存率は時間とともに低下し、24 時間後の 76% から 48 時間後の 72%、72 時間後の 70% へと低下しました (図 2B)。L. acidophilus の場合、ヒト大腸腫瘍 HCT 115細胞株の生存率の低下はごくわずかです。このように、スルホローダミン B (SRB) 分析では、L. plantarum の場合、L. rhamnosus および L. acidophilus と比較して、がん細胞株の生存率の時間依存的および濃度依存的な低下が顕著に見られます。 |
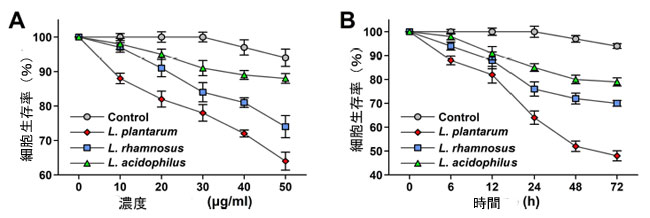 |
| 図2 (A) 乳酸菌の無細胞凍結乾燥濾液が、スルホローダミン B (SRB) 分析によるさまざまな濃度での ヒト大腸腫瘍 HCT 115細胞株の生存率に与える影響。値は、生存率の平均比 ± SD* として表され、n = 3。 (B) 乳酸菌の無細胞凍結乾燥濾液が、スルホローダミン B (SRB) 分析によるさまざまなインキュベーション時間での ヒト大腸腫瘍 HCT 115細胞株の生存率に与える影響。値は、生存率の平均比 ± SD* として表され、n = 3。 |
| 3.3. MTT 分析 |
| この分析では、3-(4-5-ジメチルチアゾール-2-イル-)-2, 5-ジフェニルテトラゾリウムブロミド( MTT ) 試薬が生細胞を通過してミトコンドリアに入り、フォルマザンと呼ばれる濃い青/紫色の不溶性化合物を生成します。これは生細胞でのみ観察されます。MTT 試薬の黄色のテトラゾリウム塩は、生細胞でのみ紫色の色素に還元されるためです。これらの生細胞は、イソプロパノールなどの有機溶媒の使用により均質化され、フォルマザンの形成につながる可溶性になります。死細胞はこれらの活性を示さないため、この分析では、生細胞数を生存率の形で示し、代謝活性細胞の数を決定します。ヒト大腸腫瘍HCT 115 細胞株で MTT 分析によって実施された生存率研究では、L. plantarum の場合、最高用量の 50 µg/mL で細胞生存率のパーセンテージが約 40% 減少し、さらに、対照群と比較して最も強い抗増殖活性を示しています。 L. plantarum の場合、10 µg/mL の用量を除き、20 µg/mL から 50 µg/mL までの他の用量で抗増殖活性が示されています。同様に、L. rhamnosus および L. acidophilus の場合に得られた細胞生存率の結果は、ヒト大腸腫瘍 HCT 115細胞株で最高用量の 50 µg/mL で対照群に対して 74% および 88% でした。参照対照群として使用される L. acidophilus は、抗増殖活性を示しません (図 3A)。時間依存性 MTT分析は、24 時間、48 時間、および 72 時間の期間にわたって実行されます。この研究では、細胞生存率は時間とともに低下することが明らかになっています。 L. plantarum は、対照群と比較して、生存率が 24 時間で約 41%、48 時間で約 38%、72 時間後に約 34% 減少しています。同様に、L. rhamnosus の場合、細胞生存率は時間とともに減少し、24 時間で約 72%、48 時間で約 70%、72 時間で約 68% 減少しています (図 3B)。一方、対照群の場合、ヒト大腸腫瘍 HCT 115細胞株の生存率のわずかな減少が観察されています。このように、MTT分析では、L. plantarum の場合、L. rhamnosus および L. acidophilus と比較して、時間依存的および濃度依存的にがん細胞株生存率の減少が有意に観察されています。 |
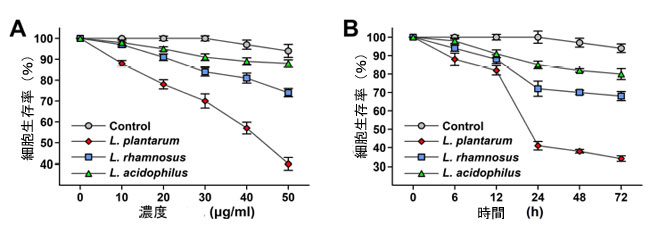 |
| 図3 (A) MTT 分析による、さまざまな濃度での乳酸菌の細胞フリー凍結乾燥濾液の ヒト大腸腫瘍 HCT 115細胞株の生存率への影響。値は、生存率の平均比 ± SD* として表され、n = 3。 (B) MTT 分析による、さまざまなインキュベーション時間での乳酸菌の細胞フリー凍結乾燥濾液のヒト大腸腫瘍 HCT 115細胞株の生存率への影響。値は、生存率の平均比 ± SD* として表され、n = 3。 |
| 3.4.DAPI分析 |
| 3 種類の菌株すべての無細胞凍結乾燥濾液をヒト大腸腫瘍 HCT 115細胞株で 24 時間分析しました。L. plantarum の場合、L. rhamnosus と比較して顕著なアポトーシス シグナルが観察されました。参照コントロール グループとして使用される L. acidophilus の場合、非アポトーシス シグナルが観察されました。観察されたアポトーシス細胞は、無傷の色の正常細胞と比較して、断片化凝縮核を有していました。24 時間の培養後、L. plantarum 処理されたヒト大腸腫瘍 HCT 115細胞は、L. rhamnosus と比較して、核断片化パターンを伴うアポトーシス収縮細胞を示しています。アポトーシス細胞の場合に観察されたその他の特徴は、L. plantarum の核の収縮を伴う微小核ブレブ細胞膜の形成です。一方、L. rhamnosus は微小核を伴う水疱膜を示します。アポトーシスは4.6-ジアミジノ-2-フェニルインドール (DAPI)によって可視化されます (図 4A ~ D)。 |
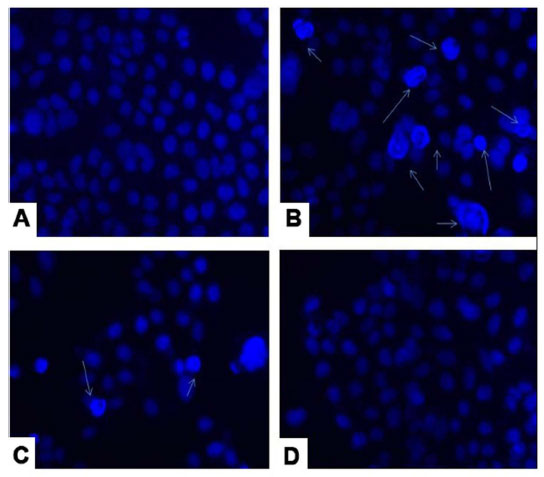 |
| 図4 乳酸菌株の4.6-ジアミジノ-2-フェニルインドール (DAPI) 分析 (A) 未処理細胞株、(B) L. plantarum (C) L. rhamnosus、(D) L. acidophilus。 |
| 3.5.L. plantarum、L. rhamnosus、L. acidophilus の アネキシンV/ヨウ化プロピジウム分析 |
| ヒト大腸腫瘍 HCT 115細胞を L. plantarum、L. rhamnosus、L. acidophilus の上清で 24 時間処理します。その結果、右下象限に蛍光ドット (annexin V+/PI-) の混合結果が観察され、L. plantarum および L. rhamnosus の場合に早期アポトーシス現象を示していますが、コントロール L. acidophilus ではそのようなドットは観察されません。同様に、右上象限に蛍光ドット (annexin V+/PI-) の混合結果が観察され、L. plantarum および L. rhamnosus の場合に後期アポトーシス現象を示していますが、コントロールではそのような蛍光ドットは観察されません。結果によると、L. plantarum 上清液で処理した ヒト大腸腫瘍 HCT 115 細胞株では、約 57.5% の早期アポトーシスと 7.3% の後期アポトーシスが観察されました (図 5A)。L. rhamnosus の場合、ヒト大腸腫瘍 HCT 115細胞株で観察された早期および後期アポトーシスは、それぞれ約 22.2% と 6.0% でした (図 5B)。また、この結果は、本研究で参照標準コントロール グループとして使用されたL. acidophilus上清液で処理した ヒト大腸腫瘍 HCT 115 細胞株では、0.0% および 0.1% の早期および後期アポトーシスが観察されたことも明らかにしました (図 5C)。L. plantarum、L. rhamnosus、および L. acidophilus の場合に左上象限で観察された壊死性死菌数は、それぞれ 1.7%、6.4%、および 0.7% であり、実施された研究全体に影響を与えませんでした。炎症誘発物質は壊死現象による細胞死によって放出され、一方アポトーシスによる細胞死はカスケードイベントです。細胞株の死は、補完システムの活性化によるマクロファージとサイトカインによって誘発される貪食現象によるものであると結論付けられます。分析にヨウ化プロピジウム(PI)分析を含めることで、アポトーシスプロセス中の膜の完全性を評価できます。FITC結合アネキシンVによる染色により、死のカテゴリーを壊死またはアポトーシス(初期または後期)として区別できます。現在の研究では、L. plantarumは、壊死イベントが無視できるL. rhamnosusと比較して、初期および後期アポトーシスを示すことが証明されています。以前の研究では、濃度約50 µg/mLのL. plantarum SBLが、24時間後にHela細胞株で20%と51.5%の初期および後期アポトーシスを示すことが証明されています。 |
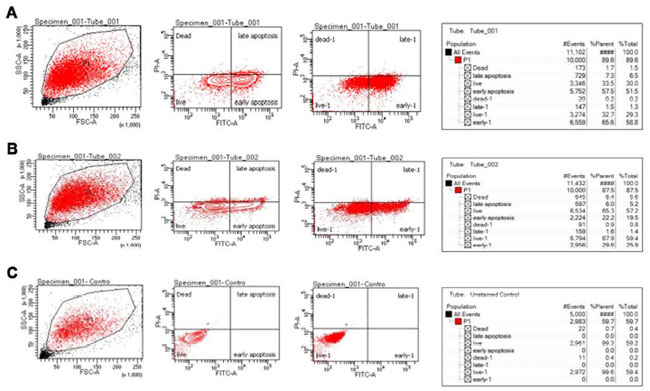 |
| 図5 ヒト大腸腫瘍 HCT 115細胞に対する L. plantarum、L rhamnosus、および L. acidophilus の Annexin V/PI 分析、(A) L. plantarum 処理、パネル (B) L. rhamnosus 処理、パネル (C) L. acidophilus 処理 (コントロール)。 |
| 3.6. 乳酸菌株のアポトーシスタンパク質発現のアップ/ダウン制御 |
| アポトーシスタンパク質は、Bax、Bcl2(訳者注:BAX(Bcl-2-associated X protein、Bcl-2結合Xタンパク質)は、ヒトではBAX遺伝子によってコードされるタンパク質で、アポトーシスの調節因子である)、ベータアクチンのアップ制御とダウン制御、およびその発現比によって調査されました。Baxはプロアポトーシスタンパク質として作用し、L. plantarum(処理済み)のBaxは、(未処理)コントロールグループと比較して有意に増加(p<0.01)しています。同様に、L. rhamnosusのBaxは、コントロールグループと比較して有意に増加(p<0.05)しています。したがって、L. plantarumでは、L. rhamnosusと比較して、Baxの増加がより高くなっています(図6)。同様に、Bcl2は抗アポトーシスタンパク質として作用し、L. plantarumのBcl2は、コントロールグループと比較して有意に減少(p<0.01)しています。同様に、対照群と比較して、L. rhamnosus の Bcl2 は有意に減少しています (p<0.05)。したがって、Bcl2 発現の減少は、L. rhamnosus と比較して L. plantarum でより高く見られます。L. plantarum と L. rhamnosus の場合、処理群と未処理群の両方でベータアクチン発現に有意な変化は観察されません。これは、L. plantarum が L. rhamnosus と比較して有意に高いアポトーシスタンパク質発現特性を示すことを示しています。L. reuteri によって、HT 29 結腸がん細胞株に対する Bax の増加と Bacl2 の減少によるアポトーシス活性が報告されました。同様に、L. plantarum は Bax の上方制御と Bcl2 の下方制御によってアポトーシス活性を示します。 |
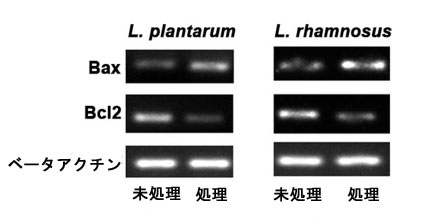 |
| 図6 乳酸菌株のアポトーシスタンパク質発現のアップ/ダウン制御。処理群と未処理群における Bax (プロアポトーシス)、Bcl2 (抗アポトーシス)、およびベータアクチン発現の分析。 |
| 4.考察 |
| がん細胞株に対する乳酸菌株の細胞毒性効果の研究は、がん研究および治療における大きな進歩です。この研究の目的は、3 種類の乳酸菌株 (L. plantarum、L. rhamnosus、L. acidophilus) が ヒト大腸腫瘍 HCT 115 結腸がん細胞に与える影響を調査することです。細胞を殺す能力の背後にあるメカニズムを理解し、がん治療の新たな選択肢としての可能性を評価するために、いくつかのテストと検査を実施しました。細胞生存率を評価し、乳酸菌株の細胞毒性効果を決定するための主な方法として、スルホローダミン B (SRB) 分析を使用しました。細胞タンパク質レベルの検出に基づくこのテストは、染料に結合する能力を測定することで、細胞生存率に関する情報を提供します(25)。さまざまな乳酸菌株で処理した後、細胞生存率は用量依存的に減少することを発見しました。その中で、L. plantarum は L. rhamnosus や L. acidophilus と比較して最も高い抗増殖効果を示しました。この観察結果は、L. plantarum が ヒト大腸腫瘍 HCT 115結腸がん細胞を殺す強力な能力を持っていることを強調しており、がん治療としてさらに調査するのに適した選択肢となっています。ヒト大腸腫瘍 HCT15 細胞株に関するこの最初の報告は、L. plantarum が結腸がん細胞を殺すことを示しています。 |
| 我々は、細胞生存率を評価し、乳酸菌株の凍結乾燥濾液の細胞毒性効果を決定するための主な方法としてスルホローダミン B (SRB) 分析を使用しました。MTT分析は、生細胞内のミトコンドリア酵素の活性を測定し、MTTからフォルマザン結晶への変換を追跡することで細胞生存率を定量化します(26)。SRB分析の結果と一致して、さまざまなLactobacillus濾液、特にL. plantarumで処理した後、細胞生存率が用量依存的に減少することを発見しました。同様の時間および濃度依存的なMTT研究が、25〜250 μgの用量でL. plantarum DGK-17に対して実施され、24時間後に結腸がん細胞株の効果的な減少を示しました(27)。我々の知る限り、これはヒト大腸腫瘍 HCT 115細胞株でL. plantarum分泌物が結腸がん細胞に細胞毒性効果を示す最初の報告です。 |
| 我々は、乳酸菌株によって引き起こされる細胞死のプロセスを理解するために、4.6-ジアミジノ-2-フェニルインドール (DAPI)染色やアネキシン V/ヨウ化プロピジウム (PI) 分析などのさらなる調査を実施しました(28)。4.6-ジアミジノ-2-フェニルインドール (DAPI)標識により核構造を観察できるため、核凝縮や崩壊などのアポトーシスの特徴を特定しやすくなりました。結果は、L. plantarum 濾液で処理した細胞が、プログラム細胞死の兆候である核断片化や細胞収縮などのアポトーシスの特徴を示したことを示しました。L. rhamnosus 処理細胞はアポトーシスシグナルが減少しましたが、L. acidophilus処理ではアポトーシスの特徴が見られなかったことから、アポトーシスが引き起こされませんでした。L. plantarum は主にアポトーシスによって細胞死を引き起こすため、がんの集中治療として有望であることが示唆されています。アポトーシスのプロセスを詳細に理解するために、アネキシン V/PI 分析を行いました。これにより、アポトーシスの初期段階と後期段階を区別できるようになりました。この研究では、L. plantarum と L. rhamnosus による治療はヒト大腸腫瘍 HCT 115 細胞で早期および後期アポトーシスを誘発したが、L. acidophilus による治療では中程度のアポトーシス活性が得られたことが示された。この研究は、L. plantarum による細胞死の特殊性をさらに証明し、がん治療への応用の可能性を浮き彫りにした。さらに、アポトーシスタンパク質発現の検査により、L. plantarum の細胞毒性効果の原因となるアポトーシスプロセスが裏付けられた(23–31)。 |
| L. plantarum 濾液で処理した細胞では、プロアポトーシス タンパク質 Bax が増加し、抗アポトーシス タンパク質 Bcl2 が減少したことから、内因性アポトーシス経路の活性化が示唆された。一方、L. rhamnosus で処理した場合も、L. plantarum と比較して Bax の発現が高く、さまざまな 乳酸菌株間で異なるアポトーシス シグナル伝達経路があることが示された。全体として、私たちの結果は、L. plantarum 濾液がアポトーシスを誘導することにより、ヒト大腸腫瘍 HCT 115結腸がん細胞に対して強力な阻害効果を発揮することを強調している。この結果は、乳酸菌 株の細胞毒性効果の原因となる分子経路に関する重要な情報を提供し、がん治療のための新しい治療薬としての可能性を強調している。L. plantarum 誘導アポトーシスに関与する正確なシグナル伝達経路を明らかにし、前臨床および臨床環境の両方でその有効性を評価するには、さらなる研究が必要である。さらに、乳酸菌株と従来のがん治療の併用による相乗効果の可能性を調査することで、治療結果の改善や個別化されたがん治療戦略につながる可能性があります。特定の乳酸菌株に焦点を当てているため、多様なプロバイオティクスの状況を完全に代表しているわけではありません。L. plantarum 誘導性アポトーシスの複雑なメカニズムは部分的に解明されていますが、さらなる調査が必要です。私たちの研究結果の臨床的関連性を考えると、L. plantarum 濾液をがん治療の治療薬として検討する前に、安全性、有効性、最適な投与量について広範な研究を行う必要があります。この研究の範囲には従来のがん治療との相乗効果の評価は含まれておらず、治療結果の向上のための併用療法に関する将来の調査への道が示唆されています。 |
| 5.結論 |
| 本研究では、がん細胞株に対する乳酸菌の比較細胞毒性研究を扱っています。この研究では、L. plantarum は L. rhamnosus や L. acidophilus と比較して、がん細胞株に対して効果的な抗増殖剤として作用することが示されています。L. plantarum は、核の断片化によるアポトーシスによる細胞死を示します。現在の研究では、L. plantarum は、L. rhamnosus と比較して、壊死イベントが無視できるほどの早期および後期アポトーシスとして細胞死メカニズムを示すことが示されています。アポトーシスタンパク質発現研究では、L. plantarum は Bax の上方制御と Bcl2 の下方制御によってがん細胞を殺すことが示されています。したがって、in vitro 研究では、L. plantarum のがん殺傷傾向は、抗増殖と遺伝子タンパク質調節メカニズムの組み合わせによるものであることが示されています。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Biologics. 2024 Oct 1;18:285–295.に掲載されたExploring Anticancer Potential of Lactobacillus Strains: Insights into Cytotoxicity and Apoptotic Mechanisms on HCT 115 Cancer Cells.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |