
Roberta Prete et al., |
要約 |
| 乳酸菌が産生する菌体外多糖 (EPS) は、酸化ストレスや炎症関連ストレスへの対処能力など、宿主にさまざまな健康上の利点をもたらすと言われています。この研究では、食品由来の Lactiplantibacillus (Lpb.) plantarum が菌体外多糖を産生することで発酵乳の抗酸化活性を向上させる能力を調査しました。菌体外多糖産生量が低い Lpb. plantarum 株と 菌体外多糖産生量が高い Lpb. plantarum 株の 2 株を、従来のスターターと組み合わせて実験室規模の発酵乳生産に適用しました。抗酸化活性は、DPPH(1,1-ジフェニル-2-ピクリルヒドラジル)、ABTS(2,2-アジノ-ビス(3-エチルベンゾチアゾリン-6-スルホン酸)、FRAP(鉄還元抗酸化力)アッセイを使用してin vitroで調査され、活性酸素種(ROS)レベルを調節する能力は、酸化ストレスと炎症ストレスの両方にさらされた腸の健康なモデルで評価されました。さらに、消化が機能性に影響を与えるかどうかを確認するために、発酵乳をin vitroでシミュレートされた標準化胃腸モデル(INFOGEST)消化の前後で評価しました。結果は、最高の菌体外多糖産生菌であるLpb. plantarum LT100で強化された発酵乳の抗酸化活性が向上したことを示しました。さらに、データは、Lpb. plantarum株で強化されたサンプルの保護的な抗炎症効果による異なる活性酸素種調節を示しました。 私たちのデータは、Lpb. plantarumの選択された菌体外多糖産生菌株を、活性酸素種調節と炎症関連ストレスの観点から見た発酵乳の機能性により腸内細菌叢を豊かにするための自然な戦略として使用することを示唆しています。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.材料と方法 |
| 2.1. 本研究で使用した細菌 |
| 2.2. 細菌株間の増殖適合性試験 |
| 2.3. ルテニウムレッドアッセイ |
| 2.4. 単回接種発酵乳における菌体外多糖生成 |
| 2.5. ラボ規模の発酵乳製造 |
| 2.6. 発酵のモニタリング |
| 2.7. 共接種発酵乳中の菌体外多糖定量 |
| 2.8. 胃十二指腸模擬標準化胃腸モデル消化 |
| 2.9. in vitro 抗酸化活性 |
| 2.10. 腸管上皮モデル |
| 2.11. 細胞生存率アッセイ |
| 2.12. 腸細胞モデルにおける活性酸素種調節評価 |
| 2.13. 統計およびデータ分析 |
| 3. 結果 |
| 3.1. 細菌株間の増殖適合性アッセイ (交差適合性試験) |
| 3.2. 菌体外多糖生産プレートスクリーニング |
| 3.3. 単回接種発酵乳中の菌体外多糖定量 |
| 3.4. ラボ規模の発酵乳生産: 物理化学的および細胞生存率パラメータ |
| 3.5. Lpb. plantarum 強化発酵乳中の 菌体外多糖定量 |
| 3.6. in vitro抗酸化活性 |
| 3.6.1. 従来スターターとLpb. plantarumのin vitro抗酸化活性 |
| 3.6.2. 発酵乳の in vitro 抗酸化活性 |
| 3.7. 発酵乳の腸管モデルへの影響の評価 |
| 3.7.1. 発酵乳の非細胞毒性(MTT アッセイ) |
| 3.7.2. 発酵乳が腸モデルにおける活性酸素種調節に与える影響 |
| 4. 考察 |
| 5. 結論 |
| 本文 |
| 1.はじめに |
| 発酵食品は人類の進化において重要な役割を果たしてきました。発酵食品は、その官能特性、保存期間、安全性だけでなく、いくつかの生物学的作用を持つ微生物代謝産物の存在でも高く評価されてきました。発酵プロセス中の微生物代謝活動は、食品の栄養特性と機能特性も改善し、人間の健康に有益な効果をもたらします [1]。乳製品、特にヨーグルトと発酵乳は、コーデックス規格 No. 243/2003 [2] に従って、正式には Lactobacillus delbrueckii subsp. bulgaricus と Streptococcus thermophilus と呼ばれる選ばれたスターターカルチャーによって生産される、広く消費されている発酵食品です。これらの食品は、乳糖の消化を改善する役割について EFSA (欧州食品安全機関) の健康強調表示を受けています [3]。ヨーグルトや発酵乳には、ペプチド、ミネラル、ビタミンなどの生理活性化合物が含まれているため、免疫系との相互作用を介して胃腸の健康に良いとされ、腸内細菌叢の調整や腸管バリア恒常性維持により慢性炎症の循環バイオマーカーが減少することが分かっています [4,5]。しかし、ヨーグルトや発酵乳は、プロバイオティクスを加えることで機能性を高めることができます [6]。その中でも、乳酸菌(LAB)とビフィズス菌は、発酵プロセス中にバクテリオシン、生理活性ペプチド、神経伝達物質、菌体外多糖(EPS)などの有益な化合物を生成することで健康効果を高めるため、乳製品に広く使用されています [7]。技術的な観点から見ると、菌体外多糖は天然のバイオ増粘剤であり、乳酸菌による菌体外多糖の現場生産は、人工の安定化増粘剤/添加物の現実的な代替手段です。したがって、乳製品の製造における菌体外多糖産生株の使用は、主に食品の粘稠度と食感を自然に改善するために使用されます [8]。 それに加えて、乳酸菌によって産生される菌体外多糖は、微生物と宿主の相互作用や免疫系の微生物による調節との相関関係、および抗酸化作用や抗炎症作用などの他の有益な効果でも注目を集めています [9,10]。 さらに、菌体外多糖は細菌が胃腸のストレスに耐えるのを助ける役割も果たしており、腸内での細菌の持続時間が長くなり、宿主への健康効果が向上する可能性があります [11]。 今日では、生体内での酸化ストレスを誘発する活性酸素種 (ROS) の蓄積が増加しているため、腸内の多くの慢性炎症状態と密接に関連しているため、乳酸菌由来の菌体外多糖を含む天然源からの抗酸化戦略が、活性酸素種の過剰産生と蓄積に対処するための食事介入として研究されています [12]。 他の有益な特徴として、さまざまな要因が細菌の菌体外多糖産生能力に影響を与える可能性があります。したがって、菌体外多糖の種類、菌体外多糖の生産量、および有効な 菌体外多糖の健康効果は、種および株によって大きく異なります [8]。 乳酸菌種のうち、Lactiplantibacillus (Lpb.) plantarum はスターター培養物として発酵において長い歴史を持つ柔軟な種であり、多くの株が補助的なプロバイオティクス培養物として使用されており、酸化ストレスと炎症の改善を介してさまざまな疾患を予防および誘発する自然に安全で効率的な戦略であることが示されています。 さらに、さまざまな Lpb. plantarum 株が 菌体外多糖の生産を介してこれらの有益な効果を発揮できることが示されています [13]。 さらに、さまざまな食品関連の Lpb. plantarum 株から分離された菌体外多糖が抗酸化活性を持つことを示す一連の in vitro 証拠があります [14,15,16,17,18]。 最近、いくつかの in vivo 研究で、乳酸菌種によって生成された菌体外多糖の抗酸化作用が確認されました。 たとえば、Lpb. plantarum YW11 および Lactobacillus helveticus KLDS1.8701 は、老化マウスモデルの酸化ストレスを軽減しました [19,20]。これらの研究では、さまざまな乳酸菌によって生成された分離および精製された菌体外多糖を、酸化ストレスと炎症に対抗する健康的で「グリーン」な戦略として適用することが報告および示唆されていますが、同様の結果を達成するための代替戦略は、発酵プロセス中に活性酸素種調節および抗炎症活性を持つ菌体外多糖をその場で放出することにより、乳製品の強化に選択された 菌体外多糖産生乳酸菌株を適用することです。 |
| それを踏まえ、本研究の目的は、実験室規模の発酵プロセス用に選択されるLpb. plantarum株のin vitroスクリーニングと評価と、炎症を起こした腸モデルを用いた活性酸素種調節によるLpb. plantarum強化発酵乳の抗炎症活性の評価を組み合わせた革新的なアプローチを用いて、発酵プロセス中に菌体外多糖を生成することにより、いくつかの食品由来のLpb. plantarumが発酵乳の抗酸化活性を高める能力を調査することであった。まず、発酵食品から分離されたLpb. plantarum株を、発酵乳中の菌体外多糖生成に基づいて選択し、次に発酵中に生成された菌体外多糖の抗酸化活性をin vitroで調査した。さらに、菌体外多糖を含む発酵乳による 活性酸素種調節が、酸化ストレスと炎症ストレスの両方が誘発された健康な人の結腸粘膜 (NCM460) から得られた腸上皮モデルで評価されました。発酵乳の生物活性に対する消化プロセスの推定影響も考慮されました。図 1 は、この研究の実験設計の図式を示しています。 |
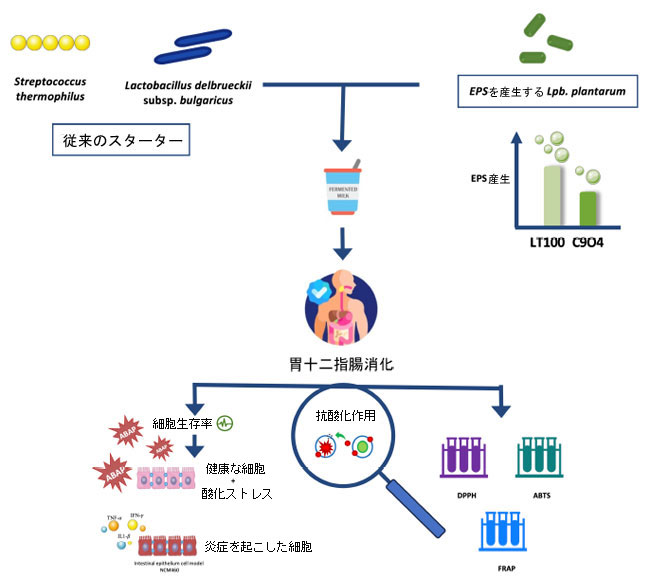 |
図 1 本研究の実験設計のグラフィカル スキーム。 グラフィカル イラストは、Servier の Servier Medical Art のグラフィック要素を使用して作成されました。このコンテンツは、https://smart.servier.com/ (2021 年 11 月 24 日にアクセス) で Creative Commons Attribution 3.0 Unported License に基づいて提供されています。 |
| 2.材料と方法 |
| 2.1. 本研究で使用した乳酸菌 |
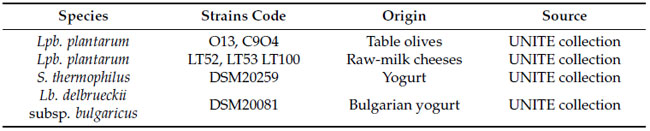
| 本研究で調査した Lpb. plantarum 株は、酸化ストレスに耐える能力と、以前に報告された抗酸化作用および抗炎症作用を理由に、テラモ大学の当研究室コレクション (表 1) から選択されました [21]。すべての Lpb. plantarum 株は、さまざまな発酵食品 (テーブルオリーブと生乳チーズ) から分離され、いくつかのプロバイオティクス特性について遺伝的および表現型的に特徴付けられました [22,23,24]。Streptococcus thermophilus (DSM20259) および Lactobacillus delbrueckii subsp. bulgaricus (DSM20081) は、DSMZ (ドイツ微生物・細胞培養コレクション) から入手され、ラボ規模の発酵乳生産における従来のスターターカルチャーとして本研究に含められました。Lpb. plantarum、Lb. delbrueckii および S. thermophilus は、MRS (de Man–Rogosa–Sharpe) および M17 ブロスで 37 °C の微好気条件下で培養され、各実験の前に一晩継代培養されました。 |
| 表1 本研究で調査したLpb. plantarum、S. thermophilus、およびLb. delbrueckii subsp. bulgaricus。 |
 |
| 2.2. 細菌株間の増殖適合性試験 |
| 選択した株を実験室規模の発酵乳生産で混合物として使用するために、Prete ら [22] に従って、増殖適合性の観点から株間の相互作用を評価する in vitro 増殖阻害試験 (相互適合性試験) を実施しました。この試験は、MRS、M17、PCA (Plate Count Agar) 培地を含む寒天培地を使用して実施しました。簡単に説明すると、各一晩培養物から 10 µL をドナー株については垂直に、試験株については水平に接種しました。重複領域に阻害ゾーンが存在する場合、株が非適合であることを意味します。 |
| 2.3. ルテニウムレッドアッセイ |
| すべての株は、表S1に示すように、異なる炭素源(グルコース、ラクトース、スクロース)を含むM17、MRS、PCAを含むルテニウムレッド(RR; 0.08 g/L)寒天培地上で菌体外多糖産生について予備スクリーニングされました。一晩培養したものをそれぞれのルテニウムレッド寒天培地に塗布し、37℃で48時間培養した後、白色またはピンク色のコロニーはそれぞれEPS+またはEPS−株の挙動を示します[25]。 |
| 2.4. 単回接種発酵乳における菌体外多糖生成 |
| 菌体外多糖生成が最も低い株と最も高い株を選択するために、Lpb. plantarum 株が発酵乳で 菌体外多糖を生成する能力を評価しました。 牛乳発酵は、スーパーマーケットで購入したイタリアの TreValli Swan Milk の部分脱脂 UHT 牛乳を使用して実施しました。組成は、タンパク質: 3.2%、脂肪: 1.6%、炭水化物: 4.9% でした。 殺菌して冷却した UHT 牛乳に、Lpb. plantarum (LT100、LT52、C9O4、O13)、S. thermophilus (DSM20259)、および Lb. delbrueckii subsp. bulgaricus (DSM20081) を発酵させ、37 °C および 42° (Lb. delbrueckii subsp. bulgaricus) で 48 時間培養しました。pH が 4.55~4.65 に達したら、サンプルを 4 °C で保存して発酵を停止しました。 全菌体外多糖抽出は、Ayyash ら [18] が説明したプロトコルに従って、若干の変更を加えて行いました。簡単に説明すると、発酵乳をまず沸騰水 (90~95 °C) で 10 分間加熱して内因性酵素を不活性化し、次に 4000 rpm で 10 分間遠心分離して細菌細胞と凝固タンパク質を分離しました。次に、トリクロロ酢酸 (TCA) ストック溶液 (85%) を上清に加えました。その後、4℃で14,000rpmで20分間遠心分離し、残りのタンパク質をさらに沈殿させた。 収集した上清を3倍量の冷却無水エタノールと混合して菌体外多糖を沈殿させ、4℃で13,000rpmで20分間再度遠心分離した。得られたペレットを脱イオン蒸留水に溶解した。フェノール硫酸法[26]を使用して粗菌体外多糖含有量を定量した。 簡単に説明すると、菌体外多糖溶液1mLを5%フェノール水溶液0.5mLと混合した。その後、濃硫酸2.5mLを混合物に素早く加え、氷中で10分間インキュベートして発色させ、分光光度計(DU530 UV/Vis分光光度計、Beckman Coulter、Irvine, CA, USA)を使用して490nmで測定した。脱イオン蒸留水がブランクとして使用されました。残留乳糖も新鮮な牛乳から計算され、すべてのデータから差し引かれました。次に、各サンプルの粗菌体外多糖含有量は、グルコース (50~750 mg/L) 標準曲線 (R2 = 0.998、図 S1) を使用して計算され、3 つの異なる反復からの結果は mg/L グルコース相当として表されます。 |
| 2.5. ラボ規模の発酵乳製造 |
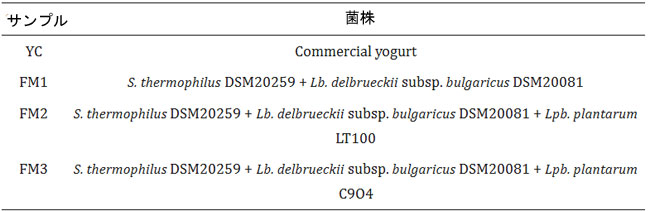
| 発酵乳は、前述の方法に若干の修正を加えて調製した [27,28,29,30]。上記の部分脱脂乳にさまざまな 乳酸菌を接種し、pH が 4.55~4.65 に達するまで 42 °C で培養した後、4 °C で一晩保存した。 表 2 に示すように、実験計画では、次のようにさまざまな乳酸菌で発酵させた 4 つの異なるサンプルを使用した: (1) 従来のヨーグルトと同様に、S. thermophilus DSM20259 と Lb. delbrueckii subsp. bulgaricus DSM20081 を共接種 (各スターターの 3% v/v)。 (2) S. thermophilus DSM20259、Lb. delbrueckii subsp. bulgaricus DSM20081、 および高EPS生産菌としてLpb.plantarum LT100(各スターターの3% v/vと5% LT100); (3)S. thermophilus DSM20259、Lb. delbrueckii subsp. bulgaricus DSM20081、 および低EPS生産菌としてLpb. plantarum C9O4(各スターターの3% v/vと5% C9O4);および (4)市販ヨーグルト(Sterzing-Vipiteno)。 |
| 表2 本研究で製造および調査された発酵乳 |
 |
| 2.6. 発酵のモニタリング |
| 発酵の後は、物理化学的および微生物学的分析が行われた。発酵中の発酵産物のpH値は、pHメーター(pH80 + DHS、XS Instruments、Carpi, Italy)を使用して、1時間ごとに6.8から3.4まで推定された。滴定酸度は、10gのサンプルを10mLの蒸留水と混合し、0.1N NaOH溶液を使用してpH 8.3になるまで滴定することによって測定された。滴定酸度は、Changら[30]によって記載されたように、乳酸のパーセントとして計算された。さらに、発酵後、接種したすべての株の生存率は、MRSまたはM17寒天プレートの生菌数によって確認された。その後、すべてのサンプルは、さらなる分析のために4°Cで一晩保存された[31]。 |
| 2.7. 共接種発酵乳中の菌体外多糖定量 |
| 異なる接種乳酸菌株による発酵乳生産中に放出された菌体外多糖は、すでに上で説明したように、フェノール硫酸法を使用して定量されました。 |
| 2.8. 胃十二指腸模擬標準化胃腸モデル消化 |
| 模擬消化プロセスは、標準化されたin vitro 標準化胃腸モデル(INFOGEST)プロトコル[32]に従って実施しました。簡単に説明すると、各サンプル5gを、模擬唾液(α-アミラーゼ75 U/mLを含む)に2分間、模擬胃液(ペプシン25,000 U/mLを含む)にpH 3で2時間、模擬腸液(胆汁酸塩12 g/Lおよびパンクレアチン2 g/Lを含む)にpH 7で2時間、順に浸漬しました。消化ステップはすべて、胃腸の蠕動運動を模倣するために、振とうしながら37°Cで実施しました。消化サンプルは4000 rpmで15分間遠心分離し、0.22 μmシリンジフィルターで濾過し、使用時まで-20°Cで保存しました。 |
| 2.9. in vitro 抗酸化活性 |
| 発酵中に生成された菌体外多糖の抗酸化活性を評価するために、各サンプルの水抽出物を[33]の報告に従って調製しました。簡単に説明すると、すべてのサンプル(10g)を2.5mLの脱イオン水と混合し、pHを4.0(1M HClを使用)に調整した後、45°Cで10分間インキュベートし、その後遠心分離しました(13,000rpm、20分、4°C)。上清を回収し、各サンプルのpHを中和し(1M NaOHを使用)、再度遠心分離しました(13,000rpm、20分、4°C)。各サンプルの上清を収集し、さらなる分析に使用しました。抗酸化活性は、Prete ら [21] によって詳細に説明されているプロトコルに従い、3 つの異なるマイクロプレート化学アッセイ、DPPH (1,1-ジフェニル-2-ピクリルヒドラジルラジカル)、ABTS ([2,2-アジノ-ビス(3-エチルベンゾチアゾリン-6-スルホン酸)])、FRAP (鉄還元抗酸化力) を実行することによって評価されました。さらに、同じアッセイを使用して、従来のスターターとして使用される S. thermophilus (DSM20259) と Lb. delbrueckii subsp. bulgaricus (DSM20081) が in vitro で抗酸化特性を持っているかどうかを評価して、発酵サンプルへの潜在的な影響を排除しました。 |
| 2.10. 腸管上皮モデル |
| NCM460 細胞 (INCELL Corporation、LCC、Sant'Antonio, TX, USA) を腸管上皮として使用しました [24]。細胞株は、10% (v/v) ウシ胎児血清 (FBS、Corning, NY, USA)、1% (v/v) ペニシリン-ストレプトマイシン (Pen-Strep、Corning, NY, USA)、および 1% (v/v) 非必須アミノ酸 (NEAAs、Corning, NY, USA) を添加した INCELL の M3:Base 培地で培養し、5% CO2 雰囲気で 37 °C でインキュベートしました。細胞は、各アッセイの前に 24 時間播種 (96 ウェルプレートに 1.0 × 105 細胞/ウェル) して、コンフルエントな単層を形成しました。 |
| 2.11. 細胞生存率アッセイ |
| 細胞生存率の検出に広く使用されている比色法 3-(4,5-ジメチルチアゾール-2-イル)-2,5-フェニルテトラゾリウムブロミド (MTT) アッセイを、ガルシアら [24] の方法に若干の修正を加えて実施し、発酵乳が NCM460 ヒト細胞に対して細胞毒性を示さないことを確認しました。簡単に説明すると、健康な腸モデル (酸化刺激や炎症刺激なし) における細胞毒性の可能性を評価するために、各発酵乳からの 3 つの異なる濃度の水抽出物 (培地 5 μL/mL、10 μL/mL、20 μL/mL) を NCM460 のコンフルエント単層に添加しました。その後、96 ウェルプレートを 5% CO2 雰囲気で 37 °C で 24 時間インキュベートしました。インキュベーション後、上清を除去し、10 μL の MTT (5 mg/mL) と 100 μL の DMEM を各ウェルに加え、5% CO2 雰囲気下、37 °C で 4 時間インキュベートしました。次に、上清を除去し、100 μL の酸性イソプロパノールを加えて機械的に振盪することにより、フォルマザン結晶を溶解しました。各ウェルの OD は、EnSpire マルチモード プレート リーダー (PerkinElmer、Waltham, MA, USA) を使用して 570 nm および 630 nm で測定しました。バックグラウンド ノイズとブランク測定を除去するために、コントロール ウェル (サンプルなし) とブランク ウェル (細胞なし) も含めました。細胞生存率は、次の式で計算しました: 細胞生存率=[試験サンプル (発酵乳で処理した NCM460) の OD]/[コントロール ウェル (未処理の NCM460) の OD × 100]。 |
| 2.12. 腸細胞モデルにおける活性酸素種調節評価 |
| 消化された発酵製品による活性酸素種調節を評価するために、Preteら[21]が説明した蛍光マイクロプレートジクロロフルオレセインジアセテート(DCFH-DA)アッセイを実施した。発酵乳が腸細胞による活性酸素種放出に与える影響は、以下のように酸化ストレスと炎症ストレスの両方を誘発した際に調査された。
(i)NCM460 細胞を、細胞毒性効果を示さない最高濃度 (培地 1 mL あたり 20 μL) の消化サンプルで 24 時間処理し、1% ウシ胎仔血清(FBS)を含む M3:Base 培地で 37 °C、5% CO2 雰囲気で培養しました。ハンクス平衡塩類溶液 (HBSS) で 2 回洗浄した後、NCM460 細胞を 100 μL の DCF-DA (25 μM) で 37 °C、5% CO2 雰囲気で 1 時間培養しました。次に、各ウェルを HBSS で 2 回洗浄し、100 μL の 2,2'-アゾビス (2-アミジノプロパン) 二塩酸塩溶液、ABAP (600 μM) を加えて酸化ストレスを誘発し、ROS 生成を促進しました。 (ii) NCM460細胞を、細胞毒性効果を示さない最高サンプル濃度(20μL/mL培地)の消化サンプルで24時間処理し、同時に炎症性カクテル(TNF-α 10 ng/mL、IFN-γ 10 ng/mL、IL1-β 5 ng/mL)を1% ウシ胎仔血清を含むM3:Base培地で、37℃、5% CO2雰囲気下で処理し、IBDの炎症状態を模倣した[24]。その後、ハンクス平衡塩類溶液で2回洗浄し、炎症処理したNCM460細胞を100μLのDCF-DA(25μM)とともに37℃、5 CO2雰囲気下で1時間インキュベートした。 |
| 蛍光発光は、EnSpire マルチモード プレート リーダー (PerkinElmer、Waltham, MA, USA) で、励起波長 485 nm、発光波長 535 nm で 1 時間にわたって 5 分ごとに測定されました。各アッセイでは、ハンクス平衡塩類溶液蛍光値をブランクとして使用し、未処理の NCM460 細胞を陰性対照として使用し、ABAP および炎症性カクテルで処理した NCM460 を陽性対照として使用しました。データは、陽性対照で測定された蛍光単位に対する蛍光単位のパーセンテージの平均値として表されます。 |
| 2.13. 統計およびデータ分析 |
| 3 つの生物学的反復と 3 つの技術的反復から得られたすべてのデータは、平均値 ± SEM として報告され、PRISM 8.3.1 (GRAPHPAD Software Inc.、米国カリフォルニア州ラホヤ) を使用して一元配置分散分析 (ANOVA) を行い、その後 Tukey の多重比較分析と Student t 検定を実施して、p < 0.05 の水準を統計的に有意とみなして分析されました。 |
| 3. 結果 |
| 3.1. 細菌株間の増殖適合性アッセイ (交差適合性試験) |
| in vitro 増殖評価、すなわち交差適合性試験は、菌株間の分離株が増殖に与える影響を評価するために適用されました [22]。簡単に言うと、すべての菌株を互いにベンチマークし、置換菌株として他の菌株に対して作用する可能性を評価しました。交差適合性試験では、すべての菌株が 48 時間にわたって互いの増殖を許容し、増殖阻害は検出されませんでした (表 S2)。これらのデータにより、in vitro では、従来のスターター菌株と Lpb. plantarum 菌株の両方が混合物として使用するのに適していることが確認されました。混合培養発酵では、異なる微生物の組み合わせが発酵特性と微生物の増殖に影響を与える可能性があり、それが細菌群集の構造と機能に影響を与える可能性があります [34]。 最終製品の機能性を高めるために、従来のスターターと健康促進作用のある Lpb. plantarum 株を組み合わせた混合培養を使用するという観点からは、株の置換がないという点で微生物の積極的な相互作用を達成することが最も重要であり、スターター混合物に異なる種を導入しても発酵プロセスが変わらない可能性があることを示しています。 |
| 3.2. 菌体外多糖生産プレートスクリーニング |
| 従来のスターターと Lpb. plantarum 株による推定 菌体外多糖生産は、異なる成長培地でルテニウムレッド染料を使用してプレートスクリーニングで評価されました。図 2 に示すように、菌体外多糖生産は、菌体外多糖生産株を区別できるさまざまな炭素源を含む培地を使用して評価されました。ルテニウムレッドは細菌細胞壁を染色するため、非ロープ状菌種はルテニウムレッドプレート上でピンク/赤色のコロニーを生成します。菌体外多糖はロープ状菌株のこの染色を防ぎ、白いコロニーを生成します [25]。Lpb. plantarum O13、C9O4、および LT100 の成長は白いコロニー (ロープ状菌株) をもたらし、菌体外多糖生産陽性であると見なされましたが、Lpb. plantarum LT53 はピンク色のコロニー (非ロープ状菌株) を示したため、それ以上の分析から除外されました。同様のスクリーニングアプローチは、他の研究でも成功裏に報告されています [25,35]。最後に、S. thermophilus DSM20259 は 菌体外多糖非産生菌でしたが、Lb. delbrueckii subsp. bulgaricus はわずかに 菌体外多糖産生菌株であると考えられます。 |
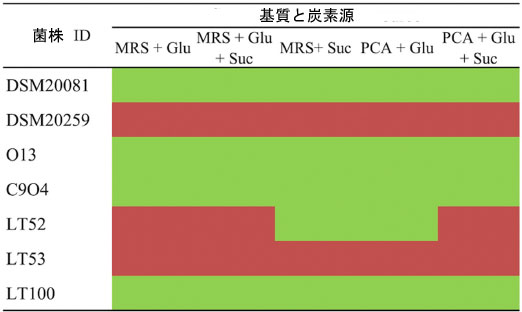 |
| 図 2 菌体外多糖産生スクリーニングのためのルテニウム レッド プレート アッセイ。(Glu: グルコース、Suc: スクロース) さまざまな培養培地で。緑のボックスはロープ状菌 (菌体外多糖産生菌)、赤のボックスはロープ状菌ではない菌株 (菌体外多糖非産生菌) を示します。 |
| 3.3. 単回接種発酵乳中の菌体外多糖定量 |
| Lpb. plantarum を豊富に含む発酵乳中の菌体外多糖定量は、食品サンプル中の総多糖類を定量するためのシンプルで実用的かつ広く使用されている方法であるフェノール硫酸法 [26] を用いて実施しました。図 3 に示すように、結果から Lpb. plantarum 株間で生産される菌体外多糖の量が異なることがわかり、菌体外多糖生産能力が高い株と低い株を選択できます。Lpb. plantarum 株間の菌体外多糖生産量は、115.55 (C9O4 の場合) から 587.77 mg/L (LT100 の場合) グルコース当量の範囲でした (図 3)。したがって、テストした株の中で、C9O4 が最も菌体外多糖生産量が低く、LT100 が最も菌体外多糖生産量が高い株として選択されました。さらに、S. thermopilus DSM20259 および Lb. delbrueckii subsp. bulgaricus DSM20081 の結果から、従来のスターターによる菌体外多糖生産量は最終製品に影響を与えない可能性があることが確認され、Lpb. plantarum 株と比較して菌体外多糖生産能力が最小限であることが示され、最近報告されたように、株依存的に高い菌体外多糖生産能力を示しました [36,37,38,39]。菌体外多糖を生産する能力は、細菌の増殖に影響を与えるいくつかの主要な要因 (温度、インキュベーション時間、pH、酸素率、炭素源および窒素源など) に依存し、菌体外多糖生産量は主に株固有です [8]。したがって、菌体外多糖生産株の選択は、乳製品の技術的および機能的特性を改善するための重要なツールを提供します [8]。 |
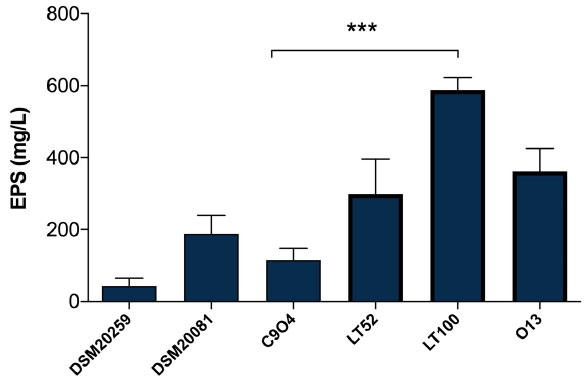 |
| 図 3 DSM20259:S. thermophilus、DSM20081:Lb. delbrueckii subsp. bulgaricus、C9O4:Lpb. plantarum、LT52:Lpb. plantarum、LT100:Lpb. plantarum、および O13:Lpb. plantarum によって発酵された牛乳サンプル中の菌体外多糖生成の定量。データは平均値 ± SEM として報告されています。統計分析は、一元配置分散分析に続いて Tukey の多重比較事後検定によって実行されました (*** p = 0.0002)。 |
| 3.4. ラボ規模の発酵乳生産: 物理化学的および細胞生存率パラメータ |
| 発酵乳生産は、上記のように 42 °C の温度で実施されました。発酵プロセスは、pH と滴定酸度をモニタリングする物理化学的分析によって監視され、Lpb. plantarum 株の添加がこれらのパラメータに影響を与えるかどうかを判断しました。発酵終了の 24 時間後、発酵中の乳酸菌の生存率は、MRS および M17 寒天プレート上の生菌数によって評価されました。表 3 は、発酵 24 時間後の微生物生存率、pH 値、および乳酸の相対濃度 (g/L) を示しています。 |
| 表 3 発酵 24 時間後の発酵サンプルの微生物学的生存率と物理化学的特性。データは平均値 ± SEM として報告されています。統計分析は、一元配置分散分析に続いて Tukey の多重比較事後検定によって実施されました (異なる文字はサンプル間の有意差を意味します、p < 0.05)。 |
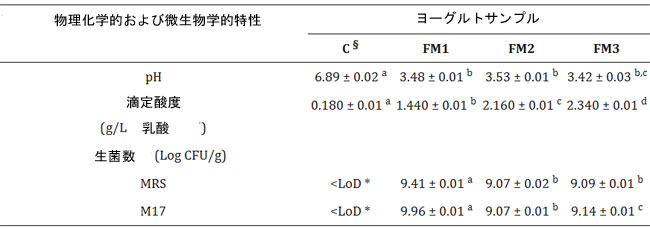 |
| * LoD: 検出限界 (101 CFU/g)。§ C は、陰性対照として未発酵乳から得られたデータを表します。 |
| 3.5. Lpb. plantarum 強化発酵乳中の 菌体外多糖定量 |
| 最終製品中の菌体外多糖生成の定量化は、選択された 2 つの Lpb. plantarum 株の添加が、異なるタイプの発酵乳中の菌体外多糖量に影響を与えるかどうかを、2 つの従来のスターターのみで生産された発酵乳と比較するために実施されました。 図 4 は、2 つの従来のスターター DSM20259 および DSM20081 を Lpb. plantarum LT100 を添加して発酵させて生成された FM2 と、Lpb. plantarum C9O4 を含む FM3 の間に有意差 (p < 0.0001) があることを示しています。これは、単一接種発酵乳で既に観察されているように (図 2)、最終製品中に菌体外多糖を生成する LT100 の主要な能力を反映しています。 さらに、Lpb. plantarum C9O4 を従来のスターターと組み合わせて発酵させて生産された FM3 は、菌体外多糖の量が最も少ない製品となり、単一接種発酵で観察されたように C9O4 の菌体外多糖生産能力が低いことを確認しました (図 3)。 さらに、スターターによって生成された菌体外多糖の生成は、Lpb. plantarum による生成に影響を与えません。 |
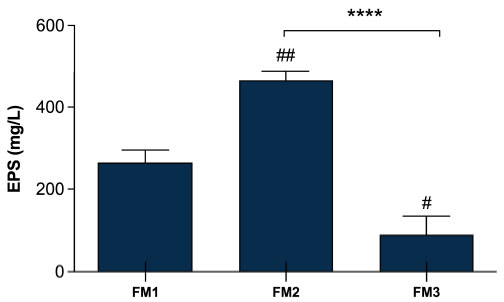 |
図 4 発酵乳サンプル中の菌体外多糖生成。 FM1 は S. thermophilus DSM20259 と L. delbrueckii subsp. bulgaricus DSM20081 で発酵。FM2 は S. thermophilus DSM20259、L. delbrueckii subsp. bulgaricus DSM20081、および Lpb. plantarum LT100 で発酵。FM3 は S. thermophilus DSM20259L. delbrueckii subsp. bulgaricus DSM20081、および Lpb. plantarum C9O4 で発酵。データは平均値 ± SEM として報告され、mg/L グルコース当量として表されます。統計解析は一元配置分散分析に続いてTukeyの多重比較事後検定(FM1 vs. FM2 ## p < 0.005、FM1 vs. FM3 # p < 0.05、FM2 vs. FM3 **** p < 0.0001)によって実施されました。 |
| 3.6. in vitro 抗酸化活性 |
| 3.6.1. 従来スターターとLpb. plantarumのin vitro 抗酸化活性 |
| すべてのLpb. plantarum株は、以前に試験され、in vitroでの抗酸化活性に基づいて選択されています[21]。 この研究では、2つの従来スターター株であるS. thermophilusとLb. delbruckeii subsp. bulgaricusの抗酸化活性を、in vitro DPPHおよびABTSラジカル消去活性、ならびにPreteら[21]に従って鉄還元能(FRAP)を測定することによって評価しました。 Lpb. plantarum株(C9O4およびLT100)は、Preteら[21]によって以前に行われた分析を確認するためにアッセイに含められました。 図5に示すように、2つの従来のスターターの抗酸化能は最小限(DPPH < 10%、ABTS < 30%、FRAP < 20 mmol Fe2+/mL)であり、Lpb. plantarum株の抗酸化能と比較して有意に低かった。 Lpb. plantarum株では、DPPHで20%超、ABTSで30%超の活性酸素種中和活性と鉄還元能 > 100 mmol Fe2+/mLが確認されており、これはすでに報告されている[21]。 |
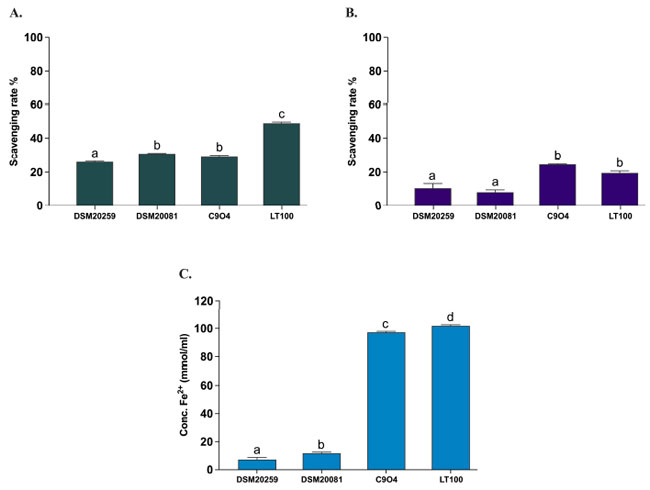 |
| 図 5 従来のスターターと Lpb. plantarum 株の抗酸化活性。(A) ABTS、(B) DPPH、(C) FRAP。データは平均値 ± SEM として報告され、一元配置分散分析と Tukey の多重比較検定によって統計的に分析されました (異なる文字はサンプル間の有意差を意味します、p < 0.05)。 |
| 3.6.2. 発酵乳の in vitro 抗酸化活性 |
| すべてのサンプルの in vitro 抗酸化活性の評価は、標準化胃腸モデル(INFOGEST)消化後に実施され、3 つの異なるタイプの in vitro アッセイ (ABTS、DPPH、FRAP) を使用してすべての菌株の抗酸化特性を評価しました。これにより、発酵中に生成された菌体外多糖の量に基づいて潜在的な機能性を評価し、サンプルを市販のヨーグルト (YC) と比較し、in vivo 条件下での模擬消化プロセス後の顕著な抗酸化活性の持続を確認することができました。 in vitro ABTS 法で決定された抗酸化活性の評価では、標準化胃腸モデル消化プロトコル後もすべてのサンプルの強力な抗酸化能力 (>99%) が示され、市販のヨーグルト (YC) と比較して FM1、FM2、FM3 発酵乳の間に統計的に有意な差 (p < 0.0001) が示されました (図 6A)。 一方、DPPH法を用いた抗酸化活性の評価では、捕捉活性が低い(<20%)ことが明らかになりましたが、サンプル間で有意差はありませんでした(図6B)。 捕捉活性の低下は、菌体外多糖が親水性分子であり、水性環境に溶解するため、反応環境(アルコール溶液)の性質によって説明できます。 DPPHを使用した親水性化合物の抗酸化活性の低下は、他の研究ですでに報告されています[16、40、41]。 最後に、鉄還元抗酸化力を調査したところ、FRAPアッセイでは発酵乳サンプルの鉄還元能力が良好であることが示されました(図6C)。 特に、FM2 および FM3 (Lpb. plantarum 株を強化) は、市販のヨーグルト (28.14 ± 0.70 mmol/mL) および 2 つの従来のスターターのみを含むヨーグルト (FM1、46.81 ± 3.60 mmol/mL) と比較して、高い電子供与能 (それぞれ 60.37 ± 1.00 および 52.37 ± 1.58 mmol/mL) を示し、ABTS の結果と一致して有意差 (p < 0.0001) がありました。さらに、LT100 で発酵させたサンプル FM2 は、C9O4 で発酵させたサンプル FM3 よりも統計的に有意 (p < 0.0001) かつ高い還元能を示し、最終製品で 菌体外多糖を生成および放出する能力の違いと一致していました。 |
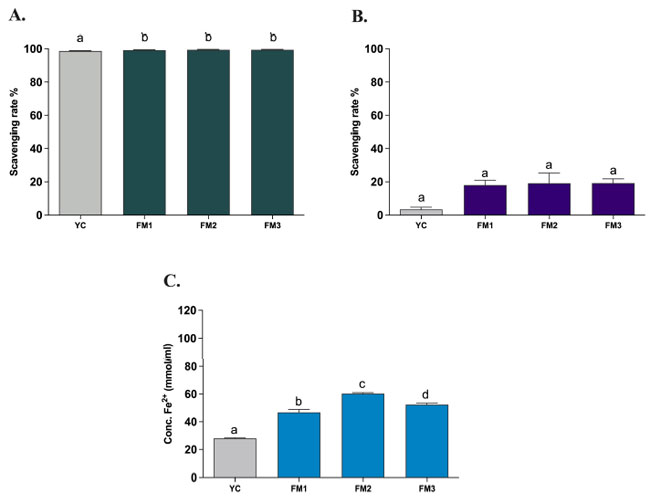 |
| 図 6 (A) ABTS、(B) DPPH、(C) FRAP アッセイで評価した発酵乳の抗酸化活性。 YC = 市販ヨーグルト、FM1 = 従来のスターターで製造した発酵乳、FM2 = 従来のスターターと Lpb. plantarum LT100 (高菌体外多糖生産菌) で製造した発酵乳、FM3 = 従来のスターターと Lpb. plantarum C9O4 (低菌体外多糖生産菌) で製造した発酵乳。 データは平均値 ± SEM として報告され、一元配置分散分析と Tukey の多重比較検定によって統計的に分析されています (異なる文字はサンプル間の有意差を意味します p < 0.0001)。 |
| 3.7. 発酵乳の腸管モデルへの影響の評価 |
| 3.7.1. 発酵乳の非細胞毒性(MTT アッセイ) |
| 摂取時にすべてのサンプルに細胞毒性作用がないことを確認するために、Garciaら [24] に従って、健康な状態(酸化または炎症刺激なし)のヒト腸管細胞(NCM460)で MTT 比色アッセイを実施しました。結果から、すべてのサンプルが健康なヒト腸管細胞の細胞代謝活性を不変のままにするか、サンプル間で有意差がなく改善する可能性が明らかになりました(図 7)。さらに、消化サンプルの結果と未消化サンプルの結果を比較すると(図 S2)、消化ステップによって誘発される有意差はなく、調査したさまざまな濃度(5 μL/mL、10 μL/mL、20 μL/mL)間でも有意差はありませんでした。これに基づいて、細胞毒性効果のない最高濃度 (20 μL/mL) が活性酸素種調節に関するさらなる分析のために選択されました。 |
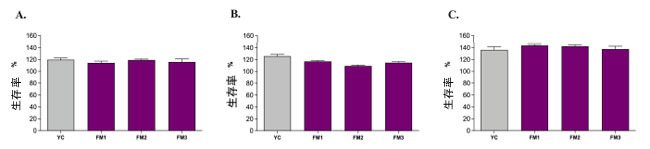 |
| 図 7 異なる濃度の消化発酵乳で培養したヒト腸細胞の生存率の評価: (A) 5 μL/mL、(B) 10 μL/mL、(C) 20 μL/mL。灰色の列は市販のヨーグルト (YC) を表し、紫色の列は本研究で得られた発酵乳 (FM1、FM2、FM3) を表します。データは平均値 ± SEM として報告され、一元配置分散分析と Tukey の多重比較検定 (p > 0.05) を使用して統計的に分析されました。 |
| 3.7.2. 発酵乳が腸モデルにおける活性酸素種調節に与える影響 |
| 活性酸素種を部分的に中和する能力が強化されたという in vitro の証拠に基づいて、2 つの異なる腸モデルで DCFH-DA (ジクロロフルオレセイン-ジアセテート) アッセイを適用して、消化サンプル (20 μL/mL) が活性酸素種調節に及ぼす潜在的な保護効果をテストしました [21]。 図 8 は、誘発酸化ストレスを模倣するために ABAP によって活性酸素種の放出が誘発されたヒト腸管細胞で表された陽性対照と比較した、腸細胞によって放出された 活性酸素種レベルの % 阻害として表された結果を示しています。 図 8 で報告されているように、この健康な上皮モデルでは、陽性対照と比較して活性酸素種放出に有意差はありません (図 8A)。潜在的な保護効果を評価するために、サンプルは誘発炎症の腸モデルでも同様にテストされました [24]。 興味深いことに、図 8B は、すべてのサンプルについて、活性酸素種含有量の放出の減少による炎症状態の保護効果を示しています。特に、サンプル FM2 (Lpb. plantarum LT100 を強化) は、陽性対照 (炎症を起こしたヒト腸管細胞) と比較して大幅な減少が確認され、サンプル FM3 (Lpb. plantarum C9O4 を強化) よりも高い値を示しました。これは、発酵中に生成される菌体外多糖が炎症を軽減する上で推定上重要な役割を果たすことを示唆しています。 |
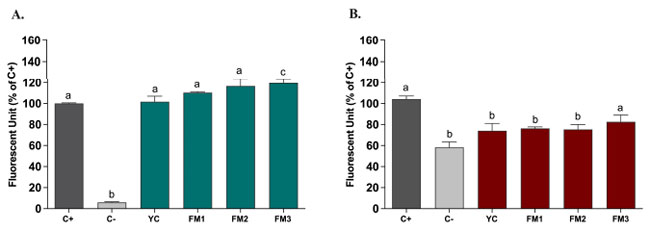 |
| 図 8 消化発酵乳 (20 μL/mL) による活性酸素種調節を、(A) 誘発酸化ストレスおよび (B) 誘発炎症の腸モデルで評価。 濃い灰色の列は陽性対照、薄い灰色の列は陰性対照、緑と赤の列はヨーグルトおよび発酵乳サンプルで処理した細胞を表します。データは平均値 ± SEM として報告され、一元配置分散分析と Tukey の多重比較検定を使用して統計的に分析されます (異なる文字はサンプル間の有意差を意味します、p < 0.05)。 |
| 4. 考察 |
| 発酵食品や発酵飲料は、機能性微生物の存在と直接的な活動だけでなく、宿主の健康にプラスの影響を与える可能性のある生理活性代謝物を放出する発酵微生物の能力により、最近その健康上の利点に注目が集まっています [1]。これまで、発酵中に生成される微生物代謝物(最近ポストバイオティクスと定義されています [42])、それらの相対的な生物学的活性、およびそれらが人間の健康に及ぼす潜在的な影響 [43] の調査に関心が集まっています。発酵プロセス中に生成されるポストバイオティクスのうち、菌体外多糖は、そのレオロジー特性と感覚特性 [8] だけでなく、抗老化、抗酸化、抗炎症、免疫調節効果などの潜在的な健康上の利点 [9,44] からも大きな関心を集めています。乳酸菌、特に乳酸菌によって生成される菌体外多糖は、他の微生物に関連するものと比較して興味深い構造的多様性を示します。しかし、食品業界での活用を制限している主な欠点は、生産量の少なさであり、この問題は現在まで解決されていません。乳酸菌によって生産される菌体外多糖は、特に乳製品において、その生物学的および技術的役割について十分に説明されています。しかし、菌体外多糖の健康への影響は、食品用途における市販のプレバイオティクスと同様に議論されてきました [45]。最近、私たちは以前の研究で、発酵食品、特に乳製品における菌体外多糖の人間の健康に対する中心的な役割について広範囲に検討しました [8]。乳酸菌によって生産される菌体外多糖の有益な効果のうち、潜在的な抗酸化活性は、いくつかの in vitro および in vivo 研究によって確認されています [19,46,47]。Lpb. plantarum YW11 によって生産される高用量の菌体外多糖 (50 mg/kg/日) が、誘発老化マウスモデルに対する酸化ストレスの影響をうまく改善したことが報告されています [19]。同様の結果は、Lactobacillus helveticus KLDS1.8701が産生するEPS-1を摂取した後のマウスの老化モデルでも見られ、腸内細菌叢中の酸化ストレス関連細菌の減少とともに、肝臓障害と酸化ストレスに対する有意なプラス効果が観察され、菌体外多糖の抗酸化活性と腸内細菌叢の調節との相関関係が確認された[46]。 本研究では、発酵中に菌体外多糖を生成する多様な能力 (LT100 主要産生株と C9O4 マイナー産生株) に基づいて、発酵乳の抗酸化活性を異なる方法で高める Lpb. plantarum の 2 つの株の能力を調査しました。一部の乳酸菌が酸化ストレスに対抗する能力に関する科学的証拠があり、その分子メカニズムはまだ完全には解明されていないこと [48,49] を考慮して、本研究では、菌体外多糖 が Lpb. plantarum の抗酸化および抗炎症活性に関与しているかどうかを調べたいと考えました。これらの理由から、一連の in vitro および ex vivo 技術を適用して、水素または電子移動によるフリーラジカルの直接中和、鉄の還元力、および酸化ストレスと炎症刺激の両方にさらされた健康な上皮の腸細胞モデル (NCM460) を使用した抗炎症および抗酸化活性の評価の観点から抗酸化活性を決定しました。 菌体外多糖産生乳酸菌の調査では、細菌を「ロープ状または非ロープ状」の 菌体外多糖産生株として区別するために、早期かつ迅速な in vitro スクリーニングが必要です。予備試験として、さまざまな炭素源を使用したルテニウムレッドプレートアッセイ (表 S1) により、推定菌体外多糖産生に基づいて株を簡単にスクリーニングできました (図 2)。その後、フェノール硫酸法 [26] を使用して、株間の異なる菌体外多糖産生が確認されました。これは、菌体外多糖収量を計算するための最も広く使用されている比色アッセイです [50,51]。培地中に存在する他の炭水化物による干渉がある可能性がありますが、以前に他の著者によって報告されているように、比色法は食品マトリックス中の総多糖類の有効な定量に広く使用されています [10,52,53]。 結果から、他の多くの機能的活性で知られているように、菌体外多糖生産は厳密に株に依存していることを確認しました [13]。これにより、Lpb. plantarum LT100 と Lpb. plantarum C9O4 をそれぞれ主要 (587.8 ± 34.5 mg/L) およびマイナー (115.6 ± 32.5 mg/L) な 菌体外多糖生産菌として選択することができました (図 3)。最適化されていない条件では、Lpb. Plantarum菌体外多糖生産は 0.14~0.4 g/L の範囲であることがすでに報告されています [50,54]。また、一般に、ほとんどの乳酸菌株の菌体外多糖収量は 1 g/L 未満です [45]。さらに、相互適合性試験により、株間に阻害がないことが確認されました (表 S2)。これは、発酵プロセスの成功と、混合して使用した場合の株の効果的な機能性にとって非常に重要な側面です [22]。実際、実験室規模の発酵乳生産において、2種類の従来のスターターとLpb. plantarum株を組み合わせても、Lpb. plantarum株による菌体外多糖生産には影響がなく、LT100が最終製品中に最も多くの菌体外多糖(465.33 ± 24.27 mg/L)を生産する能力があることも確認されました(図4)。一方、単一接種乳発酵で得られた結果によると、C9O4は発酵後に最も低い菌体外多糖含有量(89.03 ± 25.37 mg/L)を示しました(図3)。スーパーオキシドアニオン(O2−)、ヒドロキシラジカル(OH•)、一酸化窒素(NO)、ペルオキシナイトライト(ONOO−)などの活性酸素種は、細胞内のすべての生体高分子と反応して深刻な損傷を引き起こし、蓄積すると生体内で酸化ストレスを引き起こし、腸内で多くの慢性炎症状態を引き起こします。これは、特に西洋社会で現在科学的に関心の高い問題です[12,55]。したがって、菌体外多糖の抗酸化活性の分析は、抗酸化活性の基礎となる分子メカニズムがまだ完全には解明されていないため、ABTS、DPPH、FRAPなどの3つの異なるin vitroアッセイを組み合わせたアプローチを使用して実施されました[21,56,57]。これらのアッセイは、異なる反応環境条件(DPPHの場合は疎水性、ABTSの場合は親水性)や異なる中和メカニズムを模倣しています。したがって、複数の方法を使用することで、いくつかの制限を克服し、ラジカル消去活性をより適切に評価できます[40]。 いくつかの実験的研究では、消化プロセスがフェノール分子などの抗酸化能を低下させるという悪影響を報告しており、これは最近 Ribeiro らによって実証されている [58]。したがって、これらのアッセイは、消化プロセス後の抗酸化活性の持続性を評価するために、標準化胃腸モデルプロトコル [32] に従って消化されたサンプルに対して実施された。抗酸化活性を決定するために 3 つの異なる in vitro 技術を使用して得られた結果は、2 つの Lpb. plantarum 株による 菌体外多糖の異なる生成が、消化プロセス後も依然として高いものの、異なる抗酸化活性 (厳密に株依存) を持つことを明確に示していた (図 6)。 全体として、すべてのサンプルについて、菌体外多糖の親水性による菌体外多糖抗酸化活性を調査した他の研究ですでに報告されているように、ABTS 消去活性は DPPH フリーラジカル中和よりもはるかに高かった。 しかし、他の著者らは、Lpb plantarum <C88 が産生する菌体外多糖の DPPH 消去活性がより高い値 (52.23%) を示した [15,19,41]。消去率の違いは、濃度や抽出方法などのさまざまな実験的側面から推測できる [59]。 FRAP アッセイでは、すべてのサンプル間で有意差が見られ、Lpb. plantarum LT100 由来の菌体外多糖を含むヨーグルトのようなサンプルでは、最終製品における菌体外多糖の産生および放出能力の違いに応じて、有意に高い還元力が示された (p < 0.0001) (図 6C)。 さらに、得られた結果をPreteらが実施した以前の研究[21]の結果と比較すると、Lpb plantarumが産生する菌体外多糖は、各単一株と比較して活性酸素種を中和する全体的な能力が非常に高いことが確認され、Lpb plantarum株が発酵中に最終製品への機能性を付与し強化する能力が強調されています。他の研究と一致して、私たちの結果は、より多くの菌体外多糖産生とより高い抗酸化活性との間に相関関係があることを示しています。Sengülらが実施した研究では、Lb. delbrueckii ssp. bulgaricus B3による菌体外多糖の高産生は、菌体外多糖産生能力が低い株であるLb. delbrueckii ssp. bulgaricus A13と比較して、より高い抗酸化活性および金属イオンキレート活性に対応していることが示されました[60]。 さらに最近では、Yilmaz 氏と共同研究者らは、各菌株によって生成される菌体外多糖の濃度が増加するにつれて、特にその量が 2 倍になると、ヒドロキシルラジカルの中和活性の値が約 2 倍に増加することを観察しました。これは、おそらく菌体外多糖のヒドロキシル基が活性水素を供与する能力によるものです [17]。他の研究では、Lb. delbrueckii spp. bulgaricus [61]、Lacticaseibacillus (Lcb.) paracasei ssp. paracasei、Lcb. rhamnosus [62,63]、Lb. helveticus [52]、および Lpb. plantarum のいくつかの菌株 [14,15,64] を含む多数の 乳酸菌種によって、in vitro システムでさまざまなメカニズムを通じて牛乳発酵中に生成される菌体外多糖の抗酸化能が確認されており、これは乳酸菌由来の菌体外多糖を天然に生成される抗酸化食品添加物として使用できる可能性を示唆しています。さらに、抗酸化活性を持つさまざまな乳酸菌種によって生成されるいくつかの菌体外多糖は、免疫調節特性や抗炎症特性などの他の有益な効果を発揮する能力も示していることが報告されており、慢性腸炎のin vitroおよびin vivoモデルで潜在的な相関関係があることを示唆しています[17,19,60]。したがって、本研究では、健康なヒト結腸粘膜から得られた腸上皮細胞モデル(NCM460)[24]を使用して、選択された2つのLpb. plantarum株(LT100およびC9O4)によって生成された菌体外多糖を含むサンプルによる活性酸素種調節を評価しました。同じモデルは以前に、Lpb. plantarum LT100およびC9O4細胞の酸化ストレスおよび炎症ストレスに対する潜在的な保護的役割、および慢性炎症性腸疾患(IBD)に典型的な炎症反応の媒介を調査するために使用されました[21]。 標準化胃腸モデルで消化したサンプルの抗酸化および抗炎症能力を評価する前に、細胞生存率を評価するための優れたツールとして広く認識されている比色分析法である MTT アッセイを使用して、非細胞毒性試験を実施しました [65]。図 7 に示すように、さまざまな株によって生成された菌体外多糖は、健康な腸上皮の細胞生存率を阻害しないことが証明されており、以前に報告されたように [17]、菌体外多糖サンプルの非細胞毒性を示しています。各サンプルでテストしたすべての濃度 (5 μL/mL、10 μL/mL、20 μL/mL) は、健康な腸上皮細胞の細胞代謝活性を不変または改善する可能性があり、サンプル間で有意差はありません。したがって、細胞毒性効果のない最高濃度が活性酸素種調節を評価するために選択されました。食品由来のサンプルを他のヒト細胞株でテストする際にも同様のアプローチがすでに報告されています [66]。 以前に報告されたように、乳酸菌および/または食品マトリックスによる活性酸素種調節は腸管細胞の健康状態によって影響を受ける可能性があるという実験的証拠があるため [21]、ヨーグルトのようなサンプルによる活性酸素種調節を、酸化ストレス (ABAP 刺激) と炎症の両方にさらされた健康な腸管上皮のモデルで評価し、活性酸素種放出の調節によって媒介される潜在的な保護効果を評価しました。 菌体外多糖とヒト細胞の生物学的活性との実際の相互作用をよりよく反映するために、活性酸素種調節は、より生物学的に代表的な方法である細胞 DCFH-DA アッセイを実施して評価しました。これは、さまざまな細胞株での微生物活性酸素種調節の検出に広く適用されています [67,68,69]。 興味深いことに、図 8 は、腸管上皮の健康状態に基づいて、乳酸菌株によって生成された 菌体外多糖を含む発酵乳の異なる影響を示しています。これは、以前に Lpb. plantarum 細胞による活性酸素種調節を評価することで得られたものです [21]。 すべてのサンプルは、健康な細胞で活性酸素種産生を誘発することで予防効果を示しました(図8A)。一方、興味深いことに、炎症の病理学的モデルでは、炎症効果の減少による保護効果が示されました(図8B)。 活性酸素種は細胞活性化におけるシグナル伝達分子としてよく知られており[70]、いくつかの以前の研究では、プロバイオティクスとその代謝物が、さまざまな病理学的および炎症を起こした腸細胞における細胞防御機構として活性酸素種放出を促進できることが報告されています[49,71,72]。 炎症中、活性酸素種はセカンドメッセンジャーとして働き、炎症プロセスに関与するNF-κBやMAPKなどのさまざまなシグナル伝達分子を活性化することができます[73,74]。 さらに、Lpb plantarum LT100 を豊富に含む発酵物から得られたサンプル FM2 は、陰性対照 (未処理の健康な細胞) と比較して有意差 (p > 0.05) を示さず、炎症細胞から放出された活性酸素種を健康な細胞の基本レベルに戻す能力があることを示唆しています (図 8B)。 同様の結果が Diao ら [75] によって報告されており、彼らは別の炎症モデルで Bacillus sp. 株の菌体外多糖を調査し、NF-κB 阻害による菌体外多糖の抗炎症活性は、RAW264.7 マクロファージにおける菌体外多糖の抗酸化活性と活性酸素種減少によって媒介される可能性があると推測しています [75]。 しかし、我々のデータや他の過去の研究[40,75]が示唆しているように、菌体外多糖が活性酸素種の中和と調節を介して炎症を軽減する有益な役割を果たすことを確認するためには、菌体外多糖による活性酸素種調節と抗炎症活性との間の正確な作用機序をより深く調査するためのさらなる研究が必要である。 |
| 5. 結論 |
| 全体として、結果は、発酵乳における抗酸化作用と活性酸素種調節活性を高めるために、菌体外多糖を産生する選択された Lpb. plantarum の推定役割を強調し、発酵中にその機能を最終製品に伝達する能力を確認しました。この研究では、選択された 2 つの Lpb. plantarum 株 LT100 と C9O4 による菌体外多糖産生と機能活性の間に相関関係があることも示されました。テストされた株の中で最も高い菌体外多糖産生株である Lpb. plantarum 株 (LT100) で産生されたサンプル (EPS、587.77 mg/L) は、市販のヨーグルトと菌体外多糖産生の低い株で産生されたサンプル (EPS、115.55 mg/L) の両方と比較して、より高い抗酸化能 (ABTS > 99%、FRAP 60.37 ± 1.00 mmol/mL) に恵まれています。興味深いことに、データは、炎症または酸化ストレスのいずれかによる腸細胞によるROS産生の差別的調節を示しており、Lpb. plantarum株を豊富に含むヨーグルトサンプルによって放出される活性酸素種の大幅な減少(陽性対照と比較して、FM2:24.7%およびFM3:17.4%の活性酸素種減少)を介して保護的な抗炎症効果があり、以前にLpb. plantarum細胞で観察されたのと同じ効果を確認しました[26]。 |
| 略語 |
| EPS: 菌体外多糖類、DPPH: 1,1-ジフェニル-2-ピクリルヒドラジルラジカル、ABTS: 2,2-アジノ-ビス (3-エチルベンゾチアゾリン-6-スルホン酸)、FRAP: 鉄還元抗酸化力、ROS: 活性酸素種、EFSA: 欧州食品安全機関、LAB: 乳酸菌、NCM460: 正常結腸粘膜細胞、DSM: ライプニッツ研究所 DSMZ - ドイツ微生物・細胞培養コレクション、MRS: de Man-Rogosa-Sharpe、PCA: プレートカウント寒天培地、RR: ルテニウムレッド、UHT: 超高温、TCA: トリクロロ酢酸、NaOH: 水酸化ナトリウム、FBS: ウシ胎児血清、Pen-Strep: ペニシリン-ストレプトマイシン、 NEAAs: 非必須アミノ酸、MTT: 3-(4,5-ジメチルチアゾール-2-イル)-2,5-フェニルテトラゾリウム臭化物、DMEM: ダルベッコ改変イーグル培地、OD: 光学密度、DCFH-DA/DCF-DA: ジクロロフルオレセインジアセテート、HBSS: ハンクス平衡塩類溶液、ABAP: 2,2'-アゾビス(2-アミジノプロパン)二塩酸塩溶液、TNF-α: 腫瘍壊死因子-α、IFN-γ: インターフェロン-γ、IL1-β: インターロイキン-1-β、IBD: 炎症性腸疾患、NF-κB: 活性化B細胞の核因子κ軽鎖エンハンサー、MAPKs: マイトジェン活性化タンパク質キナーゼ、SEM: 平均標準誤差。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Foods. 2024 May 25;13(11):1663.に掲載されたImproving the Antioxidant and Anti-Inflammatory Activity of Fermented Milks with Exopolysaccharides-Producing Lactiplantibacillus plantarum Strains.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |